2. 大英县农业农村局, 四川遂宁 629300
2. Bureau of Agriculture and Rural Affairs of Daying County, Suining, Sichuan 629300, China
世界人口的快速增长对农业生产提出了更高要求。近年来,相较于化肥投入量高、土壤耕作强度大等为特点的传统农业,以保护性耕作为核心的保护性农业日益受到重视[1-2]。研究表明,保护性耕作有提高土壤有机质和矿质养分含量[3]、改良土壤团聚结构[4]、减少土壤侵蚀和水土流失[1]、降低劳动力和机械成本[2]等优点。保护性耕作分布广泛且其面积呈逐年增加趋势。2013年全球保护性耕作面积已达155万km2,占全球耕地面积的11%[5];据《中国农业机械工业年鉴(2019)》[6]资料,我国机械免耕的面积由2009年的10.19万km2增加至2018年的14.12万km2,增幅为38.57%。严格意义上,保护性耕作应包括两个组成部分:免耕或少耕、土壤覆盖[7]。然而,由于世界各地耕作制度及秸秆管理的差异,免耕和秸秆覆盖这两个核心组成并不经常同时使用[7-8],秸秆覆盖还田的占比并不是很高。因此,进一步明确免耕条件下秸秆覆盖的作物产量效应及作用机理,有利于提高秸秆利用水平及保护性耕作的合理推广。
前人在研究秸秆覆盖对免耕作物产量的影响结论不一:增产[9]、减产[10]或无影响[11]。成都平原作为我国西南地区的粮食主产区,稻–麦/油轮作是该地区典型轮作制度,每年秸秆产量至少4 000多万吨,占西南地区秸秆总量的50%以上[12]。长期秸秆覆盖对该区域免耕稻-麦轮作体系作物产量的影响与作用机制尚不明确,值得深入研究。秸秆覆盖可通过调节土壤肥力、水分、微生物群落等土壤理化和生物学性质进而影响作物产量[9-11]。前人在保护性耕作对土壤肥力的影响方面有所报道:邓超超等[3]发现免耕加秸秆覆盖可增加土壤表层总有机碳和全氮含量;在免耕条件下,相较于秸秆移除,秸秆覆盖对土壤表层有机碳增幅最大,并随土层深度显著降低[2,13]。作为土壤肥力的核心指标之一,氮素是维持植物生长发育关键元素。除全氮(TN)外,土壤活性氮组分,比如颗粒有机氮(PON)、可溶性有机氮(DON)、微生物生物量氮(MBN)、硝态氮(NO3––N)和铵态氮(NH4+–N)等也会对秸秆还田有所响应。董林林等[14]发现秸秆还田增加了土壤TN、NO3––N和NH4+–N含量;张忠学等[15]研究表明,秸秆还田提高了土壤表层可溶性氮在全氮中的比重。然而,上述研究多集中于土壤表层,且耕作措施多为翻耕,在免耕田间下秸秆覆盖对不同土层全氮及活性氮组分的影响鲜有报道,该过程是否会对作物产量产生直接影响?这是本研究关注的重点之一。土壤微生物是驱动还田秸秆降解和土壤碳氮循环等过程的重要力量,Li等[16]通过整合分析发现,相较于免耕条件下秸秆移除处理,秸秆覆盖降低了耕层(0~10 cm)土壤真菌磷脂脂肪酸含量,对总体微生物和细菌磷脂脂肪酸含量影响不明显。然而,Li等[16]的分析数据不包含我国西南地区及类似区域,土壤微生物受不同土壤类型和植物种类的影响较大,具有明显的地理学特性[17]。探究分析我国西南免耕区秸秆覆盖下土壤微生物群落的变化规律,有助于深化理解秸秆覆盖如何对土壤肥力和作物产量产生影响。因此,本研究基于长期定位试验拟探究长期秸秆覆盖对四川免耕区作物产量的影响,并通过不同土层氮素组分及微生物群落特征揭示其影响机制,以期为西南地区保护性耕作的合理推广提供科学依据。
1 材料与方法 1.1 试验地概况本定位试验位于四川省广汉市西高镇(31°08'38''N,104°29'45''E),年平均温度16.3℃,平均降水量890.8 mm,日照时数1 229 h,主要轮作方式为水稻−小麦或油菜。试验地土壤为灰棕色冲积物发育而成的水稻土,2005年试验开始前耕层土壤理化性质为:pH 5.54,有机质31.3 g·kg−1,全氮2.02 g·kg−1,全磷1.04 g·kg−1,全钾7.69 g·kg−1,碱解氮189.8 mg·kg−1,有效磷12.61 mg·kg−1,速效钾258.2 mg·kg−1。该区域土壤质地为壤土,2015年测定其黏粒、粉粒和砂粒含量分别为52.0 mg·kg−1、405.4 mg·kg−1和542.6 mg·kg−1。本定位试验包括秸秆移除、秸秆覆盖及秸秆覆盖基础上不同氮磷钾肥料用量等八个处理,每个处理有三个小区重复,小区面积为12 m2(3 m × 4 m),各小区之间用60 cm深的水泥埂隔开。试验小区完全随机排列,耕作方式均为免耕。
1.2 试验设计本研究选取两个处理:免耕且秸秆移除(NT)和免耕且秸秆覆盖(NTS)。种植的水稻品种为川香优9838,小麦品种为川麦42。肥料用量及施用比例见表 1,每季作物化肥氮的投入量为150 kg·hm–2(以N计,下同),作物收获后秸秆未经粉碎直接覆盖于地表。小麦和水稻秸秆的氮含量分别约为4.5 g·kg−1和7.8 g·kg−1,根据小麦和水稻秸秆还田量,小麦秸秆可带入土壤的氮约为27.00 kg·hm–2,水稻秸秆可带入土壤的氮约为66.30 kg·hm–2。
|
|
表 1 免耕区不同秸秆处理的每季肥料和秸秆施入量 Table 1 Fertilizer input for wheat and rice with or without straw mulch under a no-till system/(kg· hm–2) |
于2018年5月小麦收获后立即采集0~5、5~10、10~20和20~30 cm不同层次土壤样品。每个小区采集五个点,除去根系和石头等杂质后将相同层次的土壤混合,装入无菌袋,贴上标签后带回实验室。将土壤样品混匀后过2 mm筛,用四分法将每份样品分为三份,一份置于–20℃冰箱以测定土壤微生物群落,一份置于4℃冰箱保存以测定NO3––N、NH4+–N、DON和MBN,一份风干以测定土壤TN和PON。
1.4 土壤氮组分及土壤微生物群落组成的测定土壤氮组分测定:土壤TN采用半微量凯氏法,NH4+–N采用靛酚蓝比色法,NO3––N采用紫外分光光度法,MBN采用氯仿熏蒸法,测定方法参考《土壤农业化学分析方法》[18]。DON采用Jones和Willett[19]的方法:将相当于干土质量20 g的新鲜土样加入100 mL蒸馏水,置于摇床(200 r·min–1)震荡1 h,然后用离心机以4 000 r·min–1离心10 min,将上清液通过0.45 μm滤膜,用总有机碳分析仪(Multi N/C 3100,耶拿,德国)测定其含量。PON采用Cambardella和Eillott[20]的方法:向盛有10 g过2 mm筛风干土的离心管中加入30 mL浓度为5 g·L–1的六偏磷酸钠((NaPO3)6)溶液,放置于摇床(150 r·min–1)上震荡16 h后,将全部溶液置于53 μm筛上,用蒸馏水轻轻冲洗至滤液澄清,将筛上的土壤转移至烧杯,于55℃下烘干至恒重,用测定全氮的方法测定其含量。
土壤微生物群落组成测定:采用的表征方法为磷脂脂肪酸法(phospholipid fatty acid,PLFA)。参考修正后的Bligh–Dyer法[21]提取土壤微生物PLFA,参考黄雪娇等[22]的研究,选用脂肪酸组分11Me18:1ω7c、14:0、i14:0、i15:0、a15:0、i15:0 3OH、i15:1 G、16:0、a16:0、i16:0、16:1ω5c、16:1ω9c、16:1ω11、16:0 2OH、a17:0、i17:0、17:0、17:1ω8、cy17:0、18:0、i18:0、a19:0、i19:0、cy19:0ω8c、20:0等代表细菌;真菌标记性脂肪酸有18:1ω9c和20:1ω9c;放线菌标记性脂肪酸有10Me17:0和10Me18:0。
1.5 作物产量测定将2013年至2018年成熟季水稻和小麦人工收获并脱粒称重,同时取一部分样品于80℃烘至恒重,计算其含水量后折算,并记录其13%含水量的产量值。
1.6 统计分析各测定数据进行方差分析前需进行齐性检验,若可通过齐性检验则进行后续分析,否则,需先对原始数据进行数据转换。运用双因素方差分析(Two-way ANOVA)分别检验秸秆覆盖与试验年份对稻/麦产量以及秸秆覆盖与土壤层次对土壤氮组分和微生物丰度的影响;如果两因素交互效应显著,则分别对其中一因素在另一因素梯度上进行单因素方差分析;如果两因素交互效应不显著,则对各主效应因素进行多重比较。使用SPSS 19.0软件进行数据统计分析,采用邓肯(Duncan)法进行多重比较;使用Origin 2021软件绘制图形;使用Canoco 5.0进行主成分分析和冗余分析。文中数据表示方式为均值±标准差。
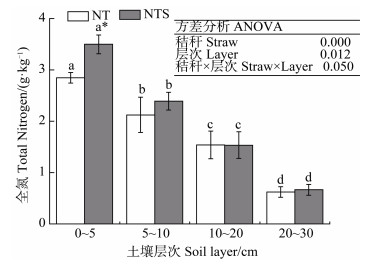
2 结果 2.1 秸秆覆盖对不同土层全氮的影响双因素方差分析结果(图 1)表明:秸秆覆盖与土层的交互效应对TN含量影响显著(P≤0.05)。通过单因素方差分析发现TN含量随土层增加而显著降低,其中在0~5 cm含量最高,为2.78~3.70 g·kg–1;对比秸秆移除处理,秸秆覆盖显著提高了土壤0~5 cm TN含量(P < 0.05),增幅为23.24%(从2.84增加至3.50 g·kg–1),两处理在其他土层差异不显著。
|
注:不同小写字母表示同处理不同土层之间差异显著,*表示相同土层不同处理之间差异显著。下同。 Note: Different lowercase letters indicate significant differences between the four soil layers at the P < 0.05 level. * indicates differences between the NT and NTS treatments at the same soil layer at the P < 0.05 level. The same below. 图 1 秸秆覆盖下不同土层全氮含量 Fig. 1 Soil total nitrogen contents at four soil layers under two straw managements |
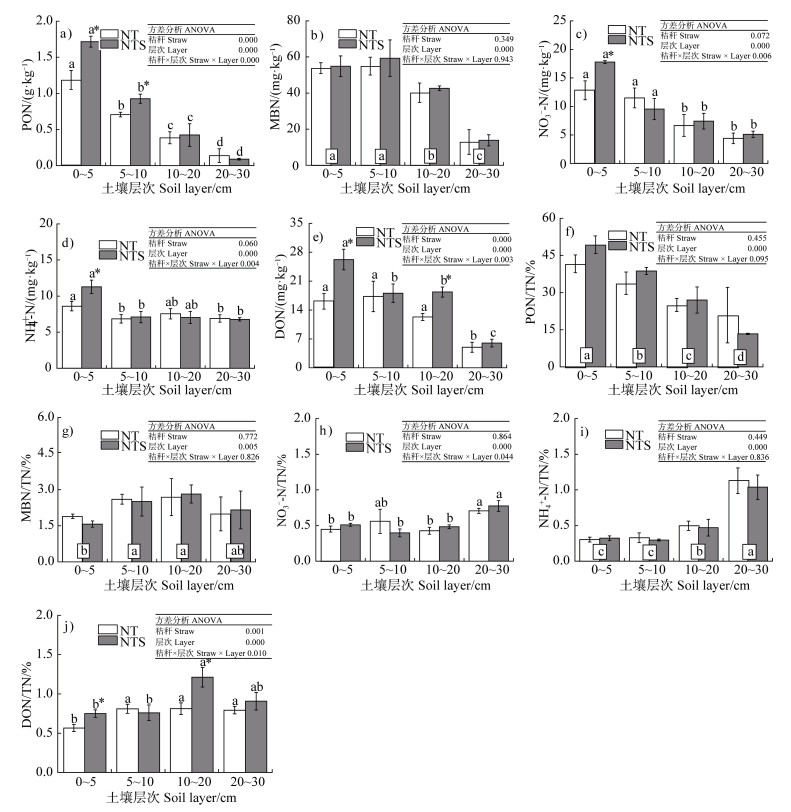
图 2表明秸秆覆盖和土层的交互效应对不同活性氮组分的影响有所差异。在活性氮组分含量方面(图 2a~图 2e),秸秆覆盖与土层交互效应对PON、NH4+–N、NO3––N和DON含量影响极显著(P < 0.001),对MBN含量影响不显著。具体地,PON、MBN、NH4+–N、NO3––N和DON含量随土层增加而显著降低。相较于秸秆移除,秸秆覆盖显著提高了土壤0~5和5~10 cm PON、0~5 cm NH4+–N和NO3––N、0~5和10~20 cm DON含量(P < 0.05),对四层土壤MBN含量均无显著影响,PON含量在0~5和5~10 cm土层的增幅分别为44.74%和31.02%,NH4+–N和NO3––N在0~5 cm土层的增幅分别为31.02%和38.53%,DON在0~5和10~20 cm土层的增幅分别为62.82%和48.89%。
|
注:PON,颗粒有机氮;MBN,微生物生物量氮;NO3––N,硝态氮;NH4+–N,铵态氮;DON,可溶性有机氮;TN,全氮。带方框的不同小写字母表示基于土层主效应的不同土层之间差异显著。下同。 Note: PON, particulate organic nitrogen; MBN, microbial biomass nitrogen; NO3––N, nitrate-nitrogen; NH4+–N, ammonium-nitrogen; DON, dissolved organic nitrogen; TN, total nitrogen. Different lowercase letters in boxes indicate significant differences between the four soil layers at the P < 0.05 level based on the main effects of soil layer. The same below. 图 2 秸秆覆盖下不同土层颗粒有机氮、微生物量氮、硝态氮、铵态氮和可溶性有机氮含量(a、b、c、d、e)及其在全氮中占比(f、g、h、i、j) Fig. 2 Soil active nitrogen contents and their proportions in soil total nitrogen at four soil layers under two straw managements(a. PON contents; b. MBN contents; c. NO3––N contents; d. NH4+–N contents; e. DON contents; f. PON/TN values; g. MBN/TN; h. NO3––N/TN values; i. NH4+–N/TN values; j. DON/TN) |
在活性氮组分占全氮比重方面(图 2f~ 图 2j),秸秆覆盖与土层的交互效应对PON/TN、MBN/TN和NH4+–N/TN比值均无显著影响,对NO3––N/TN和DON/TN比值影响显著。具体地,在四层土壤中,PON/TN比值随土层增加而显著降低;MBN/TN比值在5~10和10~20 cm土层最大,在0~5 cm最小;NH4+–N/TN和NO3––N/TN比值随土层增加而增加;DON/TN比值在0~5 cm土层最小。相较于秸秆移除,秸秆覆盖提高了0~5和10~20 cm MBN/TN比值,对其他活性氮组分占全氮比重无显著影响。
2.3 土壤不同氮组分之间的相关性对两个处理四层土壤氮组分进行相关性分析,结果如表 2所示。不同土壤活性氮组分含量均与TN含量呈现极显著的正相关关系(P < 0.01),说明土壤活性氮组分很大程度上依赖土壤TN含量,其中PON与TN相关系数最高,其次为NO3––N和DON。除土壤NH4+–N与MBN之间无显著相关性外,土壤活性氮组分之间均表现出极显著的正相关关系(P < 0.01)。
|
|
表 2 土壤不同氮组分的相关性 Table 2 Correlations between different soil nitrogen fractions |
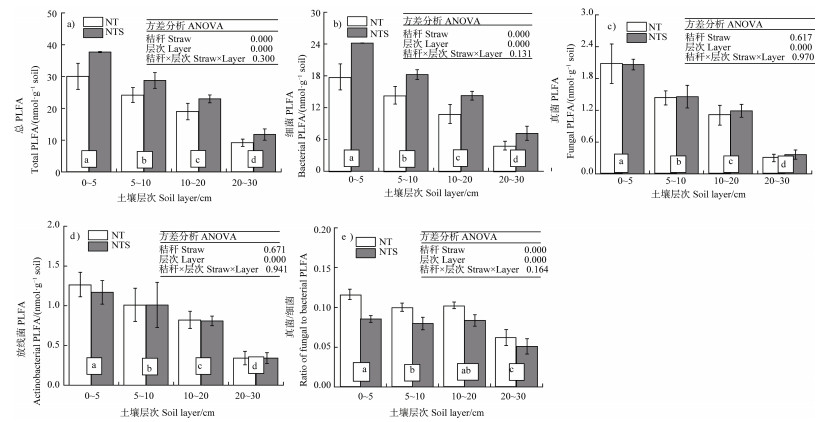
图 3显示:秸秆覆盖和土层交互效应对总体微生物、细菌、真菌和放线菌PLFA以及真菌/细菌比影响均不显著;相较于秸秆移除,秸秆覆盖显著提高了总体微生物和细菌PLFA丰度(增幅分别为22.79%和33.55%),对真菌和放线菌PLFA丰度无影响,降低了真菌/细菌比(降幅为21.43%);各组分PLFA及真菌/细菌比随土壤层次增加而降低。利用皮尔森相关性分析,对两个处理四个土壤层次的不同微生物种类、真菌/细菌比与土壤氮组分及碳氮比(土壤碳组分数据发表于Zhou等[13],包括总有机碳(TOC)、颗粒有机碳(POC)、微生物生物量碳(MBC)和可溶性有机碳(DOC))进行分析。在四层土壤中,显著相关性多集中在0~5 cm土层,其余三层很少有显著相关性。在0~5 cm土层,总体微生物和细菌含量与TN、PON、NO3––N和DON显著正相关,与MBC/MBN显著负相关;真菌和放线菌含量与上述理化指标均无显著相关性;真菌/细菌比与TN、PON、NO3––N、NH4+–N、DON和TOC/TN显著负相关(表 3)。
|
图 3 秸秆覆盖下不同土层总体微生物(a)、细菌(b)、真菌(c)和放线菌(d)的磷脂脂肪酸(PLFA)丰度及真菌/细菌比(e) Fig. 3 The abundances of soil total PLFA(a), bacterial PLFA(b), fungal PLFA(c), and actinobacterial PLFA(d), and the ratio of fungal PLFA to bacterial PLFA(e)at four soil layers under two straw managements |
|
|
表 3 0~5 cm土层各种类PLFA丰度、真菌/细菌比与土壤氮组分和碳氮比的相关性 Table 3 Correlations among the abundances of microbial PLFA, the ratio of fungal PLFA to bacterial PLFA, soil nitrogen fractions and C/N ratios at 0–5 cm soil layer |
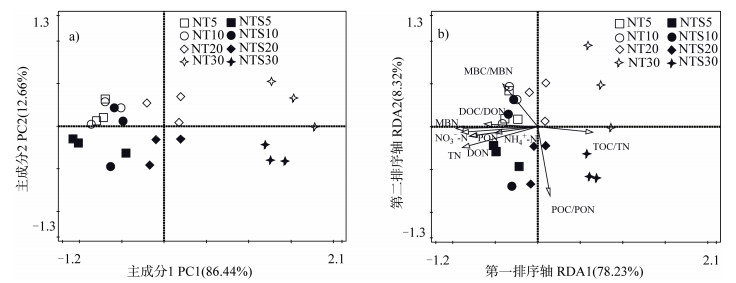
对24个样品的土壤微生物群落组成进行主成分分析(图 4a),发现主成分1和主成分2分别解释了总变异的84.66%和12.66%。两个处理不同土层的微生物群落主要沿着主成分1轴分布,20~30 cm土层的土壤微生物群落组成显著区别于0~20 cm土层;秸秆移除和秸秆覆盖处理的土壤微生物群落分别位于主成分1轴的上下方。将24个样本的PLFA组分与土壤氮组分、各组分碳氮比值进行冗余分析(图 4b),并利用其前向选择功能(forward selection)发现显著影响土壤微生物群落组成的土壤环境因子为MBN(F = 56.6,P = 0.001)、POC/PON(F = 5.2,P = 0.007)和TN(F = 3.6,P = 0.034),其余土壤氮组分和碳氮比值对微生物群落组成影响不显著。
|
注:NT5、NT10、NT20和NT30分别表示取自于免耕且秸秆不还田处理的0~5、5~10、10~20和20~30 cm土壤样品;NTS5、NTS10、NTS20和NTS30分别表示取自于免耕且秸秆覆盖处理的0~5、5~10、10~20和20~30 cm土壤样品。 Note: NT5, NT10, NT20, and NT30 represent the soil sampled at 0–5, 5–10, 10–20, and 20–30 cm layers, respectively, under straw removal. NTS5, NTS10, NTS20, and NTS30 represent the soil sampled at 0–5, 5–10, 10–20, and 20–30 cm layers, respectively, under straw mulching. 图 4 基于24个样本的土壤微生物群落组成的主成分分析(a)和基于土壤微生物组成与土壤理化性质的冗余分析(b) Fig. 4 Principal component analysis plot of the soil microbial community from 24 samples(a)and redundancy analysis based on the soil microbial community and the soil physicochemical property differences between NT and NTS(b) |
表 4双因素方差分析结果表明:种植年份对小麦和水稻产量具有显著影响;与秸秆移除相比,秸秆覆盖能够显著提高小麦产量(P < 0.05),增产幅度为6.49%,而秸秆覆盖对水稻产量增加不显著(P > 0.05)。
|
|
表 4 不同年份秸秆覆盖对小麦和水稻产量的影响 Table 4 Wheat and rice yields under two straw managements in different years/(kg·hm–2) |
分别用两个处理的四层土壤氮组分与水稻和小麦平均产量进行相关性分析,结果如表 5所示。除20~30 cm土层的PON含量外,0~5、5~10、10~20和20~30 cm土层的其余氮组分均与水稻和小麦的产量无显著相关性(P > 0.05)。
|
|
表 5 不同土层氮组分与作物产量的相关性 Table 5 Correlations between soil nitrogen fractions at different layers and crop yields |
无论秸秆覆盖与否,在免耕条件下肥料主要施于地表,并且作物根系在表层土壤分布最多,其随深度增加而减少[23],这意味着大量化肥氮及作物根系腐解带入的氮素会先聚集于土壤表层,造成了土壤TN及各活性氮素组分表现出随土层深度而逐渐降低的分布特征。土壤TN含量的增加能显著提高活性氮组分含量(表 2),但各活性氮组分占全氮比例略有差异:颗粒有机物是一种介于新鲜秸秆和腐殖质的有机物质[24],它的周转速率较慢,移动性差,地表覆盖的秸秆及土壤表层分布的大量根系造成PON/TN比值在土壤表层最高;土壤NH4+–N、NO3––N和DON的流动性较强,部分会逐渐积累至土壤深层,同时TN在土壤深层含量较低,所以NH4+–N/TN、NO3––N/TN和DON/TN比值表现出随土壤层次逐渐增加的趋势;MBN的移动性介于PON和可溶性氮之间,所以MBN/TN比值在土壤亚表层(5~20 cm)最高。
由于长期免耕土壤扰动较少,秸秆覆盖于土壤表层,所以相较于秸秆移除,秸秆覆盖处理的TN含量增加主要发生在土壤0~5 cm表层(图 1),董林林等[14]也得到了类似结果。值得注意的是,免耕条件下秸秆覆盖对土壤容重有所影响[25],土壤全氮含量的增加并不一定意味着土壤氮储量的增加。秸秆覆盖提高了小麦产量,理论上也提高了其根系生物量(未测定),加上秸秆氮的贡献,显著提高了0~5和5~10 cm土壤PON含量。秸秆覆盖同时提高了PON和TN含量,导致其PON/TN值与秸秆移除处理无显著差异(图 2a和图 2f)。秸秆覆盖并未增加土壤MBN的含量(图 2b),可能与采样时间有关。李秀等[26]发现秸秆覆盖处理在作物生长旺期MBN含量最高,但在成熟期会降低至无秸秆覆盖的水平。秸秆覆盖提高了土壤可溶性氮的含量,可能有多方面的原因:第一,还田秸秆腐解过程会产生可溶性氮,包括无机氮和可溶性有机氮;第二,土壤氮素组分之间可相互转化,不仅全氮与可溶性氮组分存在动态平衡,不同活性氮组分可相互转化[27];第三,秸秆覆盖会作用于部分土壤微生物进而影响氮素转化过程[28],改变土壤无机氮含量。
3.2 秸秆覆盖对土壤微生物含量和群落组成的影响秸秆覆盖提高了土壤表层全氮含量,表 3结果证实了土壤微生物含量一定程度上与土壤氮含量显著正相关。然而,不同微生物种类的数量(基于PLFA结果)对秸秆覆盖的响应有所差异:细菌表现为增加,但真菌和放线菌影响不显著(图 3),可能是由几方面原因造成的。第一,细菌是农田秸秆降解的主要驱动力,它喜好利用易降解碳组分[29],显著提高了土壤细菌PLFA含量。第二,有研究报道真菌分解难降解有机碳[30],但秸秆覆盖对细菌影响更大[31];相对于细菌,真菌或放线菌因对秸秆相对不敏感而处于竞争弱势地位[32]。此外,充足的土壤养分可能不会刺激真菌或放线菌快速生长以获取养分[28]。第三,由于磷脂脂肪酸存活于活体细胞,土壤微生物PLFA含量受采样时间和土壤性质影响较大。Peng等[33]研究表明,在作物生长旺期秸秆还田提高了土壤真菌PLFA含量,在作物收获期其影响不显著;Chen等[34]发现秸秆还田可提高姜堰(低肥力)土壤真菌PLFA含量,对屈家岭和广德(高肥力)土壤真菌PLFA无影响。土壤微生物群落受多种土壤理化因子的影响,有研究[35]表明,土壤总微生物含量、真菌/细菌比与土壤C/N比、有机碳含量显著正相关,细菌和真菌含量与土壤氮含量显著正相关,但土壤氮含量超过一定阈值(比如0.6 kg·m–2)时其对真菌生长的抑制效果远大于对细菌的效果[36],这是本研究中秸秆覆盖处理的真菌/细菌比值低于秸秆移除处理的重要原因,也间接解释了土壤MBN、POC/PON和TN是共同显著影响土壤微生物群落组成的环境因子。
3.3 秸秆覆盖对作物产量的影响本研究发现,秸秆覆盖能够显著提高小麦产量,对水稻产量有增产趋势,但未达到显著水平(表 4)。以往研究[9-11]表明,秸秆覆盖对作物产量的影响表现出一定的地域性,受土壤性质、温度和降雨量等多种因素影响。Wang等[9]发现秸秆覆盖通过增加土壤肥力、土壤含水量和微生物活性进而提高夏玉米和小麦产量。Cook等[11]研究表明,秸秆本身养分是秸秆覆盖对作物产量影响的主要因素之一;但当土壤本身肥力较高,秸秆还田对作物产量贡献率可能较低[37]。秸秆覆盖降低作物产量可能有几个原因:一方面,部分秸秆堆积可能阻碍种子与土壤的有效接触,影响幼苗生长发育;还田秸秆数量过大时,秸秆不能及时腐解转化为有机物质,也会影响幼苗的发育,间接影响成熟期水稻和小麦有效穗数和穗粒数,进而降低作物产量[10],在上述研究中秸秆为全量还田(约10 t·hm–2)。另一方面,相较于秸秆50%保留或秸秆焚烧处理,秸秆全保留(2 t·hm–2)会增加杂草发病率,从而降低小麦产量[38];有报道免耕和秸秆覆盖(7.5 t·hm–2)会增加河谷镰刀菌(F. graminearum)和串珠镰刀菌(F. moniliforme)丰度,导致作物根腐病,威胁作物产量[39]。本定位试验地土壤地力水平较高,0~20 cm土层的土壤不同氮组分与作物产量之间无显著相关性(表 5),佐证了土壤养分不是限制该区域作物产量的关键因素,秸秆覆盖提高土壤氮含量并不是本区域小麦产量增加的原因。Pittelkow等[7]通过整合分析发现,秸秆覆盖能够提高干旱区雨养作物的产量,但对湿润区的雨养作物产量无显著影响。本试验地点位于成都平原,大陆性季风气候显著,春季降雨较少,这就意味着秸秆覆盖可能通过提高土壤含水量,进而显著提高该区域小麦产量;在水稻季节降雨充沛,秸秆覆盖对土壤含水量影响较小,造成秸秆覆盖对水稻产量增加不显著。值得注意的是,为了降低长期免耕和秸秆覆盖的增加杂草发病率和土传病害、减产等潜在不利影响,保护性耕作区应该采取适当措施,如适当年限翻耕长期免耕田、降低秸秆还田数量,以更好发挥保护性耕作的环境效益和经济效益。
4 结论相较于秸秆移除,免耕条件下长期秸秆覆盖对不同土层氮组分的影响略有差异:首先,长期秸秆覆盖显著提高了土壤0~5 cm TN含量,较秸秆移除处理提高了23.24%;其次,长期秸秆覆盖提高了0~5 cm和5~10 cm PON含量、0~5 cm NH4+–N和NO3––N含量及0~5 cm和10~20 cm DON含量,对MBN含量无显著影响;此外,长期秸秆覆盖提高了0~5 cm和10~20 cm DOC/TN比值,对其他组分在全氮占比无显著影响。同时,秸秆覆盖显著提高了土壤总体微生物和细菌PLFA含量,对真菌和放线菌PLFA含量无影响,显著降低了土壤真菌/细菌比;土壤MBN、POC/PON和TN是显著影响土壤微生物群落组成的关键土壤环境因子。对于作物产量,秸秆覆盖显著提高了小麦产量,但对水稻产量无影响。基于此,秸秆覆盖适宜于西南免耕稻–麦轮作区推广应用。
| [1] |
Hobbs P R. Conservation agriculture: what is it and why is it important for future sustainable food production[J]. Journal of Agricultural Science, 2007, 145: 127-137. DOI:10.1017/S0021859607006892
(  0) 0) |
| [2] |
Zhang H L, Lal R, Zhao X, et al. Opportunities and challenges of soil carbon sequestration by conservation agriculture in China[J]. Advances in Agronomy, 2014, 124: 1-36.
(  0) 0) |
| [3] |
Deng C C, Li L L, Xie J H, et al. Effects of tillage on soil bacterial community in the dryland farming area of central Gansu (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(1): 207-216. [耕作措施对陇中旱农区土壤细菌群落的影响[J]. 土壤学报, 2019, 56(1): 207-216.]
(  0) 0) |
| [4] |
Liu L L, Li C, Fang H, et al. Effect of no-till farming on soil structure in rice-rapeseed rotation system (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(2): 412-420. [免耕对稻油轮作系统土壤结构的影响[J]. 土壤学报, 2021, 58(2): 412-420.]
(  0) 0) |
| [5] |
Kassam A, Li H W, Niino Y, et al. Current status, prospect and policy and institutional support for conservation agriculture in the Asia-Pacific region[J]. International Journal of Agricultural & Biological Engineering, 2014, 7(5): 1-13.
(  0) 0) |
| [6] |
China Machinery Industry Yearbook Editorial Committee, China Association of Agricultural Machinery Manufacturers. China Agricultural Machinery Industry Yearbook(2019) (In Chinese). Beijing: China Machine Press, 2019. [中国农业机械工业年鉴(2019)[M]. 北京: 机械工业出版社, 2019.]
(  0) 0) |
| [7] |
Pittelkow C M, Liang X Q, Linquist B A, et al. Productivity limits and potentials of the principles of conservation agriculture[J]. Nature, 2015, 517(7534): 365-368. DOI:10.1038/nature13809
(  0) 0) |
| [8] |
Giller K E, Witter E, Corbeels M, et al. Conservation agriculture and smallholder farming in Africa: The heretics' view[J]. Field Crops Research, 2009, 114: 23-34. DOI:10.1016/j.fcr.2009.06.017
(  0) 0) |
| [9] |
Wang X B, Wu H J, Dai K, et al. Tillage and crop residue effects on rainfed wheat and maize production in Northern China[J]. Field Crops Research, 2012, 132: 106-116. DOI:10.1016/j.fcr.2011.09.012
(  0) 0) |
| [10] |
Wang J, Xue Y, Pan J J, et al. Effects of tillage and straw incorporation on sequestration of organic carbon and crop yields (In Chinese)[J]. Journal of Soil and Water Conservation, 2018, 32(5): 121-127. [耕作和秸秆还田对土壤团聚体有机碳及其作物产量的影响[J]. 水土保持学报, 2018, 32(5): 121-127.]
(  0) 0) |
| [11] |
Cook H F, Valdes G S, Lee H C. Mulch effects on rainfall interception, soil physical characteristics and temperature under Zea mays L[J]. Soil & Tillage Research, 2006, 91: 227-235.
(  0) 0) |
| [12] |
Li S, Zhang S, Pu Y, et al. Dynamics of soil labile organic carbon fractions and C-cycle enzyme activities under straw mulch in Chengdu Plain[J]. Soil & Tillage Research, 2016, 155: 289-297.
(  0) 0) |
| [13] |
Zhou Z J, Zeng X Z, Chen K, et al. Long-term straw mulch effects on crop yields and soil organic carbon fractions at different depths under a no-till system on the Chengdu Plain, China[J]. Journal of Soils and Sediments, 2019, 19(5): 2143-2152. DOI:10.1007/s11368-018-02234-x
(  0) 0) |
| [14] |
Dong L L, Wang H H, Lu C Y, et al. Effects of straw returning amount and type on soil nitrogen and its composition (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(4): 1143-1150. [秸秆还田量和类型对土壤氮及氮组分构成的影响[J]. 应用生态学报, 2019, 30(4): 1143-1150.]
(  0) 0) |
| [15] |
Zhang Z X, Li T C, Qi Z J, et al. Effects of straw returning on nitrogen composition in paddy soil under controlled irrigation (In Chinese)[J]. Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(11): 229-238. DOI:10.6041/j.issn.1000-1298.2019.11.026 [控制灌溉下秸秆还田对稻田土壤氮素组成的影响[J]. 农业机械学报, 2019, 50(11): 229-238.]
(  0) 0) |
| [16] |
Li Y, Zhang Q P, Cai Y J, et al. Minimum tillage and residue retention increase soil microbial population size and diversity: Implications for conservation tillage[J]. Science of the Total Environment, 2020, 716: 137164. DOI:10.1016/j.scitotenv.2020.137164
(  0) 0) |
| [17] |
Allison S D, Martiny J B H. Resistance, resilience, and redundancy in microbial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(1): 11512-11519.
(  0) 0) |
| [18] |
Lu R K. Analytical methods for soil and agrochemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.]
(  0) 0) |
| [19] |
Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen(DON)and dissolved organic carbon(DOC)in soil[J]. Soil Biology and Biochemistry, 2006, 38: 991-999. DOI:10.1016/j.soilbio.2005.08.012
(  0) 0) |
| [20] |
Cambardella C A, Elliott E T. Particulate soil organic matter changes across a grassland cultivation sequence[J]. Soil Science Society of America Journal, 1992, 56(3): 777-783. DOI:10.2136/sssaj1992.03615995005600030017x
(  0) 0) |
| [21] |
Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099
(  0) 0) |
| [22] |
Huang X J, Wang F, Gu S K, et al. Effects of potassium sources and rates on crop yields and microbial community structure in a four-year experiment in purple soil (In Chinese)[J]. Acta Ecologica Sinica, 2018, 38(16): 5792-5799. [钾肥及与秸秆配施对紫色土作物产量和微生物群落结构的影响[J]. 生态学报, 2018, 38(16): 5792-5799.]
(  0) 0) |
| [23] |
Li Y L, Wang C K, Lu B L, et al. In-situ monitoring method of wheat root growth under salt stress using minirhizotron technique (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3): 599-609. [基于微根管技术的盐胁迫下小麦根系生长原位监测方法[J]. 土壤学报, 2021, 58(3): 599-609.]
(  0) 0) |
| [24] |
Haynes R J. Labile organic matter fractions as central components of the quality of agricultural soils: an overview[J]. Advances in Agronomy, 2005, 85: 221-268.
(  0) 0) |
| [25] |
Liu Y C, Feng W Q, Qin Y S, et al. Effects of long-term fertilization and straw mulch on crop yields and soil fertility under rice-wheat rotation in Chengdu Plain (In Chinese)[J]. Southwest China Journal of Agricultural Sciences, 2015, 28(1): 240-247. [长期秸秆还田与施肥对成都平原稻-麦轮作下作物产量和土壤肥力的影响[J]. 西南农业学报, 2015, 28(1): 240-247.]
(  0) 0) |
| [26] |
Li X, Han J L, Wu W X, et al. Effects of different straw returning methods on soil microbial biomass carbon, nitrogen and winter wheat yield in Guanzhong Plain (In Chinese)[J]. Journal of Soil and Water Conservation, 2018, 32(4): 170-176. [秸秆还田方式对关中盆地土壤微生物量碳氮和冬小麦产量的影响[J]. 水土保持学报, 2018, 32(4): 170-176.]
(  0) 0) |
| [27] |
Spedding T A, Hamel C, Mehuys G R, et al. Soil microbial dynamics in maize–growing soil under different tillage and residue management systems[J]. Soil Biology and Biochemistry, 2004, 36: 499-512. DOI:10.1016/j.soilbio.2003.10.026
(  0) 0) |
| [28] |
Sun L, Wu Z, Ma Y, et al. Ammonia volatilization and atmospheric N deposition following straw and urea application from a rice–wheat rotation in southeastern China[J]. Atmospheric Environment, 2018, 181: 97-105. DOI:10.1016/j.atmosenv.2018.02.050
(  0) 0) |
| [29] |
Qiu C P, Chen X F, Liu M, et al. Microbial transformation process of straw-derived C in two typical paddy soils (In Chinese)[J]. Scientia Agricultura Sinica, 2019, 52(13): 2268-2279. DOI:10.3864/j.issn.0578-1752.2019.13.007 [两种典型水稻土中秸秆碳转化的微生物过程[J]. 中国农业科学, 2019, 52(13): 2268-2279.]
(  0) 0) |
| [30] |
Struecker J, Joergensen R G. Microorganisms and their substrate utilization patterns in topsoil and subsoil layers of two silt loams, differing in soil organic C accumulation due to colluvial processes[J]. Soil Biology and Biochemistry, 2015, 91: 310-317. DOI:10.1016/j.soilbio.2015.09.011
(  0) 0) |
| [31] |
Lupwayi N Z, May W E, Kanashiro D A, et al. Soil bacterial community responses to black medic cover crop and fertilizer N under no-till[J]. Applied Soil Ecology, 2018, 124: 95-103. DOI:10.1016/j.apsoil.2017.11.003
(  0) 0) |
| [32] |
Cardinale B J, Matulich K L, Hooper D U, et al. The functional role of producer diversity in ecosystems[J]. American Journal of Botany, 2011, 98(3): 572-592. DOI:10.3732/ajb.1000364
(  0) 0) |
| [33] |
Peng C J, Lai S S, Luo X S, et al. Effects of long term rice straw application on the microbial communities of rapeseed rhizosphere in a paddy-upland rotation system[J]. Science of the Total Environment, 2016, 557/558: 231-239. DOI:10.1016/j.scitotenv.2016.02.184
(  0) 0) |
| [34] |
Chen Z, Wang H, Liu X, et al. Changes in soil microbial community and organic carbon fractions under short-term straw return in a rice-wheat cropping system[J]. Soil & Tillage Research, 2017, 165: 121-127.
(  0) 0) |
| [35] |
De Vries F T, Hoffland E, Van Eekeren N, et al. Fungal/ bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092-2103. DOI:10.1016/j.soilbio.2006.01.008
(  0) 0) |
| [36] |
Zhang T A, Chen H Y H, Ruan H H. Global negative effects of nitrogen deposition on soil microbes[J]. The ISME Journal, 2018, 12(7): 1817-1825. DOI:10.1038/s41396-018-0096-y
(  0) 0) |
| [37] |
Chen Z M, Wang Q, Wang H Y, et al. Crop yields and soil organic carbon fractions as influenced by straw incorporation in a rice-wheat cropping system in southeastern China[J]. Nutrient Cycling in Agroecosystems, 2018, 112(1): 61-73. DOI:10.1007/s10705-018-9929-3
(  0) 0) |
| [38] |
Taa A, Tanner D, Bennie A T P. Effects of stubble management, tillage and cropping sequence on wheat production in the south-eastern highlands of Ethiopia[J]. Soil & Tillage Research, 2004, 76: 69-82.
(  0) 0) |
| [39] |
Wang H, Guo Q, Li X, et al. Effects of long-term notillage with different straw mulching frequencies on soil microbial community and the abundances of two soilborne pathogens[J]. Applied Soil Ecology, 2020, 148: 103488. DOI:10.1016/j.apsoil.2019.103488
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


