2. 湿润亚热带山地生态国家重点实验室培育基地,福州 350007;
3. 北京大学生态研究中心,北京大学城市与环境学院,北京大学地表过程分析与模拟教育部重点实验室,北京 100871;
4. 福建戴云山国家级自然保护区管理局,福建泉州 362500
2. Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou 350007, China;
3. Institute of Ecology, College of Urban and Environmental Sciences, Key Laboratory for Earth Surface Processes of the Ministry of Education, Peking University, Beijing 100871, China;
4. Daiyun Mountain National Nature Reserve Administration Bureau, Quanzhou, Fujian 362500, China
土壤有机碳(SOC)矿化是陆地生态系统土壤碳排放的主要途径[1]。在全球尺度上,SOC矿化产生的CO2是人类活动碳排放量的6倍至10倍[2],土壤碳库的微小变化都可能显著改变大气CO2浓度,进而影响全球气候变化[3]。因此,了解土壤SOC矿化对探究陆地生态系统土壤碳的储存及周转具有重要意义。
研究表明,凋落物输入会促进或抑制原有SOC矿化,产生正或负激发效应(Priming effect,PE)[4]。且未来全球变化(如气候变暖、CO2增多)可能会促进植物生长,增加凋落叶归还量[5]。凋落叶输入量的增加给土壤微生物生长提供了更多的碳源和能量[6],改变微生物活性和功能,从而影响激发效应的强度和方向[7]。除数量外,凋落物质量(如C/N等)亦会影响激发效应。通常高质量的凋落叶(C/N低)更容易被土壤微生物利用[8],添加高质量凋落叶(C/N低)可能加快原有SOC矿化,产生正激发效应[9]。但也有研究表明,供应低质量的凋落物会使微生物矿化更多的土壤有机质(SOM)以满足对氮的需求,产生正激发效应[10]。因此,凋落叶输入对土壤激发效应的影响及其机制有待进一步探索。
“计量比分解”原理和“微生物氮矿化”理论常被用作解释外源物质输入后改变SOC矿化和土壤激发效应的理论依据。其中,“计量比分解”强调土壤微生物为保持养分计量比平衡,从而增加SOM矿化来获取限制性养分[11];“微生物氮矿化”理论则认为微生物为了获取氮养分而增加对SOM的矿化[12]。两者虽有差异,但均强调了限制性养分在调节土壤有机质分解过程中具有关键作用。在湿润亚热带地区,土壤风化严重且铁、铝氧化物含量高,导致土壤磷有效性较低,使得磷成为该区域内植被和土壤微生物生长的限制性养分[13],因此,土壤磷有效性的变化可能会影响亚热带森林SOC的矿化过程。如部分研究发现,低磷土壤添加磷会促进[14]、抑制[15]或未显著改变[16]SOC矿化速率。此外,在温带森林[17]和草原[18]的研究表明,磷有效性会影响土壤碳矿化对外源碳添加的响应程度和模式。以上结果表明磷可能是影响SOC矿化和激发效应的关键因子,但目前仍不清楚在亚热带低磷土壤中,凋落叶和磷共同添加如何影响SOC矿化过程。
马尾松(Pinus massoniana)是一种重要的速生用材树种和造林先锋树种,广泛分布于我国热带亚热带15个省区[19],种植面积约为800万hm2,占我国森林总面积的3.6%[20],在森林生态系统中占有重要地位。本课题组前期调查研究发现,马尾松、火力楠(Michelia macclurei)和枫香(Liquidambar formosana)凋落叶质量差异较大。因此,本研究以马尾松林下土壤为对象,通过室内培养试验,并结合碳同位素示踪技术,探究13C富集的不同质量凋落叶(马尾松、火力楠和枫香)和磷添加对亚热带低磷土壤碳矿化和激发效应的影响,以期为该区域森林生态系统碳循环研究提供理论依据。
1 材料与方法 1.1 供试材料2018年6月,选择大小相近的马尾松、火力楠和枫香幼苗进行盆栽种植,待生长稳定后,对三种树苗进行13C脉冲标记。选择天气晴好的上午,将盆栽转移至玻璃房中,同时使稀HCl和13C富集的NaHCO3(99%)在玻璃瓶中反应并通过管道将产生的CO2泵入密封的玻璃房中。玻璃房中装有2个电风扇进行吹风,使气体混合均匀,每次标记持续时间约3 h,标记流程如图 1所示。每隔15 d左右标记一次,持续半年。标记完成后,收集新鲜叶片,进行杀青、烘干和研磨后,测定叶片全碳(TC)、全氮(TN)、全磷(TP)含量和碳同位素(δ13C)值(测定方法见1.3)。供试叶片性质如表 1所示。
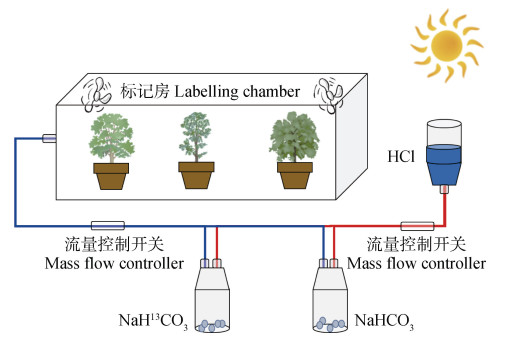
|
图 1 三种植物13C脉冲标记流程示意图 Fig. 1 Schematic diagram of 13C pulse labeling process for three plants |
|
|
表 1 供试凋落叶的基本性质 Table 1 Basic properties of the litters used in the experiment |
2019年6月于福建省泉州市戴云山自然保护区(25°38′—25°43′ N,118°05′—118°20′ E)采集马尾松林表层土壤,该地区属中亚热带海洋季风气候,年平均气温17℃左右,年降水量为1 700~2 000 mm[21],其地带性土壤以花岗岩发育的红壤为主。将采集的土壤带回实验室处理,剔除碎石及可见动植物残体,过2 mm筛后混匀,一部分风干、研磨,测定土壤理化性质,一部分4℃保存用于培养试验。供试土壤有机碳(SOC)80.04 g·kg–1,全氮(TN)5.23 g·kg–1,碳氮比15.30,全磷(TP)0.46 g·kg–1,土壤pH 3.71,可溶性有机碳(DOC)398.8 mg·kg–1,可溶性有机氮(DON)21.18 mg·kg–1,铵态氮66.17 mg·kg–1,硝态氮7.97 mg·kg–1,有效磷(AP)4.95 mg·kg–1。
1.2 实验设计采用双因素实验设计,分别添加磷(KH2PO4)和不同植物(马尾松、火力楠、枫香)凋落叶。共设8个处理,包括对照(CK)、单独添加磷处理(P)、添加马尾松凋落叶处理(PM)、马尾松凋落叶和磷共同添加处理(PM+P)、添加火力楠凋落叶处理(MM)、火力楠凋落叶和磷共同添加处理(MM+P)、添加枫香凋落叶处理(LF)、枫香凋落叶和磷共同添加处理(LF+P),每个处理6个重复(3个重复用于测定土壤SOC矿化,3个重复用于测定其他土壤及微生物指标)。具体方法是取干重为100 g的过筛鲜土放入500 mL培养瓶中,于25℃的培养箱中进行15 d预培养使土壤内部环境趋于稳定。依据田间管理方式以P 30 mg·kg–1干土的量添加KH2PO4[22]。按照SOC的2%的比例进行凋落叶源碳的添加(即C 20 mg·g–1 SOC),以刺激微生物活性[23]。培养过程中将含水率调节至田间饱和持水量的60%,并且每隔3 d对土壤水分进行校正。在培养第0、1、2、4、6、9、14、22、28和35天抽取气体测定土壤CO2排放和CO2-C的δ13C等值计算原有SOC矿化和土壤激发效应,并且在培养35 d后进行破坏性取样,测定土壤化学性质、微生物生物量、酶活性等指标。
1.3 测定方法植物叶片指标测定:用植物碳氮元素分析仪(Vario EL Ⅲ,德国)测定叶片TC、TN含量;叶片13C同位素用稳定同位素比质谱仪测定(MAT253;Finnigan MAT,Bremen,德国),碳同位素(δ13C)以千分比(‰)表示;植物样品经H2SO4-HClO4消解后,通过连续流动分析仪(Skalar san++,荷兰)测定TP含量。
土壤基本化学性质的测定:SOC和TN用土壤碳氮元素分析仪(Elementar Vario MAX,德国)测定。土壤TP经H2SO4-HClO4消解后,通过连续流动分析仪(Skalar san++,荷兰)测定。土壤pH用pH计(STARTER 300,美国)测定。土壤DOC以土︰水= 1︰4用去离子水浸提,震荡离心后,经0.45 µm滤膜抽滤,通过总有机碳分析仪(TOC-VCPH/CPN,日本)测定。土壤NH4+-N和NO3–-N以2 mol·L–1的KCl浸提[24],土壤AP以0.5 mol·L–1 NaHCO3提取[25],用连续流动分析仪(Skalar san++,荷兰)测定。土壤无机氮(IN)为NH4+-N和NO3–-N之和。
土壤微生物生物量测定:微生物生物量碳(MBC)、微生物生物量氮(MBN)和微生物生物量磷(MBP)采用氯仿熏蒸法浸提[26-27],通过总有机碳分析仪(TOC-VCPH/CPN,日本)和连续流动分析仪(Skalar san++,荷兰)测定。
土壤酶活性的测定:参照Saiya-Cork等[28]的方法测定了β-葡萄糖苷酶(β-glucosidase,βG)和酸性磷酸酶(Acid phosphatase,ACP)两种水解酶活性。具体方法如下:取1 g新鲜土壤,加入125 mL的醋酸盐缓冲液(50 mmol·L–1,pH=5),用磁力搅拌器搅拌5 min使其均质化,待溶液澄清后用移液器取200 μL移于96孔微孔板。用伞形酮(MUB)作为标示底物测定水解酶活性。微平板置于黑暗环境下经过20℃恒温培养后,用多功能酶标仪(SpectraMax M5,Molecular Devices,美国)在365 nm激发波长测定水解酶的荧光度。
土壤碳矿化和激发效应的测定及计算:每次采集气体时间均为上午9~11时,采集气体前通风0.5 h,用鼓风装置使培养瓶内气体与外界空气充分交换,随后抽取气体测定CO2背景值,并于密封2 h后再次抽取气体测定CO2浓度,以培养2 h内CO2浓度差值计算CO2排放速率。使用气相色谱仪(GC-2014,日本)测定CO2浓度。
土壤CO2排放速率及累积CO2排放量参考Lang等[29]和Chao等[9]的方法,其中CO2-C排放速率R计算如下:
| $ R = \frac{{\Delta C}}{{\Delta t}} \times \frac{{273.15 \times {\text{M}} \times {\text{V}}}}{{(273.15 + {t} ) \times 22.4 \times {\text{W}}}} $ |
式中,R为碳矿化速率(µg·g–1·h–1);
累积CO2-C排放量T计算如下:
| $ T = \sum {\frac{{{R_i} + {R_{i + 1}}}}{2}} \times ({t_{i + 1}} - {t_i}) \times 24 $ |
式中,T为CO2累积排放量(µg·g–1干土),Ri和Ri+1为第i天和第i+1天CO2通量;ti+1-ti为第i天到第(i+1)天之间的间隔时间(d)。
用稳定同位素比质谱仪(MAT253;Finnigan MAT,Bremen,Germany)测定CO2-C的同位素组成(δ13C),以区分CO2-C的不同来源(土壤源碳和凋落叶源碳)。参考Keith等[30]的方法,两种碳源对CO2-C贡献的计算公式如下:
| $ {C_l} = {{{C_t} \times ({\delta _t} - {\delta _s})} \mathord{\left/ {\vphantom {{{C_t} \times ({\delta _t} - {\delta _s})} {({\delta _l} - {\delta _s})}}} \right. } {({\delta _l} - {\delta _s})}} $ |
| $ {C_s} = {C_t} - {C_l} $ |
式中,Cl为凋落叶源CO2排放;Cs为原有SOC源CO2排放;Ct为土壤总CO2排放;δt为添加凋落叶或凋落叶和磷共同添加处理土壤CO2-C的δ13C值;δs为对照土壤CO2-C的δ13C值;δl为凋落叶的δ13C值。
以凋落叶添加处理和凋落叶与磷共同添加处理中原有SOC源CO2排放与对照土壤中的SOC矿化的CO2排放之差计算激发效应(PE)[4]:
| $ {C_s} = {C_t} - {C_l} $ |
式中,Cct表示对照土壤的SOC源CO2排放。
1.4 数据处理使用单因素方差分析(one-way ANOVA)和双因素方差分析(two-way ANOVA)探究碳底物(无凋落叶添加、马尾松凋落叶、火力楠凋落叶和枫香凋落叶添加)和磷(有无磷添加),以及二者交互作用对土壤累积激发效应、DOC、IN、AP、微生物生物量和酶活性的影响。采用线性回归分析检验土壤累积激发效应与土壤氮磷有效性、MBN、MBP和两种酶活性的关系。P≤0.05被认为差异显著。必要时对数据进行对数转换,以改善正态分布,减少异方差。所有统计分析均在SPSS 22.0软件中进行。使用Origin 10.0软件绘图。
2 结果 2.1 凋落叶和磷添加对土壤化学性质的影响培养结束后,凋落叶和磷单独添加或共同添加对SOC、TN和pH均无显著影响(表 2)。无论是否添加凋落叶,添加磷整体上提高了土壤TP的含量(P=0.004),且凋落叶和磷添加对TP的交互作用显著(P=0.043)。与CK相比,凋落叶添加整体上提高了土壤DOC含量(P=0.030,表 2),但与单独添加火力楠和枫香凋落叶相比,凋落叶与磷共同添加后土壤DOC含量显著降低(凋落叶和磷的交互作用显著,P < 0.001)。与CK相比,凋落叶单独添加及凋落叶和磷共同添加均显著降低了土壤IN含量(P < 0.001),且与单独添加凋落叶相比,凋落叶和磷添加使土壤IN含量显著降低(凋落叶和磷的交互作用显著,P=0.011)。单独添加磷、凋落叶和磷添加处理的AP含量均显著高于CK(P < 0.001)。
|
|
表 2 凋落叶和磷添加对土壤化学性质的影响 Table 2 Effects of litters and P addition on soil chemical properties |
培养初期,与CK相比,三种凋落叶添加后土壤CO2排放速率均大幅度提升,随后逐渐降低(图 2)。培养初期,磷添加也提高了土壤碳矿化速率,并且在第4天达到最大值,随后逐渐减弱并与CK趋于一致(图 2)。与CK相比,凋落叶和磷单独添加或共同添加均显著提高了土壤累积CO2排放(图 3a)。不同凋落添加处理的SOC矿化与累积CO2排放量变化一致,均为PM > MM > LF。凋落叶源CO2排放表现为MM显著高于PM和LF(图 3a)。磷添加显著降低了火力楠和枫香凋落叶诱导的土壤SOC矿化,但对三种凋落叶源CO2排放均无显著影响(图 3a)。
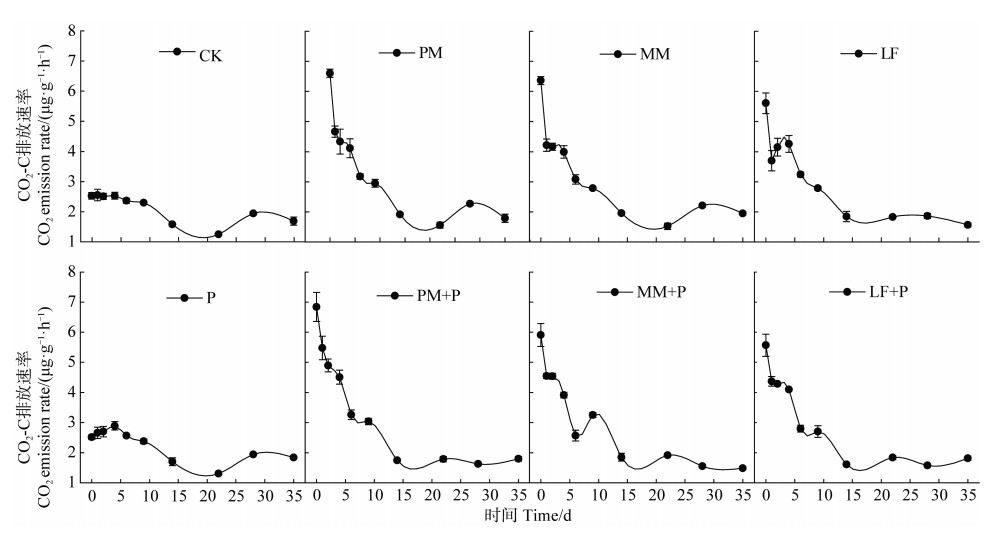
|
图 2 凋落叶和磷添加对土壤CO2排放速率的影响 Fig. 2 Effects of litters and P addition on soil CO2 emission rate |
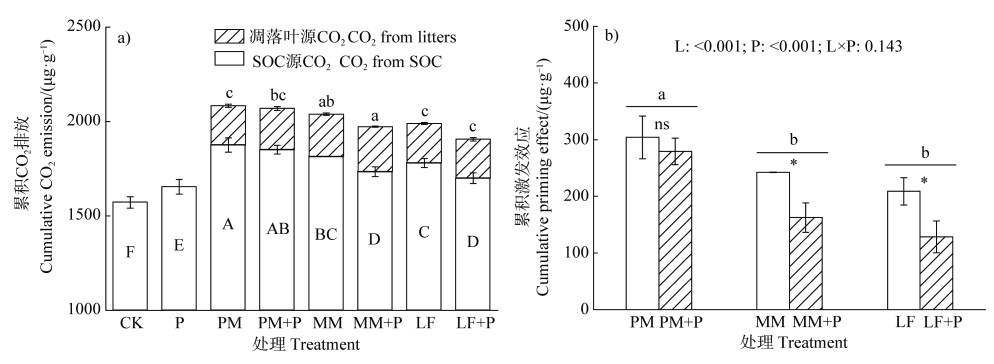
|
注:图 3a中不同大写字母表示不同处理间SOC源CO2排放差异显著(P < 0.05),不同小写字母表示不同凋落叶源CO2排放差异显著(P < 0.05)。图 3b中L,P和L×P分别表示双因素分析中凋落叶添加,磷添加以及凋落叶和磷共同添加的主效应;不同小写字母表示不同凋落叶处理间差异显著(P < 0.05);*和**分别表示相同凋落叶底物情况下加磷与不加磷间差异显著(P < 0.05)和极显著(P < 0.01),ns则表示差异不显著(P > 0.05)。下同。 Note: In fig. 3a, different capital letters indicate significant differences(P < 0.05)in CO2 emissions from SOC sources among different treatments, and different lowercase letters indicate significant differences(P < 0.05)in CO2 emissions from different litters sources. In fig. 3b, L, P and L×P represent the main effects of litters addition, P addition, and interaction between litters and P addition, respectively; different lowercase letters indicate significant differences(P < 0.05)in different litters treatments; * and ** respectively indicate significant(P < 0.05)and extremely significant(P < 0.01)differences between the addition of P and non-addition of P under the same litters substrate, "ns" indicate no significant differences(P > 0.05). The same below. 图 3 凋落叶和磷添加对土壤累积CO2排放和激发效应的影响 Fig. 3 Effects of litters and P addition on soil cumulative CO2 emission and priming effect |
三种凋落叶添加均产生了强烈的正激发效应,且激发效应强度因凋落物类型而异(P < 0.001),表现为PM显著高于MM和LF(图 3b)。磷添加未显著影响PM凋落叶添加产生的激发效应,但显著降低了MM和LF添加产生的激发效应(P < 0.01,图 3b)。
2.3 凋落叶和磷添加对土壤微生物生物量碳、氮、磷的影响与CK相比,单独添加马尾松和火力楠凋落叶后MBC含量显著提高了15.4%和12.5%,单独添加磷处理的MBC含量显著提高了10.8%(表 3)。此外,与单独添加马尾松凋落叶相比,马尾松凋落叶与磷添加降低了MBC含量(凋落叶和磷的交互作用显著,P=0.011,表 3)。培养结束后,与CK相比,凋落叶和磷添加均显著提高了MBN和MBP含量(P < 0.001),且火力楠凋落叶与磷共同添加后,MBN含量要显著高于单独添加火力楠凋落叶和磷处理(凋落叶和磷的交互作用显著,P=0.015,表 3)。
|
|
表 3 凋落叶和磷添加对土壤微生物生物量碳、氮和磷的影响 Table 3 Effects of litters and P addition on soil microbial biomass carbon, nitrogen and phosphorus |
与CK相比,添加凋落叶整体上提高了βG和ACP活性,而单独添加磷对βG和ACP活性均没有显著影响(图 4)。此外,与单独添加凋落叶相比,火力楠和枫香凋落叶与磷共同添加均显著降低了ACP的活性(图 4b)。
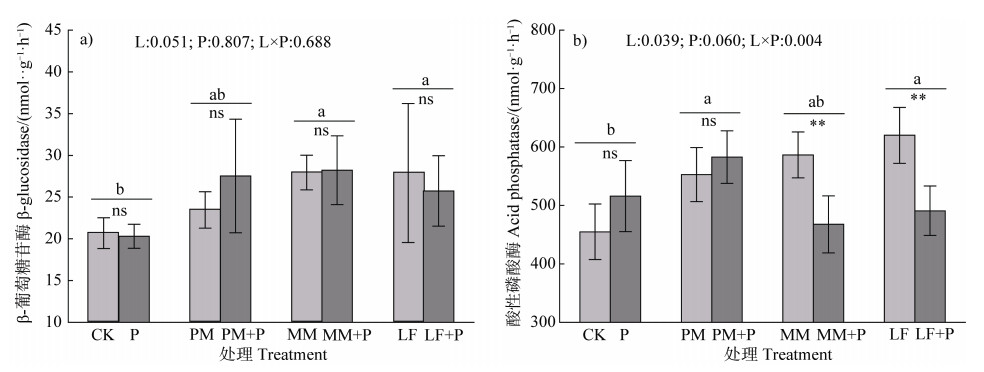
|
图 4 凋落叶和磷添加对土壤酶活性的影响 Fig. 4 Effects of litters and P addition on soil enzymes activities |
线性回归分析结果表明(图 5),激发效应和土壤AP、MBN、MBP含量均呈显著负相关,而与土壤IN含量无明显的相关关系。累积激发效应与土壤ACP活性呈显著正相关,而与βG活性的相关性不显著。
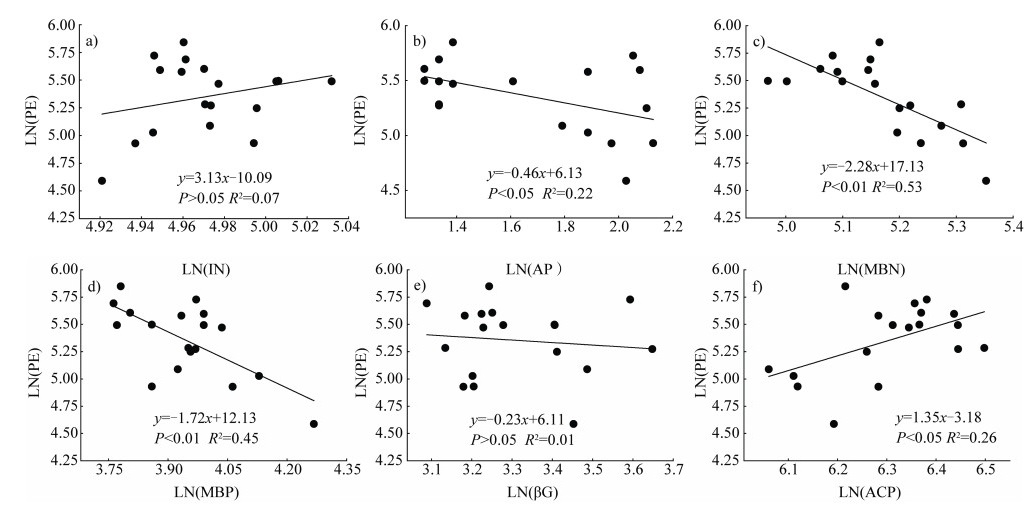
|
注:PE,激发效应;βG,β-葡萄糖苷酶;ACP,酸性磷酸酶。 Note: PE, priming effect; βG, β-glucosidase; ACP, Acid phosphatase. 图 5 土壤累积激发效应与土壤养分有效性及酶活性的关系(对原始数据进行自然对数转换) Fig. 5 Relationships between soil cumulative priming effect and soil nutrient availability and enzymatic activities(The natural logarithmic transformation was performed on the original data) |
本研究中,三种凋落叶添加均显著提高了土壤SOC矿化(图 3a),产生了正激发效应(图 3b),与森林、农田土壤的大部分研究结果保持一致[11,31]。这可能是因为凋落物输入带来的新鲜碳源刺激了微生物生长,微生物为满足自身生长需要,增加胞外酶的分泌以获取更多养分,从而促进SOC矿化,产生正激发效应。三种凋落叶累积激发效应表现为PM > MM > LF(图 3),与所添加凋落叶的碳氮比(PM < MM < LF,表 1)相对应,表明高质量凋落叶(低C/N)添加可能导致更高的激发效应。Fanin等[32]的研究也表明高质量凋落叶添加会产生更强的激发效应,说明凋落物质量是影响土壤激发效应强度的关键因素之一。
已有研究发现,在磷限制的生态系统中添加磷会影响土壤碳循环过程[33]。本研究中磷添加促进了土壤碳矿化速率(图 2)和累积CO2排放量(图 3a),这表明土壤微生物呼吸可能受磷的限制。Fang等[15]的研究表明磷添加改变了土壤微生物群落结构,降低了碳循环酶活性,抑制了碳矿化。本研究磷添加并未降低土壤酶活性(图 4),因此与Fang等的研究结果不同。此外,磷添加未显著改变马尾松凋落叶诱导的激发效应,但显著降低了火力楠和枫香凋落叶诱导的激发效应,这表明磷添加可能会减少火力楠和枫香凋落叶输入导致的土壤碳损失。
3.2 凋落叶和磷添加影响SOC矿化和激发效应的机制凋落叶输入导致的正激发效应可能与微生物的计量比分解有关。添加凋落叶后,土壤MBC含量增加(表 3),碳水解酶-βG活性增强(图 4a),进而促进有机碳分解来获取生长所需的关键养分。同时,凋落叶添加后土壤MBN和MBP含量增加(表 3),表明微生物增加了氮和磷养分的吸收和同化,进一步说明凋落叶诱导的正激发效应可能与计量比分解有关。由于亚热带森林土壤具有独特的氮保持机制,处于相对氮饱和状态,而土壤磷成为限制性养分,因此微生物为分泌更多的磷酸酶(图 4b)来获取更多的磷,这也可能会影响土壤碳的分解,即“磷挖掘”理论[34]。此外,不同凋落叶添加处理间激发效应强度的差异可能和凋落叶的质量(凋落叶碳氮比和碳磷比等)有关[35]。添加高质量的外源碳更有利于微生物的生长[36],因此,与添加火力楠和枫香凋落叶相比,添加质量相对较高的马尾松凋落叶产生了更高的激发效应。
磷添加降低了火力楠和枫香凋落叶输入诱导的激发效应,而未改变马尾松凋落叶诱导的激发效应的强度(图 3b),这可能是凋落叶质量和磷有效性共同驱动的结果。通常认为在磷限制的土壤中添加凋落叶,可能会进一步加剧磷限制[17],促使微生物分泌胞外酶,增加有机质矿化来获取养分;而磷添加会缓解微生物磷限制,减轻微生物因获取磷而产生的土壤有机质矿化。事实上,土壤磷有效性对土壤碳矿化的影响还可能与添加凋落叶的性质有关,因为凋落叶输入土壤后,不仅提高了土壤碳含量,同时也提高了氮、磷等养分含量。本研究中马尾松凋落叶TP含量显著高于火力楠和枫香凋落叶(表 1),微生物通过分解马尾松凋落叶可以获得更多的磷,降低了磷挖掘为目的的有机质矿化,因此磷添加未显著改变马尾松凋落叶诱导的激发效应强度。此外,与单独添加凋落叶相比,马尾松凋落叶和磷共同添加未显著改变ACP活性,而火力楠、枫香凋落叶和磷共同添加导致ACP活性降低(图 4b),表明磷添加缓解了火力楠和枫香凋落叶输入后土壤微生物的磷限制。线性回归分析也表明土壤激发效应与AP和MBP含量呈显著负相关关系,而与ACP活性呈显著正相关关系(图 5),进一步说明凋落叶和磷添加诱导的激发效应可能与微生物对磷的需求和磷挖掘过程有关。
综上所述,凋落叶输入刺激了微生物的生长,微生物为满足养分计量平衡矿化有机质,促进有机质分解,产生正激发效应;而磷添加通过减轻微生物的磷挖掘作用,削弱凋落叶输入诱导的正激发效应的强度。研究结果为凋落叶和磷添加如何影响亚热带森林土壤碳激发效应提供了可能的解释,但特定微生物群落对土壤碳激发效应的贡献还需要进一步探究。
4 结论三种凋落叶添加均提高了土壤SOC矿化速率与累积碳矿化量,产生了正激发效应,且激发效应的强度与凋落叶质量有关,表现为PM > MM > LF。磷添加促进了SOC的矿化,但降低了火力楠和枫香凋落叶诱导的激发效应的强度。未来气候变化条件下,凋落叶输入增多可能会导致土壤碳损失增加,而磷添加可能在短期内降低低质量凋落叶(如火力楠和枫香凋落叶)输入诱导的激发效应与碳损失,说明磷有效性是亚热带低磷森林土壤碳矿化的重要影响因素之一,区域碳循环预测模型应考虑磷的贡献。
致谢 感谢福建师范大学地理科学学院李蕾和雷国良老师在同位素测定工作中给予的帮助。
| [1] |
Zhao X X, Li Y L, Xie Z M, et al. Effects of nitrogen deposition and plant litter alteration on soil respiration in a semiarid grassland[J]. Science of the Total Environment, 2020, 740: 139634. DOI:10.1016/j.scitotenv.2020.139634
(  0) 0) |
| [2] |
Friedlingstein P, Jones M W, O'Sullivan M, et al. Global carbon budget 2019[J]. Earth System Science Data, 2019, 11(4): 1783-1838. DOI:10.5194/essd-11-1783-2019
(  0) 0) |
| [3] |
Bond-Lamberty B, Thomson A. Temperature-associated increases in the global soil respiration record[J]. Nature, 2010, 464(7288): 579-582. DOI:10.1038/nature08930
(  0) 0) |
| [4] |
Kuzyakov Y, Friedel J K, Stahr K. Review of mechanisms and quantification of priming effects[J]. Soil Biology & Biochemistry, 2000, 32(11/12): 1485-1498.
(  0) 0) |
| [5] |
Pegoraro E, Mauritz M, Bracho R, et al. Glucose addition increases the magnitude and decreases the age of soil respired carbon in a long-term permafrost incubation study[J]. Soil Biology & Biochemistry, 2019, 129: 201-211.
(  0) 0) |
| [6] |
Blagodatskaya Е, Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: Critical review[J]. Biology and Fertility of Soils, 2008, 45(2): 115-131. DOI:10.1007/s00374-008-0334-y
(  0) 0) |
| [7] |
Wang Q K, Tian P, Sun Z L, et al. Research on soil organic matter in forest ecosystems: Status and challenge (In Chinese)[J]. Chinese Journal of Ecology, 2020, 39(11): 3829-3843. [王清奎, 田鹏, 孙兆林, 等. 森林土壤有机质研究的现状与挑战[J]. 生态学杂志, 2020, 39(11): 3829-3843.]
(  0) 0) |
| [8] |
Zhang B B, Wan X H, Yang J Q, et al. Effects of litters different in quality on soil microbial community structure in Cunninghamia lanceolata plantation (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 1040-1049. [张冰冰, 万晓华, 杨军钱, 等. 不同凋落物质量对杉木人工林土壤微生物群落结构的影响[J]. 土壤学报, 2021, 58(4): 1040-1049.]
(  0) 0) |
| [9] |
Chao L, Liu Y Y, Freschet G T, et al. Litter carbon and nutrient chemistry control the magnitude of soil priming effect[J]. Functional Ecology, 2019, 33(5): 876-888. DOI:10.1111/1365-2435.13278
(  0) 0) |
| [10] |
Lyu M K, Xie J S, Vadeboncoeur M A, et al. Simulated leaf litter addition causes opposite priming effects on natural forest and plantation soils[J]. Biology and Fertility of Soils, 2018, 54(8): 925-934. DOI:10.1007/s00374-018-1314-5
(  0) 0) |
| [11] |
Fang Y Y, Nazaries L, Singh B K, et al. Microbial mechanisms of carbon priming effects revealed during the interaction of crop residue and nutrient inputs in contrasting soils[J]. Global Change Biology, 2018, 24(7): 2775-2790. DOI:10.1111/gcb.14154
(  0) 0) |
| [12] |
Chen R R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367. DOI:10.1111/gcb.12475
(  0) 0) |
| [13] |
Zeng Q X, Zhang Q F, Lin K M, et al. Enzyme stoichiometry evidence revealed that five years nitrogen addition exacerbated the carbon and phosphorus limitation of soil microorganisms in a Phyllostachys pubescens forest (In Chinese)[J]. Chinese Journal of Applied Ecology, 2021, 32(2): 521-528. [曾泉鑫, 张秋芳, 林开淼, 等. 酶化学计量揭示5年氮添加加剧毛竹林土壤微生物碳磷限制[J]. 应用生态学报, 2021, 32(2): 521-528.]
(  0) 0) |
| [14] |
Liu H M, Zhou G Y, Bai S H, et al. Differential response of soil respiration to nitrogen and phosphorus addition in a highly phosphorus-limited subtropical forest, China[J]. Forest Ecology and Management, 2019, 448: 499-508. DOI:10.1016/j.foreco.2019.06.020
(  0) 0) |
| [15] |
Fang X M, Zhang X L, Chen F S, et al. Phosphorus addition alters the response of soil organic carbon decomposition to nitrogen deposition in a subtropical forest[J]. Soil Biology & Biochemistry, 2019, 133: 119-128.
(  0) 0) |
| [16] |
Nie E Q, Zhang X Y, Zheng G D, et al. Effects of nitrogen and phosphorus additions on soil organic carbon and nitrogen mineralization and hydrolase kinetics in Chinese fir plantations (In Chinese)[J]. Acta Ecologica Sinica, 2018, 38(2): 615-623. [聂二旗, 张心昱, 郑国砥, 等. 氮磷添加对杉木林土壤碳氮矿化速率及酶动力学特征的影响[J]. 生态学报, 2018, 38(2): 615-623.]
(  0) 0) |
| [17] |
Fisk M, Santangelo S, Minick K. Carbon mineralization is promoted by phosphorus and reduced by nitrogen addition in the organic horizon of northern hardwood forests[J]. Soil Biology & Biochemistry, 2015, 81: 212-218.
(  0) 0) |
| [18] |
Mehnaz K R, Corneo P E, Keitel C, et al. Carbon and phosphorus addition effects on microbial carbon use efficiency, soil organic matter priming, gross nitrogen mineralization and nitrous oxide emission from soil[J]. Soil Biology & Biochemistry, 2019, 134: 175-186.
(  0) 0) |
| [19] |
Liu S Z, Yin H F, Shen Y, et al. Effects of thinning intensity on species composition and diversity of undergrowth vegetation community in Pinus massoniana plantation at initial stage of thinning (In Chinese)[J]. Chinese Journal of Applied Ecology, 2020, 31(9): 2866-2874. [刘思泽, 尹海锋, 沈逸, 等. 间伐强度对马尾松人工林间伐初期林下植被群落物种组成和多样性的影响[J]. 应用生态学报, 2020, 31(9): 2866-2874.]
(  0) 0) |
| [20] |
National Forestry and Grassland Administration. China Forest Resources Report(2014-2018) (In Chinese). Beijing: China Forestry Publishing House, 2019. [国家林业和草原局. 中国森林资源报告-2014-2018[M]. 北京: 中国林业出版社, 2019.]
(  0) 0) |
| [21] |
Song X Z, Chen X F, Zhou G M, et al. Observed high and persistent carbon uptake by Moso bamboo forests and its response to environmental drivers[J]. Agricultural and Forest Meteorology, 2017, 247: 467-475. DOI:10.1016/j.agrformet.2017.09.001
(  0) 0) |
| [22] |
Zhu Z K, Ge T D, Luo Y, et al. Microbial stoichiometric flexibility regulates rice straw mineralization and its priming effect in paddy soil[J]. Soil Biology & Biochemistry, 2018, 121: 67-76.
(  0) 0) |
| [23] |
Qiao N, Wang J, Xu X L, et al. Priming alters soil carbon dynamics during forest succession[J]. Biology and Fertility of Soils, 2019, 55(4): 339-350. DOI:10.1007/s00374-019-01351-0
(  0) 0) |
| [24] |
Carter M R. Soil Sampling and Methods of Analysis . Florida: The Chemical Rubber Company Press, 1993.
(  0) 0) |
| [25] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [26] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 1987, 19(6): 703-707.
(  0) 0) |
| [27] |
Brookes P C, Powlson D S, Jenkinson D S. Measurement of microbial biomass phosphorus in soil[J]. Soil Biology & Biochemistry, 1982, 14(4): 319-329.
(  0) 0) |
| [28] |
Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology & Biochemistry, 2002, 34(9): 1309-1315.
(  0) 0) |
| [29] |
Lang M, Cai Z C, Chang S X. Effects of land use type and incubation temperature on greenhouse gas emissions from Chinese and Canadian soils[J]. Journal of Soils and Sediments, 2011, 11(1): 15-24. DOI:10.1007/s11368-010-0260-0
(  0) 0) |
| [30] |
Keith A, Singh B, Singh B P. Interactive priming of biochar and labile organic matter mineralization in a smectite-rich soil[J]. Environmental Science & Technology, 2011, 45(22): 9611-9618.
(  0) 0) |
| [31] |
Lu X R, Yin Y, Feng J X, et al. Effects of Chinese fir litter and its biochar addition on mineralization of native soil organic carbon (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(4): 943-953. [卢晓蓉, 尹艳, 冯竞仙, 等. 杉木凋落物及其生物质炭对土壤原有有机碳矿化的影响[J]. 土壤学报, 2020, 57(4): 943-953.]
(  0) 0) |
| [32] |
Fanin N, Alavoine G, Bertrand I. Temporal dynamics of litter quality, soil properties and microbial strategies as main drivers of the priming effect[J]. Geoderma, 2020, 377: 114576. DOI:10.1016/j.geoderma.2020.114576
(  0) 0) |
| [33] |
Wang D D, Zhu Z K, Shahbaz M, et al. Split N and P addition decreases straw mineralization and the priming effect of a paddy soil: A 100-day incubation experiment[J]. Biology and Fertility of Soils, 2019, 55(7): 701-712. DOI:10.1007/s00374-019-01383-6
(  0) 0) |
| [34] |
Nottingham A T, Hicks L C, Ccahuana A J Q, et al. Nutrient limitations to bacterial and fungal growth during cellulose decomposition in tropical forest soils[J]. Biology and Fertility of Soils, 2018, 54(2): 219-228. DOI:10.1007/s00374-017-1247-4
(  0) 0) |
| [35] |
Zhang Y J, Gan Z T, Li R J, et al. Litter production rates and soil moisture influences interannual variability in litter respiration in the semi-arid Loess Plateau, China[J]. Journal of Arid Environments, 2016, 125: 43-51. DOI:10.1016/j.jaridenv.2015.09.016
(  0) 0) |
| [36] |
Fan Y X, Zhong X J, Lin T C, et al. Effects of nitrogen addition on DOM-induced soil priming effects in a subtropical plantation forest and a natural forest[J]. Biology and Fertility of Soils, 2020, 56(2): 205-216. DOI:10.1007/s00374-019-01416-0
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


