2. 广东省环境污染控制与修复技术重点实验室, 广州 510006;
3. 华南农业大学资源环境学院, 广东省农业农村污染治理与环境安全重点实验室, 广州 510642;
4. 岭南现代农业科学与技术广东省实验室, 广州 510642
2. Guangdong Provincial Key Lab for Environmental Pollution Control and Remediation Technology, Sun Yat-sen University, Guangzhou 510006, China;
3. Guangdong Provincial Key Laboratory of Agriculture & Rural Pollution Abatement and Environmental Safety, College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China;
4. Guangdong Laboratory for Lingnan Modern Agriculture, Guangzhou 510642, China
人类的生产开发活动向土壤、水体和大气中排放了大量重金属,引发环境污染问题。重金属具有毒性和不可降解性,且随食物链传递和累积,威胁人体健康。据2014年《全国土壤污染状况调查公报》[1],当前我国土壤重金属污染严重,亟需有效管控和治理修复[2]。要解决上述问题,研究和掌握重金属在环境介质中的输入、迁移、转化和归趋等环境行为是关键前提。
由于自然环境的复杂性,重金属环境行为的研究受诸多因素的干扰和局限,稳定同位素技术提供了一个有效的工具。自1947年Urey[3]开启稳定同位素地球化学研究的先河以来,以质量较轻的大量元素(碳C、氢H、氧O、氮N等)为代表的传统稳定同位素研究长达几十年[4],直至20世纪末多接收器等离子体质谱仪(multi-collector inductively coupled plasma mass spectrometry,MC-ICP-MS)面世应用,质量较大、检测难度高的非传统稳定同位素得到了跨越式发展[5]。尤其是铅(Pb)、锌(Zn)、铜(Cu)、镉(Cd)、银(Ag)等重金属稳定同位素体系的开发,为重金属地球化学和环境行为研究开拓了新方向。
不同环境样品的重金属稳定同位素组成及变化指示着重金属生物地球化学过程(如来源、过程及归趋)。根据不同输入端独特的同位素组成,重金属稳定同位素技术能追踪环境中重金属污染物的排放来源[6];通过不同过程引发的同位素分馏,还可示踪重金属可能发生的生物地球化学过程(如吸附、转化、吸收等)[7]。相比其他技术,稳定同位素示踪技术在实现污染物溯源的同时还能量化不同来源贡献,且由于同位素组成不受浓度稀释或富集的影响,对环境过程的示踪摆脱了浓度依赖性的局限。除利用样品本身同位素组成特性进行示踪外,稳定同位素标记法可增强检测灵敏度,使样品同位素组成及变化更直观、可控,在示踪工程金属纳米颗粒环境行为方面有广泛应用[8]。
本文从同位素基本概念出发,根据重金属稳定同位素示踪土壤中重金属环境行为方面的研究进展,重点介绍了土壤环境中重金属的来源与归趋、土壤-植物体系的重金属迁移转化以及金属纳米颗粒环境过程三大应用方向,并讨论总结了重金属稳定同位素分馏的影响机制,最后展望了重金属稳定同位素在土壤环境领域的应用前景,以期对不同重金属在土壤及相关体系中的输入、迁移、转化、归趋等环境行为有更加全面、深入的认识,为土壤污染防治工作提供有效的示踪工具和理论依据。
1 同位素分馏基本概念同位素之间相对原子质量不同会导致物理化学性质(如键强、自由能、热力学势、熵等)存在差异,因此在物理、化学及生物过程中会以不同比例分配于不同物相,从而发生同位素分馏[7]。利用MC-ICP-MS能够精准测定待测样品相对标准物质的同位素组成δ值:
| $ {\delta ^{x/y}}M = \left( {\frac{{^{x/y}{R_{sa}}}}{{^{x/y}{R_{st}}}} - 1} \right) \times 1000‰ $ | (1) |
式中,M为金属元素,x、y分别为两种同位素的质量数,Rsa为样品重轻同位素丰度比;Rst为标准物质重轻同位素丰度比。当δ值大于0时,表示待测样品相对标准物质富集重同位素;小于0时,表示富集轻同位素。
同位素分馏值Δ可描述同位素在不同物相间的分布差异,即同位素分馏程度:
| $ {\Delta ^{x/y}}{M_{A - B}} = {\delta ^{x/y}}{M_A} - {\delta ^{x/y}}{M_B} $ | (2) |
根据上式,Δ大于0,A相对B富集重同位素;反之亦然。
2 稳定同位素示踪土壤重金属的应用进展当前利用重金属稳定同位素示踪土壤中重金属环境行为得到广泛研究(图 1)。其中,土壤重金属污染的溯源与归趋是研究最早也是最多的领域;而后随着对粮食安全问题的重视[9]以及植物修复学科的兴起,土壤-植物体系重金属元素迁移转化示踪成为新的热点;近年来随着纳米科技的不断发展,重金属在纳米尺度的环境行为受到关注,对其环境过程示踪的相关研究也逐步出现。
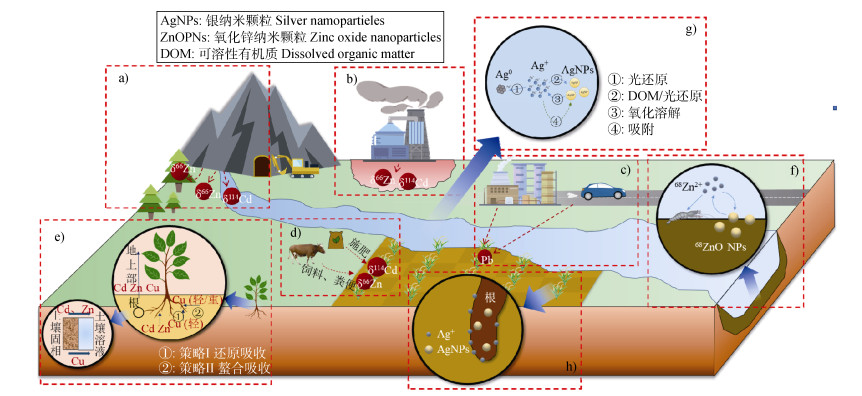
|
注:a)矿山污染来源示踪,b)冶炼污染来源示踪,c)工业排放归趋示踪,d)农业排放归趋示踪,e)土壤-植物体系迁移转化示踪,f)工程金属纳米颗粒(MNPs)转化与吸收示踪,g)天然MNPs形态转化示踪,h)天然MNPs根际吸收示踪。 Note: a)Mine pollution source tracing, b)Smelting pollution source tracing, c)Industrial emission fate tracing, d)Agricultural emission fate tracing, e)Soil-plant system transport and transformation tracing, f)Engineered metal nanoparticles(MNPs)transformation and absorption tracing, g)Natural MNPs morphological transformation tracing, h)Natural MNPs rhizosphere absorption tracing. 图 1 重金属稳定同位素示踪土壤重金属环境行为的应用示意图 Fig. 1 Schematic diagram of heavy metal stable isotope to trace the environmental behavior of heavy metals in soils |
由于同位素组成的指纹特性,重金属稳定同位素常被当作示踪污染物来源与归趋的理想工具,目前在锌(Zn)、镉(Cd)、铅(Pb)等重金属体系应用较为成熟。
2.1.1 土壤重金属污染来源示踪由于天然岩石矿物和土壤等背景源与人为排放源的重金属同位素组成特征一般存在显著差异,利用这种差异可识别污染来源并量化不同污染源的污染贡献(图 1a,图 1b)。在Zn污染溯源方面,Juillot等[10]发现法国北部某旧锌加工厂附近的表层污染土壤是混入了Zn同位素组成较重的锌铁矿矿渣。在巴西塞佩蒂巴湾,Araujo等[11]发现沿海沉积物的Zn同位素组成很好地符合陆地源内湾岩石、海洋源悬浮颗粒物、人为源电镀废物的三端元混合模型,并且在工业化期间人为源污染贡献高达近80%。采矿冶炼活动是Cd污染的重要来源,对中国典型铅锌矿区调查[12]显示,污染土壤的Cd同位素组成(δ114/110CdSpex < 0)明显较无污染土壤(δ114/110CdSpex > 0)更轻。Yang等[13]调查某酸性矿山废水污染流域水体和沉积物的Cd同位素组成发现,上游污染来自尾矿库矿物风化溶解,且分馏过程受吸附络合、(共)沉淀和三元络合作用调控。高温冶炼导致矿渣和粉尘分别富集Cd重同位素和轻同位素,Zhong等[14]通过二元混合模型定量某铅锌冶炼厂下游沉积物中Cd污染有88%~93%来自矿渣,7%~12%来自粉尘。根据Cd同位素组成可判断江汉平原农田受到了远距离冶炼厂粉尘和焚烧飞灰的污染[15]。使用Pb的不同稳定同位素比值(206Pb/204Pb、207Pb/204Pb、208Pb/204Pb)可识别环境中多个污染源:Zhu等[16]结合多元统计分析、地理统计分析和Pb稳定同位素比值综合判断首钢工业区土壤中的Pb有炼钢粉尘、煤炭燃烧和自然背景三种来源,且主要贡献是人为来源。因此,通过分析和量化不同污染源重金属同位素组成特征差异,能够可靠、有效地示踪重金属污染来源及该来源的污染贡献。
2.1.2 土壤重金属污染归趋示踪重金属稳定同位素可示踪工业源排放污染物的归趋(图 1 c)。火法冶金等矿石加工过程会使冶炼废料与矿石原料之间产生同位素分馏,因此可用于示踪尾矿库废料储存过程的金属迁移和冶炼生产排放。Sonke等[17]研究某冶炼厂周边沉积物Zn同位素组成的历史变化发现,精炼过程中气态冶炼废料富集重Zn同位素,从而影响周边环境的Zn同位素分布。有研究[18]表明,人为源Pb(凡口铅锌矿和汽车尾气排放)进入了珠江三角洲农田土壤,并以铁锰氧化物和有机/硫化物结合态稳定存在。
重金属稳定同位素可示踪农业源排放(如动物饲料和粪便排泄)污染物归趋(图 1 d)。Imseng等[19]发现相较于历时较短的人类农业活动,土壤形成的自然长期过程对土壤Zn分布的影响程度占主导地位,且土壤-植物循环和母质风化是最重要的过程,但随着近年来饲料添加剂和肥料用量增多,农业活动对土壤中Zn积累和稳定同位素分布的影响愈发显著。与Zn类似,自然长期的非人为输入对当前土壤Cd分布也起主导作用,但随着工农业活动加剧,大气沉降、施肥和作物收获等促进了Cd的输入与输出。Salmanzadeh等[20]通过对新西兰Winchmore试验农田1959—2015年的肥料与土壤样品建立Cd同位素质量平衡模型,发现2000—2015年间由于生物积累和淋溶作用加强,土壤Cd的去除大幅增加,推测土壤Cd的迁移可能主要与动植物吸收和土壤剖面侵蚀损失等途径有关。同示踪污染物来源一样,示踪重金属污染归趋也是通过分析重金属同位素的组成特征差异实现的。
2.2 土壤-植物体系的重金属元素迁移转化示踪土壤重金属污染对粮食安全和人体健康危害甚深,因此利用重金属稳定同位素示踪土壤-植物体系的重金属循环及迁移转化成为研究热点,可分为地下部的释放、吸收和地上部的迁移转运(图 1 e)。
2.2.1 重金属在地下部的释放与吸收示踪重金属在土壤-植物体系的地下部过程主要是指从土壤固相向土壤溶液的释放和植物根系的吸收与储存等。首先是重金属从土壤固相向土壤溶液的释放(图 2a)。Cd会随矿物磷肥施用进入农业生态系统,其中的地球化学过程引起土壤固液相间的同位素分馏。Wiggenhauser等[21]发现植物有效态Cd相较表层土壤富集Cd重同位素,推测可能是因为土壤固相中的Cd形成了化学键较长的有机质/氢氧化物结合的内层络合物,而土壤溶液水合离子态Cd由于化学键更短、键能更强,更易与Cd重同位素结合[22]。矿物吸附[23]、风化作用[24]、硫化物沉淀[25]也会导致Cd重同位素向土壤溶液的释放或富集。与Cd不同,Zn轻同位素更倾向从土壤固相释放。比如黑云母花岗岩经酸淋洗后会出现Zn轻同位素流失[26],但在缺Zn条件下,番茄根系分泌物反而会促进土壤固相释放Zn重同位素[27]。Cu既是植物生长必需微量元素,也是一种重金属污染物。Bigalke等[28]发现在水成土中表层有机土壤δ65Cu较下层矿质土壤更轻,推测可能是同位素组成较轻的凋落物降解,导致土壤溶液富集Cu轻同位素。

|
图 2 土壤-植物体系重金属迁移转化过程示踪 Fig. 2 Tracer of heavy metal transport and transformation process in soil-plant system |
其次是植物根系对重金属的吸收与储存(图 2b)。植物根系对重金属的吸收由生物过程(如离子通道、转运蛋白等)和非生物过程(如吸附、共沉淀等)共同作用,且不同植物根系对不同重金属作用机制存在差异。Cd主要通过低亲和转运系统进入根系,并导致根部富集轻同位素。如旱伞草(Cyperus alternifolius)(Δ114/110Cd根部-土壤 = −0.28‰)和蜈蚣草Pteris vittata(Δ114/110Cd根部-土壤 = −0.25‰)根部相较土壤富集Cd轻同位素[29]。作为解毒机制,水稻根表膜转运蛋白OsHMA3和液泡中Cd-S螯合物会储存Cd轻同位素,阻止其向上转运[25]。然而Zhou等[30]发现Cd超富集植物伴矿景天(Sedum plumbizincicola)有明显重Cd同位素提取与积累倾向,为Cd转运蛋白存在提供了证据。与Cd不同,Zn是植物生长必需元素[31],具有专门的转运载体蛋白。高亲和转运系统对Zn基本无选择性吸收,不会引起分馏或略富集重同位素,而低亲和转运系统则倾向吸收轻同位素。环境中Zn2+浓度决定着根系选择高或低亲和转运系统来吸收Zn,以及可能产生的同位素分馏[32]。在缺Zn条件下番茄[27]和水稻[33]还会生成根系分泌物和植物铁载体促进对Zn重同位素的吸收。Tang等[34]证明天蓝遏蓝菜(Noccaea caerulescens)根系质外体与营养液间产生了最大0.96‰的分馏,质外体途径吸收Zn会富集重同位素。此外,有研究[35]发现,湿地植物香蒲(Typha latifolia)通过生成根表铁膜来优先吸收Zn轻同位素。植物根部对Cu与Fe存在竞争性吸收,因此吸收过程产生的Cu同位素分馏与植物对Fe的吸收策略密切相关。策略Ⅰ植物(双子叶植物和非分枝单子叶植物)通过铁还原酶将Fe(Ⅲ)还原为Fe(Ⅱ)再被吸收,策略Ⅱ植物(禾本科单子叶植物)则是通过根系分泌铁载体络合Fe(Ⅲ)来促进吸收[36]。Ryan等[37]发现在缺铁条件下,策略Ⅰ植物番茄富集Cu轻同位素,策略Ⅱ植物燕麦未见明显同位素分馏,这是因为前者的还原吸收导致了富集轻同位素的Cu(Ⅰ)优先吸收,而后者铁载体络合对Cu同位素选择性不大。
2.2.2 重金属在地上部的迁移转运示踪重金属在土壤-植物体系地上部过程主要为从根部向上转运和再分配(图 2c)。Cd重同位素在小麦体内富集由高到低依次为:籽粒、秸秆、根部,可能是植物根茎中植物螯合肽、谷胱甘肽和金属硫蛋白等含S配体螯合Cd轻同位素并阻止其向籽粒迁移、避免籽粒Cd积累的解毒机制[21]。耐Cd植物蓖麻与Cd超富集植物龙葵的地上部相对根部富集重同位素,在高Cd胁迫下同位素分馏均会减弱,说明分馏大小可反映Cd对植物的毒害程度[38]。由于根部对Zn重同位素的结合,Zn轻同位素迁移能力更强,因此地上部的Zn同位素组成更轻。Aucour等[39]发现湿地植物虉草Phalaris arundinacea茎相较根富集Zn轻同位素,相比叶富集程度较小,表明植物通过低亲和转运系统优先吸收Zn轻同位素,进而通过叶片再分配转运至茎部共质体中。大量Zn轻同位素在小麦籽粒灌浆期间还会从秸秆转移至籽粒(δ66Zn籽粒–秸秆= –0.21‰~–0.31‰)[40]。不同吸收策略的植物对Cu的转运机制及其同位素分馏也有差异。据研究[37],策略Ⅰ植物番茄对Cu转运可能是由氧化还原驱动,植物将吸收的Cu(Ⅰ)氧化为Cu(Ⅱ)后由木质部装载运输,导致地上部富集重同位素;而策略Ⅱ植物燕麦对Cu转运则是由络合作用驱动,因此未产生明显同位素分馏。此外在铁缺乏和铁充足条件下,番茄从茎向叶转运Cu时富集轻同位素,并以Cu(Ⅰ)形式与谷胱甘肽/半胱氨酸结合,燕麦则无明显分馏[37]。由此可见,植物不同部位对不同重金属迁移转运能力不同,这是由植物不同部位对重金属的传输机制差异决定的。
2.3 金属纳米颗粒的环境过程示踪金属纳米颗粒(metal nanoparticles,MNPs)是指至少在一个维度上小于100 nm的金属颗粒。根据产生来源,MNPs可划分为人为制造的工程MNPs和自然产生的天然MNPs。
2.3.1 工程金属纳米颗粒环境过程示踪在生产、运输、使用、处置和回收等过程中工程MNPs会不可避免地释放至环境中,带来潜在的环境和健康风险。运用稳定同位素标记技术可在高浓度同元素背景下,保证工程MNPs的纳米特性和检测信号,对其输入、迁移和吸收等环境过程进行识别和追踪。
原则上金属元素必须有两种及以上稳定同位素才能够运用该技术,通过同位素富集前体合成相应的标记MNPs,尤其是利用自然丰度低的稳定同位素制备MNPs具有最佳的灵敏度,即便是微量掺入也能引起环境样品可检测的同位素变化。采用湿化学法合成制备工程MNPs可保证产品尺寸可控均匀,如以同位素富集可溶性金属盐直接作为前体[41],或者将金属单质/金属氧化物加酸消化为可溶盐前体[42]。根据同位素比值变化即可判断同位素标记的工程MNPs是否进入环境,从而识别其输入风险。Lamer和Rehkamper[43]通过比较评估利用Zn同位素组成自身差异和Zn稳定同位素标记两种示踪氧化锌纳米颗粒(ZnO NPs)的方法,发现前者中市售ZnO NPs的Zn同位素组成与自然样品无明显差别,而后者可在高浓度Zn天然样品中有效检测到低水平的ZnO NPs,更具备示踪环境输入的应用潜力。
重金属稳定同位素标记法可示踪工程MNPs进入土壤和沉积物等环境介质后的沉积和形态转化(图 1 f)。MNPs在一定的离子强度下易于团聚沉降,Buffet等[44]通过67Zn标记发现ZnO NPs在水体中会快速沉积,但进入沉积物后迁移能力有限。Larner等[45]通过标记法发现68Zn2+极易吸附于沉积物从而进入固相。由于生物利用Zn主要以Zn2+为主,而ZnO NPs溶解度较高,两者间存在着密切的相互转化关系。Laycock等[46]通过制备、添加68ZnO NPs和可溶性64ZnCl2至土壤以示踪蚯蚓对Zn的吸收和两者间的转化,发现由于ZnO NPs的快速溶解,蚯蚓、土壤和孔隙水的68Zn/64Zn比值无明显差异,因此土壤风险评估应考虑到ZnO NPs与Zn2+的风险一致性[46]。
重金属稳定同位素标记法还可示踪工程MNPs的生物吸收以评估其生理毒性。体外实验表明,在共培养24 h后,68ZnO NPs可穿透进入人角质形成细胞(HaCAT)[47]。在泥虾对Zn2+及沉积物颗粒的摄取中,沉积物对Zn的高吸附能力会促进易溶性ZnO NPs中Zn的转移[45]。淡水螺体内80%~90%的Cu来自65CuO NPs,表明溶解度对65Cu吸收的影响可忽略不计,食物暴露相对环境暴露可能更容易导致生物积累和生理毒性[48]。
2.3.2 天然金属纳米颗粒环境过程示踪土壤中天然MNPs来源于环境反应、自然形成,是长期以来各种物理、化学、生物过程相互作用形成的结果。作为重金属的一种天然载体,天然MNPs对其迁移性、生物有效性、毒性等有着重要影响,因此在天然MNPs形成、转化和吸收方面也开展了重金属稳定同位素示踪研究。
由于土壤介质的客观复杂性,以及稳定同位素示踪天然MNPs环境过程的研究正处于起步阶段,当前文献以成分均一的水体介质体系为主,后续土壤体系的相关研究可作为参考。重金属稳定同位素可验证天然MNPs的形成和生长机制。Guilbaud等[49]发现在四方硫铁矿(FeSm)纳米颗粒形成生长过程中,其与Fe(Ⅱ)aq的同位素交换速率逐渐降低,且交换程度最多达到75%,从而证明了四方硫铁矿纳米颗粒(FeSm NPs)具有核-壳结构,且是通过聚集-生长机制生长而非奥斯特瓦尔德(Ostwald)熟化。
重金属稳定同位素可示踪天然MNPs的转化和吸收(图 1 g,图 1h)。通过双稳定同位素和形态分析,Yu等[50]首次在同一体系研究了107AgNPs和109Ag+的相互转化及各组分氧化溶解和还原总速率的测定。Lu等[51]发现阳光照射下,富含溶解有机质的自然水体AgNPs的氧化溶解和Ag+还原成核同时发生,Ag同位素比值发生了0.86‰的显著变化,且可溶性腐殖酸对天然AgNPs形成及持久性存在影响[52]。Yang等[53]通过双稳定同位素示踪(107AgNO3和109AgNPs),发现水稻根部吸收Ag主要是通过对AgNPs的直接摄取和Ag+的还原再吸收,且茎部转运会发生AgNPs的再氧化。
2.3.3 工程源与天然源金属纳米颗粒的辨别工程和天然MNPs在环境介质中基本混合,且性质类似,因此区分工程源与天然源对于排放责任追踪、源头输入控制、环境归趋研究和土壤风险及修复效果评估等方面具有重要意义。
根据工程和天然MNPs同位素分馏差异,重金属稳定同位素可用于辨别MNPs的来源。由于工程和天然AgNPs表面涂层的氧化还原活性不同,两者溶解释放引起的同位素分馏效应具有明显区别[51]:利用聚乙烯吡咯烷酮或柠檬酸盐包覆的工程AgNPs会优先溶解释放109Ag+,这是因为AgNPs表面光氧化诱导形成的金属氧化物中间产物(例如Ag2O)富集重同位素;而利用腐殖酸(HA)包覆的天然AgNPs倾向溶解释放107Ag+,这是因为HA在自然条件下优先将109Ag+还原为109Ag0,使最终释放的Ag+富集107Ag。因此,通过工程源和天然源AgNPs溶解时的分馏特征差异,可对环境样品不同来源的AgNPs进行区分。此外Yang等[54]利用工程二氧化硅纳米颗粒(SiO2 NPs)制造过程中Si与O的同位素分馏、不同原料的独特同位素组成以及硅氧双元素同位素信息等特征,建立了Si-O双同位素指纹图谱模型,并以高达93.3%的识别精度实现了对SiO2 NPs工程来源和天然来源的有效区分。尽管SiO2 NPs并非金属纳米颗粒,但为后续金属纳米颗粒来源辨别技术开发提供了参考。
3 重金属稳定同位素分馏过程及其机制重金属在土壤中的不同环境行为及作用机制对重金属同位素分馏均会产生影响,目前报道的主要包括:氧化还原、沉淀溶解、吸附解吸、有机络合和生物作用。
3.1 氧化还原变价金属元素(如Cu、Fe等)的氧化还原会引起同位素分馏。一般情况下,氧化作用易发生正分馏,还原作用易发生负分馏。Cu重同位素倾向富集于高价态的铜矿物中,且氧化还原环境会显著影响Cu同位素分馏。在氧化风化的矿质土壤剖面中,有机层下的矿质表层土壤δ65Cu明显高于底层[55],而还原环境下水成土的同位素分布特征则与之相反[28]。室温还原过程中同样也发现Cu2+富集重同位素,Cu+富集轻同位素[56]。Fe2+氧化形成Fe3+的过程也会产生显著的铁同位素分馏,且氧化态富集重同位素[57]。异化铁还原(DIR)一般表现为缺氧环境下铁素体、针铁矿和赤铁矿等铁的(氢)氧化物的还原溶解,常伴随着Fe同位素分馏。研究表明,DIR早期阶段Fe(Ⅱ)aq的δ56Fe值要较Fe(Ⅲ)底物低0.5‰~2.0‰,因此,可将水相中DIR来源与其他来源的Fe(Ⅱ)进行区分[58]。
3.2 沉淀溶解金属硫化物沉淀会发生同位素分馏,一般沉淀矿物同位素组成相对残余流体会更轻。在室温缺氧下CuSO4和Na2S沉淀生成CuS,残余溶液相对CuS沉淀更易富集65Cu[59]。同样条件下Zn的硫化物沉淀也出现类似分馏特征,即沉淀相对溶液更易富集轻同位素[60]。在对洋底热液地质实测中,矿物Zn同位素组成均较流体轻,进一步佐证金属硫化物沉淀的同位素分馏效应[61]。然而研究发现,金属单向沉淀的动力学分馏与固液相的平衡分馏可能存在不同分馏方向,动力学分馏固相沉淀富集轻同位素,平衡分馏则富集重同位素。例如,在四方硫铁矿沉淀过程中[49],初期沉淀受动力学作用控制,矿物δ56Fe较溶液中Fe2+轻,随后有学者[62]利用三同位素法测定沉淀平衡分馏系数,却发现矿物固相(FeS)相对溶液更易富集Fe重同位素。除硫化物沉淀外,碳酸盐岩沉淀[63]、硫酸盐矿物沉淀[64]、金属氧化物/氢氧化物沉淀[65]、氯化物沉淀[66]、硅酸盐沉淀[67]等过程也会导致重金属稳定同位素分馏。
3.3 吸附解吸重金属在环境介质中的归趋受吸附解吸过程的强烈控制[68],多数情况下,吸附引起的分馏程度小于氧化还原,且大部分分馏系数均小于1‰[7]。吸附引起的金属同位素分馏主要受结合环境差异以及溶液种类控制。根据吸附相种类不同,可分为金属(氢)氧化物、黏土矿物、有机物和生物表面等,且吸附能力差异会引起不同程度的分馏。金属氧化物表面对Cu(Ⅱ)的吸附会形成键能较强的双齿配位键与四面体内环结构,从而富集重同位素[69]。Zn2+与γ-Al2O3吸附过程同位素分馏取决于Zn浓度和pH,低浓度和低pH形成的是平均Zn-O键长更短(1.98 Å)的四面体配位内层表面络合物,相对富集Zn重同位素[70]。但高岭土会吸附富集Cu轻同位素,这是因为同位素组成较轻的Cu(H2O)62+络合物会被优先吸附[71]。在pH较高时纯化腐殖酸与Zn的复合体络合常数更高,键长更短,因此倾向吸附Zn重同位素[72]。硅藻表面羟基、硫基和硅醇基会与溶液中的Zn2+(H2O)6形成四次配位,使Zn-O键长更短、键能更强,因此会优先吸附Zn重同位素[73]。通过土壤矿物、土壤有机质等对重金属吸附前后同位素分馏的变化,可进一步阐明重金属在土壤的赋存机制及微界面环境化学行为。
3.4 有机络合有机络合态是Cu在土壤、沉积物、湖泊和河流等自然系统中的主要赋存形态。研究发现腐殖酸络合产物富集Cu重同位素,且pH对络合过程的分馏无影响[74]。金属与有机官能团络合反应导致的同位素分馏是由键合热力学差异引起的,包括振动频率和零点能的差异。Fujii等[75]通过密度泛函理论和热化学手段解释了ZnCl2/冠醚体系的分馏是由同位素之间吉布斯自由能差异所决定。生物体内也存在络合反应。如植物体内木质部汁液中99.6%以上的Cu是以络合态存在[76],并富集65Cu。受热致死的大肠杆菌在pH为4.1~5.1时细胞表面有机酸官能团也表现出络合富集 65Cu[77]。Fujii和Albarède[78]通过第一性原理计算得到磷酸优先络合Zn重同位素,苹果酸倾向络合Zn轻同位素,而柠檬酸络合Zn产生的同位素分馏随pH由正向负变化。植物铁载体2'-脱氧麦根酸(DMA)及其结构类似物与Zn的络合会富集Zn重同位素,且分馏程度与络合稳定常数正相关[79]。此外,植物体内的螯合肽、谷胱甘肽和金属硫蛋白等含硫配体一般倾向络合Cd轻同位素以减弱Cd的毒害[21]。因此,土壤有机质与重金属络合作用主要取决于不同有机质中特定官能团与重金属的键合热力学差异。
3.5 生物作用许多重金属还会参与生物体的各类生命活动并引起同位素分馏,但本质上还是与上述的氧化还原、吸附解吸、络合反应等过程密切相关。综合现有研究,高等植物、浮游藻类和微生物细菌等生物对重金属的吸收转运均有同位素分馏现象。高等植物吸收转运重金属时,大部分是植物体富集轻同位素。水稻(Oryza sativa)、番茄(Lactuca sativa)和生菜(Lycopersicon esculentum)对Zn的吸收与分馏实验表明,植物根部相对溶液更易富集重同位素,而在成熟茎叶中Zn同位素组成较轻,说明植物地上部分优先富集轻同位素[80]。浮游藻类大洋海链藻(Thalassiosira oceanica)对Zn的高、低亲和吸收机制引起的分馏程度不同,但均为富集轻同位素[32]。革兰氏阳性菌和革兰氏阴性菌优先吸收Cu轻同位素,这可能与细胞对Cu的运输、调节以及体内氧化还原作用有关[77]。天青蛋白对铜的摄取存在类似特征,63Cu会被细胞蛋白优先摄取进入体内[56]。
|
|
表 1 不同环境过程对重金属同位素分馏的作用 Table 1 Heavy metal isotope fractionation under different environmental processes |
自MC-ICP-MS推广应用以来,重金属稳定同位素取得了诸多研究成果,但未来在土壤环境科学领域尚有更多的应用潜力值得被发现和挖掘。本文针对当前研究现状,提出了以下展望:
(1)完善不同成土地质背景、不同土壤类型储库的同位素组成数据。当前重金属稳定同位素在自然界不同储库的同位素组成已有一定积累,主要关注储库包括陨石、陆壳、洋壳、地幔、海水、河水、洋底沉积物等。若将研究视野集中于土壤领域,针对土壤环境介质,如成土母岩、地理气候、土壤类型等差异划分出更细致的储库分类,将有助于推进重金属稳定同位素在土壤学领域的研究与应用。
(2)开发多元素重金属稳定同位素示踪手段。当前面临的土壤重金属污染主要是复杂的多金属复合污染,若是对不同元素单独开展稳定同位素示踪,势必会造成工作量的骤增和研究资源的浪费。因此,尽快实现多元素重金属稳定同位素示踪,对土壤污染修复具有极大裨益。
(3)拓宽多维度重金属稳定同位素研究范围。自然界金属元素循环基本会涉及所有圈层和环境介质,土壤并非封闭独立的体系,需将关注对象扩大至土壤介质与其他环境介质之间、土壤介质与动植物和微生物之间的多重界面,以多维度多界面交互体系开展重金属稳定同位素研究可摆脱土壤单一体系的局限性,有助于更加全面了解重金属的生物地球化学循环。
(4)利用重金属稳定同位素示踪天然金属纳米颗粒(MNPs)环境行为值得关注。前文介绍了MNPs的环境风险与稳定同位素应用,但目前相关研究多为工程MNPs,关于天然MNPs形成过程与迁移转化的同位素分馏研究尚较少。天然MNPs可自然形成并成为重金属的载体,影响其潜在扩散风险,因此,探究天然MNPs环境过程的稳定同位素分馏将有助于理解其环境行为,进而评估潜在环境风险。
(5)结合其他先进表征技术深入探究分馏机理。如果不能正确理解环境过程是如何影响重金属稳定同位素分馏,就无法对同位素数据进行有效的解读和分析。目前相关研究多停留于同位素分馏的简单表征,利用同步辐射、场流仪联用表征技术等手段可实现从微观层面阐明相关机制。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17)[2020-04-19]. http://www.gov.cn/foot/2014-04/17/content_2661768.htm. Ministry of Environmental Protection of the People's Republic of China, Ministry of Land and Resources of the People's Republic of China. Bulletin of the ational survey on soil pollution status [EB/OL]. (2014-04-17)[2020-04-19]. http://www.gov.cn/foot/2014-04/17/content_2661768.htm. (  0) 0) |
| [2] |
Luo Y M, Teng Y. Research progresses and prospects on soil pollution and remediation in China (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1137-1142. [骆永明, 滕应. 中国土壤污染与修复科技研究进展和展望[J]. 土壤学报, 2020, 57(5): 1137-1142.]
(  0) 0) |
| [3] |
Urey H C. The thermodynamic properties of isotopic substances[J]. Journal of the Chemical Society, 1947, 562-581. DOI:10.1039/jr9470000562
(  0) 0) |
| [4] |
Huang F, Tian S Y. Recent advances of metal stable isotope geochernistry studies (In Chinese)[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2018, 37(5): 793-811. [黄方, 田笙谕. 若干金属稳定同位素体系的研究进展: 以中国科大实验室为例[J]. 矿物岩石地球化学通报, 2018, 37(5): 793-811.]
(  0) 0) |
| [5] |
Johnson C M, Beard B L, Albarede F. Overview and general concepts[J]. Geochemistry of Non-Traditional Stable Isotopes, 2004, 55: 1-24.
(  0) 0) |
| [6] |
Wang L W, Jin Y L, Weiss D J, et al. Possible application of stable isotope compositions for the identification of metal sources in soil[J]. Journal of Hazardous Materials, 2021, 407: 124812. DOI:10.1016/j.jhazmat.2020.124812
(  0) 0) |
| [7] |
Wiederhold J G. Metal stable isotope signatures as tracers in environmental geochemistry[J]. Environmental Science & Technology, 2015, 49(5): 2606-2624.
(  0) 0) |
| [8] |
Yin Y G, Tan Z Q, Hu L G, et al. Isotope tracers to study the environmental fate and bioaccumulation of metal-containing engineered nanoparticles: Techniques and applications[J]. Chemical Reviews, 2017, 117(5): 4462-4487. DOI:10.1021/acs.chemrev.6b00693
(  0) 0) |
| [9] |
Xu J M, Liu X M. Frontier trends and development strategies of soil quality and food safety in the 14th Five-Year Plan (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1143-1154. [徐建明, 刘杏梅. "十四五"土壤质量与食物安全前沿趋势与发展战略[J]. 土壤学报, 2020, 57(5): 1143-1154.]
(  0) 0) |
| [10] |
Juillot F, Maréchal C, Morin G, et al. Contrasting isotopic signatures between anthropogenic and geogenic Zn and evidence for post-depositional fractionation processes in smelter-impacted soils from Northern France[J]. Geochimica et Cosmochimica Acta, 2012, 75(9): 2295-2308.
(  0) 0) |
| [11] |
Araujo D F, Boaventura G R, Machado W, et al. Tracing of anthropogenic zinc sources in coastal environments using stable isotope composition[J]. Chemical Geology, 2017, 449: 226-235. DOI:10.1016/j.chemgeo.2016.12.004
(  0) 0) |
| [12] |
Wen H J, Zhang Y X, Cloquet C, et al. Tracing sources of pollution in soils from the jinding Pb-Zn mining district in China using cadmium and lead isotopes[J]. Applied Geochemistry, 2015, 52: 147-154. DOI:10.1016/j.apgeochem.2014.11.025
(  0) 0) |
| [13] |
Yang W J, Ding K B, Zhang P, et al. Cadmium stable isotope variation in a mountain area impacted by acid mine drainage[J]. The Science of the Total Environment, 2019, 646: 696-703. DOI:10.1016/j.scitotenv.2018.07.210
(  0) 0) |
| [14] |
Zhong Q H, Yin M L, Zhang Q, et al. Cadmium isotopic fractionation in lead-zinc smelting process and signatures in fluvial sediments[J]. Journal of Hazardous Materials, 2021, 411: 125015. DOI:10.1016/j.jhazmat.2020.125015
(  0) 0) |
| [15] |
Wang P C, Li Z G, Liu J L, et al. Apportionment of sources of heavy metals to agricultural soils using isotope fingerprints and multivariate statistical analyses[J]. Environmental Pollution, 2019, 249: 208-216. DOI:10.1016/j.envpol.2019.03.034
(  0) 0) |
| [16] |
Zhu G X, Guo Q J, Xiao H Y, et al. Multivariate statistical and lead isotopic analyses approach to identify heavy metal sources in topsoil from the industrial zone of Beijing Capital Iron and Steel Factory[J]. Environmental Science and Pollution Research, 2017, 24(17): 14877-14888. DOI:10.1007/s11356-017-9055-9
(  0) 0) |
| [17] |
Sonke J E, Sivry Y, Viers J, et al. Historical variations in the isotopic composition of atmospheric zinc deposition from a zinc smelter[J]. Chemical Geology, 2008, 252(3/4): 145-157.
(  0) 0) |
| [18] |
Zhu B Q, Chen Y W, Peng J H. Lead isotope geochemistry of the urban environment in the pearl river delta[J]. Applied Geochemistry, 2001, 16(4): 409-417. DOI:10.1016/S0883-2927(00)00047-0
(  0) 0) |
| [19] |
Imseng M, Wiggenhauser M, Müller M, et al. The fate of Zn in agricultural soils: A stable isotope approach to anthropogenic impact, soil formation, and soil-plant cycling[J]. Environmental Science & Technology, 2019, 53(8): 4140-4149.
(  0) 0) |
| [20] |
Salmanzadeh M, Hartland A, Stirling C H, et al. Isotope tracing of long-term cadmium fluxes in an agricultural soil[J]. Environmental Science & Technology, 2017, 51(13): 7369-7377.
(  0) 0) |
| [21] |
Wiggenhauser M, Bigalke M, Imseng M, et al. Cadmium isotope fractionation in soil-wheat systems[J]. Environmental Science & Technology, 2016, 50(17): 9223-9231.
(  0) 0) |
| [22] |
Imseng M, Wiggenhauser M, Keller A, et al. Towards an understanding of the Cd isotope fractionation during transfer from the soil to the cereal grain[J]. Environmental Pollution, 2019, 244: 834-844. DOI:10.1016/j.envpol.2018.09.149
(  0) 0) |
| [23] |
Wasylenki L E, Swihart J W, Romaniello S J. Cadmium isotope fractionation during adsorption to Mn oxyhydroxide at low and high ionic strength[J]. Geochimica et Cosmochimica Acta, 2014, 140: 212-226. DOI:10.1016/j.gca.2014.05.007
(  0) 0) |
| [24] |
Zhang Y X, Wen H J, Zhu C W, et al. Cd isotope fractionation during simulated and natural weathering[J]. Environmental Pollution, 2016, 216: 9-17. DOI:10.1016/j.envpol.2016.04.060
(  0) 0) |
| [25] |
Wiggenhauser M, Aucour A M, Bureau S, et al. Cadmium transfer in contaminated soil-rice systems: Insights from solid-state speciation analysis and stable isotope fractionation[J]. Environmental Pollution, 2021, 269: 115934. DOI:10.1016/j.envpol.2020.115934
(  0) 0) |
| [26] |
Weiss D J, Boye K, Caldelas C, et al. Zinc isotope fractionation during early dissolution of biotite granite[J]. Soil Science Society of America Journal, 2014, 78(1): 171-179. DOI:10.2136/sssaj2012.0426
(  0) 0) |
| [27] |
Smolders E, Versieren L, Dong S F, et al. Isotopic fractionation of Zn in tomato plants suggests the role of root exudates on Zn uptake[J]. Plant and Soil, 2013, 370(1/2): 605-613.
(  0) 0) |
| [28] |
Bigalke M, Weyer S, Wilcke W. Stable copper isotopes: A novel tool to trace copper behavior in hydromorphic soils[J]. Soil Science Society of America Journal, 2010, 74(1): 60-73. DOI:10.2136/sssaj2008.0377
(  0) 0) |
| [29] |
Wei R F, Guo Q J, Wen H J, et al. An analytical method for precise determination of the cadmium isotopic composition in plant samples using multiple collector inductively coupled plasma mass spectrometry[J]. Analytical Methods, 2015, 7(6): 2479-2487. DOI:10.1039/C4AY02435D
(  0) 0) |
| [30] |
Zhou J W, Li Z, Liu M S, et al. Cadmium isotopic fractionation in the soil-plant system during repeated phytoextraction with a cadmium hyperaccumulating plant species[J]. Environmental Science & Technology, 2020, 54(21): 13598-13609.
(  0) 0) |
| [31] |
Liu Q, Wang Z M, Pan F, et al. Effect evaluation on method of zinc biofortification for rice in paddy field (In Chinese)[J]. Soils, 2019, 51(1): 32-38. [刘琦, 王张民, 潘斐, 等. 大田条件下水稻锌营养强化方法探究及效果评估[J]. 土壤, 2019, 51(1): 32-38.]
(  0) 0) |
| [32] |
John S G, Geis R W, Saito M A, et al. Zinc isotope fractionation during high-affinity and low-affinity zinc transport by the marine diatom thalassiosira oceanica[J]. Limnology and Oceanography, 2007, 52(6): 2710-2714. DOI:10.4319/lo.2007.52.6.2710
(  0) 0) |
| [33] |
Arnold T, Kirk G J D, Wissuwa M, et al. Evidence for the mechanisms of zinc uptake by rice using isotope fractionation[J]. Plant, Cell & Environment, 2010, 33(3): 370-381.
(  0) 0) |
| [34] |
Tang Y T, Cloquet C, Deng T H B, et al. Zinc isotope fractionation in the hyperaccumulator Noccaea caerulescens and the nonaccumulating plant Thlaspi arvense at low and high Zn supply[J]. Environmental Science & Technology, 2016, 50(15): 8020-8027.
(  0) 0) |
| [35] |
Aucour A M, Bedell J P, Queyron M, et al. Zn speciation and stable isotope fractionation in a contaminated urban wetland soil-Typha latifolia system[J]. Environmental Science & Technology, 2017, 51(15): 8350-8358.
(  0) 0) |
| [36] |
Marschner H, Römheld V. Strategies of plants for acquisition of iron[J]. Plant and Soil, 1994, 165(2): 261-274. DOI:10.1007/BF00008069
(  0) 0) |
| [37] |
Ryan B M, Kirby J K, Degryse F, et al. Copper speciation and isotopic fractionation in plants: Uptake and translocation mechanisms[J]. New Phytologist, 2013, 199(2): 367-378. DOI:10.1111/nph.12276
(  0) 0) |
| [38] |
Wei R, Guo Q, Tian L, et al. Characteristics of cadmium accumulation and isotope fractionation in higher plants[J]. Ecotoxicology and Environmental Safety, 2019, 174: 1-11. DOI:10.1016/j.ecoenv.2019.02.003
(  0) 0) |
| [39] |
Aucour A M, Bedell J P, Queyron M, et al. Dynamics of Zn in an urban wetland soil-plant system: Coupling isotopic and EXAFS approaches[J]. Geochimica et Cosmochimica Acta, 2015, 160: 55-69. DOI:10.1016/j.gca.2015.03.040
(  0) 0) |
| [40] |
Wiggenhauser M, Bigalke M, Imseng M, et al. Zinc isotope fractionation during grain filling of wheat and a comparison of zinc and cadmium isotope ratios in identical soil-plant systems[J]. New Phytologist, 2018, 219(1): 195-205. DOI:10.1111/nph.15146
(  0) 0) |
| [41] |
Laycock A, Stolpe B, Roemer I, et al. Synthesis and characterization of isotopically labeled silver nanoparticles for tracing studies[J]. Environmental Science-Nano, 2014, 1(3): 271-283. DOI:10.1039/C3EN00100H
(  0) 0) |
| [42] |
Zhang P, Misra S, Guo Z L, et al. Stable isotope labeling of metal/metal oxide nanomaterials for environmental and biological tracing[J]. Nature Protocols, 2019, 14(10): 2878-2899. DOI:10.1038/s41596-019-0205-z
(  0) 0) |
| [43] |
Lamer F, Rehkämper M. Evaluation of stable isotope tracing for ZnO nanomaterials—New constraints from high precision isotope analyses and modeling[J]. Environmental Science & Technology, 2012, 46(7): 4149-4158.
(  0) 0) |
| [44] |
Buffet P E, Amiard-Triquet C, Dybowska A, et al. Fate of isotopically labeled zinc oxide nanoparticles in sediment and effects on two endobenthic species, the clam scrobicularia plana and the ragworm hediste diversicolor[J]. Ecotoxicology and Environmental Safety, 2012, 84: 191-198. DOI:10.1016/j.ecoenv.2012.07.010
(  0) 0) |
| [45] |
Larner F, Dogra Y, Dybowska A, et al. Tracing bioavailability of ZnO nanoparticles using stable isotope labeling[J]. Environmental Science & Technology, 2012, 46(21): 12137-12145.
(  0) 0) |
| [46] |
Laycock A, Romero-Freire A, Najorka J, et al. Novel multi-isotope tracer approach to test ZnO nanoparticle and soluble Zn bioavailability in joint soil exposures[J]. Environmental Science & Technology, 2017, 51(21): 12756-12763.
(  0) 0) |
| [47] |
Lee P L, Chen B C, Gollavelli G, et al. Development and validation of TOF-SIMS and CLSM imaging method for cytotoxicity study of ZnO nanoparticles in HaCaT cells[J]. Journal of Hazardous Materials, 2014, 277: 3-12. DOI:10.1016/j.jhazmat.2014.03.046
(  0) 0) |
| [48] |
Croteau M N, Misra S K, Luoma S N, et al. Bioaccumulation and toxicity of CuO nanoparticles by a freshwater invertebrate after waterborne and dietborne exposures[J]. Environmental Science & Technology, 2014, 48(18): 10929-10937.
(  0) 0) |
| [49] |
Guilbaud R, Butler I B, Ellam R M, et al. Fe isotope exchange between Fe(Ⅱ)(aq)and nanoparticulate mackinawite(FeSm)during nanoparticle growth[J]. Earth and Planetary Science Letters, 2010, 300(1/2): 174-183.
(  0) 0) |
| [50] |
Yu S J, Yin Y G, Zhou X X, et al. Transformation kinetics of silver nanoparticles and silver ions in aquatic environments revealed by double stable isotope labeling[J]. Environmental Science-Nano, 2016, 3(4): 883-893. DOI:10.1039/C6EN00104A
(  0) 0) |
| [51] |
Lu D W, Liu Q, Zhang T Y, et al. Stable silver isotope fractionation in the natural transformation process of silver nanoparticles[J]. Nature Nanotechnology, 2016, 11(8): 682-686. DOI:10.1038/nnano.2016.93
(  0) 0) |
| [52] |
Zhang T Y, Lu D W, Zeng L X, et al. Role of secondary particle formation in the persistence of silver nanoparticles in humic acid containing water under light irradiation[J]. Environmental Science & Technology, 2017, 51(24): 14164-14172.
(  0) 0) |
| [53] |
Yang Q Q, Shan W Y, Hu L G, et al. Uptake and transformation of silver nanoparticles and ions by rice plants revealed by dual stable isotope tracing[J]. Environmental Science & Technology, 2019, 53(2): 625-633.
(  0) 0) |
| [54] |
Yang X Z, Liu X, Zhang A Q, et al. Distinguishing the sources of silica nanoparticles by dual isotopic fingerprinting and machine learning[J]. Nature Communications, 2019, 10(1): 1620. DOI:10.1038/s41467-019-09629-5
(  0) 0) |
| [55] |
Bigalke M, Weyer S, Wilcke W. Stable Cu isotope fractionation in soils during oxic weathering and podzolization[J]. Geochimica et Cosmochimica Acta, 2011, 75(11): 3119-3134. DOI:10.1016/j.gca.2011.03.005
(  0) 0) |
| [56] |
Zhu X K, Guo Y, Williams R J P, et al. Mass fractionation processes of transition metal isotopes[J]. Earth and Planetary Science Letters, 2002, 200(1/2): 47-62.
(  0) 0) |
| [57] |
Welch S A, Beard B L, Johnson C M, et al. Kinetic and equilibrium Fe isotope fractionation between aqueous Fe(Ⅱ)and Fe(Ⅲ)[J]. Geochimica et Cosmochimica Acta, 2003, 67(22): 4231-4250. DOI:10.1016/S0016-7037(03)00266-7
(  0) 0) |
| [58] |
Crosby H A, Johnson C M, Roden E E, et al. Coupled Fe(Ⅱ)and Fe(Ⅲ)electron and atom exchange as a mechanism for Fe isotope fractionation during dissimilatory iron oxide reduction[J]. Environmental Science & Technology, 2005, 39(17): 6698-6704.
(  0) 0) |
| [59] |
Ehrlich S, Butler I, Halicz L, et al. Experimental study of the copper isotope fractionation between aqueous Cu(Ⅱ)and covellite, CuS[J]. Chemical Geology, 2004, 209(3/4): 259-269.
(  0) 0) |
| [60] |
Archer C, Vance D. Mass discrimination correction in multiple-collector plasma source mass spectrometry: An example using Cu and Zn isotopes[J]. Journal of Analytical Atomic Spectrometry, 2004, 19(5): 656-665. DOI:10.1039/b315853e
(  0) 0) |
| [61] |
John S G, Rouxel O J, Craddock P R, et al. Zinc stable isotopes in seafloor hydrothermal vent fluids and chinmeys[J]. Earth and Planetary Science Letters, 2008, 269(1/2): 17-28.
(  0) 0) |
| [62] |
Wu L L, Druschel G, Findlay A, et al. Experimental determination of iron isotope fractionations among Feaq2+-FeSaq-mackinawite at low temperatures: Implications for the rock record[J]. Geochimica et Cosmochimica Acta, 2012, 89: 46-61. DOI:10.1016/j.gca.2012.04.047
(  0) 0) |
| [63] |
Marechal C N, Sheppard S M F. Isotopic fractionation of Cu and Zn between chloride and nitrate solutions and malachite or smithsonite at 30 degrees and 50 degrees C[J]. Geochimica et Cosmochimica Acta, 2002, 66(15a): A484-A484.
(  0) 0) |
| [64] |
Von Allmen K, Böttcher M E, Samankassou E, et al. Barium isotope fractionation in the global barium cycle: First evidence from barium minerals and precipitation experiments[J]. Chemical Geology, 2010, 277(1/2): 70-77.
(  0) 0) |
| [65] |
Bullen T D, White A F, Childs C W, et al. Demonstration of significant abiotic iron isotope fractionation in nature[J]. Geology, 2001, 29(8): 699-702. DOI:10.1130/0091-7613(2001)029<0699:DOSAII>2.0.CO;2
(  0) 0) |
| [66] |
Luo Y, Celo V, Dabek-Zlotorzynska E, et al. Effects of precipitation and UV photolysis on Ag isotope ratio: Experimental studies[J]. Journal of Analytical Atomic Spectrometry, 2012, 27(2): 299-304. DOI:10.1039/C1JA10291E
(  0) 0) |
| [67] |
Wimpenny J, Colla C A, Yin Q Z, et al. Investigating the behaviour of Mg isotopes during the formation of clay minerals[J]. Geochimica et Cosmochimica Acta, 2014, 128: 178-194. DOI:10.1016/j.gca.2013.12.012
(  0) 0) |
| [68] |
Tao X, Yang H, Ji R, et al. Stabilizers and their applications in remediation of heavy metal-contaminated soil (In Chinese)[J]. Soils, 2016, 48(1): 1-11. [陶雪, 杨琥, 季荣, 等. 固定剂及其在重金属污染土壤修复中的应用[J]. 土壤, 2016, 48(1): 1-11.]
(  0) 0) |
| [69] |
Pokrovsky O S, Viers J, Emnova E E, et al. Copper isotope fractionation during its interaction with soil and aquatic microorganisms and metal oxy(hydr)oxides: Possible structural control[J]. Geochimica et Cosmochimica Acta, 2008, 72(7): 1742-1757. DOI:10.1016/j.gca.2008.01.018
(  0) 0) |
| [70] |
Gou W X, Li W, Ji J F, et al. Zinc isotope fractionation during sorption onto Al oxides: Atomic level understanding from EXAFS[J]. Environmental Science & Technology, 2018, 52(16): 9087-9096.
(  0) 0) |
| [71] |
Li D D, Liu S A, Li S G. Copper isotope fractionation during adsorption onto kaolinite: Experimental approach and applications[J]. Chemical Geology, 2015, 396: 74-82. DOI:10.1016/j.chemgeo.2014.12.020
(  0) 0) |
| [72] |
Jouvin D, Louvat P, Juillot F, et al. Zinc isotopic fractionation: Why organic matters[J]. Environmental Science & Technology, 2009, 43(15): 5747-5754.
(  0) 0) |
| [73] |
Gelabert A, Pokrovsky O S, Viers J, et al. Interaction between zinc and freshwater and marine diatom species: Surface complexation and Zn isotope fractionation[J]. Geochimica et Cosmochimica Acta, 2006, 70(4): 839-857. DOI:10.1016/j.gca.2005.10.026
(  0) 0) |
| [74] |
Bigalke M, Weyer S, Wilcke W. Copper isotope fractionation during complexation with insolubilized humic acid[J]. Environmental Science & Technology, 2010, 44(14): 5496-5502.
(  0) 0) |
| [75] |
Fujii T, Kato C, Mahan B, et al. Study on the isotope fractionation of zinc in complexation with macrocyclic polyethers[J]. Zeitschrift Fur Anorganische Und Allgemeine Chemie, 2021, 647: 1-8. DOI:10.1002/zaac.202170011
(  0) 0) |
| [76] |
Liao M T, Hedley M J, Woolley D J, et al. Copper uptake and translocation in chicory(Cichorium intybus l. Cv. Grasslands puna)and tomato(Lycopersicon esculentum mill. Cv. Rondy)plants grown in nft system. I. Copper uptake and distribution in plants[J]. Plant and Soil, 2000, 221(2): 135-142. DOI:10.1023/A:1004731415931
(  0) 0) |
| [77] |
Navarrete J U, Borrok D M, Viveros M, et al. Copper isotope fractionation during surface adsorption and intracellular incorporation by bacteria[J]. Geochimica et Cosmochimica Acta, 2011, 75(3): 784-799. DOI:10.1016/j.gca.2010.11.011
(  0) 0) |
| [78] |
Fujii T, Albarède F. Ab initio calculation of the Zn isotope effect in phosphates, citrates, and malates and applications to plants and soil[J]. PLoS One, 2012, 7(2): e30726. DOI:10.1371/journal.pone.0030726
(  0) 0) |
| [79] |
Marković T, Manzoor S, Humphreys-Williams E, et al. Experimental determination of zinc isotope fractionation in complexes with the phytosiderophore 2'- deoxymugeneic acid(DMA)and its structural analogues, and implications for plant uptake mechanisms[J]. Environmental Science & Technology, 2017, 51(1): 98-107.
(  0) 0) |
| [80] |
Weiss D J, Mason T F D, Zhao F J, et al. Isotopic discrimination of zinc in higher plants[J]. New Phytologist, 2005, 165(3): 703-710. DOI:10.1111/j.1469-8137.2004.01307.x
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


