2. 农业农村部西北植物营养与农业环境重点实验室(西北农林科技大学资源环境学院), 陕西杨凌 712100;
3. 中国科学院大学, 北京 100049
2. Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture and Rural Affairs; College of Natural Resources and Environment, Northwest A & F University, Yangling, Shannxi 712100, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
辣椒疫病是一种由辣椒疫霉(Phytophthora capsici Leonian)引起的极具破坏性的土传病害,能引起植株根冠腐烂以及叶子、果实与茎枯萎等现象[1],对辣椒集约化种植造成严重威胁。更为严重的是,辣椒疫霉卵孢子在土壤中可以休眠3年以上,环境适宜时又可以重新萌发、侵害植株,引发大面积发病[2]。随着设施农业面积的不断扩大,辣椒作为一种经济作物其生产设施化程度也日益提高。然而,设施大棚内高温高湿的环境极易引起辣椒疫病的爆发与流行,因为疫霉卵孢子易在灌溉作用下产生、游动及侵染,可在短时间内带来毁灭性灾害,在生产上防治难度大[3]。因此,随着设施辣椒复种指数不断提高,防治辣椒疫病已成为辣椒产业不容忽视的问题。
丛枝菌根(Arbuscular mycorrhizal,AM)真菌在自然界中广泛存在且可与绝大多数陆生植物的根系形成互惠共生体,可以改善宿主植物营养水平,此外对由疫霉(Phytophthora)、腐霉(Pythium)、镰孢霉(Fusarium)和丝囊霉(Aphanomyces)等病原菌所引起的植物病害也表现出一定的防治效果[4]。研究表明,接种AM真菌可以通过生态位竞争和增强宿主养分吸收等途径对抗辣椒疫病[5]。在生产上如能充分发掘AM真菌的抑病功能,则有利于降低现代农业对化肥与农药的依赖性,改善土壤性状并促进农业可持续健康发展。由于AM真菌是一类严格共生菌,极大限制了其规模化生产,学者们转向寻找调动土著AM真菌抑病功能的农艺调控措施[6]。
间作可以提高土壤微生物的多样性与稳定性[7-8],也有利于AM真菌的生存及对作物根系的侵染[8-9]。在间作生产系统中,AM真菌菌丝连接不同作物根系形成菌根网络并传递水分和养分[10],同时加大对作物光合产物的利用以促进自身的增殖[11]。由于辣椒耐荫而玉米喜温,两者间作在空间上形成了垂直高差、光热资源可得到充分利用,具有明显的增产潜力和经济效益[12]。陈颖等[13]比较了间作多种作物对辣椒的影响,也发现间作玉米处理辣椒品质最佳。间作玉米也能有效控制辣椒疫病的发生,其中混作(即随意间作)可使病害的减轻达到最大化[14]。安曈昕等[15]通过比较发现,只要每2行辣椒间作1行玉米就可以有效控制辣椒疫病。但是,上述通过间作玉米防治辣椒疫病的研究中,没有关注AM真菌的响应及其可能发挥的防病功效;且除了间作比例之外,作物间的行距大小也会影响间作效应,但目前针对间作行距的研究更为不足。
鉴于此,本试验在设施大棚内设置不同行距的辣椒和玉米间作体系,探究间作玉米对土著AM真菌生长及辣椒疫病防治的影响,以期获得可高效调动土著AM真菌防治辣椒疫病的调控措施。
1 材料与方法 1.1 研究区概况重庆市石柱县为“中国辣椒之乡”,目前是川渝鄂最大的辣椒生产基地,辣椒种植历史久、品质优,是当地的农业支柱产业。试验地位于该县辣椒科技园(30°12′63″N,108°18′38″E),选择一个连续植椒5年以上、试验前一年度(2017年)疫病发病严重的设施大棚开展试验。试验前土壤pH 6.5,有机碳16.2 g·kg–1,全氮1.16 g·kg–1,全磷0.89 g·kg–1,全钾23.2 g·kg–1,矿质氮114 mg·kg–1,有效磷613 mg·kg–1,速效钾347 mg·kg–1。
1.2 试验设计试验共设12个小区(每个小区8 m×5.25 m,小区之间间隔0.5 m)、完全随机分布3个处理(×4个重复):辣椒单作(CK),每小区4垄(垄宽1.2 m,垄间排水沟宽0.15 m),每垄种植2行辣椒,辣椒株距、行距均为40 cm,每个小区合计136株辣椒;等垄宽间作玉米(same ridge width,SRW),两行辣椒中间种植1行玉米(垄宽不变,行距降至20 cm,玉米的株距也为40 cm),每个小区合计136株辣椒、64株玉米;等行距间作玉米(same row distance,SRD),垄宽扩至1.65 m(每小区减为3垄),行距仍为40 cm,每个小区合计102株辣椒、48株玉米。
供试辣椒品种为石辣7号,供试玉米品种为渝单33号,所有小区的施肥水平均为:复合肥(含N 210 g·kg–1,P2O5 167 g·kg–1和K2O 250 g·kg–1)720 kg·hm–2、有机肥(含有机碳423 g·kg–1,N 35 g·kg–1,P2O5 61 g·kg–1和K2O 47 g·kg–1)5 730 kg·hm–2。2018年5月5日移栽大小一致的辣椒苗,同时播种玉米,使用滴灌带进行浇水,棚内常规农田管理。辣椒果实成熟后分批次收获、称鲜重(即经济产量);玉米棒成熟后一次性收获,晒干后脱粒、称晒干重(即经济产量)。
1.3 辣椒病情测定9月4日(辣椒盛果期),每垄随机选取9株辣椒判定疫病发病率和病情指数(设0~5级,标准参考Matsumoto[16]),各小区的综合病情指数为[(1×n1 + 2×n2 + 3×n3 + 4×n4 + 5×n5)/ N×(n0 + n1 + n2 + n3 + n4 + n5)] ×100%,其中n0~n5表示各个发病级别的株数,N表示最高发病级别[17]。
1.4 植株样品测定10月10日,各小区随机采集5株辣椒与3株玉米(分为茎叶、根系两部分),根系用水冲净,取很少部分经10% KOH清洗后用曲利苯蓝染色,显微镜下测定AM真菌侵染率[18]。根系、茎叶样品置于65℃烘箱中烘干后称重;另从收获的辣椒、玉米果实样品中随机选取部分置于65℃烘箱中烘干后称重,通过测算水分含量进而计算单株果实生物量;分别选取部分样品,粉碎后经H2SO4-H2O2消煮,分别用凯氏消解法、钼抗坏血酸比色法、火焰光度法测定氮、磷、钾含量[19],计算单株以及小区氮、磷和钾的总吸收量以及辣椒占玉米与辣椒养分总吸收量的比例。
1.5 土壤样品测定10月10日,在上述选取的辣椒与玉米株围分别采集根系附近土样(须在相应作物的行上),每个小区每种作物混成一份土壤样品后分成两部分。其中一部分用于提取DNA(低温保存):称取约0.5 g土壤样品,用FastDNA®SPIN Kit for soil(MP Biomedicals,美国俄亥俄州)试剂盒提取(用NanoDrop ND2000核酸蛋白分析仪测定浓度后–30 ℃保存),使用引物AML2 /NS31、通过CFX96 instrument(Bio-Rad,中国上海)进行定量PCR(qPCR),同时以含有相应基因片段的DNA样品通过10倍梯度稀释以产生包括7个数量级的标准曲线[20]。qPCR的扩增效率为113.8%(R2 = 0.994),最后基于土壤含水量和DNA浓度换算每克干土所含的AM真菌18S rRNA基因拷贝数。另一部分风干后用于测定土壤基础化学性质:先过0.841 mm筛,土壤pH用1:2.5水浸提液测定,矿质氮经KCl提取后用流动分析仪测定[21],有效磷经碳酸氢钠提取后用钼蓝比色法测定[19],速效钾经醋酸铵提取后用火焰光仪测定[19],土壤磷酸酶活性按照Tabatabai方法测定[19];再从中选取部分样品过0.150 mm筛,土壤有机碳用重铬酸钾容量法测定[19]。
1.6 数据处理使用Excel 2016计算平均值与标准偏差并绘图,通过SPSS 13.0软件基于Duncan新复极差法进行统计分析(P < 0.05),其中作物之间或两个处理之间的差异分析采用t检验(P < 0.05)。
2 结果 2.1 AM真菌生长与辣椒发病如图 1所示,与单作处理(CK)相比,间作(SRW、SRD)处理辣椒根际AM真菌数量与根系AM真菌侵染率均显著(P < 0.05)提高,疫病发病率与病情指数均显著(P < 0.05)下降,其中种植更加紧密的SRW处理辣椒与玉米根系AM真菌侵染率均显著(P < 0.05)高于SRD处理、疫病发病率也显著(P < 0.05)低于SRD处理,但两者之间病情指数无明显差异,且对辣椒与玉米根际AM真菌数量的影响也无显著差异。此外,SRW处理玉米根际AM真菌数量与根系AM真菌侵染率均显著(P < 0.05)高于辣椒,而SRD处理玉米与辣椒之间无类似差异。
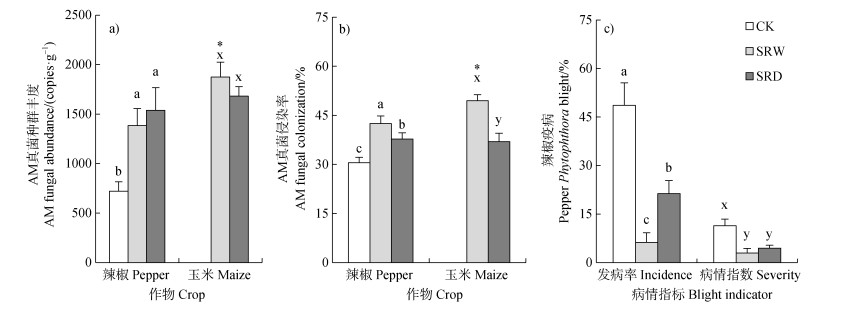
|
注:CK,辣椒单作;SRW,等垄宽间作玉米;SRD等行距间作玉米;同一作物不同字母表示处理之间差异显著(P < 0.05),*表示玉米与辣椒之间差异显著(P < 0.05)。下同。 Note: CK, mono-cropping of pepper; SRW, intercropping with maize under same ridge width as CK; SRD, intercropping with maize under same row distance as CK. Different letters within the same crop species represent significant differences between treatments(P < 0.05), while * indicates significant differences between maize and pepper(P < 0.05). The same below. 图 1 AM真菌种群丰度、侵染率和辣椒疫病发病率、病情指数 Fig. 1 The AM fungal abundance, mycorrhizal colonization, and pepper Phytophthora blight incidence and severity |
如图 2所示,与单作处理(CK)相比,间作(SRW、SRD)处理对单株辣椒茎叶、根系生物量及氮、钾吸收量均没有显著影响,但单株辣椒的果实生物量及磷吸收量均显著下降(P < 0.05),而两个间作处理之间单株辣椒、玉米各部位生物量与养分吸收量均无显著差异。结果表明,间作体系中磷吸收量成为了辣椒单株产量的限制因子,其中种植更加紧密的SRW处理辣椒与玉米之间单株果实生物量的平均值均低于SRD处理,说明该处理作物间的养分竞争更为激烈。
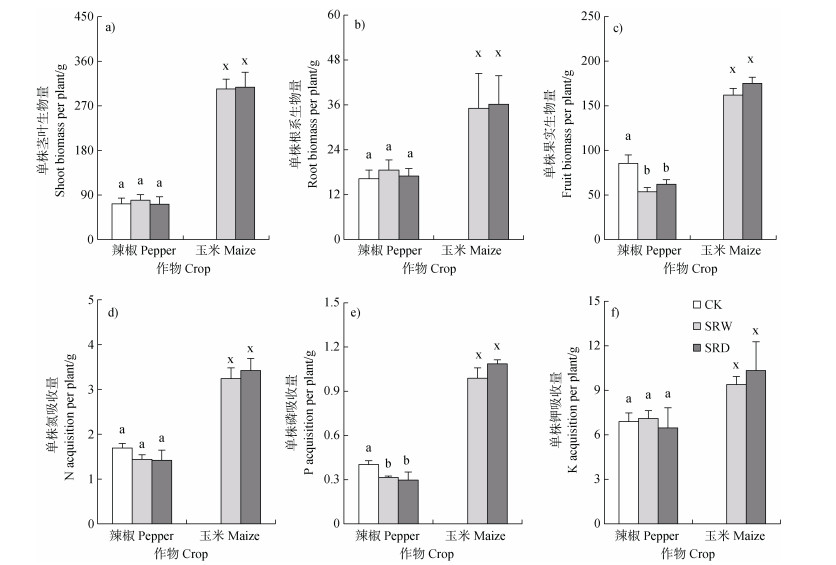
|
图 2 单株茎叶、根系、果实生物量及氮、磷、钾吸收量 Fig. 2 The biomasses of shoot, root, fruit and the acquisition amounts of N, P, K per plant |
如图 3所示,间作(SRW、SRD)处理小区作物氮、磷、钾总吸收量均显著(P < 0.05)高于单作处理(CK)、辣椒产量均显著(P < 0.05)低于单作处理,尽管两个间作处理之间辣椒产量没有显著差异,但SRD处理小区玉米产量及作物氮、磷、钾总吸收量均显著低于(P < 0.05)SRW处理,故相比之下SRW处理更具经济优势。在间作情形下,SRW与SRD处理间辣椒的氮、磷、钾吸收占比均没有显著差异,即辣椒与玉米的行距调整未明显改变两者之间的养分竞争平衡。
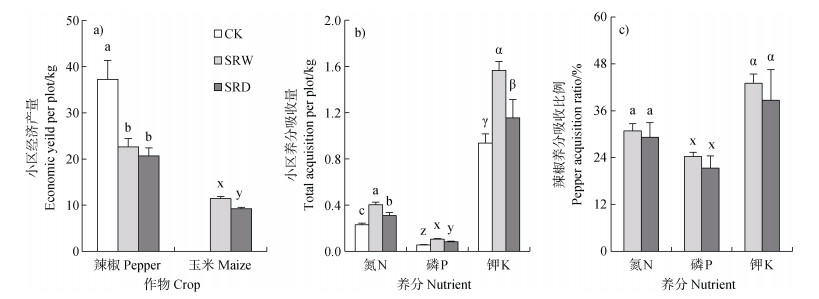
|
图 3 小区经济产量、养分总吸收量及辣椒吸收占比 Fig. 3 The economic yields and nutrient acquisition amounts per plot and the pepper acquisition ratio |
如表 1所示,与单作处理(CK)相比,间作(SRW、SRD)处理辣椒根际土壤磷酸酶活性显著(P < 0.05)提高,土壤有效磷含量趋于上升但仅SRD处理达到显著水平(P < 0.05)。无论是辣椒根际还是玉米根际,两个间作处理之间土壤化学性质均没有显著差异。此外,无论是SRW处理还是SRD处理,玉米根际土壤仅pH显著(P < 0.05)高于辣椒根际,其他性状也没有差异。
|
|
表 1 土壤基础化学性质与磷酸酶活性 Table 1 Soil basic chemical properties and phosphatase activity |
针对玉米-辣椒间作系统,探究不同行距对土著AM真菌抑病功能的调动效果,对实际生产具有重要指导意义。通过本研究发现,间作玉米可使辣椒根系AM真菌侵染率和定殖数量显著提高(图 1)。已有报道显示,间作能有效提高土壤中AM真菌的丰富度[22]和孢子数量[23]。此外,间作情形下土壤微生物在选择生境时会有一定倾向性,进而会形成与之相应的、多样化的根际微生物群落[24-25]。当然,间作也会导致根系分泌物发生变化,其中有些成分对某些AM真菌有较强的吸引力,进而促进相关AM真菌的定殖[26]。AM真菌与宿主植物间并没有严格的专一性,可以通过根外菌丝与不同植物根系形成菌根网络——即在共生植物之间形成菌丝桥[10]。作物通过菌丝桥获得养分,AM真菌也可以通过菌根网络获取碳源并提高其侵染率[26]。与辣椒相比,玉米往往能与AM真菌形成更强的共生关系,也可为AM真菌提供更为充足的碳源[11]。
本研究结果也显示,间作玉米处理能显著降低辣椒疫病发病率和病情指数(图 1c)。以往的研究表明,间作系统本身能够通过稀释[12]、阻挡[27]、拮抗[28]、互作[29]等效应有效防治辣椒疫病。例如,玉米根系可以将辣椒疫霉游动孢子吸附在根际,并分泌一些物质抑制孢子萌发并使其裂解,通过阻隔游动孢子的移动有效控制辣椒疫病[30]。此外,间作玉米在一定程度上也能促进土壤中酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)和接合菌门(Zygomycota)等有益微生物的种类与相对丰度,对防治辣椒疫病产生间接效果[31]。然而,间作系统中两种作物之间不可避免发生竞争作用,包括光、养分、热等有限资源[32],导致辣椒果实产量下降(图 2c),这与Midmore等[33]的结论一致。单就养分竞争而言,间作玉米明显降低单个辣椒植株的磷吸收量,尽管这对辣椒植株生物量未产生实质影响,但对辣椒果实产量形成了明显限制。磷在土壤中移动性差,土壤磷酸酶活性的提高也是AM真菌提高土壤磷有效性的重要作用之一:不仅可以通过改善营养使植物根系释放更多的酶,而且可以通过真菌分泌物或改变根系分泌物来增强土壤微生物代谢活性[34]。鉴此,间作玉米对辣椒根系AM真菌侵染率及根际土壤磷酸酶活性与速效磷含量的提高(表 1),是促成间作效应产生[20]和养分利用效率提高(图 3b)的重要保证。
本研究以辣椒单作为对照,设置了两种不同行距的玉米-辣椒间作体系,辣椒疫病发病率与根系AM真菌侵染率之间呈现明显的消长关系(图 1)。其中,种植密度更高、根系更加紧密的等垄宽间作处理可更突出地提高AM真菌侵染率并降低辣椒疫病发病率,这表明根系交叉程度越高、玉米给AM真菌输送碳源的强度越大,同时也增强了AM真菌对辣椒根系的侵染。有研究表明,在植株异质性能发挥“微生态效应”抑病功能范围内,抑病效果与间距成反比[35]。尽管两个间作处理之间辣椒产量没有显著差异,但等行距间作处理小区玉米产量显著低于等垄宽间作处理。对辣椒与玉米的总产值进行评估,等垄宽间作处理更具经济优势和推广价值。与此同时,整个小区作物养分吸收量也表现为等垄宽间作处理高于等行距间作处理(图 3b),故在此条件下等行距间作处理所采用的种植密度并未充分发挥间作的应有效应。此外,两个处理辣椒养分吸收比例间均无显著差异,说明辣椒与玉米的行距调整未明显改变两者之间的竞争力。
4 结论设施大棚中,间作玉米可以显著提高辣椒根系AM真菌侵染率、根际AM真菌数量与土壤磷酸酶活性,显著降低辣椒疫病发病率与病情指数。尽管间作条件下单株辣椒的磷吸收量及果实生物量因受到竞争而显著降低,小区作物的养分总吸收量却显著提高。其中,种植密度更高的等垄宽间作处理较等行距间作处理更有利于提高AM真菌侵染率、小区玉米产量及作物养分总吸收量,辣椒疫病发病率也更低。因此,等垄宽间作模式是一种高效调动土著AM真菌抑病功能且具有推广应用潜力的农艺防治措施。
| [1] |
Ristaino J B, Johnston S A. Ecologically based approaches to management of Phytophthora blight on bell pepper[J]. Plant Disease, 1999, 83(12): 1080-1089. DOI:10.1094/PDIS.1999.83.12.1080
(  0) 0) |
| [2] |
Guan T S, Li F Y, Zhao K H, et al. The current situation of Phytophthora capsici (In Chinese)[J]. Liaoning Agricultural Science, 1999(5): 24-27. [关天舒, 李凤云, 赵奎华, 等. 我国辣椒疫病的研究现状[J]. 辽宁农业科学, 1999(5): 24-27.]
(  0) 0) |
| [3] |
Hou Z R, Zhang J, Wang J Q, et al. Occurrence status and comprehensive prevention and control of pepper diseases and pests in facility (In Chinese)[J]. Agricultural Engineering Technology, 2020, 40(28): 73-75. [侯峥嵘, 张洁, 王建泉, 等. 设施辣椒病虫害发生现状与综合防控[J]. 农业工程技术, 2020, 40(28): 73-75.]
(  0) 0) |
| [4] |
Hou S W, Hu J L, Wu F Y, et al. The function and potential application of disease suppression by arbuscular mycorrhizal fungi (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(5): 941-951. [侯劭炜, 胡君利, 吴福勇, 等. 丛枝菌根真菌的抑病功能及其应用[J]. 应用与环境生物学报, 2018, 24(5): 941-951.]
(  0) 0) |
| [5] |
Hu J L, Hou S W, Li M H, et al. The better suppression of pepper Phytophthora blight by arbuscular mycorrhizal(AM)fungus than Purpureocillium lilacinum alone or combined with AM fungus[J]. Journal of Soils and Sediments, 2020, 20(2): 792-800. DOI:10.1007/s11368-019-02438-9
(  0) 0) |
| [6] |
Hou S W, Zhang Y, Li M H, et al. Concomitant biocontrol of pepper Phytophthora blight by soil indigenous arbuscular mycorrhizal fungi via upfront film-mulching with reductive fertilizer and tobacco waste[J]. Journal of Soils and Sediments, 2020, 20(1): 452-460. DOI:10.1007/s11368-019-02393-5
(  0) 0) |
| [7] |
Kennedy A C, Smith K L. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil, 1995, 170(1): 75-86. DOI:10.1007/BF02183056
(  0) 0) |
| [8] |
Lacombe S, Bradley R L, Hamel C, et al. Do tree-based intercropping systems increase the diversity and stability of soil microbial communities?[J]. Agriculture Ecosystems & Environment, 2009, 131(1/2): 25-31.
(  0) 0) |
| [9] |
Hage-Ahmed K, Krammer J, Steinkellner S. The intercropping partner affects arbuscular mycorrhizal fungi and Fusarium oxysporum f. sp. lycopersici interactions in tomato[J]. Mycorrhiza, 2013, 23(7): 543-550. DOI:10.1007/s00572-013-0495-x
(  0) 0) |
| [10] |
Zeng S C, Su Z Y, Chen B G, et al. Effects of VA mycorrhiza(VAM)on nutrient acquisition and transmission of plants (In Chinese)[J]. Journal of Southwest Forestry College, 2005, 25(1): 72-75. [曾曙才, 苏志尧, 陈北光, 等. VA菌根真菌对植物养分吸收与传递的影响[J]. 西南林学院学报, 2005, 25(1): 72-75.]
(  0) 0) |
| [11] |
Kiers E T, Duhamel M, Beesetty Y, et al. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis[J]. Science, 2011, 333(6044): 880-882. DOI:10.1126/science.1208473
(  0) 0) |
| [12] |
Sun Y, Zhou T F, Wang Y Y, et al. Effect of intercropping on disease management and yield of chilli pepper and maize (In Chinese)[J]. Acta Horticulturae Sinica, 2006, 33(5): 995-1000. DOI:10.3321/j.issn:0513-353X.2006.05.012 [孙雁, 周天富, 王云月, 等. 辣椒玉米间作对病害的控制作用及其增产效应[J]. 园艺学报, 2006, 33(5): 995-1000.]
(  0) 0) |
| [13] |
Chen Y, Xu K F, Zhang H, et al. Effects of different intercropping patterns on the quality of pepper (In Chinese)[J]. Guizhou Agricultural Sciences, 2012, 40(6): 81-82. [陈颖, 许开飞, 张辉, 等. 不同间作方式对辣椒品质的影响[J]. 贵州农业科学, 2012, 40(6): 81-82.]
(  0) 0) |
| [14] |
Mundt C C. Modeling disease increase in host mixtures//Milgroom M G, Levin S A, Fry W E. Plant disease epidemiology 2: Genetics, resistance and management[M]. New York, USA: McGraw-Hill, 1989: 150—181.
(  0) 0) |
| [15] |
An T X, Dai P, Wu B Z, et al. Control efficacy of intercropping of sweet maize and vegetables on main pest and disease (In Chinese)[J]. Journal of Yunnan Agricultural University: Natural Science, 2011, 26(4): 449-453. [安曈昕, 代平, 吴伯志, 等. 甜玉米间作蔬菜对主要病虫害的控制作用研究[J]. 云南农业大学学报: 自然科学版, 2011, 26(4): 449-453.]
(  0) 0) |
| [16] |
Matsumoto Y. Evaluation of Cucumis ficifolius A. Rich. accessions for resistance to Fusarium wilt[J]. American Journal of Experimental Agriculture, 2012, 2(3): 470-476. DOI:10.9734/AJEA/2012/1421
(  0) 0) |
| [17] |
Ren L X, Zhang N, Wu P, et al. Arbuscular mycorrhizal colonization alleviates Fusarium wilt in watermelon and modulates the composition of root exudates[J]. Plant Growth Regulation, 2015, 77(1): 77-85. DOI:10.1007/s10725-015-0038-x
(  0) 0) |
| [18] |
Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 1970, 55(1): 158-161. DOI:10.1016/S0007-1536(70)80110-3
(  0) 0) |
| [19] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [20] |
Hu J L, Li M H, Liu H, et al. Intercropping with sweet corn(Zea mays L. var. rugosa Bonaf.)expands P acquisition channels of chili pepper(Capsicum annuum L.)via arbuscular mycorrhizal hyphal networks[J]. Journal of Soils and Sediments, 2019, 19(4): 1632-1639. DOI:10.1007/s11368-018-2198-6
(  0) 0) |
| [21] |
Meisinger J J, Bandel V A, Angle J S, et al. Presidedress soil nitrate test evaluation in Maryland[J]. Soil Science Society of America Journal, 1992, 56(5): 1527-1532. DOI:10.2136/sssaj1992.03615995005600050032x
(  0) 0) |
| [22] |
Chifflot V, Rivest D, Olivier A, et al. Molecular analysis of arbuscular mycorrhizal community structure and spores distribution in tree-based intercropping and forest systems[J]. Agriculture, Ecosystems & Environment, 2009, 131(1/2): 32-39.
(  0) 0) |
| [23] |
Muleta D, Assefa F, Nemomissa S, et al. Distribution of arbuscular mycorrhizal fungi spores in soils of smallholder agroforestry and monocultural coffee systems in southwestern Ethiopia[J]. Biology and Fertility of Soils, 2008, 44(4): 653-659.
(  0) 0) |
| [24] |
Hou H, Dong K, Yang Z X, et al. Root-soil interaction in intercropping system and alleviation mechanism of continuous cropping obstacle (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2016, 32(29): 105-112. [侯慧, 董坤, 杨智仙, 等. 间作系统根-土互作与连作障碍缓解机制[J]. 中国农学通报, 2016, 32(29): 105-112.]
(  0) 0) |
| [25] |
Yang Z X, Tang L, Zheng Y, et al. Effects of different wheat cultivars intercropped with faba bean on faba bean Fusarium wilt, root exudates and rhizosphere microbial community functional diversity (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(3): 570-579. [杨智仙, 汤利, 郑毅, 等. 不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 570-579.]
(  0) 0) |
| [26] |
Bacilio-Jimenez M, Aguilar-Flores S, Ventura-Zapata E, et al. Chemical characterization of root exudates from rice(Oryza sativa)and their effects on the chemotactic response of endophytic bacteria[J]. Plant and Soil, 2003, 249(2): 271-277.
(  0) 0) |
| [27] |
Zi S H, Wang L, Zhong L, et al. The effects of different intercropping patterns on incidence of diseases and pests in chilli pepper (In Chinese)[J]. Journal of Yunnan University: Natural Sciences Edition, 2010, 32(6): 733-739. [字淑慧, 王丽, 钟禄, 等. 不同间作模式对丘北辣椒病虫害的影响[J]. 云南大学学报: 自然科学版, 2010, 32(6): 733-739.]
(  0) 0) |
| [28] |
Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates (In Chinese)[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. [吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310.]
(  0) 0) |
| [29] |
Fu X P, Wu F Z, Zhou X G. Research progress on the mechanism of intercropping to prevent and control crop soil-borne diseases (In Chinese)[J]. Jiangsu Agricultural Sciences, 2016, 44(1): 16-20. [付学鹏, 吴凤芝, 周新刚. 间作防控作物土传病害的机理研究进展[J]. 江苏农业科学, 2016, 44(1): 16-20.]
(  0) 0) |
| [30] |
Yang M, Zhang Y, Qi L, et al. Plant-plant-microbe mechanisms involved in soil-borne disease suppression on a maize and pepper intercropping system[J]. PLoS One, 2014, 9(12): e115052.
(  0) 0) |
| [31] |
Dong Y F, Lyu X Z, Zhang Z K, et al. Effects of different cultivation patterns on soil microbial community and enzyme activity in continuous cropped pepper field (In Chinese)[J]. Acta Agriculturae Zhejiangensis, 2019, 31(9): 1485-1492. [董宇飞, 吕相漳, 张自坤, 等. 不同栽培模式对辣椒根际连作土壤微生物区系和酶活性的影响[J]. 浙江农业学报, 2019, 31(9): 1485-1492.]
(  0) 0) |
| [32] |
Zhao P, Fan M P, Zhao X Y, et al. Study on the absorption and utilization of phosphorus nutrients under the condition of mixed corn and pepper (In Chinese)[J]. Jiangsu Agricultural Sciences, 2004, 32(4): 99-101. [赵平, 范茂攀, 赵秀英, 等. 玉米辣椒混作条件下磷素养分吸收利用研究[J]. 江苏农业科学, 2004, 32(4): 99-101.]
(  0) 0) |
| [33] |
Midmore D J, Yang S, Kleinhenz V, et al. Intercropping chilli peppers with maize//Proceedings of the Conference on Chilli Pepper Production in the Tropics[C]. Kuala Lumpur, Malaysia. 1992: 37—51.
(  0) 0) |
| [34] |
Wang F Y, Lin X G, Yin R, et al. Effects of arbuscular mycorrhizal inoculation on the growth of Elsholtzia splendens and Zea mays and the activities of phosphatase and urease in a multi-metal-contaminated soil under unsterilized conditions[J]. Applied Soil Ecology, 2006, 31(1/2): 110-119.
(  0) 0) |
| [35] |
Xi Y D, Xiang Y J, Wu J, et al. Efficacy of intercropping systems of pepper and peanut for pepper anthracnose and peanut leafspot diseases (In Chinese)[J]. Southwest China Journal of Agricultural Sciences, 2015, 28(1): 150-154. [席亚东, 向运佳, 吴婕, 等. 间套作对辣椒炭疽病、花生叶斑病的影响[J]. 西南农业学报, 2015, 28(1): 150-154.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


