2. 中国科学院东北地理与农业生态研究所, 黑土区农业生态重点实验室, 哈尔滨 150081;
3. 中国科学院大学, 北京 100049;
4. 密歇根州立大学, 植物、土壤和微生物科学系微生物生态中心, 美国密歇根州 48824
2. Key Laboratory of Mollisols Agroecology, Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Harbin 150081, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Microbial Ecology, Department of Plant, Soil and Microbial Sciences, Michigan State University, East Lansing, Michigan 48824, USA
东北黑土区是世界四大连续黑土带之一,因其土壤有机质含量高和耕地肥沃被称为我国粮食生产的“压舱石”和“稳压器”。但高强度农业管理方式极易导致土壤有机质含量降低,而土壤微生物直接或间接参与土壤有机质的合成与分解以及碳氮等物质循环,在土壤有机质转化和累积过程中发挥了重要作用[1-2]。土壤是历史自然体,是母质在地形、时间、生物和气候长期作用下形成的产物,而土壤肥力最本质的特征是地上部植物的生长繁殖[3]。因此,微生物在土壤形成,特别是植物定植过程中发挥了重要作用。有研究[4-5]表明,森林变耕为茶园以及水田变耕为果园,土壤微生物的种群和功能多样性降低。此外,通过生态修复林设置[6]、自然植被生长[1]、豆科植被种植[7]以及无翻耕和种前灌溉保护性耕种等[8-9]措施均有助于土壤微生物系统的恢复。但在典型黑土区,经过长期不同植被覆盖的土地利用方式对土壤微生物群落结构及土壤肥力的影响规律及其驱动机制研究较少。据此,于1985年在东北典型黑土区建立了长期观测试验地,通过空间和时间策略,设置了裸地、玉米-大豆-小麦轮作和杂草自然生长三种土地利用方式,研究地上部植物对土壤性质及微生物群落演替的影响规律,以期为更好地保护和利用黑土地提供科学依据。
1 材料与方法 1.1 样地设置与样品采集试验地位于中国科学院黑龙江海伦农田生态系统国家野外科学观测研究站(47°27′ N,126°55′ E),隶属松嫩平原典型黑土区。该区海拔240m,属于温带大陆性季风气候,年平均气温为1.5℃,年降水量为500~600 mm,年均日照时数2 600~2 800 h,无霜期为130 d左右。据历史资料分析,该黑土区开垦前为草甸草原,植被优势种为狗尾草(Setaria viridis)。
长期样地的实验设计如下:1985年,将一块典型黑土退化农田划分为3个地块,采取不同的土地利用恢复方式,形成裸地、农田和草地三种生态系统。具体设置如下:(1)草地(Grassland),无任何肥料投入或耕作,自然恢复为草原化草甸植被,优势种为羊草(Leymus chinensis)、苔草(Carex)、木贼(Equisetum arvense L.)和狗尾草(Setaria viridis),植被自然生长还田,无人为干扰;(2)农田(Cropland),采用传统耕作方式,不施用任何肥料以减少土壤继续退化程度,种植方式为小麦(Triticum aestivum L.)-玉米(Zea mays L.)-大豆(Glycine max L. Merrill.)轮作,一年一熟,作物生长季进行3~4次耙松,设置3个试验小区,其当季作物分别为小麦、玉米和大豆,秋季收获后将作物地上部全部移除;(3)裸地(Bareland),定期将作物地上部分铲除,保持无植被覆盖。
于2017年10月作物收获后采集土壤样品,针对每一个样地重复按照“S”形采样法采集0~20 cm表层土,并将采样点样品混合装于采样袋中。其中草地和农田土壤取三个重复样品,农田土壤分别取3个试验小区样品作为三个重复。将样品用冰袋运回实验室,去除土样中动植物残体,混匀后一部分用于测定土壤理化性质,一部分保存在–80℃冰箱用于土壤微生物测定。
1.2 土壤理化属性测定土壤基本理化性质的测定方法参照早期研究[10]进行。土壤含水量用干燥法测定,土壤pH用pH计(水土比2.5:1)测定,土壤有机质采用重铬酸钾氧化—外加热法测定,土壤全氮采用半微量凯氏定氮法测定。土壤阳离子交换量使用醋酸铵(pH 7.0)法测定。土壤碱解氮通过1 mol·L–1 NaOH水解,用碱解扩散法测定。土壤有效磷用0.5 mol·L–1 NaHCO3(pH 8.5)溶液萃取,并用钼酸盐比色法测定。土壤速效钾用1 mol·L–1 CH3COONH4(pH 7.0)提取,通过火焰光度法测定。
1.3 土壤微生物总DNA的提取称取0.5 g土壤,利用PowerSoil kit(QIAGEN GmbH,Hilden,德国)DNA提取试剂盒,根据说明书提取土壤DNA,溶解于50 µL无核酸酶水中。取1 µL的DNA用荧光计(Qubit 3.0,Thermo Fisher Scientific Inc.,美国)分析DNA的质量和浓度。将DNA保存于–20℃冰箱进行下一步试验。
1.4 高通量测序分析土壤微生物群落通过Wafergen SmartChip实时荧光定量PCR系统分析16S rRNA基因的拷贝数,使用特异性引物,上游引物为1132R(5'-GGGTTGCGCTCGTTGC5- 3'),下游引物为1108F(5'-ATGGYTGTCGTCAGCT CGTG-3')。PCR反应条件为:95℃预变性10 min,95℃变性34 s,60℃复性64 s,进行40个循环,熔解曲线和循环阈值(Ct)由Wafergen软件自动生成。土壤微生物丰度为每克干燥土壤中16S rRNA的基因拷贝数。
基因拷贝数(gene copy number,GCN)= POWER((10,30-Ct)/3.33)
利用Illumina Miseq平台高通量测序技术,PCR扩增16S rRNA的V4~V5高变区,引物为515F(5'-GTGCCAGCMGCCGCGG-3')和907R(5'-CCG TCAATTCMTTTRAGTT-3')。PCR反应程序:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸45 s,27个循环;72℃延伸10 min。
1.5 数据处理使用SPSS 25.0软件对土壤理化性质和16S rRNA基因拷贝数进行统计和差异性分析。采用QIIME(quantitative insight into microbial ecology)软件对序列进行过滤筛选,并用UCLUST软件根据序列相似性进行聚类,相似度为97%的序列合并为同一可操作分类单元(operational taxonomic units,OTU)。结果采用RDP classifier贝叶斯算法将OTUs与silva(silva 132)数据库进行物种比对和聚类(置信度为70%),鉴定OTUs种属分类,无分配结果的序列定义为“Unclassified”。利用R 3.6.1软件分析并可视化土壤微生物群落结构及其影响因素。
2 结果与讨论 2.1 长期不同利用方式对典型黑土区土壤理化性质的影响32年不同土地利用方式显著改变了典型黑土区的土壤理化性质(表 1)。与裸地土壤相比,长期作物种植和自然杂草显著提高了黑土裸地有机质含量,从52.07 g·kg–1增加至54.83 g·kg–1和61.54 g·kg–1,增幅分别为8.0%和27.5%,这与Machmuller等[11]关于自然杂草恢复下土壤有机质含量最高的结果一致。土壤pH、碱解氮、有效磷和速效钾含量与土壤有机质呈现相似的变化规律。
|
|
表 1 不同土地利用方式对土壤理化性质的影响 Table 1 Effect of different land use patterns on soil physicochemical properties |
裸地土壤未获得植物生物量,农田土壤每年仅获得总生物量的5%~30%[12],而草地获得所有生物量。因此,相对于裸地,农田和草地土壤增加了进入土壤的养分,并减少了土壤扰动过程养分的损失[7]。此外,随着长期裸地、农田和草地处理过程中植被覆盖率依次升高,土壤养分流失减缓[13]。裸地中持续去除植被带走土壤中的碱性阳离子,使土壤pH不断降低,而农田和草地植物源有机物料在土壤中分解会释放OH–离子,抑制土壤酸化[14]。草地土壤含水量显著高于裸地土壤,但和农田土壤无显著差异性,这与江恒等[15]在黑土区的研究结果一致,主要由不同植被覆盖造成。此外,阳离子交换量在三个长期不同土地利用黑土中无显著差异,这与早期多数研究表明阳离子交换量主要受到有机质影响的结果[16]不同,可能原因是本研究土壤背景相同,且黑土土壤有机质远高于其他类型土壤,不是制约阳离子交换量变化的影响因素。
2.2 长期不同利用方式对典型黑土区土壤微生物丰度的影响利用土壤中16S rRNA基因拷贝数评估微生物丰度,典型黑土区经过32年无植被覆盖、作物种植和自然杂草生长,草地和农田土壤微生物丰度显著高于裸地,每克干燥土壤中微生物丰度从2.25×107拷贝数增加至8.08×107和1.69×108拷贝数,分别增加了2.58倍和6.51倍(图 1)。这一结果与已有的报道[17-18]类似,表明植物残体进入土壤后,强烈刺激了微生物生长。草地的杂草类型多样,其植物残体和凋落物的组成丰富,同时也可能产生类型各异的根系分泌物,刺激微生物生长[19]。相反,长期玉米-大豆-小麦轮作种植过程中,秋季移除地上部分,仅有农作物凋落物、根系分泌物及少量的作物残体进入土壤,对微生物生长的刺激效应可能低于草地杂草。此外,长期轮作过程中大豆根系能促生固氮菌、根瘤菌共生生长,改善土壤微域并提高土壤养分有效性,但与草地相比,作物类型单一,对土壤微生物的刺激作用略小[20]。但如何定量评价植物和微生物的关系仍需开展系统深入的研究。裸地可被认为是一个开放的长期生态系统,缺少植被保护情况下,土壤养分不断被消耗,可能缺少微生物生长发育所需的营养元素,限制微生物生长发育[17]。未来开展原位条件下微生物重要功能群,如固氮菌、硝化菌和有机物腐解菌生理生长特征的研究,具有重要意义。
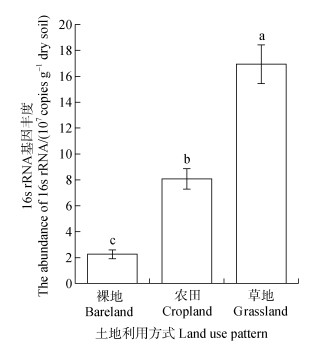
|
图 1 不同利用方式下土壤微生物丰度 Fig. 1 The abundance of microbe in the soils under different land use pattern |
通过高通量测序16S rRNA基因(图 2)发现:经过长期不同处理形成的裸地、农田和草地土壤中共检测出26个微生物门(图 2a),其中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)的相对丰度均大于19%,且在三个处理土壤中无显著性差异。上述优势微生物类群的分布规律与典型黑土的其他研究报道[21-22]基本一致,如草地土壤中相对丰度最高的是放线菌门和变形菌门,而裸地和农田土壤中则为变形菌门和酸杆菌门。值得注意的是,经过长期不同土地利用形成的裸地、农田和草地土壤中,共计7个相对丰度较低的微生物门具有显著性差异,包括绿弯菌门(Chloroflexi)、芽孢杆菌门(Gemmatimonadetes)、晚期细菌门(Latescibacteria)、装甲菌门(Armatimonadetes)、肠杆菌门(Entotheonellaeota)、细菌水稻簇I门(BRC1)和噬氢菌门(Hydrogenedentes),而差异最显著的菌群是绿弯菌门和芽孢杆菌门。绿弯菌门微生物可通过光合作用产生能量生长,而裸地开放系统中植被覆盖率低,光照充足,相比草地与农田土壤具有更理想的生态位,可能是其占据显著优势的重要原因[23]。芽孢杆菌微生物生理代谢多样性高,具有较强的营养和空间位点竞争能力,杂草或作物残体及其根系分泌物可能通过溶磷、固氮等作用改善土壤理化性质,为生理代谢多样的芽孢杆菌提供适宜的生境,因此在草地和农田土壤中发挥更加重要作用[24]。
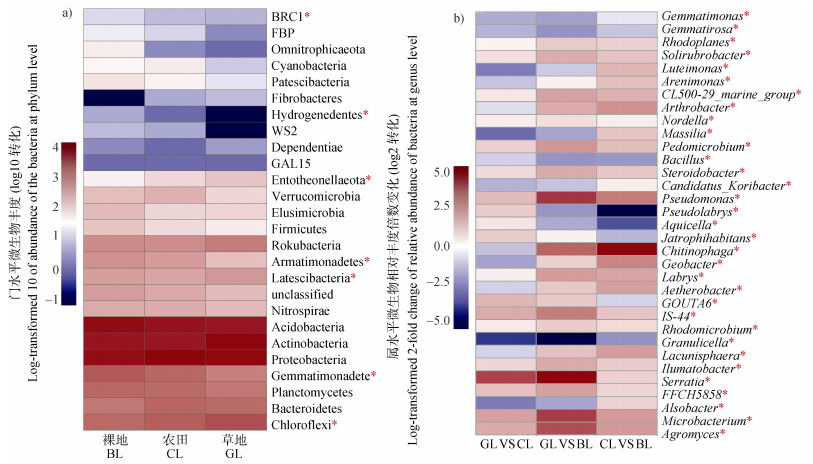
|
注:*表示土壤微生物相对丰度在三种处理土壤中存在显著差异(P < 0.05)。BL:裸地;CL:农田;GL:草地。 Note:* indicated significant differences in the relative abundance of the microbial community in soil among different treatmentts(P < 0.05). BL:bareland;CL:cropland;GL:grassland. 图 2 不同利用方式下土壤微生物群落门水平的物种组成(a)及其具有显著差异的微生物属(b) Fig. 2 The distribution of microbial phyla(a)and microbial genera(b)with a significant difference in soil under different land usage |
尽管裸地、草地和农田土壤中的优势菌群无显著差异,但其在土壤物质转化过程中也可能发生了重要作用。例如,变形菌门含有大量的寡营养微生物功能群,相当一部分类群具有固氮能力,利用各种有机物分解产生的营养物质进行代谢活动[21],适应环境能力强,这可能是长期不同管理方式下土壤中变形菌门无显著差异的重要原因。酸杆菌门的大部分微生物类群尚未被培养,而裸地土壤酸杆菌门丰度最高,表明了这类微生物可能处于一种养分匮乏或物质周转缓慢的状态。事实上,已有研究[25]表明,酸杆菌门适合在低碳土壤中发挥作用,并驱动碳氮元素生物地球化学循环。同时,裸地土壤pH最低(pH 5.97),可能促进了尚未被培养的耐酸性酸杆菌门菌群的生长[26]。然而,也有一些研究[22]发现酸杆菌门受到土壤pH、土壤有机质及作物生长状况等因子的综合影响较强,而非单一pH酸碱度影响。放线菌门则表现出不同的规律,放线菌门含有大量的腐解微生物类群,在动植物残体降解过程中发挥了重要作用,参与了植物残体腐解及氮循环等养分转化过程[27],可能是其在草地和农田土壤中丰度较高的原因。同时,放线菌门的相当一部分微生物能够产生菌丝和孢子,更好适应环境胁迫[28],也可能是长期保持裸地状态土壤中其丰度较高的重要原因。同时,RB41、Gaiella和Microlunatus是属水平相对丰度最高的微生物群落,均属于放线菌,但其相对丰度在不同生态系统中无显著差异性,这与矿区土壤属水平优势菌群相同[29]。
在微生物分类属的水平,长期不同土地利用方式形成的裸地、农田和草地土壤中共检测到228个微生物属,其中有54个微生物属的相对丰度具有显著差异性(图 2b),这些微生物属的分布规律明显不同。其中Rhodoplanses、Pseudomonas、Solirubrobacter、CL500-29_marine_group和Pedomicrobium微生物属在草地土壤相对丰度最高,其原因可能是这些属大多为植物根际促生菌,能有效利用多种形式的碳化合物并促进土壤碳氮循环[30],尤其是长期杂草自然生长的草地中植被种类繁多且覆盖率最高,意味着根系发达,大量根系分泌物可能刺激了根际微域中菌群及其相互作用,共同改变土壤理化性质并重塑了根际的微生物群落结构[31]。在长期作物种植的农田土壤中Arenimonas、Arthrobacter、Luteimonas和Massiliadeng微生物属的相对丰度显著高于草地和裸地,其原因可能是单一农作物种植促进了植物病原菌的繁殖,同时一些农业污染物也可能进入土壤并诱发了这些功能微生物生长[32],但这些微生物是否具有黑土区特异性,仍需深入研究。在长期保持裸地的土壤中,Gemmatimonas和Gemmatirosa属的相对丰度最高,表现为裸地、农田、草地依次降低,表明这些芽孢杆菌门微生物更适合在寡营养环境中生长。但未来仍需通过微生物富集培养或同位素示踪分析等技术,明确不同菌群的生理生态功能特征及其对长期农田种植和草地杂草生长管理方式的适应机制。
2.4 长期不同利用方式对典型黑土区土壤微生物群落演替的环境驱动机制典型黑土区长期裸地、农田和草地三种不同土地利用方式,土壤理化性质发生分异,并可能影响了微生物的生长及群落演替,而微生物的生理代谢产物可能进一步影响土壤理化性质,形成正反馈。通过冗余分析(RDA)耦合土壤微生物群落与理化性质(图 3)表明,典型黑土区土壤经过32年无植被覆盖的裸地、作物种植和杂草自然生长后土壤微生物群落结构发生了显著分异,RDA第一排序轴和第二排序轴分别解释土壤微生物变异量的51.9%和24.9%,表明土壤理化性质可解释土壤微生物分异的76.8%。裸地土壤微生物群落主要受土壤含水量的影响,农田土壤主要受到阳离子交换量的影响,而草地土壤微生物群落主要影响因素是土壤碱解氮、速效钾、有效磷、全氮、pH和有机质。本研究中阳离子交换量(R2 = 0.97)、碱解氮(R2 = 0.96)、有效钾(R2 = 0.95)、全氮(R2 = 0.94)、土壤有机质(R2 =0.94)和有效磷(R2 = 0.94)对微生物群落结构产生了显著影响(P < 0.05),这与已有的报道较为一致,说明氮磷钾等养分含量是土壤微生物群落构建的重要驱动力[33],但不同养分含量在不同土地利用方式下对土壤微生物群落构建的重要性不同。本研究中土壤pH和含水量与土壤微生物群落结构分异无显著相关性(P>0.05),与已有的相关报道[34]不一致。可能是由于长期不同利用方式下土壤pH变幅较小且均为中性,对微生物群落结构影响较小;而水分是一切生命活动的前提,尽管统计分析未能发现土壤含水量与微生物群落演替的显著相关性,但未来仍需开展更加深入研究,尤其针对生理代谢重要的功能群开展进一步分析。

|
注:MC:水分含量;AP:有效磷;AK:速效钾;SOM:土壤有机质;AN:碱解氮;TN:总氮;CEC:阳离子交换量。下同。 Note:MC:moisture content;AP:available phosphorus;AK:available potassium;SOM:soil organic matter;CEC:cation exchange capacity;SOM:soil organic matter;AN:available nitrogen;TN:total nitrogen;CEC:cation exchange capacity. The same below. 图 3 土壤微生物群落组成和土壤理化性质的冗余分析(RDA) Fig. 3 Redundancy analysis of microbial l community composition and soil physicochemical properties |
微生物属与土壤理化性质进行相关性网络分析(图 4)表明:黑土中8个微生物门的35个微生物属与土壤理化性质存在显著相关性(r>0.8,P < 0.05),主要包括酸杆菌、放线菌、芽孢杆菌、绿弯菌、芽孢杆菌。放线菌的微生物属与土壤理化性质仅存在正相关关系,而绿弯菌的微生物属仅与阳离子交换量存在正相关性。此外,共计11个微生物属与土壤理化性质存在负相关性,包括Aquicella、Bacillus、Bryobacter、Candidatus_Koribacter、Chthonomonas、Ellin6055、Gemmatimonas、Gemmatirosa、Granulicella、Noviherbaspirillum和Pirellula微生物属,表明这些微生物属在原位土壤中具有寡营养生长特征,能够更好地适应养分低的土壤,并具有较强的养分竞争能力[35-36]。值得注意的是,Granulicella微生物属与土壤理化性质及其他微生物属关联性最强,表明该微生物属可作为指示菌群,评估黑土环境变化。类似地,已有研究[33]表明华北平原潮土中Gemmatimonas和Flavobacterium也被认为可作为重要的环境指示菌群。未来仍需开展深入研究,全面剖析典型黑土区土壤形成演变过程中的关键指示菌群及其农业环境意义。
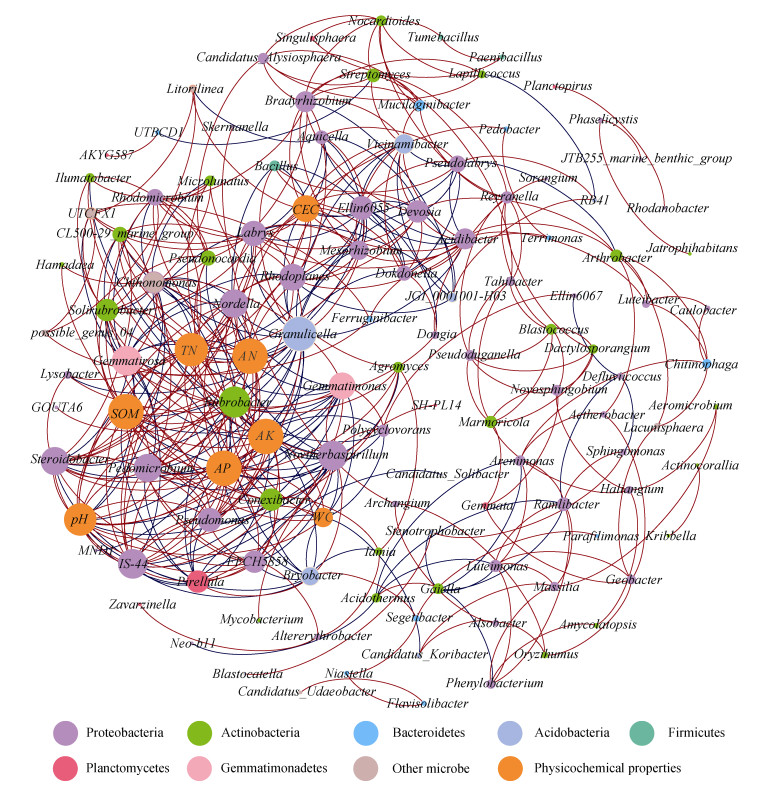
|
注:相关系数Pearson's r>0.8,P < 0.05。节点颜色代表不同门水平的土壤微生物,节点大小代表与其连接的节点数目。红色连接线表示正相关关系,蓝色连接线表示负相关关系。“Other microbe”包括Fibrobacteres、Chloroflexi、Armatimonadetes、Verrucomicrobia菌群。 Note:Pearson's r>0.8,P < 0.05,N = 9,n>6). The color of nodes represented the phylum of soil microbe and the size of nodes related to the frequency of corresponding genes. The red line represented a positive correlation,and the blue line represented a negative correlation. Other microbe included Fibrobacteres,Chloroflexi,Armatimonadetes,Verrucomicrobia. 图 4 土壤属水平微生物群落与理化性质的相关网络分析 Fig. 4 The correlation network analysis between microbial genera and physicochemical properties in black soil |
典型黑土区经过32年保持无植被覆盖、轮作不施肥农田和自然植被生长的土地利用方式,土壤理化性质和微生物群落发生显著分异。与裸地土壤相比,农田和草地土壤中有机质等养分含量显著增加,微生物丰度显著提高,且农田微生物丰度显著低于草地土壤。同时,裸地、农田和草地土壤中的优势微生物类群基本一致,但其群落结构具有显著差异,主要的环境驱动力可能包括阳离子交换量、全氮、有机质、碱解氮、有效磷和速效钾。上述研究结果表明长期植被覆盖是典型黑土区土壤微生物群落演替的重要影响因素,未来应深入研究原位条件下黑土微生物的功能及其农业环境意义,为维系土壤养分良性循环和发展可持续农业生态管理模式提供理论参考。
| [1] |
Guo Y Q, Chen X T, Wu Y T, et al. Natural revegetation of a semiarid habitat alters taxonomic and functional diversity of soil microbial communities[J]. Science of the Total Environment, 2018, 635: 598-606. DOI:10.1016/j.scitotenv.2018.04.171
(  0) 0) |
| [2] |
Zhang J D, Li S Y, Sun X Y, et al. Analysis of soil bacterial diversity in urban parks with different ages by high throughput sequencing (In Chinese)[J]. Microbiology, 2019, 46(1): 65-74. [张骏达, 李素艳, 孙向阳, 等. 基于高通量测序技术的不同年代公园绿地土壤细菌多样性[J]. 微生物学通报, 2019, 46(1): 65-74.]
(  0) 0) |
| [3] |
Zhu Y G, Li G, Zhang G L, et al. Soil security: From earth's critical zone to ecosystem services (In Chinese)[J]. Acta Geographica Sinica, 2015, 70(12): 1859-1869. DOI:10.11821/dlxb201512001 [朱永官, 李刚, 张甘霖, 等. 土壤安全: 从地球关键带到生态系统服务[J]. 地理学报, 2015, 70(12): 1859-1869.]
(  0) 0) |
| [4] |
Yang D W, Zhang M K, Zhang P Q, et al. Evolution of soil in microbiology after reclamation of paddy into orchard (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(1): 182-193. [杨东伟, 章明奎, 张鹏启, 等. 水田改果园后土壤微生物学特性演变[J]. 土壤学报, 2018, 55(1): 182-193.]
(  0) 0) |
| [5] |
Zhang J, Li H L, Wang L, et al. The impact of land use change and long-term fertilization on the microbial communities in acidic soils (In Chinese)[J]. Sichuan Environment, 2017, 36(6): 36-44. DOI:10.3969/j.issn.1001-3644.2017.06.006 [张静, 李会琳, 王岚, 等. 土地利用方式改变以及长期施肥处理对酸性土壤微生物群落结构的影响[J]. 四川环境, 2017, 36(6): 36-44.]
(  0) 0) |
| [6] |
Qin H, Li C X, Ren Q S. Effects of different land use patterns on soil bacterial and fungal biodiversity in the hydro-fluctuation zone of the Three Gorges Reservoir region (In Chinese)[J]. Acta Ecologica Sinica, 2017, 37(10): 3494-3504. [秦红, 李昌晓, 任庆水. 不同土地利用方式对三峡库区消落带土壤细菌和真菌多样性的影响[J]. 生态学报, 2017, 37(10): 3494-3504.]
(  0) 0) |
| [7] |
Zhang Z M, Han X Z, Yan J, et al. Keystone microbiomes revealed by 14 years of field restoration of the degraded agricultural soil under distinct vegetation scenarios[J]. Frontiers in Microbiology, 2020, 11: 1915. DOI:10.3389/fmicb.2020.01915
(  0) 0) |
| [8] |
Carlos F S, Schaffer N, Marcolin E, et al. A long-term no-tillage system can increase enzymatic activity and maintain bacterial richness in paddy fields[J]. Land Degradation & Development, 2021, 32(12). DOI:10.1002/ldr.3896
(  0) 0) |
| [9] |
Schmidt R, Gravuer K, Bossange A V, et al. Long-term use of cover crops and no-till shift soil microbial community life strategies in agricultural soil[J]. PLoS One, 2018, 13(2): e0192953. DOI:10.1371/journal.pone.0192953
(  0) 0) |
| [10] |
Bao S D. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agriculture Press, 2008. [鲍士旦. 土壤农业化学分析方法[M]. 北京: 中国农业出版社, 2008.]
(  0) 0) |
| [11] |
Machmuller M B, Kramer M G, Cyle T K, et al. Emerging land use practices rapidly increase soil organic matter[J]. Nature Communications, 2015, 6: 6995. DOI:10.1038/ncomms7995
(  0) 0) |
| [12] |
Wang C, Liu W, Li Q, et al. Effects of different irrigation and nitrogen regimes on root growth and its correlation with above-ground plant parts in high-yielding wheat under field conditions[J]. Field Crops Research, 2014, 165: 138-149. DOI:10.1016/j.fcr.2014.04.011
(  0) 0) |
| [13] |
Wang Q J, Yang T, Liu Y L, et al. Review of soil nutrient transport in runoff and its controlling measures (In Chinese)[J]. Transactions of the Chinese Society of Agricultural Machinery, 2016, 47(6): 67-82. [王全九, 杨婷, 刘艳丽, 等. 土壤养分随地表径流流失机理与控制措施研究进展[J]. 农业机械学报, 2016, 47(6): 67-82.]
(  0) 0) |
| [14] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [15] |
Jiang H, Zou W X, Han X Z, et al. Effects of land use and fertilization on physical properties of black soil (In Chinese)[J]. Rural Eco-Environment, 2013, 29(5): 599-604. DOI:10.3969/j.issn.1673-4831.2013.05.010 [江恒, 邹文秀, 韩晓增, 等. 土地利用方式和施肥管理对黑土物理性质的影响[J]. 生态与农村环境学报, 2013, 29(5): 599-604.]
(  0) 0) |
| [16] |
Huang S H, Ye C, Zhong Y J, et al. Soil cation exchange capacity and exchangeable base cations as affected by land use pattern in sloping farmland of red soil (In Chinese)[J]. Soil and Crop, 2016, 5(2): 72-77. [黄尚书, 叶川, 钟义军, 等. 不同土地利用方式对红壤坡地土壤阳离子交换量及交换性盐基离子的影响[J]. 土壤与作物, 2016, 5(2): 72-77.]
(  0) 0) |
| [17] |
Wang Y, Zhang Z M, Li X H, et al. Effects of land use type on the abundance of bacteria, crenarchaea, and ammonia-oxidizing archaea in black soil (In Chinese)[J]. Chinese Journal of Ecology, 2013, 32(11): 2931-2936. [王影, 张志明, 李晓慧, 等. 土地利用方式对土壤细菌、泉古菌和氨氧化古菌丰度的影响[J]. 生态学杂志, 2013, 32(11): 2931-2936.]
(  0) 0) |
| [18] |
Yan J, Han X Z, Wang S Y. Variation of soil microoganism under different vegetation coverages and fertilization systems in black soil (In Chinese)[J]. Chinese Journal of Soil Science, 2009, 40(2): 240-244. [严君, 韩晓增, 王守宇. 黑土不同植被覆盖与施肥下土壤微生物的变化特征[J]. 土壤通报, 2009, 40(2): 240-244.]
(  0) 0) |
| [19] |
Zhalnina K, Louie K B, Hao Z, et al. Dynamic root exudate chemistry and microbial substrate preferences drive patterns in rhizosphere microbial community assembly[J]. Nature Microbiology, 2018, 3(4): 470-480. DOI:10.1038/s41564-018-0129-3
(  0) 0) |
| [20] |
Liu Z X, Liu J J, Xu Y X, et al. Effects of continuous cropping years of soybean on the bacterial community structure in black soil (In Chinese)[J]. Acta Ecologica Sinica, 2019, 39(12): 4337-4346. [刘株秀, 刘俊杰, 徐艳霞, 等. 不同大豆连作年限对黑土细菌群落结构的影响[J]. 生态学报, 2019, 39(12): 4337-4346.]
(  0) 0) |
| [21] |
Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of Northeast China[J]. Soil Biology & Biochemistry, 2014, 70: 113-122.
(  0) 0) |
| [22] |
Wang F W, Wang X B, Li J C, et al. Effects of fertilization and straw incorporation on bacterial communities in lime concretion black soil (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2015, 23(10): 1302-1311. [王伏伟, 王晓波, 李金才, 等. 施肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 中国生态农业学报, 2015, 23(10): 1302-1311.]
(  0) 0) |
| [23] |
Jin Z W, Zhong W H, Wu S S, et al. Effect of vegetation degradation on microbial communities in alpine grassland soils in Northwest Yunnan (In Chinese)[J]. Acta Microbiologica Sinica, 2018, 58(12): 2174-2185. [金志薇, 钟文辉, 吴少松, 等. 植被退化对滇西北高寒草地土壤微生物群落的影响[J]. 微生物学报, 2018, 58(12): 2174-2185.]
(  0) 0) |
| [24] |
崔晓. 东北黑土农田功能芽孢杆菌筛选及鉴定[D]. 黑龙江牡丹江: 牡丹江师范学院, 2019. Cui X. Screening and identification of functional bacillus in farmland of black soil in Northeast China[D]. Mudanjiang, Heilongjiang: Mudanjiang Normal University, 2019 (  0) 0) |
| [25] |
Jones R T, Robeson M S, Lauber C L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. ISME Journal, 2009, 3(4): 442-453. DOI:10.1038/ismej.2008.127
(  0) 0) |
| [26] |
Mao J D, Johnson R L, Lehmann J, et al. Abundant and stable char residues in soils: Implications for soil fertility and carbon sequestration[J]. Environmental Science and Technology, 2012, 46(17): 9571-9576. DOI:10.1021/es301107c
(  0) 0) |
| [27] |
Lauber C L, Strickland M S, Bradford M A, et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology & Biochemistry, 2008, 40(9): 2407-2415.
(  0) 0) |
| [28] |
Wagg C, Bender S F, Widmer F, et al. Soil biodiversity and soil community composition determine ecosystem multifunctionality[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(14): 5266-5270. DOI:10.1073/pnas.1320054111
(  0) 0) |
| [29] |
Sun J H, Yang L, Wei J, et al. The responses of soil bacterial communities and enzyme activities to the edaphic properties of coal mining areas in central China[J]. PLoS One, 2020, 15(4): e0231198. DOI:10.1371/journal.pone.0231198
(  0) 0) |
| [30] |
Lai B C, Dai R Q, Wu Z Q, et al. Bacterial diversities in rhizosphere soils at sites of healthy and Fusarium wilt infected chili plants (In Chinese)[J]. Fujian Journal of Agricultural Sciences, 2019, 34(9): 1073-1080. [赖宝春, 戴瑞卿, 吴振强, 等. 辣椒健康植株与患枯萎病植株根际土壤细菌群落多样性的比较研究[J]. 福建农业学报, 2019, 34(9): 1073-1080.]
(  0) 0) |
| [31] |
Liu B R, Xu Q F, Qin H, et al. Bacterial community structure in soils under four main types of vegetation in subtropical area (In Chinese)[J]. Acta Pedologica Sinica, 2012, 49(6): 1185-1193. [刘卜榕, 徐秋芳, 秦华, 等. 亚热带四种主要植被类型土壤细菌群落结构分析[J]. 土壤学报, 2012, 49(6): 1185-1193.]
(  0) 0) |
| [32] |
Gao S, Liang J D, Teng T T, et al. Petroleum contamination evaluation and bacterial community distribution in a historic oilfield located in Loess Plateau in China[J]. Applied Soil Ecology, 2019, 136: 30-42. DOI:10.1016/j.apsoil.2018.12.012
(  0) 0) |
| [33] |
Li F, Chen L, Zhang J B, et al. Bacterial community structure after long-term organic and inorganic fertilization reveals important associations between soil nutrients and specific taxa involved in nutrient transformations[J]. Frontiers in Microbiology, 2017, 8: 187.
(  0) 0) |
| [34] |
Cao C, Zhang Y, Qian W, et al. Land-use changes influence soil bacterial communities in a meadow grassland in Northeast China[J]. Solid Earth, 2017, 8(5): 1119-1129. DOI:10.5194/se-8-1119-2017
(  0) 0) |
| [35] |
Barnard R L, Osborne C A, Firestone M K. Responses of soil bacterial and fungal communities to extreme desiccation and rewetting[J]. ISME Journal, 2013, 7(11): 2229-2241. DOI:10.1038/ismej.2013.104
(  0) 0) |
| [36] |
Ivanova A A, Kulichevskaya I S, Merkel A Y, et al. High diversity of Planctomycetes in soils of two lichen-dominated sub-arctic ecosystems of Northwestern Siberia[J]. Frontiers in Microbiology, 2016, 7: 2065.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


