2. 中国科学院封丘农业生态实验站(中国科学院南京土壤研究所), 南京 210008;
3. 中国科学院大学, 北京 100049
2. Fengqiu Agro-Ecological National Experimental Station, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
近代以来,为缓解人口的剧烈增加带来的粮食危机,人类在农业生产过程中大量使用氮肥[1]。但长此以来,为追求作物产量的提升而过量使用氮肥引发了一系列土壤和环境问题。长期施氮肥导致土壤酸化[2-4],进而导致土壤有机碳溶解性升高[5],影响土壤中有机—无机的复合作用[6],限制土壤肥力的提升。长期大量施氮肥使得部分土壤氮素以硝酸根的形式通过淋溶作用进入地下水,造成农业面源污染[7],另一部分氮肥以气体NH3的形式进入陆地生态系统,降低了生物多样性且导致了整个生态系统的氮富集污染现象[8-10]。不过,长期施用氮肥后,虽然氮肥大部分转化为作物生物量、经淋溶作用流失以及以气体挥发,但仍有相当大部分无机氮残留在土壤中。土壤中这部分无机氮素有益于秸秆降解,即秸秆还田后,通过调节土壤有效态C/N,使土壤细菌处于一个较为适宜的有效态C/N中,这有利于细菌活性增加,进而有益于秸秆的降解[11]。不同施氮水平虽未显著改变土壤微生物的群落和结构,但显著改变了秸秆降解相关的微生物生长速度和丰度,进而导致不同施氮水平下秸秆降解速度不同[12]。
目前国内外对于长期施氮秸秆降解过程中的土壤细菌作用机理研究较少。本研究基于长期不同施氮水平下土壤残留无机氮含量是否存在差异、如何影响秸秆降解前期过程中细菌群落结构演变的科学问题,提出三点假设:1)高施氮水平导致高量的土壤无机氮残留;2)高施氮水平下秸秆降解率高;3)不同施氮水平下秸秆降解前期过程细菌群落结构与共现模式不同。研究采用长期不同施氮水平的潮土,开展短期秸秆降解-土壤培育实验,探究长期不同施氮水平下潮土无机氮的截留与秸秆降解状况,阐明秸秆降解前期过程中潮土细菌群落结构及其网络共现模式的演变特征。本研究可为合理施氮与秸秆高效降解提供一定数据支撑和思路启示。
1 材料与方法 1.1 供试土壤和试验设计供试土壤为潮土,取自中国科学院封丘农业生态实验站(35°00´N,114°24´E)长期定位试验(2005—2018年)[13-16]。选取5个施氮水平(0、150、190、230和270 kg·hm–2·a–1)土壤,记为N0、N1、N2、N3和N4,基本理化性质见表 1。土壤样品过2 mm筛均匀化,备用。
|
|
表 1 长期不同施氮水平下土壤的理化性质 Table 1 Soil physico-chemical properties under long-term different nitrogen |
培养试验每个氮水平各设置2个处理,添加秸秆和未添加秸秆,3个重复,共30个处理。每个处理取100 g土壤(烘干重),加1.714 g灭菌的玉米秸秆(潮土田间秸秆还田标准的2倍,18 kg·hm–2,还至7.5 cm,约为8.57 g·kg–1,为了使培养实验效果更明显,将秸秆投入量加大1倍,即17.14 g·kg–1),混合均匀后放入1 L广口瓶中,用灭菌去离子水调至最大持水量的55%,25℃黑暗培养50 d。
在培养0、3、7、15、25、37、50 d测定各处理CO2浓度:在每个时间点放入10 mL 1 mol·L–1 NaOH溶液,在下一次时间点取出并更换新的碱液。取出的碱液密封放入干燥器保存,收集全部样品后用过量的1 mol·L–1氯化钡溶液沉淀,并用0.5 mol·L–1的盐酸滴定,然后计算CO2含量。在培养0、7、25、50 d采集N0、N1、N4处理土样,–80℃冷冻储藏,用于细菌测序。同时在培养前后,测定所有处理土壤的铵态氮、硝态氮、可溶性有机碳、微生物生物量碳。
1.2 指标测定微生物生物量碳用氯仿熏蒸-硫酸钾浸提法测定;铵态氮用2 mol·L–1的KCl浸提-靛酚蓝比色法测定;硝态氮用双波长紫外分光光度法测定;可溶性有机碳用0.5 mol·L–1的硫酸钾浸提法测定;秸秆降解状况用CO2累积释放量和释放速率表示,计算公式如下[17]:
| $ \begin{array}{l} {\text{C}}{{\text{O}}_2} = \{ [({V_0} - V) \times c \times 0.022 \times (22.4/44) \times 1000 \times 2 \times \hfill \\ \;\;\;\;\;\;\;\;\;\;1000]\} /m \hfill \\ \end{array} $ | (1) |
式中,CO2为每千克土壤释放的二氧化碳体积(mL·kg–1);V0为空白滴定时消耗标准盐酸的体积(mL);V为样品滴定时消耗标准盐酸的体积(mL);c为标准盐酸的浓度(mol·L–1);0.022为二氧化碳(0.5CO2)的摩尔质量,M(0.5CO2)=0.22 g·mmol–1;22.4/44×1000为标准状态下每克CO2的毫升数。
1.3 土壤DNA提取和测序培养结束后,用Fast DNA Spin Kit for Soil试剂盒(MP Biomedicals,美国)提取样品土壤基因组DNA。用1.0%的琼脂糖凝胶电泳检测(电压110 V,30 min)DNA的提取效果,DNA浓度及纯度利用超微量分光光度计(Spectra Max® Quick Drop™,Molecular Devices公司,美国)测定,冷冻保存于–80℃冰箱待用。待所有样品DNA提取结束后,用冰袋保存送至百诺盛信息技术服务有限公司(Binosun),测定土壤细菌群落的组成和多样性。
1.4 数据分析各处理数据利用Microsoft Excel 2010和Origin 8.0进行分析绘图,采用SPSS 25.0软件进行单因素方差分析和LSD多重比较检验各处理间差异的显著性(α = 0.05)。基于土壤细菌高通量测序得到OTU聚类、α多样性和β多样性等数据。然后基于α多样性数据进行Shannon分析,基于OTU进行群落组成分析,基于β多样性进行P CoA统计分析和作图。最后,基于OUT进行网络构建和分析。
1.5 网络分析基于焦磷酸测序数据进行网络分析旨在探究微生物间的相互关系和关键物种。细菌丰富度数据序列依据每个样品的最低数据序列被稀释为2 079。在MINE软件中用最大信息系数(maximal information coefficient,MIC)得分进行网络分析。最大信息系数是一个非常有用的分数,用来揭示变量之间的线性和非线性关联的强度。为减少两两比较以及管理错误发现率(FDR),对经SIMPER识别的OTUs进行了网络分析,其中OTUs在各处理间的细菌中存有90%的差异。这样共筛选1 390个OTUs。在Cytoscape 3.2.0版本中,FDR为5%时微生物群落与处理之间的显著关系被可视化。从两两比较中,选出了整体和个体网络中最重要的193个交互作用。为了突出微生物间最重要的相互关系,只有强正相关性(r > 0.8)、强负相关性(r > 0.8)和强非线性(MIC2 > 0.8)在网络图中展示。为评估合成网络中的非随机性,使用Cytoscape v2.6.1中的Randomnetworks插件中的Barbasi-Albert模型将网络与随机版本进行了比较,发现整体网络的聚类系数、平均度、度分布、平均最短路径等结构属性与等节点数、等边数的随机网络存在显著差异。根据节点的模内连通性Zi和Pi确定各节点的连通性。节点拓扑分为四类:(1)模块点(模块内高度连接的节点,Zi > 2.5);(2)网络点(全网络内高度连接节点,Zi > 2.5,Pi > 0.62);(3)连接点(连接模块的节点,Pi > 0.62);(4)外部点(外部连接较少的模块内节点,Zi < 2.5,Pi < 0.62)。
2 结果 2.1 长期不同施氮水平下土壤无机氮含量状况研究结果显示,长期施氮水平越高,土壤中无机氮(硝态氮和铵态氮)含量就越高,表现为N0(18.25 mg·kg–1) < N1(21.12 mg·kg–1) < N2(44.70 mg·kg–1) < N3(57.80 mg·kg–1) < N4(72.13 mg·kg–1)。这表明长期不同的施氮水平下土壤残留氮含量不同,在一定范围内,土壤无机氮含量随着施氮水平的升高而增加。
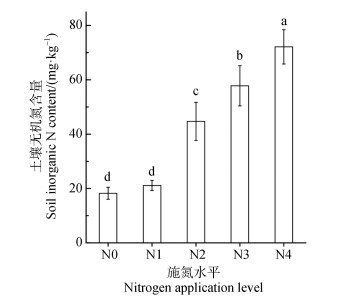
|
注:N0、N1、N2、N3、N4施氮水平分别为0、150、190、230、270 kg·hm–2·a–1。 Note: N application levels of N0, N1, N2, N3 and N4 were 0, 150, 190, 230 and 270 kg·hm–2·a–1, respectively. 图 1 长期不同施氮后土壤无机氮(硝态氮和铵态氮)的含量 Fig. 1 Content of inorganic N(NO3–-N and NH4+-N) after long-term application of nitrogen |
经过50 d室内培养后,随着长期施氮量的增加,土壤CO2累积释放量越大(除了N2处理),表现为N4(65.59 μg·g–1) > N2(59.04 μg·g–1) > N3(57.22 μg·g–1) > N1(47.57 μg·g–1) > N0(38.08 μg·g–1)(图 2a)。在培养阶段0~38 d,随着长期施氮量的增加,土壤CO2累积释放量越大。所有的处理CO2释放速率都随着培养时间的增加而逐渐减小(图 2b)。在培养初始阶段,CO2释放速率表现为N4(0.22 μg·g–1·h–1) > N3(0.21 μg·g–1·h–1) > N2(0.16 μg·g–1·h–1) > N1(0.14 μg·g–1·h–1) > N0(0.11 μg·g–1·h–1)。在整个培养期间,土壤CO2累积释放量随着长期施氮水平的增加而增加(图 3)。本研究结果表明,随着长期施氮水平的升高,对秸秆降解效率的潜力提高趋势。
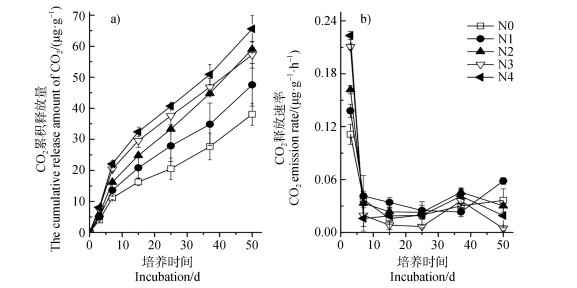
|
图 2 CO2累积释放量和其释放速率随时间的变化 Fig. 2 Temporal variation of the cumulative release amount and emission rate of CO2 over the 50-day incubation period |
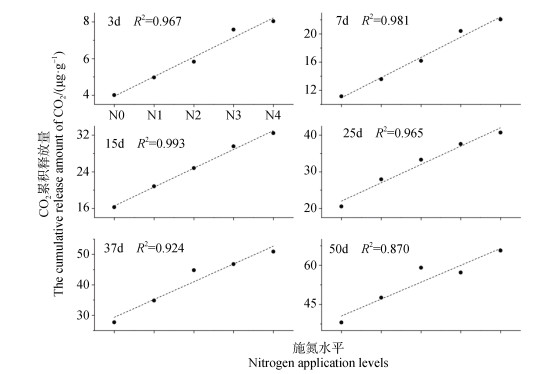
|
图 3 CO2累积释放量随施氮水平的变化 Fig. 3 Temporal variation of the cumulative release amount of CO2 with nitrogen application level |
培养结束后,与培养前相比,土壤的微生物生物量碳显著增加(P < 0.05),其总体上随着长期施氮水平的增高而增高(图 4)。培养结束后,相对于对照组(N0),长期施氮下的土壤细菌OTUs及其多样性呈不同程度的增加(图 5a,图 5b),且各处理土壤细菌群落存在显著性差异(图 5c,P < 0.01)。所有处理土壤细菌群落在不同的培养阶段均(沿NMDS 2轴)彼此分离,且也均随着培养时间(沿NMDS 1轴)呈现从左向右相同的演替规律(图 5c)。由图 5d可知,随着长期施氮量的增加,土壤中酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和β-变形菌纲(Betaproteobacteria)的相对丰度减小,厚壁菌门(Firmicutes)和γ-变形菌纲(Gammaproteobacteria)的相对丰度增加,表明长期不同施氮水平显著影响土壤细菌群落组成。

|
图 4 不同氮水平对土壤微生物生物量碳的影响 Fig. 4 Effects of different level nitrogen application on soil MBC |
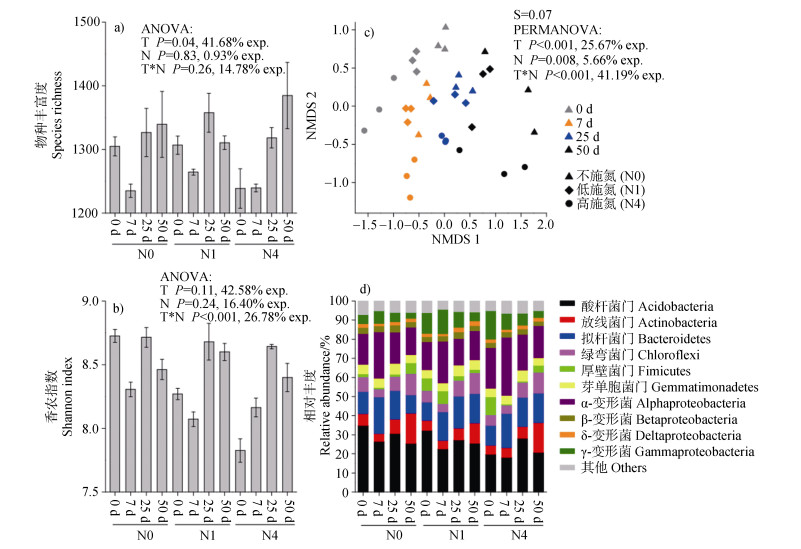
|
注:a表示土壤细菌OTU数量;b表示土壤细菌群落香农指数;c表示土壤细菌量群落随着培养时间的演替;d表示土壤细菌组成群落。 Note: a) The number of OTUs at different nitrogen application levels. b) Shannon index of different nitrogen application levels. c) Soil bacterial community structure was successively changed with the incubation time. d) Community composition was measured by the relative abundance of major phyla and classes for bacterial 16S rRNA. 图 5 长期(14年)施用氮肥后土壤细菌群落结构、多样性和组成成分的变化 Fig. 5 Changes of soil bacterial community structure, diversity and composition after long-term(14 years) application of nitrogen |
培养结束后,与培养前相比,拟杆菌门(Bacteroidetes)的相对丰度在N0处理减小,在N1和N4处理增加;酸杆菌门(Acidobacteria)的相对丰度在N0和N1处理减小,在N4处理没有明显变化;放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)的相对丰度在所有处理均增加。长期不同施氮水平下在秸秆降解过程中,细菌群落发生了明显改变。
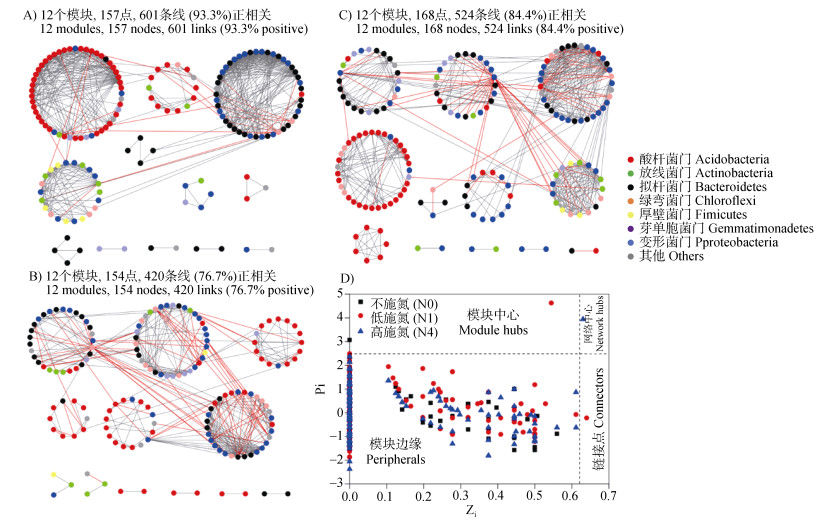
2.4 秸秆降解过程中不同施氮水平下细菌群落物种间的相互关系相比于N0的网络结构,N1和N4的网络结构较为简单,N1和N4处理具有较少的线条和点以及较低的平均连通性(表 2,图 6)。N1和N4处理的网络平均路径距离较N0处理高,而其平均聚类系数更低。N0处理共有157个点和601条线和,其中561条线(93.3%)起显著正向关联作用(图 6a),而N1处理具有较少的点(154)和线(420),N4处理具有较多的点(168)和较少的线(524),但三个网络结构均有12个模块。相较于N0处理网络起主导作用的是变形菌和酸杆菌门,N1和N4处理网络酸杆菌门作用较大。本研究通过Zi-Pi图来评估网络图中分类单元的拓扑作用。可以发现三个网络的绝大部分点均在外围(图 6d),N1处理网络仅一个点位于中心,柠檬酸杆菌(Citrobacter),属于酸杆菌门;N4网络中也只有一个点位于中心,不动杆菌(Acinetobacter),属于变形菌门。相较于长期不施氮肥土壤,在秸秆降解过程中,长期施氮肥土壤细菌间潜在的相互关系可能发生了改变,变形菌主导地位减弱、酸杆菌主导地位增强,群落内物种之间的竞争性可能变得更为强烈,某些关键中枢细菌突显出来,如不动杆菌、柠檬酸杆菌。
|
|
表 2 细菌群落的实验网络及其关联随机网络的拓扑特性 Table 2 Topological properties of the empirical ecological networks(MENs) of microbial communities in and their associate random MENs |
|
注:A)表示不施氮处理;B)表示低施氮水平处理;C)表示高施氮水平处理;D)通过Z-P图表示不同施氮水平下土壤中关键物种的节点分类。 Note: A) Ecological network of soil bacterial species at no N level. B) Ecological network of soil bacterial species at low N level. C) Ecological network of soil bacterial species at high N level. D) Z-P plot showing the classification of nodes to identify putative keystone species in different level nitrogen soils. The colors of nodes indicate different major phyla. A red link indicates negative interaction between two individual nodes, whereas a blue link indicates positive interaction. 图 6 长期(14年)施用氮肥后土壤细菌物种生态网络关系 Fig. 6 Network interactions between soil bacterial in different level nitrogen soils after long-term(14 years) application of nitrogen |
本研究结果显示,长期不同施氮水平下土壤的无机氮含量也不同,在一定范围内,土壤无机氮含量随着长期施氮量的增加而增加。这一研究与张福锁等[2]研究一致,其研究表明在中国北方干旱区,长期过量使用氮肥导致土壤存有较高的无机氮含量。长期过量使用氮肥后,除大部分经植物吸收用于自身生长发育、随水淋失、遇热挥发等外[18-19],其余部分残留在土壤中,使得土壤无机氮素含量增加。因而,长期施氮量不同,土壤残留无机氮素含量不同。
本研究结果表明,秸秆加入土壤后,在整个培养期间,CO2累积释放量和CO2释放速率随着长期施氮量的增加整体上呈现增大的趋势,与前人研究一致[20]。这是因为长期不同施氮水平下土壤无机氮含量也随之不同,较高的施氮量使土壤存有较大的残留氮素含量。添加等量秸秆后,土壤有效态C/N随着土壤无机氮素含量的增加而降低。即随着土壤无机氮量的增加,为微生物繁殖提供了较好的营养条件,故而一定环境条件下,土壤有效态氮素含量越高,秸秆降解的量就越大。此外,本研究发现,在整个秸秆降解期间,前期(前3天)的CO2释放速率比后期大,这与Chen等[21]研究结果一致。植物残体中的有机碳分为两大类:易于降解的部分(如淀粉和葡萄糖)和难降解的部分(如木质素)[22]。在培养前期阶段,土壤细菌易于利用秸秆中易降解的部分,快速降解秸秆,CO2释放速率较大;在培养后期阶段,土壤细菌难于利用秸秆中难降解的部分,使得秸秆降解速率慢,达到稳定的阶段,CO2释放速率较小,在这个阶段,主要是真菌在起作用。值得注意的是,本研究内容主要集中在秸秆降解的前期阶段,而未开展秸秆降解的后期阶段,为更好地阐明秸秆降解过程,将在以后进行长期秸秆降解的探究,探究在整个秸秆降解过程中,土壤微生物群落(真菌和细菌)如何变化。
3.2 土壤细菌群落对长期不同施氮量的响应及其在秸秆降解过程中变化特征土壤细菌群落结构体现了细菌群落组成、决定了细菌功能,这很大程度上决定了土壤细菌的生物过程,在有机物质(动植物残体等)降解、有机质的合成和土壤颗粒团聚化等过程起着关键作用[23]。如图 5所示,土壤细菌群落随着长期施氮水平的不同而彼此分离,这表明长期施氮量的不同,细菌群落结构也不相同,土壤细菌群落存在着显著(P < 0.05)差异。适量的土壤无机氮素增加促进了某些富营养型细菌的生长发育,抑制了某些贫养型细菌的生长发育,进而改变了两者丰度的相对比例,导致土壤细菌群落发生改变[24]。如本研究中随着长期施氮含量的增加,酸杆菌、放线菌和绿弯菌门相对丰度)减小,而厚壁菌门和γ-变形菌纲相对丰度增加(图 5d)。此外,本研究发现,长期不同施氮水平下土壤细菌多样性随着施氮水平的增加而呈现减小的趋势,这与Campbell等[25]研究结果相一致。但Fierer等[26]研究发现氮肥的使用对细菌多样性影响较小,却显著(P < 0.05)改变了细菌群落结构,使得富营养型细菌相对丰度增加,而贫养型细菌相对丰度降低。Ramirez等[27]通过微观实验研究也发现氮素的使用显著(P < 0.05)改变了细菌的群落结构。因此,可以确定的是,氮素的使用显著(P < 0.05)改变了细菌的群落结构。氮肥的使用对细菌多样性影响的研究不一致,可能由所选用的土壤类型导致的,具体原因有待于进一步研究。
秸秆降解过程中,所有处理细菌群落都发生演替。与培养前相比,培养结束后,不施氮土壤细菌多样性降低,施氮处理下(N1和N4)土壤细菌多样性增加。加入秸秆后,土壤有效态C/N随着长期施氮量的增加而减小。在不同有效态C/N条件下,土壤细菌种群的活性不同,相对丰度不同,因而细菌群落多样性和群落结构也不同[28-29]。随着培养进行,土壤细菌群落消耗土壤有效态碳源用于自身的新陈代谢,导致各处理的土壤有效态C/N发生变化,随后土壤细菌群落发生演替。对于不施氮处理(N0),土壤无机氮含量较低,不足以提供秸秆降解所需的足够氮源,因而与培养前相比,土壤细菌多样性降低;又因充足的碳源,随着秸秆降解过程的进行,土壤有效态C/N发生变化,因此细菌群落发生演替。对于施氮处理(N1和N4),土壤无机氮含量较大,能够提供秸秆降解所需的足够氮源,因此,培养结束后,土壤细菌多样性增加,其群落发生演替。
3.3 秸秆降解过程中不同氮水平下细菌物种之间的关系细菌生态系统的成员根据自身的营养偏好和功能特性分布于一定的营养水平或生态位[30-31]。因此,为了更加深入理解秸秆降解,我们需要探究细菌物种间的相互关系。网络分析法可以识别非随机的相互作用,并提供细菌生态系统整体观点[32]。本研究发现,与培养前相比,秸秆降解后,相对不施氮处理(N0,6.7%),施氮处理下(N1和N4)土壤细菌群落物种之间的关系负相关性增加,分别为23.3%和15.6%。这可能由于在一定的范围内随着土壤有效态C/N的减小(N0(C/N=15) > N1(C/N=10) > N4(C/N=6)),土壤中可供细菌使用的有效碳氮源减小,不足于供给所有的细菌生长发育,因而细菌群落物种间可能争相竞争资源用于自身生长。本研究的不同施氮水平下细菌的丰富度和多样性结论(相对于不施氮处理,施氮处理下(N1和N4)细菌的丰富度和多样性呈现不同程度地增加)也佐证了这一观点。但与Blagodatskaya和Kuzyakov[30]及Mau等[31]研究结果不一致。这可能与研究对象土壤中碳氮的资源丰富度有关。一般情况下,资源丰富时,细菌群落内竞争关系较弱,体现为彼此间负相关性较弱,且存有负相关性的物种数较少;资源匮乏时,群落内竞争关系较强,体现为彼此间负相关性较强,且存有负相关性的物种数较多[24]。本研究中,各处理土壤有效态碳源的含量一致,氮源的含量随着长期施氮水平的增加而增加,因而土壤有效态C/N随着长期施氮水平的增加而减小,适宜于细菌的生长发育的有效碳氮含量相对减小。细菌喜爱于适宜的土壤有效态C/N中生长发育[29]。因此,秸秆降解过程中,相对于不施氮处理,施氮处理下的土壤有效态C/N不适中,不适宜于细菌的生长发育,细菌间的竞争关系有可能较强,体现为彼此间负相关性较强,且存有负相关性的物种数较多。因此,对于长期高量施氮土壤,可以适当增加秸秆还田量。
4 结论长期不同施氮水平下土壤无机氮含量不同,在一定范围内,土壤无机氮含量随着施氮水平的升高而增加。在秸秆降解过程中,随着长期施氮水平的升高,由于土壤无机氮含量随之增加,所以秸秆的降解效率也就随之增大。土壤细菌群落结构随着长期不同施氮肥含量而不同,其群落存在着显著差异。土壤无机氮素含量的增加,促进了某些富营养型细菌的生长发育,抑制了某些贫养型细菌的生长发育,进而改变了两者之间丰度的相对比例,导致土壤细菌群落发生改变。
| [1] |
Geisseler D, Scow K M. Long-term effects of mineral fertilizers on soil microorganisms - A review[J]. Soil Biology & Biochemistry, 2014, 75: 54-63.
(  0) 0) |
| [2] |
Zhang F S, Wang J Q, Zhang W F, et al. Nutrient use efficiencies of major cereal crops in China and measures for improvement (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(5): 915-924. DOI:10.3321/j.issn:0564-3929.2008.05.018 [张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924.]
(  0) 0) |
| [3] |
Schroder J L, Zhang H L, Girma K, et al. Soil acidification from long-term use of nitrogen fertilizers on winter wheat[J]. Soil Science Society of America Journal, 2011, 75(3): 957-964. DOI:10.2136/sssaj2010.0187
(  0) 0) |
| [4] |
Lu X, Mao Q, Gilliam F S, et al. Nitrogen deposition contributes to soil acidification in tropical ecosystems[J]. Global Change Biology, 2014, 20(12): 3790-3801. DOI:10.1111/gcb.12665
(  0) 0) |
| [5] |
Vance G F, David M B. Forest soil response to acid and salt additions-of sulfate[J]. Soil Science, 1991, 151(4): 297-305. DOI:10.1097/00010694-199104000-00005
(  0) 0) |
| [6] |
Oades J M. An introduction to organic matter in mineral soils[J]. Minerals in Soil Environments, 1989, 89-159.
(  0) 0) |
| [7] |
Ju X T, Xing G X, Chen X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3041-3046. DOI:10.1073/pnas.0813417106
(  0) 0) |
| [8] |
Chen Q, Zhang X S, Zhang H Y, et al. Evaluation of current fertilizer practice and soil fertility in vegetable production in the Beijing region[J]. Nutrient Cycling in Agroecosystems, 2004, 69(1): 51-58. DOI:10.1023/B:FRES.0000025293.99199.ff
(  0) 0) |
| [9] |
Ju X T, Kou C L, Zhang F S, et al. Nitrogen balance and groundwater nitrate contamination: Comparison among three intensive cropping systems on the North China Plain[J]. Environmental Pollution, 2006, 143(1): 117-125. DOI:10.1016/j.envpol.2005.11.005
(  0) 0) |
| [10] |
Malińska K, Zabochnicka-Świątek M, Dach J. Effects of biochar amendment on ammonia emission during composting of sewage sludge[J]. Ecological Engineering, 2014, 71: 474-478. DOI:10.1016/j.ecoleng.2014.07.012
(  0) 0) |
| [11] |
Zhou J, Jiang X, Ma M C, et al. Effects of long-term nitrogen fertilization on soil fertility and microorganism: A review (In Chinese)[J]. Soil and Fertilizer Sciences in China, 2016(6): 8-13. [周晶, 姜昕, 马鸣超, 等. 长期施氮对土壤肥力及土壤微生物的影响[J]. 中国土壤与肥料, 2016(6): 8-13.]
(  0) 0) |
| [12] |
Zhong Y, Liu J, Jia X Y, et al. Microbial community assembly and metabolic function during wheat straw decomposition under different nitrogen fertilization treatments[J]. Biology and Fertility of Soils, 2020, 56(5): 697-710. DOI:10.1007/s00374-020-01438-z
(  0) 0) |
| [13] |
Chen L, Zhang J B, Zhao B Z, et al. Soil fertility and its response to drying-wetting alternation as affected by nitrogen fertilization rate (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(4): 675-683. [陈林, 张佳宝, 赵炳梓, 等. 不同施氮水平下土壤的生化性质对干湿交替的响应[J]. 土壤学报, 2013, 50(4): 675-683.]
(  0) 0) |
| [14] |
Chen L, Zhang J B, Zhao B Z, et al. Dynamics of nitrogen in topsoil related to integrated water and nitrogen management (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(3): 459-468. [陈林, 张佳宝, 赵炳梓, 等. 不同水氮耦合管理下耕层土壤的氮动态[J]. 土壤学报, 2013, 50(3): 459-468.]
(  0) 0) |
| [15] |
Huang P, Zhang J B, Zhu A N, et al. Nitrate accumulation and leaching potential reduced by coupled water and nitrogen management in the Huang-Huai-Hai Plain[J]. Science of the Total Environment, 2018, 610/611: 1020-1028. DOI:10.1016/j.scitotenv.2017.08.127
(  0) 0) |
| [16] |
Huang P, Zhang J B, Zhu A N, et al. Coupled water and nitrogen(N) management as a key strategy for the mitigation of gaseous N losses in the Huang-Huai-Hai Plain[J]. Biology and Fertility of Soils, 2015, 51(3): 333-342. DOI:10.1007/s00374-014-0981-0
(  0) 0) |
| [17] |
Zhang J, Huang J S, Liu J, et al. Carbon dioxide emissions and organic carbon contents of fluvo-aquic soil as influenced by straw and lignin and their biochars (In Chinese)[J]. Journal of Agro-Environment Science, 2015, 34(2): 401-408. [张杰, 黄金生, 刘佳, 等. 秸秆、木质素及其生物炭对潮土CO2释放及有机碳含量的影响[J]. 农业环境科学学报, 2015, 34(2): 401-408.]
(  0) 0) |
| [18] |
Dalal R C, Wang W J, Robertson G P, et al. Nitrous oxide emission from Australian agricultural lands and mitigation options: A review[J]. Soil Research, 2003, 41(2): 165. DOI:10.1071/SR02064
(  0) 0) |
| [19] |
Galloway J N, Townsend A R, Erisman J W, et al. Transformation of the nitrogen cycle: Recent trends, questions, and potential solutions[J]. Science, 2008, 320(5878): 889-892. DOI:10.1126/science.1136674
(  0) 0) |
| [20] |
Wang J B, Zhu T C, Ni H W, et al. Effects of elevated CO2 and nitrogen deposition on ecosystem carbon fluxes on the Sanjiang plain wetland in Northeast China[J]. PLoS One, 2013, 8(6): e66563. DOI:10.1371/journal.pone.0066563
(  0) 0) |
| [21] |
Chen L, Zhang J B, Zhao B Z, et al. Carbon mineralization and microbial attributes in straw-amended soils as affected by moisture levels[J]. Pedosphere, 2014, 24(2): 167-177. DOI:10.1016/S1002-0160(14)60003-5
(  0) 0) |
| [22] |
Milner P, Ralevic V, Hopwood A M, et al. Ultrastructural localisation of substance P and choline acetyltransferase in endothelial cells of rat coronary artery and release of substance P and acetylcholine during hypoxia[J]. Experientia, 1989, 45(2): 121-125. DOI:10.1007/BF01954843
(  0) 0) |
| [23] |
Banerjee S, Kirkby C A, Schmutter D, et al. Network analysis reveals functional redundancy and keystone taxa amongst bacterial and fungal communities during organic matter decomposition in an arable soil[J]. Soil Biology & Biochemistry, 2016, 97: 188-198.
(  0) 0) |
| [24] |
Jackson L E. Ecology in Agriculture . Academic Press, 1997.
(  0) 0) |
| [25] |
Campbell B J, Polson S W, Hanson T E, et al. The effect of nutrient deposition on bacterial communities in Arctic tundra soil[J]. Environmental Microbiology, 2010, 12(7): 1842-1854. DOI:10.1111/j.1462-2920.2010.02189.x
(  0) 0) |
| [26] |
Fierer N, Lauber C L, Ramirez K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6(5): 1007-1017.
(  0) 0) |
| [27] |
Ramirez K S, Craine J M, Fierer N. Consistent effects of nitrogen amendments on soil microbial communities and processes across biomes[J]. Global Change Biology, 2012, 18(6): 1918-1927.
(  0) 0) |
| [28] |
Zhang X F, Xu S J, Li C M, et al. The soil carbon/nitrogen ratio and moisture affect microbial community structures in alkaline permafrost-affected soils with different vegetation types on the Tibetan Plateau[J]. Research in Microbiology, 2014, 165(2): 128-139.
(  0) 0) |
| [29] |
Livesley S J, Ossola A, Threlfall C G, et al. Soil carbon and carbon/nitrogen ratio change under tree canopy, tall grass, and turf grass areas of urban green space[J]. Journal of Environmental Quality, 2016, 45(1): 215-223.
(  0) 0) |
| [30] |
Blagodatskaya Е, Kuzyakov Y. Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure: Critical review[J]. Biology and Fertility of Soils, 2008, 45(2): 115-131.
(  0) 0) |
| [31] |
Mau R L, Liu C M, Aziz M, et al. Linking soil bacterial biodiversity and soil carbon stability[J]. The ISME Journal, 2015, 9(6): 1477-1480.
(  0) 0) |
| [32] |
Bissett A, Brown M V, Siciliano S D, et al. Microbial community responses to anthropogenically induced environmental change: Towards a systems approach[J]. Ecology Letters, 2013, 16: 128-139.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


