2. 中国科学院大学现代农业科学学院, 北京 100049
2. College of Advanced Agricultural Sciences, University of Chinese Academy of Sciences, Beijing 100049, China
磷是所有生命体所必须的营养元素之一,在合成遗传物质(DNA、RNA)、能量传递物质ATP等基本生化反应中扮演着重要的角色,也是组成生物体支撑结构如膜结构、骨骼等不可或缺的元素[1]。长期以来,磷一直被认为是陆地生态系统中仅次于氮的第二大限制植物生长的养分[2]。磷矿石是磷元素的重要来源,磷作为肥料应用于农业以来,大量的磷矿石被开采以制作磷肥,近年来,每年约有2 200万吨开采自磷矿石中的磷被投入世界经济[3],然而,磷矿石是一种有限且不可再生的资源,有报道称目前已知的储量仅能满足50~100年的需求[4]。磷在土壤中易被固定,导致磷的有效性和利用率低下、在土壤中过度积累以及环境风险的增加。
微生物在土壤磷循环中起着重要的作用,解磷菌能够通过自身代谢或与其他生物协同作用将固定态磷转化为可溶态(植物可利用态)磷,对其利用是提高土壤磷有效性最环保、经济的方式[5]。解磷菌已被广泛用于开发生物肥料,可用作化学肥料的补充剂和环保型磷生物肥料,巨大芽孢杆菌是一种重要的且研究较为广泛的解磷菌,具有很强的解磷作用。有研究表明巨大芽孢杆菌的施用可以增加土壤细菌和真菌的群落丰富度,提高土壤有效磷含量,并可减少10%~20%的磷肥施用量[6]。
藻类在农业中作为生物肥料和土壤改良剂也越来越受到人们的关注。小球藻由于生长速度快、易培养利用,越来越受到科学研究和工业生产的关注,在农业中作为生物肥料也受到了越来越多的关注和研究[7],成为最重要的养殖和商业使用微藻品种之一。小球藻在农业中用作微藻生物肥料可以增加土壤养分、改善土壤质量,提高植物种子发芽率、产量以及果实质量[8-9]。
藻类和细菌在土壤中共同存在,共同影响着生态系统,并具有密切的相互作用关系,互相影响着彼此的生理功能和新陈代谢,且具有共生、竞争、寄生等生物间存在的全部相互作用关系[10]。藻菌相互作用受到越来越多的关注和研究,藻菌复合体也广泛应用于废水处理、重金属污染的生物修复、生物燃料的生产等方面[11],然而其在农业方面的应用还比较少,解磷菌和藻类生物肥料通常单独研究和应用,其配合施用是否对土壤磷循环产生更好的促进效果尚不明确。基于以上研究背景,本研究拟通过室内培养试验探索如下问题:(1)巨大芽孢杆菌和小球藻配合施用对水稻土磷有效性有何影响;(2)巨大芽孢杆菌和小球藻配合施用对水稻土微生物组成和活性有何影响,以期为藻、菌生物肥的开发和利用提供理论基础,通过微生物方式提高土壤磷的有效性和利用率,促进作物生长的同时减少磷肥的施用、降低由磷积累所带来的水体富营养化等环境风险。
1 材料与方法 1.1 供试材料供试土壤为采自江苏句容水稻田的耕层土壤(0~20 cm)。将采集的新鲜土壤置于阴凉处自然风干,剔除石子、植物根系、秸秆等杂物,过10目筛,备用。
供试细菌为巨大芽孢杆菌(Bacillus megaterium),菌株编号:1.223,购买自中国普通微生物菌种保藏管理中心。将其接种于灭菌的LB液体培养基中,于30℃,180 r·min–1的条件下培养18 h,得到处于指数生长期的菌悬液(OD600=0.8),备用。
供试藻种为普通小球藻(Chlorella vulgaris),编号:FACHB-8,购买自中国科学院淡水藻种库。将其接种于灭菌的BG11培养基中,置于25℃,12 h/12 h温室中培养至生长对数期(OD680=1.0),备用。
1.2 试验设计称取40 g土壤置于50 mL烧杯中,加入蒸馏水30 mL至土壤淹水,上覆水液面高约1 cm,在上覆水中加入藻液、菌液,设置如下4个处理:1)对照(CK);2)添加小球藻液5 mL和蒸馏水5 mL(A);3)添加巨大芽孢杆菌菌液5 mL和蒸馏水5 mL(B);4)添加小球藻液5 mL和巨大芽孢杆菌菌液5 mL(A+B),每个处理设15个重复,完全随机排列。为保证上述藻液、菌液添加量一致,加入前分别将预培养的藻液、菌液混合均匀,并测定各自的吸光度,其中藻液OD680为1.0、菌液OD600为0.8。将烧杯置于28℃/22℃,12 h/12 h恒温培养箱培养30 d。每隔3 d添加蒸馏水以保持上覆水高度始终保持在1 cm左右。每组处理分别在培养0、3、7、15、30 d后采集3个重复测定各指标。
1.3 测定指标及方法 1.3.1 土壤理化性质土壤有效磷含量测定使用NaHCO3浸提—钼锑抗比色法[12]。土壤pH、总有机碳(TOC)、全氮(TN)采用常规土壤农化方法测定[12]。土壤pH使用pH计(pHS-3C,上海雷磁)测定,水土比为2.5:1;可溶性有机碳含量使用TOC分析仪(Vario TOC,德国Elementar)测定;总有机碳含量使用高温外热氧化-亚铁滴定法[12];全氮含量使用流动分析仪(Skalar San++ System,荷兰Skalar仪器公司)测定。
1.3.2 土壤微生物高通量测序培养第30天采集各处理土壤样品5~10 g,置于–80℃保存。通过16S/18S rRNA基因扩增子高通量测序来分析土壤微生物群落的组成和多样性。首先,使用土壤DNA提取试剂盒(FastDNA™ SPIN Kit for Soil,MP Biomedicals)对土壤样品中的DNA进行提取,使用1%的琼脂糖凝胶电泳检测DNA的纯度和浓度。利用引物341F(CCTACGGGRBGCASCAG)/806R(GGACTACNNGGGTATCTAAT)对细菌16S rRNA基因的V3~V4区域进行扩增,利用引物528F(GCGGTAATTCCAGCTCCAA)/706R(AATCCRAGAATTTCACCTCT)对真核微生物18S rRNA基因的V4区域进行扩增。PCR扩增程序包括:预变性95℃,5 min;(94℃,1 min;57℃,45 s;72℃,1 min)×34个循环;72℃,10 min;16℃,5 min。对PCR产物进行磁珠纯化,采用酶标定量,然后等量混样。使用建库试剂盒(TruSeq DNA PCR-Free Library Preparation Kit)进行文库构建,构建好的文库使用Qubit@ 2.0 Fluorometer(Thermo Scientific)和Agilent Bioanalyzer 2100 system进行库检,库检合格后,使用Illumina NovaSeq 6000进行上机测序,测序服务委托天津诺禾致源生物信息科技有限公司完成。
高通量测序所得原始数据处理流程如下:(1)根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH(V1.2.7)对每个样本的reads进行拼接,得到原始Tags数据(Raw Tags);(2)Raw Tags经过Tags截取和长度过滤、与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到有效数据(Effective Tags);(3)利用Uparse(v7.0.1001)软件按照97%的序列相似度将Effective Tags聚类为操作分类单元(Operational Taxonomic Units,OTUs),筛选OTUs中出现频数最高的序列作为OTUs的代表序列;(4)利用RDP Classifier(Version 2.2)和Silva132数据库以0.6~1为阈值对OTUs序列进行物种注释,并在各个分类水平统计各样本的群落组成;(5)使用MUSCLE(Version 3.8.31)软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系;(6)最后对各样本的数据以样本中数据量最少的为标准进行均一化处理。
1.3.3 微量热分析对初始土样和培养第30天采集的各处理土壤样品进行微量热分析[13]。取1 g风干土壤样品置于4 mL安瓿瓶中,加入200 μL蒸馏水预培养12 h,预培养后加入40 μL浓度为50 g·L–1的葡萄糖溶液作为底物,安瓿瓶加盖使其密闭,然后将安瓿瓶置于TAM III微量热仪(TA Instrument,Delaware,美国)中检测放热速率,油浴体系温度恒定为25℃。监测土壤样品的放热功率随时间变化的情况,表征土壤微生物的代谢放热情况。
1.4 数据处理使用Excel处理原始数据,所有结果用平均数±标准差表示。使用SPSS22.0进行差异显著性分析、多重比较和相关性分析,显著性水平为P < 0.05。使用Origin进行绘图。
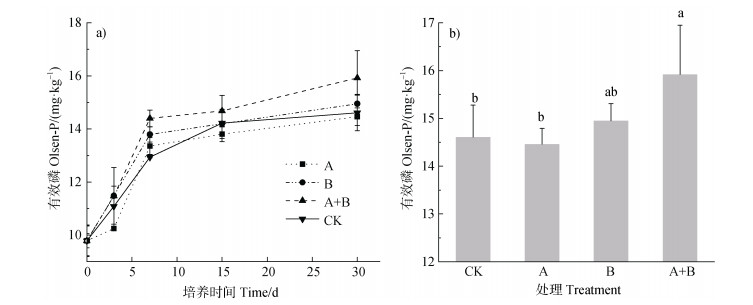
2 结果 2.1 巨大芽孢杆菌和小球藻配施对土壤有效磷含量及土壤理化性质的影响单独施用巨大芽孢杆菌(B)以及巨大芽孢杆菌和小球藻配施(A+B)的处理在培养过程中均能显著提高土壤有效磷的含量(P < 0.05),而单独施用小球藻(A)的处理中土壤有效磷含量略低于对照(CK,图 1a)。培养30 d后,单独施用小球藻的处理土壤有效磷含量(14.46 mg·kg–1)较对照土壤((14.61 mg·kg–1)低1.0%;单独施用巨大芽孢杆菌的处理土壤有效磷含量(14.95 mg·kg–1)较对照土壤(14.61 mg·kg–1)高2.3%,但与对照处理无显著性差异;巨大芽孢杆菌和小球藻配施处理土壤有效磷含量(15.92 mg·kg–1)显著高于对照和单独施用小球藻的处理(P < 0.05),较对照(14.61 mg·kg–1)提高9.0%(图 1b)。
|
注:A:施用小球藻;B:施用巨大芽孢杆菌;A+B:小球藻和巨大芽孢杆菌配合施用;CK:对照。下同。 Note: A: Application of Chlorella vulgaris; B: Application of Bacillus megaterium; A+B: Combined application of Bacillus megaterium and Chlorella vulgaris; CK: The control. The same below. 图 1 不同处理土壤有效磷含量随培养时间的变化情况(a)以及培养第30天土壤有效磷含量(b) Fig. 1 Changes of soil Olsen-P contents in different treatments with cultivation time(a)and soil Olsen-P contents in different treatments on day 30 of culture |
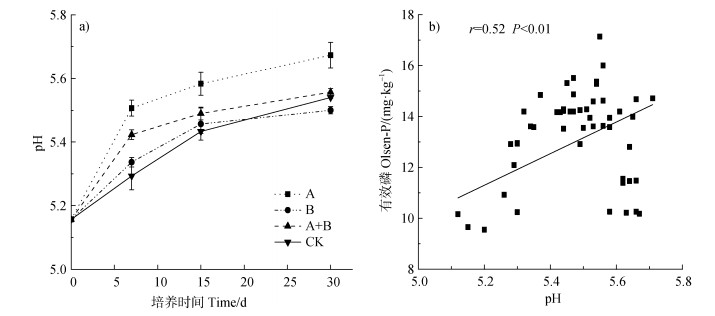
不同于土壤有效磷含量,单独施用小球藻的处理(A)、巨大芽孢杆菌和小球藻配施的处理(A+B)在培养过程中显著提高土壤pH,两个处理土壤的pH分别从5.16提高至5.67、5.56,而单独施用巨大芽孢杆菌(B)的处理在培养第30天时土壤pH(5.50)显著低于对照(CK,5.54,图 2a)。土壤有效磷的含量与土壤pH呈显著的正相关关系(P < 0.01),相关系数为0.52(图 2b)。
|
图 2 不同处理土壤pH随培养时间的变化情况(a)及土壤pH与有效磷含量的相关关系(b) Fig. 2 Changes of soil pH in different treatments with cultivation time(a)and the correlation between soil pH and Olsen-P content(b) |
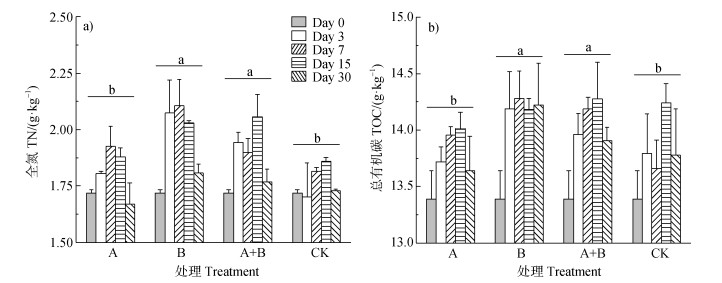
与土壤有效磷含量类似,单独施用巨大芽孢杆菌的处理土壤全氮(2.00 g·kg–1)及巨大芽孢杆菌和小球藻配施的处理土壤全氮(1.96 g·kg–1)含量显著高于单独施用小球藻的处理土壤全氮(1.80 g·kg–1)及对照土壤全氮(1.76 g·kg–1)含量。单独施用巨大芽孢杆菌的处理土壤总有机碳(14.24 g·kg–1)及巨大芽孢杆菌和小球藻配施的处理土壤总有机碳(14.10 g·kg–1)含量显著高于单独施用小球藻的处理土壤总有机碳(13.74 g·kg–1)及对照土壤总有机碳(13.80 g·kg–1)含量。
|
图 3 不同处理土壤全氮(a)、总有机碳(b)含量随培养时间的变化 Fig. 3 Changes of soil TN(a), TOC(b)contents from different treatments with cultivation time |
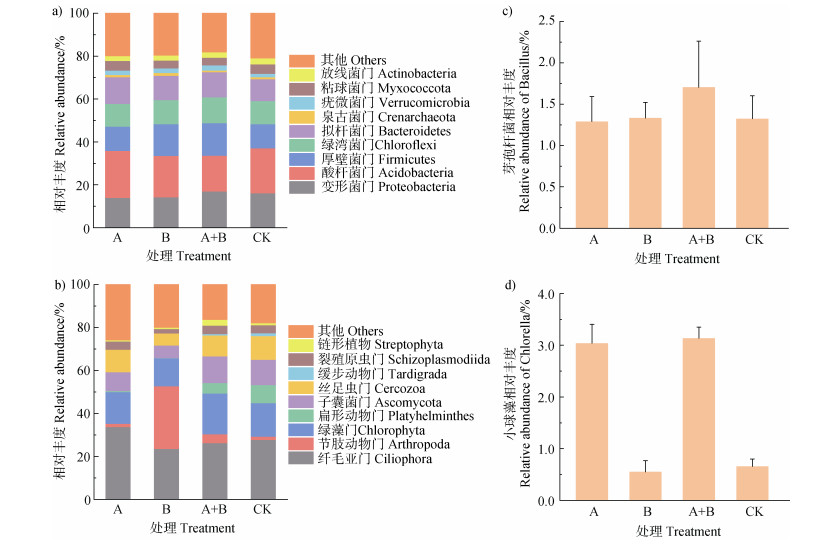
通过高通量测序研究了不同处理土壤微生物群落组成。培养第30天土壤中的优势原核生物(图 4a)主要为变形菌门(Proteobacteria)(14.00%~ 17.03%)、酸杆菌门(Acidobacteria)(16.69%~ 21.98%)、厚壁菌门(Firmicutes)(11.21%~ 15.18%)、绿湾菌门(Chloroflexi)(10.57%~ 12.05%)、拟杆菌门(Bacteroidetes)(10.27%~ 12.45%),巨大芽孢杆菌和小球藻配施的处理(A+B)中,巨大芽孢杆菌所属的厚壁菌门占比最高(15.18%),较对照(CK,11.21%)高35.39%,较单独施用巨大芽孢杆菌的处理(B,14.87%)高2.12%。土壤中的优势真核生物(图 4b)主要包括纤毛亚门(Ciliophora)(23.63%~33.86%)、绿藻门(Chlorophyta)(13.03%~18.96%)、子囊菌门(Ascomycota)(5.82%~12.52%)、丝足虫门(Cercozoa)(5.67%~11.03%)。巨大芽孢杆菌和小球藻配施的处理(A+B)中,小球藻所属的绿藻门占比最高(18.96%),较对照(15.56%)高21.83%,较单独施用小球藻的处理(14.80%)高28.09%。
|
图 4 培养第30天各处理土壤中优势原核生物(a)和真核生物(b)群落结构相对丰度以及芽孢杆菌属的相对丰度(c)和小球藻在绿藻中的相对丰度(d) Fig. 4 The relative abundance of dominant prokaryote(a)and eukaryote(b)community structure and the relative abundance of Bacillus(c), and the relative abundance of Chlorella in Chlorophyta(d)of incubated soils on day 30 |
在影响土壤微生物群落组成的同时,巨大芽孢杆菌和小球藻配施的处理亦能提高土壤微生物中芽孢杆菌及小球藻的相对丰度(图 4c,d)。巨大芽孢杆菌和小球藻配施的处理土壤中芽孢杆菌属的相对丰度(1.70%)较单独施用巨大芽孢杆菌的处理土壤中芽孢杆菌属的相对丰度(1.33%)提高27.9%;单独施用小球藻的处理土壤中芽孢杆菌属的相对丰度(1.29%)较对照土壤中芽孢杆菌属的相对丰度(1.32%)降低2.57%。巨大芽孢杆菌和小球藻配施的处理土壤中,小球藻在绿藻门中的相对丰度(3.14%)较单独施用小球藻的处理土壤(3.04%)提高3.18%;单独施用巨大芽孢杆菌的处理土壤中,小球藻在绿藻门中的相对丰度(0.55%)较对照土壤(0.66%)降低16.0%。
2.3 巨大芽孢杆菌和小球藻配施对土壤微生物活性的影响在影响土壤理化性质及微生物群落结构的同时,向土壤中施用巨大芽孢杆菌和小球藻显著影响了土壤微生物的热量—时间曲线(微生物代谢曲线)。培养第30天时,巨大芽孢杆菌和小球藻配施的处理最大放热速率(Pmax)最高(322.1 μW),显著高于初始土壤(262.4 μW)和其他三个处理(A:279.2 μW;B:273.5 μW;CK:253.2 μW);而其达到最大放热速率的时间(Tmax)最小(11.28 h),显著低于初始土壤(15.57 h)和对照土壤(14.40 h),表明巨大芽孢杆菌和小球藻配施显著提高了土壤微生物整体的代谢活性和增殖速率,且这种促进作用至少能够维持30 d。单独施用巨大芽孢杆菌的Pmax(273.5 μW)和单独施用小球藻的处理的Pmax(279.2 μW)显著高于初始土壤(262.4 μW)和对照土壤(253.2 μW),但单独施用巨大芽孢杆菌的Tmax(13.39 h)和单独施用小球藻的处理的Tmax(12.33 h)和对照土壤(14.40 h)无显著差异,表明单独施用巨大芽孢杆菌、小球藻对于土壤微生物的代谢活性有一定的提升作用,但不能提高土壤微生物的增殖速率。对照土壤在培养第30天时的Pmax(253.2 μW)显著低于初始土壤(262.4 μW),表明其微生物代谢活性有所降低。
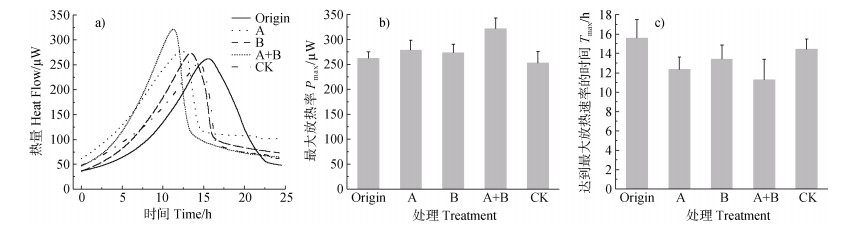
|
图 5 初始土壤和培养第30天各处理土壤的微量热曲线(a)及其参数最大放热率Pmax(b)和达到最大放热速率的时间Tmax(c) Fig. 5 Power-time curves(a)and calorimetric parameters Pmax(b), Tmax(c)acquired from heat flow curves of the original soil and incubated soils on day 30 |
土壤pH是影响土壤磷有效性的重要因素[14],本研究表明酸性水稻土(pH < 7.0)中,有效磷含量与pH呈显著正相关,相关系数为0.52。巨大芽孢杆菌可通过产生有机酸等方式溶解不溶性磷,从而提高磷的有效性[15],有机酸的产生通常使得接种巨大芽孢杆菌的土壤pH显著低于对照[16]。而小球藻的施用使得土壤pH升高,巨大芽孢杆菌和小球藻配施的处理由于巨大芽孢杆菌和小球藻共同作用pH略低于单独施用小球藻的处理但显著高于对照。在pH低于5.5的酸性土壤中,磷易与铁、铝结合形成磷酸盐沉淀或与其氧化物吸附结合而被固定[17];pH < 7时,pH的升高可以增加铁、铝磷酸盐的溶解并减少铁铝氧化物表面的正电荷,降低铁铝氧化物表面的活性,从而释放铁铝吸附态磷,增加土壤磷的有效性[18]。因此,巨大芽孢杆菌和小球藻配施相较单独施用巨大芽孢杆菌,可以通过提高pH而进一步提高土壤磷的有效性。Gougoulias等[19]研究发现施用小球藻对有效磷含量的影响不显著,本研究结果也表明单独施用小球藻时土壤有效磷含量低于对照,这是由于小球藻自身生长吸收利用了土壤中的部分有效磷所致。培养结束时小球藻的生物量增加,表明其生长速率大于死亡速率,在30 d的培养期内保持着良好的生长,对磷的吸收量大于释放量,而且藻细胞死亡释放的磷多为有机磷,因此施加小球藻的处理组中土壤有效磷含量有所下降。
巨大芽孢杆菌被普遍认为可以作为土壤改良剂,增加土壤磷的有效性[20],对其解磷作用研究较多。本研究表明,巨大芽孢杆菌的施用除提高土壤磷的有效性以外,还可以提高土壤总有机碳、全氮含量。有研究表明,小球藻的施用尤其是高施用量(4 g·kg–1干重)下可以显著提高土壤总有机碳及全氮含量[8],然而本研究发现单独施用小球藻的处理土壤有机碳和全氮含量与对照无显著差异,这可能是由于小球藻的施用量不够高;也可能是相比于藻菌配施处理,单独施用时小球藻在土壤中生长速率较低所致。此外,小球藻属于外源有机质,将小球藻施入土壤中后会引起激发效应,加剧短期内的土壤物质循环,使得土壤全氮和总有机碳含量与对照之间无显著性差异。巨大芽孢杆菌和小球藻共同施用显著提高了土壤总有机碳、全氮的含量,并显著提高土壤pH,有效改良土壤酸化、改善土壤性质、提高土壤质量。
3.2 巨大芽孢杆菌和小球藻配施能够改变土壤微生物群落结构、提高土壤微生物活性外来微生物的引入可通过不同方式改变土壤微生物群落结构[21]。巨大芽孢杆菌和小球藻配施的处理中芽孢杆菌属的相对丰度较单独施用巨大芽孢杆菌的处理提高27.9%,小球藻属的相对丰度较单独施用小球藻时提高3.18%,表明巨大芽孢杆菌和小球藻互相促进。有研究表明巨大芽孢杆菌和小球藻能够形成良好的共栖互利关系,巨大芽孢杆菌能够帮助小球藻适应环境并促进其生长[22],微藻浆施用于土壤可以刺激异养活性并促进细菌生长[23]。小球藻可通过光合作用固碳,并为异养细菌巨大芽孢杆菌提供碳源及氧气;巨大芽孢杆菌严格好氧,又通过呼吸作用将氧气转化为二氧化碳为小球藻光合作用提供底物[24]。此外,细菌也为藻类提供生长激素和维生素等从而建立互利共生关系[25]。由于这种互利共生关系的存在,促进了两种生物的生长繁殖,因而配合施用较单独施用更有利于提高其相对丰度,有利于巨大芽孢杆菌解磷而进一步提高土壤有效磷的含量。
微生物生长代谢活动产生大量的热,其趋势与微生物的生长特征一致,因此可以用热动力学曲线来表示微生物的代谢活性,较大Pmax(最大放热速率)和较小Tmax(出峰时间)代表较高的土壤微生物代谢活性[26]。巨大芽孢杆菌和小球藻的互利共生关系促进土壤微生物群落生长繁殖,提高土壤微生物活性和增殖速率。这可能有两方面的原因,一方面外来微生物的引入刺激了土著微生物的生长繁殖;另一方面巨大芽孢杆菌和小球藻作用对土壤有效磷、全氮及总有机碳含量的提高为微生物提供了更多的代谢底物,从而提高其代谢活性。
4 结论巨大芽孢杆菌和小球藻配施可以通过巨大芽孢杆菌的解磷作用、藻菌共同作用提高水稻土pH、增加土壤微生物中芽孢杆菌和小球藻的相对丰度、刺激土壤微生物活性提高土壤磷有效性,在不外加磷肥的条件下增加土壤有效磷、全氮和总有机碳含量,改善土壤质量。因此,巨大芽孢杆菌和小球藻配施是提高水稻土磷有效性的有效方式,并可减少磷肥的施用、降低磷积累带来的水体富营养化等环境风险,是环境友好且可持续的农业措施。
| [1] |
Ruttenberg K C. The global phosphorus cycle[M]//Treatise on Geochemistry. Amsterdam: Elsevier, 2003: 585—643.
(  0) 0) |
| [2] |
Liang J L, Liu J, Jia P, et al. Novel phosphate- solubilizing bacteria enhance soil phosphorus cycling following ecological restoration of land degraded by mining[J]. The ISME Journal, 2020, 14(6): 1600-1613. DOI:10.1038/s41396-020-0632-4
(  0) 0) |
| [3] |
Reijnders L. Phosphorus resources, their depletion and conservation, a review[J]. Resources, Conservation and Recycling, 2014, 93: 32-49. DOI:10.1016/j.resconrec.2014.09.006
(  0) 0) |
| [4] |
Cordell D, Drangert J O, White S. The story of phosphorus: Global food security and food for thought[J]. Global Environmental Change, 2009, 19(2): 292-305. DOI:10.1016/j.gloenvcha.2008.10.009
(  0) 0) |
| [5] |
Owen D, Williams A P, Griffith G W, et al. Use of commercial bio-inoculants to increase agricultural production through improved phosphrous acquisition[J]. Applied Soil Ecology, 2015, 86: 41-54. DOI:10.1016/j.apsoil.2014.09.012
(  0) 0) |
| [6] |
Zhao Y N, Mao X X, Zhang M S, et al. The application of Bacillus megaterium alters soil microbial community composition, bioavailability of soil phosphorus and potassium, and cucumber growth in the plastic shed system of North China[J]. Agriculture, Ecosystems & Environment, 2021, 307: 107236.
(  0) 0) |
| [7] |
Safi C, Zebib B, Merah O, et al. Morphology, composition, production, processing and applications of Chlorella vulgaris: A review[J]. Renewable and Sustainable Energy Reviews, 2014, 35: 265-278. DOI:10.1016/j.rser.2014.04.007
(  0) 0) |
| [8] |
Alobwede E, Leake J R, Pandhal J. Circular economy fertilization: Testing micro and macro algal species as soil improvers and nutrient sources for crop production in greenhouse and field conditions[J]. Geoderma, 2019, 334: 113-123. DOI:10.1016/j.geoderma.2018.07.049
(  0) 0) |
| [9] |
Odgerel B, Tserendulam D. Effect of Chlorella as a biofertilizer on germination of wheat and barley grains[J]. Proceedings of the Mongolian Academy of Sciences, 2017, 26-31. DOI:10.5564/pmas.v56i4.839
(  0) 0) |
| [10] |
Fuentes J L, Garbayo I, Cuaresma M, et al. Impact of microalgae-bacteria interactions on the production of algal biomass and associated compounds[J]. Marine Drugs, 2016, 14(5): 100. DOI:10.3390/md14050100
(  0) 0) |
| [11] |
Ramanan R, Kim B H, Cho D H, et al. Algae-bacteria interactions: Evolution, ecology and emerging applications[J]. Biotechnology Advances, 2016, 34(1): 14-29. DOI:10.1016/j.biotechadv.2015.12.003
(  0) 0) |
| [12] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [13] |
Jing Z W, Chen R R, Wei S P, et al. Response and feedback of C mineralization to P availability driven by soil microorganisms[J]. Soil Biology & Biochemistry, 2017, 105: 111-120.
(  0) 0) |
| [14] |
Wang X C, Deng X Y, Pu T, et al. Contribution of interspecific interactions and phosphorus application to increasing soil phosphorus availability in relay intercropping systems[J]. Field Crops Research, 2017, 204: 12-22. DOI:10.1016/j.fcr.2016.12.020
(  0) 0) |
| [15] |
Saeid A, Prochownik E, Dobrowolska-Iwanek J. Phosphorus solubilization by Bacillus species[J]. Molecules, 2018, 23(11): 2897. DOI:10.3390/molecules23112897
(  0) 0) |
| [16] |
Wyciszkiewicz M, Saeid A, Chojnacka K. In situ solubilization of phosphorus-bearing raw materials by Bacillus megaterium[J]. Engineering in Life Sciences, 2017, 17(7): 749-758. DOI:10.1002/elsc.201600191
(  0) 0) |
| [17] |
Mkhabela M S, Warman P R. The influence of municipal solid waste compost on yield, soil phosphorus availability and uptake by two vegetable crops grown in a Pugwash sandy loam soil in Nova Scotia[J]. Agriculture, Ecosystems & Environment, 2005, 106(1): 57-67.
(  0) 0) |
| [18] |
Penn C J, Camberato J J. A critical review on soil chemical processes that control how soil pH affects phosphorus availability to plants[J]. Agriculture, 2019, 9(6): 120. DOI:10.3390/agriculture9060120
(  0) 0) |
| [19] |
Gougoulias N, Papapolymerou G, Karayannis V, et al. Effects of manure enriched with algae Chlorella vulgaris on soil chemical properties[J]. Soil and Water Research, 2018, 13(1): 51-59. DOI:10.17221/260/2016-SWR
(  0) 0) |
| [20] |
Zhu J, Li M, Whelan M. Phosphorus activators contribute to legacy phosphorus availability in agricultural soils: A review[J]. Science of the Total Environment, 2018, 612: 522-537. DOI:10.1016/j.scitotenv.2017.08.095
(  0) 0) |
| [21] |
Gadhave K R, Devlin P F, Ebertz A, et al. Soil inoculation with Bacillus spp. modifies root endophytic bacterial diversity, evenness, and community composition in a context-specific manner[J]. Microbial Ecology, 2018, 76(3): 741-750. DOI:10.1007/s00248-018-1160-x
(  0) 0) |
| [22] |
陈咏芳. 共栖菌影响下小球藻表型变化研究[D]. 重庆: 重庆大学, 2016. Chen Y F. Research on phenotypic changes of Chorella of the influence of commensal bacteria[D]. Chongqing: Chongqing University, 2016 (  0) 0) |
| [23] |
Marks E A N, Miñón J, Pascual A, et al. Application of a microalgal slurry to soil stimulates heterotrophic activity and promotes bacterial growth[J]. Science of the Total Environment, 2017, 605/606: 610-617. DOI:10.1016/j.scitotenv.2017.06.169
(  0) 0) |
| [24] |
Perera I, Subashchandrabose S R, Venkateswarlu K, et al. Consortia of cyanobacteria/microalgae and bacteria in desert soils: An underexplored microbiota[J]. Applied Microbiology and Biotechnology, 2018, 102(17): 7351-7363.
(  0) 0) |
| [25] |
Teplitski M, Rajamani S. Signal and nutrient exchange in the interactions between soil algae and bacteria[M]//Biocommunication in soil microorganisms. Springer, Berlin, Heidelberg, 2011: 413—426.
(  0) 0) |
| [26] |
Xu J B, Wang Y L, Liu M, et al. Use of BIOLOG and microcalorimetry in combination to study factors of carbon sources stimulating metabolic activity of soil microbe in red soil (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(1): 203-212. [徐江兵, 王艳玲, 刘明, 等. BIOLOG与微量热耦合研究提高红壤微生物代谢活性的碳源因子[J]. 土壤学报, 2018, 55(1): 203-212.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


