2. 中国科学院大学, 北京 100049;
3. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. State Key Laboratory of Soil & Sustainable Agriculture(Institute of Soil Science, Chinese Academy of Sciences), Nanjing 210008, China
磷是组成生命的重要元素之一,在生物体的发育繁殖中起着至关重要的作用[1]。磷是作物生长必需的营养元素,直接影响到作物的生长和产量。近年来磷肥的大量施用,不仅使磷肥的利用率下降,还增加了土壤磷的流失风险,进而导致水体富营养化等问题[2-3]。磷在土壤中以不同的形式存在,随着光谱技术的发展,已经能够从分子水平上认识土壤不同磷素的形态[4],但是目前仍然无法很好地区分不同形态的磷素,并且不同形态磷素之间的相关转化机制尚不清楚。
同位素是研究元素循环的重要手段,可以示踪元素的来源和迁移转化过程[5-6]。放射性磷同位素半衰期均小于一个月,且放射强度较低,因此在长周期和较大空间尺度上无法用于同位素示踪研究[7]。而磷的稳定同位素只有31P,无法用稳定同位素示踪法来研究磷在自然界中的迁移转化。自然界中大多数磷与氧紧密结合形成正磷酸盐,磷氧键十分稳定,在自然温度和pH条件下,非生物的氧同位素分馏可以忽略不计,磷酸盐氧同位素组成(δ18OP)反映了磷的微生物利用状况[8-9],因此可以用氧同位素间接研究环境中磷的生物地球化学循环。氧元素有三个稳定同位素(16O、17O、18O),氧同位素定义为:
| $ {\delta ^{18}}{\text{O}} = \frac{{{R_{{\text{sample}}}} - {R_{{\text{VSMOW}}}}}}{{{R_{{\text{VSMOW}}}}}} \times 1000 $ | (1) |
式中,Rsample为样品的18O/16O原子丰度比值;RVSMOW为维也纳标准平均海洋水(VSMOW)18O/16O原子丰度比值。
对已发表的δ18OP技术相关文献进行了统计分析,结果如图 1所示。该技术在1980年以后开始被应用,进入21世纪尤其是2010年以后相关研究开始增多,而在土壤学中的应用主要集中在近十年,且有迅速增长的趋势。但是与其他研究发表文章的数量相比,该技术的相关成果还是比较匮乏的。
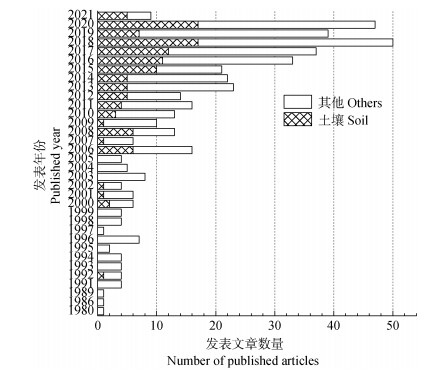
|
注:在Web of Science核心数据库中,以“oxygen isotopes”和“phosphorus”为主题词进行检索,截至到2021年3月8日共搜索到期刊类文章439篇,有“soil”主题词的文章共120篇。Note:In the core database of Web of Science,a total of 439 journal articles were searched with the main headings of "oxygen isotopes" and "phosphorus",and 120 articles with the theme of "soil" were found up to March 8,2021. 图 1 不同年份磷酸盐氧同位素技术的发表文章数量统计 Fig. 1 Publication related to the technology of phosphate oxygen isotopic ratios at different year |
δ18OP技术经过几十年的发展,其测定方法已经相对成熟,但是土壤磷形态的提取和纯化过程复杂,限制了该方法的应用。本文介绍了目前常用的不同土壤磷形态的提取方法和两种常用提取剂的提纯和转化方法,对已发表与土壤δ18OP相关的研究成果进行了总结,分析了相关的影响因素,最后对未来δ18OP技术在土壤磷循环研究中的应用提出了一些建议,并对该技术未来的发展进行了展望。
1 土壤磷酸盐氧同位素的应用原理磷进入土壤后经一系列物理化学生物作用转化成不同形态的磷,并在这些形态中相互转化,此过程会发生磷氧键的断裂和形成,与环境中的水分子发生同位素交换,由此产生同位素分馏。有研究证明在不同温度条件下或者不同氧同位素的水环境中,细胞外的无机焦磷酸酶均能使无机磷(Pi)与水迅速达到温度依赖的氧同位素平衡,在Pi上留下平衡的氧同位素标记[8]。Longinelli和Nuti[10]采用经验方程描述了水和磷酸盐之间的温度依赖平衡:
| $ T = 111.4 - 4.3 \times \left( {{\delta ^{18}}{{\text{O}}_{\text{P}}} - {\delta ^{18}}{{\text{O}}_{{{\text{H}}_2}{\text{O}}}}} \right) $ | (2) |
式中,T为水温(℃);δ18OP和δ18OH2O分别为磷酸盐和水的氧同位素组成。
土壤不同磷形态的δ18OP并不总是稳定在平衡值。微生物从环境中吸收磷酸盐时会偏好吸收利用轻同位素,使残留的磷酸盐富集重氧同位素[8],而有机磷(Po)被碱性磷酸酶或酸性磷酸酶分解则会伴随着动力学分馏,产生负的同位素分馏[8,11-12]。这两种非平衡分馏形式均会改变土壤环境中的δ18OP,甚至打破原有的同位素平衡。δ18OP相比磷的浓度对生物活动更加敏感,能够快速地响应微生物活动,从而反映土壤中磷的利用状况。
水体中磷酸盐如果未被大量循环利用,且来源中δ18OP有显著差异时,溶解态Pi的δ18OP可以示踪磷的来源[13]。土壤作为磷汇,有丰富的物质来源,包括成土母质、化肥、畜禽粪便、植物残体、大气沉降等,它们的δ18OP是有差异的。过量的磷进入土壤,如果未被微生物循环利用,则原有的δ18OP特征就会被保存下来,因此δ18OP也具有示踪土壤磷循环和来源的潜力[11,14]。土壤中磷的循环还可以通过时间变化和不同处理的土壤不同磷形态δ18OP的差异揭示土壤磷循环机制。
2 土壤磷酸盐氧同位素的分析方法 2.1 土壤无机磷提取、转化和提纯方法由于土壤中磷素形态复杂多样,对于不同磷形态的分级依旧停留在操作上的定义,即用不同强度的提取剂提取不同活性的磷。对于Pi分级常用方法是顺序提取法或单一提取法。顺序提取法最先由Hedley等[15]提出的,主要用于提取土壤中不同形态的磷,并测定相应的浓度。但是Hedley等提取法中20%~60%的磷在残留态中未被提取出,其中Po占比很大,这些Po也会参与磷的短期循环转化,因此Tiessen和Moir[16]对Hedley顺序提取法进行了改进。随后Zohar等[17]将Hedley和Tiessen顺序提取法与McLaughlin等[18]采用的海水Pi氧同位素测定方法结合起来并进行改进,用于土壤Pi的研究,图 2展示了该方法的实验流程。Lei等[19]也证明了这种方法适用于土壤样品的研究。在对土壤特定形态的磷酸盐进行研究时,有些学者则选择使用一种提取剂[14,20-21]或者顺序提取法中的一种提取态测定δ18OP[22]。
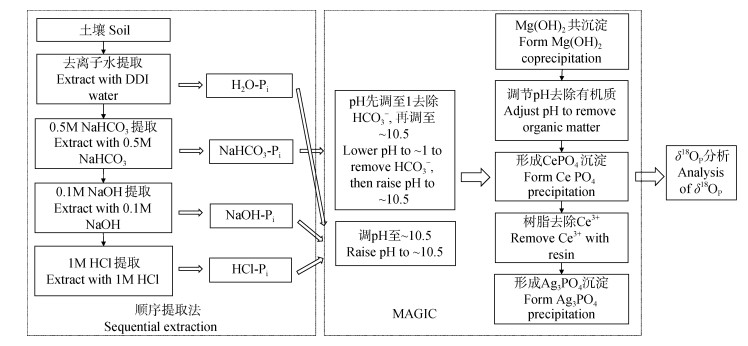
|
注:MAGIC:McLaughlin等[18]采用的磷酸盐纯化方法。Note:MAGIC:the phosphate purification method adopted by McLaughlin et al.[18] 图 2 土壤顺序提取法和无机磷酸盐氧同位素测定方法实验流程图 Fig. 2 Flow chart of sequential extraction in soil and determination of inorganic phosphate oxygen isotopes |
由于土壤组分比较复杂,提取的溶液中除了有Pi,还包含有机质和金属离子(Fe、Mg、Ca、Al等),这些杂质会影响磷酸银的形成且对氧同位素的测定产生干扰[14,17],因此在转化成磷酸盐的过程中对提取液进行纯化非常重要。目前常用的有两种方法,一种是McLaughlin等[9,18,23]使用的氢氧化镁共沉淀法(MAGIC)富集磷酸盐,将其转化成磷酸铈,再转化成磷酸银测定δ18OP。另一种是Tamburini等[14]提出的磷酸钼铵-磷酸铵镁多步沉淀法(APM- MAP)。MAGIC最开始是用于海水中δ18OP研究,因此更适用于磷酸盐含量较低的提取液,而APM-MAP能够更加有效地去除有机质的干扰,更适用于有机质含量高的土壤和沉积物。对于H2O/树脂、NaHCO3和NaOH提取的溶液一般使用MAGIC共沉淀法,而HCl、三氯乙酸(TCA)和NaOH-EDTA提取的溶液常使用APM-MAP方法[6,11,14,20-22],也有研究将两个方法相结合,即先用Mg(OH)2对提取液进行浓缩,再利用APM-MAP进行提纯[24]。
为了更好地去除杂质,得到纯度比较高的磷酸银,不同的学者对转化方法进行了改进。具体的改进方式和效果如表 1所示。目前对于样品的标准纯化方法仍未建立,对于不同转化和提纯方法测得的δ18OP是否能够进行比较也鲜有报道。
|
|
表 1 磷酸盐氧同位素纯化的改进方法比较 Table 1 Comparison between improvement methods for purification of phosphate oxygen isotopes |
δ18OP的研究主要集中在土壤Pi,而Po一般当做杂质去除,但是Po的研究在揭示土壤磷循环中也是至关重要的[26]。关于Po的氧同位素分析相关报道较少,Tamburini等[27]第一次尝试,将NaOH-EDTA提取液用分子排阻色谱法将分子量大于5kDa的Po分离出来,用紫外灯照射使Po降解成Pi,再通过Pi的转化和提纯方法进行氧同位素分析。随后该方法也被其他学者采用,测定Po的氧同位素组成[28-30]。但是该方法回收率较低,提取时需要消耗大量土壤,因此对于Po的δ18OP研究还需进一步探索。
2.3 磷酸盐氧同位素的测定方法δ18OP测定方法出现比较早,技术发展也相对成熟,其测定技术的发展历史已有相关综述[31-33]进行介绍,不再赘述。目前应用最广泛的方法是对原始的土壤样品进行提取、转化和纯化等一系列复杂的处理后转化成磷酸银,用连续流的元素分析仪-稳定性同位素比例质谱仪(TC/EA- IRMS)测定氧同位素比值[18,33]。该方法方便快捷,样品稳定,需要样品量少。研究表明TC/EA-IRMS测定结果与传统氧同位素线下测定技术的结果能够很好地拟合,并且磷酸银的性质稳定,同位素完整性至少可以保存八年,是目前测定δ18OP最常用的方法[34]。
3 土壤磷酸盐氧同位素特征 3.1 无机磷氧同位素特征土壤中的磷约有60%~80%为Pi[35],因此对土壤δ18OP的研究主要集中在Pi。结合Hedley等[15]、Tiessen和Moir [16]顺序提取法,研究较多的是H2O/树脂、NaHCO3、NaOH和HCl提取的Pi(分别记为H2O-Pi/Resin-Pi、NaHCO3-Pi、NaOH-Pi和HCl-Pi)。H2O-Pi/Resin-Pi是土壤可溶性磷,NaHCO3-Pi是弱吸附态磷,这两种形态的磷交换迅速[36],且受土壤中高效微生物活动和肥料的影响,对环境变化响应较快,易于迁移,能够在土壤中快速循环[6]。因此,该形态磷的δ18OP具有较大的变动范围,加上受微生物活动影响大,常具有较高的δ18OP值,与理论计算的同位素平衡值也较为接近(图 3)。NaOH-Pi主要以晶型或者非晶型的铁铝磷酸盐形式存在[15-17],属于中等活性磷,也受微生物的影响,通常处于平衡状态,但是微生物偏好吸收或细胞内磷酸盐的释放占主导时会使该形态磷的δ18OP高于平衡值[6],而Po(主要是DNA)水解较多时则会导致NaOH-Pi的δ18OP降低[37],因此NaOH-Pi也有很大的变动范围。HCl-Pi是矿物态磷,一般很难被微生物利用,所以δ18OP常远低于平衡值,主要反映母岩的δ18OP特征。但在微生物活动旺盛的地区,磷的循环比较彻底,部分经过微生物循环的Pi也会沉淀成矿物磷,最后形成HCl-Pi,使δ18OP值接近理论计算的平衡分馏值[23,28,37-38]。
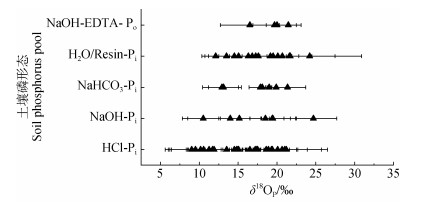
|
注:数据来自参考文献[5],[6],[11],[14],[19]-[22],[27]-[30],[36],[37],[39]-[54]。 Note: Data is from reference [5], [6], [11], [14], [19]-[22], [27]-[30], [36], [37], [39]-[54]. 图 3 土壤不同形态磷的磷酸盐氧同位素特征 Fig. 3 Characteristics of phosphate oxygen isotopes ratios in different soil phosphorus pools |
最初土壤Po的δ18OP特征是通过Pi来反映的。有研究表明添加植物凋落物的土壤中,植物叶片结构中Po释放出来的Pi的δ18OP会非常高[47],这说明植物Po引起了土壤Pi的δ18OP升高。但是Zohar等[36]观察到的现象与之相反,认为Po矿化引起了土壤Pi的δ18OP降低。到2018年,Tamburini等[27]第一次测得了土壤NaOH-EDTA提取液的Po氧同位素值,结果表明土壤中Po的δ18OP与树脂磷,微生物活动性磷具有不同的氧同位素特征,并且植物样品中TCA提取液Pi的δ18OP很大,而NaOH-EDTA提取液Po的δ18OP很小,说明Po氧同位素不能通过其他微生物活动性Pi的δ18OP进行推导和计算,需要测定提取和纯化后的Po。随后Siegenthaler等[30]采用18O标记的水进行34 d培养实验,测定了NaOH-EDTA提取液中Po的δ18OP,结果显示在培养时间内土壤Po与水未发生明显的同位素交换,这可能与该方法中截取的是分子量大于5kDa的有机质有关,这部分Po是相对比较稳定的。
3.3 磷酸盐氧同位素时空分布特征磷在不同形态之间流通时,其更新和变化速度也是有差异的。培养实验表明H2O-Pi在几秒内转化,Resin-Pi在几分钟内转化,NaOH-Pi在几周到几个月内转化,HCl-Pi则需要几年到几千年,在干旱地区甚至可以保留15万年[28]。在缺磷土壤中,磷进入细胞的新陈代谢转化加快,树细根中甚至能在4 h内完成Pi的高度转化[55]。磷素含量变化的同时也伴随着δ18OP的变化。在半干旱气候区,随着气候的季节性变化,Resin-Pi的δ18OP会产生季节性变化,而HCl-Pi的δ18OP则无明显季节性变化规律[41]。对于δ18OP的日变化,由于时间较短,土壤不同形态的磷浓度和δ18OP并未明显变化[50]。
磷素除了随时间变化,在空间上的分布也存在异质性。研究表明总磷有较强的空间自相关性,主要受土壤性质(pH、SOM)、降雨、地形的影响,而速效磷有中等的空间自相关性,主要与土地利用方式和地形有关[3]。Piotrowska-Długosz等[56]的研究表明,除有效磷外其他形态磷不存在空间格局变化。而Granger等[44]在对英国西南部一个农场研究时发现,HCl-Pi与海拔、坡度、土壤类型和管理方式等因素相关,但是δ18OP与这些田间变量却没有关系。
4 土壤磷酸盐氧同位素的应用 4.1 评估土壤磷的微生物利用状况生物活性磷(H2O-Pi、Resin-Pi和NaHCO3-Pi)微生物可利用程度高,大多数均参与了磷循环,但是该形态磷的含量相对较低。土壤中HCl-Pi含量较高,但是相对于表土,底土中微生物含量低,养分不充足,有研究表明只有在N和P均充足的条件下底土中的磷才能得到充分利用[57],而且在不同深度也会存在差异,因此单纯的含量分析很难对土壤中磷的微生物利用状况进行评估。而磷酸盐的氧同位素分馏在自然条件下只有微生物的活动才能驱动,对环境变化更加敏感,土壤中磷素水平和磷的利用难易程度也会影响生物对磷素的摄取利用,使土壤不同形态磷的δ18OP产生差异,因此δ18OP可以为土壤不同形态磷的微生物利用状况提供信息。通过对比不同提取态的磷δ18OP与理论计算的同位素平衡值,可以推断不同形态磷酸盐的微生物利用程度[36]。
Bi等[43]研究了长期施肥的农田土壤,H2O-Pi、NaHCO3-Pi和NaOH-Pi接近或达到同位素平衡,是外源磷被土壤微生物高效利用和循环后的结果,HCl-Pi的同位素值低于平衡值,受施肥和母岩风化的共同影响,但是缺磷处理土壤HCl-Pi的δ18OP远低于同位素平衡值,接近或者等于母岩的δ18OP。Pistocchi等[29]在对磷含量不同的土壤进行培养时发现,富磷土壤中有效磷δ18OP高于贫磷土壤,接近磷与水的同位素平衡。Gross等[47]对不同施肥处理的土壤研究发现,当土壤中磷过量时高量的N和K也会减缓微生物对磷酸盐的周转。因此土壤δ18OP特征不仅提供了磷的微生物利用信息,也为土壤施肥的决策提供理论依据。
4.2 示踪土壤磷循环土壤中磷循环示踪分为三个方面,土壤磷来源、磷在土壤中的转化和磷的输出。在土壤磷来源的示踪方面,可以根据输入土壤的磷源与土壤不同形态磷δ18OP特征差异来解释不同来源的贡献。磷在土壤中的转化除了受来源的影响,更多的是土壤微生物和植物的影响,而在磷输出过程中的示踪,土壤则可以作为磷源用于识别。Zohar等[17]研究了废水和淡水灌溉的农业土壤,淡水灌溉土壤H2O-Pi的δ18OP为18.5‰,接近同位素平衡值,而废水灌溉土壤δ18OP为10.7‰,原因可能是废水中有较多的Po,在土壤中被胞外酶分解产生了同位素的负向偏移。Tian等[11]对中国北方和中部地区几个典型农业土壤不同形态磷的δ18OP进行了分析,结果显示长春地区土壤H2O-Pi和NaHCO3-Pi的δ18OP低于平衡值,但是浓度却明显高于其他地区,主要反映了施肥的影响,肥料的δ18OP特征覆盖了同位素平衡效应。Tian等[6]对北京地区的农业土壤Pi循环进行研究时认为,δ18OP接近平衡值的H2O-Pi和NaHCO3-Pi主要是受微生物活动和复合肥的影响,而低于平衡值的样品则可能是Po水解引起的;NaOH-Pi的δ18OP在平衡线以上,反映了微生物吸收和细胞释放磷的平衡;HCl-Pi非常低,反映了年轻土壤的母质特征。同时土壤又作为水体悬浮颗粒[58]、沉积物[52,59]、湖泊河流海洋[49,60]的重要磷来源之一,参与这些系统中的磷循环。
目前,自然条件下土壤磷循环的解释大多是对已知的来源和可能的影响过程进行推测,难以从根本上揭示磷循环机制。如果土壤磷素处于同位素平衡状态,原始的同位素标志会被抹除,也无法对来源和具体的循环过程进行解释。室内标记培养实验虽然不是在自然丰度同位素条件下进行的,但是能更好地揭示磷循环机制。过去常利用放射性磷进行标记培养实验,但是放射性磷的敏感度低,且具有放射性,衰变周期短,磷酸盐氧同位素技术的出现为磷循环机制的研究提供了新方向。von Sperber等[61]测定了小麦胚芽和马铃薯块茎的酸性磷酸酶和大肠杆菌的碱性磷酸酶对氧同位素的分异作用,发现两种酶的反应机制不同,在水氧同位素组成相同的情况下,酸性磷酸酶引起的δ18OP分馏效应较碱性磷酸酶小20‰~30‰,导致其释放Pi的δ18OP较碱性磷酸酶释放Pi的δ18OP高5‰~7.5‰,这种差异足以在环境样品中区分不同酶的作用。Pistocchi等[29]采用富氧同位素水进行的培养实验证实,在限磷条件下Po水解的同位素效应大于同位素平衡效应,使微生物磷的δ18OP低于平衡值,在富磷土壤中估计Resin-Pi和NaOH-Pi之间的磷交换量时,磷标记和氧同位素示踪方法有相似的结果,认为在P-O键不被破坏的条件下,δ18OP可以示踪磷通量。同样,Siegenthaler等[30]也采用了这两种标记方法进行培养试验,结果表明使用32P标记可以量化Resin-Pi被微生物吸收的比例,但是δ18OP却无法量化不同形态磷之间的流通量。δ18OP技术在土壤磷循环机制的研究中不仅能提供土壤磷循环的信息,也能为其他方法的研究提供佐证以及互补信息。
5 影响土壤磷酸盐氧同位素的因素土壤δ18OP值是处于动态变化中的,受多种因素影响,主要包括磷的来源、环境条件(温度,水分、pH等)、生物活动[8,11]和样品处理过程。只有充分了解土壤中δ18OP的影响因素和变化过程,才能有效地利用氧同位素来揭示土壤磷循环机制。
5.1 磷来源的影响土壤形成初期主要是由原岩中的磷灰石提供磷源,原岩的磷灰石氧同位素因原岩成因和风化条件不同而存在差异[32]。此外,火山灰、森林火灾产生的灰烬和其他大气颗粒物的沉降也会携带少量磷进入土壤[62-63]。在农业土壤中,人为施用含磷化肥和有机肥或采用含磷污水灌溉,均会在土壤中引入磷。这些磷进入土壤后打破了原来磷循环的平衡,直接影响了土壤磷的含量和δ18OP特征,对于土壤磷循环有较大的扰动。Amelung等[39]研究了长期不同施肥处理下农田土壤HCl-Pi的δ18OP特征,结果显示表土δ18OP达到了同位素平衡,覆盖了肥料的影响,但底土中由于微生物活动受限,施用有机肥的土壤其底土δ18OP低于长期施用矿物肥的土壤。Zohar等[36]对淡水和污水灌溉的土壤研究时发现污水灌溉土壤的δ18OP更接近平衡值。
5.2 环境条件的影响δ18OP的平衡理论计算方程是温度的函数,且与土壤水分的氧同位素有关,因此两者直接决定了最终达到平衡分馏时的氧同位素值。但是von Sperber等[61]的研究结果显示温度对酸性和碱性磷酸酶水解Po产生的同位素分馏没有显著影响,这可能是酶催化Po水解不是平衡分馏的缘故。Angert等[40-41]研究发现土壤中植物可利用磷酸盐(Resin-Pi)δ18OP因水分的变化而改变,土壤湿度增加是产生同位素效应的主导因素。在降水稀少的以色列地区,土壤经过灌溉处理后,Po矿化速度加快,生物活动旺盛,会促进土壤δ18OP达到平衡。而在相对湿润的夏威夷地区,微生物磷δ18OP随着降雨梯度的增加而降低,可能是由于高磷的输出使湿润地区磷匮乏,且细胞内与细胞外具有不同的δ18OP,微生物加速细胞内Po的水解和磷循环,使高湿润地区土壤δ18OP降低[28]。Tian等[11]认为pH通过影响土壤总磷中NaOH- Pi和HCl- Pi的比例,从而影响磷的生物有效性。Pfahler等[51]在英国洛桑试验站进行长期试验,研究了不同施肥和石灰处理的公园草地土壤,发现高pH土壤中δ18OP低,在没有磷限制的条件下,施用石灰使δ18OP增加3‰,原因是随着pH的改变,不同土壤过程会影响磷的有效性。
5.3 生物活动的影响δ18OP的分馏是生物过程驱动的,环境因素也是通过影响生物过程从而对δ18OP产生影响[8]。在土壤18O的生物去标记实验中,未灭菌土壤中标记的18O半衰期是15~22 d,而灭菌土壤培养50d后未发现去标记现象,说明微生物对磷的利用是导致土壤磷酸盐18O去标记的唯一原因,也证明了土壤中磷酸盐的转化是由微生物驱动的[64]。Siebers等[53]通过水培试验研究发现森林砍伐后的土壤微团聚体的磷酸盐与水之间的氧交换较砍伐处理前明显增多,森林砍伐一年和两年后δ18OP(HCl-Pi)均有所增加,这主要是因为微生物加快了土壤磷循环。虽然微生物利用会使不同形态磷δ18OP产生差异,但从长远来看,微生物转化所产生的同位素特征也可能由于不同形态磷之间的相互转化而被掩盖[47]。除了微生物,植物也会对土壤δ18OP产生影响。缺磷实验中,氧同位素标记结果显示,旧叶中残留态的磷被转化重新变成可活动态磷,并将可活动态磷从旧叶和根中转运至茎和新叶中[65]。植物多样性不仅影响植物对磷的吸收,还通过诱导微气候进而影响与磷交换的土壤水分的氧同位素,间接地影响土壤中生物有效磷的δ18OP[48]。
5.4 样品处理过程的影响样品采集后的储存和预处理过程可能会产生δ18OP的分馏,导致测定结果偏离真实值。Jiang等[66]的研究证明提取和纯化过程,干燥温度(< 0℃~80℃)和筛分网(20~100)对Pi的δ18OP没有显著影响,但存储在室温下(没有微生物增长抑制剂的添加)的土壤几乎所有形态磷的δ18OP发生了显著变化,为避免产生同位素分馏,土壤样品的最佳储存条件是立即低温冻结(–20℃或–80℃)或冷冻干燥。此外在土壤提取液的转化和纯化过程中,如果引入了杂质也会对最后δ18OP的测定结果产生影响[24-25],因此在样品处理过程中要监测是否发生了同位素的分馏。
6 结论与展望δ18OP技术为示踪土壤磷循环,揭示土壤磷的生物地球化学机制提供了新的思路和方法。目前该方法在土壤中的应用仍处于起步阶段,不管是从分析方法还是技术应用上均面临着巨大的挑战,亟需从以下三个方面开展研究:(1)标准方法的建立。不同土壤性质、不同提取态中离子种类以及有机质的含量存在很大差异,然而目前在Pi样品的前处理方面,对土壤不同磷形态提取和转化的方法还未统一,不同方法之间也缺乏比较,因此开展不同方法之间的比较并建立统一的标准方法或者评价标准更加有利于不同研究成果之间的对比。(2)加强对Po的δ18OP研究。目前对Po的研究相对缺乏,提取和分离技术尚不成熟。相对于Pi,土壤中Po比例偏低,而且现有的提取方法回收率低,需要消耗大量的样品。排阻色谱法截取的是分子量大于5kDa的Po,小分子量Po比例虽然低,但在土壤中更加活跃,更容易被微生物利用,其研究价值也会更高。关于Po形态的研究也相对匮乏,尤其是不同形态Po的δ18OP特征,因此对Po的研究需要加强。(3)多方法融合揭示土壤磷循环机制。现阶段δ18OP技术在土壤磷循环研究上的应用多是对不同形态磷的特征进行了分析,测定的氧同位素值是一个综合作用的结果,对土壤中的磷循环过程只是推测,是否与实际情况相符很难确定。有研究将放射性磷标记与氧同位素标记联合使用来示踪土壤磷循环[29-30,56],也有将光谱技术与同位素技术相结合测定土壤磷循环的动态过程[28]。不同方法的结果不仅能相互印证,也能避免单一研究方法的不足,从而更好地揭示土壤磷循环机制。多种方法融合研究土壤磷循环或成未来的研究趋势。虽然δ18OP技术在土壤磷循环的研究中仍然存在很多问题亟待解决,但该方法已经被证明在揭示土壤磷循环机制中有巨大的应用潜力。随着分析技术的进步和研究的逐步深入,土壤磷循环机制一定会越来越清晰。
| [1] |
MacDonald G K, Bennett E M, Potter P A, et al. Agronomic phosphorus imbalances across the world's croplands[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(7): 3086-3091. DOI:10.1073/pnas.1010808108
(  0) 0) |
| [2] |
Li Z G, Zhang R H, Liu C, et al. Phosphorus spatial distribution and pollution risk assessment in agricultural soil around the Danjiangkou reservoir, China[J]. Science of the Total Environment, 2020, 699: 134417. DOI:10.1016/j.scitotenv.2019.134417
(  0) 0) |
| [3] |
Zhou G F. Effects of nitrogen and phosphate fertilizer application on water eutrophication in agricultural cultivation (In Chinese)[J]. Agricultural Engineering Technology, 2017, 37(5): 37. [周广飞. 农业种植中氮磷肥施用对水体富营养化的影响[J]. 农业工程技术, 2017, 37(5): 37.]
(  0) 0) |
| [4] |
Liu J, Yang J J. Molecular speciation of phosphorus in agricultural soils: Advances over the last 30 years (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3): 558-567. [刘瑾, 杨建军. 近三十年农田土壤磷分子形态的研究进展[J]. 土壤学报, 2021, 58(3): 558-567.]
(  0) 0) |
| [5] |
Tamburini F, Pfahler V, Bünemann E K, et al. Oxygen isotopes unravel the role of microorganisms in phosphate cycling in soils[J]. Environmental Science & Technology, 2012, 46(11): 5956-5962.
(  0) 0) |
| [6] |
Tian L Y, Guo Q J, Zhu Y G, et al. Research and application of method of oxygen isotope of inorganic phosphate in Beijing agricultural soils[J]. Environmental Science and Pollution Research, 2016, 23(23): 23406-23414. DOI:10.1007/s11356-016-7482-7
(  0) 0) |
| [7] |
Chu Q, Fan J L, Feng G. New advance of the p isotopic tracing in the ecology and resource-environmental sciences: A review (In Chinese)[J]. Journal of Nuclear Agricultural Sciences, 2012, 26(5): 828-837. [褚群, 范家霖, 冯固. 磷同位素示踪技术在生态与资源环境科学研究中的新进展[J]. 核农学报, 2012, 26(5): 828-837.]
(  0) 0) |
| [8] |
Blake R E. Biogeochemical cycling of phosphorus: Insights from oxygen isotope effects of phosphoenzymes[J]. American Journal of Science, 2005, 305(6/7/8): 596-620.
(  0) 0) |
| [9] |
McLaughlin K, Kendall C, Silva S R, et al. Phosphate oxygen isotope ratios as a tracer for sources and cycling of phosphate in North San Francisco Bay, California[J]. Journal of Geophysical Research: Biogeosciences, 2006, 111(G3): G03003.
(  0) 0) |
| [10] |
Longinelli A, Nuti S. Oxygen isotope measurements of phosphate from fish teeth and bones[J]. Earth and Planetary Science Letters, 1973, 20(3): 337-340. DOI:10.1016/0012-821X(73)90007-1
(  0) 0) |
| [11] |
Tian L Y, Guo Q J, Yu G R, et al. Phosphorus fractions and oxygen isotope composition of inorganic phosphate in typical agricultural soils[J]. Chemosphere, 2020, 239: 124622. DOI:10.1016/j.chemosphere.2019.124622
(  0) 0) |
| [12] |
Zhang C, Ji H B, Chen Z G. The application of phosphate oxygen isotope in organophosphorus degradation (In Chinese)[J]. Journal of Shandong Agricultural University(Natural Science Edition), 2018, 49(6): 1008-1014. [张弛, 季宏兵, 陈志刚. 磷酸盐氧同位素在有机磷降解研究中的应用[J]. 山东农业大学学报(自然科学版), 2018, 49(6): 1008-1014.]
(  0) 0) |
| [13] |
Ji J P, Xu Z F. Progress on tracing sources and biogeochemical cycling of phosphorus by using oxygen isotopes of phosphate (In Chinese)[J]. Environmental Science & Technology, 2010, 33(S2): 360-363. [冀建鹏, 徐志方. 磷酸盐的氧同位素示踪磷来源及循环研究进展[J]. 环境科学与技术, 2010, 33(S2): 360-363.]
(  0) 0) |
| [14] |
Tamburini F, Bernasconi S M, Angert A, et al. A method for the analysis of the δ18O of inorganic phosphate extracted from soils with HCl[J]. European Journal of Soil Science, 2010, 61(6): 1025-1032. DOI:10.1111/j.1365-2389.2010.01290.x
(  0) 0) |
| [15] |
Hedley M J, Stewart J W B, Chauhan B S. Changes in inorganic and organic soil phosphorus fractions induced by cultivation practices and by laboratory incubations[J]. Soil Science Society of America Journal, 1982, 46(5): 970-976. DOI:10.2136/sssaj1982.03615995004600050017x
(  0) 0) |
| [16] |
Tiessen H, Moir J O. Characterization of available P by sequential extraction//Carter M R, Gregorich E G. Soil sampling and methods of analysis[M]. Boca Raton: CRC Press, 2007: 297—306.
(  0) 0) |
| [17] |
Zohar I, Shaviv A, Klass T, et al. Method for the analysis of oxygen isotopic composition of soil phosphate fractions[J]. Environmental Science & Technology, 2010, 44(19): 7583-7588.
(  0) 0) |
| [18] |
McLaughlin K, Silva S, Kendall C, et al. A precise method for the analysis of δ18O of dissolved inorganic phosphate in seawater[J]. Limnology and Oceanography: Methods, 2004, 2(7): 202-212. DOI:10.4319/lom.2004.2.202
(  0) 0) |
| [19] |
Lei X T, Zhang H, Chen M, et al. The efficiency of sequential extraction of phosphorus in soil and sediment: Insights from the oxygen isotope ratio of phosphate[J]. Journal of Soils and Sediments, 2020, 20(3): 1332-1343. DOI:10.1007/s11368-019-02517-x
(  0) 0) |
| [20] |
Wen Y J, Liu R L, Wang H. Analysis of the oxygen isotopic composition of inorganic phosphate extracted from soils with NaHCO3 (In Chinese)[J]. Acta Scientiae Circumstantiae, 2017, 37(1): 326-331. [温云杰, 刘荣乐, 汪洪. 土壤碳酸氢钠提取态无机磷酸盐中氧同位素分析[J]. 环境科学学报, 2017, 37(1): 326-331.]
(  0) 0) |
| [21] |
Zhang H, Wang J N, Zhu Y G, et al. Research and application of analytical technique on δ18Op of inorganic phosphate in soil (In Chinese)[J]. Chinese Journal of Analytical Chemistry, 2015, 43(2): 187-192. [张晗, 王佳妮, 朱永官, 等. 土壤无机磷酸盐中氧同位素分析方法的研究及应用[J]. 分析化学, 2015, 43(2): 187-192.]
(  0) 0) |
| [22] |
Wen Y J, Song S H, Zhang J Y, et al. The oxygen isotopic composition of phosphates in soils extracted with HCl (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(1): 255-260. [温云杰, 宋书会, 张金尧, 等. 盐酸提取的土壤无机磷酸盐中氧同位素分析[J]. 植物营养与肥料学报, 2018, 24(1): 255-260.]
(  0) 0) |
| [23] |
McLaughlin K, Paytan A, Kendall C, et al. Oxygen isotopes of phosphatic compounds—Application for marine particulate matter, sediments and soils[J]. Marine Chemistry, 2006, 98(2/3/4): 148-155.
(  0) 0) |
| [24] |
Xu Z F, Huang T, Yin X J. Improvements in the preparation of phosphate for oxygen isotope analysis from soils and sediments[J]. PLoS One, 2018, 13(9): e0204203. DOI:10.1371/journal.pone.0204203
(  0) 0) |
| [25] |
Liu Y, Wang J F, Chen J G, et al. Pretreatment method for the analysis of phosphate oxygen isotope(δ18Op)of different phosphorus fractions in freshwater sediments[J]. Science of the Total Environment, 2019, 685: 229-238. DOI:10.1016/j.scitotenv.2019.05.238
(  0) 0) |
| [26] |
George T S, Giles C D, Menezes-Blackburn D, et al. Organic phosphorus in the terrestrial environment: A perspective on the state of the art and future priorities[J]. Plant and Soil, 2018, 427(1/2): 191-208.
(  0) 0) |
| [27] |
Tamburini F, Pistocchi C, Helfenstein J, et al. A method to analyse the isotopic composition of oxygen associated with organic phosphorus in soil and plant material[J]. European Journal of Soil Science, 2018, 69(5): 816-826. DOI:10.1111/ejss.12693
(  0) 0) |
| [28] |
Helfenstein J, Tamburini F, von Sperber C, et al. Combining spectroscopic and isotopic techniques gives a dynamic view of phosphorus cycling in soil[J]. Nature Communications, 2018, 9: 3226. DOI:10.1038/s41467-018-05731-2
(  0) 0) |
| [29] |
Pistocchi C, Mészáros É, Frossard E, et al. In or out of equilibrium? How microbial activity controls the oxygen isotopic composition of phosphate in forest organic horizons with low and high phosphorus availability[J]. Frontiers in Environmental Science, 2020, 8: 564778. DOI:10.3389/fenvs.2020.564778
(  0) 0) |
| [30] |
Siegenthaler M B, Tamburini F, Frossard E, et al. A dual isotopic(32P and 18O)incubation study to disentangle mechanisms controlling phosphorus cycling in soils from a climatic gradient(Kohala, Hawaii)[J]. Soil Biology and Biochemistry, 2020, 149: 107920. DOI:10.1016/j.soilbio.2020.107920
(  0) 0) |
| [31] |
Tamburini F, Pfahler V, von Sperber C, et al. Oxygen isotopes for unraveling phosphorus transformations in the soil-plant system: A review[J]. Soil Science Society of America Journal, 2014, 78(1): 38-46. DOI:10.2136/sssaj2013.05.0186dgs
(  0) 0) |
| [32] |
Tian L Y, Guo Q J, He H J, et al. Progress on phosphate oxygen isotope technology in environmental science (In Chinese)[J]. Chinese Journal of Ecology, 2016, 35(7): 1947-1956. [田丽艳, 郭庆军, 何会军, 等. 磷酸盐氧同位素技术在环境科学中的研究进展[J]. 生态学杂志, 2016, 35(7): 1947-1956.]
(  0) 0) |
| [33] |
Zhang H, Wang J N, Guo Q J, et al. Advance in study on method for oxygen isotopic analysis of phosphate in soil and its application (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(1): 19-27. [张晗, 王佳妮, 郭庆军, 等. 土壤磷酸盐氧同位素分析方法和应用研究进展[J]. 土壤学报, 2015, 52(1): 19-27.]
(  0) 0) |
| [34] |
Lécuyer C, Fourel F, Martineau F, et al. High-precision determination of 18O/16O ratios of silver phosphate by EA-pyrolysis-IRMS continuous flow technique[J]. Journal of Mass Spectrometry, 2007, 42(1): 36-41. DOI:10.1002/jms.1130
(  0) 0) |
| [35] |
Sun G F, Jin J Y, Shi Y L. Research advance on soil phosphorous forms and their availability to crops in soil (In Chinese)[J]. Soil and Fertilizer Sciences in China, 2011(2): 1-9. [孙桂芳, 金继运, 石元亮. 土壤磷素形态及其生物有效性研究进展[J]. 中国土壤与肥料, 2011(2): 1-9.]
(  0) 0) |
| [36] |
Zohar I, Shaviv A, Young M, et al. Phosphorus dynamics in soils irrigated with reclaimed waste water or fresh water—A study using oxygen isotopic composition of phosphate[J]. Geoderma, 2010, 159(1/2): 109-121.
(  0) 0) |
| [37] |
Roberts K, Defforey D, Turner B L, et al. Oxygen isotopes of phosphate and soil phosphorus cycling across a 6500 year chronosequence under lowland temperate rainforest[J]. Geoderma, 2015, 257/258: 14-21. DOI:10.1016/j.geoderma.2015.04.010
(  0) 0) |
| [38] |
Joshi S R, Li X N, Jaisi D P. Transformation of phosphorus pools in an agricultural soil: An application of oxygen-18 labeling in phosphate[J]. Soil Science Society of America Journal, 2016, 80(1): 69-78. DOI:10.2136/sssaj2015.06.0219
(  0) 0) |
| [39] |
Amelung W, Antar P, Kleeberg I, et al. The δ18O signatures of HCl-extractable soil phosphates: Methodological challenges and evidence of the cycling of biological P in arable soil[J]. European Journal of Soil Science, 2015, 66(6): 965-972. DOI:10.1111/ejss.12288
(  0) 0) |
| [40] |
Angert A, Weiner T, Mazeh S, et al. Soil phosphate stable oxygen isotopes across rainfall and bedrock gradients[J]. Environmental Science & Technology, 2012, 46(4): 2156-2162.
(  0) 0) |
| [41] |
Angert A, Weiner T, Mazeh S, et al. Seasonal variability of soil phosphate stable oxygen isotopes in rainfall manipulation experiments[J]. Geochimica et Cosmochimica Acta, 2011, 75(15): 4216-4227. DOI:10.1016/j.gca.2011.05.002
(  0) 0) |
| [42] |
Bauke S L, von Sperber C, Siebers N, et al. Biopore effects on phosphorus biogeochemistry in subsoils[J]. Soil Biology and Biochemistry, 2017, 111: 157-165. DOI:10.1016/j.soilbio.2017.04.012
(  0) 0) |
| [43] |
Bi Q F, Zheng B X, Lin X Y, et al. The microbial cycling of phosphorus on long-term fertilized soil: Insights from phosphate oxygen isotope ratios[J]. Chemical Geology, 2018, 483: 56-64. DOI:10.1016/j.chemgeo.2018.02.013
(  0) 0) |
| [44] |
Granger S J, Harris P, Peukert S, et al. Phosphate stable oxygen isotope variability within a temperate agricultural soil[J]. Geoderma, 2017, 285: 64-75. DOI:10.1016/j.geoderma.2016.09.020
(  0) 0) |
| [45] |
Gross A, Angert A. Use of 13C- and phosphate 18O-labeled substrate for studying phosphorus and carbon cycling in soils: A proof of concept[J]. Rapid Communications in Mass Spectrometry, 2017, 31(11): 969-977. DOI:10.1002/rcm.7863
(  0) 0) |
| [46] |
Gross A, Nishri A, Angert A. Use of phosphate oxygen isotopes for identifying atmospheric-P sources: A case study at lake Kinneret[J]. Environmental Science & Technology, 2013, 47(6): 2721-2727.
(  0) 0) |
| [47] |
Gross A, Turner B L, Wright S J, et al. Oxygen isotope ratios of plant available phosphate in lowland tropical forest soils[J]. Soil Biology and Biochemistry, 2015, 88: 354-361. DOI:10.1016/j.soilbio.2015.06.015
(  0) 0) |
| [48] |
Hacker N, Wilcke W, Oelmann Y. The oxygen isotope composition of bioavailable phosphate in soil reflects the oxygen isotope composition in soil water driven by plant diversity effects on evaporation[J]. Geochimica et Cosmochimica Acta, 2019, 248: 387-399. DOI:10.1016/j.gca.2018.11.023
(  0) 0) |
| [49] |
Ishida T, Uehara Y, Iwata T, et al. Identification of phosphorus sources in a watershed using a phosphate oxygen isoscape approach[J]. Environmental Science & Technology, 2019, 53(9): 4707-4716.
(  0) 0) |
| [50] |
Lei X T, Chen M, Guo L D, et al. Diurnal variations in the content and oxygen isotope composition of phosphate pools in a subtropical agriculture soil[J]. Geoderma, 2019, 337: 863-870. DOI:10.1016/j.geoderma.2018.10.039
(  0) 0) |
| [51] |
Pfahler V, MacDonald A, Mead A, et al. Changes of oxygen isotope values of soil P pools associated with changes in soil pH[J]. Scientific Reports, 2020, 10: 2065. DOI:10.1038/s41598-020-59103-2
(  0) 0) |
| [52] |
Pistocchi C, Tamburini F, Gruau G, et al. Tracing the sources and cycling of phosphorus in river sediments using oxygen isotopes: Methodological adaptations and first results from a case study in France[J]. Water Research, 2017, 111: 346-356. DOI:10.1016/j.watres.2016.12.038
(  0) 0) |
| [53] |
Siebers N, Bauke S L, Tamburini F, et al. Short-term impacts of forest clear-cut on P accessibility in soil microaggregates: An oxygen isotope study[J]. Geoderma, 2018, 315: 59-64. DOI:10.1016/j.geoderma.2017.11.024
(  0) 0) |
| [54] |
姜朝华. 农田土壤不同形态磷酸盐氧同位素比值的精确测量及其控制因子的研究[D]. 湖南衡阳: 南华大学, 2016. Jiang Z H. The accurate measurement and control factors of the phosphate oxygen isotope ratios of different phosphate forms in farmland soil[D]. Hengyang, Hunan: University of South China, 2016. (  0) 0) |
| [55] |
Scheerer U, Netzer F, Bauer A F, et al. Measurements of 18O-Pi uptake indicate fast metabolism of phosphate in tree roots[J]. Plant Biology, 2019, 21(4): 565-570. DOI:10.1111/plb.12922
(  0) 0) |
| [56] |
Piotrowska-Długosz A, Lemanowicz J, Długosz J. The spatial pattern and seasonal changes in the soil phosphorus content in relation to the phosphatase activity: A case study of Luvisols[J]. Archives of Agronomy and Soil Science, 2020, 66(11): 1583-1597. DOI:10.1080/03650340.2020.1759798
(  0) 0) |
| [57] |
Bauke S L, von Sperber C, Tamburini F, et al. Subsoil phosphorus is affected by fertilization regime in long-term agricultural experimental trials[J]. European Journal of Soil Science, 2018, 69(1): 103-112. DOI:10.1111/ejss.12516
(  0) 0) |
| [58] |
Mingus K, Liang X M, Massoudieh A, et al. Stable isotopes and Bayesian modeling methods of tracking sources and differentiating bioavailable and recalcitrant phosphorus pools in suspended particulate matter[J]. Environmental Science & Technology, 2019, 53(1): 69-76.
(  0) 0) |
| [59] |
Yuan H Z, Li Q, Kukkadapu R K, et al. Identifying sources and cycling of phosphorus in the sediment of a shallow freshwater lake in China using phosphate oxygen isotopes[J]. Science of the Total Environment, 2019, 676: 823-833. DOI:10.1016/j.scitotenv.2019.04.322
(  0) 0) |
| [60] |
Tonderski K, Andersson L, Lindström G, et al. Assessing the use of δ18O in phosphate as a tracer for catchment phosphorus sources[J]. Science of the Total Environment, 2017, 607/608: 1-10. DOI:10.1016/j.scitotenv.2017.06.167
(  0) 0) |
| [61] |
von Sperber C, Kries H, Tamburini F, et al. The effect of phosphomonoesterases on the oxygen isotope composition of phosphate[J]. Geochimica et Cosmochimica Acta, 2014, 125: 519-527. DOI:10.1016/j.gca.2013.10.010
(  0) 0) |
| [62] |
Bigio L, Angert A. Oxygen isotope signatures of phosphate in wildfire ash[J]. ACS Earth and Space Chemistry, 2019, 3(5): 760-769. DOI:10.1021/acsearthspacechem.8b00216
(  0) 0) |
| [63] |
Mizota C, Domon Y, Yoshida N. Oxygen isotope composition of natural phosphates from volcanic ash soils of the Great Rift Valley of Africa and east Java, Indonesia[J]. Geoderma, 1992, 53(1/2): 111-123.
(  0) 0) |
| [64] |
Melby E S, Soldat D J, Barak P. Biological decay of 18O-labeled phosphate in soils[J]. Soil Biology and Biochemistry, 2013, 63: 124-128. DOI:10.1016/j.soilbio.2013.03.020
(  0) 0) |
| [65] |
Pfahler V, Tamburini F, Bernasconi S M, et al. A dual isotopic approach using radioactive phosphorus and the isotopic composition of oxygen associated to phosphorus to understand plant reaction to a change in P nutrition[J]. Plant Methods, 2017, 13: 75. DOI:10.1186/s13007-017-0227-x
(  0) 0) |
| [66] |
Jiang Z H, Zhang H, Jaisi D P, et al. The effect of sample treatments on the oxygen isotopic composition of phosphate pools in soils[J]. Chemical Geology, 2017, 474: 9-16. DOI:10.1016/j.chemgeo.2017.10.017
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


