2. 中国科学院沈阳应用生态研究所, 沈阳 110016
2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, China
微生物是驱动土壤元素生物地球化学循环的引擎,在土壤有机质(soil organic matter,SOM)转化过程中发挥着重要作用[1]。微生物可通过矿化作用将SOM分解并释放CO2至大气中,也能通过同化作用将SOM转化为自身组分,并在其死亡后以微生物残体的形态在土壤中积累[2]。随着生物学研究手段的不断进步,越来越多的证据表明:真菌和细菌的细胞残体是土壤稳定有机碳库的重要组分[3-4],这使得微生物残体在SOM积累和转化过程中的作用越来越受到重视[5]。近期提出的土壤微生物碳泵理论[2]进一步聚焦和强调了微生物同化作用介导的细胞残体积累对土壤有机碳截获的重要性,其核心是微生物通过细胞生长、数量增殖和死亡积累等连续迭代过程产生大量细胞残体,对土壤碳固存具有重要作用。因此,开展微生物残体在SOM中积累、转化和稳定化的研究工作有助于加深对土壤有机碳固存乃至全球碳循环的认识[6]。
本文对近年来微生物残体的相关研究进行了梳理和总结,在明确土壤微生物残体来源及其重要性的基础上,介绍了土壤微生物残体定量和转化的表征方法,阐述了微生物残体在SOM积累转化过程中的作用及其主要影响因素,最后探讨了微生物残体在土壤中的稳定机制。期望能为进一步探究SOM周转与微生物过程的相互作用机理提供一定的思考。
1 土壤微生物残体的来源及其重要性微生物对SOM的作用与微生物数量、群落组成及其代谢产物的形成和降解有关[7]。随着分子生物学技术的快速发展,研究者可从基因水平将土壤生态过程与微生物群落组成进行直接关联,用来评价微生物在SOM周转过程中的作用与功能[8]。这方面研究对于揭示微生物同化底物的瞬时性响应特征具有重要的指示意义。但上述研究方法无法获知SOM转化过程中微生物的连续作用过程和积累效应[9]。微生物代谢与SOM转化在时间上具有连续性,外源养分或有机物质输入不仅影响微生物的瞬时性响应特征,也会直接或间接影响微生物对SOM积累和转化的贡献[10-11]。实质上,微生物参与SOM的积累转化过程很大程度上是微生物增殖-代谢-死亡周转的连续累积效应的体现。当外源底物输入后,微生物能够同化底物不断合成和构建细胞组分,并最终以细胞残体的形式积累在土壤中[12]。如果仅以活体微生物量来评价,会低估微生物在土壤有机质形成和积累过程中的贡献。根据马尔可夫模型推测发现,土壤微生物残体库的大小为活体生物量的40倍[13]。最近,Liang等[6]基于不同生态系统中微生物残体对土壤有机碳的贡献进行综合分析后得出,微生物残体的贡献比例超过50%,进一步说明微生物通过细胞残体形式向土壤中输送有机物质的数量远高于传统意义上的认知[14]。
越来越多的研究表明,微生物细胞残体(包括完整或不同破碎程度的细胞壁组分)是SOM形成的重要前体物质,在土壤有机碳的长期截获和稳定过程中发挥重要作用[2]。基于核磁共振波谱(NMR)技术的结果显示,SOM中包含大量的微生物来源物质,对有机质的贡献比例超过50%[15]。采用同位素标记-热解色谱-同位素比例质谱的研究手段对农田SOM组成进行分析发现:微生物来源的几丁质和多聚糖等细胞壁组分伴随着微生物生长代谢和死亡循环过程在土壤中不断积累,由于其自身难降解的生化特性使其成为稳定SOM的重要来源[16-17]。Miltner等[18]利用固体核磁共振技术(13C-CP/MAS NMR)比对添加了13C标记大肠杆菌细胞的土壤和对照土壤中碳化学结构的变化,证明土壤微生物来源碳对稳定性SOM的形成起重要作用。对上述试验样品进行224 d培养后,发现50%的微生物来源碳仍保留于土壤中,且主要存在于非活性有机质组分中[5];进一步利用扫描电子显微镜观察到土壤矿物表面多是200~500 nm有机碎片,大部分为不同分解程度和破碎的细胞壁,且这部分细胞壁碎片与在干净无菌的原位培养条件下培养成的碎片具有相似的性质。上述研究结果表明,微生物生长代谢过程中不断积累和破碎的细胞壁物质是微生物残体的重要来源,也是微生物来源有机质的重要贡献者。与此同时,这部分微生物残体可通过与土壤矿物表面相结合,增加其在土壤中的稳定性和长期固持[10,19]。因此,探讨微生物在SOM形成和积累过程中的作用时,需要考虑微生物残体的形成过程、积累动态和稳定机制,这样才能更有效地评价微生物在SOM转化过程中的长期作用效应。
2 土壤微生物残体定量和转化的表征方法 2.1 土壤微生物残体定量的评价指标虽然微生物残体在SOM积累和转化过程中发挥着重要作用,但由于技术上很难区分微生物残体来源碳和非微生物来源有机碳,使得直接测量微生物残体的含量很难实现。微生物残体实质上是包含许多化合物分子的复杂混合体,有一些具有特定特点的标识物分子可用来指示微生物来源的有机碳组分[20-21]。理论上,任何可在土壤中长期保持相对稳定的微生物细胞来源的有机化合物分子均可帮助揭示微生物残体的积累转化动态及其参与SOM转化的机制。微生物残体研究中的生物标识物主要包括氨基酸、蛋白质、磷脂、DNA及细胞壁组分氨基糖。目前除氨基糖外,其他标识物的应用非常少[11,20-22]。土壤氨基糖是微生物细胞壁的重要组分,在微生物细胞死亡后能够稳定存在于土壤基质中,可为微生物残体的积累动态提供有效的指示作用。目前有四种氨基糖可被提取并量化,包括氨基葡萄糖、氨基半乳糖、氨基甘露糖和胞壁酸[23]。其中,土壤中的胞壁酸唯一来源于细菌细胞壁的肽聚糖层,氨基葡萄糖主要来源于真菌细胞壁,而氨基半乳糖的来源仍存在较大争议[20]。氨基甘露糖由于其来源不明确,且含量变异大,很多文章均未进行报道[11]。基于土壤氨基糖的异源性,微生物群落中优势菌群(主要是真菌和细菌)的变化能够通过其代谢残体的数量和比例变化影响SOM的积累[7]。通常用氨基葡萄糖与氨基半乳糖的比例以及氨基葡萄糖与胞壁酸的比例来表征不同微生物群落(真菌与细菌)在SOM积累和养分循环中的相对贡献[20]。氨基糖具有较高的稳定性,不会随着外界环境因素的改变而迅速起较大变化,对土壤微生物的长期作用过程具有“记忆效应”[11]。根据氨基糖的含量和组成变化能提供SOM积累过程中的微生物印记,可在化合物分子水平上定量评价微生物残体对SOM积累的贡献,对于阐明微生物在调控SOM转化及持续固碳过程中的作用具有独特的意义和优势[24]。很多研究者应用此方法在不同气候区和不同时空尺度下开展了大量微生物残体的相关研究,并取得了很好的试验结果,使氨基糖作为微生物残体标识物的应用逐渐得到了学术界的关注和广泛认可[25]。
为了考察微生物残体碳库的大小及其在土壤有机碳中的占比,研究者将土壤氨基糖数据进行了转换[26-27]。具体而言,用土壤中胞壁酸的含量乘以45得到细菌残体碳的含量,其中转换系数45是基于一定的假设获得,即细菌群落中革兰氏阳性菌和革兰氏阴性菌的比例为65%和35%,革兰氏阳性菌和革兰氏阴性菌中胞壁酸的平均含量分别为13.9 mg·g–1和3.7 mg·g–1,同时假设细菌中碳的含量为46%[26]。而真菌残体碳的计算是用土壤中的总氨基葡萄糖的含量减去细菌来源的氨基葡萄糖含量,然后乘以转换系数9,假设细菌中胞壁酸和氨基葡萄糖的摩尔数比为1︰2,真菌中氨基葡萄糖的平均含量为49 mg·g–1,同时假设真菌中碳的含量为46%[27]。这种转换对评价微生物残体碳对土壤有机碳的贡献具有重要意义。公式如下:
| $ \begin{array}{*{20}{c}} 细菌残体碳/({\rm{mg}·g}^{–1})=胞壁酸的含量({\rm{mg·kg}}^{–1})\\ \times 45/1\ 000 \end{array} $ | (1) |
| $ \ \ \ \ \ \ \ \ 真菌残体碳/({\rm{mg·g}}^{-1})=(氨基葡萄糖的含量\\ ({\rm{mg·kg}}^{-1})/氨基葡萄糖的摩尔质量(179\ {\rm{g·mol}}^{-1})–\\ 2 \times 胞壁酸的含量({\rm{mg·kg}}^{-1})/胞壁酸的摩尔质量\\ (251\ {\rm{g·mol}}^{-1})) \times 氨基葡萄糖的摩尔质量(179\ {\rm{g·mol}}^{-1})\\ \times 9/1\ 000\\ $ | (2) |
值得注意的是,基于氨基糖来计算微生物残体碳也有一定的局限性[8,18]。主要是由于在应用氨基糖标识物获取转化系数时是在室内纯培养条件下进行的,这种转化系数在实际环境中会有较大变化,进而会导致依据此系数计算微生物残体的数量估算变异较大。但是目前在缺少更为可靠的替代分析方法之前,氨基糖的分析方法仍不失为一种有效的微生物残体估算手段[25]。
2.2 土壤微生物残体转化的表征方法理论上,跟踪和描述土壤氨基糖的合成转化动态变化,在探究和评价微生物通过同化代谢作用参与有机质转化和持续固碳过程中的作用具有独特的意义和优势[9]。然而,从氨基糖的数量变化上无法准确推知微生物利用外源底物合成氨基糖的动态变化及评价微生物活性的相对变化。从技术手段上,只有实现土壤中新生成的微生物残体和土壤中原有微生物残体的有效区分,才能在化合物分子水平上探讨外源碳素的微生物转化动态与稳定机制。He等[28]建立的气相色谱-质谱联机技术(gas chromatographymass spectrometry,GC-MS)为研究外源标记底物进入氨基糖的富集转化动态提供了强有力的支持。GC-MS技术可将时间因素纳入研究范围,对目标化合物进行动态特征研究,是分析氨基糖中同位素比例变化的有效方法之一[29]。通过加入含13C或15N的标记底物并跟踪13C在氨基糖“碳骨架”的结合或15N在“氨基位”富集随时间的变化,可计算微生物利用标记碳氮合成细胞壁物质的速率和容量,从而反映微生物新陈代谢速率,进而推知微生物对土壤碳氮截获及对SOM循环的贡献[28,30]。通过研究添加活性碳源(葡萄糖)后微生物同化无机氮素(15N标记硫酸铵)合成氨基糖的过程,表明碳源的可利用性是影响微生物同化无机氮素构建细胞组分的主控因素,在有活性碳源存在的条件下,铵态氮较硝态氮(15N标记硫酸铵和15N标记硝酸钾)更易于被微生物优先利用,并且短期内细菌较真菌对活性底物添加的响应更为强烈,表现为细菌残体在底物添加初期快速合成,而真菌残体在后期的合成强度逐渐超过细菌[31]。此外,气相色谱-燃烧-同位素比例质谱联用技术(gas chromatography-combustion-isotopic ratio mass spectrometry,GC-C-IRMS)也可进行自然丰度或人工标记13C底物添加条件下氨基糖δ13C的测定,用于评价微生物参与碳转化及微生物死亡残体介导的有机碳截获的研究中[9]。但应用该技术测定氨基糖的同位素丰度值时,由于衍生过程中会引入碳原子,所以会引起同位素的分馏。另外一种用于氨基糖同位素分析的方法是阴离子交换高效液相色谱法(high-performance anion-exchange liquid chromatography,HPAE-LC-IRMS),由于该方法不需要对样品进行衍生,前期准备简单,同位素矫正更为直接,是一种很有前景的化合物同位素测定方法[32]。但该方法分离氨基糖的精确度较低,尤其是含量较低的甘露糖和胞壁酸,需要进一步优化[11]。
根据氨基糖组分中同位素富集比例的变化,计算出新合成氨基糖的数量,定量评价新生成的微生物残体对土壤原有组分的更新和替代程度,解析底物-微生物的调控与反馈作用[9]。同时根据标记底物碳氮进入不同微生物(真菌和细菌)来源氨基糖的富集动态变化,可评价底物转化过程中微生物群落组成的连续性变化及不同微生物在外源碳氮截获过程中的相对贡献大小[33]。最近,研究者[19]利用高丰度氮培养基对微生物进行培养获得真菌和细菌残体,然后在野外进行微生物残体原位分解实验,来考察微生物残体的周转速率,结果发现培养800 d后仍有33%~40%的微生物残体存留于土壤中,而且以微生物残体氮素指示的分解速率在细菌和真菌之间无显著差异,为研究土壤微生物残体的周转提供了新的思路。可见,将微生物标识物和稳定同位素示踪技术相结合,为深入探讨微生物在SOM积累过程中的持续作用效应及对有机质组分的更新过程研究提供了有力的手段和技术支撑。
3 微生物残体在SOM中的积累转化及其影响因素微生物残体在土壤中的形成、积累和转化受到内部自身因素和外界环境因子的显著影响,明确影响微生物残体积累转化的主要作用因子有助于提升对微生物参与的SOM形成和稳定化过程的理解与调控[25]。内部因素主要是土壤中不同种类微生物自身的生理生化特性差异(如微生物细胞组成、生长速率等),使得不同微生物的生长代谢活性不同,进而影响微生物残体的形成及其对SOM的贡献[34],本文在此不做探讨。仅对外界环境主要影响因子进行概述,主要包括养分管理措施、耕作和土地利用方式及气候变化(如温度升高、氮沉降)(图 1)。
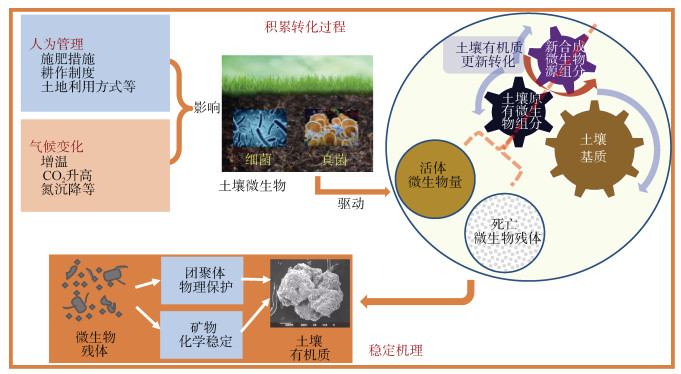
|
图 1 微生物残体在土壤中的积累转化过程与稳定机理 Fig. 1 Accumulation, turnover and stabilization of microbial residues in soil |
陆地生态系统中土壤微生物通常处于“饥饿”状态,其活性受到能源和养分的强烈影响[35]。因此,养分管理措施,如外源氮磷养分和碳源加入土壤后,会不同程度地改变原有的物质和能量循环过程及微生物活性[36]。随着新陈代谢作用的改变,以真菌几丁质和细菌肽聚糖为代表的微生物细胞壁残体在土壤中的含量会不断发生改变,进而影响微生物残体的积累动态及其对有机质库的贡献。例如,He等[31]利用添加13C标记葡萄糖对氨基糖合成和矿化过程的研究结果表明,以胞壁酸为代表的细菌残体在土壤中的合成和矿化速率快于以氨基葡萄糖为代表的真菌残体,后者对有机质稳定性的贡献更大。Geyer等[37]利用室内模拟和meta分析手段,探讨了活性碳源添加后是否短期内(72 h)就会有微生物残体的形成,研究发现,在土壤中添加活性碳源(13C标记葡萄糖)后,6 h内就有30%~34%的葡萄糖来源碳进入微生物残体中,说明外源碳能快速被微生物同化并形成细胞残体积累在土壤中,这有利于活性碳源在土壤中的长期保持。Bai等[38]采用室内培养方法探讨了13C标记的小麦植株残体(根、茎、叶)在培养21 d内向氨基糖的富集情况,结果表明,微生物利用根茎叶来源碳素合成氨基糖的数量动态及峰值明显不同。Liang等[39]在室内培养条件下,通过氨基糖的含量变化研究了大豆和玉米秸秆添加在土壤中的微生物转化过程,结果表明,在较短的培养时间内,底物添加的数量是影响微生物过程的重要因素;而在相对较长的时间范围内,底物的组成则是主要影响因子。同时,外源底物输入后土壤氨基糖的合成转化过程还受到土壤原有有机质水平的影响[40]。例如,Wang等[41]研究了两种有机质含量差异显著的农田黑土和红壤中微生物利用13C标记葡萄糖合成氨基糖的数量和转化动态,发现在有机碳匮乏的红壤中微生物对活性碳底物添加的响应更为强烈,并存在由真菌向细菌群落演替的趋势;在有机碳含量较高的黑土中外源碳生成微生物残体的数量更多,对外源底物的同化效率更高。由此可以看出,以氨基糖为代表的微生物残体积累转化过程受到外加碳源和养分的显著影响,并且与土壤本身的有机质特性密切相关。此外,根据生态计量学理论,微生物的生长需要有合适的元素计量比(如碳氮磷),为维持这种体内化学计量平衡,微生物会将土壤有机质矿化,进而驱动土壤微生物的代谢过程发生变化[42]。由于不同微生物种类具有不同的元素计量比和能量需求,进而会导致微生物的代谢能力、微生物生物量和最终微生物残体的生成量有所不同[42]。但是目前很少有研究从能量和计量学角度探讨其对微生物残体形成的调控效应。
田间条件下,施肥是一种重要的养分管理措施,会对土壤-植物系统中物质和能量的输入-输出平衡产生扰动,从而影响微生物的活性、数量及有机质的生物降解过程。研究表明,外源肥料和有机物质(作物秸秆和厩肥)输入土壤后会直接影响微生物的群落组成、数量及其代谢活性[43],进而影响微生物死亡残体的积累动态[44]。在农田生态系统中,已有关于有机物质输入对微生物残体积累影响方面的研究多集中于旱地[45],例如,Ding等[40]研究表明,施入不同种类有机物料对农田黑土微生物残体积累数量有显著影响;Ye等[46]基于对南方旱地农田土壤的研究结果也得出了相似的研究结论,而且真菌和细菌对有机物料添加的响应不同,说明微生物残体的积累转化动态受有机肥还田数量和质量的影响。近年来,关于微生物死亡残体对稻田土壤有机碳截获方面的研究也日渐受到研究者的关注[47-49]。鉴于稻田特有的水耕熟化作用和淹水造成独特的还原厌氧环境,水稻土中外源有机物质输入后微生物代谢过程(同化合成和异化分解)会与旱地生态系统有所不同,相应的微生物代谢产物(细胞残体)的数量和积累特征会有所差异。Xia等[48]分析了我国东部中温带、暖温带、亚热带和热带四个气候区的稻田土壤中氨基糖含量的变化情况,发现微生物残体对水稻土有机碳积累的贡献在温暖、湿润的热带亚热带地区要高于寒冷干燥的温带地区,并且真菌和细菌残体对气候因子变化的响应不同,说明不同地区稻田土壤微生物残体的积累特征和内在机制不同。根据Chen等[49]基于红壤丘陵区典型稻田的研究结果,长期作物秸秆和有机肥输入会提高水稻土根际和非根际土壤微生物生长速率,最终促进微生物残体的积累。综上,养分管理措施通过影响微生物的数量、活性或群落结构最终会影响微生物的同化合成代谢作用,表现为微生物残体的生成和积累数量发生变化。同时,由于不同种类微生物(真菌和细菌)对底物添加的响应不同,真菌和细菌同化外源底物后生成细胞残体的数量和积累特征会有所不同。这些变化将直接影响SOM库中微生物残体的积累数量和贡献比例,进而影响SOM的组成(植物来源和微生物来源)组分相对积累差异及其稳定性的变化。
3.2 耕作和土地利用方式耕作方式和土地利用方式变化强烈影响着土壤微生物的作用过程,进而影响微生物参与的土壤碳氮循环过程[50]。研究[51]表明,氨基糖在农田土壤中的积累动态受耕作措施的显著影响。免耕无秸秆覆盖对微生物细胞残体及土壤有机碳含量无显著影响,而免耕结合秸秆覆盖则显著促进了表层土壤有机碳以及微生物残体的积累[52]。这是因为免耕条件下土壤受外界的扰动减少,真菌的菌丝能够保留下来,同时,秸秆覆盖地表为微生物生长活动提供必要的底物,进而加快土壤微生物利用外源养分进行新陈代谢和自身物质的合成[53]。此外,免耕的土壤环境有利于保护微生物的生境免遭翻耕引起的破坏,相对稳定的土壤温湿度以及良好的团聚体结构均有利于微生物在土壤中的生长繁殖,进而促进了微生物代谢产物如氨基糖等物质在土壤中的积累和保持[7]。在传统耕作方式下,频繁的土壤扰动对真菌菌丝破坏严重,真菌生物量的减少引起真菌来源氨基葡萄糖的降低;传统耕作还会引起土壤团聚体的破坏,使得原来与土壤团聚体相结合的微生物残体暴露出来,在底物可利用性较低时被微生物分解利用[54]。传统耕作条件下,通过增加绿肥作物覆盖,能够有效抵消耕作对微生物残体积累的负效应[51]。
土地利用方式变化,如森林或草地开垦为农田,会直接影响地上和地下有机物质输入的数量和质量,从而影响微生物主导的元素地球生物化学循环。研究[55-57]表明,土地利用方式的改变对土壤微生物残体的积累具有显著影响。天然湿地或草地开垦为农田会引起微生物代谢残体和有机碳数量的快速下降,并伴随真菌和细菌相对比例的显著变化[56-57]。Amelung等[58]以南非Highveld地区沙质土为研究对象,研究了不同开垦年限土壤中氨基糖的含量变化,结果表明,死亡残体标识物氨基糖的含量在开垦前20年下降最快,随着开垦年限的延长,这种下降趋势一直存在,直至开垦98年土壤氨基糖含量下降60%。后续的研究[55]结果表明,这种长期连作的农田土壤,即使退耕休养也很难在短期内(30年)恢复至原有水平。Ding等[56]以我国东北农田黑土为研究对象,对草地开垦为农田的土壤剖面(0~90 cm)中微生物残体的变化进行了研究,发现草地开垦为农田50年后0~90 cm剖面土壤总有机碳和微生物残体数量均显著下降,而且真菌与细菌残体的比值显著降低。值得注意的是,在表层以下(30~90 cm)微生物残体碳的损失速率要高于土壤总有机碳,说明随着土地利用方式的变化,底层土壤中微生物来源有机物质的损失比例增加,导致SOM组成发生改变,这对土壤有机碳的长期截获和稳定会产生深远影响。再次将开垦后的退化农田重新恢复为湿地或草地后,在10~20年的时间尺度上微生物来源有机碳的积累量及其对有机质库的贡献比例仍无法恢复至初始状态,暗示土地利用方式变化对SOM的来源和组成会有长期的影响[57]。Li等[59]研究表明,我国亚热带区森林开垦为农田后真菌和细菌同化硝态氮合成氨基糖的能力显著下降,但真菌的下降比例要显著高于细菌。研究结果也进一步证明了森林开垦为农田后导致土壤中硝态氮固持能力下降,这与微生物同化代谢介导的细胞残体形成过程密切相关。Huang等[60]研究了亚热带地区玉米-黄豆田改为种植牧草、桑葚和甘蔗后微生物残体的变化情况,发现影响微生物残体对有机碳积累贡献的主要因子是SOM和微生物量之间的碳氮化学计量比,土地利用方式改变后加剧了碳氮比的失衡,是导致微生物残体对土壤碳截获贡献减少的主要原因。由此可见,土地利用方式的改变是影响土壤微生物残体积累的重要人为干扰因素。鉴于微生物残体在SOM截获和稳定过程中的重要性,在生产实践中探讨如何通过适宜的土地管理措施来提升微生物残体的积累强度和固持时间,对于应对人类活动和全球变化引起的生态系统碳截获潜力及其稳定性方面的变化具有重要意义。
3.3 气候变化因子全球气候变化(升温、氮沉降和大气CO2浓度升高)会影响陆地生态系统碳循环,对地下根系碳的输入以及土壤微生物群落的结构和代谢功能也会产生重要影响,这必然会影响微生物残体在土壤中的积累和转化过程。然而,目前气候变化因子,尤其是多环境因子耦合效应对微生物残体在土壤中固持的影响研究非常有限。全球气候变化背景下,为准确预测微生物来源碳对气候变化的响应,需要明确微生物残体对一系列环境因子的响应,这方面研究对于进一步揭示微生物残体在土壤中的固持和转化的内在机制至关重要。换言之,亟待探明气候因子变化如何影响微生物残体的积累过程与强度及内在驱动机理[2,6]。Jia等[61]以青藏高原海北站的长期增温试验为平台,结合13C标记葡萄糖的室内培养实验,对比研究了增温背景下表层(0~10 cm)和底层(30~40 cm)土壤中微生物残体的形成数量和有机质激发效应强度的响应规律,结果发现,与对照相比,增温后底层土壤微生物利用标记外源碳生成微生物残体的数量低于表层土壤,而其矿化激发效应却明显高于表层。上述结果说明,增温降低了底层土壤微生物碳利用效率和残体积累效率,限制了土壤微生物的碳截获潜力,而对表层土壤微生物过程无显著影响。Liang和Balser[62]以加利福尼亚草原生态系统为研究对象,探讨了连续9年CO2浓度升高、增温和氮沉降三个因子单独或耦合作用对微生物残体积累的影响,研究结果表明,增温和氮沉降能显著影响微生物残体的积累数量及其占土壤有机碳的比例,但是二者引起微生物残体对有机碳贡献减弱的内在变化机制不同;增温条件下,微生物残体数量显著下降,但总有机碳含量变化较小;氮沉降背景下总有机碳增加,但微生物残体降幅较小。与上述研究结果不同,Ding等[63]以青藏高原高寒草甸生态系统为研究对象,探讨了增温后表层和底层微生物残体积累的响应特征,结果发现在0~50 cm土层内,增温能显著增加微生物来源碳在土壤有机碳库中的贡献比例,尤其是真菌残留物在土壤有机碳库的比例明显增加,暗示增温后高寒草甸生态系统中土壤有机碳库的组成(微生物来源和植物来源)发生了本质上的变化,说明气候变化对地下微生物的影响会对陆地生态系统功能演变产生深远的影响。进一步选取青藏高原的另两种典型生态系统(沼泽草甸和高寒草原)土壤为研究对象,发现增温会引起高寒草原生态系统中微生物残体的快速下降,对有机碳的贡献也明显减小;而增温会导致沼泽草甸生态系统中微生物残体显著增加[64]。同样,Zhang等[65]通过模拟氮沉降对微生物同化外源氮合成微生物残体的研究中发现,氮添加有助于促进微生物残体的形成和积累,并且不同形态氮源之间的微生物偏好利用不同。上述研究结果的不一致性说明微生物残体对气候变化的响应具有生态系统特异性,可能是不同生态系统中土壤类型和水分、养分含量等因素导致。可见,气候变化对微生物死亡残体介导的碳截获过程的影响较为复杂,因此,在预测全球气候变化对生态系统碳储量的影响时,需要考虑生态系统自身的差异和多种因子互作效应。
4 微生物残体在土壤中的稳定机制SOM的稳定性主要取决于其自身的化学结构和抗分解特性、团聚体的物理保护以及与土壤矿物相互作用的化学保护。微生物残体作为微生物来源有机组分在土壤中的保持和稳定也与这三方面密切相关(图 1)。微生物同化过程导致微生物残体的持续生成,并通过自身的稳定性或土壤的物理/化学保护作用而不断积累并稳定于土壤中[11]。
多数微生物细胞壁组分是大分子聚合物,通常在土壤中较难分解[20],而且不同类别微生物残体的结构和化学组成不同[10,66],可能使其在土壤中的分解速率和稳定性有所不同[67]。真菌细胞壁的含氮化合物主要是由几丁质和黑色素组成,二者降解速率较慢,稳定性较高[66];而细菌细胞壁中含氮化合物主要是由肽聚糖组成,通常认为更容易分解[66]。例如,根据稳定同位素示踪研究结果,以胞壁酸为代表的细菌残留物稳定性较低,与其他氨基糖相比在土壤中更容易被分解转化,在土壤养分周转过程中扮演重要角色;而以氨基葡萄糖为代表的真菌残留物在土壤中转化相对较慢,主要贡献于土壤有机碳的长期截获[30]。同时,由于真菌和细菌残体的化学组成特性不同,二者与土壤矿物相互作用过程及稳定性不同,所以二者具有不同的转化速率。然而,Wang等[19]通过氮标记培养方法开展了为期800 d微生物残留物原位分解实验,发现微生物残留物氮素在土壤中较难分解,但分解速率在真菌、细菌和放线菌间无显著差异。不同研究结果之间的差异,可能是由于所选取的研究对象不同(特异性的微生物残体标识物为目标化合物和以纯培养方式获取的总微生物残体)而导致最终获得的微生物残体降解速率有所差异。尽管这种纯培养方法在研究微生物残体氮素的降解和稳定性方面提供了新的思路,但值得注意的是,纯培养方式获取的微生物残体在实验初始阶段是未受到土壤矿物或团聚体保护的,而实际土壤环境中微生物残体是受到土壤物理或化学保护的,这可能会导致低估微生物残体的稳定性。
土壤是一个在时间和空间上具有异质性的环境,土壤颗粒的空间分布产生了很多物理、化学和生物学特性不同的微环境,使有机质的动态在时间和空间上具有高度异质性[68]。因而,土壤质地和土壤结构是影响SOM周转的重要因素之一,决定着SOM的转化更新程度和限度。Kögel-Knabner等[16]认为在SOM循环过程中,有机物质与土壤矿物之间的相互作用是有机质稳定的决定性调控因子,即有机物质通过与黏土矿物表面相互作用、与一些金属离子(钙、铁、铝等)发生络合作用而稳定在土壤基质中。研究[69]表明,微生物残体的积累与转化动态与土壤矿物粒级的组成和含量密切相关,其中黏粒和粉粒是微生物残体积累的主要贮存库。土壤矿物基质与氨基化合物的相互作用对氨基糖的稳定性具有显著影响,尤其与黏粒和粉粒的结合能力是影响其稳定性的主要因素[70]。Ding等[71]比较了美国内华达州三种不同成土母质(安山岩、玄武岩和花岗岩)下微生物残留物的积累特征差异,发现土壤母质的矿物组成和黏粒含量与微生物残体的积累密切相关,尤其在表层以下淋溶层(B层)中,土壤短程有序(Short-ranged order,SRO)矿物晶体的含量是影响其积累的主要因素。与上述研究不同的是,Pronk等[72]利用人工合成土壤(伊利石、蒙脱石、氧化铁和黑炭不同组合)研究了黏土矿物组成对微生物残体在全土和小于20 μm粒级中积累和分布的影响,发现矿物组成显著影响微生物残体在全土中的积累,但是在小于20 μm粒级中氨基糖的含量较低,说明微生物残体并未随着培养时间的延长而逐渐积累在黏土矿物中。可能的原因是:土壤矿物组成能够改变土壤性质和结构及团聚化过程,这会直接影响微生物在土壤异质空间的生境,进而在一定程度上影响SOM的特性,使得微生物的群落和数量发生变化,最终影响微生物残体在土壤粒级中的分布。研究者[5,16]认为氨基糖可作为微生物残体的重要标识物来研究矿物组成对微生物残体和SOM形成的影响,但是需要考虑到整个土壤系统才能更好地理解微生物-矿物-有机质之间的相互作用。Griepentrog等[73]结合密度分组方法,研究了氮沉降和CO2浓度升高对微生物残体分布和有机碳转化的影响,发现微生物残体的稳定化过程主要是通过与黏土矿物相结合,表现为微生物残体在重组有机质中的分布比例最高,其中,84%的氨基葡萄糖、92%的氨基半乳糖和97%的胞壁酸均分布在重组有机质中。此外,研究[61,74]发现表层和底层土壤中与矿物结合的有机组分本质有很大不同,植物来源的化合物主要在表层土壤,而微生物来源物质,如氨基糖指示的细胞残体则在底层土壤中占优势。上述研究结果进一步说明有机物质与矿物相互作用是微生物残体的重要稳定机制之一。
团聚体是土壤结构的基本单元,也是微生物活动的主要场所。不同粒径大小的团聚体其物理化学性质不同,可通过影响微生物生长和不同微生物种类间的相互作用而影响有机物质的分解转化过程[75]。团聚体的物理保护作用对有机组分在土壤中的转化和稳定性方面发挥重要作用[76]。团聚体对有机组分的物理保护主要有三个作用途径:(1)分室作用阻断底物与微生物的接触;(2)分室作用降低氧气进入大团聚体和微团聚体的扩散能力;(3)分室作用限制了底物与土壤酶的接触[77]。Ding等[78]研究发现,微生物残留物与土壤团聚体的形成及其稳定性密切相关,二者协调作用共同影响土壤有机碳的截获与稳定化过程。长期施入有机肥的农田土壤中氨基糖的含量显著增加,并与土壤大团聚体的质量百分含量和平均重量直径呈显著正相关。这说明氨基糖在调控土壤团聚体形成和稳定性方面发挥重要作用;反过来,土壤团聚化作用加强可能又进一步促进微生物代谢产物在土壤中的保持和积累,而且土壤团聚体的物理保护对相对容易降解的细菌残体的积累和稳定化尤为重要[51]。根据Cotrufo等[79]提出的微生物效率-基质稳定性(microbial efficiency-matrix stabilization,MEMS)概念模型,来自植物残体的活性组分能被微生物高效同化利用,伴随着植物残体降解过程的进行,微生物代谢产物可通过促进团聚化过程及其与土壤矿物结合变成稳定SOM的主要前体物质[68],进而在土壤有机碳的长期截获和稳定过程中发挥重要作用。揭示微生物残体的保护机制对调控SOM转化及持续固碳过程、阐明微生物介导的SOM稳定化过程至关重要,目前对有关微生物残体稳定机制的了解仍不充分,亟待加强这方面的研究[6,11,80]。
5 结语微生物是SOM形成和转化的重要驱动与参与者,在通过异化作用分解SOM产生气体的同时,也通过同化合成作用不断地以微生物残体形式向土壤中输入有机物质,介导了SOM的形成过程。本文围绕微生物残体介导SOM形成的相关研究进展,总结分析了微生物残体在SOM形成和积累过程中的重要性、评价指标、影响因素及其稳定机制(图 1)。建议在探讨微生物与SOM动态之间的内在关联机制时,要考虑这部分微生物残体信息,这是深刻理解微生物在SOM形成和转化过程中的作用和贡献机制的重要切入口。现对该研究领域的发展趋势和科学问题展望如下:
(1)目前关于我国典型农田土壤外源有机物质输入后,对微生物残体参与有机质形成过程和机理的认识亟待加强。农田SOM转化与调控研究中关于外源有机物质输入后微生物的同化过程及微生物来源物质在SOM积累和转化过程中的作用与机理研究相对不足,尤其是微生物通过同化代谢驱动细胞残体积累的贡献机制缺乏深入认识。未来开展相关研究时,可以考虑选取不同的微生物细胞标识物,将微生物活体和死亡残体同化外源碳氮的信息进行互补研究。进而将外源养分和有机物质输入与微生物同化过程进行联系,从瞬时到过程的连续性视角全面解析SOM形成、积累和转化的微生物参与过程与贡献机制。
(2)在SOM循环过程中,有机物质与土壤矿物之间的相互作用是决定有机质稳定性的重要调控因子。目前关于微生物残体在土壤中的分配过程和稳定机制尚不清晰,尤其是矿物学保护机制了解甚少。只有明确微生物参与碳转化过程与土壤空间异质性的关联,才能在理论上阐明SOM周转的微生物贡献机制,进而在实践上通过寻求调控微生物过程的方向和强度以达到增加土壤固碳潜力、提升土壤肥力的目的。利用稳定同位素示踪和微生物标识物方法,结合土壤物理分级方法,开展微生物同化新碳在土壤矿物基质中的分配和转化动态研究,将有助于揭示微生物残体的保护过程和稳定机制。
(3)已有关于微生物残体的研究主要集中在有机碳含量高和微生物活性强的表层土壤,而对有机碳和养分相对匮乏的底层土壤中微生物残留物对土壤碳截获的贡献关注较少。事实上,土壤微生物参与整个土壤剖面有机质转化的生物化学过程。由于土壤剖面养分环境差异较大,微生物的数量、群落结构和同化外源碳底物的能力会随着土层深度变化而发生明显变化。因此,对表层以下底层土壤中微生物参与有机碳库周转过程和稳定机制的深入认识将会极大促进土壤碳循环过程调控的研究[81]。因此,有必要在不同深度土壤剖面尺度上全面解析微生物残体对SOM截获和周转的贡献及其与环境因子的相互耦合机制。
| [1] |
Schimel J P, Schaeffer S M. Microbial control over carbon cycling in soil[J]. Frontiers in Microbiology, 2012, 3: 348.
(  0) 0) |
| [2] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105. DOI:10.1038/nmicrobiol.2017.105
(  0) 0) |
| [3] |
Kindler R, Miltner A, Richnow H H, et al. Fate of gram-negative bacterial biomass in soil-mineralization and contribution to SOM[J]. Soil Biology and Biochemistry, 2006, 38: 2860-2870. DOI:10.1016/j.soilbio.2006.04.047
(  0) 0) |
| [4] |
Schweigert M, Herrmann S, Miltner A, et al. Fate of ectomycorrhizal fungal biomass in a soil bioreactor system and its contribution to soil organic matter formation[J]. Soil Biology and Biochemistry, 2015, 88: 120-127. DOI:10.1016/j.soilbio.2015.05.012
(  0) 0) |
| [5] |
Miltner A, Bombach P, Schmidt-Brücken B, et al. SOM genesis: Microbial biomass as a significant source[J]. Biogeochemistry, 2012, 111(1/2/3): 41-55.
(  0) 0) |
| [6] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25: 3578-3590. DOI:10.1111/gcb.14781
(  0) 0) |
| [7] |
Six J, Frey S D, Thiet R K, et al. Bacterial and fungal contributions to carbon sequestration in agroecosystems[J]. Soil Science Society of American Journal, 2006, 70: 555-569. DOI:10.2136/sssaj2004.0347
(  0) 0) |
| [8] |
Jia Z J. Principle and application of DNA-based stable isotope probing: A review (In Chinese)[J]. Acta Microbiologica Sinica, 2011, 51(12): 1585-1594. DOI:10.13343/j.cnki.wsxb.2011.12.013 [贾仲君. 稳定性同位素核酸探针技术DNA-SIP原理与应用[J]. 微生物学报, 2011, 51(12): 1585-1594.]
(  0) 0) |
| [9] |
Gunina A, Dippold M, Glaser B, et al. Turnover of microbial groups and cell components in soil: 13C analysis of cellular biomarkers[J]. Biogeosciences, 2017, 14: 271-283. DOI:10.5194/bg-14-271-2017
(  0) 0) |
| [10] |
Kästner M, Miltner A. SOM and microbes-What is left//Garcia C, Nannipieri P, Hernandez T. The future of soil carbon[M]. San Diego, USA: Academic Press, 2018: 125-163.
(  0) 0) |
| [11] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568. DOI:10.1007/s00374-018-1288-3
(  0) 0) |
| [12] |
Kallenbach C M, Grandy A S, Frey S D, et al. Microbial physiology and necromass regulate agricultural soil carbon accumulation[J]. Soil Biology and Biochemistry, 2015, 91: 279-290. DOI:10.1016/j.soilbio.2015.09.005
(  0) 0) |
| [13] |
Liang C, Cheng G, Wixon D L, et al. An Absorbing Markov Chain approach to understanding the microbial role in soil carbon stabilization[J]. Biogeochemistry, 2011, 106(3): 303-309. DOI:10.1007/s10533-010-9525-3
(  0) 0) |
| [14] |
Kallenbach C M, Frey S D, Grandy A S. Direct evidence for microbial-derived soil organic matter formation and its ecophysiological controls[J]. Nature Communications, 2016, 7: 13630. DOI:10.1038/ncomms13630
(  0) 0) |
| [15] |
Simpson A J, Simpson M J, Smith E, et al. Microbially derived inputs to soil organic matter: Are current estimates too low?[J]. Environmental Science & Technology, 2007, 41(23): 8070-8076.
(  0) 0) |
| [16] |
Kögel-Knabner I, Guggenberger G, Kleber M, et al. Organo-mineral associations in temperate soils: Integrating biology, mineralogy and organic matter chemistry[J]. Journal of Plant Nutrition and Soil Science, 2008, 171: 61-82. DOI:10.1002/jpln.200700048
(  0) 0) |
| [17] |
Paul E A. The nature and dynamics of soil organic matter: Plant inputs, microbial transformations, and organic matter stabilization[J]. Soil Biology and Biochemistry, 2016, 98: 109-126. DOI:10.1016/j.soilbio.2016.04.001
(  0) 0) |
| [18] |
Miltner A, Kindler R, Knicker H, et al. Fate of microbial biomass-derived amino acids in soil and their contribution to soil organic matter[J]. Organic Geochemistry, 2009, 40: 978-985. DOI:10.1016/j.orggeochem.2009.06.008
(  0) 0) |
| [19] |
Wang C, Wang X, Pei G, et al. Stabilization of microbial residues in soil organic matter after two years of decomposition[J]. Soil Biology and Biochemistry, 2020, 141: 107687. DOI:10.1016/j.soilbio.2019.107687
(  0) 0) |
| [20] |
Amelung W. Methods using amino sugars as markers for microbial residues in soil//Lal J M, Follett R F, Stewart B A. Assessment methods for soil carbon[M]. Lewis, USA: Boca Raton, 2001: 233-272.
(  0) 0) |
| [21] |
Glaser B, Turrión M B, Alef K. Amino sugars and muramic acid – biomarkers for soil microbial community structure analysis[J]. Soil Biology and Biochemistry, 2004, 36: 399-407. DOI:10.1016/j.soilbio.2003.10.013
(  0) 0) |
| [22] |
Carini P, Marsden P J, Leff J W, et al. Relic DNA is abundant in soil and obscures estimates of soil microbial diversity[J]. Nature Microbiology, 2016, 2: 16242.
(  0) 0) |
| [23] |
Zhang X, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology and Biochemistry, 1996, 28: 1201-1206. DOI:10.1016/0038-0717(96)00117-4
(  0) 0) |
| [24] |
张旭东. 土壤物质循环过程[R]. 沈阳, 2003. Zhang X D. Soil material cycling process[R]. Shenyang, 2003. (  0) 0) |
| [25] |
Liang C. Soil microbial carbon pump: Mechanism and appraisal[J]. Soil Ecology Letters, 2020, 2(4): 241-254. DOI:10.1007/s42832-020-0052-4
(  0) 0) |
| [26] |
Appuhn A, Joergensen R. Microbial colonisation of roots as a function of plant species[J]. Soil Biology and Biochemistry, 2006, 38: 1040-1051. DOI:10.1016/j.soilbio.2005.09.002
(  0) 0) |
| [27] |
Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biology and Biochemistry, 2007, 39: 2111-2118. DOI:10.1016/j.soilbio.2007.03.020
(  0) 0) |
| [28] |
He H B, Xie H T, Zhang X D. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars[J]. Soil Biology and Biochemistry, 2006, 38: 1083-1091. DOI:10.1016/j.soilbio.2005.09.007
(  0) 0) |
| [29] |
Glaser B, Gross S. Compound-specific δ13C analysis of individual amino sugars: A tool to quantify timing and amount of soil microbial residue stabilization[J]. Rapid Communications in Mass Spectrometry, 2005, 19(11): 1409-1416. DOI:10.1002/rcm.1913
(  0) 0) |
| [30] |
He H B, Zhang W, Xie H T, et al. A GC/MS method to assess 15N ratios in soil amino sugars and amino acid enantiomers (In Chinese)[J]. Acta Pedologica Sinica, 2009, 46(2): 289-298. DOI:10.3321/j.issn:0564-3929.2009.02.014 [何红波, 张威, 解宏图, 等. 测定土壤氨基糖和氨基酸手性异构体中氮同位素比值的气相色谱/质谱方法[J]. 土壤学报, 2009, 46(2): 289-298.]
(  0) 0) |
| [31] |
He H B, Zhan W, Zhang X D et al. Temporal responses of soil microorganisms to substrate addition as indicated by amino sugar differentiation[J]. Soil Biology and Biochemistry, 2011, 43: 1155-1161. DOI:10.1016/j.soilbio.2011.02.002
(  0) 0) |
| [32] |
Indorf C, Stamm F, Dyckmans J, et al. Determination of saprotrophic fungi turnover in different substrates by glucosamine specific δ13C liquid chromatography/isotope ratio mass spectrometry[J]. Fungal Ecology, 2012, 5: 694-701. DOI:10.1016/j.funeco.2012.07.001
(  0) 0) |
| [33] |
Amelung W, Brodowski S, Sandhage-Hofmann A, et al. Combining biomarker with stable isotope analyses for assessing the transformation and turnover of soil organic matter[J]. Advances in Agronomy, 2008, 100: 155-250.
(  0) 0) |
| [34] |
Liang C, Zhu X F. The soil microbial carbon pump as a new concept for terrestrial carbon sequestration (In Chinese)[J]. Science China Earth Sciences, 2021, 51(5): 680-695. [梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论[J]. 中国科学: 地球科学, 2021, 51(5): 680-695.]
(  0) 0) |
| [35] |
Sun B, Liao H, Su Y H, et al. Advances in key coordinative mechanisms in soil-root-microbe systems to affect nitrogen and phosphorus utilization (In Chinese)[J]. Soils, 2015, 47(2): 210-219. [孙波, 廖红, 苏彦华, 等. 土壤-根系-微生物系统中影响氮磷利用的一些关键协同机制的研究进展[J]. 土壤, 2015, 47(2): 210-219.]
(  0) 0) |
| [36] |
Ding X L, He H B, Zhang B, et al. Effects of inorganic nitrogen application rate on content of amino sugars in Alfisol during microbial decomposition of corn stalks (In Chinese)[J]. Acta Pedologica Sinica, 2011, 48(3): 665-671. [丁雪丽, 何红波, 张彬, 等. 无机氮素加入量对玉米秸秆分解过程中棕壤氨基糖含量的影响[J]. 土壤学报, 2011, 48(3): 665-671.]
(  0) 0) |
| [37] |
Geyer K M, Kyker-Snowman E, Grandy A S, et al. Microbial carbon use efficiency: Accounting for population, community, and ecosystem-scale controls over the fate of metabolized organic matter[J]. Biogeochemistry, 2016, 127(2/3): 173-188.
(  0) 0) |
| [38] |
Bai Z, Bodé S, Huygens D, et al. Kinetics of amino sugar formation from organic residues of different quality[J]. Soil Biology and Biochemistry, 2013, 57: 814-821. DOI:10.1016/j.soilbio.2012.08.006
(  0) 0) |
| [39] |
Liang C, Zhang X D, Balser T C. Net microbial amino sugar accumulation process in soil as influenced by different plant material inputs[J]. Biology and Fertility of Soils, 2007, 44(1): 1-7. DOI:10.1007/s00374-007-0170-5
(  0) 0) |
| [40] |
Ding X L, Han X Z, Zhang X D. Long-term impacts of manure, straw, and fertilizer on amino sugars in a silty clay loam soil under temperate conditions[J]. Biology and Fertility of Soils, 2013, 49(7): 949-954. DOI:10.1007/s00374-012-0768-0
(  0) 0) |
| [41] |
Wang X X, Zhang W, Zhou F, et al. Distinct regulation of microbial processes in the immobilization of labile carbon in different soils[J]. Soil Biology and Biochemistry, 2020, 142: 107723. DOI:10.1016/j.soilbio.2020.107723
(  0) 0) |
| [42] |
Mooshammer M, Wanek W, Zechmeister-Boltenstern S, et al. Stoichiometric imbalances between terrestrial decomposer communities and their resources: Mechanisms and implications of microbial adaptations to their resources[J]. Frontiers in Microbiology, 2014, 5: 22.
(  0) 0) |
| [43] |
Liu J G, Li X G, Wang X X. Effects of successive application of organic fertilizers on rhizosphere microbial populations and enzyme activities of monoculture peanut (In Chinese)[J]. Soils, 2018, 50(2): 305-311. DOI:10.13758/j.cnki.tr.2018.02.012 [刘金光, 李孝刚, 王兴祥. 连续施用有机肥对连作花生根际微生物种群和酶活性的影响[J]. 土壤, 2018, 50(2): 305-311.]
(  0) 0) |
| [44] |
Joergensen R G, Mäder P, Fließbach A. Long-term effects of organic farming on fungal and bacterial residues in relation to microbial energy metabolism[J]. Biology and Fertility of Soils, 2010, 46(3): 303-307. DOI:10.1007/s00374-009-0433-4
(  0) 0) |
| [45] |
Liu X, Zhou F, Hu G, et al. Dynamic contribution of microbial residues to soil organic matter accumulation influenced by maize straw mulching[J]. Geoderma, 2019, 333: 35-42. DOI:10.1016/j.geoderma.2018.07.017
(  0) 0) |
| [46] |
Ye G P, Lin Y X, Kuzyakov Y, et al. Manure over crop residues increases soil organic matter but decreases microbial necromass relative contribution in upland Ultisols: Results of a 27-year field experiment[J]. Soil Biology and Biochemistry, 2019, 134: 15-20. DOI:10.1016/j.soilbio.2019.03.018
(  0) 0) |
| [47] |
Murugan R, Kumar S. Influence of long-term fertilization and crop rotation on changes in fungal and bacterial residues in a tropical rice-field soil[J]. Biology and Fertility of Soils, 2013, 49(7): 847-856. DOI:10.1007/s00374-013-0779-5
(  0) 0) |
| [48] |
Xia Y H, Chen X B, Hu Y J, et al. Contrasting contribution of fungal and bacterial residues to organic carbon accumulation in paddy soils across Eastern China[J]. Biology and Fertility of Soils, 2019, 55(8): 767-776. DOI:10.1007/s00374-019-01390-7
(  0) 0) |
| [49] |
Chen X B, Xia Y H, Rui Y C, et al. Microbial carbon use efficiency, biomass turnover, and necromass accumulation in paddy soil depending on fertilization[J]. Agriculture, Ecosystems and Environment, 2020, 295: 106867. DOI:10.1016/j.agee.2020.106867
(  0) 0) |
| [50] |
Guggenberger G, Frey S D, Six J, et al. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems[J]. Soil Science Society of American Journal, 1999, 63: 1188-1198. DOI:10.2136/sssaj1999.6351188x
(  0) 0) |
| [51] |
Li L, Wilson C B, He H, et al. Physical, biochemical, and microbial controls on amino sugar accumulation in soils under long-term cover cropping and no-tillage farming[J]. Soil Biology and Biochemistry, 2019, 135: 369-378. DOI:10.1016/j.soilbio.2019.05.017
(  0) 0) |
| [52] |
Ding X L, Zhang X D, Yang X M, et al. Accumulation of amino sugar carbon affected by tillage in black soil in Northeast China (In Chinese)[J]. Acta Pedologica Sinica, 2012, 49(3): 535-543. [丁雪丽, 张旭东, 杨学明, 等. 免耕秸秆还田和传统耕作方式下东北黑土氨基糖态碳的积累特征[J]. 土壤学报, 2012, 49(3): 535-543.]
(  0) 0) |
| [53] |
Zhang B, He H, Ding X, et al. Soil microbial community dynamics over a maize(Zea mays L.)growing season under conventional-and no-tillage practices in a rainfed agroecosystem[J]. Soil and Tillage Research, 2012, 124: 153-160. DOI:10.1016/j.still.2012.05.011
(  0) 0) |
| [54] |
Zhu X, Xie H, Masters M D, et al. Microbial trade-off in soil organic carbon storage in a no-till continuous corn agroecosystem[J]. European Journal of Soil Biology, 2020, 96: 103146. DOI:10.1016/j.ejsobi.2019.103146
(  0) 0) |
| [55] |
Lauer F, Kösters R, du Preez C C, et al. Microbial residues as indicators of soil restoration in South African secondary pastures[J]. Soil Biology and Biochemistry, 2011, 43: 787-794. DOI:10.1016/j.soilbio.2010.12.012
(  0) 0) |
| [56] |
Ding X L, Zhang B, Wei Z B, et al. Conversion of grassland into cropland affects microbial residue carbon retention in both surface and subsurface soils of a temperate agroecosystem[J]. Biology and Fertility of Soils, 2020, 56(1): 137-143. DOI:10.1007/s00374-019-01400-8
(  0) 0) |
| [57] |
Ding X L, Zhang B, Filley T R, et al. Changes of microbial residues after wetland cultivation and restoration[J]. Biology and Fertility of Soils, 2019, 55(4): 405-409. DOI:10.1007/s00374-019-01341-2
(  0) 0) |
| [58] |
Amelung W, Lobe I, Du Preez C C. Fate of microbial residues in sandy soils of the South African Highveld as influenced by prolonged arable cropping[J]. European Journal of Soil Science, 2012, 53: 29-35.
(  0) 0) |
| [59] |
Li X B, He H B, Zhang X D, et al. Distinct responses of soil fungal and bacterial nitrate immobilization to land conversion from forest to agriculture[J]. Soil Biology and Biochemistry, 2019, 134: 81-89. DOI:10.1016/j.soilbio.2019.03.023
(  0) 0) |
| [60] |
Huang Y, Liang C, Duan X W, et al. Variation of microbial residue contribution to soil organic carbon sequestration following land use change in a subtropical karst region[J]. Geoderma, 2019, 353: 340-346. DOI:10.1016/j.geoderma.2019.07.028
(  0) 0) |
| [61] |
Jia J, Feng X J, He J S, et al. Comparing microbial carbon sequestration and priming in the subsoil versus topsoil of a Qinghai-Tibetan alpine grassland[J]. Soil Biology and Biochemistry, 2017, 104: 141-151. DOI:10.1016/j.soilbio.2016.10.018
(  0) 0) |
| [62] |
Liang C, Balser T C. Warming and nitrogen deposition lessen microbial residue contribution to soil carbon pool[J]. Nature Communications, 2012, 3: 1222. DOI:10.1038/ncomms2224
(  0) 0) |
| [63] |
Ding X, Chen S, Zhang B, et al. Warming increases microbial residue contribution to soil organic carbon in an alpine meadow[J]. Soil Biology and Biochemistry, 2019, 135: 13-19. DOI:10.1016/j.soilbio.2019.04.004
(  0) 0) |
| [64] |
Ding X L, Chen S Y, Zhang B, et al. Warming yields distinct accumulation patterns of microbial residues in dry and wet alpine grasslands on the Qinghai-Tibetan Plateau[J]. Biology and Fertility of Soils, 2020, 56(7): 881-892. DOI:10.1007/s00374-020-01474-9
(  0) 0) |
| [65] |
Zhang W, Zhang X C, Bai E, et al. The strategy of microbial utilization of the deposited N in a temperate forest soil[J]. Biology and Fertility of Soils, 2020, 56(3): 359-367. DOI:10.1007/s00374-019-01427-x
(  0) 0) |
| [66] |
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter[J]. Soil Biology and Biochemistry, 2002, 34: 139-162. DOI:10.1016/S0038-0717(01)00158-4
(  0) 0) |
| [67] |
Wang X, Wang C, Cotrufo M F, et al. Elevated temperature increases the accumulation of microbial necromass nitrogen in soil via increasing microbial turnover[J]. Global Change Biology, 2020, 26(9): 5277-5289. DOI:10.1111/gcb.15206
(  0) 0) |
| [68] |
Cotrufo M F, Soong J L, Horton A J, et al. Formation of soil organic matter via biochemical and physical pathways of litter mass loss[J]. Nature Geoscience, 2015, 8: 776. DOI:10.1038/ngeo2520
(  0) 0) |
| [69] |
Zhang X, Amelung W, Yuan Y, et al. Amino sugar signature of particle size fractions in soils of the native prairie as affected by climate[J]. Soil Science, 1998, 163: 220-229. DOI:10.1097/00010694-199803000-00007
(  0) 0) |
| [70] |
Aumtong S, Neergaard A, Magid J. Formation and remobilization of soil microbial residue. Effect of clay content and repeated additions of cellulose and sucrose[J]. Biology and Fertility of Soils, 2011, 47: 863-874. DOI:10.1007/s00374-011-0592-y
(  0) 0) |
| [71] |
Ding X, Zhang B, Lü X, et al. Parent material and conifer biome influence microbial residue accumulation in forest soils[J]. Soil Biology and Biochemistry, 2017, 107: 1-9. DOI:10.1016/j.soilbio.2016.12.020
(  0) 0) |
| [72] |
Pronk G J, Heister K, Kögel-Knabner I. Amino sugars reflect microbial residues as affected by clay mineral composition of artificial soils[J]. Organic Geochemistry, 2015, 83/84: 109-113. DOI:10.1016/j.orggeochem.2015.03.007
(  0) 0) |
| [73] |
Griepentrog M, Bodé S, Boeckx P, et al. Nitrogen deposition promotes the production of new fungal residues but retards the decomposition of old residues in forest soil fractions[J]. Global Change Biology, 2014, 20: 327-340. DOI:10.1111/gcb.12374
(  0) 0) |
| [74] |
Rumpel C, Kögel-Knabner I. Deep soil organic matter: A key but poorly understood component of terrestrial C cycle[J]. Plant and Soil, 2011, 338(1/2): 143-158.
(  0) 0) |
| [75] |
Kong A Y Y, Scow K M, Cordova-Kreylos A L, et al. Microbial community composition and carbon cycling within soil microenvironments of conventional, low-input, and organic cropping systems[J]. Soil Biology and Biochemistry, 2011, 43: 20-30. DOI:10.1016/j.soilbio.2010.09.005
(  0) 0) |
| [76] |
Blackwood C B, Dell C J, Smucker A J M, et al. Eubacterial communities in different soil macroaggregate environments and cropping systems[J]. Soil Biology and Biochemistry, 2006, 38: 720-728. DOI:10.1016/j.soilbio.2005.07.006
(  0) 0) |
| [77] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68. DOI:10.1038/nature16069
(  0) 0) |
| [78] |
Ding X, Liang C, Zhang B, et al. Higher rates of manure application lead to greater accumulation of both fungal and bacterial residues in macroaggregates of a clay soil[J]. Soil Biology and Biochemistry, 2015, 84: 137-146. DOI:10.1016/j.soilbio.2015.02.015
(  0) 0) |
| [79] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization(MEMS)framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter[J]. Global Change Biology, 2013, 19: 988-995. DOI:10.1111/gcb.12113
(  0) 0) |
| [80] |
Zhu X F, Jackson R D, DeLucia E H, et al. The soil microbial carbon pump: From conceptual insights to empirical assessments[J]. Global Change Biology, 2020, 26: 6032-6039. DOI:10.1111/gcb.15319
(  0) 0) |
| [81] |
Cressey E L, Dungait J A J, Jones D L, et al. Soil microbial populations in deep floodplain soils are adapted to infrequent but regular carbon substrate addition[J]. Soil Biology & Biochemistry, 2018, 122: 60-70.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


