农田氮肥氨挥发损失不仅降低肥料的养分价值,进入大气的气态氨还参与形成细颗粒物(PM2.5)[1],其沉降可导致土壤酸化及水体富营养化[2]。我国稻田氮肥施用量高、施肥深度较浅或表施、施肥期间气温高、田间藻类滋生等引发田面水高pH,氨挥发损失严重[3−6]。研究稻田氨挥发对于科学评价稻田氮肥去向、指导稻田合理施肥、消减氨排放引起的环境影响均具有重要意义。
田间原位监测稻田氨挥发的方法主要分为三类,分别为微气象学法、密闭室抽气法和通气法。微气象学法被认为是监测大面积农田氨排放的标准方法[7],可监测农田向大气实际排放的氨量,但因其设备昂贵、要求试验地面积较大(半径一般为20~30 m)且平坦均一、周围不能有其他氨排放源,难以用于多处理多重复的氨挥发监测。一些稻田氨挥发研究采用了海绵通气法[8−9],但由于硬质塑料管内空气交换受阻,该法测定的氨挥发量仅占微气象学法的50%左右[10]。密闭室抽气法用于田间原位监测氨挥发始于20世纪80年代[11],由于该法具有设备易得、所需监测面积小、在一定程度上模拟自然通气等优点,可用于多处理多重复同时监测,是目前多数农田(尤其是稻田)氨挥发研究中所采用的监测方法[5,12−13]。密闭室抽气法基本原理是利用真空负压抽气,用外源空气不断交换土壤(旱地)/田面
水(稻田)上方的含氨空气,含氨空气在气流的带动下,气态氨被酸吸收液吸收,通过测定吸收液内铵态氮(
对于换气频率的影响,Kissel等[11]测定了旱地裸土高施氮量(448 kg·hm−2)条件下硫酸铵表施后5种换气频率下的氨挥发,换气频率每分钟15次以上时氨挥发不再明显增加;朱兆良等[15]采用温室盆栽测定了4种换气频率下的水稻基肥期氨挥发,氨挥发随换气频率增加而增加,田间环境下换气频率的影响尚未有相关报道。旱地与盆栽氨挥发研究中抽气室气相体积较小且易于控制,如以上研究中气相体积仅为0.50 L,而稻田田间原位测定氨挥发时,受表层土稀软及田面水的影响,抽气室内气相高度一般大于5 cm,直径20 cm的抽气室气相体积至少1.6 L,在换气频率为每分钟15次时每个气路的抽气量至少为23.6 L·min−1,高温环境下长时间(至少2 h)该抽气量抽气会导致吸收液大量损失,造成氨挥发量的低估。对于一天中的抽气时间,现有报道时间不一,从6:00至19:30均有分布[16−19],氨挥发日变化特征是确定监测时间段的前提,已有研究[20]报道稻田尿素水解基本结束后氨挥发日变化与气温变化基本一致,然而,在稻田尿素施用后的迅速水解阶段,田面水内
目前,密闭室抽气法监测稻田氨挥发的相关监测参数尚未统一规范,多数研究报道未对监测参数进行明确表述,导致不同密闭室抽气法研究结果之间缺乏可比性,加剧我国稻田氨排放清单分析评估的不确定,难以满足大范围氨挥发的系统分析以及模型运用需求。现有报道的不同密闭室抽气法测定结果之间差异很大[12,14,16],除不同施肥管理、土壤性质以及气候因素导致的氨挥发本身差异外,测定时所选择的监测参数不一致可能是另一个重要因素。因此,有必要在气候环境、田面水
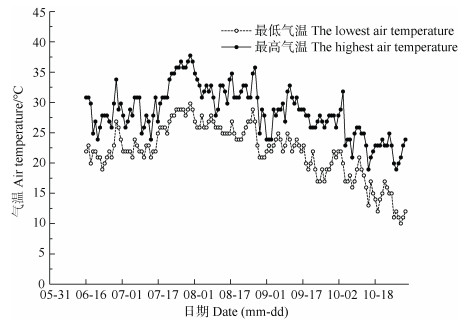
试验于2019年水稻季在江苏常熟农田生态系统国家野外科学观测研究站(31º15′15″N,120º57′43″E)开展。该研究站位于太湖地区,该地区主要种植制度为稻麦轮作或单季稻,海拔3.25 m,属于亚热带湿润气候,年均气温为15.5 ℃,年均降水量为1 038 mm,水稻季气温见图 1。
|
图 1 水稻季气温变化 Fig. 1 Dynamics of air temperature during the rice−growing period |
共开展5项专题试验(详见1.2节~1.6节),分别研究换气频率、抽气时间段、是否串联洗气瓶、抽气室与洗气瓶规格等监测参数以及抽气与自然风对比对氨挥发量的影响。相应试验均在水稻种植框(100 cm × 80 cm)内进行,种植框放置于田间试验小区旁。水稻种植前,框内装厚度为20 cm的0~20 cm表层水稻土,水稻土来自大田,土壤为湖积物发育而成的潜育型水稻土(乌栅土),pH(H2O)7.36、有机质41.1 g·kg−1、全氮2.22 g·kg−1、全磷0.93 g·kg−1、阳离子交换量(CEC)20.2 cmol·kg−1。泡水3 d后于6月28日施入基肥,随即插秧,水稻品种为南粳46,秧龄38 d,株行距20 cm × 20 cm,分蘖肥与孕穗肥分别于7月18日和8月4日施入,水稻生长期间保持3~7 cm的田面水。
水稻季施氮量为270 kg·hm−2,氮肥种类为尿素,基肥、分蘖肥、孕穗肥分配比例为4︰3︰3,磷肥(过磷酸钙,P2O5)、钾肥(氯化钾,K2O)施肥量均为90 kg·hm−2,磷钾肥作为基肥一次性施入,基肥施用方法是:撒肥后浅耙一遍,分蘖肥和穗肥均为表面撒施。
1.2 换气频率对氨挥发量的影响试验该试验于分蘖肥施用后第3天的15:30—17:00进行,设置每分钟2.5、5、8、12、16、20、23和30次共8个换气频率,研究氨挥发量与换气频率之间的关系,每个换气频率一个抽气室,采用2X-8A型真空泵进行抽气(以下抽气试验均采用此型号真空泵),每个抽气室的抽气量采用转子流量计控制(LZB-3WB,常州双环热工仪表)。抽气室材料为透明有机玻璃,外径15 cm(内径14 cm),底部开口,顶部有内径25 mm的进气口和内径8 mm的出气口,进气口和出气口分布于两端,进气口与高度为2.5 m的通气杆相连,抽气时抽气室内气相高度为5 cm,氨挥发吸收液为0.02 mol·L–1稀硫酸,抽气前体积80 mL。
氨挥发量计算公式为:
F=
式中,F为氨挥发量,mg·m−2·h−1;c和c0分别为抽气结束后试验区以及纯净水上方氨挥发吸收液中铵态氮(
分别在分蘖肥施用后第2天和第4天测定不同时间段的氨挥发量。第2天于6:00—7:00、9:00—10:00、14:30—15:30、16:00—17:00测定,第4天从早上6点,每隔1 h测定一次氨挥发量,每次测定1 h。每个测定时间段测定3个重复,抽气室规格同1.2,抽气量10 L·min−1,换气频率每分钟13次。抽气后量取吸收液体积,测定吸收液
该试验于分蘖肥施用后第2天7:30—8:30进行,设置单独洗气瓶、洗气瓶串联两个处理,每处理重复3次。每个洗气瓶80 mL吸收液。抽气室规格、抽气量及吸收液测定同1.3。
1.5 洗气瓶不同结构对氨挥发量的影响试验本试验于分蘖肥施用后第4天8:00—9:00和14:00—15:00进行,选择常见的4种结构的洗气装置,分别为圆盘多孔型、直杆多孔型、球形多孔型以及直通型(表 1)。每种结构相应设置三套用于测定,作为3个重复。抽气装置、抽气量以及吸收液测定同1.3。
|
|
表 1 不同结构洗气装置图示 Table 1 Diagram of different air-washing devices |
该试验于分蘖肥施用后第3天14:20—15:20进行,选择三种规格的抽气室:(1)内径14 cm,气相高度5 cm,抽气量10 L·min−1;(2)内径14 cm,气相高度10 cm,抽气量20 L·min−1;(3)内径19 cm,气相高度3.5 cm,抽气量18.4 L·min−1,换气频率均为每分钟13次。每种规格测定设置3个重复。
1.7 抽气与自然风环境下氨挥发比较试验为阐明密闭室抽气与自然放置状态下氨挥发的异同,开展该试验,于分蘖肥施用后第2天15:00—17:00进行。首先,将框内一部分田面水盛出,加入一定量的灌溉河水混匀,准确称取1 000 g(精确至0.01 g)混合溶液,放置于内径19 cm、高8 cm、顶部开口的9个容器内;设置低抽气量(8.5 L·min−1、换气频率每分钟5.0次)、高抽气量(19 L·min−1、换气频率每分钟9.0次)、自然风三个处理,每处理重复3次。用于抽气的6个容器在田面水放入后立即将相同直径的抽气室罩于容器上,接缝处用胶带密封。抽气期间地面1 m处平均风速1.8 m·s−1,气温32℃。所有9个容器均放置于同一个田间试验小区内,抽气结束后准确称量9个容器内剩余田面水,抽气前后每个容器均对田面水样取样。
1.8 测定方法与数据处理田面水、氨挥发吸收液
每项试验中不同处理间的差异显著性采用最小显著差异(LSD)方法分析(P < 0.05),作图采用Origin 2017。
2 结果 2.1 换气频率对氨挥发量的影响试验开始前,田面水
|
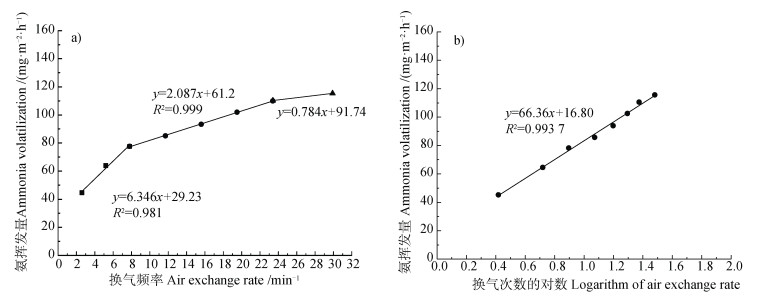
图 2 氨挥发量与换气频率(a)以及换气频率的对数(b)的相关性 Fig. 2 Correlation between ammonia volatilization(AV)and air exchange rate(a)and the logarithm of air exchange rate(b) |
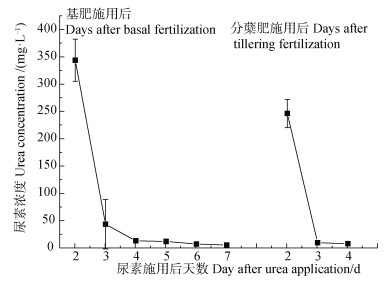
尿素施入稻田后,第1~2天为快速水解期,由图 3可看出,基肥和分蘖肥施用后第2天田面水中尿素浓度高达250~340 mg·L−1,之后迅速下降,基肥施用后第4天,分蘖肥施用后第3天,田面水中尿素浓度接近背景值。施肥后第2天尿素浓度迅速降低,田面水中
|
图 3 尿素施用后田面水尿素浓度 Fig. 3 Urea concentration in surface water after urea application |
|
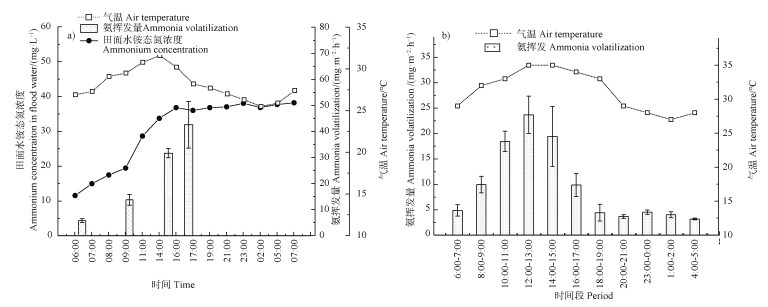
图 4 分蘖肥施用后第2天(a)与第4天(b)氨挥发变化特征 Fig. 4 Dynamics of ammonia volatilization(AV)in the second(a)and fourth(b)day after urea application |
上述结果说明,在选择密闭室抽气法适宜抽气时间时,需将尿素施用后前2天单独考虑,不能仅以上午或下午作为一天的平均值计算,采用上午的挥发量会低估挥发量,采用下午的挥发量则会高估挥发量。这两天的氨挥发监测尽量白天每隔2 h抽气1~2 h,晚上每隔4 h测定1~2 h,用于计算日挥发量。
2.3 串联洗气瓶对氨挥发量的影响本试验开始前田面水
|
|
表 2 洗气瓶不同串联方式下的氨挥发量 Table 2 Effect of series of two absorption bottles on AV |
本试验开始前田面水
|
|
表 3 洗气头结构对氨挥发量的影响 Table 3 Effect of different types of air-washing device on AV |
抽气前田面水
|
|
表 4 抽气室规格对氨挥发的影响 Table 4 Effect of specification of the dynamic chamber on AV |
密闭室抽气法抽气结束后田面水减少量、田面水内
|
|
表 5 抽气与自然放置环境下田面水、田面水 |
密闭室抽气法是目前稻田氨挥发研究的常用监测方法,可在一定程度上模拟自然挥发状态,又可用于多处理同步监测,但该方法亟需统一规范操作。密闭室抽气法因监测参数不同,导致研究结果差异较大。以往研究认为换气频率是关键影响因素,旱地模拟研究报道氨挥发在换气频率为每分钟15~20次时,氨挥发量接近最大[11],现有密闭室抽气法监测稻田氨挥发的研究绝大多数报道换气频率为每分钟15~20次,而无具体的换气频率及抽气量[4,23−26]。本研究结果表明,稻田氨挥发量随换气频率的增加持续增加,依增加速度不同,可分为三个阶段,换气频率每分钟20次时的氨挥发量分别为每分钟10和15次时的1.3倍和1.2倍(图 2),仅报道大概的换气频率每分钟15~20次,而未提供具体的抽气量、换气频率以及气相体积等参数,监测的氨挥发结果则难以用于不同密闭室抽气法研究之间的比较分析,也无法满足大范围稻田氨挥发的系统分析需求。受洗气瓶的曝气程度限制,如抽气量超过20 L·min−1时,洗气瓶内吸收液爆气剧烈,部分吸收液可窜至洗气瓶顶部随气流被抽走,导致吸收液的损失及氨挥发量的低估。根据洗气瓶的抽气量限制与稻田表层土及田面水特点,建议采用直径为15 cm(内径14 cm)的抽气室,气相高度5~8 cm,抽气量为15~20 L·min−1,换气频率为每分钟16~20次。尽管氨挥发增加速度有明显的三个阶段,抽气室内换气频率的对数与氨挥发量呈显著的直线相关关系(图 2),利用这一关系,可为采用不同换气频率的氨挥发研究提供矫正和互比依据。
除换气频率外,密闭室抽气法监测结果还受抽气时间段选择、是否串联洗气瓶、抽气室规格、洗气瓶洗气头结构等因素的影响。尿素施入稻田后2 d内为快速水解期,氨挥发与田面水
除上述影响因素外,稻田氨挥发抽气过程中,氨吸收液体积会发生变化。如采用不同抽气量抽气1.5 h后,吸收液体积随抽气量增加呈线性减少(数据未列出)。由于气流中氨与吸收液中的H+快速结合生成铵盐,挥发的吸收液携带铵盐的可能性较小,因此,若用抽气前吸收液体积来计算氨挥发量,会高估实际氨挥发量,应以抽气后实际剩余的体积为准。
3.2 自然风与负压抽气对稻田氨排放进程的影响稻田土−水表面上方空气流动情况影响氨挥发量,诸多报道指出风速是影响稻田氨挥发量的重要因素[27−28]。一直以来,箱内空气流动状况与自然状态下的差异是箱式法被质疑的重要方面[29]。一些研究人员试图通过自动调节抽气室内的换气频率来模拟外界风速[30−31],使抽气室内空气流动尽可能地接近自然状况。对于水面挥发源,还有一些学者希望通过抽气室内的水分蒸发量与自然放置状态下水分蒸发量之间的关系来矫正密闭室抽气法的氨挥发量[32]。
本研究测定了两种抽气量以及自然状态共三种情形下田面水减少量、田面水
采用密闭室抽气法监测稻田氨挥发时,对氨挥发量影响最大的监测参数是换气频率和抽气时间段。随着换气频率的增加氨挥发量持续增加,换气频率的对数与氨挥发量呈显著直线相关关系。尿素施用后存在1~2 d的快速水解期,该时期与水解基本结束后的氨挥发日变化特征不同,适宜抽气时间段也不同,前者要求尽量白天每隔2 h抽气1~2 h,晚上每隔4 h测定1−2 h,后者可在上午8:00—9:00和/或下午14:00—15:00测定。在抽气量相同条件下,两个洗气瓶串联反而使氨挥发量降低,无需串联洗气瓶。球形洗气装置不利于挥发氨的吸收,宜选择圆盘多孔型或直杆底部多孔型洗气装置。抽气室内径越大,室内气相高度越低,测到的氨挥发量越低。结合洗气瓶爆气程度限制以及稻田表层土与田面水特点,宜选择直径15 cm的抽气室,抽气时气相高度5~8 cm,抽气量15~20 L·min−1。研究报告中应明确监测时的实际换气频率、抽气量等监测参数。
| [1] |
Ju X T, Gu B J, Cai Z C. Suggestions on reducing agricultural ammonia emissions to alleviate haze hazards (In Chinese)[J]. Science & Technology Review, 2017, 35(13): 11-12. [巨晓棠, 谷保静, 蔡祖聪. 关于减少农业氨排放以缓解灰霾危害的建议[J]. 科技导报, 2017, 35(13): 11-12.]
(  0) 0) |
| [2] |
Aneja V P, Schlesinger W H, Erisman J W. Effects of agriculture upon the air quality and climate: Research, policy, and regulations[J]. Environmental Science & Technology, 2009, 43(12): 4234-4240.
(  0) 0) |
| [3] |
Cai G X, Chen D L, Ding H, et al. Nitrogen losses from fertilizers applied to maize, wheat and rice in the North China Plain[J]. Nutrient Cycling in Agroecosystems, 2002, 63(2/3): 187-195. DOI:10.1023/A:1021198724250
(  0) 0) |
| [4] |
He T H, Liu D Y, Yuan J J, et al. A two years study on the combined effects of biochar and inhibitors on ammonia volatilization in an intensively managed rice field[J]. Agriculture, Ecosystems & Environment, 2018, 264: 44-53.
(  0) 0) |
| [5] |
Wang H Y, Zhang D, Zhang Y T, et al. Ammonia emissions from paddy fields are underestimated in China[J]. Environmental Pollution, 2018, 235: 482-488. DOI:10.1016/j.envpol.2017.12.103
(  0) 0) |
| [6] |
Zhang W X, Sun G, He P, et al. Effects of urease and nitrification inhibitors on ammonia volatilization from paddy fields (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2013, 19(6): 1411-1419. [张文学, 孙刚, 何萍, 等. 脲酶抑制剂与硝化抑制剂对稻田氨挥发的影响[J]. 植物营养与肥料学报, 2013, 19(6): 1411-1419.]
(  0) 0) |
| [7] |
Sommer S G, Misselbrook T H. A review of ammonia emission measured using wind tunnels compared with micrometeorological techniques[J]. Soil Use and Management, 2016, 32: 101-108. DOI:10.1111/sum.12209
(  0) 0) |
| [8] |
He Y P, Zhang J Y, Yang S H, et al. Effect of controlled drainage on nitrogen losses from controlled irrigation paddy fields through subsurface drainage and ammonia volatilization after fertilization[J]. Agricultural Water Management, 2019, 221: 231-237. DOI:10.1016/j.agwat.2019.03.043
(  0) 0) |
| [9] |
Yu Y L, Xue L H, Yang L Z. Ammonia volatilization from paddy fields under different nitrogen schemes in Tai Lake region (In Chinese)[J]. Journal of Agro-Environment Science, 2013, 32(8): 1682-1689. [俞映倞, 薛利红, 杨林章. 太湖地区稻田不同氮肥管理模式下氨挥发特征研究[J]. 农业环境科学学报, 2013, 32(8): 1682-1689.]
(  0) 0) |
| [10] |
Tian Y H, Zeng K, Yin B. Ammonia emission following basal and tillering fertilization in Taihu Lake region relative to monitoring techniques (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(5): 1180-1189. [田玉华, 曾科, 尹斌. 基于不同监测方法的太湖地区稻田基蘖肥期氨排放研究[J]. 土壤学报, 2019, 56(5): 1180-1189.]
(  0) 0) |
| [11] |
Kissel D E, Brewer H L, Arkin G F. Design and test of a field sampler for ammonia volatilization[J]. Soil Science Society of America Journal, 1977, 41: 1133-1138. DOI:10.2136/sssaj1977.03615995004100060024x
(  0) 0) |
| [12] |
Zhou F, Ciais P, Hayashi K, et al. Re-estimating NH3 emissions from Chinese cropland by a new nonlinear model[J]. Environmental Science & Technology, 2016, 50(2): 564-572.
(  0) 0) |
| [13] |
Zhan X Y, Chen C, Wang Q H, et al. Improved Jayaweera-Mikkelsen model to quantify ammonia volatilization from rice paddy fields in China[J]. Environmental Science and Pollution Research, 2019, 26(8): 8136-8147. DOI:10.1007/s11356-019-04275-2
(  0) 0) |
| [14] |
Tian G M, Cai Z C, Cao J L, et al. Factors affecting ammonia volatilization from a rice-wheat rotation system[J]. Chemosphere, 2001, 42: 123-129. DOI:10.1016/S0045-6535(00)00117-X
(  0) 0) |
| [15] |
Zhu Z L, Cai G X, Xu Y H, et al. Ammonia volatilization and its significance to the losses of fertilizer nitrogen applied to paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 1985, 22(4): 320-328. [朱兆良, 蔡贵信, 徐银华, 等. 种稻下氮肥的氨挥发及其在氮素损失中的重要性的研究[J]. 土壤学报, 1985, 22(4): 320-328.]
(  0) 0) |
| [16] |
Zhang J, Wang D J. Ammonia volatilization in gleyed paddy field soils of Taihu Lake region (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2007, 15(6): 84-87. [张静, 王德建. 太湖地区乌栅土稻田氨挥发损失的研究[J]. 中国生态农业学报, 2007, 15(6): 84-87.]
(  0) 0) |
| [17] |
Chen G, Chen Y, Zhao G H, et al. Do high nitrogen use efficiency rice cultivars reduce nitrogen losses from paddy fields?[J]. Agriculture, Ecosystems & Environment, 2015, 209: 26-33.
(  0) 0) |
| [18] |
Xu M G, Li D C, Li J M, et al. Polyolefin-coated urea decreases ammonia volatilization in a double rice system of southern China[J]. Agronomy Journal, 2013, 105: 277-284. DOI:10.2134/agronj2012.0222
(  0) 0) |
| [19] |
Zhao X, Yan X Y, Xie Y X, et al. Use of nitrogen isotope to determine fertilizer- and soil-derived ammonia volatilization in a rice/wheat rotation system[J]. Journal of Agricultural and Food Chemistry, 2016, 64(15): 3017-3024. DOI:10.1021/acs.jafc.5b05898
(  0) 0) |
| [20] |
Tian Y H, Zeng K, Yao Y L, et al. Ammonia emission following fertilization at booting stage of rice crop in Taihu Lake region relative to monitoring techniques (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(3): 693-702. [田玉华, 曾科, 姚元林, 等. 基于不同监测方法的太湖地区水稻穗肥期氨排放研究[J]. 土壤学报, 2019, 56(3): 693-702.]
(  0) 0) |
| [21] |
Lu R K. Analysis methods for soil and agrochemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000: 129-133. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 129-133.]
(  0) 0) |
| [22] |
Peng Y J, Tian Y H, Yin B. Effects of NBPT urease inhibitor on ammonia volatilization in paddy fields with wheat straw application (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2012, 20(1): 19-23. [彭玉净, 田玉华, 尹斌. 添加脲酶抑制剂NBPT对麦秆还田稻田氨挥发的影响[J]. 中国生态农业学报, 2012, 20(1): 19-23.]
(  0) 0) |
| [23] |
Tang Y, Li X, Shen W Z, et al. Effect of the slow-release nitrogen fertilizer oxamide on ammonia volatilization and nitrogen use efficiency in paddy soil[J]. Agronomy, 2018, 8(4): 53. DOI:10.3390/agronomy8040053
(  0) 0) |
| [24] |
Li H, Liang X Q, Chen Y X, et al. Ammonia volatilization from urea in rice fields with zero-drainage water management[J]. Agricultural Water Management, 2008, 95(8): 887-894. DOI:10.1016/j.agwat.2007.05.016
(  0) 0) |
| [25] |
Wu G, Yuan M M, Cao Z W, et al. Ammonia volatilization under different water management and nitrogen schemes in a paddy field (In Chinese)[J]. Journal of Ecology and Rural Environment, 2019, 35(5): 651-658. [邬刚, 袁嫚嫚, 曹哲伟, 等. 不同水氮管理条件下稻田氨挥发损失特征[J]. 生态与农村环境学报, 2019, 35(5): 651-658.]
(  0) 0) |
| [26] |
Zhou L, Rong X M, Xie G X, et al. Effects of different nitrogen fertilizers on ammonia volatilization and its dynamic characteristics of double cropping rice (In Chinese)[J]. Journal of Soil and Water Conservation, 2014, 28(4): 143-147. [周亮, 荣湘民, 谢桂先, 等. 不同氮肥施用对双季稻稻田氨挥发及其动力学特性的影响[J]. 水土保持学报, 2014, 28(4): 143-147.]
(  0) 0) |
| [27] |
Zhu Z L, Cai G X, Simpson J, et al. Processes of nitrogen loss from fertilizers applied to flooded rice fields on a calcareous soil in north-central China[J]. Fertilizer Research, 1988, 18(2): 101-115.
(  0) 0) |
| [28] |
Freney J R, Trevitt A C F, De Datta S K, et al. The interdependence of ammonia volatilization and denitrification as nitrogen loss processes in flooded rice fields in the Philippines[J]. Biology and Fertility of Soils, 1990, 9(1): 31-36.
(  0) 0) |
| [29] |
Shah S B, Westerman P W, Arogo J. Measuring ammonia concentrations and emissions from agricultural land and liquid surfaces: A review[J]. Journal of the Air & Waste Management Association, 2006, 56(7): 945-960.
(  0) 0) |
| [30] |
Cabrera M L, Kissel D E, Davis R C, et al. Design and ammonia-recovery evaluation of a wind speed-sensitive[J]. Soil Science Society of America Journal, 2001, 65(4): 1302-1306.
(  0) 0) |
| [31] |
Kissel D E, Cabrera M L, Craig J R, et al. Rate of urea application and NH3 volatilization from loblolly pine[J]. Soil Science Society of America Journal, 2013, 77(1): 184-189.
(  0) 0) |
| [32] |
Parker D, Ham J, Woodbury B, et al. Standardization of flux chamber and wind tunnel flux measurements for quantifying volatile organic compound and ammonia emissions from area sources at animal feeding operations[J]. Atmospheric Environment, 2013, 66: 72-83.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59





