2. 南京林业大学, 南方现代林业协同创新中心, 生物与环境学院, 南京 210037
2. Co-Innovation Center for the Sustainable Forestry in Southern China, College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037, China
有机酸广泛存在于土壤圈中,是土壤中碳的最活跃形式,作用于多种土壤过程,并强烈影响多种植物生理生态行为,其产生与土壤微生物数量和活性相关联,并与土壤类型、根圈环境等密切相关。目前,土壤圈样品中检出的小分子有机酸主要包括脂肪族和芳香族两大类,芳香族有机酸(通常也称为化感物质)主要包括具有芳香气味的如安息香酸、水杨酸、香草酸等酚酸类化合物;脂肪族有机酸则主要包括:甲酸、乙酸、草酸、苹果酸等[1-8]。其中乙酸在生态系统的碳氮循环过程中是重要的中间化合物,是温室气体二氧化碳和甲烷产生的来源之一[9-11];故对乙酸的监测是相关研究者关注的重点。根际环境中大部分有机酸对植物的生长具有积极作用,但也需关注某些有机酸因过量而带来的不良影响,如植物根际中甲酸、乳酸、乙酸、丙酸、丁酸等脂肪族单羧酸积累到一定量后会影响植物根系的生长等 [12]。因此,该类单羧酸在植物根系分泌物、有机肥料等相关研究中通常也会受到关注。
目前,脂肪族有机酸的检测可以使用气相色谱法(GC/FID)[13-16]或气相色谱-质谱法(GC/MS)[17-19]、高效液相色谱法(HPLC/UV)[20-25]、离子色谱法(IC/ED)[26-30]、毛细管电泳法(CE/UV)[31-33]和液相色谱-质谱法(LC-MS)[34-35]等。GC/FID法或GC/MS法测定时,色谱柱分离一般很好,但试样多需酯化或硅烷化等衍生处理后方可检测,复杂耗时,水溶性样品测定难度大,通常不可直接上机测定。HPLC法和IC法样品前处理较为简单,高含量有机酸样品可以直接过滤后进样,在色谱柱上的分离效果较好,目前这两种方法在有机酸分析中应用广泛;但主要缺点是实际试样中的复杂基质会影响目标物的准确定性与定量,且低含量试样难测出。CE法试样用量很少,分析时间短,干扰较HPLC法和IC法小,但仪器的稳定性较HPLC和IC差,低含量样品同样难测出。LC-MS法很少检测这几种酸,其一是甲酸、乙酸分子量过小,二是通常选择甲酸、乙酸及其盐溶液作为流动相,故文献报道较少。
1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)被作为交联剂在有机合成中广泛使用,且常与N-羟基丁二酰亚胺(NHS)搭配使用以增加偶联反应的效率,但其多应用于材料及其改性研究中,尤其是医用材料,定量分析较少,其在酰胺化反应中的原理值得借鉴[36-39]。鉴于土壤圈样品中甲、乙、丙、丁酸的含量通常较低,故借用该原理将此类酸衍生为含吲哚基团的增敏物质后再进行测定,灵敏度大幅提升,且衍生物具有特征光谱图,色谱分离条件得以良好改善,定性可靠,为土壤圈相关研究提供参考。
1 材料与方法 1.1 主要仪器与试剂材料仪器:超高压液相色谱仪(Shimadzu LC-20A XR,配备二极管阵列检测器(SPD)及荧光检测器(FLD),岛津公司,日本);液相色谱-飞行时间质谱联用仪(AB Sciex Exion UPLC-QTOF-MS/MS X500R)移液器(10~1 000 μL,精确至1 μL,1~100 μL,精确至0.1 μL,Eppendorf公司,德国);电子天平(精确至0.0001g,德国Sartorius公司,德国);电子天平(精确至0.001 g,上海良平仪器仪表有限公司);超纯水机(Millipore,Mini-Q Reference A+,Merck公司,法国)。
标样及试剂:甲酸(纯度 > 88%,成都市科龙化工试剂厂,LC/MS级,赛默飞世尔科技(中国)有限公司);乙酸(纯度 > 99.8%,南京化学试剂有限公司);丙酸(纯度 > 99.5%,天津市科密欧化学试剂有限公司);丁酸(纯度 > 99.0%,上海凌峰化学试剂有限公司);甲醇(色谱纯,美国Tedia公司);乙腈(色谱纯,美国Tedia公司);1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC,含量 > 99.0%,BR,国药集团);2-(N-吗啉代)乙磺酸(MES,含量 > 99.0%,Biosharp);N-羟基丁二酰亚胺(NHS,含量97.0%~102%,BR,国药集团);色胺(含量98.0%,阿拉丁);N-乙酰基色胺(含量 > 99.0%,东京化成工业株式会社,日本);蒸馏水(由南京土壤研究所开发公司统一制备供应);超纯水(用蒸馏水经纯水机Millipore制得)。
1.2 实验方法方法原理:甲、乙、丙、丁酸在紫外检测器下随着碳链的延长,对紫外光的吸收越来越弱,当其含量较低时,更难检出。本法通过偶联-酰胺化法将色胺与此类酸进行反应,生成含吲哚基团的衍生物,在紫外光223 nm下具有高灵敏性,达到间接、高灵敏度检测此类单羧酸的目的。
其反应基理如下:
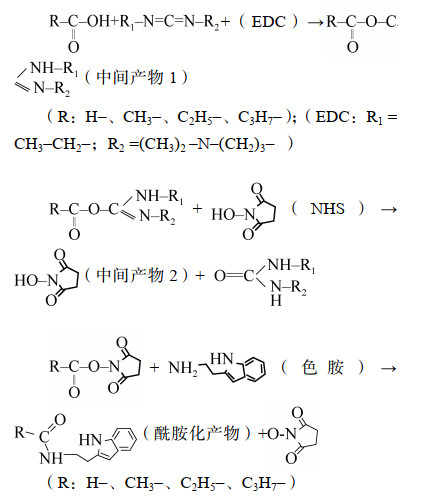
|
(1)衍生化反应所需的试剂水溶液的配制。EDC溶液(30~90 mmol·L–1);MES溶液(30~60 mmol·L–1,采用NaOH溶液调配pH为5~6);NHS溶液(20~90 mmol·L–1);色胺溶液(30~60 mmol·L–1,需采用乙腈助溶)。
(2)标准溶液配制。用超纯水配制4种单羧酸混合标准母液,其中含甲酸、乙酸、丙酸、丁酸均为1 000 mg·L–1,同时加入适量乙腈以防菌,稀释为浓度为100 mg·L–1标准溶液使用。
(3)衍生化反应。校准曲线样品的衍生化反应:分别取适量的4种有机酸混合标准母液(0~1 mL)加入5 mL的刻度试管中,再分别加入适量(0.2~1.0 mL)的MES溶液,0.1~0.6 mL EDC溶液、20 min后加入0.1~0.5 mL NHS溶液、此时,反应溶液的pH控制在5.0~6.0之间,静置反应0.5~1 h后,再加入适量(0.1~1.0 mL)的衍生试剂色胺溶液,静置过夜,最后采用超纯水定容至5 mL,终止反应,溶液待测。整个反应过程室温控制约25℃,反应体系中羧酸:EDC:NHS:胺基(摩尔比)控制在1:(~4):(~2):(~5),胺基过量。
样品溶液来源于植物根系分泌物,或土壤圈其他溶液样品。样品的衍生化反应步骤与标准样的处理相同,取样量视情况而定(0.5~1.0 mL)。
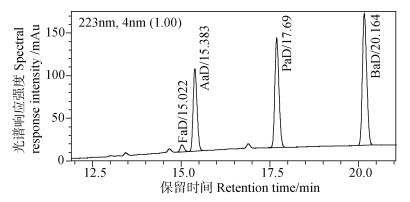
(4)液相色谱(HPLC)测定方法。采用液相色谱仪对衍生后的标准溶液及样品溶液进行测定,以二极管阵列检测器进行全波长扫描测定,定量检测波长为223 nm,衍生物液相色谱图见图 1。液相色谱仪测定条件:流动相为水(A)+乙腈(B);流速为0.8 mL·min–1,色谱柱为Agilent SB-C18,250 mm×4.6 mm,5um,柱温为35℃。流动相梯度洗脱程序为:初始乙腈体积比为10%,30 min时升为70%,31 min时快速升至100%,并保持至31.5 min,而后在32 min时降为10%,并保持至34 min,程序结束。
|
注:FaD-甲酸衍生物,AaD-乙酸衍生物,PaD-丙酸衍生物,BaD-丁酸衍生物。下同。 Note: FaD-Formic acid derivative, AaD-Acetic acid derivative, PaD-Propionic acid derivative, BaD-Butyric acid derivative.The same as below. 图 1 四种有机酸衍生物液相色谱图 Fig. 1 Liquid chromatogram of four organic acid derivatives |
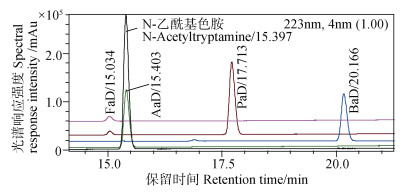
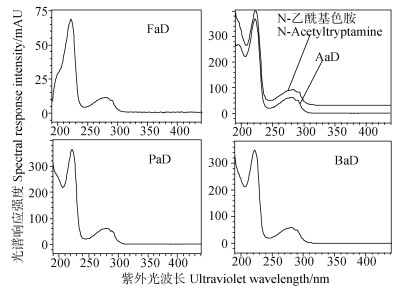
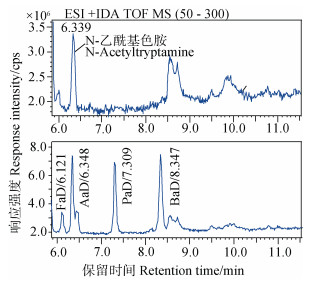
图 2为市面购得N-乙酰基色胺标准物和各有机酸单独衍生后叠加色谱图,表明乙酸衍生物与标准物保留时间一致,且与图 1混合标样衍生后保留时间一致;图 3为N-乙酰基色胺标准物和各有机酸单独衍生后衍生物的紫外光谱图,其中标准物与乙酸衍生物光谱图一致,结合图 2可确定为衍生物即为标准物,图 3中甲酸、丙酸、丁酸等衍生物的光谱图也与标准物一致,表明3种有机酸衍生后均含有目标基团。图 4是采用液相色谱-飞行时间质谱仪(UPLC-QTOF-MS/MS,流动相为0.1%甲酸水+乙腈,色谱柱为Phenomenex Omega 1.6μm Polar C18,100×2.1 mm)对标准物和衍生物测定后的总离子流色谱图,表 1是检测到的各化合物质谱信息,表明衍生所得的衍生物与预期目标物的一级、二级质谱离子均相符,再结合图 1~图 3,可以确认图 1中方法测定的甲酸、乙酸、丙酸、丁酸等有机酸衍生物即为预期的衍生物。
|
图 2 N-乙酰基色胺和四种单标有机酸衍生物液相色谱图 Fig. 2 Liquid chromatogram of N-Acetyltryptamine and four organic acids' derivatives respectively |
|
图 3 N-乙酰基色胺和四种单羧酸衍生物紫外光谱图 Fig. 3 UV spectrums of N-Acetyltryptamine and four organic acids' derivatives respectively |
|
图 4 N-乙酰基色胺和四种单羧酸衍生物的UPLC-QTOF- MS/MS总离子流色谱图 Fig. 4 TIC of N-Acetyltryptamine and four organic acids' derivatives respectively by UPLC-QTOF-MS/MS |
|
|
表 1 N-乙酰基色胺和四种单羧酸衍生物的UPLC-QTOF-MS/MS质谱鉴定信息表 Table 1 Tentatively identification of N-Acetyltryptamine and organic acids' derivatives by UPLC-QTOF-MS/MS |
以N-乙酰基色胺为标准品,考察乙酸衍生产物的产率,其浓度由0~20 mg·L–1的N-乙酰基色胺的校准曲线(线性方程y=228761x+7771.4,R2=0.9999)算得,并与理论浓度进行比较得到相应浓度的产率。结果表明,在乙酸浓度为0.1、0.2、0.5、1、2、5、10 mg·L–1下,经扣除空白后,各浓度下乙酸衍生产物的平均产率为96.3%~135%(n=3),说明可以满足该方法分析要求。
2.3 衍生化反应的稳定性将0.5、1、10 mg·L–1的有机酸衍生化反应标准溶液保存于4℃冰箱中,放置2周后再进行复测,峰面积均未显著性改变,且采用现做的有机酸衍生化标准曲线进行标定后,各有机酸浓度回收率0.5 mg·L–1为86.0%~109%(n=3),1 mg·L–1为81.2%~106.4%(n=3),10 mg·L–1为91.9%~107%(n=3),故认为衍生化产物稳定存在,衍生化反应稳定可靠。
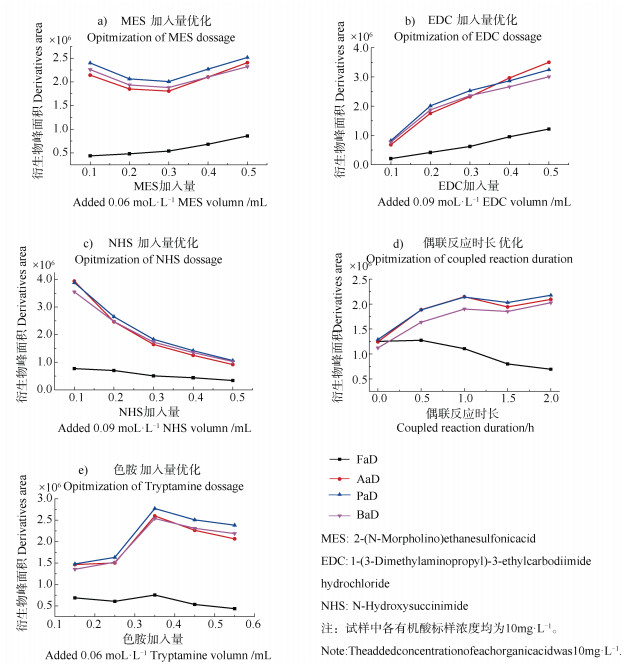
2.4 衍生化反应的条件优化该衍生化反应在实验中所给定的条件下均能发生反应,但衍生产物的产率会有差异,故对衍生化反应过程中各衍生试剂的浓度、反应条件进行优化,以获得最优化反应条件,达到最佳衍生效率。条件优化以一系列试验样品中某一条件呈梯度变化,其他条件维持不变为准,即作为非变量时,试剂MES、EDC、NHS加入量均为0.5 mL、色胺为0.35 mL、偶联反应时长为2 h。仪器测定后对峰面积作曲线图,衍生化产物的峰面积越高,则溶液中浓度越高,生成的衍生物量最多,此时可认定为最优条件。图 5是衍生化反应条件优化图。
由图 5a知,甲酸衍生物浓度随MES加入量增加而逐渐增高,其他几种单羧酸的衍生物浓度则先降低再升高,当加入0.5 mL(30.0 μmol)MES,衍生物的产率达到较佳状态,故选择加入0.5 mL(30.0 μmol)的MES。由图 5b,EDC加入量越多,衍生物浓度越高,当加入0.5 mL(22.5μmol)后,达最大值;但是,当加入0.3 mL(13.5μmol)后,乙、丙、丁酸衍生物浓度增加缓慢,且色谱图杂质峰随EDC加入量增多而增强。综合考虑,EDC加入量不宜过多,因此,在灵敏度足够时,本法选0.3 mL(13.5μmol)较佳,既不影响样品分析,又可保证液相色谱图的相对简单。且据实验证实,EDC需即配即用,否则不易发生交联反应。由图 5c,当加入的NHS量越多,衍生化产物的峰面积反而越小,即衍生物浓度越低,这应该与反应平衡有关。当NHS过量太多,可能会抑制中间产物2与色胺的反应进行,使最后一步酰胺化反应逆向进行,进而使得目标产物减少,故选择0.1mL(9.0 μmol)NHS加入量。据图 5d ,甲酸衍生物峰面积随着偶联反应时间的延长而减小,反应0.5 h峰面积达峰值,表明甲酸偶联反应很快,故甲酸的最佳偶联反应时长为0.5 h;而对于乙酸、丙酸和丁酸而言,衍生产物峰面积随反应时间的延长先升高后降低,当反应达到1.0 h,衍生产物峰面积达最高,故认为1.0 h为此三种酸的最优偶联反应时长。综合考虑,选0.75 h(45 min)为四种酸的偶联优化反应时长。由图 5e),在所设置的反应条件下,当色胺溶液的加入量为0.35 mL(21.0 μmol)时,各有机酸衍生物的峰面积最高,即产率最高,故本法选0.35 mL为较佳(若线性范围上限提高,需要适当提升色胺的加入量)。
|
图 5 衍生化反应条件优化图 Fig. 5 Optimized figures of derived reaction conditions |
此外,优化实验对整个反应温度也进行了考察,发现相同的反应在20℃和25℃的条件下生成的各衍生化产物的峰面积没有显著性差异(n=3),故选择室温(20℃~25℃)。而在加入色胺进行酰胺化反应时间达4 h后,衍生化产物的量不再增加(n=3),考虑操作便捷性,故选择静置反应过夜。
2.5 衍生法精密度和准确度评价采用最优化反应条件对该方法进行方法精密度和准确度测试,结果如下。
标准工作曲线。有机酸标准样衍生后的校准曲线线性方程和线性相关性如表 2,由表 2,各有机酸在衍生化后所得曲线方程线性相关性均为R2 > 0.99,可满足有机分析的要求。
|
|
表 2 有机酸衍生物校准曲线方程及线性相关性 Table 2 Linear equation and linearly dependence of derivatives |
方法加标回收率。加标样品衍生后回收率见表 3。4种有机酸的加标回收率范围为79.7%~133%,在有机分析的可控范围内,可满足有机分析的要求。
|
|
表 3 加标样品溶液经衍生化后测得的回收率 Table 3 Recovery of spiked sample by derivative method |
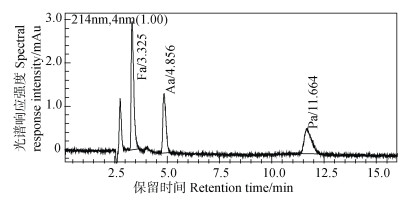
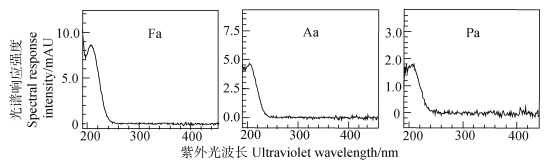
方法检测限。表 4是采用样品溶液直接液相色谱法(直接法DM)和有机酸衍生-液相色谱法(衍生法DvM)测定时检出限对比表。表 4表明衍生法不仅检出限较直接法低得多,还可以高灵敏度检测出丁酸。由于丁酸在紫外光下吸收很弱,当采用直接法时较难测出,故衍生法的检出优势更明显。其中直接法测定时所用仪器和色谱柱同衍生法,定量检测波长为214 nm,流动相为98%磷酸盐溶液(0.02 mol·L–1 NaH2PO4,pH为2.5)+2%甲醇(V/V),流速为0.8 mL·min–1,等梯度洗脱,其液相色谱图见图 6,紫外光谱图见图 7,丁酸在该测定条件下未能明显测出。
|
|
表 4 直接法与衍生法检测限比较 Table 4 Method detection limit comparison of direct method and derivative method |
|
图 6 3种有机酸标样DM液相色谱图(20 mg·L–1) Fig. 6 Liquid chromatogram of 3 organic acids by DM(20 mg·L–1) |
|
图 7 3种有机酸紫外光谱图(20 mg·L–1) Fig. 7 UV spectrums of 3 organic acids by DM respectively(20 mg·L–1) |
方法精密度和仪器精密度。表 5为本方法测定时的方法精密度和HPLC仪器精密度。由表 5,低浓度时(2 mg·L–1)4种有机酸衍生物的方法精密度均 < 10%,各衍生物仪器精密度均 < 3%,而较高浓度时(10 mg·L–1)各衍生物方法精密度均 < 3%,重复性很好,可满足有机分析的要求。
|
|
表 5 衍生法的精密度与仪器(HPLC)精密度 Table 5 Precisions of the derivative method and the instrument(HPLC) |
为了验证该衍生方法,对已经采用直接法测试过的两批次不同类型的样品进行衍生法复测并比较,见表 6。其中样品F36和F78是农作物秸杆发酵液,样品X27是水稻根系分泌物浓缩液,直接取样进行衍生化。图 8~图 10为各样品两种方法测试色谱图比较图。
|
|
表 6 实际样品直接法(DM)与衍生法(DvM)测定结果比较 Table 6 Comparison of sample results detected by direct method(DM)and derivative method(DvM) |
|
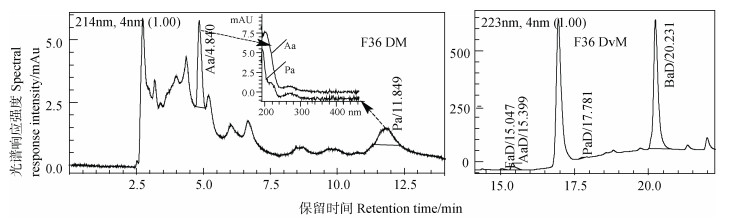
图 8 样品F36两种方法测试液相色谱图 Fig. 8 Liquid chromatograms of F36 by DM and DvM respectively |
|
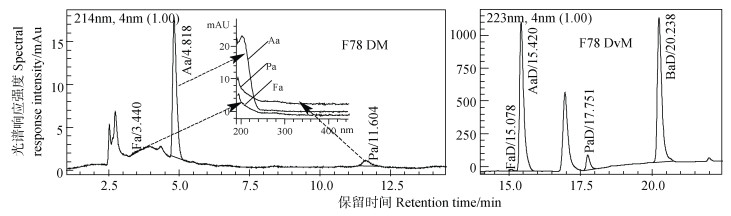
图 9 样品F78两种方法测试液相色谱图 Fig. 9 Liquid chromatograms of F78 by DM and DvM respectively |
|
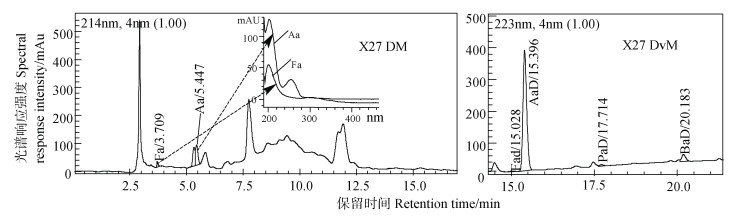
图 10 样品X27两种方法测试液相色谱图 Fig. 10 Liquid chromatograms of X27 by DM and DvM respectively |
图 8为F36在两种方法测试下的色谱比较图。在DM(直接法)测试中,甲酸(Fa)为未检出,尽管在Fa出峰处有色谱峰,但比较其紫外光谱图与图 7后发现明显不是,故判定为未检出。而在DvM法测试图中,则可看到有较小FaD(甲酸衍生物)峰,定量结果为0.932 mg·L–1(见表 6),表明样品中有少量Fa存在;DM法条件下,由于样品基质复杂及检测限较高很难测出,难以对其进行定性与定量。DM测试时Aa(乙酸)的保留时间为4.840 min,峰形尖锐且明显,可以定性,其定量结果为46.0 mg·L–1,但由该处对应的紫外光谱图与图 7对比后,发现在270 nm处有弱吸收,应有杂质峰共流出,定量结果应偏高;而经DvM法测试后发现该样品有明显的AaD(乙酸衍生物)峰,定量结果为5.56 mg·L–1(见表 6),两种方法测试结果差异较大,此时DvM法Aa测试结果因无杂质峰共流出而更可靠。Pa(丙酸)在DM测试时,保留时间为11.664 min,其色谱峰左右没有干扰峰,如果定量的话,结果为31.1 mg·L–1(见表 6),但此处的紫外光谱图与图 7比较后提示应不是丙酸;而且在DvM法测试图中,PaD(丙酸衍生物)峰几乎没有,低于其检测限,故可以认为该样品中应不含Pa,所以Pa判定为未检出;两种方法的测试结果有差异,DvM法测试时Pa结果更可信,且当丙酸的浓度较低(当Pa浓度 < 5 mg·L–1),很难准确测出。丁酸则只能采用DvM法准确测出,结果为137 mg·L–1(见表 6)。
图 9为两种方法下样品F78测试色谱图比较结果,由图可以看出Aa在两种方法的色谱图中均有很强烈的响应峰,Pa也均有明显的对应色谱峰,Fa在DM图中有很弱的色谱峰,在DvM法色谱图中有明显的色谱峰;再由表 6,可以看出,Fa、Aa和Pa在两种方法测试下,结果较一致,DvM法结果可靠。丁酸只有在DvM法下测试结果为262 mg·L–1,其对应的色谱图较好地印证了这一点。
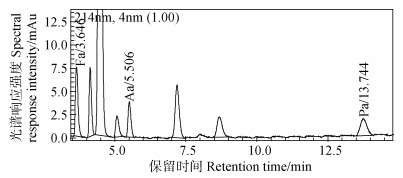
图 10为两种方法下样品X27测试色谱图比较结果,其中在DM测试图中,3种有机酸的定性保留时间取决于当次测试时有机酸标准样的液相色谱图,见图 11。由图 10,DM图中,Fa在其标样出峰处有非常明显的色谱峰,Aa出峰更显著,但是Aa色谱峰与其他共流出物有交叠,Pa则没有明显峰,结合各自的紫外光谱图,发现Fa和Aa出峰处很可能均有杂质峰,因为它们分别在约300 nm和250 nm处均有吸收峰;而由DvM法色谱图可看出该样品中Aa的含量较高,其他3种有机酸存在,但是含量不高。结合表 6,说明DM测试时Fa的值偏高较多,Aa则偏低,可能与附近的杂质干扰有关。Pa和Ba的测试结果则相对一致,由于检测限的限制,DM法很难测出此浓度水平下的含量,而DvM法可以测出。
|
图 11 有机酸标样液相色谱图(20 mg·L–1) Fig. 11 Liquid chromatogram of mix organic acids' standard |
综上,当采用DM测试此4种有机酸时,样品中单羧酸含量需较高(通常需 > 5 mg·L–1)、杂质的种类和含量相对较少,且在配备二极管阵列检测器时测试较为可靠,否则很可能带来定性定量不准,而采用DvM法测试时杂质干扰较小,具有定性定量可靠的特性,同时可以测定低含量样品,增敏效果显著,并且可以高灵敏度测定丁酸。
3 结论本文提出的几种小分子单羧酸偶联-酰胺化-液相色谱检测法具有定性定量准确可靠;灵敏度比液相色谱直接检测法提高达100倍以上,而且可以高灵敏度测定丁酸,优势明显;对于这几种单羧酸浓度较低、或基质复杂的土壤圈样品,具有样品前处理简单,操作方便等优势。
| [1] |
Shen A L, Li X Y, Wu S R. The composition characteristics of low-molecular-weight organic acids in soil and their roles on soil material cycling (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 1997, 3(4): 363-371. DOI:10.3321/j.issn:1008-505X.1997.04.012 [沈阿林, 李学垣, 吴受容. 土壤中低分子量有机酸在物质循环中的作用[J]. 植物营养与肥料学报, 1997, 3(4): 363-371.]
(  0) 0) |
| [2] |
Song J F, Cui X Y. Advances in the study of low molecular mass organic acids in forest soils (In Chinese)[J]. Scientia Silvae Sinicae, 2008, 44(6): 118-124. DOI:10.3321/j.issn:1001-7488.2008.06.021 [宋金凤, 崔晓阳. 森林土壤中低分子有机酸研究进展[J]. 林业科学, 2008, 44(6): 118-124.]
(  0) 0) |
| [3] |
Wu L H, Luo Y M, Christie P, et al. Effects of EDTA and low molecular weight organic acids on soil solution properties of a heavy metal polluted soil[J]. Chemosphere, 2003, 50(6): 819-822. DOI:10.1016/S0045-6535(02)00225-4
(  0) 0) |
| [4] |
Pramod K, Jyothi L N, Mani V P. Interactive effects of salicylic acid and phytohormones on photosynthesis and grain yield of soybean(Glycine, Merril1)[J]. Physiology and Molecular Biology of Plants, 2000, 6: 179.
(  0) 0) |
| [5] |
Chen X Q, Kang Ou, Zhou J M, et al. Effect of moisture conditions and OA Co-application on the transference and transformation of phosphorus in the fertisphere of a paddy soil from central China (In Chinese)[J]. Soils, 2013, 45(5): 838-844. DOI:10.3969/j.issn.1674-5906.2013.05.019 [陈小琴, 康欧, 周健民, 等. 水分与有机酸对水稻土肥际微域磷迁移转化的影响[J]. 土壤, 2013, 45(5): 838-844.]
(  0) 0) |
| [6] |
Wang D S, Liang C H, Wang W H. The dynamics research on the cinnamon releasing of brown soil extracted by low-molecular-weight organic acid (In Chinese)[J]. Journal of Liaoning Agricultural Vocation-Technical College, 2005, 7(1): 1-3. DOI:10.3969/j.issn.1671-0517.2005.01.001 [王东升, 梁成华, 王文华. 低分子量有机酸作用下棕壤、褐土钾的释放动力学研究[J]. 辽宁农业职业技术学院学报, 2005, 7(1): 1-3.]
(  0) 0) |
| [7] |
Qian Y, Liu Y. Effects of single and combined organic acids on form of Cd in soil (In Chinese)[J]. Chinese Journal of Soil Science, 2012, 43(1): 186-189. DOI:10.19336/j.cnki.trtb.2012.01.036 [钱翌, 刘莹. 单一及复合有机酸对土壤中镉形态的影响研究[J]. 土壤通报, 2012, 43(1): 186-189.]
(  0) 0) |
| [8] |
Li W Z, Xie W M, Jiang T, et al. Effect of three low-molecular organic acids on desorption of DDT in soil (In Chinese)[J]. Journal of Beihua University: Natural Science, 2009, 10(6): 551-553. DOI:10.3969/j.issn.1009-4822.2009.06.023 [李宛泽, 谢文明, 江涛, 等. 3种低相对分子质量有机酸对土壤中DDT的解吸[J]. 北华大学学报: 自然科学版, 2009, 10(6): 551-553.]
(  0) 0) |
| [9] |
Tagami K, Uchida S, Ishii N. Measurement of the fate of acetic acid form carbon in soil solution of flooded soils using high-performance liquid chromatography coupled with isotope ratio mass spectrometry[J]. Geoderma, 2011, 165(1): 25-30. DOI:10.1016/j.geoderma.2011.06.019
(  0) 0) |
| [10] |
Wang D L, Lin W H. Effects of CO2 elevation on root exudates in rice (In Chinese)[J]. Acta Ecologica Sinica, 1999, 19(4): 570-572. DOI:10.3321/j.issn:1000-0933.1999.04.025 [王大力, 林伟宏. CO2浓度升高对水稻根系分泌物的影响--总有机碳、甲酸和乙酸含量变化[J]. 生态学报, 1999, 19(4): 570-572.]
(  0) 0) |
| [11] |
Thangarajan R, Bolan N S, Tian G L, et al. Role of organic amendment application on greenhouse gas emission from soil[J]. Science of the Total Environment, 2013, 465: 72-96. DOI:10.1016/j.scitotenv.2013.01.031
(  0) 0) |
| [12] |
Lynch J M. Production and phytotoxicity of acetic acid in anaerobic soils containing plant residues[J]. Soil Biology and Biochemistry, 1978, 10(2): 131-135. DOI:10.1016/0038-0717(78)90083-4
(  0) 0) |
| [13] |
Jiang Z Z, Zhang C Z, Wang Y F, et al. Establishment of a novel diagnostic method for colorectal cancer based on metabolites of intestinal microorganism (In Chinese)[J]. Chinese Journal of Analytical Chemistry, 2016, 44(8): 1178-1184. [江振作, 张春泽, 王跃飞, 等. 基于肠道微生物代谢产物的人结直肠癌诊断方法研究[J]. 分析化学, 2016, 44(8): 1178-1184.]
(  0) 0) |
| [14] |
Li J H, Wang Z C. Determination of propionic acid, malic acid and citric acid in the soil by gas chromatography (In Chinese)[J]. Journal of East China Institute of Technology, 2006, 29(4): 376-378. [李建红, 王志畅. 气相色谱法测定土壤中丙酸、苹果酸、柠檬酸[J]. 东华理工学院学报, 2006, 29(4): 376-378.]
(  0) 0) |
| [15] |
Li S H, Liu L, Liu B. Gas chromatography determination of monoprotic organic acids content in cyclohexane oxidation liquid (In Chinese)[J]. China Synthetic Fiber Industry, 2011, 34(2): 65-66. DOI:10.3969/j.issn.1001-0041.2011.02.019 [李曙红, 柳利, 刘彬. 气相色谱法测定环己烷氧化液中一元有机酸含量[J]. 合成纤维工业, 2011, 34(2): 65-66.]
(  0) 0) |
| [16] |
Zhu L, Zheng J, Yang J, et al. Determination of polybasic acids and higher fatty acids in tobacco by microwave-assisted methyl esterification combining with fast GC (In Chinese)[J]. Tobacco Science & Technology, 2015, 48(9): 56-61. [朱玲, 郑健, 杨涓, 等. 微波辅助甲酯化-快速GC法测定烟草中的多元酸和高级脂肪酸[J]. 烟草科技, 2015, 48(9): 56-61.]
(  0) 0) |
| [17] |
Ji H W, Zhang L, Man J, et al. Determination of fourteen volatile organic acids in total particulate matters in mainstream cigarette smoke by shaking extraction and gas chromatography-mass spectrometry (In Chinese)[J]. Tobacco Science & Technology, 2015, 48(9): 33-39. [姬厚伟, 张丽, 满杰, 等. 振荡萃取-GC/MS法测定卷烟主流烟气总粒相物中的14种挥发性有机酸[J]. 烟草科技, 2015, 48(9): 33-39.]
(  0) 0) |
| [18] |
Zhang Q, Xiang Z M, Cai K, et al. Determination of organic acids from mainstream cigarette smoke using ultra low temperature solvent extraction followed by comprehensive two-dimensional gas chromatography /time-of-flight mass spectrometry (In Chinese)[J]. Chinese Journal of Analytical Chemistry, 2014, 42(8): 1124-1130. [张权, 向章敏, 蔡凯, 等. 超低温溶剂提取-全二维气相色谱/飞行时间质谱法测定卷烟主流烟气中有机酸成分[J]. 分析化学, 2014, 42(8): 1124-1130.]
(  0) 0) |
| [19] |
Zhao Y F, Lu S M, Wang H L, et al. Analysis of volatile acids in food by headspace gas chromatography-mass spectrometry (In Chinese)[J]. Journal of Instrumental Analysis, 2009, 28(12): 1456-1459. DOI:10.3969/j.issn.1004-4957.2009.12.022 [招云芳, 陆舍铭, 王海利, 等. 顶空气相色谱质谱法快速测定液体食品中的挥发性酸[J]. 分析测试学报, 2009, 28(12): 1456-1459.]
(  0) 0) |
| [20] |
Wang P, Zhou R. Determination of organic acids exuded from plant roots by high performance liquid chromatography (In Chinese)[J]. Chinese Journal of Chromatography, 2006, 24(3): 239-242. DOI:10.3321/j.issn:1000-8713.2006.03.006 [王平, 周荣. 高效液相色谱法测定植物根系分泌物中的有机酸[J]. 色谱, 2006, 24(3): 239-242.]
(  0) 0) |
| [21] |
Qian B, Zhang Y, Li S, et al. Determination of organic acids in propionic acid fermentation broth by reversed phase high performance liquid chromatography (In Chinese)[J]. Chinese Journal of Analytical Chemistry, 2007, 35(11): 1651-1653. DOI:10.3321/j.issn:0253-3820.2007.11.023 [钱兵, 章燕, 李莎, 等. 反相高效液相色谱法测定丙酸发酵液中的有机酸[J]. 分析化学, 2007, 35(11): 1651-1653.]
(  0) 0) |
| [22] |
Huang T Z, Wang S J, Liu X M, et al. Rapid determination of eight organic acids in plant tissue by sequential extraction and high performance liquid chromatography (In Chinese)[J]. Chinese Journal of Chromatography, 2014, 32(12): 1356-1361. [黄天志, 王世杰, 刘秀明, 等. 逐级提取-高效液相色谱法快速测定植物组织中8种有机酸[J]. 色谱, 2014, 32(12): 1356-1361.]
(  0) 0) |
| [23] |
Gao Y Y, Peng Z F, Yang C, et al. Determination of the effect of organic acids in Ricinus communis L. roots under copper stress by HPLC (In Chinese)[J]. Guangdong Chemical Industry, 2018, 45(21): 10-11. [高媛媛, 彭兆丰, 杨成, 等. 应用HPLC检测蓖麻根系分泌物中有机酸的含量[J]. 广东化工, 2018, 45(21): 10-11.]
(  0) 0) |
| [24] |
Wu C C, Liu J, Zhang X H. Determination of organic acids in the root exudates of Cr-hyperaccumulator Leersia hexandra Swartz using high performance liquid chromatography (In Chinese)[J]. Chinese Journal of Chromatography, 2018, 36(2): 167-172. [伍婵翠, 刘杰, 张学洪. 高效液相色谱法测定铬超富集植物李氏禾根系分泌物中的有机酸[J]. 色谱, 2018, 36(2): 167-172.]
(  0) 0) |
| [25] |
Liu K L, Huang J, Han T F, et al. Variation of potassium-solubilizing bacteria in red soil under long-term fertilization and its driving factors (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 183-194. [柳开楼, 黄晶, 韩天富, 等. 长期施肥下红壤旱地解钾菌变化及其驱动因子[J]. 土壤学报, 2020, 57(1): 183-194.]
(  0) 0) |
| [26] |
Shi Y L, Liu J S, Cai Y Q, et al. Simultaneous determination of organic acids and inorganic anions in beer by ion chromatography (In Chinese)[J]. Chinese Journal of Analytical Chemistry, 2005, 33(5): 605-608. [史亚利, 刘京生, 蔡亚岐, 等. 离子交换色谱法同时测定啤酒中有机酸和无机阴离子[J]. 分析化学, 2005, 33(5): 605-608.]
(  0) 0) |
| [27] |
Cao J X, Hang Y P, Lu J P, et al. Determination of nonnitrogenous organic acids and inorganic anions in sugarcane molasses and molasses alcohol waste by ion chromatography with solid-phase extraction (In Chinese)[J]. Chinese Journal of Chromatography, 2010, 28(9): 893-897. [曹家兴, 杭义萍, 陆建平, 等. 固相萃取-离子色谱法测定甘蔗糖蜜及糖蜜酒精废液中的非氮有机酸和无机阴离子[J]. 色谱, 2010, 28(9): 893-897.]
(  0) 0) |
| [28] |
Li F, Wang L L, Xu Y, et al. Determination of six kinds of organic acids in grapes by ion chromatography (In Chinese)[J]. Journal of Jilin Agricultural Sciences, 2011, 36(1): 48-49. [李芳, 王丽丽, 徐熠, 等. 离子色谱法测定葡萄中六种有机酸[J]. 吉林农业科学, 2011, 36(1): 48-49.]
(  0) 0) |
| [29] |
Sun Y Y, Yu S, Luan L Y, et al. Simultaneous determination of formic acid, acetic acid, propionic acid and n-butyric acid in environmental samples by ion chromatography (In Chinese)[J]. Shandong Science, 2017, 30(4): 92-98. [孙芸芸, 于帅, 栾玲玉, 等. 离子色谱法同时测定环境样品中有机酸的研究[J]. 山东科学, 2017, 30(4): 92-98.]
(  0) 0) |
| [30] |
Mu X W, Zhang D G, Chen H, et al. Determination of organic acids and inorganic anions in the steam by ion chromatography (In Chinese)[J]. Industrial Water Treatment, 2019, 39(10): 100-103. [慕晓炜, 张达光, 陈皓, 等. 离子色谱法测定水汽中有机酸和无机阴离子[J]. 工业水处理, 2019, 39(10): 100-103.]
(  0) 0) |
| [31] |
Cheng J Y, Wang T D, Kang J W. Quantitative monitoring the concentration changes of organic acids in fermentation process of Clostridium acetobutylicum using capillary ion electrophoresis (In Chinese)[J]. Chinese Journal of Chromatography, 2008, 26(6): 658-661. [程佳懿, 汪彤丹, 康经武. 毛细管离子电泳法定量监测丙酮丁醇梭菌发酵过程中产生的有机酸的浓度变化[J]. 色谱, 2008, 26(6): 658-661.]
(  0) 0) |
| [32] |
Yan L, Tu C Y, Tang M H. Determination of organic acid in fermentation broth by capillary electrophoresis (In Chinese)[J]. Journal of Nanjing University of Technology: Natural Science Edition, 2008, 30(6): 95-100. [严励, 屠春燕, 唐美华. 毛细管区带电泳法检测丁二酸发酵液中多种低相对分子质量有机酸[J]. 南京工业大学学报: 自然科学版, 2008, 30(6): 95-100.]
(  0) 0) |
| [33] |
Brugnerotto P, Della Betta F, Gonzaga L V, et al. A capillary electrophoresis method to determine aliphatic organic acids in bracatinga honeydew honey and floral honey[J]. Journal of Food Composition and Analysis, 2019, 82: 103243.
(  0) 0) |
| [34] |
Mi Z H, Chen Y F, Zhang H P. Application of UPLC-MS in analysis of organic acids in fermented milk (In Chinese)[J]. China Dairy Industry, 2017, 45(12): 37-39. [米智慧, 陈永福, 张和平. 超高效液相色谱质谱联用技术在发酵乳有机酸分析中的应用[J]. 中国乳品工业, 2017, 45(12): 37-39.]
(  0) 0) |
| [35] |
Wang S W, Liu Y P, Wang X N, et al. Determination of ten organic acids content in fresh Litchi based on high performance liquid chromatography with triple quadrupole mass spectrometry technique (In Chinese)[J]. Chinese Journal of Pesticide Science, 2019, 21(3): 359-365. [王思威, 刘艳萍, 王潇楠, 等. 基于高效液相色谱-三重四极杆串联质谱技术测定鲜荔枝果肉中10种有机酸含量[J]. 农药学学报, 2019, 21(3): 359-365.]
(  0) 0) |
| [36] |
Wang Y J, Yang C R, Wang L Y. Influence of EDC/NHS crosslinking on physicochemical properties of collagen (In Chinese)[J]. Journal of South China University of Technology: Natural Science Edition, 2007, 35(12): 66-70. [王迎军, 杨春蓉, 汪凌云. EDC/NHS交联对胶原物理化学性能的影响[J]. 华南理工大学学报: 自然科学版, 2007, 35(12): 66-70.]
(  0) 0) |
| [37] |
Lu G Y, Kong L J, Sheng B Y, et al. Degradation of covalently cross-linked carboxymethyl chitosan and its potential application for peripheral nerve regeneration[J]. European Polymer Journal, 2007, 43(9): 3807-3818.
(  0) 0) |
| [38] |
Shepherd D V, Shepherd J H, Ghose S, et al. The process of EDC-NHS cross-linking of reconstituted collagen fibres increases collagen fibrillar order and alignment[J]. APL Materials, 2015, 3(1): 014902.
(  0) 0) |
| [39] |
Elahi M F, Guan G P, Wang L, et al. Influence of layer-by-layer polyelectrolyte deposition and EDC/NHS activated heparin immobilization onto silk fibroin fabric[J]. Materials: Basel, Switzerland, 2014, 7(4): 2956-2977.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


