2. 杭州市临安区农业农村局,杭州 311300
2. Bureau of Agriculture and Rural Development, Lin'an District, Hangzhou 311300, China
森林资源的持续发展不仅是国民经济发展的要求,也是良好生态环境的保障。众多文献报道桉树[1]、杉木[2]、杨树[3]等人工林长期连栽表现出明显的连作障碍现象,严重影响我国的木材产量和生态安全,而同为人工林的毛竹却没有发生类似连栽障碍现象,毛竹林和杉木林对土壤的长期影响可能存在差异。
相比人工林,农业生产发生连作障碍现象更加普遍、更加严重、研究也更加深入,尤其是经营强度大的瓜果蔬菜[4]、花卉[5]和中药材[6]等经济效益高的植物。但文献报道人工林的连栽障碍和农作物的连作障碍主导因子具有共同特点,包括土壤养分亏缺、土壤反映异常、土壤理化性质恶化、植物有害物质累积、土壤微生物变化等5大类[7]。连作障碍是农业生产的疑难杂症,虽然轮作、休耕和有机肥等农业措施是缓解连作障碍的有效措施[8],但不能可持续地满足农事和产业要求[9]。连作导致土壤微生物群落组成和结构破坏[10-11]。连作过程中伴随根际微生态变化的另一个明显特征是致病菌数量增加而有益菌数量下降,这是导致植物减产、甚至死亡的直接原因[12]。研究发现,长期连续种植香草后,土壤弱化和香草枯萎病可归因于土壤真菌群落的变化,有益微生物水平的降低以及土壤传播和镰刀菌病原菌的积累[13];种植在再植地的苹果根际土壤中的细菌多样性要比新种植地要低[14];真菌病原体的增加和有益真菌群落简化导致多年连作花生生长和单产下降[15]。
虽然生产上连作(栽)障碍现象非常普遍,然而仍然存在不发生连作(栽)障碍的土壤,其特征为土壤微生物多样性高、微生物量大以及微生物结构稳定,抵御连作(栽)障的能力强,这种土壤被称为抑病型土壤[16]。抑制土传病害的土壤作为一种特殊的生态系统,受特定微生物群落活动的影响,植物根系感染的风险较小[17]。连作(栽)障碍程度还与植物类型密切相关,甚至同一植物不同品种之间都存在差异[18]。毛竹对土壤微生物的影响可能有别于杉木林,因此,本研究推测毛竹林没有发生连作障碍可能是因为毛竹长期种植有助于抑病型土壤的形成。已有研究通过采集分析不同种植时间毛竹土壤的理化性质和微生物的变化发现,在毛竹长期栽培过程中,土壤微生物具有对环境干扰的抵抗和恢复本能[19]。
揭示人工林连栽障碍一般采用代际梯度采样方法,研究不同梯度林分土壤的差异。我们提出了一种新的研究思路,第二代人工林生长明显下降可能是第一代长期生长过程中积累了某些不良因素所致;气候、立地和土壤相同的背景下,不同树种长期生长导致的土壤性质、尤其是微生物学性质差异,可能对下一代林木生长产生截然不同的影响。基于我们对毛竹和杉木的实际调研以及文献报道的结果,本研究提出如下科学假设,毛竹长期生长过程中能保持土壤理化性质、土壤微生物群落特征以及多样性稳定,而杉木林则不具有此特点。为此,本研究以植被多样性丰富[20]、土壤各项性质最优的阔叶林[21-22]为对照,以生态控制原则,选择种植时间长达40年的毛竹和杉木林,应用高通量测序技术,比较分析毛竹林和杉木林土壤微生物特征的差异。
1 材料与方法 1.1 研究区概况研究区位于浙江省杭州市临安区玲珑山(30°14′N,119°42′E),属于中亚热带季风气候,年平均温度16.4℃,年降水量1 628.6 mm。选取的三种林分成土母质统一,均为发育于凝灰岩的黄红壤。森林类型分别是阔叶林(Broad-leaved forest,BL)、毛竹林(Moso banboo forest,MB)、杉木林(Chinese fir forest,CF)。其中,阔叶林和杉木林下植被均包含丛生灌木和蕨类植物,毛竹林下植被很少,仅有稀疏的草本植物[23]。
1.2 土壤样品采集2017年10月中旬,在10 m2范围内采样区按三角采样法选取3个取样点,收集表层(0~20 cm)土壤,每个样地的3个取样点混合成一个复合土壤样品,每种林分选择4个重复,3种林分共得12个(3×4×1)土样。将土壤进一步分为两部分,一部分土壤样品自然风干并使用2 mm孔径的筛子过筛后,用于土壤理化性质分析;另一部分新鲜土壤在–80℃下存储,每个样品100 g,用于DNA提取。
1.3 土壤基本理化性质分析土壤分析方法参考《土壤农业化学分析方法》[24]。采用烘干法测定土壤含水量(SWC),玻璃电极法测定pH,水土比5:1(v/m),碱解扩散法测定土壤碱解氮(AN)含量,钼锑抗比色法测定土壤盐酸-氟化铵浸提液中有效磷(AP)含量,火焰光度计法测定土壤NH4OAc提取液中速效钾(AK)含量,元素分析仪(ELEMENTAR Vario El Cube)通过干式燃烧分析土壤有机碳(SOC)和土壤全氮(TN)。
1.4 土壤DNA提取使用Power Soil DNA Isolation Kit土壤DNA试剂盒提取土壤样品中总基因组DNA,然后使用分光光度计(QuickDrop2017)和琼脂糖凝胶电泳验证DNA的质量和数量。提取的DNA分装并保存在–70℃中备用。
1.5 PCR扩增和Illumina高通量测序分析每个样品的稀释DNA用作模板,分别使用不同引物对细菌16S和真菌ITS rRNA基因序列进行PCR扩增。对于细菌多样性分析,使用通用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')扩增16S rRNA基因的可变V3-V4区[25]。对于真菌多样性分析,使用通用引物ITS3(5'-GCATCGATGAAGAACGCA GC-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')扩增ITS rRNA基因的真菌序列[26]。
采用2%琼脂糖凝胶电泳,配合使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,联合市,加利福尼亚州,美国)进行纯化,将纯化的扩增子等摩尔合并,在上海美吉生物公司进行扩增子的高通量测序。在这项研究中生成的完整数据集已上传于NCBI Sequence Read Archive数据库中,登录号为SRR11809960和SRR11810741。
首先使用Trimmomatic软件对原始的序列进行质量过滤;FLASH软件进行双端序列拼接;之后,基于Qiime(版本1.9.1)和Uparse环境进行后续分析,最终以97%的相似度指标对优质序列进行聚类获得OTU表和代表性序列。最后,分别基于silva138和unite8.0数据库对细菌16S和真菌ITS rDNA序列进行物种分类注释,各分类水平的物种均以相对丰度形式进行后续分析。为了比较不同林分土壤样品中细菌和真菌OTU多样性的相对水平,首先根据最小序列的样品中的OTU数将数据进行均一化处理,然后使用Mothur软件中的collect.single和summary.single函数计算,以获得各样品中微生物群落的α多样性。
1.6 统计分析所有参数基于SPSS 20软件,使用单因素方差分析(one-way ANOVA)进行处理间差异比较,并利用Duncan’s函数进行多组数据的事后显著性检验,显著性水平设定为P < 0.05。组间差异比较是基于Kruskal-Wallis秩和检验使用MAFFT软件分析的。Venn图是用R语言(version 3.3.1)的VennDiagram包进行分析和可视化。
基于OUT表的主坐标轴分析(PCoA)利用R平台的“vegan”包进行基于Bray_Curtis距离矩阵计算,然后利用“ggplot2”进行可视化。最后,利用R语言的“Randomforest”包,计算基于随机森林模型的MeanDecreaseGini指标,分别预测可以区分三种林分土壤细菌、真菌群落的关键OTU,并将排序前20的OTU可视化。db-RDA分析方法(基于Bray-Curtis距离差异)用于分析物种与环境因子之间的关系(所有进行相关分析的环境因子已通过VIF方差膨胀因子分析)。相关性Heatmap图是基于“pheatmap”包(R version 3.3.1)绘制生成的。
2 结果 2.1 不同林分细菌和真菌的alpha多样性原始的fastq序列拼接、质控、去嵌合体后,12个土壤样品共获得细菌618 076条序列、真菌692 739条序列,根据97%的相似性,进一步分为2 858个细菌OTU和1 985个真菌OTU。置信度阈值设为0.7,且三种林分的Shannon稀疏曲线均趋于平坦(图S1),认为测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。抽平后阔叶林、毛竹林和杉木林土壤细菌有效序列分别为171 301、277 630和169 145条序列,真菌分别为236 727、268 146和187 866条序列。
基于OTU的α多样性指数可反映土壤微生物的多样性。Shannon多样性指数综合考虑了群落的丰富度和均匀度,数值越高,表明群落多样性越高。当组间群落多样性都较为均匀时,可以通过添加Invsimpson(逆辛普森指数)来展示细微的组间差异。Invsimpson是均匀度一致的群落丰富程度的标志,指数越高说明其多样性与丰富程度越高。Chao1指数用来估计群落中实际存在的物种数,一般而言,Chao1指数越大,表明群落的丰富度越高。Berger-Parker指数越高,表明优势物种多样性越高。毛竹林和杉木林土壤微生物α多样性结果悬殊,土壤细菌和真菌的Shannon多样性和Invsimpson均匀度指数均为毛竹林最高、杉木林最低(P < 0.05),而Berger-Parker指数则杉木林高于其他两种林分(P < 0.05),Chao1指数均为毛竹林最高、阔叶林最低(P < 0.05)。
|
|
表 1 林下土壤微生物OTU水平上α多样性(均值±标准差) Table 1 Alpha diversity of understory soil microbial at the level of OTU(mean±SD) |
根据细菌门水平分类结果(图 1),16S rDNA序列中的97.12%被归类为10个不同的门。三种林分的土壤细菌群落总体呈现出相似的门水平分类,但相对丰度存在差异。最丰富的酸杆菌门(Acidobacteria)在各样本中均占三分之一以上,其在阔叶林样品中的含量明显高于其他2种林分。第二优势门变形菌门(Proteobacteria)平均相对丰度为24%,毛竹林样品中的含量略高于杉木林大于阔叶林,但在三种林分土体土壤中的相对含量没有显著差异。第三优势门绿弯菌门(Chloroflexi)为杉木林土壤中的含量(24.42%)显著(P < 0.05)高于毛竹林和阔叶林,而第四优势门放线菌门(Actinobacteria)则是毛竹林样品中的含量(13.13%)明显高于阔叶林地杉木林地,但未呈现出显著差异。其他优势细菌门包括浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、WPS-2、芽单胞菌门(Gemmatimonadetes)、Patescibacteria和拟杆菌门(Bacteroidetes)。其中杉木林地的芽单胞菌门和芽单胞菌门占比分别极显著低于(P < 0.01)和高于(P < 0.001)阔叶林。
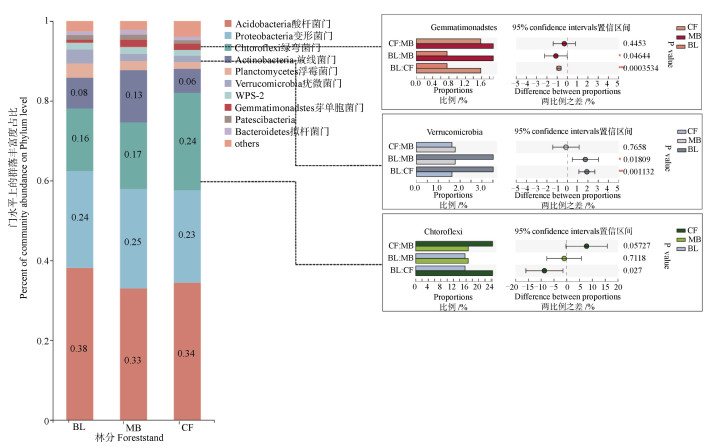
|
注:BL代表阔叶林,MB代表毛竹林,CF代表杉木林。下同。 Note: BL stands for the broad-leaved forest, MB stands for the bamboo forest, and CF stands for the fir forest. *, P < 0.05;**, P < 0.01;***, P < 0.001。n=12. The same below. 图 1 细菌门水平分类结果及组间显著比较 Fig. 1 Bacteria classification at the phyla level and significant difference comparison between groups |
细菌目水平分类检测到的24个目在三个森林类型中均有分布,占总变异类型的84.84%。图 2a和图b分别不同林分土壤真菌优势目相对比例和前30个目的组间差异情况。阔叶林土壤优势目依次为酸杆菌门(Acidobacteria)的Subgroup_2、Acidobacteriales、Solibacterales,绿弯菌门(Chloroflexi)的norank_c__AD3和Ktedonobacterales,变形菌门(Proteobacteria)的Elsterales(毛竹林土壤相对丰度显著低于阔叶和杉木林,P < 0.05)。毛竹林土壤优势目依次为酸杆菌门(Acidobacteria)的Acidobacteriales、Subgroup_2、Solibacterales,绿弯菌门(Chloroflexi)的norank_c__AD3目和Ktedonobacterales,变形菌门(Proteobacteria)的Rhizobiales。阔叶和毛竹林土壤中最优势门Acidobacteria的几个优势目种类一致,但相对占比顺序不同。然而,杉木林土壤占比最大的是绿弯菌门(Chloroflexi)norank_c__AD3目(17%,相对丰度极显著高于阔叶林和毛竹林,P < 0.01),其次为酸杆菌门(Acidobacteria)的Subgroup_2、Solibacterales和Acidobacteriales(7%,相对丰度显著低于阔叶林,P < 0.05),变形菌门(Proteobacteria)的Elsterales。
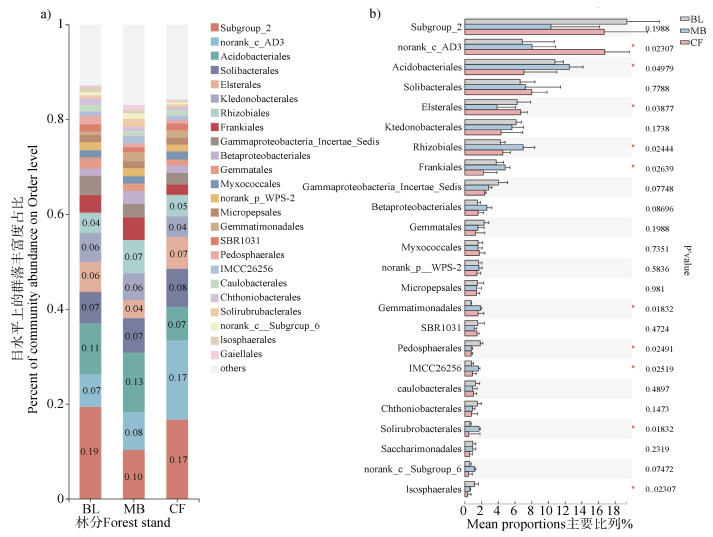
|
图 2 细菌目水平分类结果及组间显著比较 Fig. 2 Classification results of bacterial orders and significant difference comparison between groups |
真菌门水平上前5个分类结果包含了99.15%的序列,杉木林相对丰度与其他两者差异较大(图 3)。子囊菌门(Ascomycota)为阔叶林(68%)和毛竹林(67%)第一优势门,显著(P < 0.05)高于杉木林(38%)。担子菌门(Basidiomycota)为毛竹林和阔叶林的第二优势门,毛竹林(23%)与杉木林(10%)差异显著(P < 0.05)。被孢菌门(Mortierellomycota)为杉木林(45%)第一优势门,显著(P < 0.05)高于阔叶林(4%)和毛竹林(5%)。Unclassified和毛霉门(Mucoromycota)虽未呈现出显著性,但三种林分丰度差异明显。
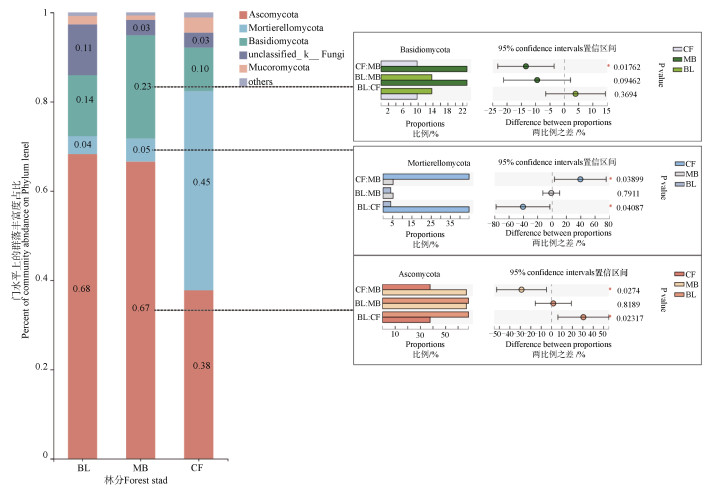
|
图 3 真菌门水平分类结果及组间显著比较 Fig. 3 Classification results of fungal phyla and significant difference comparison between groups |
真菌目水平共检测到30个分类,在三个森林类型的总变异中占94.07%。图 4a和图 4b分别展示了不同林分土壤真菌优势目水平分类结果和前30个目的组间显著比较。阔叶林土壤真菌优势目Eurotiales(18%,显著高于毛竹林和杉木林,P < 0.05)、Helotiales(17%,显著高于杉木林,P < 0.05)、unclassified_p_Ascomycota等3个主要目均属于子囊菌门(Ascomycota)。毛竹林土壤最优势真菌目为担子菌门(Basidiomycota)的Agaricales,其余优势目依次为unclassified_p_Ascomycota、Chaetothyriales、Helotiales、Geoglossales,均属于子囊菌门(Ascomycota)。杉木林土壤真菌被孢菌门(Mortierellomycota)的Mortierellales目(45%)显著(P < 0.05)高于毛竹林(5%)和阔叶林(4%),其他优势目均来自子囊菌门(Ascomycota),分别为Venturiales(12%,显著高于毛竹林,P < 0.05)、unclassified_p_Ascomycota和Helotiales。总体而言,三种林分土壤真菌的优势目以子囊菌门(Ascomycota)为主,但不同林分各自特殊的优势目不同,仅Helotiales目为三者共性目。杉木林土壤Mortierellales目的比例异常高,而其他两种林分没有出现单目异常高的情况。
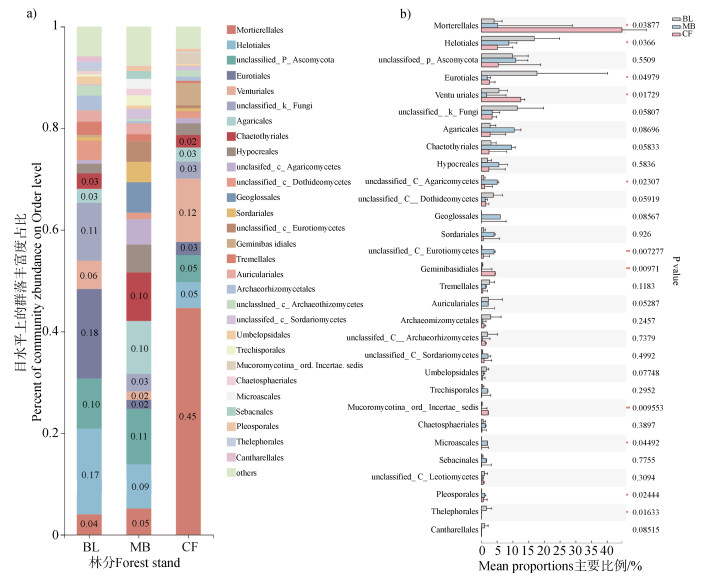
|
图 4 真菌目水平分类结果及组间显著比较 Fig. 4 Classification results of fungi orders and significant difference comparison between groups |
基于Bray-Curtis距离矩阵的PCoA分析结果,不同森林植被类型之间的群落组成差异明显(图 5)。毛竹林土壤细菌和真菌群落在PCoA1轴上与其他两种林分明显分开,阔叶林与杉木林沿PCoA2轴明显分开。细菌PCoA1轴上贡献度最大的10个OTU分别来自绿弯菌门(Chloroflexi)的norank、Ktedonobacterales和SBR1031目,放线菌门(Actinobacteria)的Corynebacteriales、Streptomycetales和IMCC26256目,以及变形菌门(Proteobacteria)的Reyranellales和Rhizobiales目,酸杆菌门(Acidobacteria)的Subgroup_7目,拟杆菌门(Bacteroidetes)的Sphingobacteriales目。
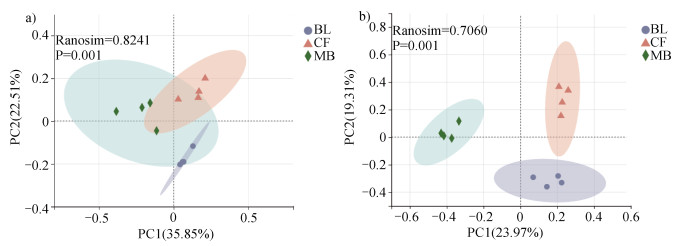
|
图 5 土壤细菌(a)、真菌(b)群落PCoA分析结果 Fig. 5 PCoA analysis results of soil bacterial(a)and fungal(b)communities |
真菌PCoA1轴上贡献度最大的10个OTU分别来自子囊菌门(Ascomycota)的Chaetothyriales、Helotiales、unclassified_c_Archaeorhizomycetes、unclassified_c_Leotiomycetes、Chaetosphaeriales和Pleosporales目,Mucoromycota门的Mucorales目。阔叶林和毛竹林土壤真菌占比最高的子囊菌门(Ascomycota)所属OTU对不同林分土壤真菌群落分异的贡献度最高,其次为杉木林土壤最优势门Mucoromycota门所属OTU。
2.4 环境因子与微生物菌群的关系 2.4.1 环境因子对土壤微生物多样性的影响环境因子与微生物多样性相关性分析结果表明(表 2),不同多样性指数响应的土壤指标不同,细菌Shannon多样性指数和Invsimpson指数分别对全氮和pH响应极显著(P < 0.01),细菌Chao1指数对有效磷具有显著响应(P < 0.05);真菌Chao1指数分别对全氮和pH表现为极显著(P < 0.01)和显著(P < 0.05)响应,真菌Berger-Parker指数对碱解氮具有显著响应(P < 0.05)。
|
|
表 2 土壤理化性质与微生物多样性的相关性 Table 2 Results of correlation between soil physical and chemical properties and microbial diversity |
PCoA分析显示了不同森林类型之间土壤微生物群落结构的差异,而冗余分析用于反映土壤理化性质对微生物群落的影响结果(图 6)。根据DCA分析结果Lengths of gradient第一轴的大小如果大于等于3.5,CCA的结果要好于RDA,如果小于3.5,则选用RDA。从细菌的RDA和真菌的CCA图可以看出,基于不同林分土壤微生物群落结构对理化因子的响应结果表明,同种林分细菌和真菌呈现出相同的规律,具体表现为毛竹林土壤细菌和真菌群落结构对有效磷、pH、速效钾均表现为正响应,阔叶林土壤细菌和真菌群落则对全氮、碱解氮、碳氮比表现为正响应,杉木林土壤细菌和真菌群落对除pH以外的理化因子均表现为负响应。
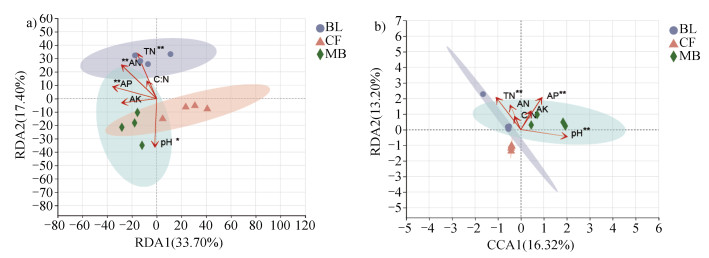
|
图 6 RDA/CCA关系图显示细菌(a)、真菌(b)群落结构与理化因子的关联 Fig. 6 The RDA/CCA relationship between bacterial(a)and fungal(b)communities and soil physical and chemical factors |
土壤理化因子对细菌和真菌群落结构的影响表现为土壤全氮、碱解氮、有效磷对细菌群落有极显著影响(P < 0.01)、pH有显著影响(P < 0.05),全氮、有效磷和pH对真菌群落有极显著影响(P < 0.01)。
2.4.3 环境因子对优势微生物的影响为进一步揭示优势物种与环境因子的关系,基于目水平的Heatmap图结果显示了土壤理化性质与前50个优势目的相关性。细菌方面(图 7a),Streptomycetales、AD3纲norank、Subgroup_13、PGL15门norank等对全氮、碱解氮、有效磷、速效钾表现出显著(P < 0.05)负相关的目均为杉木林土壤相对丰度高于其他两种林分;Pedosphaerales、Isosphaerales、Corynebacteriales、Gammaproteobacteria_Incertae_Sedis、Obscuribacterales、Acidobacteriales、Chthoniobacterales、Caulobacterales等对碱解氮、全氮和有效磷表现出显著正相关(P < 0.05),及Alphaproteobacteria纲unclassified等对pH表现出显著(P < 0.05)负相关的目均为阔叶林土壤相对丰度最高;而Acetobacterales、Solirubrobacterales、Sphingomonadales、Betaproteobacterial、Gaiellales、Frankiales等对速效钾表现出显著(P < 0.05)正相关的目,以及TK10纲norank、Rhizobiales等对pH表现出显著(P < 0.05)正相关的目在毛竹林中的相对丰度占比高于其他两种林分。
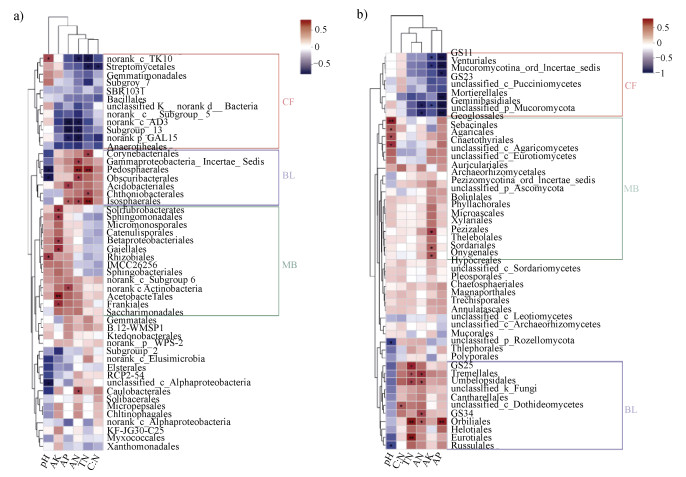
|
TN,全氮Total nitrogen;AN,碱解氮Alkaline hydrolysis nitrogen;AK,速效钾Available potassium;AP,有效磷Available phosphorus. 图 7 细菌(a)、真菌(b)优势菌与理化因子的关系热图 Fig. 7 Heatmap of the relationship between dominant bacteria and physical and chemical factors of bacteria(a)and fungi(b) |
真菌方面(图 7b),GS11、Venturiales、Mortierellales、Geminibasidiales、Mucoromycota门的未知目(unclassified)等对有效磷表现出极显著(P < 0.01)负相关、对速效钾和碱解氮表现出显著(P < 0.05)负相关的目均为杉木林相对丰度高于阔叶林和毛竹林;Eurotiales、Orbiliales、GS34、Umbelopsidales、Tremellales、GS25等对全氮和碱解氮表现出显著(P < 0.05)正相关,以及Thelephorales、Russulales等与pH表现出显著(P < 0.05)负相关的目在阔叶林中的相对丰度占比远高于其他两种林分;Pezizales、Sordariales、Onygenales等对速效钾表现出显著正相关和Geoglossales、Sebacinales、Agaricales、Chaetothyriales等对pH表现出显著正相关的目均为毛竹林相对丰度高于另外两种林分。
3 讨论 3.1 不同林分塑造微生物群落的差异基于高通量分析结果表明,三种林分土壤细菌和真菌群落表现出明显的差异,毛竹林和杉木林土壤微生物多样性和群落结构均与阔叶林存在显著差异。
从alpha多样性的分析结果来看,毛竹林土壤细菌的Shannon和Invsimpson指数最高、杉木林最低,而Berger-Parker指数则是杉木林高于其他两种林分(P < 0.05),Chao1指数均为毛竹林最高、阔叶林最低(P < 0.05);多样性指数结果说明,组成毛竹林土壤的细菌多样性和均匀度高,表明土壤细菌不仅种类多而且分布均匀。杉木土壤细菌群落则正好相反,表明长期种植杉木对土壤细菌具有选择作用,某些土壤微生物成为优势物种,抑制了另外一些物种的繁殖生长,导致土壤细菌的总体多样性下降。宋贤冲等[27]研究发现,近自然管理的天然次生林的土壤微生物多样性显着高于毛竹林和杉木人工林,而毛竹林高于杉木人工林。人工林连作导致土壤细菌丰富度和多样性降低同样发生在杨树林[28]。不同林分之间土壤真菌α多样性指数差异与对应的细菌指数一致,除Berger-Parker指数外,其他3个指数的平均值均为毛竹林最高,但毛竹林土壤数值的变异较大没有达到统计上显著水平。究其原因可能是土壤中真菌有聚集性分布的习性,因为大部分真菌属于异养型,依赖于土壤有机质的分布,而毛竹林土壤地下鞕根的腐烂分解可能引起土壤有机质的不均匀分布[29]。
从物种组成看,虽然三种林分土壤细菌主要的优势门类一致,但不同林分的优势门的相对比例则明显不同,阔叶、毛竹和杉木林第一优势门分别是酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和绿弯菌门(Chloroflexi);毛竹林与阔叶林门水平物种组成相似度高于杉木林与阔叶林的相似度,可推测相比杉木林,毛竹林具有良好的生态功能。毛竹林土壤的放线菌门(Actinobacteria)相对丰度显著高于其他,可能是因为土壤pH较高所致,放线菌相比其他细菌适合微碱性环境;杉木林土壤绿弯菌门(Chloroflexi)相对丰度显著高于其他,绿弯菌门相对丰度占比高可能是不良群落结构的特征,如人工杨树林[30]连作后绿弯菌门(Chloroflexi)相对丰度所占比例显著升高;绿弯菌门的菌群活动与连作土壤的营养代谢有较强的负相关性,使致病菌增多,不利于烤烟的生长发育[31],因此绿弯菌门相对丰度高可能导致杉木林退化。第二优势细菌门Proteobacteria相对丰度在3种林分之间差异较小(23%-25%),说明它的相对丰度受到环境影响较小,一方面可能是因为其物种丰富、食谱广泛(可利用碳源种类多)[32],另一方面是不同物种对环境变化响应呈多样性,不同物种对环境的反应可能是相互消长关系,例如毛竹林土壤Elsterales目相对丰度显著低于阔叶林和杉木林、而Rhizobiales目则正好相反。
不同林分土壤目水平的差异特征表明,阔叶林和杉木林目水平Subgroup_2(属于酸杆菌门)相对丰度占比高于毛竹,毛竹林Acidobacteriales(属于酸杆菌门)和Frankiales(属于放线菌门)以及Betaproteobacteriales(属于变形菌门)相对丰度占比高于其他林分,杉木林的特点是norank_c__AD3(属于绿弯菌门)相对丰度显著高、而Acidobacteriales目相对丰度显著低。阔叶林优势目对应自己优势门(酸杆菌门),毛竹的优势目(属于放线菌门)没有对应自己优势门(酸杆菌门),而杉木则表现为良好的一致性,尤其是绿弯菌门的norank_c__AD3相对丰度占比高达17%,进一步说明杉木林土壤中绿弯菌门的特殊性。以上数据表明,不同林分土壤目与门水平最优势物种并不存在完全一致关系,说明目水平物种的优势性并非异常突出。因此,在比较不同土壤微生物群落结构差异时,可根据不同目的选择分类水平。在杉木林土壤中相对丰度占比尤其高的绿弯菌门是什么原因所致,值得后续深入研究。目前对绿弯菌门的认识不深入,虽然相关研究可追溯到20世纪70年代,但对于森林生态系统中的行为特征和功能了解甚少[33]。
三种林分之间土壤真菌的相对丰度差异比细菌显著,尤其是杉木林土壤,无论是门水平和目水平的相对丰度组成与阔叶林和毛竹林差异明显。不同林分土壤真菌最优势门与目之间的一致性规律与细菌相似。阔叶林和毛竹林土壤的优势真菌门均为子囊菌门(Ascomycota),而毛竹林相对丰度最优势目则来自担子菌门(Basidiomycota)而非子囊菌门(Ascomycota)(图 4),杉木林的最优势目(属于Mortierellales)与其最优势门(被孢菌门)一致。研究报道,而Mortierellales目的Mortierella属是连作植物的主要有害属[34],可能是不利杉木林生长的主要原因之一。导致杉木林土壤细菌和真菌与众不同的物种组成原因,一方面与其土壤养分水平低有关,另一方面可能与其特殊的根系分泌物和凋落物有关[35]。
从群落整体结构来看,Kristin和Miranda[36]提出树种可以在周围土壤中形成与主体相适应的细菌和真菌群落。本研究结果也支持该假说,不同林分土壤细菌和真菌群落均存在明显差异。植被对土壤微生物显著影响的结论已经被许多研究所证实[37],有些研究者通过改变植被类型来揭示植物的不同反馈效应,如阔叶改种杉木后土壤的许多性质变差,表现为负反馈[38]。从土壤细菌和真菌门水平及目水平物种相对丰度最大的几个门和目的情况分析(图 1~图 4),杉木林土壤明显有别于毛竹林和阔叶,然而,基于物种目单元以及OTU的PCoA分析结果则发现,毛竹林土壤细菌和真菌群落特征与阔叶的差别大于杉木(图 5),说明杉木与阔叶林土壤的总体物种结构更加相似。对于生态系统而言,一般认为物种多样性高,其生态稳定性和生态功能强,但也有学者提出,生态系统中最优势的几个物种和数量是决定其生态稳定性和生态功能关键[39]。基于关键优势生物决定论的观点,本研究中毛竹的土壤生态功能与阔叶林土壤更加相近。
综上结果得出结论,同为人工纯林,毛竹林土壤的细菌和真菌的群落结构虽然与阔叶林的差别大于杉木,但其多样性显著高于杉木林、丰度最大的几个门和目的物种组成与阔叶林较相似,标志其良好生态功能。
3.2 不同林分土壤微生物对环境因子的响应土壤微生物多样性受到环境因子影响(表 2),细菌Shannon多样性指数和Invsimpson指数分别与全氮和pH极显著相差(P < 0.01),细菌Chao1丰富度指数与有效磷显著相关(P < 0.05),表明毛竹林土壤总体较高多样性和丰富度指数受到较高的土壤pH、全氮和有效磷影响,而杉木土壤养分水平是3种林分中最低则是导致其多样性最低的主要原因,该结果支持大尺度森林土壤细菌的分布格局,即高碳氮含量和近中性pH土壤细菌多样性最高[40]。从细菌的RDA和真菌的CCA结果可知,阔叶林土壤丰富的有机质以及氮水平形成了特殊的细菌群落,毛竹林土壤丰富的磷钾以及高pH与其群落形成密切相关,而杉木林土壤的特殊结构与其高pH和低有机质和养分水平有关。土壤全氮、碱解氮、有效磷对细菌的分布差异起决定作用,而对真菌群落分布起决定作用的是土壤全氮、有效磷和pH。
深入探究具体物种与土壤性质的关系发现(图 7),阔叶林土壤子囊菌门(Ascomycota)Eurotiales目细菌与全氮指标极显著正相关,与其他研究结果相似[41]。毛竹林微生物与所有理化因子均呈现出正向响应,子囊菌门(Ascomycota)Geoglossales目真菌与pH显著正相关(图 6),或与pH可以介导土壤中养分的有效性有关[42]。杉木林土壤优势微生物与大多数理化因子负相关,如绿弯菌门(Chloroflexi)的norank_c__AD3目细菌、被孢菌门(Mortierellomycota)的Mortierellales和子囊菌门(Ascomycota)的Venturiales目真菌与有效磷的负相关性极显著。在以往的研究中也发现杉木林土壤绿弯菌门细菌丰度与速效磷含量呈负相关关系[43]。不同植物对土壤理化特性的响应能力不同,Dorodnikov和Kuzyakov[44]认为这是由微生物群落的大小和群落组成的变化引起的。在以后的研究中可以结合根际过程和根际微生物菌群,探讨植物物种影响土壤养分循环的潜在重要性,为植物物种如何维持长期连作生长提供新的见解[45]。
4 结论毛竹林土壤细菌和真菌不仅种类多而且分布均匀,杉木林土壤微生物则总体多样性低、但某些特定物种占比高;毛竹林土壤细菌和真菌总OTU和特有OTU数量远高于杉木林和阔叶林,毛竹林与阔叶林土壤细菌和真菌在门分类水平分异小于杉木,但基于OTU的PCoA分析结果则显示毛竹林与阔叶林的差异最大。与杉木相比,毛竹林土壤细菌和真菌特征以及土壤理化性质与阔叶的相似度更高。
| [1] |
Yin L M, Dijkstra F A, Wang P, et al. Rhizosphere priming effects on soil carbon and nitrogen dynamics among tree species with and without intraspecific competition[J]. New Phytologist, 2018, 218(3): 1036-1048. DOI:10.1111/nph.15074
(  0) 0) |
| [2] |
Wen Y G, Ye D, Chen F, et al. The changes of understory plant diversity in continuous cropping system of Eucalyptus plantations, South China[J]. Journal of Forest Research, 2010, 15(4): 252-258. DOI:10.1007/s10310-010-0179-8
(  0) 0) |
| [3] |
Zhao J, Zheng Z L, Guo B, et al. Research progress in continuous cropping obstacle and productivity maintenance of poplar (In Chinese)[J]. World Forestry Research, 2020, 33(1): 14-19. [赵娟, 郑智礼, 郭斌, 等. 杨树连作障碍及生产力维持研究进展[J]. 世界林业研究, 2020, 33(1): 14-19.]
(  0) 0) |
| [4] |
Qin S H, Yeboah S, Cao L, et al. Breaking continuous potato cropping with legumes improves soil microbial communities, enzyme activities and tuber yield[J]. PLoS One, 2017, 12(5): e0175934. DOI:10.1371/journal.pone.0175934
(  0) 0) |
| [5] |
黄超杰. 兰州百合根系内生真菌生态学的研究[D]. 兰州: 兰州大学, 2010. Huang C J. Study on the ecology of endophytic fungi in the roots of Lilium davidii var. willmortiae[D]. Lanzhou: Lanzhou University, 2010. (  0) 0) |
| [6] |
Tan Y, Cui Y S, Li H Y, et al. Rhizospheric soil and root endogenous fungal diversity and composition in response to continuous Panax notoginseng cropping practices[J]. Microbiological Research, 2017, 194: 10-19. DOI:10.1016/j.micres.2016.09.009
(  0) 0) |
| [7] |
Guo X, Kong D Z, Huang B T, et al. Studies on the mechanism and control technology of continuous cropping obstacle (In Chinese)[J]. Crop Research, 2016, 30(2): 215-220. [郭肖, 孔德章, 黄本婷, 等. 农作物连作障碍产生机理与调控技术研究[J]. 作物研究, 2016, 30(2): 215-220.]
(  0) 0) |
| [8] |
Alvey S, Yang C H, Buerkert A, et al. Cereal/legume rotation effects on rhizosphere bacterial community structure in west African soils[J]. Biology and Fertility of Soils, 2003, 37(2): 73-82. DOI:10.1007/s00374-002-0573-2
(  0) 0) |
| [9] |
Garbeva P, van Veen J A, van Elsas J D. Microbial diversity in soil: Selection of microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243-270. DOI:10.1146/annurev.phyto.42.012604.135455
(  0) 0) |
| [10] |
Wang W B, Wang Y P, Wang H T, et al. Effects of different continuous cropping and rotation of poplar plantation on soil nitrogen bacteria community and nitrogen metabolism (In Chinese)[J]. Scientia Silvae Sinicae, 2016, 52(5): 45-54. [王文波, 王延平, 王华田, 等. 杨树人工林连作与轮作对土壤氮素细菌类群和氮素代谢的影响[J]. 林业科学, 2016, 52(5): 45-54.]
(  0) 0) |
| [11] |
Wang W B, Ma X S, Dong Y F, et al. Community characteristics and degradation metabolism regulation of soil phenolic acid degrading bacteria in poplar plantations under continuous cropping and crop rotation (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(5): 815-822. [王文波, 马雪松, 董玉峰, 等. 杨树人工林连作与轮作土壤酚酸降解细菌群落特征及酚酸降解代谢规律[J]. 应用与环境生物学报, 2016, 22(5): 815-822.]
(  0) 0) |
| [12] |
Yao X D, Li X G, Ding C F, et al. Microzone distribution characteristics of soil microbial community with peanut cropping system, monocropping or rotation (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 975-985. [姚小东, 李孝刚, 丁昌峰, 等. 连作和轮作模式下花生土壤微生物群落不同微域分布特征[J]. 土壤学报, 2019, 56(4): 975-985.]
(  0) 0) |
| [13] |
Xiong W, Zhao Q Y, Zhao J, et al. Different continuous cropping spans significantly affect microbial community membership and structure in a vanilla-grown soil as revealed by deep pyrosequencing[J]. Microbial Ecology, 2015, 70(1): 209-218. DOI:10.1007/s00248-014-0516-0
(  0) 0) |
| [14] |
Sun J, Zhang Q, Zhou J, et al. Illumina amplicon sequencing of 16S rRNA tag reveals bacterial community development in the rhizosphere of apple nurseries at a replant disease site and a new planting site[J]. PLoS One, 2014, 9(10): e111744. DOI:10.1371/journal.pone.0111744
(  0) 0) |
| [15] |
Chen M N, Li X, Yang Q L, et al. Soil eukaryotic microorganism succession as affected by continuous cropping of peanut-pathogenic and beneficial fungi were selected[J]. PLoS One, 2012, 7(7): e40659. DOI:10.1371/journal.pone.0040659
(  0) 0) |
| [16] |
Zhang R F, Shen Q R. Characterization of the microbial flora and management to induce the disease suppressive soil (In Chinese)[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 125-132. [张瑞福, 沈其荣. 抑病型土壤的微生物区系特征及调控[J]. 南京农业大学学报, 2012, 35(5): 125-132.]
(  0) 0) |
| [17] |
Carrión V J, Cordovez V, Tyc O, et al. Involvement of Burkholderiaceae and sulfurous volatiles in disease-suppressive soils[J]. The ISME Journal, 2018, 12(9): 2307-2321. DOI:10.1038/s41396-018-0186-x
(  0) 0) |
| [18] |
Yang J M, Fan P S, Wang Y T, et al. Effects of different pineapple varieties on soil properties and culturable microflora in continuous cropping banana orchard (In Chinese)[J]. Microbiology China, 2020, 47(8): 2471-2483. [杨劲明, 范平珊, 王禹童, 等. 不同菠萝品种种植对连作蕉园土壤理化性质和可培养微生物数量的影响[J]. 微生物学通报, 2020, 47(8): 2471-2483.]
(  0) 0) |
| [19] |
Zhao T X, Mao X W, Cheng M, et al. Effects of Phyllostachys edulis cultivation on soil bacterial and fungal community structure and diversity (In Chinese)[J]. Chinese Journal of Applied Ecology, 2017, 28(11): 3740-3750. [赵天心, 毛新伟, 程敏, 等. 毛竹种植对土壤细菌和真菌群落结构及多样性的影响[J]. 应用生态学报, 2017, 28(11): 3740-3750.]
(  0) 0) |
| [20] |
Yang X, Feng Y Q, Song P Y, et al. Correlation between soil microbes and plant diversity under the typical subtropical natural succession forest (In Chinese)[J]. Journal of Southwest University: Natural Science Edition, 2014, 36(9): 129-134. [杨宪, 冯玉琴, 宋鹏阳, 等. 亚热带典型自然演替林被下土壤微生物与植物多样性的关系[J]. 西南大学学报: 自然科学版, 2014, 36(9): 129-134.]
(  0) 0) |
| [21] |
Wang Q K, Wang S L, Yu X J, et al. Soil carbon mineralization potential and its effect on soil active organic carbon in evergreen broadleaved forest and Chinese fir plantation (In Chinese)[J]. Chinese Journal of Ecology, 2007, 26(12): 1918-1923. [王清奎, 汪思龙, 于小军, 等. 常绿阔叶林与杉木林的土壤碳矿化潜力及其对土壤活性有机碳的影响[J]. 生态学杂志, 2007, 26(12): 1918-1923.]
(  0) 0) |
| [22] |
曾晓敏. 亚热带典型森林植被类型下土壤磷素特征及其影响因素[D]. 福州: 福建师范大学, 2019. Zeng X M. Characteristics of soil phosphorus under typical vegetation types in subtropical forests and the affecting factors[D]. Fuzhou: Fujian Normal University, 2019. (  0) 0) |
| [23] |
Liu B R, Xu Q F, Qin H, et al. Bacterial community structure in soils under four main types of vegetation in subtropical area (In Chinese)[J]. Acta Pedologica Sinica, 2012, 49(6): 1185-1193. [刘卜榕, 徐秋芳, 秦华, 等. 亚热带四种主要植被类型土壤细菌群落结构分析[J]. 土壤学报, 2012, 49(6): 1185-1193.]
(  0) 0) |
| [24] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [25] |
Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8.
(  0) 0) |
| [26] |
Toju H, Tanabe A S, Yamamoto S, et al. High-coverage ITS primers for the DNA-based identification of ascomycetes and basidiomycetes in environmental samples[J]. PLoS One, 2012, 7(7): e40863.
(  0) 0) |
| [27] |
Song X C, Wang H L, Qin W D, et al. Effects of stand type of artificial forests on soil microbial functional diversity (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(3): 841-848. [宋贤冲, 王会利, 秦文弟, 等. 退化人工林不同恢复类型对土壤微生物群落功能多样性的影响[J]. 应用生态学报, 2019, 30(3): 841-848.]
(  0) 0) |
| [28] |
Han Y F, Yi W H, Wang W B, et al. Soil bacteria diversity in continuous cropping poplar plantation by high throughput sequencing (In Chinese)[J]. Journal of Shandong University: Natural Science, 2014, 49(5): 1-6. [韩亚飞, 伊文慧, 王文波, 等. 基于高通量测序技术的连作杨树人工林土壤细菌多样性研究[J]. 山东大学学报: 理学版, 2014, 49(5): 1-6.]
(  0) 0) |
| [29] |
Chen F L, Zhang K, Zheng H, et al. Analyzing the effect of mixed decomposition of conifer and broadleaf litters on soil microbial communities by using PCR-DGGE (In Chinese)[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(2): 145-151. [陈法霖, 张凯, 郑华, 等. PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J]. 应用与环境生物学报, 2011, 17(2): 145-151.]
(  0) 0) |
| [30] |
Zhang Y, Ma X S, Jing R Y, et al. Effects of successive-planting poplar plantation on soil microbial community (In Chinese)[J]. Journal of Shandong University: Natural Science, 2019, 54(1): 36-46. [张瑛, 马雪松, 敬如岩, 等. 基于宏基因组测序技术分析连作对杨树人工林土壤微生物群落的影响[J]. 山东大学学报: 理学版, 2019, 54(1): 36-46.]
(  0) 0) |
| [31] |
Gong Z X, Ma X H, Ren Z G, et al. Analysis of bacterial communities in rhizosphere soil of continuous cropping flue-cured tobacco using 16S rDNA-PCR-DGGE (In Chinese)[J]. Journal of Agricultural Science and Technology, 2018, 20(2): 39-47. [龚治翔, 马晓寒, 任志广, 等. 连作烤烟根际土壤细菌群落16S rDNA-PCR-DGGE分析[J]. 中国农业科技导报, 2018, 20(2): 39-47.]
(  0) 0) |
| [32] |
Philippot L, Raaijmakers J M, Lemanceau P, et al. Going back to the roots: The microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology, 2013, 11(11): 789-799.
(  0) 0) |
| [33] |
Xian W D, Zhang X T, Li W J. Research status and prospect on bacterial Phylum Chloroflexi (In Chinese)[J]. Acta Microbiologica Sinica, 2020, 60(9): 1801-1820. [鲜文东, 张潇橦, 李文均. 绿弯菌的研究现状及展望[J]. 微生物学报, 2020, 60(9): 1801-1820.]
(  0) 0) |
| [34] |
Zhu S Y, Wang Y Z, Xu X M, et al. Potential use of high-throughput sequencing of soil microbial communities for estimating the adverse effects of continuous cropping on ramie(Boehmeria nivea L. Gaud)[J]. PLoS One, 2018, 13(5): e0197095.
(  0) 0) |
| [35] |
Yu Y C, Yang J Y, Zeng S C, et al. Soil pH, organic matter, and nutrient content change with the continuous cropping of Cunninghamia lanceolata plantations in South China[J]. Journal of Soils and Sediments, 2017, 17(9): 2230-2238.
(  0) 0) |
| [36] |
Kristin A, Miranda H. The root microbiota-A fingerprint in the soil?[J]. Plant and Soil, 2013, 370(1/2): 671-686.
(  0) 0) |
| [37] |
巫文香. 人工纯林和混交林植物、土壤微生物多样性与生态系统多功能性[D]. 南宁: 广西大学, 2019. Wu W X. Plant diversity, soil microbial diversity and ecosystem multifunction in pure and mixed plantations[D]. Nanning: Guangxi University, 2019. (  0) 0) |
| [38] |
Feng J X, Gao W M, Deng F, et al. Effects of the conversion of natural evergreen broadleaved forest into Chinese fir(Cunninghamia lanceolata)plantation on soil microbial properties in subtropical China (In Chinese)[J]. Journal of Subtropical Resources and Environment, 2015, 10(2): 16-24. [冯建新, 高伟民, 邓飞, 等. 亚热带天然常绿阔叶林转变为杉木人工林对土壤微生物呼吸的影响[J]. 亚热带资源与环境学报, 2015, 10(2): 16-24.]
(  0) 0) |
| [39] |
Sasaki T, Lauenroth W K. Dominant species, rather than diversity, regulates temporal stability of plant communities[J]. Oecologia, 2011, 166(3): 761-768.
(  0) 0) |
| [40] |
Chu H Y, Feng M M, Liu X, et al. Soil microbial biogeography: Recent advances in China and research frontiers in the world (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 515-529. [褚海燕, 冯毛毛, 柳旭, 等. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529.]
(  0) 0) |
| [41] |
李木乡. 施肥处理对草甸草原土壤真菌多样性的影响[D]. 呼和浩特: 内蒙古大学, 2020. Li M X. Effects of fertilization on soil fungi diversity in meadow grassland[D]. Hohhot: Inner Mongolia University, 2020. (  0) 0) |
| [42] |
Zhalnina K, Dias R, Quadros P D, et al. Soil pH determines microbial diversity and composition in the park grass experiment[J]. Microbial Ecology, 2015, 69(2): 395-406.
(  0) 0) |
| [43] |
刘桂要. 黄土丘陵区油松人工林土壤微生物群落结构与多样性的研究[D]. 北京: 中国科学院大学(中国科学院教育部水土保持与生态环境研究中心), 2018. Liu G Y. The structure and diversity of soil microbial communities in planted forests of Chinese pine(Pinus tabulaeformis carr. )in the hilly regions of loess plateau[D]. Beijing: University of Chinese Academy of Sciences, 2018. (  0) 0) |
| [44] |
Dorodnikov M V, Kuzyakov Y V. Changes in the carbon and nitrogen isotopic composition of organic matter in soils of different thermal stability after free-air CO2 enrichment for three years[J]. Eurasian Soil Science, 2008, 41(2): 154-162.
(  0) 0) |
| [45] |
Henneron L, Kardol P, Wardle D A, et al. Rhizosphere control of soil nitrogen cycling: A key component of plant economic strategies[J]. New Phytologist, 2020, 228(4): 1269-1282.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


