2. 西华师范大学生态研究院,四川南充 637600
2. Institute of Ecology, China West Normal University, Nanchong, Sichuan 637600, China
地球上荒漠化土壤主要分布于热带、亚热带和温带干旱区,占陆地总面积约1.6×107 km2。荒漠土壤营养匮乏、盐碱化程度严重、植被覆盖率很低、气候变化多样、生物量和生物多样性较低,曾被认为不适于生命生存和活动[1]。然而,在此恶劣环境条件下,荒漠土壤却蕴含着丰富的微生物资源。土壤微生物是地下的主要生物成份,是土壤系统中最活跃的部分,在促进物质分解、养分转化、能量流动和生物地球化学循环方面发挥着重要作用[2-4],影响着植物生长发育和生态系统演变。在这些过程中,土壤微生物作为纽带联系着植物和土壤之间的相互作用[5]。研究发现,荒漠植被的适应性在很大程度上依赖于土壤微生物的响应[6-7]。土壤微生物控制着土壤生态系统的许多过程,对土壤生态系统功能的稳定和可持续具有重大意义[8]。
由于荒漠生态系统环境特殊,使得对荒漠土壤微生物的研究起步较晚,直到1948年在美国首次开展了对荒漠土壤结皮层微生物的研究[9]。随着测序技术的进步,对荒漠土壤微生物的研究越来越广泛,研究区域主要集中在中国西北部、美洲西海岸、非洲北部沿海以及南极地区,研究热点主要为微生物群落结构分布特征及其影响因素,众多研究表明,放线菌门、变形菌门、拟杆菌门、厚壁菌门是荒漠土壤中的主要细菌类群,且随着所处地理环境不同菌群丰度不同[10]。Navarro-Gonzalez对Atacama沙漠微生物多样性的研究发现水量差异对微生物丰度影响较大,Atacama沙漠土壤微生物数量随着从海洋移向内陆湿润的水汽减少而明显减少,到了极干旱的Yungay地区微生物数量基本为零[11]。土壤理化性质作为微生物生存环境左右其分布及生态功能,有机碳与可培养好氧细菌数量有明显关系,好氧菌数量随着有机碳含量增高而增高,而荒漠缺少植被和降水,固氮过程主要由固氮微生物完成,所以荒漠环境中固氮微生物数量明显较高,并且荒漠土壤pH会影响微生物的硝化和反硝化过程,从而改变固氮微生物数量[12]。荒漠土壤微生物分布直接取决于环境因子,因此在进行土壤微生物研究时,微生物与环境的相互作用已成为至关重要的一部分。
位于中国西北部的河西走廊是甘肃省主要的农业区,因地理位置和环境特殊,是西北乃至全国重要的生态屏障和经济地带[13]。如今由于水资源利用过度等因素,土壤荒漠化日趋严重,严重制约了人类的生存和发展。对荒漠地区微生物群落结构及多样性的研究,有利于揭示荒漠生态系统的功能,提高对环境与微生物之间相互作用的认识,为维持生态系统稳定性及保护物种多样性提供理论依据。本研究在河西走廊荒漠土壤区进行土壤样品采集,探究微生物的群落结构和多样性分布格局及群落结构与环境因子的相互关系,明确土壤环境对微生物存在的影响及微生物对土壤生态系统发展的作用,为保护生物多样性及荒漠生态环境提供理论参考。
1 材料与方法 1.1 研究区概况甘肃河西走廊(37°15′—41°30′N,92°21′—104°45′E)位于甘肃省西北部,东段起于乌鞘岭山脉,西段结束于古玉门关,总面积为27.6×104 km2。南北距离为40~100 km,东西距离约为1 120 km[14]。河西走廊气候受大陆性气候和青藏高原气候影响,气候条件夏季干燥冬季寒冷,年平均气温约为5~10℃,年降水量为30~320 mm,年蒸发量为1 500~3 200 mm,全年日照时数2 800~3 300 h[15],河西走廊的低降水量和高强度的蒸发量造成了中国乃至世界上的最大沙漠侵蚀区——西北荒漠带[16]。
1.2 试验设计与样品采集于2018年9月沿河西走廊东南至西北方向自然降水递减梯度下设置16个自然状态下,无人为干扰和土地利用的荒漠土壤样带(HX1~HX16),样带分布信息见图 1。每个样带内随机布设3个10 m×10 m样地(3个重复),相邻样地之间保持一定距离(不小于10 m),在所选取的每个样地内去除地表枯落物,剥离表土后用土壤取样器随机采集5~20 cm的土样3个,剔除植物根系和残体,保存于灭菌的密封袋中并储存于液氮罐带回实验室。用于分析微生物多样性的土壤放于–20℃冰箱保存;其他土壤根据测定指标的不同要求,对其养分含量、机械组成进行分析。
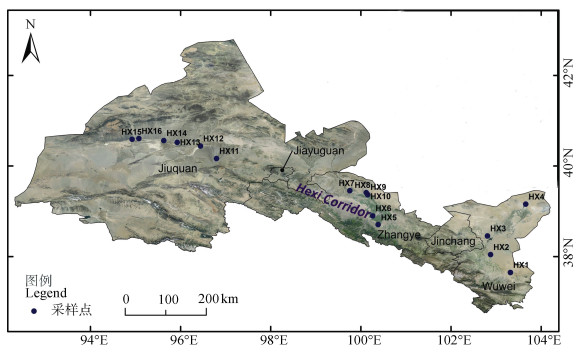
|
图 1 河西走廊荒漠调查路线和样带分布 Fig. 1 Desert survey route and transects distribution in Hexi Corridor |
土壤机械组成(指土壤粒径分级)采用英国Malver公司生产的Mastersizer 2000型激光粒度仪测定,土壤粒径主要分为石砾(Gravel) > 2 mm、砂粒(Sand,细分为五个等级:极粗砂粒,2~1 mm;粗砂粒,1~0.5 mm;中等砂粒,0.5~0.25 mm;细砂粒,0.25~0.10 mm;极细砂粒,0.10~0.05 mm)、粉粒(Silt,分两个等级:粗粉粒0.05~0.02 mm、细粉粒0.02~0.002 mm)和黏粒(Clay) < 0.002 mm。由于研究区石砾体积过大不宜用仪器进行测量,采用称重求比例的方法得到石砾含量。
土壤理化性质测定:有机碳(SOC)采用重铬酸钾氧化外加热法,碱解氮(AN)采用碱解扩散法,全氮(TN)采用凯氏定氮法,全磷(TP)采用NaOH熔融后钼锑抗比色法,有效磷(AP)采用0.5 mol·L–1NaHCO3浸提后钼锑抗比色法,全钾(TK)采用NaOH熔融后火焰光度法,速效钾(AK)用1 mol·L–1NH4OAc浸提后火焰光度法,土壤含水量(SW)采用烘干法,pH和电导率(EC)用上海精密科学仪器有限公司生产的PHS-3D型pH计测定[17]。
1.4 土壤总DNA的提取及16S rRNA基因的PCR扩增使用MoBio土壤微生物DNA强力提取试剂盒(PowerSoilⓇ DNA Isolation Kit,MO BIO Laboratories)对土壤总DNA进行提取,提取的细菌和真菌基因组进行16S rDNA V4+V5区和ITS1区PCR扩增(细菌引物为:F5'-GTGYCAGCMGCCGCGGTAA-3';R5'-CCGYCAATTYMTTTRAGTT-3';真菌引物为:F5'-CTTGGTCATTTAGAGGAAGTAA-3';R5'-GCTG CGTTCTTCATCGATGC-3'),扩增后的PCR产物用1.8%琼脂糖凝胶电泳纯化。PCR20 μL体系:模板DNA(10 ng),0.8 μL 5 μL一对引物,0.4 μL Pfu聚合酶,4 μL PCR Buffer,2 μL 2.5 mmol·L–1 dNTP,ddH2O补至总体系20 μL。PCR扩增程序:在95℃下预变性3 min,然后在95℃下循环30 s,在55℃退火30 s,72℃延伸1 min,然后再在72℃下延伸10 min。最后将纯化产物进行Illumina Hiseq 2500上机测序。
1.5 数据处理与分析16S rDNA通过软件FLASH进行PE reads拼接得到Raw Tags,然后通过质量过滤Raw Tags得到Clean Tags[18],使用USEARCH软件检查并丢弃了嵌合体序列得到Effective Tags[19]。在相似性97%的水平上,以0.005%作为阈值,使用软件QIIME进行OTU聚类[20]。
基于已分类的OTU使用Mothur进行细菌和真菌α-多样性(Ace指数、Chao1指数、Simpson指数、Shannon指数)分析[21],使用vegan包进行不同样带OTU丰度数据的主坐标分析(Principal coordinate analysis,PCoA),并用SPSS25.0进行单因素方差分析及Pearson相关性分析。利用R语言工具绘制门分类学水平下的群落结构图,使用Canoco 5.0软件将优势菌门与土壤机械组成和化学因子进行冗余分析(Redundancy Analysis,RDA),以说明土壤微生物群落结构、环境因子和样带之间的关系,并用蒙特卡罗检验(monte-carlo test)约束轴的显著性(用F值作为统计量)。
2 结果 2.1 河西走廊荒漠土壤微生物群落结构对测序所得的稀释曲线进行分析,结果表明测序覆盖度高,可用于后续分析。在Silva(细菌)和Unite(真菌)分类学数据库中对OTU进行分类学注释后,得到微生物群落结构组成(见图 2)。由统计结果可知,相对丰度大于1%的细菌群落有:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、广古菌门(Euryarchaeota)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)和蓝细菌门(Cyanobacteria)。数据分析结果可知,厚壁菌门、变形菌门、放线菌门和拟杆菌门为优势菌门(相对丰度 > 5%)。在“属”水平进行分析,HX5~HX10的6个样本中均发现较高含量的芽孢杆菌属(Bacillus)、乳球菌属(Lactococcus)和红球菌属(Rhodococcus),此外还发现了不动细胞菌属(Acinetobacter)、链霉菌属(Streptococcus)、丙酸杆菌属(Propionibacterium)、蓝细菌属(Halobacteriaceae)和酸微菌属(Cidobacterium),但分布不均匀,仅在部分样本中发现。从结构来看,表现为16个样本共有大多数相同的细菌群落,但不同样带优势菌门存在一定差异。
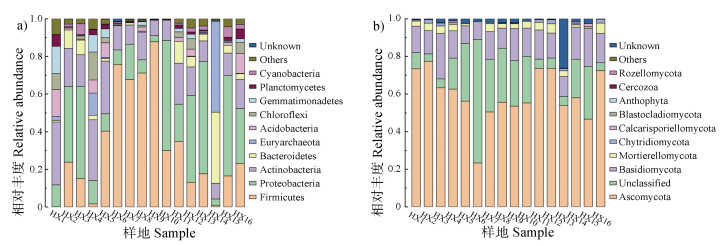
|
图 2 河西走廊荒漠土壤微生物门水平组成(a:细菌;b:真菌) Fig. 2 Horizontal composition of soil microbial phyla in the desert of Hexi Corridor(a: bacteria; b: fungi) |
河西走廊荒漠土壤相对丰度大于1%的真菌群落有:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)。数据分析结果表明:子囊菌门和担子菌门为优势菌门(相对丰度 > 5%)。荒漠土壤主要菌属为毛壳菌属(Chaetomium)、镰刀菌属(Fusarium)、链格孢属(Alternaria)和曲霉菌属(Asperyillus),在每个样本中均有分布但分布不均匀。并且在各样带都检测到未分类和未识别的真菌,尤其在HX6中未分类的真菌65.28%,在HX13中未识别的真菌占30.74%。
2.2 河西走廊荒漠土壤微生物群落α和β多样性特征使用高通量测序技术在16个样带得到不同数量的优质细菌和真菌序列,聚类分析表明,各样带土壤细菌和真菌群落丰富度和多样性存在差异。图 3细菌α-多样性指数显示:河西走廊HX4样带OTU数量、Chao1指数和Shannon指数最高,Simpson指数最低,说明HX4样带细菌群落丰富度和多样性最高,而HX9和HX10样带土壤OTU数量和Chao1指数最低,说明其群落丰富度最低,两地的Simpson指数和Shannon指数表明其群落多样性较低,且单因素方差分析结果显示不同样带细菌群落多样性差异显著(P < 0.05)。真菌α-多样性指数显示:HX5~HX10样带OTU数量和Chao1指数显著其他样带(P < 0.05),说明HX5~HX10样带真菌群落丰富度较低,HX8~HX10样带Simpson指数和Shannon指数表明其真菌群落多样性较低。
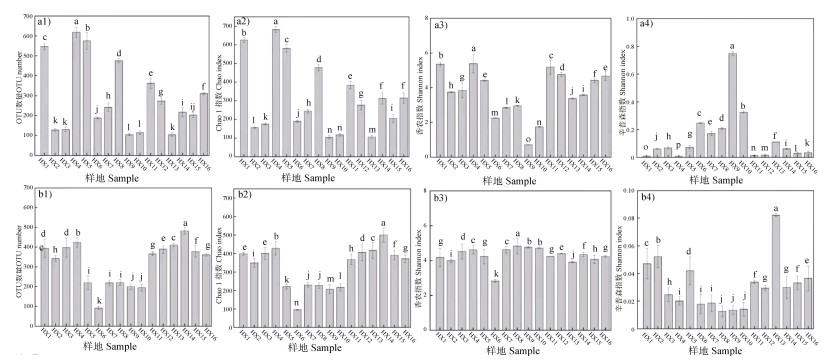
|
注:图中数值为3次重复的平均值±标准差,且不同字母表示不同样带间差异达5%显著水平。下同 Note: The values in the table are the average of three replicates ± standard deviation, and different letters indicate that the difference between different places reaches a significant level of 5%(Duncan's test). 图 3 河西走廊荒漠土壤微生物丰富度和多样性指数(a1、a2、a3、a4:细菌OTU数量、Chao1指数、Shannnon指数、Simpson指数;b1、b2、b3、b4:真菌OTU数量、Chao1指数、Shannnon指数、Simpson指数) Fig. 3 The soil microbial diversity and richness index of Hexi Corridor desert soil(a1, a2, a3, a4: number of bacteria OTU, Chao1 index, Shannnon index, Simpson index; b1, b2, b3, b4: number of fungus OTU, Chao1 index, Shannnon Index, Simpson index) |
在β多样性研究中,PCoA(Principal coordinate analysis)是基于Bray-Curtis的主坐标分析,可直观显示不同样带微生物群落结构相似性或差异性。由图 4a细菌群落PCoA结果可知:HX1和HX4样带群落结构相似,HX5~HX10样带群落结构相似,HX2、HX3、HX11、HX12、HX13、XH15、HX16样带群落结构相似,HX14样带与其他样带群落结构差异较大。图 4b真菌群落PCoA结果可知:HX5~HX10样带群落结构相似,HX14和HX15样带群落结构相似,其他样带群落结构相似。
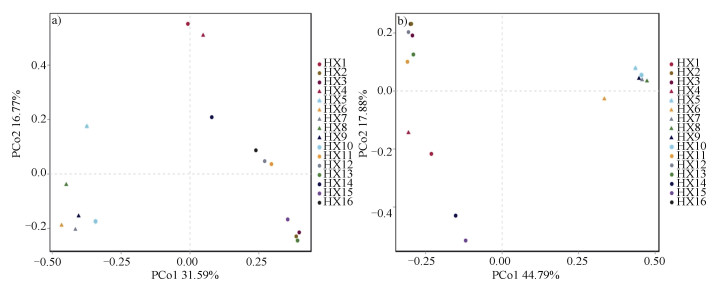
|
图 4 基于Bray-Curtis距离的河西走廊荒漠土壤细菌(a)和真菌(b)群落的主坐标分析(PCoA) Fig. 4 Principal coordinate analysis(PCoA)of the bacterial(a)and fungus(b)communities in the desert soil of the Hexi Corridor based on the Bray-Curtis distance |
荒漠土壤微生物多样性受环境影响显著,表 1可见,细菌OTU数量和Chao1指数与土壤速效钾呈极显著正相关(P < 0.01),与全钾呈显著正相关(P < 0.05),与土壤机械组成无相关性;Simpson指数与石砾、极细砂粒、全氮呈显著负相关(P < 0.05),与粗粉粒呈极显著负相关(P < 0.01),与细粉粒、黏粒、有效磷和解碱氮呈极显著正相关(P < 0.01);Shannon指数与石砾、极细砂粒、速效钾呈显著正相关(P < 0.05),与粗粉粒、有效磷和解碱氮呈极显著正相关(P < 0.01),与细粉粒和黏粒呈极显著负相关(P < 0.01)。真菌OTU数和Chao1指数与极细砂粒和粗粉粒呈显著正相关(P < 0.05),与石砾、土壤水分、有效磷和解碱氮呈极显著正相关(P < 0.01),与细粉粒和黏粒呈极显著负相关(P < 0.01);Simpson指数与解碱氮呈正相关(P < 0.05),与石砾呈显著正相关(P < 0.01),与有效磷、细粉粒和黏粒呈显著负相关(P < 0.01);Shannon指数与速效钾和极细砂粒呈正相关(P < 0.05),与粗粉粒和解碱氮呈极显著正相关(P < 0.01),与有效磷、细粉粒和黏粒呈极显著负相关(P < 0.01)。
|
|
表 1 河西走廊荒漠土壤微生物多样性与理化因子相关关系 Table 1 Correlation between soil microbial diversity and physical and chemical factors in the Hexi Corridor desert |
微生物群落结构受环境影响显著,RDA分析结果可以反映群落结构与环境因子之间的关系,从而可知影响微生物分布的重要环境驱动因子。河西走廊荒漠土壤微生物群落结构与机械组成的相关性见图 5。图 5a中,第1排序轴和第2排序轴累积解释了63.96%微生物变化,由表 2细菌群落与机械组成RDA分析结果表明:荒漠土壤细菌群落结构与细粉粒显著相关(F值为6.5,P < 0.05,蒙特卡罗算法)。从物种的分布来看,优势菌群厚壁菌门与黏粒正相关,与其余土壤粒径负相关;变形菌门和放线菌门与黏粒成负相关。图 5b中,第1排序轴和第2排序轴累积解释量为57.56%。真菌群落与机械组成RDA分析结果表明:真菌群落结构与黏粒显著相关(F值为5.2,P < 0.05,蒙特卡罗算法),优势菌群子囊菌门和担子菌门与黏粒负相关。
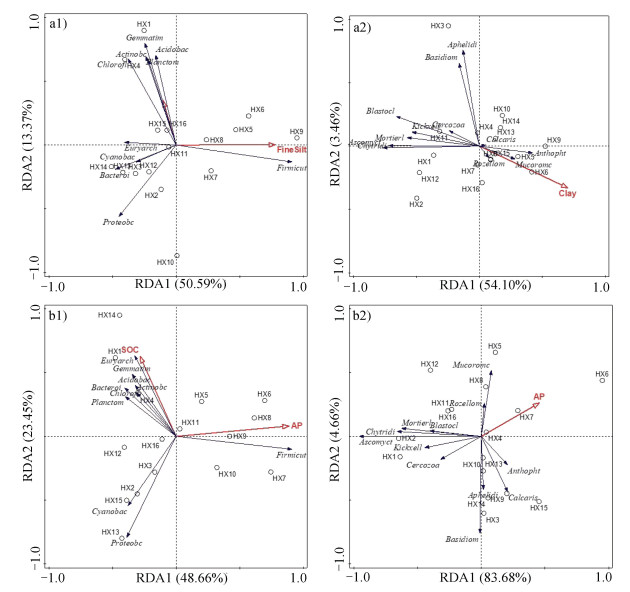
|
图 5 河西走廊荒漠土壤微生物群落与理化因子RDA分析(a1、a2:细菌、真菌与机械组成RDA;b1、b2:细菌、真菌与理化性质RDA) Fig. 5 RDA analysis of soil microbial communities and physical and chemical factors in the Hexi Corridor Desert(a1, a2: RDA of bacteria, fungi and mechanical composition; b1, b2: RDA of bacteria, fungi and physical and chemical properties) |
|
|
表 2 河西走廊荒漠土壤微生物群落与理化因子RDA分析结果 Table 2 RDA analysis results of microbial community and mechanical composition of desert soil in the Hexi Corridor |
土壤微生物群落结构与理化性质的相关性如图 6。图 6a中,第1排序轴和第2排序轴累积解释了72.11%微生物变化。表 6细菌群落与理化性质RDA分析结果表明:土壤细菌群落结构与有效磷和有机碳显著相关(F值为8.9、3.9,P < 0.05,蒙特卡罗算法),优势菌群厚壁菌门与有效磷正相关,其余菌门与有效磷均为负相关。在图 6b中,第1排序轴和第2排序轴累积解释量为88.34%。真菌群落与理化性质RDA分析结果表明:真菌群落与有效磷显著相关(F为5.7,P < 0.05,蒙特卡罗算法),优势菌群子囊菌门和担子菌门与有效磷负相关。
3 讨论土壤为微生物群落生长繁殖提供微环境,其理化性质又间接影响土壤微生物群落结构的组成[22]。本研究对河西走廊荒漠土壤理化性质进行测定分析,结果表明:河西走廊荒漠土壤盐碱化严重,土壤养分含量处于较低或极低水平,盐碱和营养匮乏的土壤环境可能对微生物群落组成产生一定影响。为探究微生物群落组成与土壤环境间的影响机制,本研究采用高通量测序技术检测了16个样带的土壤样品,结果显示,河西走廊荒漠土壤细菌群落以厚壁菌门、变形菌门、放线菌门和拟杆菌门为主,与前人对荒漠土壤细菌群落的研究结果相同[23]。荒漠地区持续的干旱和高强度的太阳辐射,促成了盐碱化严重、有机物含量少,植被缺乏的环境。而放线菌、厚壁菌等具备孢子生殖、多个UV修复机制、竞争优势的次级代谢合成能力[24],并且其部分菌属如:芽孢杆菌属和链霉菌属具有良好的嗜盐嗜碱特性,因此成为恶劣环境强有力的生存者,可以在此盐碱干旱环境中定殖。并且本研究发现河西走廊荒漠土壤中厚壁菌门丰度高达85%,An等[25]对塔克拉玛干沙漠微生物多样性的研究发现中国西部戈壁沙漠土壤厚壁菌门的相对丰度高达80%,得到相同研究结果。厚壁菌门自身的适应性除外,环境因素对其分布有很大程度的影响,一方面厚壁菌门丰度与土壤pH正相关,河西走廊荒漠土壤pH呈碱性或者强碱性,有利于厚壁菌门的生存;另一方面研究区有效磷含量高,厚壁菌门丰度与有效磷含量呈显著正相关,并且磷元素是组成细菌细胞壁的主要成分,厚壁菌细胞壁厚度达10~50 nm,较高含量的有效磷同样有利于厚壁菌门的生存。荒漠环境恶劣,高温、干旱和紫外辐射减弱了整个荒漠生态系统的碳、氮循环过程[10],在荒漠环境中,土壤氮循环主要以异化硝酸盐还原途径、反硝化途径和硝化途径为主,变形菌门、厚壁菌门、广古菌门、放线菌门、拟杆菌门参与其中,为氮循环的主要贡献者;CO2固定途径主要以C4-双羧酸循环、卡尔文循环、还原性三羧酸循环为主,变形菌门、拟杆菌门、绿弯菌门、厚壁菌门为CO2固定途径主要参与者[24]。固碳、固氮微生物的存在增强了荒漠环境的碳氮循环能力,加快荒漠区物质转化并且为植物生长提供更多的化学元素,从而提高荒漠土壤生态系统的稳定性[26]。
真菌良好的抗压性使其在荒漠土壤中广泛分布,孙蔷[27]对内蒙古和青海省荒漠土壤真菌群落结构和多样性的研究发现荒漠土壤真菌优势物种为子囊菌门和担子菌门,在大兴安岭林地、纳帕海高原湿地和内蒙古草原生态系统的研究均发现优势菌门为子囊菌门和担子菌门[28],说明子囊菌门和担子菌门能在多种类型土壤中且作为优势门存在,它们大多为腐生菌,能够分解动植物残体,释放生物可利用的营养元素,从而促进土壤养分循环,提高土壤质量,增强荒漠植物的定殖、生长发育。在Colorado高原分离出属于子囊菌门的链格孢属可以产生菌丝和色素应对干旱和辐射环境,在内蒙古荒漠草原和Negev荒漠分离出的真菌以曲霉菌属为主[29-30],这些可以释放土壤中的营养元素供植物吸收的菌属在本研究中同样存在。虽然荒漠中的真菌丰度不及细菌,但在荒漠土壤质量改善和促进植物生长方面起着重要的作用,并且在本研究中发现较多尚未分类和未识别的菌门,说明河西走廊土壤真菌群落信息还有很大的挖掘潜力。
土壤理化性质在很大程度上影响微生物群落结构和多样性特征,在全球气候急剧变化的影响下,敏感的荒漠生态系统势必会受到影响,微生物的群落结构和种群、功能多样性也会随着环境的变化而改变,所以明确土壤环境对微生物的影响机制极其紧迫。土壤不同的结构组成对微生物的分布有着极显著的影响,土壤粒径的空间分布决定孔隙的分布以及孔隙内空气和水分,从而影响微生物与环境之间的物质能量交换,进而决定了微生物的生存空间。本研究采用Pearson相关性分析和RDA分析得到细粉粒显著含量影响细菌群落组成,粗粉粒、细粉粒和黏粒含量显著影响细菌多样性,细粉粒和黏粒含量仅与厚壁菌门正相关,与其他菌门均负相关,粗粉粒与细菌多样性显著正相关,由此说明细菌在0.05~0.02 mm的土壤粒径中适宜生存。前人研究发现:影响细菌群落结构和多样性的理化因子多为pH、全氮和有机碳[31-32],因为有机碳是微生物主要营养物质,氮元素能抑制微生物生长活性。而Wang等[33]对新疆干旱区不同类型土壤细菌群落多样性的研究发现全盐、氯离子、硫酸根离子和硝酸根离子对微生物的分布影响显著,因为干旱区土壤类型为盐碱化土壤,盐离子是限制其微生物活性的主要因子,An等[25]对戈壁沙漠和塔克拉玛干沙漠表面石砾样品细菌多样性的研究发现C/N影响微生物分布,而在本研究中土壤有效磷对细菌群落结构和多样性的影响程度最显著。综上所述:不同的研究区因环境差异较大而对土壤微生物分布影响表现出不同的因素,因不同的研究区域降水、光照、温度等自然条件的差异,造就了特殊的土壤环境,从而产生了对土壤微生物影响显著的因素。本研究土壤有效磷对细菌群落影响显著一方面是因为荒漠土壤的pH较高且差异较小(8.51~9.40),无法对微生物的分布造成显著的影响,另一方面,根据土壤养分等级分级标准得本研究中土壤有效磷含量极高,可能因为较高含量的磷元素作用掩盖了其他元素的作用。
在荒漠土壤生态系统中,虽然真菌群落丰富度和多样性远不及细菌,但其生态功能对生态系统的稳定性亦不可或缺。为应对日益严重的环境问题,探明土壤环境对真菌群落的影响同样重要。曹良元[34]研究了土壤团聚体组成对微生物区系分布的影响,结果发现较大的团聚体中真菌的生物量较高,本研究Pearson相关性分析和RDA分析表明细粉粒和黏粒与真菌多样性呈极显著负相关,与优势真菌群落负相关说明真菌群落适合在较大土壤团聚体中生存。肖方南等[35]对塔里木河下游土壤真菌群落结构及多样性分析发现全氮、速效钾、铵态氮是影响土壤真菌群落结构的主要环境因子,因为氮和钾影响微生物的新陈代谢,从而影响土壤真菌的群落结构,孙倩等[28]对宁夏中部干旱带土壤真菌群落多样性及群落结构研究发现有效磷影响真菌群落结构和功能多样性,本研究中解碱氮和有效磷显著影响真菌群落结构和多样性,说明氮、磷元素对微生物的生存适应机制影响较大。
4 结论本研究采用高通量测序技术得到河西走廊荒漠土壤微生物群落结构和丰度特征,厚壁菌门、变形菌门、放线菌门、拟杆菌门、子囊菌门和担子菌门由于其自身抗逆特性适应荒漠恶劣环境,并且可以改善荒漠土壤质量,促进植物生长发育,提高荒漠生态系统稳定性,同时研究发现黏粒、细粉粒、AP和SOC显著影响微生物群落分布,并探明理化因子及与优势微生物相互关系。通过以上研究明确荒漠土壤微生物群落结构、多样性及影响因素,表明土壤环境对微生物存在的影响及微生物对土壤生态系统发展的作用,为保护生物多样性及荒漠生态服务提供理论参考。
| [1] |
D'Odorico P, Bhattachan A, Davis K F, et al. Global desertification: Drivers and feedbacks[J]. Advances in Water Resources, 2013, 51: 326-344. DOI:10.1016/j.advwatres.2012.01.013
(  0) 0) |
| [2] |
Bridge P, Spooner B. Soil fungi: Diversity and detection[J]. Plant and Soil, 2001, 232(1/2): 147-154. DOI:10.1023/A:1010346305799
(  0) 0) |
| [3] |
Dang Y, Sun D Z, Woodard T L, et al. Stimulation of the anaerobic digestion of the dry organic fraction of municipal solid waste(OFMSW)with carbon-based conductive materials[J]. Bioresource Technology, 2017, 238: 30-38. DOI:10.1016/j.biortech.2017.04.021
(  0) 0) |
| [4] |
Wang Y Y, Wang Z F, Huang R, et al. Characterization of soil microbial community structure as affected by vegetation in Jinyun Mountain (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(5): 1210-1220. [王蓥燕, 王子芳, 黄容, 等. 缙云山不同森林植被下土壤微生物群落结构特征研究[J]. 土壤学报, 2019, 56(5): 1210-1220.]
(  0) 0) |
| [5] |
Marschner P, Yang C H, Lieberei R, et al. Soil and plant specific effects on bacterial community composition in the rhizosphere[J]. Soil Biology & Biochemistry, 2001, 33(11): 1437-1445.
(  0) 0) |
| [6] |
Mengual C, Schoebitz M, Azcón R, et al. Microbial inoculants and organic amendment improves plant establishment and soil rehabilitation under semiarid conditions[J]. Journal of Environmental Management, 2014, 134: 1-7.
(  0) 0) |
| [7] |
Saetre P, Stark J M. Microbial dynamics and carbon and nitrogen cycling following re-wetting of soils beneath two semi-arid plant species[J]. Oecologia, 2005, 142(2): 247-260. DOI:10.1007/s00442-004-1718-9
(  0) 0) |
| [8] |
Griffiths B S, Kuan H L, Ritz K, et al. The relationship between microbial community structure and functional stability, tested experimentally in an upland pasture soil[J]. Microbial Ecology, 2004, 47(1): 104-113. DOI:10.1007/s00248-002-2043-7
(  0) 0) |
| [9] |
Fletcher J E, Martin W P. Some effects of algae and molds in the rain-crust of desert soils[J]. Ecology, 1948, 29(1): 95-100. DOI:10.2307/1930347
(  0) 0) |
| [10] |
Li T, Zhang W, Liu G X, et al. Advances in the study of microbial ecology in desert soil (In Chinese)[J]. Journal of Desert Research, 2018, 38(2): 329-338. [李婷, 张威, 刘光琇, 等. 荒漠土壤微生物群落结构特征研究进展[J]. 中国沙漠, 2018, 38(2): 329-338.]
(  0) 0) |
| [11] |
Navarro-Gonzalez R, Rainey F A, Molina P, et al. Mars-like soils in the Atacama desert, Chile, and the dry limit of microbial life[J]. Science, 2003, 302(5647): 1018-1021. DOI:10.1126/science.1089143
(  0) 0) |
| [12] |
Barton L, Gleeson D B, Maccarone L D, et al. Is liming soil a strategy for mitigating nitrous oxide emissions from semi-arid soils?[J]. Soil Biology & Biochemistry, 2013, 62: 28-35.
(  0) 0) |
| [13] |
Zhao L C, Zhao C Z, Wen J. Dynamic coupling and spatial pattern of urbanization and resource-environment carrying capacity in Hexi Corridor (In Chinese)[J]. Chinese Journal of Ecology, 2021, 40(1): 199-208. [赵连春, 赵成章, 文军. 河西走廊城镇化与资源环境承载力的动态耦合及空间格局[J]. 生态学杂志, 2021, 40(1): 199-208.]
(  0) 0) |
| [14] |
Yang L S, Feng Q, Adamowski J F, et al. Causality of climate, food production and conflict over the last two millennia in the Hexi Corridor, China[J]. Science of the Total Environment, 2020, 713: 136587. DOI:10.1016/j.scitotenv.2020.136587
(  0) 0) |
| [15] |
Nan L L, Guo Q E, Cao S Y. Archaeal community diversity in different types of saline-alkali soil in arid regions of Northwest China[J]. Journal of Bioscience and Bioengineering, 2020, 130(4): 382-389. DOI:10.1016/j.jbiosc.2020.06.001
(  0) 0) |
| [16] |
Zhang T R, Zhang Y F, Chai X M, et al. Impact of human activities on sandy desertification of northwestern China and countermeasures analysis (In Chinese)[J]. Journal of Desert Research, 2010, 30(2): 228-234. [张钛仁, 张玉峰, 柴秀梅, 等. 人类活动对我国西北地区沙质荒漠化影响与对策研究[J]. 中国沙漠, 2010, 30(2): 228-234.]
(  0) 0) |
| [17] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000: 14-24. [鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000: 14-24.]
(  0) 0) |
| [18] |
Caporaso J G, Lauber C L, Walters W A, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. The ISME Journal, 2012, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8
(  0) 0) |
| [19] |
Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381
(  0) 0) |
| [20] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
(  0) 0) |
| [21] |
Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: Open-source, platform-independent, community- supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541.
(  0) 0) |
| [22] |
Zhang H X, Zhang S Y, Zhang Y T, et al. Genetic 16S rRNA diversity of soil microbes in rhizosphere of Chinese yam and its influencing factors (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(5): 1235-1246. [张红霞, 张舒雅, 张玉涛, 等. 山药根际土壤微生物16S rRNA多样性及影响因素[J]. 土壤学报, 2019, 56(5): 1235-1246.]
(  0) 0) |
| [23] |
Niu S Q, Long Y, Li H Y, et al. Microbial diversity in saline alkali soil from Hexi Corridor analyzed by Illumina Mi Seq high-throughput sequencing system (In Chinese)[J]. Microbiology China, 2017, 44(9): 2067-2078. [牛世全, 龙洋, 李海云, 等. 应用IlluminaMiSeq高通量测序技术分析河西走廊地区盐碱土壤微生物多样性[J]. 微生物学通报, 2017, 44(9): 2067-2078.]
(  0) 0) |
| [24] |
任敏. 塔里木盆地微生物群落结构及其在碳氮元素循环中的作用[D]. 武汉: 华中农业大学, 2018. Ren M. Microbial communities in the Tarim Basin soil: Diversity and their roles in carbon and nitrogen cycle[D]. Wuhan: Huazhong Agricultural University, 2018. (  0) 0) |
| [25] |
An S, Couteau C, Luo F, et al. Bacterial diversity of surface sand samples from the Gobi and Taklamaken deserts[J]. Microbial Ecology, 2013, 66(4): 850-860.
(  0) 0) |
| [26] |
Warren-Rhodes K A, Rhodes K L, Pointing S B, et al. Hypolithic cyanobacteria, dry limit of photosynthesis, and microbial ecology in the hyperarid Atacama Desert[J]. Microbial Ecology, 2006, 52(3): 389-398.
(  0) 0) |
| [27] |
孙蔷. 荒漠植被土壤真菌群落结构与多样性研究[D]. 呼和浩特: 内蒙古大学, 2019. Sun Q. Research on the structure and diversity of soil fungi community in desert vegetation[D]. Hohhot: Inner Mongolia University, 2019. (  0) 0) |
| [28] |
Sun Q, Wu H L, Chen F, et al. Fungal community diversity and structure in rhizosphere soil of different crops in the arid zone of central Ningxia (In Chinese)[J]. Microbiology China, 2019, 46(11): 2963-2972. [孙倩, 吴宏亮, 陈阜, 等. 宁夏中部干旱带不同作物根际土壤真菌群落多样性及群落结构[J]. 微生物学通报, 2019, 46(11): 2963-2972.]
(  0) 0) |
| [29] |
Bates S T, Garcia-Pichel F. A culture-independent study of free-living fungi in biological soil crusts of the Colorado Plateau: Their diversity and relative contribution to microbial biomass[J]. Environmental Microbiology, 2009, 11(1): 56-67.
(  0) 0) |
| [30] |
Grishkan I, Nevo E. Spatiotemporal distribution of soil microfungi in the Makhtesh Ramon area, central Negev desert, Israel[J]. Fungal Ecology, 2010, 3(4): 326-337.
(  0) 0) |
| [31] |
Chu H Y, Neufeld J D, Walker V K, et al. The influence of vegetation type on the dominant soil bacteria, archaea, and fungi in a low arctic tundra landscape[J]. Soil Science Society of America Journal, 2011, 75(5): 1756-1765.
(  0) 0) |
| [32] |
Zhu T S, Shao T Y, Liu J Y, et al. Improvement of physico-chemical properties and microbiome in different salinity soils by incorporating Jerusalem artichoke residues[J]. Applied Soil Ecology, 2021, 158: 103791.
(  0) 0) |
| [33] |
Wang W Q, Li B B, Zhang J, et al. Diversity of bacterium communities in saline or alkaline soil in arid area (In Chinese)[J]. Arid Zone Research, 2019, 36(5): 1202-1211. [王巍琦, 李变变, 张军, 等. 干旱区不同类型盐碱土壤细菌群落多样性[J]. 干旱区研究, 2019, 36(5): 1202-1211.]
(  0) 0) |
| [34] |
曹良元. 土壤团聚体组成及耕作方式对微生物区系分布的影响[D]. 重庆: 西南大学, 2009. Cao L Y. Distribution of microbial community in soil aggregates and under different tillage patterns[D]. Chongqing: Southwest University, 2009. (  0) 0) |
| [35] |
Xiao F N, Jiang M, Li Y Y, et al. Community structure and diversity of soil fungi in Tamarix chinensis shrubs in the lower reaches of Tarim River (In Chinese)[J]. Arid Land Geography, 2021, 44(3): 759-768. [肖方南, 姜梦, 李媛媛, 等. 塔里木河下游柽柳灌丛土壤真菌群落结构及多样性分析[J]. 干旱区地理, 2021, 44(3): 759-768.]
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


