2. 中国科学院大学,北京 100049;
3. 中国科学院长沙农业环境观测研究站,长沙 410125;
4. 宁波大学植物病毒学研究所,浙江宁波 315211
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Changsha Research Station for Agricultural and Environmental Monitoring, Chinese Academy of Sciences, Changsha 410125, China;
4. Institute of Plant Virology, Ningbo University, Ningbo, Zhejiang 315211, China
全球稻田面积约1.65亿公顷[1],其中我国稻田总面积达三千多万公顷,占我国总耕地面积的27%[2]。稻田作为一种人工湿地生态系统,具有固碳的生态功能,是重要的碳汇,同时是温室气体甲烷(CH4)的重要排放源,贡献了全球人类活动CH4总排放量的11%[3],因此,水稻土在全球固碳减排中起到举足轻重的作用。水稻土碳循环是土壤物理、化学和生物过程及肥力的物质基础,是研究碳固定和温室气体减排的关键[4-5]。对水稻土碳循环过程和机理的研究有利于明确水稻土的碳汇功能和固碳潜力,推动全球碳循环的生物地球化学理论发展。
稻田的长期淹水造成嫌气或厌氧环境,导致土壤的物理、化学和生物性质以及固碳和碳循环相关过程与旱地迥异[6-8],这种情况下,碳循环过程如有机碳的矿化或氧化过程多与其他变价元素的氧化还原反应耦合。铁氧化物是典型红壤水稻土中含量较高的矿物质,铁也是参与氧化还原过程的重要变价金属元素。此外,铁氧化物在土壤中会与有机碳(如含羧基有机物)发生吸附或共沉淀作用[9-10],同时铁氧化物会通过影响胞外酶活性或芬顿反应影响有机碳的氧化和分解[11],且这些作用与铁的氧化还原状态和有效性相关[12-13]。因此,铁氧化物对水稻土碳循环或周转可能具有重要影响。土壤中铁氧化物形态多样,包括弱晶态的无定型铁矿如水铁矿、结晶程度较高的铁矿如针铁矿等[14]。铁氧化物晶型不同,比表面积不同,会导致铁的有效性、可氧化还原潜力以及对有机碳的吸附和共沉淀作用大小都不同,这可能会对土壤碳循环过程造成不同的影响。
厌氧条件下土壤有机碳的分解矿化过程中会因解聚和发酵作用产生有机酸等中间产物,其中包括乙酸,而乙酸是产CH4的重要底物,有研究认为乙酸途径贡献约80%的CH4,仅10%~30%的CH4来源于甲醇或氢气/二氧化碳(H2/CO2)等底物[15]。乙酸也是大多数厌氧微生物如铁还原菌、硫还原菌和产甲烷菌等的主要碳源[16-17]。因此,乙酸是厌氧水稻土碳循环过程中重要的有机碳形态,了解其在水稻土中的周转和去向及其影响因素对完善水稻土碳循环和固碳理论具有重要意义。然而,针对乙酸的研究多集中于CH4产生方面,鲜有关注其产生的CO2、形成的土壤碳库如可溶性有机碳(DOC)、微生物生物量碳(MBC)和土壤有机碳(SOC)以及引起的土壤本身有机碳矿化变化的激发效应。因此,本文以水稻土为研究对象,利用稳定同位素标记示踪技术,研究了水铁矿和针铁矿两种晶型不同的铁氧化物添加下,厌氧水稻土中乙酸矿化产生CO2和CH4的特征,和乙酸向土壤碳库转化的特点,及其对土壤本身有机碳矿化的影响,并结合土壤环境因子的变化,分析其中机理,以便为水稻土有机碳矿化和转化机制的研究和固碳减排工作做出贡献。
1 材料与方法 1.1 供试土壤供试土壤为麻砂泥,采集于湖南省株洲市攸县,该地区属中亚热带湿润季风气候,年平均气温17.8℃,无霜期292 d,年降水量1 410 mm左右。在采样地选取5个点,按S型路线采集耕作层(0~20 cm)土壤,充分混匀后剔除其中可见的动植物残体、石块等杂物,自然风干并过2 mm筛,储存于阴凉干燥的储藏室备用。土壤pH 6.66,有机碳32.8 g·kg–1,可溶性有机碳162.8 mg·kg–1,微生物生物量碳184.2 mg·kg–1,铵态氮124.9 mg·kg–1,全铁(Fe2O3)25.8 g·kg–1。
1.2 铁氧化物的制备水铁矿的制备:称取216.24 g的FeCl3•6H2O至聚乙烯烧杯中,加入2 L超纯水,溶解后静置,再迅速加入200 mL 1 mol·L–1 NaOH溶液,在剧烈均匀搅拌情况下用5 mol·L–1 NaOH溶液匀速滴加,调至pH7.0左右停止。静置悬浊液老化2~6 h,此时pH会略微下降,再次将pH调至7.0,静置后倒掉上清液,分装后离心20 min,弃上层清液后加超纯水搅拌均匀,然后重复离心,持续7次左右直至洗去多余的Cl–1和碱液。将沉淀冷冻干燥,即可得到水铁矿,过100目筛后(尼龙筛),密封常温储存[18]。
针铁矿的制备:称取13.52 g FeCl3•6H2O至聚乙烯烧杯中,加入50 mL超纯水,搅拌溶解。在剧烈搅拌情况下将90 mL 1mol·L–1 NaOH溶液快速加入到FeCl3溶液中,并迅速把混合溶液稀释到1 L;然后将稀释的溶液在70℃水浴中反应60 h,取出后冷却,倒掉上清液,得到黄褐色沉淀,再加入超纯水洗涤,如此重复直至pH为中性。将沉淀冷冻干燥,即可得到针铁矿,过100目筛后(尼龙筛),密封常温储存[18]。制得的水铁矿和针铁矿的比表面积分别为268和39 m2·g–1。
1.3 土壤培养试验采用室内模拟培养实验,设置添加乙酸、乙酸和水铁矿、乙酸和针铁矿以及无添加对照这四个处理,每个处理3个重复。乙酸是13C丰度为3 atom%的标记乙酸,以溶液形式用少量氢氧化钠调节土壤pH后混入土壤,添加的碳量为SOC的2%,约为MBC的2倍,即656 mg·kg–1,以此保证充足的标记碳供应且不引起土壤巨大变化。另设置一组相同处理添加未标记乙酸,作为自然丰度对照处理。水铁矿和针铁矿添加量为土壤全铁含量的5%[17]。具体操作如下:
风干土壤加水至淹水3 cm,于25℃黑暗条件下预培养10 d。预培养结束后,称取20 g(以干土计)土壤与称好的水铁矿或针铁矿粉末充分混合,加入500 mL玻璃瓶中,加入蒸馏水至淹水3 cm,同时混入乙酸溶液,加盖密封,用真空泵将瓶中的顶空气体抽出,再充入氮气,如此操作重复四次,使瓶中形成厌氧环境,置于25℃黑暗条件下培养100 d,设置3组重复。在培养1、2、4、6、8、10、13、16、20、25、30、35、40、45、50、55、65、75、85、100 d用30 mL气密型注射器进行气体采集,气体注入真空瓶中贮存。每次采气结束后,用氮气置换瓶中顶空气体。另设置9组重复,用于在6、40、100 d对土壤样品进行破坏性采集。
1.4 测定指标与方法气体的CO2和CH4浓度采用配备热传导式和火焰离子化检测器温室气体气相色谱仪(安捷伦7890A,美国)测定,CO2和CH4的13C丰度采用稳定性同位素质谱仪(赛默飞世尔MAT253,德国)测定。
土壤pH采用pH计(梅特勒-托利多FE20K,瑞士)测定。土壤MBC采用氯仿熏蒸培养法[19],熏蒸和不熏蒸土壤的浸提液有机碳含量采用有机碳自动分析仪(岛津Vwp,日本)测定。不熏蒸的土壤测定结果即为土壤DOC。土壤硝态氮(NO3–-N)和铵态氮(NH4+-N)含量用流动注射仪(福斯Fiastar 5000,瑞典)测定。土壤用盐酸浸提,采用邻菲罗啉-紫外分光光度法用紫外分光光度仪(岛津UV-2450,日本)测定Fe2+含量,用盐酸羟胺还原浸提液Fe3+,用相同方法测定得到浸提液全铁含量,Fe3+为全铁和Fe2+含量的差值[20]。β-葡糖苷酶(BG)和β-乙酰葡糖胺糖苷酶(NAG)活性采用96微孔酶标板荧光分析法测定[21],过氧化物酶(PER)活性采用紫外分光光度法测定[22]。
1.5 数据处理与统计分析本文所提到的CO2或CH4排放量均是以碳排放量计。
乙酸来源的CO2排放量计算公式为:
| $ 乙酸 - {\rm{C}}{{\rm{O}}_{2( + 乙酸)}} = {\rm{C}}{{\rm{O}}_{2( + 乙酸)}} \times \left( {{\rm{atom}}\% {\rm{C}}{{\rm{O}}_{2( + 乙酸)}} -\\ {\rm{atom}}\% {\rm{C}}{{\rm{O}}_{2(对照)}}}\; \right)/\left( {{\rm{atom}}\% {{\rm{C}}_{(乙酸)}} - {\rm{atom}}\% {{\rm{C}}_{(土壤)}}}\; \right) $ | (1) |
式中,乙酸-CO2(+乙酸)为添加了乙酸的处理(包括乙酸、乙酸+水铁矿、乙酸+针铁矿)中来源于乙酸的CO2排放量。CO2(+乙酸)为添加乙酸处理的CO2总排放量。atom%CO2(+乙酸)和atom%CO2(对照)分别为添加乙酸处理和对照处理的CO2的13C丰度。atom%C(乙酸)和atom%C(土壤)分别为添加的标记乙酸和土壤本身有机碳(SOC)的13C丰度。
SOC来源的CO2排放量为:
| $ {\rm{SOC}} - {\rm{C}}{{\rm{O}}_{2\left( { + 乙酸} \right)}} = {\rm{C}}{{\rm{O}}_{2\left( { + 乙酸} \right)}} - 乙酸 - {\rm{C}}{{\rm{O}}_{2\left( { + 乙酸} \right)}} $ | (2) |
乙酸和SOC来源的CH4排放量、MBC和DOC含量的计算同上。乙酸来源的SOC为乙酸添加量与乙酸来源CO2、CH4、MBC和DOC的差。
乙酸引起的CO2激发效应(PE)计算公式为:
| $ {\rm{PE = SOC}} - {\rm{C}}{{\rm{O}}_{2\left( { + 乙酸} \right)}} - {\rm{C}}{{\rm{O}}_{2\left( 对照 \right)}} $ | (3) |
式中,PE为激发效应。CO2(对照)是对照处理的CO2总排放量。CH4的激发效应计算同式(3)。
乙酸矿化率的计算为:
| $ {\rm{Min}} = \left( {乙酸 - {\rm{C}}{{\rm{O}}_{2\left( { + 乙酸} \right)}} + 乙酸 - {\rm{C}}{{\rm{H}}_{4\left( { + 乙酸} \right)}}} \right)/乙酸 - {{\rm{C}}^*}100\% $ | (4) |
式中,Min为乙酸矿化率,乙酸-C为乙酸碳的添加量。运用一级动力学模型拟合乙酸矿化率,公式如下:
| $ {\rm{Min}} = {\rm{b}} \times \left( {1 - {{\rm{e}}^{ - kt}}} \right) $ | (5) |
| $ {T_{1/2}} = \ln \left( 2 \right)/{\rm{k}} $ | (6) |
式中,b表示乙酸的易分解碳库大小,k为矿化速率常数,T1/2为碳库的半衰期。
所有数据用Microsoft Excel 2019初步整理,Origin 2018绘图分析。用SPSS 26检验数据的正态性,对各个时间点的乙酸和SOC来源的CO2和CH4累积排放量分别进行了单因素方差分析和Tukey多重比较,不同指标间的相关性用皮尔森相关关系进行检验。
2 结果 2.1 厌氧水稻土乙酸矿化的CO2和CH4排放特征及其对铁氧化物的响应不加乙酸的对照处理100 d的培养期间CO2累积排放量为474 mg·kg–1。乙酸添加增加了CO2累积排放量,乙酸处理的CO2总累积排放量为670 mg·kg–1。与乙酸处理相比,水铁矿的添加显著降低了CO2总累积排放量,针铁矿的影响不显著。乙酸+水铁矿和乙酸+针铁矿处理的CO2总累积排放量分别为639和661 mg·kg–1(图 1)。对照处理的CH4累积排放量为137 mg·kg–1,乙酸处理的CH4总累积排放量为455 mg·kg–1,水铁矿和针铁矿均显著降低了CH4排放量,乙酸+水铁矿和乙酸+针铁矿处理的CH4总累积排放量分别为432和430 mg·kg–1(图 1)。
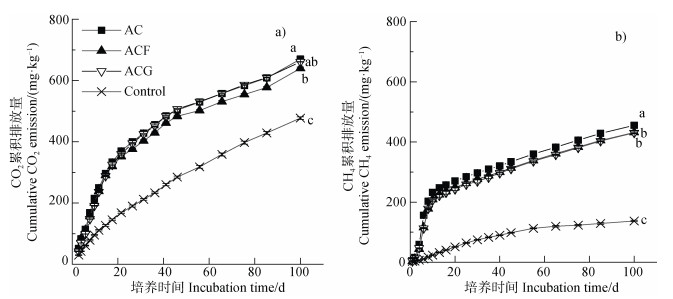
|
注:图中小写字母不同表示第100天不同处理间的显著差异(P < 0.05,n=3)。AC,乙酸;ACF,乙酸+水铁矿;ACG,乙酸+针铁矿;Control,对照。 Note: Lowercase letters in the figure represent significant differences between treatments on day 100(P < 0.05, n=3). AC, acetate; ACF, acetate+ferrihydrite; ACG, acetate+goethite. 图 1 不同处理的CO2和CH4累积排放量 Fig. 1 Cumulative CO2 and CH4 emissions of different treatments |
通过稳定同位素标记示踪技术,将CO2和CH4累积排放量来源进行区分,见图 2。培养初期,乙酸来源的CO2和CH4排放日速率较高,且在6 d时达到峰值,乙酸的CO2和CH4排放主要集中于前20 d左右,培养后期其CO2和CH4排放量较低。土壤本身有机碳(SOC)来源的CO2和CH4排放速率相对变化不大,只在前2 d排放速率较高,之后相对匀速。100 d培养结束后,SOC来源的CO2和CH4累积排放量高于乙酸来源的量(图 2)。在未添加乙酸的对照中,土壤产生CO2和CH4比例为3.46:1,加乙酸处理中SOC产生的CO2和CH4比例为1.83:1。
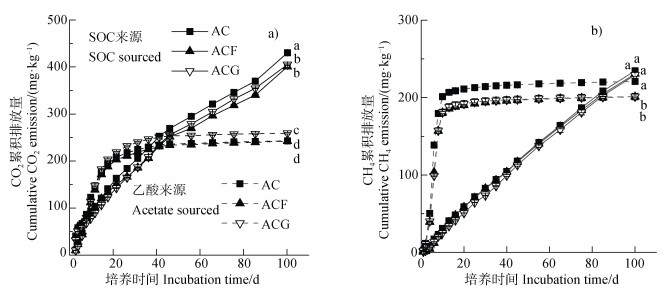
|
注:图中小写字母不同表示第100天不同处理间的显著差异(P < 0.05,n=3)。 Note: Lowercase letters in the figure represent significant differences between treatments on day 100(P < 0.05, n=3). 图 2 乙酸和土壤本身有机碳(SOC)来源的CO2和CH4累积排放量 Fig. 2 Cumulative CO2 and CH4 emissions derived from acetate and soil organic carbon(SOC) |
仅添加乙酸的处理中,100 d时乙酸来源的CO2累积排放量为240 mg·kg–1,针铁矿的添加显著增加了乙酸来源的CO2累积排放量至256 mg·kg–1,但水铁矿却无显著影响。SOC来源的CO2累积排放量为430 mg·kg–1,水铁矿和针铁矿均显著降低了SOC来源的CO2累积排放量(图 2),降低量分别为30和25 mg·kg–1。乙酸处理中乙酸来源的CH4累积排放量为220 mg·kg–1,水铁矿和针铁矿均显著降低了乙酸来源的CH4累积排放量,降低量分别为4和5 mg·kg–1。SOC来源的CH4累积排放量与乙酸来源的相近,且不受水铁矿和针铁矿影响(图 2)。
一级动力学模型拟合乙酸的矿化率(CO2+CH4,%)显示,乙酸的易分解碳库为69.92%,添加水铁矿显著降低了乙酸的易分解碳库大小,而添加针铁矿没有显著影响。乙酸分解速率为0.11%·d–1,半衰期为6.21 d,添加水铁矿和针铁矿显著降低了乙酸分解速率,且增加了其分解半衰期(表 1)。
|
|
表 1 乙酸的易分解碳库大小、分解速率和半衰期 Table 1 Labile C pool size, decomposition rate, and half-life of added acetate |
乙酸添加引起的CO2累积激发效应在培养前8 d是正激发效应,之后转变为负激发效应,且强度越来越大。乙酸+水铁矿处理的CO2激发效应前8 d也处于正激发阶段,且数值与乙酸处理类似,之后进入负激发阶段数值显著小于乙酸处理,即其负激发效应强度大于乙酸处理。乙酸+针铁矿处理在培养初期的CO2正激发效应小于乙酸处理,进入负激发效应阶段,其负激发效应强度大于乙酸处理(图 3)。三个处理的CH4累积激发效应除前1~4 d外均为正激发效应,培养100 d后三个处理的CH4累积激发效应均达到90 mg·kg–1以上,且没有显著差异(图 3)。
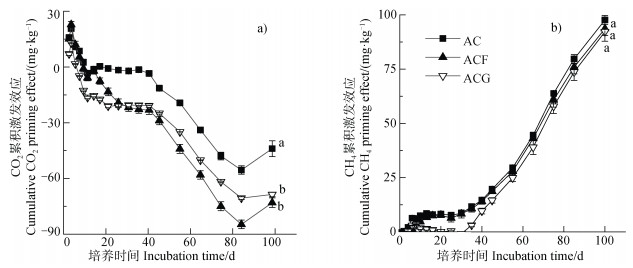
|
注:图中小写字母不同表示第100天不同处理间的显著差异(P < 0.05,n=3)。 Note: Lowercase letters in the figure represent significant differences between treatments on day 100(P < 0.05, n=3). 图 3 不同处理中乙酸引起的CO2和CH4累积激发效应 Fig. 3 Cumulative CO2 and CH4 priming effect of acetate in different treatments |
100 d培养结束后,乙酸处理中36%和33%的乙酸分别矿化为CO2和CH4,余下乙酸转化为土壤碳库,其中0.12%形成了DOC,1.99%形成了MBC,27.63%形成了SOC。水铁矿和针铁矿添加显著降低了乙酸矿化为CH4的比例,显著增加了转化为MBC和SOC的比例。针铁矿的添加还显著增加了CO2所占比例。水铁矿和针铁矿分别增加和降低了乙酸转化为DOC的比例,然而统计上差异不显著。乙酸+针铁矿处理的乙酸转化为DOC、MBC和SOC的比例均小于乙酸+水铁矿处理(图 4)。
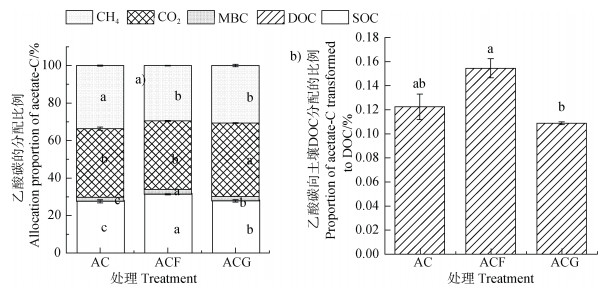
|
注:图中小写字母不同表示同一指标不同处理间的显著差异(P < 0.05,n=3)。 Note: Lowercase letters in the figure represent significant differences between treatments(P < 0.05, n=3). 图 4 培养100 d后乙酸碳矿化或转化为CO2、CH4、MBC、DOC和SOC的比例 Fig. 4 The percentages of acetate being mineralized or transformed to CO2, CH4, MBC, DOC and SOC at the end of the 100-day incubation |
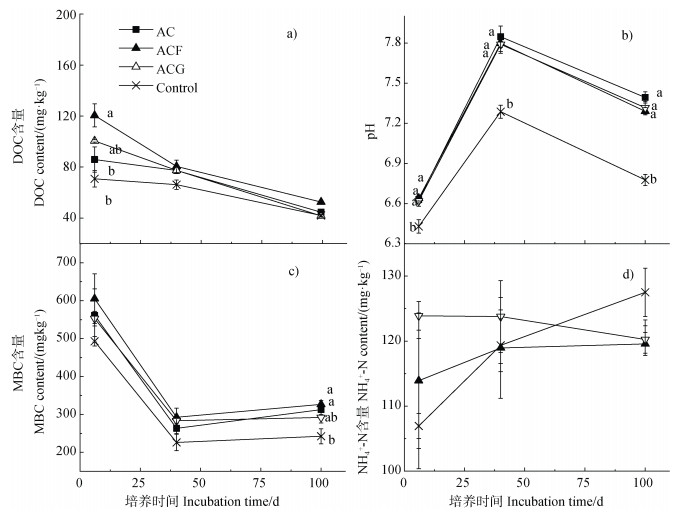
乙酸添加初期会提高土壤DOC含量,培养6 d时,三个乙酸添加处理显示出较对照处理偏高的土壤DOC含量,只是乙酸和乙酸+针铁矿与对照处理的差异统计上不显著。四个处理的土壤DOC含量随时间逐渐降低,且四个处理间的显著差异逐渐消失。三个加乙酸处理的土壤pH没有显著差异,但均显著高于对照处理。三个加乙酸处理的土壤MBC含量较对照处理偏高,但是第6天和第40天的数据统计上差异不显著。培养期间土壤NH4+含量在四个处理间无显著差异(图 5)。
|
注:图中小写字母不同表示同一时间不同处理间的显著差异(P < 0.05,n=3),未标注即表示无显著差异。 Note: Lowercase letters in the figure represent significant differences between treatments(P < 0.05, n=3). Unlabeled means there are no significant differences. 图 5 培养6、40、100 d不同处理土壤DOC、MBC、NH4+-N含量和pH Fig. 5 Soil DOC, MBC, NH4+-N contents and pH of different treatments on days 6, 40 and 100 |
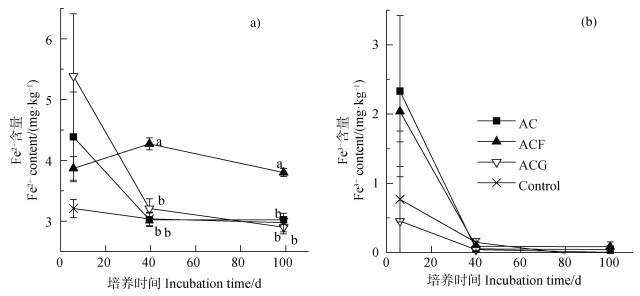
土壤经淹水(非厌氧)预培养10 d后土壤Fe2+含量为3.06 mg·kg–1,厌氧培养6 d时三个加乙酸处理和对照处理的土壤Fe2+含量均高于这一初始值,但差异不显著,三个加乙酸处理的土壤Fe2+含量均高于对照。乙酸和乙酸+针铁矿处理的土壤Fe2+含量随时间逐渐降低,乙酸+水铁矿处理的土壤Fe2+含量变化不大,且在40 d和100 d高于其他处理。培养期间各处理土壤Fe3+含量极低(接近于0),只是6 d时数据偏高,这可能是实验操作问题导致误差较大(图 6)。
|
注:图中小写字母不同表示同一时间不同处理间的显著差异(P < 0.05,n=3),未标注即表示无显著差异。 Note: Lowercase letters in the figure represent significant differences between treatments(P < 0.05, n=3). Unlabeled means there are no significant differences. 图 6 6培养6、40、100 d不同处理土壤Fe2+和Fe3+含量 Fig. 6 Soil Fe2+ and Fe3+contents of different treatments on days 6, 40 and 100 |
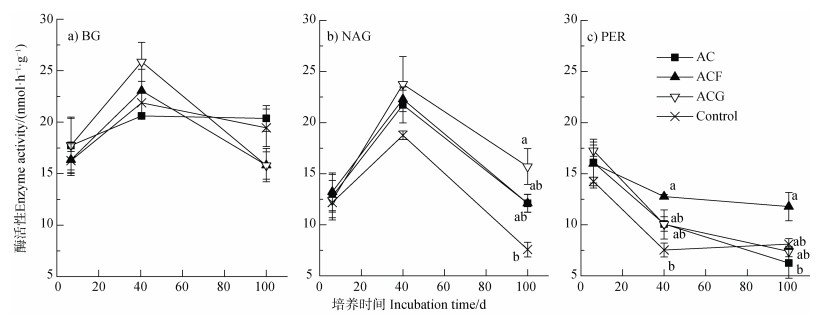
培养期间各处理土壤BG和NAG活性呈现先升高后下降的趋势,土壤PER活性呈现逐渐降低的趋势(图 7)。土壤BG活性在各处理间无显著差异。四个处理间土壤NAG活性的差异也不大,只是100 d时土壤NAG活性表现为乙酸+针铁矿≥乙酸+水铁矿=乙酸≥对照。土壤PER活性在6 d时各处理间无显著差异,在40 d表现为乙酸+水铁矿≥乙酸+针铁矿=乙酸≥对照,100 d为乙酸+水铁矿≥对照=乙酸+针铁矿≥乙酸。总之,与乙酸处理相比,加水铁矿的土壤PER活性偏高,加针铁矿的土壤NAG活性偏高。
|
注:图中小写字母不同表示同一时间不同处理间的显著差异(P < 0.05,n=3),未标注即表示无显著差异。 Note: Lowercase letters in the figure represent significant differences between treatments(P < 0.05, n=3). Unlabeled means there are no significant differences. 图 7 培养6、40、100 d土壤β-葡糖苷酶(BG)、β-乙酰葡糖胺糖苷酶(NAG)和过氧化物酶(PER)活性 Fig. 7 Soil β-1, 4-glucosidase(BG), β-1, 4-N-acetylglucosaminidase(NAG)and peroxidase(PER)activities on days 6, 40 and 100 |
将乙酸来源的CO2和CH4的累积排放量、土壤DOC、MBC、SOC含量与各土壤性质指标进行相关关系分析,发现土壤DOC、MBC、Fe2+、Fe3+含量、pH和PER活性与乙酸来源CO2、CH4、DOC、MBC、SOC含量均呈显著相关关系。乙酸来源CO2和CH4与土壤NAG活性呈显著正相关关系(表 2)。
|
|
表 2 乙酸来源的CO2、CH4累积排放量、DOC、MBC、SOC含量与土壤理化和酶学指标的相关性 Table 2 Pearson correlation analysis between acetate derived cumulative CO2 and CH4 emissions, DOC, MBC and SOC contents and soil physicochemical and enzymatic properties |
水稻土的淹水管理方式会造成嫌气或厌氧的环境,这种情况下土壤有机碳的分解不彻底,会产生乙酸等中间产物,而乙酸是产甲烷的重要底物。CH4产生包括乙酸营养型、甲基营养型、氢营养型三种途径,分别以乙酸、甲醇/甲胺、H2/CO2为底物[23]。乙酸通常可以贡献80%CH4产生量[15],其他底物可以贡献10%~30%[23-24]。本研究仅添加乙酸的处理中,经过100 d的厌氧培养,33%的乙酸转化为CH4,而36%的乙酸转化为CO2(图 4)。乙酸营养型的产甲烷公式为CH3COOH → CO2 + CH4,即产生的CO2和CH4比例为1:1,说明本研究3%的乙酸矿化出的CO2不是因产甲烷过程。研究显示乙酸也是大多数厌氧微生物如铁还原菌、硫还原菌等的主要碳源,造成了其他途径如铁还原、硫还原产生的CO2[16-17]。Xu等[25]以每天添加乙酸的方式连续添加10 d,乙酸的总添加量为1 512 mg·kg–1,10 d厌氧培养后乙酸的矿化率(CO2+CH4)不到20%,而本研究仅添加了一次乙酸,添加量较Xu等[25]低,为656 mg·kg–1,
但10 d时的矿化率较Xu等[25]高,为52%,说明乙酸进入土壤的频次和单次添加量会影响其矿化率,也可能是土壤中微生物群落结构和活性有所不同,造成对乙酸利用上的差异,影响乙酸矿化率。矿化后余下的乙酸则转化为土壤活性碳库如DOC和MBC(本研究中这部分只占2%左右),或转化为稳定碳库(本文中的SOC,不到30%)。Xu等[25]研究中乙酸矿化率偏低,更多地保留在土壤稳定碳库中。乙酸转化的SOC可能一部分是由于加入的乙酸直接与土壤矿物稳定结合从而作为SOC保留下来,而更大部分可能是乙酸经过微生物利用和转化作用产生的代谢产物或死亡残体再经过多次微生物周转而形成的。当然,在这多次微生物利用和周转过程中,也形成了某些易分解且易溶解的DOC,一些乙酸或其次级代谢产物被同化在活性碳库MBC中。
SOC来源的CO2和CH4比例为1.83:1,高于乙酸来源的比例,说明土壤中不同碳源在厌氧条件下的微生物利用和分解矿化情况不同。土壤中的乙酸主要是被产甲烷菌利用,用于产甲烷,其他有机碳多被其他微生物群落利用和分解,产生更多的CO2,因此,本研究中SOC来源的CO2远高于SOC来源的CH4,亦高于乙酸来源的CO2(图 2)。SOC产生的CH4也不仅限于乙酸营养型,还包括上述其
他途径。乙酸添加刺激了产甲烷菌的活性,导致产甲烷菌对SOC的利用增加。有研究显示,乙酸添加会增加甲烷八叠球菌属(Methanosarcina)的丰度[25],甲烷八叠球菌属的产甲烷代谢途径包括乙酸和氢营养途径,氢营养途径会对CO2有所消耗[26],因此乙酸添加不仅导致CH4的正激发效应,还引起了CO2的负激发效应(图 3),在未添加乙酸的对照中,土壤产生CO2和CH4比例为3.46:1,远高于加乙酸处理中SOC产生的1.83:1,也佐证了这一点。此外,乙酸作为简单有机碳化合物,其他厌氧微生物对其的偏好利用也是导致土壤微生物对SOC利用的减少从而引起CO2负激发效应的原因之一。
3.2 不同铁氧化物对厌氧水稻土乙酸的矿化和转化的影响铁是重要的电子受体,会与CH4产生过程竞争电子供体,如乙酸和H2[16-17, 27],异养铁还原菌对乙酸的竞争力会因铁氧化物的添加而提高,从而降低产甲烷菌对乙酸的利用以及乙酸来源CH4排放量(图 2)。已有报道发现,水铁矿添加会导致如甲烷杆菌属(Methanobacterium)、甲烷胞菌属(Methanocella)和甲烷八叠球菌属(Methanosarcina)等产甲烷细菌和产甲烷古菌有所减少[26, 28]。此外,还有报道发现某些产甲烷菌可以通过氧化H2还原铁氧化物[29-30],因而降低产CH4量。本研究中铁氧化物的添加只影响了乙酸来源的CH4产量,未影响SOC来源的CH4产量和乙酸的CH4激发效应(图 2,图 3)。水铁矿和针铁矿结晶程度和比表面积等有很大差异,但是本研究中两者对乙酸的CH4累积排放量的影响程度一致,而对乙酸的CO2累积排放量的影响不同(图 2)。
针铁矿的添加增加了乙酸来源CO2累积排放量(图 2),铁还原为微生物呼吸和CO2产生过程提供电子供体,铁氧化物的添加会刺激铁还原菌的生长和活性,从而提高对乙酸的利用[17, 27, 31],而微生物对乙酸的偏好利用加剧了乙酸引起的负激发效应(图 3)。与针铁矿不同,水铁矿对乙酸来源CO2排放量的影响不显著。这可能由于水铁矿晶型较弱,比表面积大,对乙酸及其某些次级代谢产物的吸附和共沉淀作用强,起到限制乙酸矿化和CO2排放,而这一负作用与刺激铁还原菌等正作用相抵消,呈现出不显著的影响。而且,相较于针铁矿增加了乙酸向MBC和SOC转化的比例。Xu等[25]的厌氧研究发现,添加水铁矿降低了土壤孔隙水中的乙酸,也认为这主要因为水铁矿刺激了微生物对乙酸的同化利用。Jones和Edwards[32]添加14C-葡萄糖的有氧实验也发现加水铁矿增加了葡萄糖向MBC的转化。
各处理土壤DOC含量在培养初期虽有差异,但是培养期间差距逐渐缩小至无显著差异,这期间土壤通过微生物矿化和土壤矿物吸附等过程对土壤DOC含量进行调节至较平衡状态,这可能与土壤pH、CEC等条件有关,最终加水铁矿和针铁矿的处理乙酸来源DOC含量只分别较乙酸处理略高和略低。表 2中显示土壤NAG和PER活性等与乙酸来源CO2、CH4、DOC、MBC、SOC含量的显著相关关系,然而,土壤NH4+含量和BG活性与乙酸的矿化和转化无相关关系。刘琪等[33]也发现长期淹水土壤NAG和PER活性与土壤有机碳矿化具有显著相关关系,而BG活性则无关。说明NAG和PER两种酶在嫌气和厌氧条件下有机碳矿化和转化中的重要作用。本研究中使用紫外分光光度法测定的过氧化物酶活性实际上也包含了非生物氧化活动,水铁矿的添加增加了PER活性,这可能与芬顿反应有关[34-35]。图 5b显示三个加乙酸的处理pH偏高,可能与铁还原等过程有关,这会增加CO2在土壤溶液中的溶解度,且可能形成FeCO3,使检测到的顶空气体中的CO2浓度被低估[17, 25]。
4 结论铁氧化物显著影响了水稻土中乙酸的矿化、转化和激发效应,且结晶程度不同的铁氧化物的影响有差异。针铁矿的添加显著增加了乙酸的CO2排放量,水铁矿对此却无显著影响。水铁矿和针铁矿均显著降低了乙酸的CH4排放量,增加了乙酸转化为MBC和SOC的比例。乙酸添加引起了CO2负累积激发效应和CH4正累积激发效应。水铁矿和针铁矿均显著降低了SOC的CO2累积排放量,加剧了乙酸引起的CO2负激发效应,而对SOC的CH4累积排放量无显著影响。
致谢 感谢中国科学院亚热带农业生态研究所公共技术服务中心对本研究提供的技术支持。
| [1] |
Atere C T, Ge T D, Zhu Z K, et al. Assimilate allocation by rice and carbon stabilisation in soil: Effect of water management and phosphorus fertilisation[J]. Plant and Soil, 2019, 445(1/2): 153-167.
(  0) 0) |
| [2] |
The National Bureau of Statistics. China statistical yearbook (In Chinese). Beijing: China Statistics Press, 2019. [国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2019.]
(  0) 0) |
| [3] |
IPCC. Working group Ⅰ contribution to the fifth assessment report of the Intergovernmental Panel on Climate Change[C]//Stocker T F, Qin D, Plattner G K, et al. Climate change 2013: The physical science basis. Cambridge, New York: Cambridge University Press, 2013: 1535.
(  0) 0) |
| [4] |
Cheng W G, Yagi K, Xu H, et al. Influence of elevated concentrations of atmospheric CO2 on CH4 and CO2 entrapped in rice-paddy soil[J]. Chemical Geology, 2005, 218(1/2): 15-24.
(  0) 0) |
| [5] |
Johnston S G, Burton E D, Aaso T, et al. Sulfur, iron and carbon cycling following hydrological restoration of acidic freshwater wetlands[J]. Chemical Geology, 2014, 371: 9-26. DOI:10.1016/j.chemgeo.2014.02.001
(  0) 0) |
| [6] |
Huang S, Rui W Y, Peng X X, et al. Responses of soil organic carbon content and fractions to land-use conversion from paddy field to upland (In Chinese)[J]. Environmental Science, 2009, 30(4): 1146-1151. DOI:10.3321/j.issn:0250-3301.2009.04.035 [黄山, 芮雯奕, 彭现宪, 等. 稻田转变为旱地下土壤有机碳含量及其组分的变化特征[J]. 环境科学, 2009, 30(4): 1146-1151.]
(  0) 0) |
| [7] |
Jiang J B, Zhu Z K, Lin S, et al. Mineralization of goethite-adsorbed and -encapsulated organic carbon and its priming effect in paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(6): 1530-1539. [江家彬, 祝贞科, 林森, 等. 针铁矿吸附态和包裹态有机碳在稻田土壤中的矿化及其激发效应[J]. 土壤学报, 2021, 58(6): 1530-1539.]
(  0) 0) |
| [8] |
Li W J, Huang Q H, Li D M, et al. Differences in organic carbon accumulation between reddish paddy and upland soils under long-term fertilization (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2021, 27(3): 544-552. [李文军, 黄庆海, 李大明, 等. 长期施肥红壤性稻田和旱地土壤有机碳积累差异[J]. 植物营养与肥料学报, 2021, 27(3): 544-552.]
(  0) 0) |
| [9] |
Mayes M A, Heal K R, Brandt C C, et al. Relation between soil order and sorption of dissolved organic carbon in temperate subsoils[J]. Soil Science Society of America Journal, 2012, 76(3): 1027-1037. DOI:10.2136/sssaj2011.0340
(  0) 0) |
| [10] |
Dippold M, Biryukov M, Kuzyakov Y. Sorption affects amino acid pathways in soil: Implications from position-specific labeling of alanine[J]. Soil Biology and Biochemistry, 2014, 72: 180-192. DOI:10.1016/j.soilbio.2014.01.015
(  0) 0) |
| [11] |
Li Y H, Shahbaz M, Zhu Z K, et al. Oxygen availability determines key regulators in soil organic carbon mineralisation in paddy soils[J]. Soil Biology and Biochemistry, 2021, 153: 108106. DOI:10.1016/j.soilbio.2020.108106
(  0) 0) |
| [12] |
Li Y C, Yu S, Strong J, et al. Are the biogeochemical cycles of carbon, nitrogen, sulfur, and phosphorus driven by the "FeⅢ-FeⅡ redox wheel" in dynamic redox environments?[J]. Journal of Soils and Sediments, 2012, 12(5): 683-693. DOI:10.1007/s11368-012-0507-z
(  0) 0) |
| [13] |
Wang Y Y, Wang H, He J S, et al. Iron-mediated soil carbon response to water-table decline in an alpine wetland[J]. Nature Communications, 2017, 8: 15972. DOI:10.1038/ncomms15972
(  0) 0) |
| [14] |
Cornell R M, Schwertmann U. The iron oxides: Structure, properties, reactions, occurrences, and uses . 2nd ed[M]. KGaA, Weinheim: Wiley-VCH Verlag GmbH & Co., 2003.
(  0) 0) |
| [15] |
Chin K J, Conrad R. Intermediary metabolism in methanogenic paddy soil and the influence of temperature[J]. FEMS Microbiology Ecology, 1995, 18(2): 85-102. DOI:10.1111/j.1574-6941.1995.tb00166.x
(  0) 0) |
| [16] |
Chidthaisong A, Conrad R. Turnover of glucose and acetate coupled to reduction of nitrate, ferric iron and sulfate and to methanogenesis in anoxic rice field soil[J]. FEMS Microbiology Ecology, 2000, 31(1): 73-86. DOI:10.1111/j.1574-6941.2000.tb00673.x
(  0) 0) |
| [17] |
Hori T, Müller A, Igarashi Y, et al. Identification of iron-reducing microorganisms in anoxic rice paddy soil by 13C-acetate probing[J]. The ISME Journal, 2010, 4(2): 267-278. DOI:10.1038/ismej.2009.100
(  0) 0) |
| [18] |
Schwertmann U, Cornell R M. Iron oxides in the laboratory: Preparation and characterization . 2nd ed[M]. KGaA, Weinheim: Wiley-VCH Verlag GmbH & Co., 2000.
(  0) 0) |
| [19] |
Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation-extraction-An automated procedure[J]. Soil Biology & Biochemistry, 1990, 22(8): 1167-1169.
(  0) 0) |
| [20] |
Tamura H, Goto K, Yotsuyanagi T, et al. Spectrophotometric determination of iron (Ⅱ) with 1, 10-phenanthroline in the presence of large amounts of iron (Ⅲ)[J]. Talanta, 1974, 21(4): 314-318. DOI:10.1016/0039-9140(74)80012-3
(  0) 0) |
| [21] |
Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology & Biochemistry, 2002, 34(9): 1309-1315.
(  0) 0) |
| [22] |
German D P, Weintraub M N, Grandy A S, et al. Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies[J]. Soil Biology & Biochemistry, 2011, 43(7): 1387-1397.
(  0) 0) |
| [23] |
Palmer J R, Reeve J N. Methanogen genes and the molecular biology of methane biosynthesis[M]//Brock/ Springer Series in Contemporary Bioscience. New York, NY: Springer New York, 1993: 13—35.
(  0) 0) |
| [24] |
Conrad R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J]. FEMS Microbiology Ecology, 1999, 28(3): 193-202. DOI:10.1111/j.1574-6941.1999.tb00575.x
(  0) 0) |
| [25] |
Xu J X, Li X M, Sun G X, et al. Fate of labile organic carbon in paddy soil is regulated by microbial ferric iron reduction[J]. Environmental Science & Technology, 2019, 53(15): 8533-8542.
(  0) 0) |
| [26] |
Cai W W, Liu W Z, Yang C X, et al. Biocathodic methanogenic community in an integrated anaerobic digestion and microbial electrolysis system for enhancement of methane production from waste sludge[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(9): 4913-4921.
(  0) 0) |
| [27] |
Zhang T J, Tang J, Zhuang L, et al. Effects of different iron oxides on methane emission in paddy soil as related to drying /wetting cycles (In Chinese)[J]. Environmental Science, 2014, 35(3): 901-907. [张天娇, 汤佳, 庄莉, 等. 干湿交替条件下不同晶型铁氧化物对水稻土甲烷排放的影响[J]. 环境科学, 2014, 35(3): 901-907.]
(  0) 0) |
| [28] |
Xu J X, Yi X Y, Li X M, et al. Effects of iron oxides in paddy soils on methanogens communities (In Chinese)[J]. Acta Ecologica Sinica, 2020, 40(9): 3115-3120. [徐健鑫, 扆幸运, 李晓明, 等. 水稻土中铁氧化物对产甲烷古菌群落结构的影响[J]. 生态学报, 2020, 40(9): 3115-3120.]
(  0) 0) |
| [29] |
Zhang J, Dong H L, Liu D, et al. Microbial reduction of Fe(Ⅲ) in illite-smectite minerals by methanogen Methanosarcina mazei[J]. Chemical Geology, 2012, 292/293: 35-44. DOI:10.1016/j.chemgeo.2011.11.003
(  0) 0) |
| [30] |
Yamada C, Kato S, Kimura S, et al. Reduction of Fe(Ⅲ) oxides by phylogenetically and physiologically diverse thermophilic methanogens[J]. FEMS Microbiology Ecology, 2014, 89(3): 637-645. DOI:10.1111/1574-6941.12365
(  0) 0) |
| [31] |
Kato S, Nakamura R, Kai F, et al. Respiratory interactions of soil bacteria with(semi)conductive iron-oxide minerals[J]. Environmental Microbiology, 2010, 12(12): 3114-3123. DOI:10.1111/j.1462-2920.2010.02284.x
(  0) 0) |
| [32] |
Jones D L, Edwards A C. Influence of sorption on the biological utilization of two simple carbon substrates[J]. Soil Biology & Biochemistry, 1998, 30(14): 1895-1902.
(  0) 0) |
| [33] |
Liu Q, Li Y H, Li Z, et al. Characteristics of paddy soil organic carbon mineralization and influencing factors under different water conditions and microbial biomass levels (In Chinese)[J]. Environmental Science, 2021, 42(5): 2440-2448. [刘琪, 李宇虹, 李哲, 等. 水稻土有机碳矿化及其影响因子在不同水分条件和微生物生物量水平下的差异[J]. 环境科学, 2021, 42(5): 2440-2448.]
(  0) 0) |
| [34] |
Du H Y, Chen C M, Yu G H, et al. An iron-dependent burst of hydroxyl radicals stimulates straw decomposition and CO2 emission from soil hotspots: Consequences of Fenton or Fenton-like reactions[J]. Geoderma, 2020, 375: 114512.
(  0) 0) |
| [35] |
Merino C, Kuzyakov Y, Godoy K, et al. Iron-reducing bacteria decompose lignin by electron transfer from soil organic matter[J]. Science of the Total Environment, 2021, 761: 143194.
(  0) 0) |
 2022, Vol. 59
2022, Vol. 59


