2. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101;
3. 中国科学院大学资源与环境学院, 北京 100049
2. Key Laboratory of Ecosystem Network Observation and Modeling, Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sci ences, Beijing 100101, China;
3. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China
磷(P)是指示成土过程和维持生态系统服务功能的重要生命元素[1–2]。土壤中磷的含量、形态和生物有效性随成土过程而发生变化,进而影响土壤磷素供应、养分平衡及生态系统生产力[3–7]。与氮主要来源于大气不同,自然生态系统中磷主要来源于岩石和原生矿物风化。大量研究表明,岩石和矿物风化释放的无机磷(Pi)一部分被植物吸收利用,形成有机磷(Po);一部分被次生黏土矿物或金属氧化物吸附/固定、或与有机质络合,从而形成有效性较低的吸附态磷、闭蓄态磷或难分解的Po。随着成土过程的进行,土壤全磷(Pt)含量因淋溶损失和植物利用而逐渐减少,其中有效磷(水溶态磷、弱吸附态磷和易分解的Po)含量及其占Pt的比例不断降低,而有效性低的闭蓄态磷和难分解的Po含量先增加后减少,但占Pt的比例逐渐升高[3,5,8–9]。因此,在自然生态系统演化后期,磷含量及其生物有效性低成为影响土壤初级生产力、生物多样性和生态系统健康发展的主要限制因子[6–7,10–11]。此外,随着碳、氮等养分在土壤中不断富集,碳磷比(C:P)和氮磷比(N:P)也随成土时间逐渐增大,从而进一步加剧了陆地生态系统的磷限制[6,12–13]。最近的研究表明,全球自然陆地生态系统(农田、城市和冰川除外)43%的区域受到较强的磷限制,而39%的区域受氮、磷共同限制或氮、磷任一元素的微弱限制[14],并且磷的限制程度受气候条件、土壤性质和生态系统类型等因素的共同影响[15]。
由于自然成土过程中Pi不断消耗,Po占Pt的比例逐渐升高,因此成土后期Po的循环、固定与释放对于维持土壤肥力和生态系统服务功能显得尤为重要[16]。然而,与土壤Pi相比,以往的研究对Po的重视不够,这主要是由于土壤中Po的提取、分析和鉴定方法难于Pi。因此在早期研究中,通常将Po归为有效性较低的单一磷库[3,5],或通过不同提取剂来人为划分有效性不同的Po组分[17–18]。事实上,土壤中Po由各种性质不同的有机化合物组成,且不同形态Po的化学稳定性和生物有效性具有明显差异[19]。近年来,随着液相31P核磁共振(31P NMR)技术在土壤学领域的应用,为定量分析土壤Po形态提供了新的技术手段[20],同时为更好地理解生态系统演化过程中不同形态Po的转化特征奠定了基础。大量研究表明,自然成土过程中土壤Po的含量、形态和有效性均发生显著变化[21–25],但对相关进展的系统总结和综述目前较少。基于此,本文首先介绍了土壤Po的种类和性质,以及液相31P NMR波谱分析土壤Po的原理和方法,在此基础上总结了自然成土过程中不同形态Po的转化特征及其影响因素,并提出了未来需进一步研究的方向和关键科学问题,包括但不限于(1)揭示成土过程中不同形态Po转化速率、途径与环境阈值;(2)阐明不同发育阶段土壤Po与C、N等养分之间的耦合关系及其固释机理;(3)构建不同类型土壤Po演化模型。回答上述问题有助于更好地理解地球关键带磷素生物地球化学循环,为不同发育阶段土壤养分管理与调控及土壤资源可持续利用提供理论依据。
1 土壤有机磷形态与性质Po作为土壤磷库重要组成部分,通常是指含有C-O-P键或C-P键的磷化合物[26]。Po一般占土壤Pt的30%~65%,在高有机质土壤中可达90%[27],其主要来自动植物残体,由土壤微生物合成[19]。根据磷酸键的种类或性质,Po一般分为以下3种类型:磷酸酯、膦酸酯和磷酸酐(表 1,图 1)。
|
|
表 1 土壤中常见有机磷种类 Table 1 The common organic phosphorus speciations in soils |
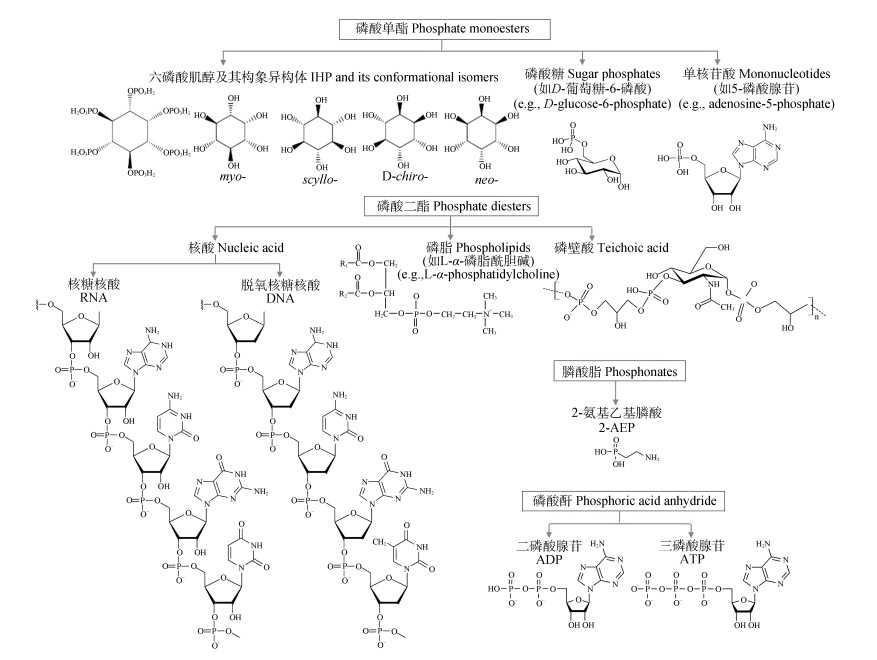
|
图 1 土壤中常见有机磷化合物结构示意图 Fig. 1 Structure of some common organic phosphorus compounds in soils |
磷酸酯是以C-O-P键结合的Po,根据每个P结合含碳基团的数量,可分为磷酸单酯和磷酸二酯[19]。土壤Po以磷酸单酯为主,其分子结构可表示为ROP
膦酸酯是以C-P键结合的Po,其分子结构可表示为RP
磷酸酐是若干磷酸基团脱水缩合后的产物,一般称为多聚磷酸盐,包括无机聚磷酸盐和有机聚磷酸盐。其中,有机聚磷酸盐是正磷酸残体通过高能磷酸酐键形成的线型多聚物,在参与生物化学反应过程中起重要作用[19]。自然界中最重要的磷酸酐为三磷酸腺苷(ATP)和二磷酸腺苷(ADP),由于二者的热力学稳定性弱,很容易降解为一磷酸腺苷(AMP),因此在自然土壤中很难被检测到[32]。
2 液相31P NMR分析土壤有机磷的原理和方法31P NMR是基于31P原子核的核磁共振特征来识别磷化合物化学形态的分析技术。其原理是在外磁场作用下,通过检测31P能级跃迁时对不同频率电磁波的吸收情况来获得核磁共振波谱[33]。由于不同化合物中31P原子核所处的化学环境不同,导致其共振频率产生微小的移动(即化学位移),因此可以根据波谱图上核磁共振峰的位置、强度准确识别和量化样品中31P的不同化学形态[34](图 2)。液相31P NMR分析土壤Po主要包括以下3个步骤:(1)样品制备;(2)选择实验参数;(3)波谱解析与磷化合物鉴定。
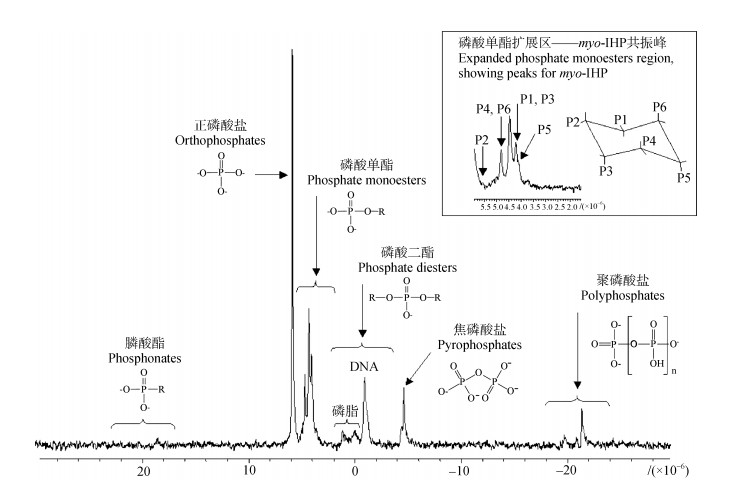
|
图 2 加拿大温哥华岛北部森林土壤液相31P NMR波谱图(修改自文献[35-36]) Fig. 2 A solution 31P NMR spectroscopy of a forest soil from northern Vancouver Island, Canada(revised after Reference [35-36]) |
在液相31P NMR分析之前,需对土壤Po进行提取。以往研究表明,不同的提取剂不仅会影响土壤Po的回收率,而且会影响所提取磷化合物的组成[36–38]。目前一般使用NaOH提取Po,但土壤中存在的顺磁性金属离子会导致样品回收率较低,因此往往会选择其他联用试剂来提高提取效率[26]。常见的联用试剂包括阳离子交换树脂、NaF、EDTA等[39]。土液比和提取时间也会影响样品提取效果,文献中已报道的土液比范围为1:4~1:20[39–42],提取时间变化范围为3~24 h[39]。目前液相31P NMR分析中使用最广泛的提取剂、土液比和提取时间分别为0.25 mol·L–1 NaOH + 0.05 mol·L–1 EDTA、1:20和16 h。然而,该提取方法在不同土壤类型中的提取效率可能存在差异,因此还应根据土壤性质,通过预实验来选择合适的提取剂、土液比和提取时间,从而提高回收率以获得更准确的数据。
样品提取后,需要对提取物进行浓缩。浓缩方法主要包括冷冻干燥、旋转蒸发和40℃下氮吹,目前最常用的是冷冻干燥法[39]。液相31P NMR分析前还需重新溶解冻干的土壤提取物,重溶解试剂主要包括:(1)纯水+ D2O;(2)NaOH + D2O;(3)NaOD + D2O;(4)NaOH-EDTA + D2O;(5)NaOH + NaOH-EDTA + D2O[39]。冻干样品重溶解后可加入适量Na2S[43]或Na2S2O4[44]使Fe、Mn离子沉淀,以进一步消除土壤顺磁性离子对波谱的干扰。为尽可能降低Po降解对实验结果产生的误差,待测样品应当在4℃下低温保存并尽快进行NMR分析。
2.2 31P NMR实验参数选择选择合适的实验参数对于获得准确、清晰的31P NMR波谱十分重要[16]。外磁场中的31P原子核被射频脉冲激发后,需要在弛豫时间内与周围环境交换能量回到平衡状态[39]。弛豫时间长度一般由指数时间常数T1和脉冲角度确定,例如90°射频脉冲虽然可以提供最大信号强度,但需要5 × T1的弛豫时间来使99%的P原子核回到平衡状态,而45°、30°脉冲仅分别需要4 × T1和3 × T1的弛豫时间[45]。Cade-Menun等[37]测定了不同磷化合物在90°脉冲下的T1,认为使用NaOH-EDTA作为提取剂时,1~2 s的弛豫时间足以获得准确的波谱信息。McDowell等[46]研究了NMR实验中T1和提取液中P /(Fe + Mn)(即P浓度与Fe、Mn浓度和的比值)之间的定量关系,指出应通过测定土壤中P、Fe和Mn的含量来估算T1值,从而保证样品获得足够的弛豫时间。质子解耦可用于消除质子对共振原子核的耦合影响,从而简化波谱的峰识别[39]。然而,质子解耦过程中射频辐射的能量会提高样品温度,可能引起Po降解,因此Cade-Menun和Liu[39]指出在31P NMR分析中,尽可能不使用质子解耦,或者使用复合脉冲解耦代替连续解耦。此外,为减少样品中Po降解,应将实验温度保持在20 ℃,同时尽可能缩短测试时间[39]。
2.3 31P NMR波谱分析与磷化合物鉴定在31P NMR波谱中,常见的土壤磷化合物的化学位移(以δ值表示)δ值为25 × 10–6~−25 × 10–6之间(图 3)。不同Po化合物的化学位移不同(表 2)。
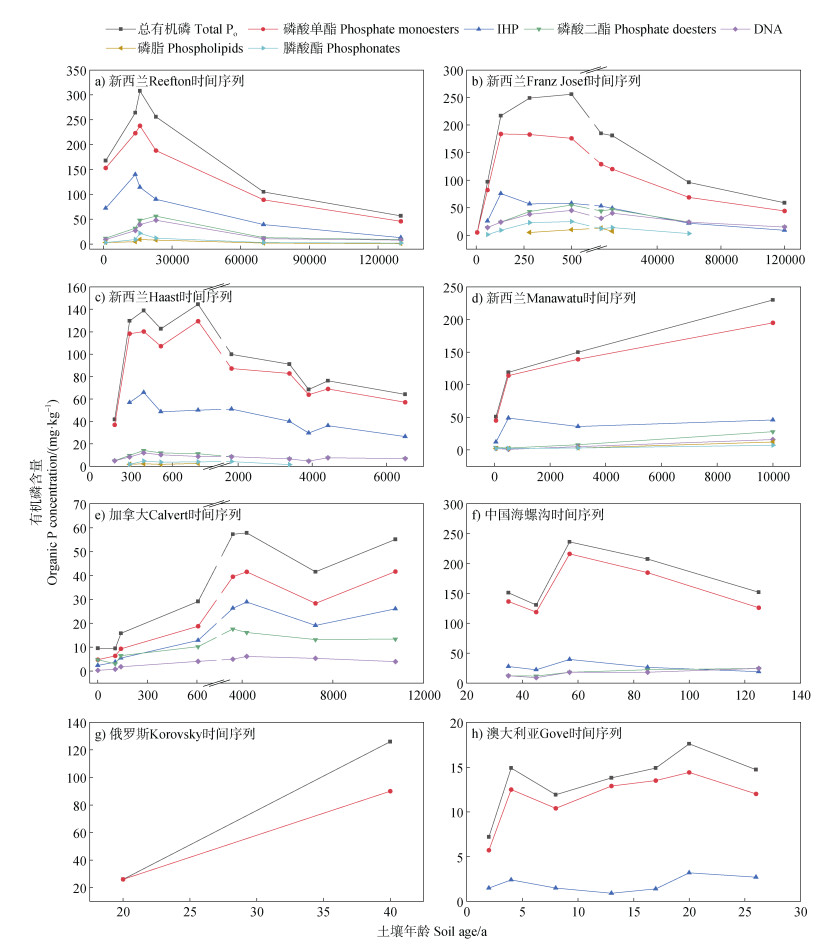
|
图 3 基于液相31P NMR波谱的自然土壤时间序列Po形态演变特征 Fig. 3 Changes in organic phosphorus compounds in natural soil chronosequences determined by solution 31P NMR spectroscopy |
|
|
表 2 土壤中常见磷化合物在31P NMR波谱中的化学位移 Table 2 31P NMR spectroscopy chemical shift of some common phosphorus compounds in soil |
磷酸单酯的共振信号出现在3.0 × 10–6~6.0 × 10–6(表 2),其中六磷酸肌醇的化学位移在3.5 × 10–6~6.0 × 10–6之间(表 2),其包含myo-IHP、scyllo-IHP、neo-IHP、D-chiro-IHP四种异构体,不同异构体的化学位移不同。根据不同学者的报道[47–49],myo-IHP的化学位移为4.43 × 10–6~5.85 × 10–6、4.02 × 10–6~5.49 × 10–6、4.06 × 10–6~5.52 × 10–6(表 2);scyllo-IHP的化学位移为4.20 × 10–6或3.71 × 10–6;neo-IHP在4e/2a构象的化学位移为6.37 × 10–6和4.25 × 10–6;D-chiro-IHP在4e/2a构象的化学位移为6.50 × 10–6、5.27 × 10–6和3.97 × 10–6,在2e/4a构象为6.17 × 10–6、4.75 × 10–6和4.32 × 10–6(表 2)。α-甘油磷酸酯的化学位移为4.88 × 10–6或4.95 × 10–6;β-甘油磷酸酯的化学位移为4.80 × 10–6 [47]、4.88 × 10–6和4.95 × 10–6 [48]。磷酸糖包括3个构象异构体,其中α-D-葡萄糖-1-磷酸的化学位移在3.36 × 10–6~ 3.37 × 10–6(表 2);D-葡萄糖-6-磷酸有两个共振信号,分别为5.36 × 10–6和4.88 × 10–6 [47];α-D-半乳糖-1-磷酸的化学位移为3.50 × 10–6。腺嘌呤核苷酸的化学位移为4.41 × 10–6~4.78 × 10–6;鸟嘌呤核苷酸为4.27 × 10–6~4.75 × 10–6(表 2)。
磷酸二酯的共振信号在−1.0 × 10–6~2.0 × 10–6(表 2),其中RNA、DNA和磷脂的化学位移在不同研究中略有差异。RNA的化学位移为0.52 × 10–6或0.54 × 10–6(表 2);Turner等[47]指出DNA的化学位移为−0.25 × 10–6、−0.37 × 10–6和−0.63 × 10–6,而Cade-Menun[48]认为DNA的化学位移为−0.73 × 10–6和−0.92 × 10–6(表 2)。由于磷脂存在不同的衍生物,因此具有不同的化学位移,其范围在0.42 × 10–6~1.75 × 10–6之间(表 2)。
膦酸酯的化学位移在12 × 10–6~23 × 10–6(表 2),通常在20 × 10–6附近可检测到2-AEP的存在。磷酸酸酐的化学位移在−20 × 10–6~−4 × 10–6(表 2),其中ADP的化学位移在−4.71 × 10–6~−9.20 × 10–6或−4.52 × 10–6~−9.05 × 10–6之间;ATP的化学位移在−4.28 × 10–6~−19.6 × 10–6或−4.08 × 10–6~ −19.22 × 10–6之间(表 2)。
3 自然成土过程中不同形态有机磷变化特征及影响因素与人类有限的寿命相比,土壤演化过程极其漫长,因此很难进行原位观测。土壤时间序列(即由母质、地形、气候和生物条件相同或相似,但发育时间不同的土壤所构成的一个序列)为研究成土过程的方向、速率及土壤属性动态演变特征提供了有利手段[51–53]。前人通过磷素连续提取和土壤时间序列方法相结合,揭示了成土过程中不同形态Pi的迁移、转化特征及其影响因素[1,3,5–7],但关于土壤Po形态转化及其动态演变特征目前仍知之甚少。随着液相31P NMR技术的发展及其在土壤学领域中的应用,为定量分析土壤Po形态及含量提供了新的技术手段。近年来,不同学者将液相31P NMR技术与土壤时间序列方法相结合,对土壤Po组分及其动态进行了初步研究。本文通过Meta分析以期更好地揭示自然土壤演化过程中不同形态Po的转化规律及影响因素(表 3,图 3)。
|
|
表 3 基于液相31P NMR技术与土壤时间序列方法相结合研究自然成土过程中有机磷转化特征的文献总结 Table 3 Published literatures on organic phosphorus transformation during natural pedogenesis based on solution 31P NMR and soil chronosequence approach |
在目前已研究的时间序列土壤中,通过液相31P NMR波谱测定的Po中磷酸单酯含量最高,其次为磷酸二酯、膦酸酯,其中磷酸单酯以IHP为主,磷酸二酯以DNA为主(图 3)。不同土壤时间序列Po形态、峰值出现时间、变化速率及环境阈值不同,这主要是由于不同地区的气候、母质、生物群落以及成土时间等具有很大差异(图 3)。然而,大多数研究中不同形态Po含量随土壤发育年龄增加呈现先增加后降低的趋势(图 3a,图 3b,图 3e,图 3f)。
McDowell等[21]利用31P NMR波谱分析研究了新西兰Manawatu和Reefton地区土壤时间序列Po形态及含量变化特征,结果表明NaOH-EDTA提取液中正磷酸盐含量最高(平均占提取液Pt的45%),其次是磷酸单酯(平均占提取液Pt的42%),而磷酸二酯、焦磷酸盐和膦酸酯占提取液Pt的比例均不到10%。Reefton地区土壤时间序列(1 000~130 000 a)中磷酸单酯(包括IHP)、磷酸二酯(包括DNA)和膦酸酯含量均随成土时间先增加后降低,各形态Po在土壤发育14 000~16 000 a内达到峰值(图 3a)。同样,在新西兰的Franz Josef地区土壤时间序列(5~120 000 a)[22]中,各形态Po(包括磷酸单酯、磷酸二酯和膦酸酯)含量在500 a内迅速积累,随后逐渐降低(图 3b)。在土壤发育初期,矿物释放的Pi被植物或微生物吸收利用从而形成Po,导致不同形态Po在年轻土壤中迅速积累(图 3a和图 3b);而土壤发育后期不同形态Po含量均下降(图 3a和图 3b),这一方面是由于土壤中Pi不断消耗,导致植物必须依靠Po的矿化分解来满足自身营养需求;另一方面是由于强风化作用导致非晶态金属氧化物含量和土壤磷吸附容量降低,使得磷酸单酯(尤其是IHP)的稳定性减弱,从而进一步促进Po的矿化和分解[21–22]。然而,在时间尺度较短的新西兰Haast地区土壤时间序列(181~6 500 a)[23]中,尽管非晶态Al/Fe含量随成土时间不断增加,IHP、磷酸二酯和DNA含量均在土壤发育392 a时增加到最大值,随后持续下降(图 3c)。这是因为在成土后期,生态系统低磷胁迫所引起的植物根系对Po的矿化作用强于非晶态金属氧化物对Po的吸附和固定作用[23]。
在时间尺度同样相对较短的新西兰Manawatu地区土壤时间序列(0~10 000 a)[21]中,磷酸单酯、磷酸二酯(包括DNA、磷脂)和膦酸酯含量随成土年龄的增加而增加(图 3d),而加拿大Calvert岛土壤时间序列(0~10 760 a)[54]中磷酸单酯、IHP和磷酸二酯含量则随成土年龄呈波动趋势(图 3e),表明Manawatu和Calvert地区的成土年龄可能不足以反映土壤Po的变化阈值。在贡嘎山海螺沟百年尺度冰碛物发育土壤时间序列(0~125 a)中,Zhou等[25]发现土壤磷酸单酯含量呈抛物线变化趋势(图 3f),与其他研究报道的磷酸单酯在土壤发育早期持续增加的趋势有所不同[21–23,54],这可能是土壤发育过程中植物群落演替引起的。海螺沟时间序列的植被类型从57 a的落叶阔叶林转变为85 a和125 a的针叶林,有证据显示阔叶林的磷归还量高于针叶林[57],此外针叶林凋落物的分解速率较阔叶林凋落物的分解速率慢[58],这也可能是导致该时间序列后期磷酸单酯含量降低的重要原因。
尽管磷酸二酯、DNA等活性较高的Po含量在成土后期逐渐降低,但其占NaOH-EDTA提取Pt的比例却在整个时间序列中不断升高。例如Franz Josef时间序列DNA的比例在土壤发育60 a后迅速增加至9%,且在12万年土壤中增加至16%[22]。海螺沟时间序列DNA的比例从35 a的4.7%增加至125 a的8.3%[25],这可能与土壤发育过程中微生物活性不断增强有关[25,59]。研究表明,以微生物主导的活性Po组分是维持土壤磷素循环的重要周转库[60]。例如,Celi等[55]对俄罗斯Korovosky废弃采砂场樟子松植被恢复时间序列(0~40 a)的土壤磷素演化过程进行了研究,发现土壤性质在植被恢复40 a内迅速变化,土壤Po(包括磷酸单酯、磷酸二酯)随着有机质的积累快速增加(图 3g),最高含量甚至超过未受人为扰动的区域。可见,在土壤生态恢复初期,随着有机质的重新积累,由微生物所驱动的磷生物化学循环得以迅速发展,从而进一步促进生态系统的恢复。Spain等[56]对澳大利亚Gove半岛废弃矿场植被恢复序列(0~26 a)的研究同样表明,Po的积累主要表现在土壤表层(图 3h),并且在单酯共振区发现大量RNA、磷脂等水解产物,进一步证实了微生物对土壤发育初期磷循环的重要性。
3.2 自然成土过程中不同形态有机磷转化过程的影响因素土壤长期演化过程中不仅土壤组分和性质发生变化,而且植物和微生物群落也会发生显著变化[23,25,61–63],从而影响Po的含量、形态和有效性。因此,土壤本身性质的变化(内因)和外界环境条件的变化(外因)均与Po的生物地球化学循环密切相关,进而共同影响土壤演化过程中Po的组成和转化。
土壤pH、Eh和矿物组成等是影响成土过程中Po形态转化的重要非生物因素。不同pH土壤中吸附磷的矿物类型具有显著差异,研究表明酸性、碱性和中性土壤中吸附磷的主要矿物分别为氧化铁、三水铝石和黏土矿物[64]。Po在矿物表面的吸附-解吸、溶解-沉淀等反应决定了土壤中Po的形态及其生物有效性,因此,土壤矿物组成变化会改变Po的稳定性和分解能力[65]。Po在矿物表面的吸附能力与矿物结晶度显著相关,例如Ruttenberg和Sulak[66]研究了ATP、AMP、2-AEP和D-葡萄糖-6-磷酸四种Po在水铁矿、针铁矿和赤铁矿表面的吸附,结果表明不同形态Po在铁氧化物表面的吸附量均随矿物结晶度的升高而降低。Yan等[67]对Po在三种含铝矿物(非晶态氢氧化铝Al(OH)3、勃姆石γ-AlOOH和刚玉α-Al2O3)表面的吸附行为进行了研究,同样发现Po在非晶态含铝矿物(Al(OH)3)表面的吸附量最高。土壤长期演化过程中,由于强风化作用导致高表面活性矿物(如水铝英石、伊毛缟石、水铁矿)向低表面活性矿物(如高岭石)转化[61],使得非晶态金属氧化物含量和土壤磷吸附容量降低,Po在矿物表面的吸附点位减少,从而促进了生态系统演化后期不同形态Po的矿化和分解[21]。Miller等[68]对夏威夷不同气候带土壤进行研究表明,Eh是控制该区土壤磷库组成的重要因素。随着降水增多Eh降低,还原作用增强,土壤Pi逐渐减少,而Po逐渐增多,但由于淋溶作用增强,导致Pt减少约三分之二。Devau等[64]研究也发现,Po的淋失与Eh变化引起的Fe流失量呈显著正相关。
除了pH、Eh和矿物组成等非生物因素的影响,生态系统演化过程中植物、微生物群落的变化以及由养分胁迫引起的磷素生物利用策略改变是影响自然成土过程中Po转化的重要生物因素[22]。例如,海螺沟山地土壤时间序列的植被类型从57 a的落叶阔叶林转变为85 a和125 a的针叶林,由于不同植物群落养分归还量、凋落物分解速率等差异造成Po输入量的改变,导致磷酸单酯含量在该地区年轻土壤时间序列中呈现抛物线变化趋势[25]。在磷可用性较低的强风化土壤中,养分胁迫可诱使植物根系或根际微生物通过增加有机酸和磷酸酶的分泌从而提高Po的利用率[69–70],其作用机制包括有机酸阴离子络合金属离子释放被固定的Po,以及磷酸酶对Po的水解[71]。Touhami等[70]验证了根际土壤缺磷时,植物可以同时吸收不同化学活性的磷组分,而中等活性Pi和稳定性Po是植物吸收最多的组分。此外,含有菌根的植物在磷有效性低的条件下可将更多的碳提供给共生真菌,从而进一步提高对根际土壤磷的获取能力[72]。
综上所述,成土过程中不仅土壤pH、Eh和矿物组成(结晶度)等非生物因素发生变化,植物和微生物群落以及磷素生物利用策略等生物因子也会发生改变,从而共同影响Po的形态和转化。然而,在自然生态系统长期演化过程中,生物和非生物要素的变化几乎是同时发生的,并且二者之间相互作用,不同因素以及它们之间的耦合效应对土壤Po转化的相对贡献目前仍知之甚少。未来还需要针对不同气候带、不同生态系统类型下的自然土壤时间序列,重点关注母质-土壤-根际-植物多界面的磷循环过程以及与磷素动力学相关的生物、非生物特性变化,研究Po与影响因子之间的相互作用关系。
4 结论与展望随着液相31P NMR技术在土壤学领域的应用,近年来Po在不同生态系统中得到了准确表征,不仅提高了对Po组分和化学结构的认知,更深化了对自然成土过程中Po形态及其转化规律的理解。鉴于成土过程中Po与生物/非生物因素之间复杂的相互作用,未来还需进一步研究和回答以下关键科学问题(图 4):
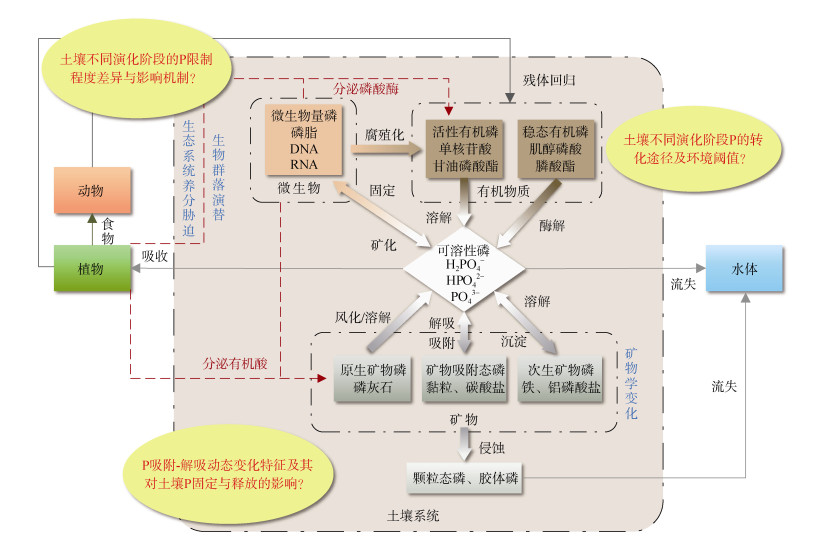
|
图 4 陆地自然生态系统磷转化示意图 Fig. 4 Phosphorus transformation in terrestrial natural ecosystems |
(1)揭示成土过程中不同形态Po转化速率、途径与环境阈值。尽管前人对生态系统长期演化过程中土壤Po的动力学特征开展了大量研究[21–25],但关于不同类型土壤中Po转化的速率、途径与环境阈值仍然知之甚少。这主要是由于成土过程中Po的形成和矿化几乎同时发生,并且很难定量区分生物和非生物因素对Po转化的相对贡献。目前关于微生物如何影响土壤Po矿化已取得重要进展[73–75],然而这些室内培养实验获得的结果能否直接外推到野外自然环境中仍需进一步验证。未来可通过室内和野外原位矿化培养试验相结合,并利用磷酸盐氧同位素标记、31P NMR波谱、XANES等多技术手段研究土壤不同发育阶段各形态Po的滞留和周转时间,从而揭示成土过程中不同形态Po转化速率、途径与环境阈值,为建立Po定量演化模型提供数据支撑。
(2)阐明不同发育阶段土壤Po与C、N等养分之间的耦合关系及其固释机理。土壤中C、N、P之间的相互作用对Po的生物地球化学循环具有直接影响[6,11,76],并且不同养分之间的化学计量平衡能够改变微生物群落组成及酶活性[77–78],从而间接影响土壤中Po的固定与释放。然而,由于生态系统长期演变过程中C、N、P等养分含量、生物有效性及其影响因素协同变化,因此难以量化多个变量(C、N、P)之间的耦合关系,进而无法揭示不同发育阶段土壤Po的固释机理。未来可通过控制单一变量,结合Meta分析、结构方程模型等方法研究成土过程中Po与C或N单一养分元素之间的耦合关系及其对土壤Po固定与释放的影响。
(3)构建不同类型土壤Po演化模型。由于土壤演化过程中生物(植被组成、微生物群落等)和非生物因子(土壤pH、Eh、有机质含量、矿物组成和结晶度等)均发生变化[23,25,61–63],从而导致Po在成土过程中可能存在非线性响应及多重阈值。因此,未来还需针对不同气候带、不同生态系统类型下的自然土壤时间序列,研究成土过程中不同形态Po的含量及其转化特征,建立不同类型土壤Po演化模型。回答上述问题有助于更好地理解地球关键带磷素生物地球化学循环,为不同发育阶段土壤养分管理与调控及土壤资源可持续利用提供理论依据。
| [1] |
Huang L M, Zhang G L, Thompson A, et al. Pedogenic transformation of phosphorus during paddy soil development on calcareous and acid parent materials[J]. Soil Science Society of America Journal, 2013, 77(6): 2078-2088. DOI:10.2136/sssaj2013.01.0033
(  0) 0) |
| [2] |
Huang L M, Thompson A, Zhang G L. Long-term paddy cultivation significantly alters topsoil phosphorus transformation and degrades phosphorus sorption capacity[J]. Soil and Tillage Research, 2014, 142(1): 32-41.
(  0) 0) |
| [3] |
Walker T W, Syers J K. The fate of phosphorus during pedogenesis[J]. Geoderma, 1976, 15(1): 1-19. DOI:10.1016/0016-7061(76)90066-5
(  0) 0) |
| [4] |
Tiessen H, Stewart J W B, Cole C V. Pathways of phosphorus transformations in soils of differing pedogenesis[J]. Soil Science Society of America Journal, 1984, 48(4): 853-858. DOI:10.2136/sssaj1984.03615995004800040031x
(  0) 0) |
| [5] |
Crews T E, Kitayama K, Fownes J H, et al. Changes in soil phosphorus fractions and ecosystem dynamics across a long chronosequence in Hawaii[J]. Ecology, 1995, 76(5): 1407-1424. DOI:10.2307/1938144
(  0) 0) |
| [6] |
Vitousek P M, Porder S, Houlton B Z, et al. Terrestrial phosphorus limitation: Mechanisms, implications, and nitrogen-phosphorus interactions[J]. Ecological Applications, 2010, 20(1): 5-15. DOI:10.1890/08-0127.1
(  0) 0) |
| [7] |
Turner B L, Brenes-Arguedas T, Condit R. Pervasive phosphorus limitation of tree species but not communities in tropical forests[J]. Nature, 2018, 555(7696): 367-370. DOI:10.1038/nature25789
(  0) 0) |
| [8] |
Galván-Tejada N C, Peña-Ramírez V, Mora-Palomino L, et al. Soil P fractions in a volcanic soil chronosequence of Central Mexico and their relationship to foliar P in pine trees[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(5): 792-802. DOI:10.1002/jpln.201300653
(  0) 0) |
| [9] |
Gu C H, Hart S C, Turner B L, et al. Aeolian dust deposition and the perturbation of phosphorus transformations during long-term ecosystem development in a cool, semi-arid environment[J]. Geochimica et Cosmochimica Acta, 2019, 246: 498-514. DOI:10.1016/j.gca.2018.12.017
(  0) 0) |
| [10] |
Richardson S J, Peltzer D A, Allen R B, et al. Rapid development of phosphorus limitation in temperate rainforest along the Franz Josef soil chronosequence[J]. Oecologia, 2004, 139(2): 267-276. DOI:10.1007/s00442-004-1501-y
(  0) 0) |
| [11] |
Elser J J, Bracken M E S, Cleland E E, et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater, marine and terrestrial ecosystems[J]. Ecology Letters, 2007, 10(12): 1135-1142. DOI:10.1111/j.1461-0248.2007.01113.x
(  0) 0) |
| [12] |
Wardle D A, Walker L R, Bardgett R D. Ecosystem properties and forest decline in contrasting long-term chronosequences[J]. Science, 2004, 305(5683): 509-513. DOI:10.1126/science.1098778
(  0) 0) |
| [13] |
Vindušková O, Pánek T, Frouz J. Soil C, N and P dynamics along a 13 ka chronosequence of landslides under semi-natural temperate forest[J]. Quaternary Science Reviews, 2019, 213: 18-29. DOI:10.1016/j.quascirev.2019.04.001
(  0) 0) |
| [14] |
Du E Z, Terrer C, Pellegrini A F A, et al. Global patterns of terrestrial nitrogen and phosphorus limitation[J]. Nature Geoscience, 2020, 13(3): 221-226. DOI:10.1038/s41561-019-0530-4
(  0) 0) |
| [15] |
Hou E Q, Luo Y Q, Kuang Y W, et al. Global meta-analysis shows pervasive phosphorus limitation of aboveground plant production in natural terrestrial ecosystems[J]. Nature Communications, 2020, 11: 637. DOI:10.1038/s41467-020-14492-w
(  0) 0) |
| [16] |
Huang L M, Jia X X, Zhang G L, et al. Soil organic phosphorus transformation during ecosystem development: A review[J]. Plant and Soil, 2017, 417(1): 17-42.
(  0) 0) |
| [17] |
Bowman R A, Cole C V. An exploratory method for fractionation of organic phosphorus from grassland soils[J]. Soil Science, 1978, 125(2): 95-101. DOI:10.1097/00010694-197802000-00006
(  0) 0) |
| [18] |
Hedley M J, Stewart J W B, Chauhan B S. Changes in inorganic and organic soil phosphorus fractions induced by cultivation practices and by laboratory incubations[J]. Soil Science Society of America Journal, 1982, 46(5): 970-976. DOI:10.2136/sssaj1982.03615995004600050017x
(  0) 0) |
| [19] |
Condron L M, Turner B L, Cade-Menun B J. Chemistry and dynamics of soil organic phosphorus[M]. Agronomy Monographs. Madison, WI, USA: American Society of Agronomy, Crop Science Society of America, and Soil Science Society of America, 2015: 87—121.
(  0) 0) |
| [20] |
Liu J, Yang J J. Molecular speciation of phosphorus in agricultural soils: Advances over the last 30 years (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3): 558-567. [刘瑾, 杨建军. 近三十年农田土壤磷分子形态的研究进展[J]. 土壤学报, 2021, 58(3): 558-567.]
(  0) 0) |
| [21] |
McDowell R W, Cade-Menun B, Stewart I. Organic phosphorus speciation and pedogenesis: analysis by solution 31P nuclear magnetic resonance spectroscopy[J]. European Journal of Soil Science, 2007, 58(6): 1348-1357. DOI:10.1111/j.1365-2389.2007.00933.x
(  0) 0) |
| [22] |
Turner B L, Condron L M, Richardson S J, et al. Soil organic phosphorus transformations during pedogenesis[J]. Ecosystems, 2007, 10(7): 1166-1181. DOI:10.1007/s10021-007-9086-z
(  0) 0) |
| [23] |
Turner B L, Wells A, Condron L M. Soil organic phosphorus transformations along a coastal dune chronosequence under New Zealand temperate rain forest[J]. Biogeochemistry, 2014, 121(3): 595-611. DOI:10.1007/s10533-014-0025-8
(  0) 0) |
| [24] |
Vincent A G, Vestergren J, Gröbner G, et al. Soil organic phosphorus transformations in a boreal forest chronosequence[J]. Plant and Soil, 2013, 367(1/2): 149-162.
(  0) 0) |
| [25] |
Zhou J, Wu Y H, Turner B L, et al. Transformation of soil organic phosphorus along the Hailuogou post-glacial chronosequence, southeastern edge of the Tibetan Plateau[J]. Geoderma, 2019, 352: 414-421. DOI:10.1016/j.geoderma.2019.05.038
(  0) 0) |
| [26] |
Turner B L, Cade-Menun B J, Condron L M, et al. Extraction of soil organic phosphorus[J]. Talanta, 2005, 66(2): 294-306. DOI:10.1016/j.talanta.2004.11.012
(  0) 0) |
| [27] |
Harrison A F. Soil organic phosphorus-A review of world literature . CAB Int., Wallingford: Oxon, UK, 1987.
(  0) 0) |
| [28] |
Turner B L, Papházy M J, Haygarth P M, et al. Inositol phosphates in the environment[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2002, 357(1420): 449-469. DOI:10.1098/rstb.2001.0837
(  0) 0) |
| [29] |
Turner B L, Mahieu N, Condron L M. The phosphorus composition of temperate pasture soils determined by NaOH-EDTA extraction and solution 31P NMR spectroscopy[J]. Organic Geochemistry, 2003, 34(8): 1199-1210. DOI:10.1016/S0146-6380(03)00061-5
(  0) 0) |
| [30] |
Cook A M, Daughton C G, Alexander M. Phosphonate utilization by bacteria[J]. Journal of Bacteriology, 1978, 133(1): 85-90. DOI:10.1128/jb.133.1.85-90.1978
(  0) 0) |
| [31] |
Cade-Menun B J, Berch S M, Preston C M, et al. Phosphorus forms and related soil chemistry of Podzolic soils on northern Vancouver Island. I. A comparison of two forest types[J]. Canadian Journal of Forest Research, 2000, 30(11): 1714-1725. DOI:10.1139/x00-098
(  0) 0) |
| [32] |
De Nobili M, Diaz-Raviña M, Brookes P C, et al. Adenosine 5'-triphosphate measurements in soils containing recently added glucose[J]. Soil Biology and Biochemistry, 1996, 28(8): 1099-1104. DOI:10.1016/0038-0717(96)00074-0
(  0) 0) |
| [33] |
Liang X Q. Soil colloidal phosphorus storage and loss control (In Chinese). Beijing: Science Press, 2020. [梁新强. 土壤胶体磷储存与流失阻控[M]. 北京: 科学出版社, 2020.]
(  0) 0) |
| [34] |
Keeler J. Understanding NMR Spectroscopy . John Wiley & Sons Ltd: Chichester, UK, 2005.
(  0) 0) |
| [35] |
Cade-Menun B J. Characterizing phosphorus in environmental and agricultural samples by 31P nuclear magnetic resonance spectroscopy[J]. Talanta, 2005, 66(2): 359-371. DOI:10.1016/j.talanta.2004.12.024
(  0) 0) |
| [36] |
Cade-Menun B J, Preston C M. A comparison of soil extraction procedures for 31P NMR spectroscopy[J]. Soil Science, 1996, 161(11): 770-785. DOI:10.1097/00010694-199611000-00006
(  0) 0) |
| [37] |
Cade-Menun B J, Liu C W, Nunlist R, et al. Soil and litter phosphorus-31 nuclear magnetic resonance spectroscopy: Extractants, metals, and phosphorus relaxation times[J]. Journal of Environmental Quality, 2002, 31(2): 457-465.
(  0) 0) |
| [38] |
Briceño M, Escudey M, Galindo G, et al. Comparison of extraction procedures used in determination of phosphorus species by 31P-NMR in Chilean volcanic soils[J]. Communications in Soil Science and Plant Analysis, 2006, 37(11/12): 1553-1569.
(  0) 0) |
| [39] |
Cade-Menun B, Liu C W. Solution phosphorus-31 nuclear magnetic resonance spectroscopy of soils from 2005 to 2013:A review of sample preparation and experimental parameters[J]. Soil Science Society of America Journal, 2014, 78(1): 19-37. DOI:10.2136/sssaj2013.05.0187dgs
(  0) 0) |
| [40] |
Cade-Menun B J, Berch S M, Preston C M, et al. Phosphorus forms and related soil chemistry of Podzolic soils on northern Vancouver Island. Ⅱ. The effects of clear-cutting and burning[J]. Canadian Journal of Forest Research, 2000, 30(11): 1726-1741. DOI:10.1139/x00-099
(  0) 0) |
| [41] |
Lu J, Wang H W, Hao H, et al. Optimizing the method for 31P-NMR analysis of organic phosphorus from wetland sediments (In Chinese)[J]. Spectroscopy and Spectral Analysis, 2013, 33(11): 3157-3161. DOI:10.3964/j.issn.1000-0593(2013)11-3157-05 [陆瑾, 王海文, 郝红, 等. 31P-NMR分析湿地沉积物有机磷的方法优化[J]. 光谱学与光谱分析, 2013, 33(11): 3157-3161.]
(  0) 0) |
| [42] |
McLaren T I, Smernik R J, Simpson R J, et al. Spectral sensitivity of solution 31P NMR spectroscopy is improved by narrowing the soil to solution ratio to 1:4 for pasture soils of low organic P content[J]. Geoderma, 2015, 257/258: 48-57. DOI:10.1016/j.geoderma.2015.02.004
(  0) 0) |
| [43] |
Ebuele V O, Santoro A, Thoss V. Phosphorus speciation by 31P NMR spectroscopy in bracken(Pteridium aquilinum(L.)Kuhn)and bluebell(Hyacinthoides non-scripta(L.)Chouard ex Rothm.)dominated semi-natural upland soil[J]. Science of the Total Environment, 2016, 566/567: 1318-1328. DOI:10.1016/j.scitotenv.2016.05.192
(  0) 0) |
| [44] |
Zhang W Q, Jin X, Ding Y K, et al. Composition of phosphorus in wetland soils determined by SMT and solution 31P-NMR analyses[J]. Environmental Science and Pollution Research, 2016, 23(9): 9046-9053. DOI:10.1007/s11356-015-5974-5
(  0) 0) |
| [45] |
Canet D. Nuclear magnetic resonance: Concepts and methods . John Wiley & Sons Ltd: Chichester, UK, 1996.
(  0) 0) |
| [46] |
McDowell R W, Stewart I, Cade-Menun B J. An examination of spin-lattice relaxation times for analysis of soil and manure extracts by liquid state phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Journal of Environmental Quality, 2006, 35(1): 293-302. DOI:10.2134/jeq2005.0285
(  0) 0) |
| [47] |
Turner B L, Mahieu N, Condron L M. Phosphorus-31 nuclear magnetic resonance spectral assignments of phosphorus compounds in soil NaOH-EDTA extracts[J]. Soil Science Society of America Journal, 2003, 67(2): 497-510. DOI:10.2136/sssaj2003.4970
(  0) 0) |
| [48] |
Cade-Menun B J. Improved peak identification in 31P-NMR spectra of environmental samples with a standardized method and peak library[J]. Geoderma, 2015, 257/258: 102-114. DOI:10.1016/j.geoderma.2014.12.016
(  0) 0) |
| [49] |
Young E O, Ross D S, Cade-Menun B J, et al. Phosphorus speciation in riparian soils: A phosphorus-31 nuclear magnetic resonance spectroscopy and enzyme hydrolysis study[J]. Soil Science Society of America Journal, 2013, 77(5): 1636-1647. DOI:10.2136/sssaj2012.0313
(  0) 0) |
| [50] |
Abdi D, Cade-Menun B J, Ziadi N, et al. Long-term impact of tillage practices and phosphorus fertilization on soil phosphorus forms as determined by 31P nuclear magnetic resonance spectroscopy[J]. Journal of Environmental Quality, 2014, 43(4): 1431-1441. DOI:10.2134/jeq2013.10.0424
(  0) 0) |
| [51] |
Brantley S L. Understanding soil time[J]. Science, 2008, 321(5895): 1454-1455. DOI:10.1126/science.1161132
(  0) 0) |
| [52] |
Walker L R, Wardle D A, Bardgett R D, et al. The use of chronosequences in studies of ecological succession and soil development[J]. Journal of Ecology, 2010, 98(4): 725-736. DOI:10.1111/j.1365-2745.2010.01664.x
(  0) 0) |
| [53] |
Huang L M, Thompson A, Zhang G L, et al. The use of chronosequences in studies of paddy soil evolution: A review[J]. Geoderma, 2015, 237/238: 199-210. DOI:10.1016/j.geoderma.2014.09.007
(  0) 0) |
| [54] |
Nelson L-A, Cade-Menun B J, Walker I J, et al. Soil phosphorus dynamics across a holocene chronosequence of aeolian sand dunes in a hypermaritime environment on Calvert Island, BC, Canada[J]. Frontiers in Forests and Global Change, 2020, 3. DOI:10.3389/ffgc.2020.00083
(  0) 0) |
| [55] |
Celi L, Cerli C, Turner B L, et al. Biogeochemical cycling of soil phosphorus during natural revegetation of Pinus sylvestris on disused sand Quarries in Northwestern Russia[J]. Plant and Soil, 2013, 367(1/2): 121-134.
(  0) 0) |
| [56] |
Spain A V, Tibbett M, Ridd M, et al. Phosphorus dynamics in a tropical forest soil restored after strip mining[J]. Plant and Soil, 2018, 427(1/2): 105-123.
(  0) 0) |
| [57] |
Luo J, Cheng G W, Li W, et al. Characteristics of nutrient biocycling of natural forests on the Gongga Mountain (In Chinese)[J]. Journal of Beijing Forestry University, 2005, 27(2): 13-17. DOI:10.3321/j.issn:1000-1522.2005.02.003 [罗辑, 程根伟, 李伟, 等. 贡嘎山天然林营养元素生物循环特征[J]. 北京林业大学学报, 2005, 27(2): 13-17.]
(  0) 0) |
| [58] |
Gholz H L, Wedin D A, Smitherman S M, et al. Long-term dynamics of pine and hardwood litter in contrasting environments: Toward a global model of decomposition[J]. Global Change Biology, 2000, 6(7): 751-765. DOI:10.1046/j.1365-2486.2000.00349.x
(  0) 0) |
| [59] |
Zhou J, Bing H, Wu Y, et al. Weathering of primary mineral phosphate in the early stages of ecosystem development in the Hailuogou Glacier foreland chronosequence[J]. European Journal of Soil Science, 2018, 69(3): 450-461. DOI:10.1111/ejss.12536
(  0) 0) |
| [60] |
Sun H Y, Wu Y H, Li N, et al. Microbial biomass phosphorus is closely linked to sodium bicarbonate extractable organic P in acid soil of Mt.Gongga (In Chinese)[J]. Mountain Research, 2017, 35(5): 709-716. [孙宏洋, 吴艳宏, 李娜, 等. 贡嘎山酸性土壤微生物量磷紧密关联碳酸氢钠提取态有机磷[J]. 山地学报, 2017, 35(5): 709-716.]
(  0) 0) |
| [61] |
Vitousek P M, Chadwick O A, Crews T E, et al. Soil and ecosystem development across the Hawaiian Islands[J]. GSA Today, 1997, 7: 1-8.
(  0) 0) |
| [62] |
Baumann K, Siebers M, Kruse J, et al. Biological soil crusts as key player in biogeochemical P cycling during pedogenesis of sandy substrate[J]. Geoderma, 2019, 338: 145-158. DOI:10.1016/j.geoderma.2018.11.034
(  0) 0) |
| [63] |
Yang Z J, Bing H J, Zhou J, et al. Variation of mineral composition along the soil chronosequence at the Hailuogou Glacier foreland of Gongga Mountain (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(3): 507-516. [杨子江, 邴海健, 周俊, 等. 贡嘎山海螺沟冰川退缩区土壤序列矿物组成变化[J]. 土壤学报, 2015, 52(3): 507-516.]
(  0) 0) |
| [64] |
Devau N, Cadre E L, Hinsinger P, et al. Soil pH controls the environmental availability of phosphorus: Experimental and mechanistic modelling approaches[J]. Applied Geochemistry, 2009, 24(11): 2163-2174. DOI:10.1016/j.apgeochem.2009.09.020
(  0) 0) |
| [65] |
Yan Y P, Wang X M, Liu F, et al. Progress in researches on interactions between organic phosphates and soil minerals and their environmental impacts (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(6): 1290-1299. [严玉鹏, 王小明, 刘凡, 等. 有机磷与土壤矿物相互作用及其环境效应研究进展[J]. 土壤学报, 2019, 56(6): 1290-1299.]
(  0) 0) |
| [66] |
Ruttenberg K C, Sulak D J. Sorption and desorption of dissolved organic phosphorus onto iron(oxyhydr)oxides in seawater[J]. Geochimica et Cosmochimica Acta, 2011, 75(15): 4095-4112. DOI:10.1016/j.gca.2010.10.033
(  0) 0) |
| [67] |
Yan Y P, Liu F Jr, Li W, et al. Sorption and desorption characteristics of organic phosphates of different structures on aluminium(oxyhydr)oxides[J]. European Journal of Soil Science, 2014, 65(2): 308-317. DOI:10.1111/ejss.12119
(  0) 0) |
| [68] |
Miller A J, Schuur E A G, Chadwick O A. Redox control of phosphorus pools in Hawaiian montane forest soils[J]. Geoderma, 2001, 102(3/4): 219-237.
(  0) 0) |
| [69] |
Gatiboni L C, Schmitt D E, Tiecher T, et al. Plant uptake of legacy phosphorus from soils without P fertilization[J]. Nutrient Cycling in Agroecosystems, 2021, 119(1): 139-151. DOI:10.1007/s10705-020-10109-2
(  0) 0) |
| [70] |
ouhami D, McDowell R W, Condron L M. Role of organic anions and phosphatase enzymes in phosphorus acquisition in the rhizospheres of legumes and grasses grown in a low phosphorus pasture soil[J]. Plants, 2020, 9(9): 1185. DOI:10.3390/plants9091185
(  0) 0) |
| [71] |
Yu X C, Liu Q, Li C J, et al. Rhizospheric processes and high substrate concentration stimulating mineralization of soil organic P in black earth (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 953-963. [于星辰, 刘倩, 李春杰, 等. 根际过程和高底物浓度促进黑土有机磷矿化[J]. 土壤学报, 2019, 56(4): 953-963.]
(  0) 0) |
| [72] |
Andrino A, Guggenberger G, Sauheitl L, et al. Carbon investment into mobilization of mineral and organic phosphorus by arbuscular mycorrhiza[J]. Biology and Fertility of Soils, 2021, 57(1): 47-64. DOI:10.1007/s00374-020-01505-5
(  0) 0) |
| [73] |
Achat D L, Bakker M R, Zeller B, et al. Long-term organic phosphorus mineralization in Spodosols under forests and its relation to carbon and nitrogen mineralization[J]. Soil Biology and Biochemistry, 2010, 42(9): 1479-1490. DOI:10.1016/j.soilbio.2010.05.020
(  0) 0) |
| [74] |
Achat D L, Morel C, Bakker M R, et al. Assessing turnover of microbial biomass phosphorus: Combination of an isotopic dilution method with a mass balance model[J]. Soil Biology and Biochemistry, 2010, 42(12): 2231-2240. DOI:10.1016/j.soilbio.2010.08.023
(  0) 0) |
| [75] |
Gaiero J R, Tosi M, Bent E, et al. Soil microbial communities influencing organic phosphorus mineralization in a coastal dune chronosequence in New Zealand[J]. FEMS Microbiology Ecology, 2021, 97(4): fiab034. DOI:10.1093/femsec/fiab034
(  0) 0) |
| [76] |
Wang J P, Wu Y H, Zhou J, et al. Carbon demand drives microbial mineralization of organic phosphorus during the early stage of soil development[J]. Biology and Fertility of Soils, 2016, 52(6): 825-839. DOI:10.1007/s00374-016-1123-7
(  0) 0) |
| [77] |
Stock S C, Köster M, Dippold M A, et al. Environmental drivers and stoichiometric constraints on enzyme activities in soils from rhizosphere to continental scale[J]. Geoderma, 2019, 337: 973-982. DOI:10.1016/j.geoderma.2018.10.030
(  0) 0) |
| [78] |
Song H X, Huang J J, Ge L M, et al. Interspecific difference in N: P stoichiometric homeostasis drives nutrient release and soil microbial community composition during decomposition[J]. Plant and Soil, 2020, 452(1/2): 29-42.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


