2. 南方海洋科学与工程广东省实验室(广州), 广州 511458;
3. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所), 南京 210008;
4. 西北农林科技大学资源环境学院, 陕西杨凌 712100;
5. 广西大学林学院, 南宁 530004
2. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China;
3. CAS Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Sciences, Chinese Academy of Sciences, Nanjing 210008, China;
4. College of Natural Resources and Environment, Northwest A & F University, Yangling, Shaanxi 712100, China;
5. College of Forestry, Guangxi University, Nanning 530004, China
土壤是地球环境的重要组成部分和人类赖以生存发展的基石。随着工业化、城市化和农业集约化的快速发展,土壤污染和退化呈现出以不同尺度和污染程度向区域性迅速蔓延的趋势,影响粮食安全和环境质量[1]。当前,我国耕地土壤重金属污染点位超标率为19.4%,污染面积约为2.6千万hm2,其中镉(Cd)、汞(Hg)、砷(As)、铜(Cu)、铅(Pb)、铬(Cr)、锌(Zn)、镍(Ni)是最主要的无机污染物[1],且农田土壤重金属含量仍存在明显的累积趋势[2]。例如,农田表层土壤Cd含量仍以0.004 mg·kg–1·a–1的速度增长[3],按照该速度,在未来50年后土壤Cd含量很可能超过农用地土壤污染风险筛选值0.3 mg·kg–1(土壤pH≤5.5,GB15618-2018[4])。总体而言,我国土壤重金属污染问题已十分严重,如不尽早采取监测、防控和修复措施,其不仅会随食物链对人畜健康造成巨大的威胁,还会引起土壤生物种群结构、功能甚至遗传多样性发生改变,从而导致土壤生态系统的退化并危及生态系统健康[5-6]。然而,我国尚缺乏有效保护土壤生物安全和生态系统健康的生态风险评估方法[7]。因此,充分认识重金属与土壤生物的相互作用机制,预知土壤重金属污染引起的生态效应,是科学有效地开展土壤污染防控与治理修复的重要前提[8]。
土壤酶主要是由微生物、细根、土壤动物分泌或释放的具有催化活性的蛋白质,其参与有机质分解、土壤微生物能量和营养获取、污染物降解等重要的生态过程[9]。近一个世纪以来,土壤酶活性分析一直是土壤生物化学和微生物学研究的重要手段之一,其不仅能够反映土壤生化反应的强弱,还可作为重要的生物学指标来监测人为活动(农林业管理措施、土壤污染等)对土壤微生物功能的影响[10]。土壤酶作为指标的优势在于测定简便、反应灵敏,能够较早预测重金属毒害下土壤养分和质量的变化过程[11];另一方面能避免重金属含量、生物有效性及土壤缓冲容量等在重金属毒性评价中出现的结果不一致的问题[12]。采用土壤酶表征土壤重金属生态毒理效应最直接有效的方法,就是建立土壤酶活性与污染物间的剂量-效应关系,从而确定重金属对土壤酶的毒性(即生态毒理学评价)。然而,由于研究方法、供试土壤、老化时间等因素的不同,造成重金属对土壤酶毒性效应差异较大,且不同研究结果之间难以比较[13],导致土壤酶在土壤重金属生态毒性评价的实际应用中存在困难。
基于此,本文系统地总结重金属对土壤酶的生态毒性效应、酶促反应的作用机理及影响因素,进而构建重金属影响土壤酶活性的概念模型,并深入剖析土壤酶作为预测土壤重金属污染的生物学指标面临的挑战及未来展望,以期促进土壤酶在反映土壤微生物功能受害程度的重金属污染监测、预警体系中的应用,对较早预知重金属毒害下土壤养分及环境质量的变化和认识生态环境退化过程具有重要意义。
1 重金属对土壤酶活性的影响重金属对土壤酶活性的影响一般通过生态剂量值(ecological dose,ED)来评估(表 1)[14],ED可作为土壤重金属生态安全阈值[15]。研究人员通常采用ED10和ED50(土壤酶活性降低10%和50%时重金属的含量或浓度),表示土壤酶受重金属轻微或重度污染时的量。梳理文献资料可见,土壤酶活性对重金属胁迫的响应受到重金属和酶的自身特性以及土壤性质的影响:
|
|
表 1 镉对土壤酶毒性的生态剂量值 Table 1 Ecological dose(ED)of Cd for soil enzymes |
(1)重金属元素自身特性的差异。对欧洲黄土脱氢酶的研究[16]表明,以外源添加重金属的总量为基准,Hg和Cu的毒性最强(ED50为2和35 mg·kg–1),Cr(Ⅵ)、Cr(Ⅲ)、Cd、Ni、Zn、As毒性次之(ED50在71和168 mg·kg–1之间),钴(Co)和Pb的毒性最弱(ED50分别为582和652 mg·kg–1);然而以土壤溶液中重金属的浓度为基准,Hg、Pb、Cu毒性最强,Cd、Zn、Cr(Ⅲ)、Ni毒性次之、Co、As、Cr(Ⅵ)毒性最弱。这主要取决于重金属离子在土壤中的含量、价态以及理化性质,例如低剂量刺激效应,重金属盐的溶解性,与土壤颗粒、酶分子巯基、胺基和羧基的结合能力、伴随阴离子类型等[17-18]。
(2)不同酶类对重金属胁迫响应的差异。相比参与碳循环的酶类,参与氮、硫循环的酶对重金属的毒性更为敏感[19-20]。通过整合全球范围内有关Cd影响土壤酶活性的研究发现,Cd对不同类型酶活性的ED50存在2倍~100倍的差异(表 1)。究其原因可能是因为土壤酶自身对重金属离子的敏感程度不同。
(3)不同土壤中同一酶类对重金属胁迫响应的差异。有研究[21]发现,在酸性土壤中芳基硫酸酯酶对Cr(Ⅵ)更敏感,而碱性土壤中芳基硫酸酯酶不敏感。针对我国不同类型土壤的研究[22-23]发现,Hg对脲酶、脱氢酶的毒性(ED10)在不同类型土壤中分别相差10倍和23倍;Cr(Ⅲ)对这两种酶的ED10分别相差133倍和91倍;Cd对同一种酶的ED50同样存在2倍~100倍的差异(表 1)。
可见,对特定种类的重金属和土壤酶而言,酶活性与重金属ED50之间可能存在一定的数量关系,但环境中的生物和非生物因素导致两者的关系十分复杂,例如以磷酸酶活性为测试终点建立的土壤性质与Cd-ED50回归模型中,模型的决定系数较低(R2 < 0.5),难以通过土壤性质准确预测外源Cd对磷酸酶活性的影响[24]。主要是因为土壤理化性质不仅影响重金属的有效性,同时还会影响酶的物理和化学性质,导致其对重金属的敏感性随之改变。已有研究[24-25]表明土壤有机碳、黏粒、阳离子交换量、pH是影响重金属抑制磷酸酶、脱氢酶、硝化活性、Fe(Ⅲ)还原活性的主控因素。除了土壤性质对重金属毒性的缓冲作用外,土壤微生物群落的特异性也是重要的影响因素[26]。例如,土壤细菌群落多样性特征决定了不同土地利用方式下碱性磷酸酶对Cd胁迫的响应程度[17]。因此,毒理学测试中表观酶活性对重金属毒性的响应可认为是自身敏感性(包括土著微生物群落对重金属的抗性或适应性[27])和土壤性质共同作用的结果。然而,不同土壤类型中酶对重金属毒性的响应机理,以及土壤生物和非生物因子在其中所起的作用尚缺乏深入的认识,上述问题的回答对采用土壤酶评价重金属的生态毒性十分重要。
2 重金属对土壤酶促反应的作用机理当存在可逆抑制剂时,大多数单底物酶促反应仍然符合米氏方程,因此通过酶最大速度(Vmax,mmol·L–1·h–1)和酶-底物解离常数(Km,mmol·L–1)的变化可以判断抑制类型(表 2)[36]。在纯酶反应体系中,当酶浓度([E0],mmol·L–1)已知时,还可求出催化速度常数(kcat,h–1),其物理意义为酶的每个活性部分在单位时间内催化底物反应的分子数。在复杂的环境条件中,例如土壤、凋落物、水体等,某一催化反应均由同工酶共同催化完成,因此测定的Vmax和Km被称之为表观最大反应速度和表观亲和力常数。此外,通过理论公式推导可知,采用表观酶活性获得的ED50受到抑制常数、底物浓度以及米氏常数的影响(表 2)[37]。由此可见,抑制动力学参数能直接反映土壤酶对重金属毒性的敏感性,可能较表观酶活性更能准确地监测重金属的生态毒性。
|
|
表 2 酶动力学参数对重金属生态剂量值的影响 Table 2 Effect of the kinetic parameters of enzyme on the ecological dose |
对现有研究的分析发现,重金属对土壤酶活性存在低剂量激活和高剂量抑制现象,且重金属对土壤酶的抑制作用属于可逆抑制范畴[36]。
(1)重金属对土壤酶的抑制机理取决于重金属种类、价态和土壤酶类型。As[38]、Cr[39]、Cu[40]和Hg[41]对土壤酶主要以竞争型抑制、非竞争型或线性混合型抑制为主;Cd[42]和Pb[43]对土壤酶主要以反竞争型抑制、非竞争型或线性混合型抑制为主。
(2)土壤类型和土壤肥力对抑制机理存在影响。Hg对黑土和草甸棕壤脲酶的作用属于反竞争型抑制[44];而对塿土脲酶为非竞争型抑制[41]。在高肥力风沙土中Cr(Ⅵ)对碱性磷酸酶为非竞争型抑制,而在低肥力风沙土中呈反竞争型抑制[45]。
(3)已有研究主要针对少数的重金属As、Cd、Cr、Cu、Hg、Pb,且重金属复合作用下的机理缺少研究[46-47]。对于其他重要的或新兴重金属污染物,如银(Ag)、Zn、锑(Sb)、Ni、铊(Tl)等以及重金属纳米态单质和化合物的研究十分匮乏[20,48-50]。
(4)当前研究仅针对脲酶[44]、磷酸酶[51]、脱氢酶[35]等少数酶类,对其他土壤酶较少涉及。尤其是对于重金属胁迫下,参与碳水化合物(纤维素水解酶、半纤维素水解酶、几丁质酶、转化酶等)、蛋白质(亮氨酸氨基肽酶等)、硫化合物(芳基硫酸酯酶)水解的酶和氧化还原酶(多酚氧化酶、过氧化氢酶等)的响应尚缺乏深入研究。
3 影响重金属对土壤酶作用的因素 3.1 酶活性测定体系影响土壤酶对重金属毒性的响应测定温度的影响:酶动力学参数受到温度的影响,因此测定温度的变化可能潜在影响重金属对酶的作用[51]。仅有的研究[51-52]表明,升温增加Cd对碱性磷酸酶以及Hg对脲酶的抑制作用,但抑制机理均未改变,可能是因为升温促进了酶和重金属离子之间的螯合,从而增强重金属对土壤酶的毒性。
测定体系pH的影响:酶蛋白的氨基酸残基在较高的pH条件下会去质子化,促使酶分子与重金属离子相互作用,从而增强重金属对酶活性的抑制效应[53]。已有研究[54]发现As(Ⅴ)对矿物吸附态碱性磷酸的抑制机理不随pH(7~10)发生改变,但其毒性随着pH升高而加强,在pH 10的条件下ED10为pH 7的3倍~11倍。Cu对土壤颗粒和矿物吸附态酸性磷酸酶的毒性随测定体系pH升高而加强,但抑制机理同样未发生变化[53]。类似的结论也在Hg、Cd对塿土脲酶的毒理学研究中出现[55]。然而,也有研究[56]表明Zn对吸附态酸性磷酸酶的毒性随pH升高而增强,对针铁矿和高岭石吸附态酶的抑制机理不变,但对土壤颗粒吸附态酶的作用从反竞争型抑制(pH 5)变为部分非竞争型抑制(pH 6),这有可能是pH变化诱导酶的化学性质或空间结构发生改变,从而影响酶对金属离子的亲和力(Ki、Kiu),产生不同的抑制机制。
底物的影响:根据可逆抑制动力学(表 2)可知,底物浓度变化会影响重金属对酶的毒性,在竞争型抑制和以竞争型抑制为主的线性混合型抑制中,底物浓度增加会降低重金属对酶活性的毒性;反竞争型抑制中,底物浓度增加反而会增加重金属的毒性效应[37]。例如,当底物浓度增加9倍,As(Ⅴ)对不同类型土壤碱性磷酸酶的ED10为原来的1.4倍~5.8倍,是因为As(Ⅴ)对碱性磷酸酶的作用属于竞争型抑制以及竞争型抑制占主导的线性混合型抑制,且底物效应随土壤类型的不同而变化[38]。也有研究[57]表明,尽管Hg、Cd对塿土脲酶活性的抑制主要属于非竞争型抑制,但随尿素浓度增加,重金属的抑制作用也更明显。这显然与上述理论不符,研究者利用酶活性与重金属浓度的拟合方程求导后得到的变浓抑制率(去除重金属浓度变化的影响)发现,Hg、Cd对脲酶的变浓抑制率随尿素浓度升高而增加,主要是酶活性随底物浓度增加的缘故[58]。
室内测定酶活性通常采用一个特定的底物浓度当作饱和底物浓度,但研究[59]发现当土壤类型不同时,测定同一种酶所需的饱和底物浓度并不一致。由此可见,测定酶活性时采用底物浓度的大小,会直接影响重金属对酶的作用,这也是不同研究中,酶活性对同一重金属毒性响应存在差异的原因之一。此外,土壤中实际存在的底物浓度远低于实验室测定酶活性所用的浓度[60],此时实验室获得的重金属对酶活性的抑制率,可能高估或低估其真实毒性。以全国不同土壤类型为基础的研究[38,42]发现,酶的一级反应速度常数和Vmax/Km对重金属毒性的响应较酶活性更为敏感,且ED-Vmax/Km在不同土壤类型之间的变异系数更小。此外,作者前期的研究[35]发现,采用的底物不同(即酶对底物的亲和力不同)也会影响土壤氧化还原酶对Cd毒性的响应,但底物不同是否会影响重金属对水解酶的毒性尚不清楚。
由此可见,在抑制机制、抑制常数(Ki和Kiu)、底物类型(Km)和浓度([S])不清楚的情况下,采用单一底物浓度测定的表观酶活性来衡量重金属毒性(比如抑制率),可能会带来两种后果,一方面会错误地估计重金属对酶的毒性阈值;另一方面不同研究获得的毒性阈值缺乏可比性。因此,阐明重金属对土壤酶的抑制机理,是解决这一问题的关键所在。
3.2 老化过程影响土壤酶对重金属毒性的响应重金属对土壤酶抑制动力学的研究均采用急性毒性研究模式,即重金属加入土壤后1~24 h内测定土壤酶活性的变化,这里的前提是土壤酶库(或总量)和性质未受到微生物变化(如细胞分裂、凋亡)的影响。然而,在老化过程中重金属有效态、微生物群落、酶均会发生改变,酶动力学参数可能受到重金属、微生物、土壤性质三者交互作用的影响,从而影响重金属对酶的作用程度和机理[61]。例如,土壤含水量的变化会改变氧化还原电位、重金属有效性和价态、微生物活性等,从而直接或间接影响重金属对土壤酶的毒性。室内模拟研究[62]表明,水稻土在最大持水量的35%(干燥)和65%(湿润)时,有效As含量和酶活性显著高于淹水(110%)条件,但淹水增强了As对土壤碱性磷酸酶的毒害。通过动力学的分析发现,干燥和湿润条件下As(Ⅴ)影响碱性磷酸酶活性的机理为完全竞争型抑制,处于淹水(110%)时则为以非竞争型抑制为主的线性混合抑制,且增强了As(Ⅴ)与碱性磷酸酶的亲和力[63]。该实验还发现土壤含水量的不同会影响老化过程中As的毒性,在淹水条件下ED10随老化时间呈现先增加后降低的趋势[62],但老化过程As对磷酸酶的抑制机理未改变,淹水条件下As毒性随老化时间而增强,可能是因为厌氧环境本身抑制了磷酸酶活性[63]。
以上研究表明,老化过程中重金属对土壤酶的毒性以及土壤酶动力学特征均会随着老化条件的不同而发生改变,然而酶动力学参数对重金属浓度增加的响应趋势与急性毒性条件下类似[63]。因此,推测尽管土壤中酶的性质可能发生改变,但急性毒性测试下获得的重金属对酶的毒性机制,在一定程度上能够推断实地污染土壤中酶对重金属毒性的响应机制;另一方面,老化过程重金属对酶抑制程度,可能取决于重金属的有效性、微生物群落的抵抗力和恢复力、胞外酶的特性(例如同工酶的比例、抗性酶、土壤中酶库的大小等)[13]。
3.3 土壤性质影响土壤酶对重金属毒性的响应土壤矿物和有机分子的影响:酶在土壤中通常以不同的方式与各种土壤矿物、有机颗粒等结合在一起,形成黏土矿物-酶、黏粒-有机质-酶复合物等[64]。土壤矿物、有机分子一方面保护酶免受外界不良条件的干扰而失活,同时也改变了酶的空间结构和活性[65-66],影响重金属对土壤酶的作用。在酶与黏土矿物或有机分子的吸附过程中作用力的不同组合(阳离子交换、库仑力、羟基配位交换、疏水力、氢键等),以及体系pH、温度、共存阴阳离子的不同,均会导致酶在吸附载体表面的排布方式及构型发生改变,致使不同吸附态酶的活性、稳定性以及动力学等一系列酶学性质存在较大差异[64]。例如,与游离酶相比,酸性磷酸酶-蒙脱石和酸性磷酸酶-单宁酸络合物对温度的敏感性较高,但抗蛋白酶水解的能力更强[67]。金属离子的存在会影响固定化酶的催化特性,Fe(Ⅲ)能够保持有机酸-脲酶复合物的构象和催化特征,增强其催化尿素水解的能力[68]。
因此,存在重金属胁迫时,不同状态的土壤酶可能会表现出不同的响应特征,因为酶与不同土壤颗粒形成的复合体具有不同的表面电荷、表面积、官能团种类及浓度等,导致被吸附的酶呈现出不一致的敏感性或动力学特征[64]。已有研究[53]表明,土壤颗粒和高岭石吸附态磷酸酶较针铁矿和MnO2吸附态磷酸酶对Cu的毒性更敏感,但抑制机理均属于反竞争型抑制。然而,As(Ⅴ)对游离态碱性磷酸酶为竞争型抑制,而对黏土矿物吸附态碱性磷酸酶为竞争型或线性混合型抑制[69]。Cu和Zn对土壤黏土矿物吸附态酸性磷酸酶属于反竞争型抑制,高岭石吸附态酸性磷酸酶属于部分非竞争型或者反竞争型抑制[53,70]。上述研究结果表明,采用土壤酶活性来评价重金属的毒性时,土壤中各状态胞外酶的比例不同,可能导致在不同类型土壤中酶活性对重金属胁迫不一致的现象(表 1)。然而,尚缺乏通过有机颗粒、矿物-有机颗粒吸附态酶模拟研究酶对重金属胁迫的敏感性或响应机制。
有机质含量的影响:通过Cd、Hg、As对土壤酶的ED50与土壤性质的多元回归模型发现,土壤有机质含量是控制重金属毒性的重要因素之一[22,38,42],因为土壤有机质含量越高,土壤对酶的保护和对重金属毒性的缓冲作用越强。但也有研究[71]发现土壤中水溶性有机质含量的增加,可能降低游离酸性磷酸酶的Vmax,但增加Km。重金属存在的情况下,有机质含量高的土壤能够降低Cr(Ⅵ)对碱性磷酸酶的毒性,但在不同土壤类型中呈现不同的抑制机理[45]。在高有机质含量的风沙土中Cr(Ⅵ)对碱性磷酸酶为非竞争型抑制,在低有机质含量的风沙土中呈反竞争型抑制,但在黄绵土和褐土中有机质含量的变化不影响抑制机制[45]。
土壤pH的影响:室内模式实验[53-55]表明,测试体系缓冲液pH变化会影响重金属的毒性,但很少会改变抑制机理。以不同类型土壤(pH 4.9~8.8)为基础的急性毒性测试表明,土壤pH是影响Cd、As对土壤酶毒性的主要控制因子,也发现抑制机理随土壤类型发生变化,但很难采用土壤的pH来区分抑制方式[42,51]。
4 酶学指标评价重金属的生态毒性土壤酶并非个体,不受种群等尺度约束,可反映整个环境的功能效应[43]。对于某一种酶而言,在不同污染物剂量或浓度下产生的生态效应可用剂量-效应曲线来描述,因此研究者通常采用单一酶或一类酶活性作为指标来指示重金属污染程度。但对于整个土壤生化过程而言,由于土壤的复杂性和酶的敏感性不同,要精确描述其对污染物胁迫的反应和变化十分困难[72]。有学者利用多个酶活性的几何平均值、加权平均值等数学模型计算出一个综合的酶学指标来反映土壤污染程度[73-75],然而这些方法忽略了土壤理化性质对重金属生物有效性和酶特性的影响,更未考虑不同酶对重金属毒性敏感性的差异。也有研究[76]认为参与碳、氮、磷循环限速酶的化学计量比能灵敏地反映重金属胁迫下微生物群落的代谢限制,从而预测重金属污染对生态系统功能的影响。在建立污染物对土壤生态风险的影响时应考虑参与所有土壤生化反应的酶,但土壤中酶的种类众多,且对外界的响应迥异,如何整合是当前存在的难题[9]。
运用土壤性质和毒害阈值的经验关系指导环境质量标准的制定,是当前土壤环境质量风险评估的重要研究内容[77]。影响重金属生物有效性的土壤主控因子与土壤微生物毒害终点的量化表征不断受到研究者的重视[78],例如基于土壤酶活性,量化了Cd、Hg、As的ED50与土壤性质的关系[25,30,42]。但利用有限的毒理学数据,建立旨在保护整个土壤生态系统阈值的重要前提是考虑土壤性质及土壤酶自身敏感性的差异[79]。物种敏感性分布法(species sensitive distribution,SSD),假设生态系统中不同物种对某一污染物的敏感性能够被一个分布函数(例如BurrIII、log-normal、log-logistic、Weibull、Gamma)所描述,可以通过上述分布函数拟合不同生物测试获得的毒性阈值(ED10、L(E)D50等),获得污染物对不同物种产生影响的概率[80]。该方法既可从污染物环境浓度出发,计算其对各类土壤酶活性潜在的影响比例,用以表征生态系统或者不同类别生物面临的生态风险;亦可通过归一化的方法消除土壤性质的差异,反向用于确定一定保护程度的污染物浓度[79]。已有研究[81-82]基于SSD与重金属生物毒性阈值、农作物富集系数的结合,建立了对应不同土壤条件下的重金属生态阈值,但是基于土壤微生物、酶活性对重金属的生态风险评价的研究尚十分欠缺。根据表 1中的数据,采用每个酶对应的最小ED50值,通过BurrIII和log-normal函数拟合出土壤中镉SSD曲线(图 1)可知,不同酶对Cd毒性的敏感程度存在很大的差异,利用这两个模型可获得保护土壤中95%的酶活性的危害浓度HC5(hazardous concentration),分别为3.1和4.5 mg·kg–1。尽管此次模拟尚未考虑土壤性质和测定底物的影响,以及可参与计算的酶种类较少,但该数值仍然十分接近我国农用地土壤污染风险管制值(pH > 6.5,3.0~4.0 mg·kg–1,GB 15618-2018[4])。未来可考虑纳入更多的土壤类型和生物学指标(微生物群落、土壤呼吸、土壤动物等),获得更为准确的HC5,进而量化毒性阈值与土壤性质之间的关系。此外,利用该技术手段能避免在重金属评价中酶的选择问题,可通过广泛测定参与关键元素循环的酶类或者土壤生物类群,更为全面地反映元素生物地球化学过程对重金属污染的响应。

|
图 1 土壤酶对镉污染敏感性的分布曲线 Fig. 1 Sensitive distribution of soil enzymes to the toxicity of cadmium contamination in soil |
通过对前人研究的总结,本文构建了重金属对土壤酶影响的概念模型(图 2):
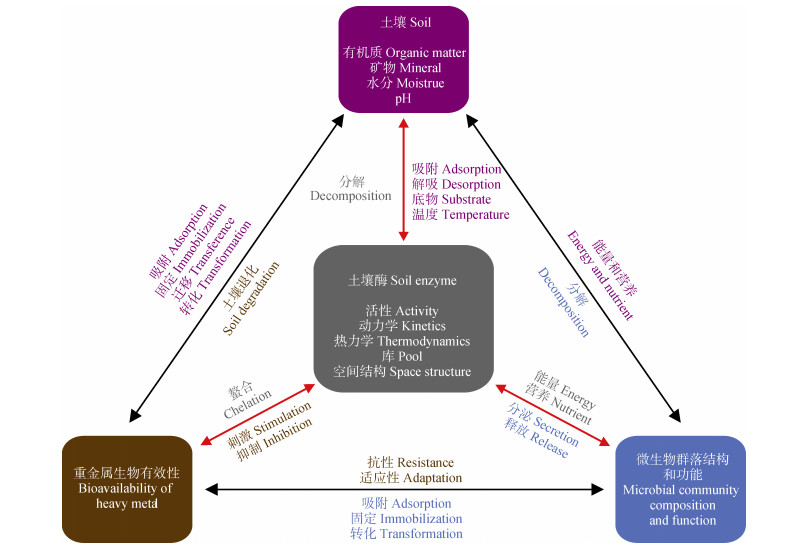
|
图 2 环境因子和重金属对土壤酶作用的概念模型 Fig. 2 Mechanistic framework to explain the effects of abiotic and biotic factors on soil enzyme |
(1)红色箭头的指向关系表示直接影响(或急性毒性),重金属对土壤酶的作用方式以及动力学参数受环境因子影响的途径。重金属对土壤酶的毒害主要是受重金属有效性、酶的自身敏感性(Ki、Kiu)、底物性质(Km)和浓度的影响。酶的自身敏感性很可能取决于微生物对当地环境的长期适应性,然而这一假说尚需要实证研究进行检验。此外,由于土壤中胞外酶的具体数量(库)仍然难以查明,阻碍了对其他酶动力学参数的计算,kcat(底物转化为产物的催化常数)和kcat/Km这两个参数可衡量或对比同一酶催化下不同底物的周转速率和周转时间(1/kcat)[83]。
(2)黑色箭头的指向关系代表间接影响(例如老化),重金属如何通过改变土壤理化性质以及土壤微生物群落结构和功能,间接影响土壤酶对重金属毒性的响应。在老化过程中,重金属形态和价态、微生物群落结构与生理特征以及土壤理化性质均会发生变化,上述因子的改变可能会影响土壤酶的量、存在状态和催化特性(Ki、Kiu和Km)。但不同重金属浓度污染下的动力学参数的变化,不能反映抑制机理,尽管在长期污染土壤的研究中也发现酶动力学参数Vmax和Vmax/Km与重金属含量的关系呈现出与急性毒性类似的趋势[84]。此时,动力学参数仅能作为重金属毒性的指标或者潜在指出重金属毒害下酶活性变化的原因[84],例如Vmax和Km的变化可能是微生物群落结构或分泌酶量的改变而引起的。然而,目前尚缺乏对重金属毒害下微生物活性和功能的了解,例如碳利用效率、元素循环、抵抗力和恢复力等[85-86],导致不能建立微生物和胞外酶之间的直接联系。
(3)酶活性测定方法、土壤性质等均可影响重金属对酶的作用机制,在作用机制不清楚的情况下,仅采用酶表观活性获得毒性阈值不能准确反映重金属的毒性,而且也不能对不同实验室得出的结果进行比较。因此,建立标准的酶活性测定方法和毒理学实验方案(长期或者短期)是解决该关键问题的核心,例如,采用统一的底物、最适底物浓度、培养温度、测试pH,尽可能获得抑制动力学参数(Ki、Kiu和Km)等。特别是动力学参数属于酶的本质特性,其不受底物浓度的影响。由于测定土壤酶动力学的过程相对繁琐,诸多研究仅限于采用表观酶活性作为测试终点,这阻碍了土壤酶学指标在生态毒理学评价中的应用。
5.2 新技术的应用随着现代分析技术的发展,荧光光谱(FS)、圆二色谱(CD)、傅里叶变换红外光谱(FTIR)、X射线吸收精细结构技术(XAFS)已用来解析酶活力与酶分子构象的稳定性和完整性的关系,检测蛋白质和多肽的二级和三级构象及其变化,定性和定量分析蛋白质二级结构,判断酶分子不同化学官能团与金属离子的亲和力大小[87]。上述技术可提供酶与重金属结合后其分子构象和表面功能团的信息,进而充分了解重金属导致土壤酶活性变化的内在原因和机理。目前,有关重金属对土壤颗粒-酶活性的影响已有零星报道,但从分子水平对这些作用过程和机理的认识还不够完善[64]。有必要对重金属与酶-土壤颗粒复合体的相互作用机理进行深入研究,阐明其分子互作机制,不仅能更真实地反映重金属在土壤环境中的毒性特征,而且对于揭示土壤中重金属的环境行为具有重要的理论和实际意义。尽管实际环境中的情况更为复杂,纯土壤矿物或有机质与酶作用的情况较少发生,但可为更复杂体系的研究提供基础。
此外,新兴酶学测定技术的出现促进了土壤酶存在状态的研究。酶谱法能够清晰地展现根际酶活性和蛋白质积累的空间分布,从而查明重金属对植物根际土壤酶活性的影响[88]。微量渗透技术(microdialysis)可区别游离酶和吸附态酶的大致比例,以及酶蛋白的时空动态,有助于加深酶对重金属响应机理的认识[89]。荧光法和商业酶试剂盒可实现室内、野外快速测定多种酶活性及动力学特征,并建立综合性的酶学指标[90]。宏蛋白组技术可探索特定物种或微生物的出现与土壤酶之间的关系,进而有助于理解胞外酶活性变化的原因[91]。
5.3 展望高强度的化肥施用、污水灌溉现象依然存在,导致短期内很难完全不向农田引入重金属,一旦其进入土壤后难以清除,且其毒害效应具有隐蔽性、长期性、不可逆性等特点。因此,建立一个灵敏的、可直接反映土壤生物受害程度的土壤重金属污染监测、预警体系,仍然是当前合理计划和使用土壤资源的首要任务之一[7]。尽管土壤酶活性可作为衡量重金属影响土壤健康的生物学指标,但重金属对土壤酶的生态毒理研究尚存在以下不足:(1)土壤酶的选择难以达成统一的标准。即在不同甚至是相似的土壤条件下,土壤酶对重金属毒性的响应不一致,可能是因为土壤酶自身敏感性的不同[35],或者长期污染情况下微生物群落对重金属污染的抗性不一致造成的[92]。(2)基于表观酶活性推算的ED可能高估或低估重金属毒性,且不同研究之间缺乏可比性,导致对不同地区的研究结果进行整合分析存在困难。(3)难以通过土壤酶活性建立重金属毒性阈值(ED)与土壤物理化学性质及土壤重金属有效性之间的定量关系,是因为很多研究未考虑或较少考虑到重金属对酶的抑制机理、底物性质和浓度的影响。要回答上述问题未来的研究应从以下方面加以深化:(1)土壤中主要酶类对重金属,特别是对新型重金属材料毒性响应的机制;(2)建立统一的方法或标准测定土壤酶活性、动力学,确保重金属毒性阈值的准确性以及增加不同研究结果的可比性;(3)重金属老化过程中,土壤微生物群落如何影响土壤酶及其对重金属的响应;(4)建立一个综合的酶学指标来反映土壤污染程度;(5)微生物群落结构和功能对重金属污染产生抵抗力和恢复力的机制;(6)微生物群落及其胞外酶对重金属污染的反馈是否影响重金属的环境行为,如价态转化、吸附解吸等。
致谢 感谢贵州大学刘克副教授、中国科学院南京土壤研究所丁昌峰副研究员对物种敏感性分布模型计算的指导。
| [1] |
Zhao F J, Ma Y B, Zhu Y G, et al. Soil contamination in China: Current status and mitigation strategies[J]. Environmental Science & Technology, 2015, 49(2): 750-759.
(  0) 0) |
| [2] |
Zeng X B, Xu J M, Huang Q Y, et al. Some deliberations on the issues of heavy metals in farmlands of China (In Chinese)[J]. Acta Pedologica Sinica, 2013, 50(1): 186-194. [曾希柏, 徐建明, 黄巧云, 等. 中国农田重金属问题的若干思考[J]. 土壤学报, 2013, 50(1): 186-194.]
(  0) 0) |
| [3] |
Luo L, Ma Y B, Zhang S Z, et al. An inventory of trace element inputs to agricultural soils in China[J]. Journal of Environmental Management, 2009, 90(8): 2524-2530. DOI:10.1016/j.jenvman.2009.01.011
(  0) 0) |
| [4] |
生态环境部. 土壤环境质量农用地土壤污染风险管控标准(试行): GB 15618-2018[S]. 北京: 中国环境出版社, 2018. Ministry of Ecology and Environment of the People's Republic of China. Soil environmental quality risk control standard for soil contamination of agricultural land: GB 15618-2018[S]. Beijing: China Environmental Science Press, 2018. (  0) 0) |
| [5] |
Srivastava V, Sarkar A, Singh S, et al. Agroecological responses of heavy metal pollution with special emphasis on soil health and plant performances[J]. Frontiers in Environmental Science, 2017, 5: Article 64. DOI:10.3389/fenvs.2017.00064
(  0) 0) |
| [6] |
Zhang T L, Wang X X. Prevention and remediation of soil contamination to strengthen the foundation for green and high-quality agricultural development in China (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(2): 251-258. [张桃林, 王兴祥. 推进土壤污染防控与修复厚植农业高质量发展根基[J]. 土壤学报, 2019, 56(2): 251-258.]
(  0) 0) |
| [7] |
Luo Y M, Teng Y. Research progresses and prospects on soil pollution and remediation in China (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(5): 1137-1142. [骆永明, 滕应. 中国土壤污染与修复科技研究进展和展望[J]. 土壤学报, 2020, 57(5): 1137-1142.]
(  0) 0) |
| [8] |
Zhu Y G, Peng J J, Wei Z, et al. Linking the soil microbiome to soil health (In Chinese)[J]. Scientia Sinica Vitae, 2021, 51(1): 1-11. [朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学: 生命科学, 2021, 51(1): 1-11.]
(  0) 0) |
| [9] |
Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234. DOI:10.1016/j.soilbio.2012.11.009
(  0) 0) |
| [10] |
Rao M A, Scelza R, Acevedo F, et al. Enzymes as useful tools for environmental purposes[J]. Chemosphere, 2014, 107: 145-162. DOI:10.1016/j.chemosphere.2013.12.059
(  0) 0) |
| [11] |
Zhou Q X, Wang M E. Researching advancement and prospect of soil ecotoxicology (In Chinese)[J]. Asian Journal of Ecotoxicology, 2006, 1(1): 1-11. [周启星, 王美娥. 土壤生态毒理学研究进展与展望[J]. 生态毒理学报, 2006, 1(1): 1-11.]
(  0) 0) |
| [12] |
He W X, Chen H M, Feng G Y, et al. Study on enzyme index in soils polluted by mercury, chromium and arsenic (In Chinese)[J]. Acta Scientiae Circumstantiae, 2000, 20(3): 338-343. [和文祥, 陈会明, 冯贵颖, 等. 汞铬砷元素污染土壤的酶监测研究[J]. 环境科学学报, 2000, 20(3): 338-343.]
(  0) 0) |
| [13] |
Vig K, Megharaj M, Sethunathan N, et al. Bioavailability and toxicity of cadmium to microorganisms and their activities in soil: A review[J]. Advances in Environmental Research, 2003, 8(1): 121-135. DOI:10.1016/S1093-0191(02)00135-1
(  0) 0) |
| [14] |
Speir T W, Kettles H A, Parshotam A, et al. A simple kinetic approach to derive the ecological dose value, ED50, for the assessment of Cr(Ⅵ)toxicity to soil biological properties[J]. Soil Biology and Biochemistry, 1995, 27(6): 801-810. DOI:10.1016/0038-0717(94)00231-O
(  0) 0) |
| [15] |
Moreno J L, Garcı́a C, Landi L, et al. The ecological dose value(ED50)for assessing cd toxicity on ATP content and dehydrogenase and urease activities of soil[J]. Soil Biology and Biochemistry, 2001, 33(4/5): 483-489.
(  0) 0) |
| [16] |
Welp G. Inhibitory effects of the total and water-soluble concentrations of nine different metals on the dehydrogenase activity of a loess soil[J]. Biology and Fertility of Soils, 1999, 30(1/2): 132-139.
(  0) 0) |
| [17] |
Fan D W, Wang S Y, Guo Y H, et al. The role of bacterial communities in shaping cd-induced hormesis in 'living' soil as a function of land-use change[J]. Journal of Hazardous Materials, 2021, 409: 124996. DOI:10.1016/j.jhazmat.2020.124996
(  0) 0) |
| [18] |
Tian H X, Kong L, Megharaj M, et al. Contribution of attendant anions on cadmium toxicity to soil enzymes[J]. Chemosphere, 2017, 187: 19-26. DOI:10.1016/j.chemosphere.2017.08.073
(  0) 0) |
| [19] |
Deng S P, Tabatabai M A. Cellulase activity of soils: Effect of trace elements[J]. Soil Biology and Biochemistry, 1995, 27(7): 977-979. DOI:10.1016/0038-0717(95)00005-Y
(  0) 0) |
| [20] |
Vasileiadis S, Brunetti G, Marzouk E, et al. Silver toxicity thresholds for multiple soil microbial biomarkers[J]. Environmental Science & Technology, 2018, 52(15): 8745-8755.
(  0) 0) |
| [21] |
Li T, Lai H X, He W X, et al. Effects of Cr6+ on soil enzyme activity (In Chinese)[J]. Journal of Northwest A & F University(Natural Science Edition), 2012, 40(8): 171-178. [李天, 来航线, 和文祥, 等. Cr6+的土壤酶效应研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(8): 171-178.]
(  0) 0) |
| [22] |
Lu G N, Xia M J, Jia D Y, et al. Response of mercury stress on soil urease and dehydrogenase activities in 14 major soil types in China (In Chinese)[J]. Acta Scientiae Circumstantiae, 2014, 34(7): 1788-1793. [卢冠男, 夏梦洁, 贾丹阳, 等. 我国14种典型土壤脲酶、脱氢酶活性对汞胁迫的响应[J]. 环境科学学报, 2014, 34(7): 1788-1793.]
(  0) 0) |
| [23] |
Zhang G Q, He W X, Lv J L, et al. Effects of Cr3+ on soil enzyme activity (In Chinese)[J]. Journal of Northwest A & F University(Natural Science Edition), 2014, 42(3): 131-136. [张国庆, 和文祥, 吕家珑, 等. Cr3+对土壤酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 2014, 42(3): 131-136.]
(  0) 0) |
| [24] |
Tan X P, Kong L, Yan H R, et al. Influence of soil factors on the soil enzyme inhibition by Cd[J]. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science, 2014, 64(8): 666-674.
(  0) 0) |
| [25] |
Welp G, Brümmer G W. Microbial toxicity of Cd and Hg in different soils related to total and water-soluble contents[J]. Ecotoxicology and Environmental Safety, 1997, 38(3): 200-204. DOI:10.1006/eesa.1997.1577
(  0) 0) |
| [26] |
He W X, Zhu M E, Zhang Y P. Recent advance in relationship between soil enzymes and heavy metals (In Chinese)[J]. Soil and Environmental Sciences, 2000, 9(2): 139-142. DOI:10.3969/j.issn.1674-5906.2000.02.015 [和文祥, 朱铭莪, 张一平. 土壤酶与重金属关系的研究现状[J]. 土壤与环境, 2000, 9(2): 139-142.]
(  0) 0) |
| [27] |
Han J G, Wang S Y, Fan D W, et al. Time-dependent hormetic response of soil alkaline phosphatase induced by Cd and the association with bacterial community composition[J]. Microbial Ecology, 2019, 78(4): 961-973. DOI:10.1007/s00248-019-01371-1
(  0) 0) |
| [28] |
Moreno J L, García C, Hernández T. Toxic effect of cadmium and nickel on soil enzymes and the influence of adding sewage sludge[J]. European Journal of Soil Science, 2003, 54(2): 377-386. DOI:10.1046/j.1365-2389.2003.00533.x
(  0) 0) |
| [29] |
Doelman P, Haanstra L. Short- and long-term effects of heavy metals on urease activity in soils[J]. Biology and Fertility of Soils, 1986, 2(4): 213-218.
(  0) 0) |
| [30] |
Tan X P, Wang Z Q, Zhang J, et al. Main factors affecting the toxicity of Cd by soil nitrification activity (In Chinese)[J]. Acta Scientiae Circumstantiae, 2016, 36(7): 2624-2630. [谭向平, 王紫泉, 张晶, 等. Cd对我国不同类型土壤硝化活性影响的主控因子研究[J]. 环境科学学报, 2016, 36(7): 2624-2630.]
(  0) 0) |
| [31] |
Doelman P, Haanstra L. Short- and long-term effects of heavy metals on phosphatase activity in soils: An ecological dose-response model approach[J]. Biology and Fertility of Soils, 1989, 8(3): 235-241.
(  0) 0) |
| [32] |
Renella G, Ortigoza A L R, Landi L, et al. Additive effects of copper and zinc on cadmium toxicity on phosphatase activities and ATP content of soil as estimated by the ecological dose(ED50)[J]. Soil Biology and Biochemistry, 2003, 35(9): 1203-1210. DOI:10.1016/S0038-0717(03)00181-0
(  0) 0) |
| [33] |
Haanstra L, Doelman P. An ecological dose-response model approach to short- and long-term effects of heavy metals on arylsulphatase activity in soil[J]. Biology and Fertility of Soils, 1991, 11(1): 18-23. DOI:10.1007/BF00335828
(  0) 0) |
| [34] |
Gao Y, Mao L, Miao C Y, et al. Spatial characteristics of soil enzyme activities and microbial community structure under different land uses in Chongming Island, China: Geostatistical modelling and PCR-RAPD method[J]. Science of the Total Environment, 2010, 408(16): 3251-3260. DOI:10.1016/j.scitotenv.2010.04.007
(  0) 0) |
| [35] |
Tan X P, Liu Y J, Yan K H, et al. Differences in the response of soil dehydrogenase activity to Cd contamination are determined by the different substrates used for its determination[J]. Chemosphere, 2017, 169: 324-332. DOI:10.1016/j.chemosphere.2016.11.076
(  0) 0) |
| [36] |
Zhu M E. Kinetics and thermodynamics of soil enzyme (In Chinese). Beijing: Science Press, 2011. [朱铭莪. 土壤酶动力学及热力学[M]. 北京: 科学出版社, 2011.]
(  0) 0) |
| [37] |
Cornish-Bowden A. Fundamentals of enzyme kinetics(4th) . Weinheim: Wiley-Blackwell, 2012.
(  0) 0) |
| [38] |
Wang Z Q, Tian H X, Lu G N, et al. Catalytic efficiency is a better predictor of arsenic toxicity to soil alkaline phosphatase[J]. Ecotoxicology and Environmental Safety, 2018, 148: 721-728. DOI:10.1016/j.ecoenv.2017.11.040
(  0) 0) |
| [39] |
He W X, Wang J, Tian H X, et al. Effect of trivalent chromium on soil urease activity characteristics (In Chinese)[J]. Journal of Agro-Environment Science, 2009, 28(11): 2343-2347. DOI:10.3321/j.issn:1672-2043.2009.11.024 [和文祥, 王娟, 田海霞, 等. Cr3+对土壤脲酶活性特征的影响[J]. 农业环境科学学报, 2009, 28(11): 2343-2347.]
(  0) 0) |
| [40] |
Feng D, Wang J S, Teng Y G. Effects of Cu pollution on soil alkaline phosphatase activity (In Chinese)[J]. Journal of Beijing Normal University(Natural Science), 2015, 51(1): 69-74. [冯丹, 王金生, 滕彦国. 重金属Cu对土壤碱性磷酸酶活性的影响[J]. 北京师范大学学报(自然科学版), 2015, 51(1): 69-74.]
(  0) 0) |
| [41] |
He W X, Wei G H, Wu Y J, et al. Soil enzyme activity effected by Hg (In Chinese)[J]. China Environmental Science, 2001, 21(3): 279-283. DOI:10.3321/j.issn:1000-6923.2001.03.021 [和文祥, 韦革宏, 武永军, 等. 汞对土壤酶活性的影响[J]. 中国环境科学, 2001, 21(3): 279-283.]
(  0) 0) |
| [42] |
Tan X P, Wang Z Q, Lu G N, et al. Kinetics of soil dehydrogenase in response to exogenous Cd toxicity[J]. Journal of Hazardous Materials, 2017, 329: 299-309. DOI:10.1016/j.jhazmat.2017.01.055
(  0) 0) |
| [43] |
Fan D W, Xu S, Zhou M L, et al. Low-dose hormetic effects of Cd2+ and Cr3+ on alkaline phosphatase in wetland soil in Dongtan of Chongming (In Chinese)[J]. Journal of Ecology and Rural Environment, 2016, 32(2): 320-325. [范弟武, 徐莎, 周曼丽, 等. Cd2+和Cr3+对崇明东滩湿地土壤碱性磷酸酶的低剂量兴奋效应[J]. 生态与农村环境学报, 2016, 32(2): 320-325.]
(  0) 0) |
| [44] |
Yang C L, Sun T H, He W X, et al. Kinetics of soil urease inhibited by Hg (In Chinese)[J]. Journal of Liaoning Technical University(Natural Science), 2008, 27(3): 454-457. DOI:10.3969/j.issn.1008-0562.2008.03.039 [杨春璐, 孙铁珩, 和文祥, 等. 汞对土壤脲酶的抑制动力学研究[J]. 辽宁工程技术大学学报(自然科学版), 2008, 27(3): 454-457.]
(  0) 0) |
| [45] |
He W X, Wang J, Gao Y J, et al. Effect of different valences chromium on soil alk-phosphatase characteristics (In Chinese)[J]. Journal of Agro-Environment Science, 2010, 29(1): 104-109. [和文祥, 王娟, 高亚军, 等. 不同价态铬的土壤碱性磷酸酶效应模拟研究[J]. 农业环境科学学报, 2010, 29(1): 104-109.]
(  0) 0) |
| [46] |
Song J W, Shen Q L, Wang L, et al. Effects of Cd, Cu, Zn and their combined action on microbial biomass and bacterial community structure[J]. Environmental Pollution, 2018, 243: 510-518. DOI:10.1016/j.envpol.2018.09.011
(  0) 0) |
| [47] |
Martín-Sanz J P, Valverde-Asenjo I, de Santiago-Martín A, et al. Enzyme activity indicates soil functionality affectation with low levels of trace elements[J]. Environmental Pollution, 2018, 243: 1861-1866. DOI:10.1016/j.envpol.2018.10.029
(  0) 0) |
| [48] |
Ameen F, Alsamhary K, Alabdullatif J A, et al. A review on metal-based nanoparticles and their toxicity to beneficial soil bacteria and fungi[J]. Ecotoxicology and Environmental Safety, 2021, 213: 112027. DOI:10.1016/j.ecoenv.2021.112027
(  0) 0) |
| [49] |
Sun W M, Xiao E Z, Xiao T F, et al. Response of soil microbial communities to elevated antimony and arsenic contamination indicates the relationship between the innate microbiota and contaminant fractions[J]. Environmental Science & Technology, 2017, 51(16): 9165-9175.
(  0) 0) |
| [50] |
Xiao E Z, Ning Z P, Sun W M, et al. Thallium shifts the bacterial and fungal community structures in thallium mine waste rocks[J]. Environmental Pollution, 2021, 268: 115834. DOI:10.1016/j.envpol.2020.115834
(  0) 0) |
| [51] |
Tan X P, Machmuller M B, Wang Z Q, et al. Temperature enhances the affinity of soil alkaline phosphatase to Cd[J]. Chemosphere, 2018, 196: 214-222. DOI:10.1016/j.chemosphere.2017.12.170
(  0) 0) |
| [52] |
Yang C L, Sun T H, He W X, et al. Effect of temperature on kinetic of soil urease inhibited by Hg (In Chinese)[J]. Environmental Science, 2007, 28(2): 278-282. DOI:10.3321/j.issn:0250-3301.2007.02.010 [杨春璐, 孙铁珩, 和文祥, 等. 温度对汞抑制土壤脲酶动力学影响研究[J]. 环境科学, 2007, 28(2): 278-282.]
(  0) 0) |
| [53] |
Huang Q Y, Shindo H. Effects of copper on the activity and kinetics of free and immobilized acid phosphatase[J]. Soil Biology and Biochemistry, 2000, 32(13): 1885-1892. DOI:10.1016/S0038-0717(00)00162-0
(  0) 0) |
| [54] |
Tian H X, Zhao Y M, Megharaj M, et al. Arsenate inhibition on kinetic characteristics of alkaline phosphatase as influenced by pH[J]. Ecological Indicators, 2018, 85: 1101-1106. DOI:10.1016/j.ecolind.2017.11.041
(  0) 0) |
| [55] |
He W X, Zhu M E, Zhang Y P. Effect of pH on relationship between soil urease activity and Hg and Cd (In Chinese)[J]. Journal of Northwest A & F University(Natural Science Edition), 2002, 30(3): 66-70. DOI:10.3321/j.issn:1671-9387.2002.03.017 [和文祥, 朱铭莪, 张一平. pH对汞镉与土壤脲酶活性关系的影响[J]. 西北农林科技大学学报(自然科学版), 2002, 30(3): 66-70.]
(  0) 0) |
| [56] |
Huang Q Y, Shindo H. Inhibition of free and immobilized acid phosphatase by zinc[J]. Soil Science, 2000, 165(10): 793-802. DOI:10.1097/00010694-200010000-00004
(  0) 0) |
| [57] |
He W X, Zhu M E, Zhang Y P. Study on the effects of Hg and Cd on soil urease activity Ⅰ: Urea concentration (In Chinese)[J]. Chinese Journal of Applied Ecology, 2002, 13(2): 191-193. DOI:10.3321/j.issn:1001-9332.2002.02.016 [和文祥, 朱铭莪, 张一平. 汞、镉对土壤脲酶活性影响的研究Ⅰ.尿素浓度[J]. 应用生态学报, 2002, 13(2): 191-193.]
(  0) 0) |
| [58] |
He W X, Chen H M, Zhu M E. Effects of Hg and Cd on free and immobilized urease activity (In Chinese)[J]. Acta Pedologica Sinica, 2003, 40(6): 945-951. DOI:10.3321/j.issn:0564-3929.2003.06.021 [和文祥, 陈会明, 朱铭莪. 汞镉对游离和固定化脲酶活性的影响[J]. 土壤学报, 2003, 40(6): 945-951.]
(  0) 0) |
| [59] |
Liu Y, Tan X P, Wang Y Y, et al. Responses of litter, organic and mineral soil enzyme kinetics to 6 years of canopy and understory nitrogen additions in a temperate forest[J]. Science of the Total Environment, 2020, 712: 136383. DOI:10.1016/j.scitotenv.2019.136383
(  0) 0) |
| [60] |
Davidson E A, Janssens I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change[J]. Nature, 2006, 440(7081): 165-173. DOI:10.1038/nature04514
(  0) 0) |
| [61] |
Ciarkowska K. Enzyme activities in soils contaminated with heavy metals in varying degrees//Sherameti I, Varma A. Heavy metal contamination of soils[M]. Cham: Springer International Publishing, 2015: 145—158.
(  0) 0) |
| [62] |
Xie W, Tan X P, Tian H X, et al. Effects of soil moisture on available arsenic and alkaline phosphatase activity in paddy soil (In Chinese)[J]. China Environmental Science, 2016, 36(8): 2418-2424. DOI:10.3969/j.issn.1000-6923.2016.08.023 [谢伟, 谭向平, 田海霞, 等. 土壤水分对稻田土壤有效砷及碱性磷酸酶活性影响[J]. 中国环境科学, 2016, 36(8): 2418-2424.]
(  0) 0) |
| [63] |
Xie W, He W X, Wang Z Q, et al. Kinetic characteristics of soil alkaline phosphatase inhibited by arsenic based on changes of soil moisture (In Chinese)[J]. Acta Scientiae Circumstantiae, 2016, 36(5): 1816-1823. [谢伟, 和文祥, 王紫泉, 等. 基于水分变化的砷抑制土壤碱性磷酸酶动力学特征研究[J]. 环境科学学报, 2016, 36(5): 1816-1823.]
(  0) 0) |
| [64] |
Zimmerman A R, Ahn M-Y. Organo-mineral–enzyme interaction and soil enzyme activity//Shukla G, Varma A. Soil enzymology[M]. Berlin: Springer Berlin Heidelberg, 2011: 271—292
(  0) 0) |
| [65] |
Andersen A, Reardon P N, Chacon S S, et al. Protein–mineral interactions: Molecular dynamics simulations capture importance of variations in mineral surface composition and structure[J]. Langmuir, 2016, 32(24): 6194-6209. DOI:10.1021/acs.langmuir.6b01198
(  0) 0) |
| [66] |
Li Y, Tan W F, Koopal L K, et al. Influence of soil humic and fulvic acid on the activity and stability of lysozyme and urease[J]. Environmental Science & Technology, 2013, 47(10): 5050-5056.
(  0) 0) |
| [67] |
Rao M A, Violante A, Gianfreda L. Interaction of acid phosphatase with clays, organic molecules and organo-mineral complexes: Kinetics and stability[J]. Soil Biology and Biochemistry, 2000, 32(7): 1007-1014. DOI:10.1016/S0038-0717(00)00010-9
(  0) 0) |
| [68] |
Gianfreda L, De Cristofaro A, Rao M A, et al. Kinetic behavior of synthetic organo- and organo-mineral-urease complexes[J]. Soil Science Society of America Journal, 1995, 59(3): 811-811. DOI:10.2136/sssaj1995.03615995005900030025x
(  0) 0) |
| [69] |
Wang Z Q, Li Y B, Tan X P, et al. Effect of arsenate contamination on free, immobilized and soil alkaline phosphatases: Activity, kinetics and thermodynamics[J]. European Journal of Soil Science, 2017, 68(1): 126-135. DOI:10.1111/ejss.12397
(  0) 0) |
| [70] |
Huang Q Y, Shindo H. Contparison of the influence of Cu, Zn, and Cd on the activity and kinetics of free and intntobilized acid phosphatase[J]. Soil Science and Plant Nutrition, 2001, 47(4): 767-772. DOI:10.1080/00380768.2001.10408441
(  0) 0) |
| [71] |
Staunton S, Razzouk R, Abadie J, et al. Water-extractable soil organic matter inhibits phosphatase activity[J]. Soil Biology and Biochemistry, 2012, 55: 14-16. DOI:10.1016/j.soilbio.2012.06.003
(  0) 0) |
| [72] |
Trasar-Cepeda C, Gil-Sotres F, Bello D. Use of enzyme activities to monitor pollution of agricultural land[J]. EQA - International Journal of Environmental Quality, 2016, 22: 15-24.
(  0) 0) |
| [73] |
Lessard I, Sauvé S, Deschênes L. Toxicity response of a new enzyme-based functional diversity methodology for Zn-contaminated field-collected soils[J]. Soil Biology and Biochemistry, 2014, 71: 87-94. DOI:10.1016/j.soilbio.2014.01.002
(  0) 0) |
| [74] |
Puglisi E, Del Re A A M, Rao M A, et al. Development and validation of numerical indexes integrating enzyme activities of soils[J]. Soil Biology and Biochemistry, 2006, 38(7): 1673-1681. DOI:10.1016/j.soilbio.2005.11.021
(  0) 0) |
| [75] |
He W X, Tan X P, Wang X D, et al. Study on total enzyme activity index in soils (In Chinese)[J]. Acta Pedologica Sinica, 2010, 47(6): 1232-1236. [和文祥, 谭向平, 王旭东, 等. 土壤总体酶活性指标的初步研究[J]. 土壤学报, 2010, 47(6): 1232-1236.]
(  0) 0) |
| [76] |
Cui Y X, Wang X, Wang X X, et al. Evaluation methods of heavy metal pollution in soils based on enzyme activities: A review[J]. Soil Ecology Letters, 2021, 3(3): 169-177. DOI:10.1007/s42832-021-0096-0
(  0) 0) |
| [77] |
Larras F, Bouchez A, Rimet F, et al. Using bioassays and species sensitivity distributions to assess herbicide toxicity towards benthic diatoms[J]. PLoS One, 2012, 7(8): e44458. DOI:10.1371/journal.pone.0044458
(  0) 0) |
| [78] |
Xian Y, Wang M E, Chen W P. Quantitative assessment on soil enzyme activities of heavy metal contaminated soils with various soil properties[J]. Chemosphere, 2015, 139: 604-608.
(  0) 0) |
| [79] |
Wang X Q, Wei D P, Ma Y B, et al. Derivation of soil ecological criteria for copper in Chinese soils[J]. PLoS ONE, 2015, 10(7): e0133941.
(  0) 0) |
| [80] |
Posthuma L, Suter Ⅱ G W, Traas T P. Species sensitivity distribution in ecotoxicology . Boca Raton: CRC Press, 2001.
(  0) 0) |
| [81] |
Ding C F, Zhang T L, Li X B, et al. Major controlling factors and prediction models for mercury transfer from soil to carrot[J]. Journal of Soils and Sediments, 2014, 14(6): 1136-1146.
(  0) 0) |
| [82] |
Li Z J, Yang H, Li Y P, et al. Cross-species extrapolation of prediction model for lead transfer from soil to corn grain under stress of exogenous lead[J]. PLoS One, 2014, 9(1): e85688.
(  0) 0) |
| [83] |
Eisenthal R, Danson M J, Hough D W. Catalytic efficiency and kcat/Km: A useful comparator[J]. Trends in Biotechnology, 2007, 25(6): 247-249.
(  0) 0) |
| [84] |
Wang Z Q, Tian H, Lei M X, et al. Soil enzyme kinetics indicate ecotoxicity of long-term arsenic pollution in the soil at field scale[J]. Ecotoxicology and Environmental Safety, 2020, 191: 110215.
(  0) 0) |
| [85] |
Liu Y R, Delgado-Baquerizo M, Bi L, et al. Consistent responses of soil microbial taxonomic and functional attributes to mercury pollution across China[J]. Microbiome, 2018, 6(1): 183.
(  0) 0) |
| [86] |
Xu Y L, Seshadri B, Bolan N, et al. Microbial functional diversity and carbon use feedback in soils as affected by heavy metals[J]. Environment International, 2019, 125: 478-488.
(  0) 0) |
| [87] |
Fang L C, Cao Y Y, Huang Q Y, et al. Reactions between bacterial exopolymers and goethite: A combined macroscopic and spectroscopic investigation[J]. Water Research, 2012, 46(17): 5613-5620.
(  0) 0) |
| [88] |
Pu S Y, Wang Y, Chen W Y, et al. Review on the mechanism of plant rhizosphere soil enzyme response to heavy metal pollution (In Chinese)[J]. Asian Journal of Ecotoxicology, 2020, 15(4): 11-20. [蒲生彦, 王宇, 陈文英, 等. 植物根际土壤酶对重金属污染的响应机制研究综述[J]. 生态毒理学报, 2020, 15(4): 11-20.]
(  0) 0) |
| [89] |
Buckley S, Allen D, Brackin R, et al. Microdialysis as an in situ technique for sampling soil enzymes[J]. Soil Biology and Biochemistry, 2019, 135: 20-27.
(  0) 0) |
| [90] |
Martínez D, Molina M J, Sánchez J, et al. API ZYM assay to evaluate enzyme fingerprinting and microbial functional diversity in relation to soil processes[J]. Biology and Fertility of Soils, 2016, 52(1): 77-89.
(  0) 0) |
| [91] |
Bastida F, Hernández T, García C. Metaproteomics of soils from semiarid environment: Functional and phylogenetic information obtained with different protein extraction methods[J]. Journal of Proteomics, 2014, 101: 31-42.
(  0) 0) |
| [92] |
Tang J Y, Zhang J C, Ren L H, et al. Diagnosis of soil contamination using microbiological indices: A review on heavy metal pollution[J]. Journal of Environmental Management, 2019, 242: 121-130.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60

