2. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所), 南京 210008;
3. 南京师范大学化学与材料科学学院, 南京 210046
2. CAS Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Nanjing 210008, China;
3. School of Chemistry and Materials Science, Nanjing Normal University, Nanjing 210046, China
随着我国经济的快速发展,人为活动对环境造成了很多的影响,其中煤、石油、木材等不完全燃烧以及石油加工过程中产生的多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)的激增严重威胁了土壤的生态环境、农产品安全和人体健康[1-2],并影响到我国社会经济的可持续发展。因此,针对土壤污染特点,调控影响土壤净化功能的关键过程,研发PAHs污染土壤修复技术是改善土壤环境质量的有效措施。
微生物转化是自然环境中有机污染物消除的主要途径之一,也是有机污染物控制与环境修复的核心技术方法[3],潜在发展空间很大。采用不同驯化和富集手段从PAHs污染环境中富集分离得到多株高效降解菌,主要包括分枝杆菌属(Mycobacterium)、红球菌属(Rhodococcus)、鞘氨醇菌属(Sphingomonas)和假单胞菌属(Pseudomonas)[4],这些菌属能够以某一种或者几种PAHs为唯一碳源和能源生长,甚至能够共代谢某些高环PAHs。然而,接种外源高效菌难以适应自然复杂水体和土壤环境的瓶颈问题,大大限制了微生物技术的实地修复[5]。尤其是当外源高效降解菌进入环境界中时,会与溶解性有机质作用。
溶解性有机质(Dissolved organic matter,DOM)是土壤和自然水体中的一种重要组分,由碳含量约50%的有机分子和氧、氮、磷和硫等各种杂原子按照一定比例组成[6],形成了含有一系列芳香基、脂基、羟基等官能团结构且化学性质各异的复杂化合物。DOM由于其特殊结构同时具有亲水和疏水的作用,因此对环境中的有机物有两面影响:DOM的亲水性使土壤中的有机污染物溶解度提高,使其易于迁移转化[7];而DOM的疏水性可以使有机污染物被土壤表面所吸附并结合[8],从而迁移能力变弱。但DOM对高效降解菌的代谢有机污染物的影响又如何呢?
基于以上所述,本研究以污染土壤中最常见的四环芘作为代表性PAHs,以腐殖酸(Humic acid,HA)为代表性DOM设置添加和未添加实验,利用高效菌株Mycobacterium sp. NJS-1降解芘。借助电喷雾电离源结合傅里叶变换离子回旋共振质谱仪(ESI-FT-ICR-MS)技术解析中间产物,利用光谱技术追踪细胞表面的变化特征,进而从细胞官能团变化趋势探明由菌株代谢芘引起的HA在细胞表面的作用。
1 材料与方法 1.1 供试材料芘降解菌Mycobacterium sp. NJS-1保藏于中国典型培养物典藏中心,编号为CCTCC M 2011011,能够以芘为唯一碳源生长。芘(分析纯)购置于Janssen Chimica公司;甲醇和乙腈(色谱纯)购置于德国默克公司。Calcein/PI活死细胞染色剂购于东仁化学科技有限公司。HA购置于阿拉丁公司,其主要成分见表 1。
|
|
表 1 腐殖酸的成分及元素组成 Table 1 The molecular class and element composition of humic acid |
实验分为两组,一组不添加HA,另一组添加HA,评价HA的添加对菌降解芘的效率以及对菌落生长情况的影响;同时设置两个不接种菌的对照组,同样一组不添加HA,另一组添加HA,评价芘在有无HA添加的情况下的挥发损失。分别移取芘浓度为1 g·L–1溶液10 μL、100 μL和1 mL置于每个组的三角瓶中,待丙酮挥发完全后,向添加HA的组分中加入5 mg灭菌后的HA以及90 mL的灭菌无机盐溶液,然后按照10%的菌液接种比例在实验组中加入10 mL Mycobacterium sp. NJS-1菌液,细菌的初始密度约为1.6 × 107 CFU·mL–1,芘的初始浓度分别为0.1、1、10 mg·kg–1。每组重复3次,所有三角瓶置于摇床中避光培养7 d,并间隔1 d取出样品用于分析,整个过程中摇床转速为160 r·min–1。
1.3 样品处理及测定方法取出培养7 d的菌悬液,加入20 mL正己烷和10 mL 0.1 mol·L–1 HCL溶液,超声10 min(50 Hz)。待液面分层稳定后吸取上层液体,得到有机相正己烷溶液,随后采用氮吹仪换相到乙腈溶液中,最后使用0.45 µm滤头过滤并采用ESI-FT-ICR-MS分析其碎片离子。具体条件如下:毛细管电压-3.8 kV和120 μL·h–1的流量,正离子模式下,为–4.0 kV喷雾电压和-4.5 kV的毛细管柱引入电压;负离子模式下,为4.0 kV喷雾电压和4.5 kV的毛细管柱引入电压和240 V毛细管柱端电压。
向间隔1 d取出的样品中分别添加正己烷20 mL,并超声20 min(50 Hz),移取正己烷相10 mL,采用旋转蒸发浓缩、氮气换相于乙腈的方法进行纯化[9-10],并最终定容至2 mL。随后,将溶液过孔径0.45 µm的滤膜,并采用高效液相色谱仪(HPLC)分析。测试条件为:C18反相柱(4.6 × 250 mm),激发波长为270 nm,发射波长为390 nm,流动相为乙腈和超纯水(9:1,v/v),固定流速为1.5 mL·min–1且柱温度为40℃,时间为6.0 min。
取培养7 d后的样品,离心并收集沉淀,冷冻干燥后,使用共聚焦拉曼光谱仪(HR Evolution,France)测试样品,激发波长为633 nm,扫描范围为100~2 000 cm–1。冷冻后样品采用KBr压片,使用红外光谱测定其官能团变化特征,样品扫描范围为4 000~400 cm–1。瞬态三维荧光光谱(EEM)在室温下测定,将菌液溶液置于四通常量比色皿中。设置测定参数:激发波长(Ex)和发射波长(Em)都为220~550 nm,狭缝宽度为5 nm。
菌落的成活及生长特性采用激光共聚焦显微镜(CLSM,N-STORM,Nikon)检测,取培养7 d后的菌悬液100~150 μL,置于专用培养小皿中心位置,恒温培养24 h。待菌沉降附着至皿底后将多余培养液用移液枪吸掉,然后用100 μL配置好的Calcein/PI染色剂缓慢加进培养皿中,使菌落浸泡且置于暗处染色15 min。随后采用磷酸缓冲液清洗染色液,并置于激光共聚焦下观察。CLSM所设参数:发射激光波长为488 nm和561 nm,物镜倍数为20倍。同时,取10 μL菌悬液梯度稀释后并采用平板计数法统计隔天菌落的生长特征。
1.4 数据处理ESI-FT-ICR-MS的结果利用Bruker Data Analysis进行分析,高效液相质谱及其他光谱测试结果均由统计软件Microsoft Excel 2016和Origin 2018进行数据处理和作图。
2 结果与讨论 2.1 芘的降解特征如图 1所示,芘降解及菌落Mycobacterium sp. NJS-1生长受HA影响显著。未接种芘降解菌时,芘未出现明显减少,其降解率低于5%,表明在整个降解过程中,并未出现明显的挥发损失。未添加HA时,经过7 d培养,芘降解率最高达到35.33% ± 3.27%;但是在相同培养条件下,添加HA后,其降解率明显提高,达到88.33% ± 3.40%(图 1a)。表明添加HA促进芘降解。监测芘降解菌的生长情况发现:在降解芘的过程中,降解菌呈明显增长趋势,添加HA后,菌落生长速率明显加快,当芘浓度为10 mg·kg–1时,降解菌的增长速率最快,最高达到6.5×107 CFU·mL–1(图 1b)。根据芘降解速率及菌落生长可以得出HA促进了微生物的生长及对芘的降解。HA作为一种载体[11],能改变PAHs在细胞内外的转运方式。
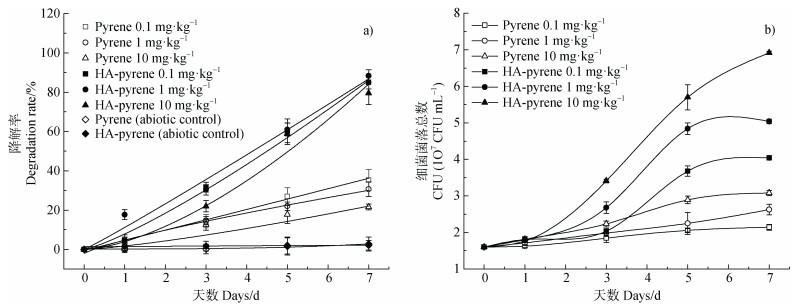
|
图 1 培养期间分枝杆菌Mycobacterium sp. NJS-1降解芘的效率(a)及菌落的生长(b) Fig. 1 Biodegradation of pyrene by Mycobacterium sp. NJS-1 of incubation(a), and its cell growth(b)during culture |
为确定高效菌Mycobacterium sp. NJS-1降解芘的途径,进一步采用ESI-FT-ICR-MS测定其中间产物,得到芘降解的中间产物信息结果如表 2所示,由表中信息可知当不添加HA时,检测到化合物C16H10O2和C14H10O2,分别是4,5-芘二氢二醇和3,4-菲二醇;然而添加HA时,检测到C18H14O2和C16H8O2,分别是1,2-二甲氧基芘和4,5-二酮芘。Peng等[12]指出Mycobacterium sp. NJS-1的生物降解由双加氧酶启动,因此根据产物4,5-芘二氢二醇推断可得:在降解芘的过程中,菌落Mycobacterium sp. NJS-1分泌的双加氧酶进攻芘的C4,5位点,随后发生加氧开环及脱羧反应,进而生成3,4-菲二醇。然而添加HA后,由中间产物4,5-二酮芘可推断双加氧酶进攻芘的C4,5位点,由1,2-二甲氧基芘推断双加氧酶进攻芘的C1,2位点,降解路径如图 2所示。表明添加HA增加了双加氧酶的进攻位点,优化了降解途径,从而加快了降解。HA含有双键、芳环等官能团[13],能够与芘分子作用,减弱芘分子的电负性;HA还富含极性的官能团[14],能与细胞表面的膜蛋白作用,从而有利于菌落细胞的酶与芘分子作用。
|
|
表 2 ESI-FT-ICR-MS检测芘降解的中间产物信息 Table 2 The intermediate products of pyrene degradation detected by ESI-FT-ICR-MS |

|
图 2 菌落Mycobacterium sp. NJS-1降解芘的路径分析 Fig. 2 Biodegradation pathways for pyrene by Mycobacterium sp. NJS-1 |
为确定菌落在芘降解过程中的作用机制及HA的影响,需要明确菌落的活性及赋存形态。图 3激光共聚焦(CLSM)的结果显示,当芘浓度较低为0.1 mg·kg–1时(图 3a),经过7 d培养,降解菌分布较为分散,团聚并不明显。随着芘浓度逐渐增加,细菌出现明显团聚现象,并形成生物膜(图 3b,图 3c)。表明随着芘浓度增大,为了应对芘的毒性及疏水性并降解芘时,降解菌通过形成生物膜调整其存活方式,使其适应外界环境。生物膜形成是一个动态过程,主要包括细菌粘附、生物膜形成、生物膜生长、生物膜成熟等阶段[15]。但是,芘作为一种四环的代表性化合物,其毒性较强[16],因此在降解过程中,尽管有微生物膜形成,但仍然出现部分红色细胞,预示着部分细胞死亡。

|
(a)芘0.1 mg·kg–1,(b)芘1 mg·kg–1,(c)芘10 mg·kg–1,(d)腐殖酸-芘0.1 mg·kg–1,(e)腐殖酸-芘1 mg·kg–1,(f)腐殖酸-芘10 mg·kg–1。 (a)pyrene 0.1 mg·kg–1, (b)pyrene 1 mg·kg–1, (c)pyrene 10 mg·kg–1, (d)HA-pyrene 0.1 mg·kg–1, (e)HA-pyrene 1 mg·kg–1, (f)HA-pyrene 10 mg·kg–1. 图 3 有无HA添加时菌落Mycobacterium sp. NJS-1降解不同浓度芘时的激光共聚焦图 Fig. 3 The CLSM images of degradation of pyrene by Mycobacterium sp. NJS-1 with or without HA |
然而,添加HA后,生物膜形成速度加快,尤其芘浓度较低时,快速形成了微生物膜(图 3d-图 3f)。而且,添加HA后,无红色细胞出现,表明添加HA后,未出现细胞死亡。芘在HA表面发生吸附行为[17],减少了芘与细胞表面直接接触,削弱芘对细胞毒性,从而无死亡细胞出现。Cai等[18]研究了森林凋落物释放的HA对PAHs降解影响,发现HA为降解菌提供了蛋白质和酪氨酸等营养物质,刺激了降解菌的活性,从而提高了降解菌的生长及活性。此外,HA也提高了PAHs的生物利用度,从而促进PAHs降解[5]。在自然环境中,绝大多数微生物以生物膜的结构形态赋存环境界中,并且生物膜细胞通过分泌胞外聚合物调节细胞表面的结构[19]。本研究采用的分枝杆菌Mycobacterium sp. NJS-1能够于细胞表面分泌分枝菌酸[20],分枝菌酸的官能团以及细胞表面的官能团与HA的官能团分子容易发生物理或者化学键合。因此添加HA能够促进细胞与细胞之间相互作用,从而增强降解菌的代谢活性。
2.4 微生物细胞的光谱变化特征红外光谱技术能反应细胞表面官能团的变化信息[21],不同浓度芘降解的红外特征峰如图 4所示。首先,3 441 cm–1归属于N-H伸缩振动、2 950~2 880 cm–1归属于脂肪酸、2 426 cm–1归属于羧酸类O-H多重复合谱带、1 656 cm–1归属于酰胺Ⅰ带,1 542 cm–1归属于酰胺Ⅱ带、1 240 cm–1归属于酰胺Ⅲ带[22],表明微生物细胞表面存在含有酰胺、羧酸和碳水化合物类物质。同时在芘降解过程中,于1 150 cm–1、984 cm–1、943 cm–1处产生了归属于多糖、醇类、羧酸或酯类C-O伸缩振动和C-H弯曲振动峰。说明菌落Mycobacterium sp. NJS-1细胞表面发生了明显的性能变化,分泌了大量糖类等生物大分子物质。
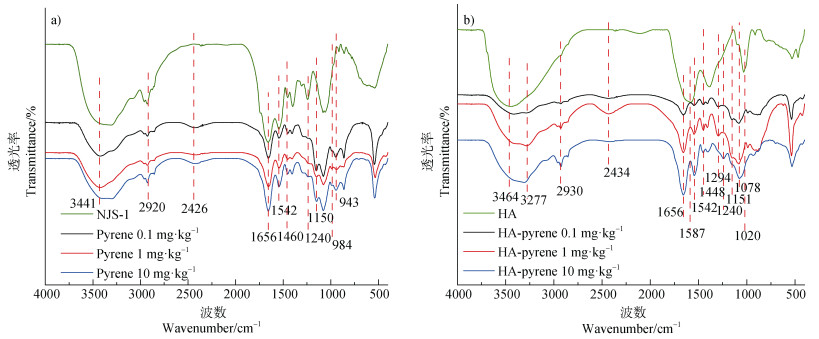
|
图 4 菌落Mycobacterium sp. NJS-1降解芘(a)及有HA时降解芘(b)的红外光谱图 Fig. 4 Infrared spectrum of Mycobacterium sp. NJS-1 degradation of pyrene without(a)and with(b)presence of HA(HA-pyrene) |
同时,HA与芘共存时,其红外特征峰变化趋势明显。N-H伸缩振动峰由3 464 cm–1红移至3 227 cm–1;O-H伸缩振动峰由2 335 cm–1蓝移至2 424 cm–1;N-H弯曲振动峰由1 587 cm–1红移至1 537 cm–1;C-O伸缩振动峰由1 098 cm–1红移至1 068 cm–1。由峰位移推断:HA添加诱导了细胞表面、HA、芘之间的相互作用力。而且,在芘降解过程中于1 656 cm–1、1 448 cm–1、1 294 cm–1、1 240 cm–1、1 151 cm–1处出现一系列新峰,它们分别归属于羧酸酯类酰胺谱带的C-O伸缩振动、酰胺Ⅲ带C-N伸缩振动、N-H弯曲振动、芳香类C-N伸缩振动和酸酐C-O伸缩振动。表明HA添加不仅促进芘降解而且有利于菌落Mycobacterium sp. NJS-1的生长,使得菌落表面蛋白类官能团的信息逐步显现出来。
2.5 微生物细胞的拉曼光谱变化特征拉曼光谱技术分析生物样品,能给出生物细胞表面蛋白的变化特征[23]。不同浓度芘降解过程中特征峰的归属总结如图 5所示:1 666 cm–1、1 518 cm–1和1 249 cm–1分别归属于蛋白酰胺Ⅰ、Ⅱ和Ⅲ谱带;1 458 cm–1和1 338 cm–1分别归属于蛋白质和脂质的C-H弯曲振动峰(图 5a)[24]。与初始培养菌株相比,接种菌株细胞表面无明显的蛋白峰和氨基酸峰,但是接种的菌株经过芘降解过程,细胞表面出现了明显的蛋白峰和氨基酸峰,表明芘作为碳源被微生物降解时,引起了细胞内蛋白外泄到细胞表面。然而,随着芘浓度的增加,蛋白质C-H振动峰和酰胺Ⅲ带逐渐显现出来,并且出现了色氨酸呼吸振动峰;当芘浓度增至10 mg·kg–1时,拉曼峰图出现了明显的蛋白酰胺组峰,而且出现酪氨酸、色氨酸和苯丙氨酸的特征峰,分别在1 162 cm–1、1 006 cm–1和745 cm–1[25]。这意味着蛋白组分的增加以及生物膜的生长,表明微生物降解芘过程中,细胞表面的蛋白组分呈现增加趋势,细胞表面蛋白分子能起到信号传输的作用[26]。说明微生物由细胞内向细胞表面外泄蛋白是应对并降解疏水性有机污染物芘的一种生长策略。
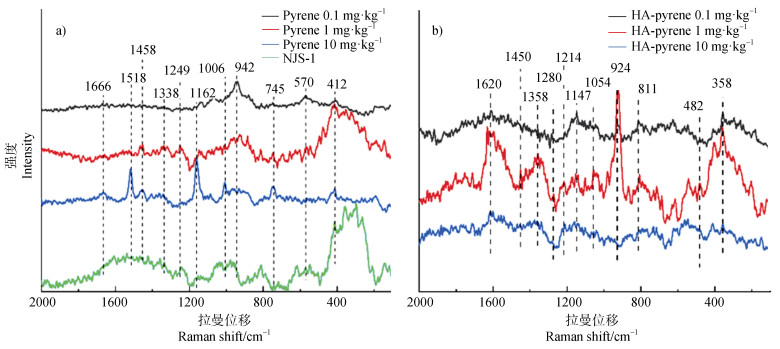
|
图 5 菌落Mycobacterium sp. NJS-1降解芘(a)及添加HA时降解芘(b)的拉曼光谱图 Fig. 5 Raman spectrum of Mycobacterium sp. NJS-1 degradation of pyrene without(a)and with(b)presence of HA(HA-pyrene) |
当加入HA后,如图 5b所示,部分谱带发生了由高波数向低波数的红移。蛋白酰胺Ⅰ、Ⅱ和Ⅲ谱带分别位移至1 620 cm–1、1 450 cm–1和1 214 cm–1,酪氨酸、色氨酸和苯丙氨酸也均稍微发生红移。表明HA的添加引起了细胞表面官能团作用力的变化。此外,当芘浓度为1 mg·kg–1时,1 620 cm–1处酰胺Ⅰ峰相较其他浓度芘的峰明显强度较大,以及1 450 cm–1和1 358 cm–1处的蛋白质和脂质C-H振动峰,也较其他浓度的峰更强。这说明当HA参与时,芘浓度过高或过低均不利于细胞生长代谢和生物膜的生长。
2.6 微生物细胞的三维荧光光谱变化特征为获取微生物降解芘过程中的细胞表面的腐殖化程度,进一步采用三维荧光光谱(EEM)分析了溶液体系及菌落团聚体的谱学变化特征。如图 6所示,当只添加HA或只添加芘时,溶液中主要检测到色氨酸类蛋白质。据研究,类色氨酸荧光峰起源于细胞内[27],类色氨酸是衡量微生物活性的依据,其构建了用于生长和代谢的蛋白质,这些均说明了降解菌的活性。此外,在只添加芘组发现了少量的类富里酸峰,这是细菌代谢的产物。
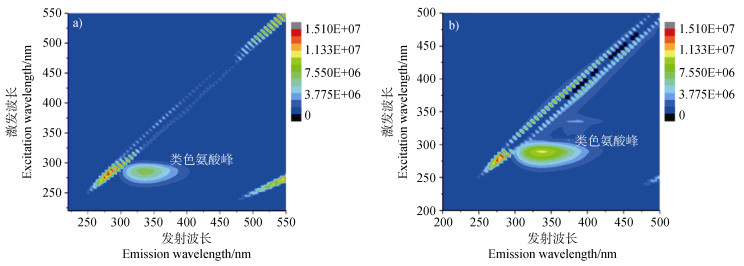
|
图 6 分支杆菌Mycobacterium sp. NJS-1在只添加芘(a)或HA(b)培养7天后的EEM图像 Fig. 6 The EEM images of Mycobacterium sp. NJS-1 added pyrene(a)or HA(b)after 7 days of culture |
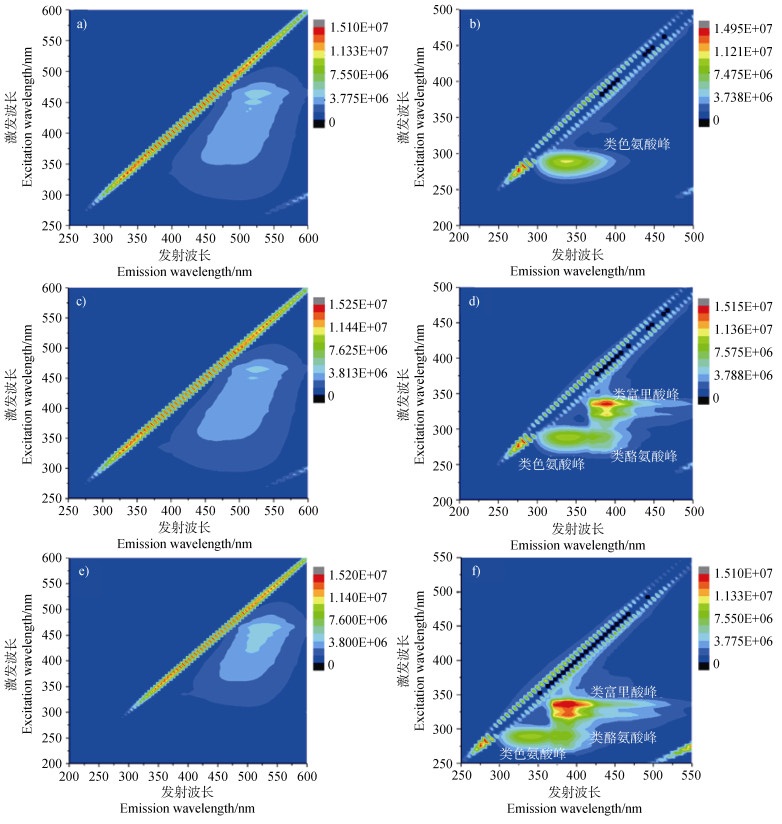
添加不同浓度芘后,检测到的EEM图像如图 7所示。随着芘浓度增加,上清液中短波HA和可见光富里酸的组成变化并不明显。当芘浓度增至10 mg·kg–1时,HA峰面积增加显著,根据文献报道[28],此类物质是微生物代谢过程中产生的水溶性产物,表明Mycobacterium sp. NJS-1在生长及代谢过程中,生成的可溶性HA量显著增加。但是,菌落团聚体的EEM图像表现出明显变化特征。芘浓度为0.1 mg·kg–1时,只有类色氨酸一个蛋白峰(图 7b)。随着芘浓度增加,产生了酪氨酸类蛋白质峰和可见光类富里酸峰,其强度随着浓度增加而随之增大,生物膜形成及增长过程中分泌大量胞外聚合物[29],胞外蛋白中可能会含有酪氨酸类蛋白质和可见光类富里酸[30],而且胞外聚合物能形成三维的多孔结构,能吸附固定此类水溶性物质。而且,在整个降解过程中,蛋白峰和HA峰整体出现红移现象,这表明羰基、羟基和羧基等[31]等官能团在细胞表面发生了作用,进一步证实了红外和拉曼光谱的结果。由此可见,降解菌在代谢利用芘疏水性碳源时,降解菌不仅通过细胞表面官能团相互作用形成微生物膜促进降解,而且外源HA能够促进菌落之间的作用,加快降解的进行。
|
图 7 分支杆菌Mycobacterium sp. NJS-1在添加HA和不同浓度芘(0.1 mg·kg–1,1 mg·kg–1,10 mg·kg–1)培养7天后上清液(a,b,c)和菌沉淀(d,e,f)的EEM图像 Fig. 7 The EEM images of Mycobacterium sp. NJS-1 added HA and different concentrations of pyrene(0.1 mg·kg–1, 1 mg·kg–1, 10 mg·kg–1)after 7 days of cultivation, the supernatant(a, b, c)and bacterial pellet(d, e, f) |
溶解性有机质深刻影响着芘的降解。HA不仅能通过增加降解途径的方式促进高效降解菌Mycobacterium sp. NJS-1利用芘,还能够提高细胞的存活率并有利于其活性增强,促进微生物膜的形成。同时,HA促进高效菌Mycobacterium sp. NJS-1在代谢过程中分泌酪氨酸类蛋白质等其他物质,这些物质通过官能团之间的物理或者化学键合形成三维结构,不仅保护细胞免受外在环境胁迫,而且有利于细胞保持代谢活性促进降解。HA能够在利用微生物技术消除土壤污染物的过程中发挥重要作用。
| [1] |
Zakaria M P, Takada H, Tsutsumi S, et al. Distribution of polycyclic aromatic hydrocarbons(PAHs)in rivers and estuaries in Malaysia: A widespread input of petrogenic PAHs[J]. Environmental Science & Technology, 2002, 36(9): 1907-1918.
(  0) 0) |
| [2] |
Ni N, Song Y, Wang F, et al. A review of researches on intensified bio-remediation of polycyclic aromatic hydrocarbons contaminated soils (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(3): 561-571. [倪妮, 宋洋, 王芳, 等. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 2016, 53(3): 561-571.]
(  0) 0) |
| [3] |
Kotterman M J, Vis E H, Field J A. Successive mineralization and detoxification of benzo[a]pyrene by the white rot fungus Bjerkandera sp. strain BOS55 and indigenous microflora[J]. Applied and Environmental Microbiology, 1998, 64(8): 1853-2858.
(  0) 0) |
| [4] |
Chen X J, Jiang L J, Sun J Y, et al. Research progress in microbial degradation of polycyclic aromatic hydrocarbons (In Chinese)[J]. Modern Chemical Industry, 2018, 38(10): 34-37. DOI:10.16606/j.cnki.issn0253-4320.2018.10.008 [陈秀鹃, 姜丽佳, 孙靖云, 等. 微生物降解多环芳烃的研究进展[J]. 现代化工, 2018, 38(10): 34-37.]
(  0) 0) |
| [5] |
Breedveld G D, Sparrevik M. Nutrient-limited biodegradation of PAH in various soil strata at a creosote contaminated site[J]. Biodegradation, 2000, 11(6): 391-399. DOI:10.1023/A:1011695023196
(  0) 0) |
| [6] |
Zhang J, Dai J L, Wang R Q, et al. Adsorption and desorption of divalent mercury(Hg2+)on humic acids and fulvic acids extracted from typical soils in China[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2009, 335(1/2/3): 194-201.
(  0) 0) |
| [7] |
Pan B, Ghosh S, Xing B S. Dissolved organic matter conformation and its interaction with pyrene as affected by water chemistry and concentration[J]. Environmental Science & Technology, 2008, 42(5): 1594-1599.
(  0) 0) |
| [8] |
Zhao X L, Bi E P. Effects of dissolved organic matter on the sorption of organic pollutants to soils (In Chinese)[J]. Environmental Chemistry, 2014, 33(2): 256-261. [赵晓丽, 毕二平. 水溶性有机质对土壤吸附有机污染物的影响[J]. 环境化学, 2014, 33(2): 256-261.]
(  0) 0) |
| [9] |
Zhang Y P, Wang F, Yang X L, et al. Extracellular polymeric substances enhanced mass transfer of polycyclic aromatic hydrocarbons in the two-liquid-phase system for biodegradation[J]. Applied Microbiology and Biotechnology, 2011, 90(3): 1063-1071. DOI:10.1007/s00253-011-3134-5
(  0) 0) |
| [10] |
Zhang Y P, Wang F, Wang C Y, et al. Enhanced microbial degradation of humin-bound phenanthrene in a two-liquid-phase system[J]. Journal of Hazardous Materials, 2011, 186(2/3): 1830-1836.
(  0) 0) |
| [11] |
Smith K E C, Thullner M, Wick L Y, et al. Sorption to humic acids enhances polycyclic aromatic hydrocarbon biodegradation[J]. Environmental Science & Technology, 2009, 43(19): 7205-7211.
(  0) 0) |
| [12] |
Peng R H, Xiong A S, Xue Y, et al. Microbial biodegradation of polyaromatic hydrocarbons[J]. FEMS Microbiology Reviews, 2008, 32(6): 927-955. DOI:10.1111/j.1574-6976.2008.00127.x
(  0) 0) |
| [13] |
Zheng Y Y, Zhang J B, Tan J, et al. Chemical composition and structure of humus relative to sources (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(2): 386-397. [郑延云, 张佳宝, 谭钧, 等. 不同来源腐殖质的化学组成与结构特征研究[J]. 土壤学报, 2019, 56(2): 386-397.]
(  0) 0) |
| [14] |
张广彩. 蘑菇湖沉积物中有机质光谱指纹特征与迁移转化机制研究[D]. 济南: 山东师范大学, 2019. Zhang G C. Study on spectral fingerprint characteristics and migration and transformation mechanism of organic matter of sediments in moguhu reservoir[D]. Jinan: Shandong Normal University, 2019. (  0) 0) |
| [15] |
Stoodley P, Sauer K, Davies D G, et al. Biofilms as complex differentiated communities[J]. Annual Review of Microbiology, 2002, 56: 187-209. DOI:10.1146/annurev.micro.56.012302.160705
(  0) 0) |
| [16] |
Yang Z W. Advances of the degradation of PAHs in soils (In Chinese)[J]. Shandong Chemical Industry, 2008, 37(1): 30-33. [杨占文. 土壤中多环芳烃菲和芘降解的研究进展[J]. 山东化工, 2008, 37(1): 30-33.]
(  0) 0) |
| [17] |
Zhang L L, Zhu D Q, Wang H, et al. Humic acid-mediated transport of tetracycline and pyrene in saturated porous media[J]. Environmental Toxicology and Chemistry, 2012, 31(3): 534-541. DOI:10.1002/etc.1726
(  0) 0) |
| [18] |
Cai D, Yang X H, Wang S Z, et al. Effects of dissolved organic matter derived from forest leaf litter on biodegradation of phenanthrene in aqueous phase[J]. Journal of Hazardous Materials, 2017, 324: 516-525. DOI:10.1016/j.jhazmat.2016.11.020
(  0) 0) |
| [19] |
Decho A W, Gutierrez T. Microbial extracellular polymeric substances(EPSs)in ocean systems[J]. Frontiers in Microbiology, 2017, 8: 922.
(  0) 0) |
| [20] |
Zeng J, Lin X G, Zhang J, et al. Isolation of polycyclic aromatic hydrocarbons(PAHs)-degrading Mycobacterium spp. and the degradation in soil[J]. Journal of Hazardous Materials, 2010, 183(1/2/3): 718-723.
(  0) 0) |
| [21] |
Mantsch H H, Casal H L. Biological applications of infrared spectrometry[J]. Fresenius' Zeitschrift Für Analytische Chemie, 1986, 324(7): 655-661. DOI:10.1007/BF00468375
(  0) 0) |
| [22] |
Hu S H, Wu Y G, Yi N, et al. Chemical properties of dissolved organic matter derived from sugarcane rind and the impacts on copper adsorption onto red soil[J]. Environmental Science and Pollution Research, 2017, 24(27): 21750-21760.
(  0) 0) |
| [23] |
Rong X, Huang S S, Liu H. Progress in application of Raman spectroscopy on the cell biology studies (In Chinese)[J]. Acta Laser Biology Sinica, 2010, 19(1): 136-142. [荣曦, 黄庶识, 刘红. 拉曼光谱分析技术在细胞生物学研究中的应用进展[J]. 激光生物学报, 2010, 19(1): 136-142.]
(  0) 0) |
| [24] |
Francioso O, Ciavatta C, Sànchez-Cortés S, et al. Spectroscopic characterization of soil organic matter in long-term amendment trials[J]. Soil Science, 2000, 165(6): 495-504.
(  0) 0) |
| [25] |
Yu Q, Chen Y P, Guo J S. Screening of antibiotic-resistant bacteria in activated sludge and study of their Raman spectroscopy (In Chinese)[J]. Spectroscopy and Spectral Analysis, 2018, 38(9): 2788-2793. [禹强, 陈猷鹏, 郭劲松. 活性污泥中抗性细菌筛选及拉曼光谱检测[J]. 光谱学与光谱分析, 2018, 38(9): 2788-2793.]
(  0) 0) |
| [26] |
曲亚运. 生物材料表面吸附蛋白质介导细胞粘附和生长的生物学信号通路研究[D]. 南京: 东南大学, 2015. Qu Y Y. Study of pathway of absorbed proteins mediating cells adhesion and growth on biomaterials[D]. Nanjing: Southeast University, 2015. (  0) 0) |
| [27] |
Fox B G, Thorn R M S, Anesio A M, et al. The in situ bacterial production of fluorescent organic matter; an investigation at a species level[J]. Water Research, 2017, 125: 350-359.
(  0) 0) |
| [28] |
Susic M. Replenishing humic acids in agricultural soils[J]. Agronomy, 2016, 6(4): 45.
(  0) 0) |
| [29] |
Decho A W, Gutierrez T. Microbial extracellular polymeric substances(EPSs)in ocean systems[J]. Frontiers in Microbiology, 2017, 8: 922.
(  0) 0) |
| [30] |
Dai J Y, Zhou J M, Qin S P. Dynamic changes of chemical composition of dissolved organic matter during decomposition of organic materials (In Chinese)[J]. Chinese Journal of Soil Science, 2004, 35(6): 724-727. [代静玉, 周江敏, 秦淑平. 几种有机物料分解过程中溶解性有机物质化学成分的变化[J]. 土壤通报, 2004, 35(6): 724-727.]
(  0) 0) |
| [31] |
Chen J, Gu B H, LeBoeuf E J, et al. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions[J]. Chemosphere, 2002, 48(1): 59-68.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


