2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
甲烷是一种重要的温室气体,它在百年尺度上的全球增温潜能是二氧化碳的28倍[1]。2019年全球大气甲烷平均浓度已经达到1.877 µL·L–1,较人类工业化以前的水平增加了160%[2]。稻田是大气甲烷重要的人为排放源,全球稻田每年约排放30 Tg甲烷,贡献了人为排放总量的8%[3]。稻田甲烷的排放是甲烷产生、氧化和传输三个过程共同作用的结果。产生是排放的基础,稻田甲烷主要由乙酸发酵和CO2/H2还原产生[4-5],由于它们几乎同时发生且影响因素复杂,有关精准量化这两个主要产生途径的相对贡献率的深入研究尚值得进一步探索。
已有研究结果表明,稻田甲烷产生途径存在明显的季节变化[6],并受水分管理[7-8]、秸秆施用[9-10]、水稻种植[11-12]、土壤类型[13-14]、温度[15-16]等诸多因素的影响。例如,Zhang等[7]研究了我国江苏稻麦轮作系统甲烷产生途径的季节变化及其对田间水分管理的响应,发现在水稻生长初期,乙酸产甲烷途径占主导地位,而在水稻生长后期,CO2/H2还原产甲烷途径变得更重要;与持续淹水相比,间歇灌溉使乙酸产甲烷途径的相对贡献率ƒ乙酸降低了8%~10%;Conrad等[9]研究了秸秆施用类型对中国浙江单季稻田土壤甲烷产生途径的影响,发现施用不同秸秆不会显著改变甲烷产生途径的时间变化模式:无论是往土壤中添加水稻(C3植物)秸秆还是玉米(C4植物)秸秆,一开始主要是CO2/H2还原产甲烷的相对贡献率更大,随后乙酸发酵产甲烷变得越来越重要,最后CO2/H2还原产甲烷途径的相对贡献率再次增大;Liu等[16]报道了温度对意大利稻田土壤甲烷产生途径的影响,发现在25 ℃和35 ℃时,甲烷总是由乙酸发酵和CO2/H2还原两种途径结合产生;而在更高的温度(45 ℃)条件下,甲烷仅通过CO2/H2还原途径产生。
常年淹水稻田不同于稻麦轮作和常规单季稻田,它不仅在水稻生长季有淹水层,在非水稻生长季也保持淹水状态。全年淹水为其产甲烷创造了良好的厌氧条件,它在稻季大部分时期都有非常可观的甲烷排放[17],其甲烷排放通量远远高于其他类型稻田[18],且冬季休闲期的甲烷排放通量也较高[19]。在我国,常年淹水稻田主要分布在西南地区,其面积只占全国稻田面积的12%,但甲烷排放量却高达全国稻田甲烷排放总量的45%[20]。常年淹水稻田的甲烷产生途径可能不同于其他类型的稻田,但目前还缺乏这方面的报道。因此,通过观测常年淹水稻田的甲烷产生潜力和产生途径,旨在更加全面地理解其甲烷排放过程,从而为全球稻田甲烷减排提供理论依据。
1 材料与方法 1.1 试验区概况试验田位于四川省资阳市雁江区雁江镇响水村(30°05′N,104°34′E),该区域年平均气温16.8 ℃,年平均降水量965.8 mm。种植模式为单季稻+冬休闲,水分管理方式为全年淹水。土壤类型为侏罗纪遂宁组母质发育红棕紫泥,有机碳含量21.67 g·kg–1,全氮含量1.98 g·kg–1,pH 7.90,土壤有机碳同位素组成值–21.23‰。
1.2 试验设计供试水稻品种川优6203,于2019年3月30日育秧、4月25日移栽、9月15日收割。稻季所施氮肥为尿素,按照基追肥2︰1︰1的比例分成3次施入,施用时间分别为4月21日、5月4日和5月23日,总施肥量为283 kg·hm–2。磷肥(过磷酸钙:600 kg·hm–2)、钾肥(氯化钾:63 kg·hm–2)、锌肥(一水合硫酸锌:15 kg·hm–2)均作为基肥一次性施用。水稻收割后秸秆全部移除。
于水稻分蘖期(5月30日)、孕穗期(6月27日)、抽穗期(8月5日)和成熟期(8月19日)采集稻田新鲜土壤进行厌氧培养试验,并在培养前测定土壤溶解性有机碳(DOC)和乙酸含量。每次培养试验均设置CH3F(添加乙酸产甲烷抑制剂氟甲烷)和CK(不添加抑制剂)2个处理,每处理5个重复。首先称取20 g新鲜土壤于100 mL培养瓶中,加入无菌无氧去离子水将其制成泥浆(水土质量比1︰1),密封瓶口。将所有装有泥浆的培养瓶抽真空之后用高纯氮气冲洗,重复此过程至少6次以排尽瓶内残留的CH4和O2。随后往培养瓶中注射2%浓度CH3F作为CH3F处理[9-10];其余不添加CH3F,作为CK处理。将所有培养瓶密封,放入25 ℃培养箱中暗箱培养。于培养后1 h和50 h收集培养瓶中的气体测定CH4和CO2浓度,以计算甲烷产生潜力。于培养结束(144 h)时测定CH4和CO2的稳定性碳同位素组成,用于计算乙酸发酵和CO2/H2还原产甲烷途径的相对贡献率。每次取气结束均重新密封瓶口。
1.3 样品测定分析CH4和CO2气体浓度用带有火焰离子检测器(FID)的安捷伦气相色谱仪(Agilent 7890B)测定,柱箱温度为60 ℃,检测器温度为300 ℃,以氮气为载气,以流速45 mL·min–1的氢气为燃气,以流速400 mL·min–1的空气作为助燃气体。CH4和CO2气体的稳定性碳同位素组成用带有全自动预GC浓缩接口(PreCon)的同位素质谱仪(MAT253plus,Thermo Fisher Scientific.)分析[21]。土壤DOC用0.5 mol·L–1 K2SO4溶液提取,水土比4︰1,浸提液用总有机碳/总氮分析仪(multi N/C 3100,Analytik Jena)进行分析。土壤乙酸用超纯水提取,水土比4︰1,浸提液用安捷伦高效液相色谱仪(Agilent HPLC 1260)测定。土壤有机碳的稳定性碳同位素组成用元素分析-同位素质谱分析联用仪(Flash- 2000 Delta V ADVADTAGE,Thermo Fisher Scientific.)测定。
1.4 数据处理土壤甲烷产生潜力用以下公式进行计算[6]:
| $ P=\mathrm{d} c / \mathrm{d} t \times V / \mathrm{MV} \times \mathrm{MW} / W \times 273 / T $ | (1) |
式中,P为土壤甲烷产生潜力,单位µg·g–1·d–1;dc/dt为单位时间内培养瓶中CH4浓度发生的变化,单位µL·L–1·d–1,本研究以培养后1 h和50 h作为始末时间点;V为培养瓶内的气体体积,单位L;MV为标准状态下气体的摩尔体积,单位L·mol–1;MW为CH4的摩尔质量,单位g·mol–1;W为干土质量,单位g;T为培养温度,单位K。
α(CO2/CH4)的获得采用氟甲烷抑制法,可通过添加CH3F的土壤厌氧培养产生的CO2和CH4的δ13C值进行推算:
| $ {{{\rm{ \mathsf{ α}}} }_{\left( \text{C}{{\text{O}}_{2}}/\text{C}{{\text{H}}_{4}} \right)}}=\left( {{{\rm{ \mathsf{ δ}}} }^{13}}\text{C}{{\text{O}}_{2}}+1\;000 \right)/\left( {{{\rm{ \mathsf{ δ}}} }^{13}}\text{C}{{\text{H}}_{4\left( \text{C}{{\text{O}}_{2}} \right)}}+1\;000 \right) $ | (2) |
土壤甲烷产生途径相对贡献的量化建立在其稳定性碳同位素组成精准观测的基础上。首先,它假设甲烷产生总量(CH4(总))为乙酸发酵产生的甲烷(CH4(乙酸))和CO2/H2还原产生的甲烷(CH4(CO2))之和,即:
| $ \mathrm{CH}_{4 \text { (总) }}=\mathrm{CH}_{4 \text { (乙酸) }}+\mathrm{CH}_{4\left(\mathrm{CO}_2\right)} $ | (3) |
那么,乙酸对稻田土壤甲烷产生总量的相对贡献(ƒ乙酸)为[11]:
| $ f _\text { 乙酸 }=\mathrm{CH}_{4 \text { (乙䣲) }} /\left(\mathrm{CH}_{4 \text { (乙䣲) }}+\mathrm{CH}_{4\left(\mathrm{CO}_2\right)}\right) \times 100 \% $ | (4) |
根据碳同位素质量守恒,可得[11]:
| $ \begin{array}{c} {\rm{ \mathsf{ δ}}}^{13} \mathrm{CH}_{4 \text { (总) }}={\rm{ \mathsf{ δ}}}^{13} \mathrm{CH}_{4 \text { (乙酸) }} \times f_{\text {乙酸 }}+{\rm{ \mathsf{ δ}}}^{13} \mathrm{CH}_{4\left(\mathrm{CO}_2\right)} \times \\ (1-f _\text { 乙酸 }) \\ \end{array} $ | (5) |
式中,δ13CH4(总)为土壤总体产生的CH4的δ13C值,δ13CH4(乙酸)为乙酸发酵途径产生的CH4的δ13C值,δ13 CH4(CO2)为CO2/H2还原途径产生的CH4的δ13C值。
其中,δ13CH4(总)可以通过测定土壤厌氧培养产生的δ13CH4获得;δ13CH4(乙酸)本研究尚未测定,参考以往结果,取δ13CH4(乙酸)= –43‰~–37‰[22-23];δ13CH4(CO2)可根据土壤厌氧培养产生的CO2的δ13C值(δ13CO2)进行推算[22-23]:
| $ {{{\rm{ \mathsf{ δ}}}}}^{13} \mathrm{CH}_{4\left(\mathrm{CO}_2\right)}=\left({{{\rm{ \mathsf{ δ}}}}}^{13} \mathrm{CO}_2+1\;000\right) / {{{\rm{ \mathsf{ α}}}}}_{\left(\mathrm{CO}_2 / \mathrm{CH}_4\right)}-1\;000 $ | (6) |
平均值和标准差的计算用Microsoft Excel 2013完成。用SPSS 20软件对数据进行方差分析和相关性分析,差异显著性比较采用Duncan法。图表绘制用Origin 2017软件完成。
2 结果 2.1 甲烷产生潜力的季节变化常年淹水稻田甲烷产生潜力的季节变化如图 1所示。甲烷产生潜力随着水稻4个生育期的进行总体呈上升趋势。CK处理的土壤甲烷产生潜力的变化范围为3.22~12.71 µg·g–1·d–1。其中,成熟期土壤的甲烷产生潜力显著高于分蘖期、孕穗期、抽穗期土壤的甲烷产生潜力(P < 0.05),分别约为它们的4倍、3倍和5倍;而分蘖期、孕穗期、抽穗期3个生育期的土壤甲烷产生潜力之间无显著差异。CH3F处理的土壤甲烷产生潜力为0.10~2.48 µg·g–1·d–1,4个生育期的甲烷产生潜力之间均存在显著差异(P < 0.05)。CH3F处理的土壤甲烷产生潜力显著低于CK处理(P < 0.05),说明CH3F抑制了土壤甲烷的产生。
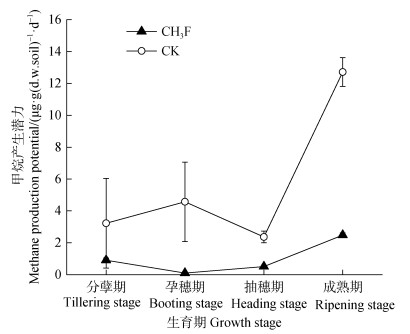
|
图 1 甲烷产生潜力的季节变化 Fig. 1 Seasonal variation of methane production potential |
水稻4个生育期土壤厌氧培养产生的CH4和CO2的δ13C如图 2所示。CK和CH3F的δ13CH4变化范围分别为–66.83‰~–59.62‰和–90.83‰~–82.26‰(图 2a)。CK处理的δ13CH4在4个生育期均无显著差异;CH3F处理的δ13CH4只在分蘖期和孕穗期有显著差异(P < 0.05)。CH3F处理产生的δ13CH4显著低于CK处理(P < 0.05)。CK和CH3F的δ13CO2季节变化趋势相似(图 2b),总体上δ13CO2值逐渐增大,至抽穗期达到最大,随后减小,变幅范围分别为–21.52‰~–17.09‰(平均值为–19.90‰)和–23.16‰~–19.56‰(平均值为–21.78‰)。
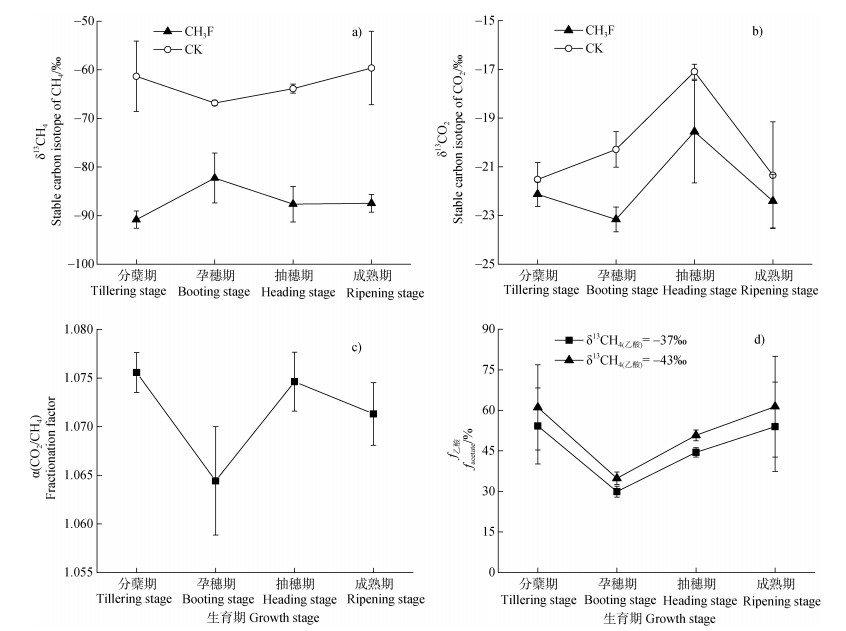
|
图 2 土壤厌氧培养产生的δ13CH4、δ13CO2、α(CO2/CH4)和ƒ乙酸的季节变化 Fig. 2 The δ13CH4 and δ13CO2 produced in soil anaerobic incubation and seasonal variation of α(CO2/CH4)and ƒacetate |
常年淹水稻田α(CO2/CH4)和ƒ乙酸的季节变化如图 2所示。随着水稻生育期的进行,α(CO2/CH4)总体呈减小趋势,在分蘖期最大,孕穗期最小;分蘖期、抽穗期、成熟期土壤α(CO2/CH4)之间的差异不大,在统计学上没有达到显著水平。4个生育期的α(CO2/CH4)变化范围为1.064~1.076(图 2c)。而ƒ乙酸则随着水稻生育期的进行呈现出先降低后升高的季节变化(图 2d)。当δ13CH4(乙酸)= –37‰时,4个生育期的ƒ乙酸变化范围为30%~54%;当δ13CH4(乙酸)= –43‰时,4个生育期的ƒ乙酸变化范围为35%~61%。ƒ乙酸在分蘖期和成熟期最大,这两个生育期土壤的ƒ乙酸没有显著差异。而在孕穗期和抽穗期,土壤ƒ乙酸较小,其中孕穗期ƒ乙酸(< 40%)显著低于分蘖期和成熟期(P < 0.05)。分蘖期和成熟期土壤ƒ乙酸较孕穗期土壤ƒ乙酸大24%~27%,而较抽穗期土壤ƒ乙酸大10%~11%。
2.4 DOC和乙酸的季节变化及其与甲烷产生潜力、ƒ乙酸的关系常年淹水稻田土壤DOC和乙酸含量的季节变化如图 3所示。土壤DOC含量随水稻生育期的进行呈升高的趋势,变化范围为224.4~315.8 mg·kg–1。4个生育期的土壤DOC含量之间均存在显著差异,成熟期土壤DOC含量显著高于其他生育期(P < 0.05)。而土壤乙酸含量随水稻生育期的进行呈先下降后上升的变化模式,变化范围为56.40~160.7 mg·kg–1。4个生育期的土壤乙酸含量之间均存在显著差异,分蘖期和成熟期的乙酸含量显著高于孕穗期和抽穗期(P < 0.05)。相关分析结果表明(表 1),资阳常年淹水稻田在稻季的甲烷产生潜力与土壤DOC含量呈显著正相关(P < 0.01),但与乙酸含量无显著相关性;ƒ乙酸与土壤DOC含量无显著相关性,但与乙酸含量呈显著正相关(P < 0.01)。
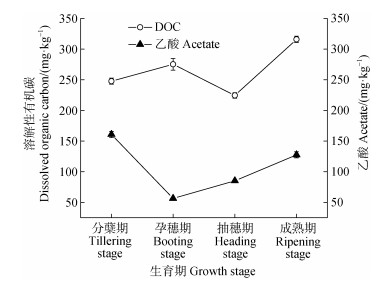
|
图 3 土壤DOC和乙酸含量的季节变化 Fig. 3 Seasonal variation of DOC and acetate content in the soil |
|
|
表 1 DOC、乙酸含量与甲烷产生潜力、ƒ乙酸间的相关系数 Table 1 Correlation coefficients between DOC content, acetate content, methane production potential and ƒacetate |
稻田甲烷的产生是在严格厌氧的条件下,土壤中的产甲烷古菌利用主要的产甲烷基质CO2/H2、乙酸产生甲烷的过程[24]。它受到土壤理化性质[25]、微生物[26]、水分管理[8]、肥料施用[27]、温度[16]等诸多因素的影响。随着水稻的生长,常年淹水稻田的甲烷产生潜力总体上趋于增大,成熟期产生的甲烷显著多于其他生育期(图 1)。这主要与水稻生长过程中根系分泌物、脱落物的增加有关。根系分泌物、脱落物是土壤DOC的重要来源[28]。它们越来越多地被释放到土壤中,使得土壤DOC含量也随之呈现增加的趋势(图 3),为产甲烷提供了丰富的基质。研究表明,湿地土壤的甲烷产生潜力与土壤DOC含量之间存在显著的正相关关系[29]。此外,早稻生长季的甲烷产生速率与土壤DOC浓度显著正相关[30]。相似地,本研究也发现常年淹水稻田在水稻4个生育期的甲烷产生潜力与土壤DOC含量的季节变化模式高度一致(表 1)。另一方面,水稻栽培期间田间温度的升高也可能使甲烷产生潜力趋于增大。丁维新和蔡祖聪[31]认为在温度较高时,土壤中的产甲烷菌优势菌为能够同时利用乙酸和CO2/H2的甲烷八叠球菌,因而土壤具有较高的产甲烷能力;而温度较低时土壤中的产甲烷菌优势菌则变成只能利用乙酸这一种产甲烷基质的甲烷毛菌,所以土壤产甲烷能力相对变弱。遗憾的是,本研究并未进行产甲烷菌相关的分析。
甲烷产生的过程中会发生碳同位素分馏[23]。通常用同位素分馏系数来表征分馏程度的大小。乙酸转化为甲烷的分馏程度(ε(乙酸/CH4))和CO2转化为甲烷的分馏程度(α(CO2/CH4))存在明显差异。在应用稳定性碳同位素自然丰度法研究稻田甲烷产生途径时,ε(乙酸/CH4)相对比较稳定,一般为–21‰[32],而α(CO2/CH4)波动较大,常见的取值为1.045和1.060[33]。α(CO2/CH4)会受到土壤类型、产甲烷菌、H2浓度、温度等因素的影响。例如:Sugimoto和Wada[5]测得日本稻田土壤的α(CO2/CH4)为1.049,Chidthaisong等[34]测得美国稻田土壤的α(CO2/CH4)为1.052,而Conrad[35]测得意大利稻田土壤的α(CO2/CH4)为1.072;Games等[33]通过纯培养试验发现巴氏甲烷八叠球菌的α(CO2/CH4)为1.045,而相同条件下甲烷杆菌M.o.H.菌株的α(CO2/CH4)为1.061;Valentine等[36]发现在H2供应浓度降低时,马尔堡甲烷嗜热杆菌纯培养物的α(CO2/CH4)会相对增大:H2分压为80 000 Pa和310 Pa时的α(CO2/CH4)分别为1.031和1.064;Fey等[15]发现意大利稻田土壤的α(CO2/CH4)会随厌氧培养温度的增加而减小:10 ℃时为1.083,25 ℃时为1.079,37 ℃时为1.076,50 ℃时为1.073。本研究通过添加2%浓度的CH3F来抑制乙酸产甲烷[9-10],根据式(2)求得常年淹水稻田α(CO2/CH4)在稻季的变化范围为1.064~1.076,与以往报道的α(CO2/CH4)结果类似。
在自然生态系统中,产甲烷基质乙酸的浓度往往可能会很低而无法对其进行同位素分析[37]。而在我们的研究中,未添加CH3F的土样在厌氧培养结束时的乙酸浓度也基本上低于检测限,因而无法测定乙酸的碳同位素组成。Krüger等[22]测定出意大利稻田孔隙水的δ13C乙酸 = –16.17‰ ± 0.30‰~–20.70‰ ± 2.31‰,通过假定ε(乙酸/CH4)= –21‰[32]得到δ13CH4(乙酸)= –43‰~–37‰。尽管本研究的土壤有机碳δ13C值(δ13C有机碳 = –21.23‰)较Krüger等[22](δ13C有机碳 = –26.7‰)的大5‰,但仍假设δ13CH4(乙酸)= –43‰~–37‰以定量估算ƒ乙酸,主要出于以下两方面考虑。一方面,–43‰~–37‰已被诸多研究引用[5,7,11-12,15,23],获得的ƒ乙酸结果便于与以往的进行比较。另一方面,Sugimoto和Wada[5]发现,尽管他们的稻田土壤δ13C有机碳与Blair和Carter[38]的海洋沉积物δ13C有机碳相差19‰,但由二者得到的乙酸产生的δ13CH4值却非常一致,这表明土壤δ13C有机碳值本身对δ13CH4(乙酸)的影响可能较小。
总体而言,常年淹水稻田乙酸对甲烷产生的相对贡献ƒ乙酸为30%~54%(δ13CH4(乙酸)= –37‰)和35%~61%(δ13CH4(乙酸)= –43‰)(图 2d),这与以往稻麦轮作稻田的结果类似。在季节变化趋势上,Krüger等[22,39]的研究认为,意大利稻田(水稻收获前排水)的乙酸产甲烷主要在水稻生长后期占主导地位,Zhang等[8,40]发现中国稻麦轮作稻田也有相同趋势;Tyler等[11]发现美国稻田(水稻收获前排水)的乙酸产甲烷在水稻生长初期更重要;而本研究的ƒ乙酸在水稻分蘖期和成熟期都较大(图 2d),这可能与其特殊的水分管理有关。常年淹水稻田在水稻休闲期也保持淹水,使得稻田一直处于严格厌氧条件,有机质分解积累的乙酸足够满足分蘖期的乙酸产甲烷过程。而成熟期水稻根系分泌物以及衰老和死亡组织脱落物的增加也可能为乙酸产甲烷过程提供丰富的碳源[41],导致乙酸的供应水平是影响甲烷产生途径的关键因素[6]。深入分析发现,常年淹水稻田乙酸含量在分蘖期和成熟期最大,ƒ乙酸的季节变化与相应的乙酸含量的季节变化呈显著正相关(表 1)。此外,产甲烷途径的相对贡献应该与产甲烷菌群落组成也有一定关系。由于乙酸营养型产甲烷菌利用乙酸产甲烷,而氢营养型产甲烷菌利用CO2和H2产生甲烷[24],因此,理论上若乙酸营养型产甲烷菌相对丰度及活性比氢营养型产甲烷菌高,则乙酸对甲烷产生的相对贡献就可能更大,但相关推测仍需通过后续研究来验证。
4 结论常年淹水稻田的甲烷产生潜力和产生途径存在明显的季节变化:甲烷产生潜力随水稻生育期的进行呈上升趋势,总体表现为成熟期的显著高于分蘖期、孕穗期和抽穗期;乙酸产甲烷途径的相对贡献率随水稻生育期的进行呈先降低后升高的变化模式,即在分蘖期和成熟期较大,而在孕穗期最小。常年淹水稻田的甲烷产生潜力主要受土壤DOC含量的影响,而土壤乙酸含量显著影响其产甲烷的贡献。
| [1] |
IPCC. Climate change 2013: The physical science basis[R]. Cambridge, United Kingdom and New York, USA: Cambridge University Press, 2013.
(  0) 0) |
| [2] |
WMO. Greenhouse gas bulletin: The state of greenhouse gases in the atmosphere based on global observations through 2019[R]. https://library.wmo.int/, 2020.
(  0) 0) |
| [3] |
Saunois M, Stavert A R, Poulter B, et al. The global methane budget 2000-2017[J]. Earth System Science Data, 2020, 12(3): 1561-1623. DOI:10.5194/essd-12-1561-2020
(  0) 0) |
| [4] |
Takai Y S. The mechanism of methane fermentation in flooded paddy soil[J]. Soil Science and Plant Nutrition, 1970, 16(6): 238-244. DOI:10.1080/00380768.1970.10433371
(  0) 0) |
| [5] |
Sugimoto A, Wada E. Carbon isotopic composition of bacterial methane in a soil incubation experiment: Contributions of acetate and CO2/H2[J]. Geochimica et Cosmochimica Acta, 1993, 57(16): 4015-4027. DOI:10.1016/0016-7037(93)90350-6
(  0) 0) |
| [6] |
Cai Z C, Xu H, Ma J. Methane and nitrous oxide emissions from rice-based ecosystems (In Chinese). Hefei: University of Science and Technology of China Press, 2009. [蔡祖聪, 徐华, 马静. 稻田生态系统CH4和N2O排放[M]. 合肥: 中国科学技术大学出版社, 2009.]
(  0) 0) |
| [7] |
Zhang G B, Ji Y, Ma J, et al. Intermittent irrigation changes production, oxidation, and emission of CH4 in paddy fields determined with stable carbon isotope technique[J]. Soil Biology & Biochemistry, 2012, 52: 108-116.
(  0) 0) |
| [8] |
Zhang G B, Liu G, Zhang Y, et al. Methanogenic pathway and fraction of CH4 oxidized in paddy fields: Seasonal variation and effect of water management in winter fallow season[J]. PLoS One, 2013, 8(9): e73982. DOI:10.1371/journal.pone.0073982
(  0) 0) |
| [9] |
Conrad R, Klose M, Lu Y H, et al. Methanogenic pathway and archaeal communities in three different anoxic soils amended with rice straw and maize straw[J]. Frontiers in Microbiology, 2012, 3: 4. DOI:10.3389/fmicb.2012.00004
(  0) 0) |
| [10] |
Ji Y, Liu P F, Conrad R. Change of the pathway of methane production with progressing anoxic incubation of paddy soil[J]. Soil Biology & Biochemistry, 2018, 121: 177-184.
(  0) 0) |
| [11] |
Tyler S C, Bilek R S, Sass R L, et al. Methane oxidation and pathways of production in a Texas paddy field deduced from measurements of flux, δl3C, and δD of CH4[J]. Global Biogeochemical Cycles, 1997, 11(3): 323-348. DOI:10.1029/97GB01624
(  0) 0) |
| [12] |
Bilek R S, Tyler S C, Sass R L, et al. Differences in CH4 oxidation and pathways of production between rice cultivars deduced from measurements of CH4 flux and δ13C of CH4 and CO2[J]. Global Biogeochemical Cycles, 1999, 13(4): 1029-1044. DOI:10.1029/1999GB900040
(  0) 0) |
| [13] |
Yao H, Conrad R. Electron balance during steady-state production of CH4 and CO2 in anoxic rice soil[J]. European Journal of Soil Science, 2000, 51(3): 369-378.
(  0) 0) |
| [14] |
Nakagawa F, Yoshida N, Sugimoto A, et al. Stable isotope and radiocarbon compositions of methane emitted from tropical rice paddies and swamps in Southern Thailand[J]. Biogeochemistry, 2002, 61(1): 1-19. DOI:10.1023/A:1020270032512
(  0) 0) |
| [15] |
Fey A, Claus P, Conrad R. Temporal change of 13C-isotope signatures and methanogenic pathways in rice field soil incubated anoxically at different temperatures[J]. Geochimica et Cosmochimica Acta, 2004, 68(2): 293-306. DOI:10.1016/S0016-7037(03)00426-5
(  0) 0) |
| [16] |
Liu P F, Klose M, Conrad R. Temperature effects on structure and function of the methanogenic microbial communities in two paddy soils and one desert soil[J]. Soil Biology & Biochemistry, 2018, 124: 236-244.
(  0) 0) |
| [17] |
Jiang C S, Wang Y S, Zheng X H, et al. CH4 and N2O emission from a winter-time flooded paddy field in a hilly area of Southwest China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2005, 16(3): 539-544. DOI:10.3321/j.issn:1001-9332.2005.03.029 [江长胜, 王跃思, 郑循华, 等. 川中丘陵区冬灌田甲烷和氧化亚氮排放研究[J]. 应用生态学报, 2005, 16(3): 539-544.]
(  0) 0) |
| [18] |
Zhang G B, Ma J, Yang Y T, et al. Variations of stable carbon isotopes of CH4 emission from three typical rice fields in China[J]. Pedosphere, 2017, 27(1): 52-64. DOI:10.1016/S1002-0160(15)60096-0
(  0) 0) |
| [19] |
Ma X M, Zhu B, Du Z L, et al. CH4, CO2 and N2O emissions from the year-round flooded paddy field at fallow season (In Chinese)[J]. Journal of Agro-Environmental Science, 2005, 24(6): 1199-1202. DOI:10.3321/j.issn:1672-2043.2005.06.031 [马秀梅, 朱波, 杜泽林, 等. 冬水田休闲期温室气体排放通量的研究[J]. 农业环境科学学报, 2005, 24(6): 1199-1202.]
(  0) 0) |
| [20] |
Cai Z C. Research progress on methane emission from rice field in China (In Chinese)[J]. Soils, 1999, 31(5): 266-269. [蔡祖聪. 中国稻田甲烷排放研究进展[J]. 土壤, 1999, 31(5): 266-269.]
(  0) 0) |
| [21] |
Cao Y C, Sun G Q, Han Y, et al. Determination of nitrogen, carbon and oxygen stable isotope ratios in N2O, CH4, and CO2 at natural abundance levels by mass spectrometer (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(2): 249-258. DOI:10.3321/j.issn:0564-3929.2008.02.009 [曹亚澄, 孙国庆, 韩勇, 等. 大气浓度下N2O、CH4和CO2中氮、碳和氧稳定同位素比值的质谱测定[J]. 土壤学报, 2008, 45(2): 249-258.]
(  0) 0) |
| [22] |
Krüger M, Eller G, Conrad R, et al. Seasonal variation in pathways of CH4 production and in CH4 oxidation in rice fields determined by stable carbon isotopes and specific inhibitors[J]. Global Change Biology, 2002, 8(3): 265-280. DOI:10.1046/j.1365-2486.2002.00476.x
(  0) 0) |
| [23] |
Conrad R, Klose M, Claus P. Pathway of CH4 formation in anoxic rice field soil and rice roots determined by 13C-stable isotope fractionation[J]. Chemosphere, 2002, 47(8): 797-806. DOI:10.1016/S0045-6535(02)00120-0
(  0) 0) |
| [24] |
Conrad R. Microbial ecology of methanogens and methanotrophs[J]. Advances in Agronomy, 2007, 96: 1-63.
(  0) 0) |
| [25] |
Xu H, Cai Z C, Ba M Y X. Methane production potentials of rice paddy soils and its affecting factors (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(1): 98-104. DOI:10.3321/j.issn:0564-3929.2008.01.013 [徐华, 蔡祖聪, 八木一行. 水稻土CH4产生潜力及其影响因素[J]. 土壤学报, 2008, 45(1): 98-104.]
(  0) 0) |
| [26] |
Dubey S K, Singh A, Singh R S, et al. Changes in methanogenic population size and CH4 production potential in response to crop phenology in tropical rice field[J]. Soil Biology & Biochemistry, 2013, 57: 972-978.
(  0) 0) |
| [27] |
Xu X, Chen C, Xiong Z Q. Effects of biochar and nitrogen fertilizer amendment on abundance and potential activity of methanotrophs and methanogens in paddy field (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(6): 1517-1527. [许欣, 陈晨, 熊正琴. 生物炭与氮肥对稻田甲烷产生与氧化菌数量和潜在活性的影响[J]. 土壤学报, 2016, 53(6): 1517-1527.]
(  0) 0) |
| [28] |
Kalbitz K, Solinger S, Park J H, et al. Controls on the dynamics of dissolved organic matter in soils: A review[J]. Soil Science, 2000, 165(4): 277-304. DOI:10.1097/00010694-200004000-00001
(  0) 0) |
| [29] |
Liu D Y, Ding W X, Yuan J J, et al. Substrate and/or substrate-driven changes in the abundance of methanogenic Archaea cause seasonal variation of methane production potential in species-specific freshwater wetlands[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4711-4721. DOI:10.1007/s00253-014-5571-4
(  0) 0) |
| [30] |
Wang C, Lai D Y F, Sardans J, et al. Factors related with CH4 and N2O emissions from a paddy field: Clues for management implications[J]. PLoS One, 2017, 12(1): e0169254. DOI:10.1371/journal.pone.0169254
(  0) 0) |
| [31] |
Ding W X, Cai Z C. Effect of temperature on methane production and oxidation in soils (In Chinese)[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 604-608. [丁维新, 蔡祖聪. 温度对甲烷产生和氧化的影响[J]. 应用生态学报, 2003, 14(4): 604-608.]
(  0) 0) |
| [32] |
Gelwicks J T, Risatti J B, Hayes J M. Carbon isotope effects associated with aceticlastic methanogenesis[J]. Applied and Environmental Microbiology, 1994, 60(2): 467-472.
(  0) 0) |
| [33] |
Games L M, HayesRobert J M, Gunsalus P. Methane-producing bacteria: Natural fractionations of the stable carbon isotopes[J]. Geochimica et Cosmochimica Acta, 1978, 42(8): 1295-1297.
(  0) 0) |
| [34] |
Chidthaisong A, Chin K J, Valentine D L, et al. A comparison of isotope fractionation of carbon and hydrogen from paddy field rice roots and soil bacterial enrichments during CO2/H2 methanogenesis[J]. Geochimica et Cosmochimica Acta, 2002, 66(6): 983-995.
(  0) 0) |
| [35] |
Conrad R. Quantification of methanogenic pathways using stable carbon isotopic signatures: A review and a proposal[J]. Organic Geochemistry, 2005, 36(5): 739-752.
(  0) 0) |
| [36] |
Valentine D L, Chidthaisong A, Rice A, et al. Carbon and hydrogen isotope fractionation by moderately thermophilic methanogens[J]. Geochimica et Cosmochimica Acta, 2004, 68(7): 1571-1590.
(  0) 0) |
| [37] |
Whiticar M J. Carbon and hydrogen isotope systematics of bacterial formation and oxidation of methane[J]. Chemical Geology, 1999, 161(1/2/3): 291-314.
(  0) 0) |
| [38] |
Blair N E, Carter W D Jr. The carbon isotope biogeochemistry of acetate from a methanogenic marine sediment[J]. Geochimica et Cosmochimica Acta, 1992, 56(3): 1247-1258.
(  0) 0) |
| [39] |
Krüger M, Frenzel P, Conrad R. Microbial processes influencing methane emission from rice fields[J]. Global Change Biology, 2001, 7(1): 49-63.
(  0) 0) |
| [40] |
Zhang G B, Ji Y, Ma J, et al. Pathway of CH4 production, fraction of CH4 oxidized, and 13C isotope fractionation in a straw-incorporated rice field[J]. Biogeosciences, 2013, 10(5): 3375-3389.
(  0) 0) |
| [41] |
Jia Z J, Cai Z C, Xu H, et al. Effect of rice plants on CH4 production, transport, oxidation and emission in rice paddy soil[J]. Plant and Soil, 2001, 230(2): 211-221.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


