2. 楚雄师范学院资源环境与化学学院, 云南楚雄675000;
3. 中国科学院大学, 北京 100049
2. School of Environmental and Chemistry, Chuxiong Normal University, Chuxiong, Yunnan 675000, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
作物秸秆富含碳、氮、磷、钾等营养元素,是常用的农田有机肥料。中国142项秸秆还田试验结果表明,92%的试验中作物产量随秸秆还田量的增加而增加[1]。施用秸秆通过调节土壤温度和水分、改善土壤结构,提升土壤有机碳、速效养分含量和酶活性[1-2],从而有助于提高产量。然而,也有研究表明,施用秸秆即使对土壤理化性质有所改善,但仍会造成作物减产[3]。秸秆既能影响微生物生存的环境,也为其提供可利用的底物[1]。因此,施用秸秆对作物生产的不同效应很大程度上可能归因于微生物群落组成发生了不同程度或不同方向的改变[3-5]。
土壤细菌和真菌是耕地生态系统中重要组成部分,分泌多种酶,促进养分循环,是土壤肥力的敏感指标[6],也是保障全球粮食的重要驱动力。植物生长促生菌不仅可合成生产素,还可通过自身代谢活动(溶磷、解钾、固氮等)使土壤元素有效化,利于植物吸收利用[7]。生防微生物依靠种间作用或代谢产物抑制病原菌的存活与活动[8]。此外,某些细菌和真菌类群是与作物病害暴发相关的病原菌[9]。越来越多的研究证实,施用秸秆重塑了土壤微生物群落,改变了土壤酶活性和关键物种丰度[6,10-12]。周文新等[10]研究表明,秸秆还田提高了土壤中解磷解钾菌、硝化和反硝化细菌的数量。刘骅等[11]发现,秸秆还田后,土壤固氮菌、氨化细菌等的丰度平均提高了15%,反硝化细菌、放线菌、纤维分解菌等的丰度平均增加44%。秸秆还田还可增加病原菌的数量[12]。因此,秸秆引发的土壤微生物丰度的改变及微生物间的相互作用可能调控着作物产量。
共现网络常用来表达微生物对外界干扰而表现出的相互共存和排斥关系,并识别与土壤功能和作物生产高度相关的关键微生物[13]。网络中的模块集成了复杂的高维度的物种信息,是多个高度关联、共享同一生态位的物种的集合,视为生态集群[14]。最新研究发现,生态集群的特性,比如其优势物种丰度、多样性等与作物产量显著相关[4-5,15]。Fan等[4]报道,在大空间尺度上,小麦产量与集群的相对丰度显著相关。长期施用无机肥和秸秆后,土壤微生物群落对秸秆和无机肥反应灵敏,生态集群中包含了一些营养菌和植物病原菌,这些关键微生物类群调节着作物生长[15]。40年田间施肥后,作物产量与生态网络中的关键种群的多样性之间存在较强的正相关关系[5]。土壤细菌和真菌共享环境和营养资源且存在着共生、对抗或竞争等相互作用[16],因此它们几乎肯定会形成占据不同生态位的集群,其特征可能与作物产量有关。了解对秸秆有不同响应的微生物对产量的调节作用,有利于识别能够提高作物产量的微生物,也可深入了解地下微生物生态关系及其对地上生产力的影响。然而,目前对秸秆诱导形成的细菌-真菌共现网络中的微生物在调节作物生产中的贡献仍不清楚。
本研究利用中国粮食产区两种典型土壤即红壤和黄褐土为研究对象,进行了三水平秸秆处理的小麦盆栽实验,主要研究目的包括:(1)明确秸秆施用对不同类型土壤上作物产量的影响;(2)明确秸秆施用对土壤化学性质、酶活性、细菌-真菌共现网络特征的影响;(3)评估秸秆施用导致的土壤化学性质和微生物性质变化对作物产量变异的影响。
1 材料与方法 1.1 试验设计供试红壤和黄褐土分别采自江西省鹰潭县(28°15'20" N,116°55'30" E)和河南省方城县(33°9′57″ N,112°48′9″ E)。于2015年7月采集典型农田表层土壤(0~20 cm),避光风干,过2 mm筛备用,试验前土壤基础理化性质见表 1。供试秸秆采自收获期的玉米秸秆,风干粉碎后备用。秸秆有机碳含量427.31 g·kg–1、全氮含量13.54 g·kg–1、全磷含量2.75 g·kg–1、全钾含量9.88 g·kg–1。
|
|
表 1 供试土壤基础理化性质 Table 1 Basic physicochemical properties of the tested soil |
盆栽试验于2015年11月10日至2016年5月25日进行,种植作物为冬小麦(Triticum aestivum L.,豫麦57)。每种土壤设3个水平秸秆施用量(0、10、30 g·kg–1土)处理(S0、S10、S30),每个处理3个重复,共18个盆钵。每盆(直径23 cm ×高23 cm)装5 kg风干土(粒径 < 2 mm)。试验用肥料包括尿素、磷酸钙和氯化钾,分别以N 150 mg·kg–1、P2O5 110 mg·kg–1和K2O 82.5 mg·kg–1的比例一次性基施。秸秆用粉碎机粉碎(长度 < 0.5 mm)并与土壤充分混合。每盆播种麦种30粒,苗期减至16株。试验期间每隔3 d采用称重法补充水分,保持土壤含水量在最大持水量的80%水平。盆钵平时放在室外,下雨时搬入温室。害虫用杀虫剂控制,杂草手动清除。
1.2 样品采集与分析在小麦收获期(2016年5月25日)破坏性采集土样(非根际土)。一部分土样置于–80 ℃冰箱保存,用于土壤DNA提取。土壤pH采用土水比1︰2.5测定;硝态氮(
土壤DNA采用Fast DNA Spin Kit for Soil(MP Biomedicals,USA)按说明书操作步骤从0.5 g鲜土中提取。使用1%的琼脂糖凝胶电泳检测DNA质量,使用NanoDrop 2000(NanoDrop Technologies,USA)测定DNA浓度和纯度。用引物515F(5’-GTGCCAGCMGCCGCGGTAA-3’)/907R(5’-CCGTCAATTCMTTTRAGTTT-3’)和ITS5F(5’-GGAAGTAAAAGTCGTAACAAGG-3’)/ITS1R(5’-GCTGCGTTCTTCATCGATGC-3’)分别进行细菌和真菌PCR扩增,选取细菌16S rRNA基因的V4-V5区和真菌ITS1区进行高通量测序。采用Illumina公司MiSeq测序仪完成序列分析,红壤中细菌和真菌平均得到35 237条和48 165条序列,黄褐土中细菌和真菌平均得到31 476条和46 970条测序。细菌和真菌测序数据已上传至公共数据库(http://bigd.big.ac.cn/gsa),序列号为CRA005094和CRA005095。对原始双端序列质控、拼接和引物切除[21]。采用QIIME(1.91)去除低质量序列并用RDP数据库去除嵌合体[22]。得到的高质量序列采用Uparse软件,以97%的相似度进行OTU划分。采用Blast方法以Greengeens13.8和Unite数据库进行细菌和真菌物种分类注释。最终,红壤和黄褐土中分别得到901个OTU(细菌629个,真菌272个)和802个OTU(细菌582个,真菌220个)。基于Bray-Curtis距离对处理间细菌和真菌群落进行的主成分分析(Principal Component Analysis,PCA)在QIIME中完成。
1.4 细菌-真菌共现网络构建使用R(4.0.1)“psych”程序包计算细菌—真菌类群(属水平)两两之间“Spearman”相关系数并采用FDR方法校正,选择相关系数r > |0.8|且P < 0.01的显著相关关系构建细菌-真菌共现网络。利用Gephi(0.9.2)实现网络可视化,并进行网络模块化分析(参数设置为系统默认设置),选择包含节点数≥15的模块作为微生物集群用于后续分析。
1.5 数据处理采用单因素方差分析(ANOVA)和Duncan多重比较分析处理间小麦籽粒产量、地上部生物量、土壤化学性质、酶活性的差异。置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)判断不施秸秆(S0)与施用秸秆处理(S10、S30)间细菌和真菌群落结构的差异。计算网络中主要模块中所有属的累积丰度,用Z分数对模块累计丰度进行标准化并视其为模块的相对丰度。对模块和模块中优势属(这些属的总丰度占模块累积丰度85%以上)的相对丰度进行单因素方差分析和Duncan多重比较。利用偏最小二乘路径模型(Partial Least Squares Path Modeling,PLSPM)评估土壤化学性质、酶活性和微生物集群三个因子之间的作用及其对小麦产量的影响;每个因子中有显著作用的指标变量用于后续分析。采用一元线性回归模型分析微生物集群(模块)相对丰度与籽粒产量和地上生物量的关系。计算模块中细菌和真菌优势属相对丰度、土壤化学性质、酶活性、小麦籽粒产量和地上部生物量两两间“Spearman”相关系数(P < 0.05),并用Cytoscape(3.7.1)软件对其相关关系可视化。PERMANOVA和路径分析分别用R(4.0.1)中的“vegan”和“plspm”程序包完成;其余统计分析采用软件SPSS 24.0进行。
2 结果 2.1 小麦籽粒产量和地上部生物量图 1表示,红壤上小麦籽粒产量和地上部生物量均随着秸秆施用量的增加稳步增加,而黄褐土中的籽粒产量和地上部生物量则稳步降低。红壤中,与S0相比,S10和S30处理小麦籽粒产量分别提高33%和73%,地上部生物量分别提高44%和85%(图 1a);而黄褐土中,S10和S30处理的小麦籽粒产量分别降低22%和55%,地上部生物量分别降低25%和55%(图 1b)。

|
注:a):红壤;b):黄褐土。S0:不施秸秆;S10:秸秆施用量为10 g·kg–1土;S30:秸秆施用量为30 g·kg–1土。误差线表示标准偏差;不同小写字母表示处理间的显著差异(邓肯法,P < 0.05)。Note:a):The red soil;b):The yellow-cinnamon soil. S0,S10,S30:Straw was applied at a rate of 0,10,30 g·kg–1 soil. The error bars represent the standard deviation of the mean,different lower letters indicate a significant difference between treatments(Duncan method,P < 0.05). 图 1 不同处理小麦籽粒产量和地上部生物量 Fig. 1 Grain yield and above-ground biomass of the wheat relative to treatments |
随着秸秆施用量增加,红壤中
|
|
表 2 不同处理的土壤化学性质 Table 2 Soil chemical properties relative to treatments |
在黄褐土中,随着秸秆施用量增加,土壤pH、
无论是红壤还是黄褐土,土壤中与碳氮磷循环转化有关的酶活性,即AMY、INV、PPO、URE、ACP和DEH活性均随着秸秆施用量的增加而呈增加趋势。上述酶活性在红壤的S10和S30处理中的增幅分别达6.9%~88.7%和20.7%~533.3%,在黄褐土中的增幅分别为6.4%~69.3%和10.6%~302.0%。红壤中PPO活性以及黄褐土中的PPO和URE活性在S0和S10处理间未达到显著差异(表 3)。
|
|
表 3 不同处理的土壤酶活性 Table 3 Soil enzyme activities relative to treatments |
红壤和黄褐土中优势细菌门均为变形菌门(Proteobacteria,平均相对丰度分别为32.3%和41.7%)、绿弯菌门(Chloroflexi,25.6%和6.5%)、放线菌门(Actinobacteria,18.2%和23.8%)和酸杆菌门(Acidobacteria,6.6%和11.6%)。真菌中以子囊菌门(Ascomycota,76.7%和49.8%)、担子菌门(Basidiomycota,2.8%和5.0%)和接合菌门(Zygomycota,10.1%和12.0%)占优势。图 2主成分分析显示,两轴PC1和PC2分别解释了红壤和黄褐土细菌群落结构的76.2%和58.4%的总方差(图 2a、图 2b)以及真菌群落结构的61.8%和65.5%的总方差(图 2c、图 2d)。不施秸秆(S0)和施用秸秆处理(S10、S30)间呈现一定的群落结构分异。PERMANOVA显示,与S0相比,施用秸秆后两种土壤细菌和真菌群落结构均发生显著变化(P < 0.05)。

|
图 2 红壤和黄褐土不同处理的细菌(a,b)和真菌群落(c,d)主成分分析(Bray-Curtis距离) Fig. 2 Principal component analysis(PCA) depicting the Bray-Curtis distance of bacterial and fungal communities of three treatments in the red soil(a, c) and yellow-cinnamon soil(b, d) |
红壤细菌-真菌共现网络中,对秸秆施用响应高度相关的微生物主要分为3个较大的集群(模块)(图 3a)。红壤中,模块1的微生物丰度随着秸秆施用量增加而逐渐降低(图 3b),该模块以细菌Terracoccus、Bacillus、Candidatus(属于酸杆菌门)、Methylibium、Microbacterium、Pseudomonas及真菌Porodisculus、Rhizophydium占优势;除Terracoccus外,施用秸秆后这些优势属的丰度均受到抑制,尤其是Candidatus和Methylibium丰度显著降低(图 3c,ANOVA,P < 0.05)。尽管秸秆施用显著提高模块2中微生物丰度,但S30处理的微生物丰度显著低于S10处理(图 3b),该模块以细菌Rhodanobacter、Rhodoplanes、Devosia及真菌Monographella、Didymella、Aspergillus、Fusarium占优势;除Didymella外,这些属均因施用秸秆而富集(图 3c,ANOVA,P < 0.05)。秸秆施用没有影响模块3的微生物丰度(图 3b),该模块以细菌Streptacidiphilus、Phenylobacterium、Paenibacillus、Nostocoida及真菌Mortierella、Geminibasidium、Mucronella、Chaetomium为主,这些属对施用秸秆耐受性强,其丰度随着秸秆施用无显著变化(图 3c,ANOVA,P > 0.05)。
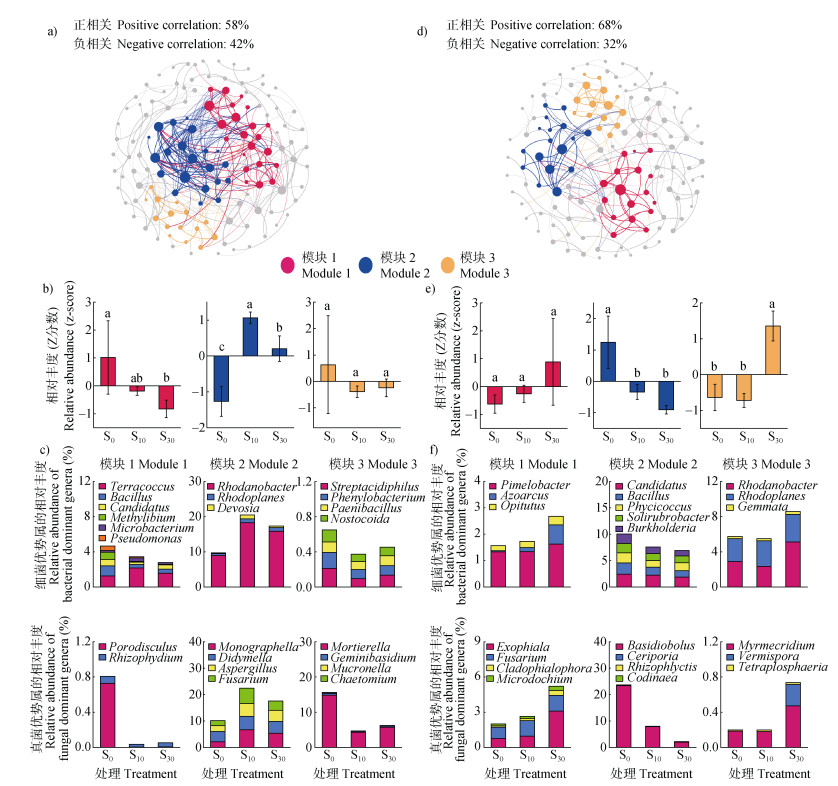
|
注:图a),d):红壤和黄褐土细菌-真菌共现网络及生态集群(模块1~3);图b),e):红壤和黄褐土不同处理间的模块相对丰度(累积丰度的Z分数);图c),f):红壤和黄褐土不同处理的模块中细菌和真菌优势属的丰度(优势属的总丰度占模块总丰度85%以上)。Note:Figure a),d):Co-occurrence networks and microbial clusters(Module 1~3)in the red soil and yellow-cinnamon soil,respectively. Figure b),e):Relative abundance(z-score of accumulating abundance)of microbial clusters of treatments in the red soil and yellow-cinnamon soil,respectively. Figure c),f):Relative abundance(%)of dominant genera(their sum accounts for more than 85% of the module abundance)in each microbial cluster of treatments in the red soil and yellow-cinnamon soil,respectively. 图 3 微生物生态集群组成及其丰度 Fig. 3 Composition of microbial clusters and their relative abundance |
黄褐土细菌-真菌共现网络中,对秸秆施用响应高度相关的微生物主要分为3个较大的集群(模块)(图 3d)。黄褐土中模块1的微生物丰度在处理间无显著差异(图 3e),该模块以细菌Pimelobacter、Azoarcus和Opitutus占优势,真菌以Exophiala、Fusarium、Cladophialophora和Microdochium为主,这些属对施用秸秆耐受性强,其丰度无显著变化(图 3f,ANOVA,P > 0.05)。秸秆施用显著降低模块2的微生物丰度,但其丰度在S10和S30处理间无显著差异(图 3e),该模块以细菌中Candidatus、Bacillus、Phycicoccus、Solirubrobacter、Burkholderia和真菌中Basidiobolus、Ceriporia、Rhizophlyctis、Codinaea占优势,施用秸秆后这些优势属的丰度均受到抑制,尤其是Candidatus、Bacillus、Burkholderia和Basidiobolus的丰度显著降低(图 3f,ANOVA,P < 0.05)。S30处理显著增加模块3中微生物丰度,但S10与S0处理间微生物丰度无显著变化(图 3e),该模块以细菌中Rhodanobacter、Rhodoplanes、Gemmata和真菌中Myrmecridium、Vermispora、Tetraplosphaeria占优势(图 3f),其中Rhodanobacter、Rhodoplanes和Myrmecridium仅在高量施用秸秆(S30处理)后其丰度显著升高(图 3f,ANOVA,P < 0.05)。
2.6 土壤化学性质、酶活性、微生物集群与作物产量之间关系将土壤化学性质,酶活性和微生物集群(以每个模块的相对丰度作为指标变量)作为影响因子,利用路径分析评估这三个因子对小麦产量的影响(图 4a、图 4b)。发现无论是红壤还是黄褐土,微生物集群和酶活性对小麦产量的总效应远高于土壤化学性质。路径分析表明,红壤中微生物集群和土壤酶活性均对小麦产量有直接显著正效应,其中微生物集群也可通过显著影响酶活性而间接影响作物产量(图 4a,P < 0.05);图 4c表示解释方差较大的微生物集群参数为模块1和2的丰度,酶活性主要为AMY、PPO、ACP和DEH活性,土壤化学性质主要为pH和

|
注:a),c):红壤;b),d):黄褐土。图A),B)中黑色数字表示直接效应系数;黑色加粗数字表示总效应系数;*表示作用显著。M1,M2:模块1,2的丰度;Grain:小麦籽粒产量;Biomass:小麦地上部生物量。Note:a),c):The red soil;b),d):The yellow-cinnamon soil. In Figures A)and B),the black numbers represent direct effect coefficients and the bold numbers represent total effect coefficients.* indicates significant effect. M1 and M2:the relative abundance of Module 1 and 2. Yield:Grain yield of the wheat;Biomass:Above-ground biomass of the wheat. 图 4 路径分析评估微生物集群、土壤化学性质和酶活性对小麦产量的影响 Fig. 4 Partial least squares path model(PLSPM) evaluated the effects between three factors as microbial clusters, soil chemical properties, enzyme activitiesand wheat yield |
进一步利用回归分析揭示两种土壤中模块1和模块2的丰度与小麦产量的关系,发现红壤中,模块1相对丰度与籽粒产量和地上部生物量呈显著负向线性关系;模块2相对丰度与它们无显著线性相关性(图 5a,P < 0.05)。黄褐土中,模块1相对丰度与籽粒产量和地上部生物量呈显著负向线性关系,模块2相对丰度却与它们呈显著正向线性关联(图 5b,P < 0.05)。

|
图 5 红壤(a)和黄褐土(b)微生物集群丰度与小麦产量的回归分析 Fig. 5 Linear regression analysis of the relationships between the relative abundance of microbial clusters and wheat yield(grain yield and aboveground biomass) in the red soil(a) and yellow-cinnamon soil(b) |
为明确模块中的优势属在调节产量中发挥的作用,对路径分析中具有较大解释方差的模块1和2中的优势属、化学性质、酶活性、小麦籽粒产量和地上生物量进行相关分析。发现红壤中,模块1中Methylibium与籽粒产量和地上生物量显著负相关,模块2中Aspergillus与籽粒产量显著正相关(图 6a)。化学性质

|
注:pH:土壤酸碱度; |
本研究发现,秸秆施用后,红壤和黄褐土中微生物群落结构均发生了显著变化(图 2);两种土壤中对秸秆有着一致响应的微生物均可聚集成三个不同的生态集群(富集型、抑制型或耐受型)(图 3),且生态集群丰度对小麦产量均有直接显著正效应,并主要受制于模块1和模块2丰度的变化(图 4、图 5)。进一步分析发现,红壤中秸秆施用导致小麦产量增加与秸秆诱导的模块1和模块2中的关键微生物Methylibium丰度降低和Aspergillus丰度增加有关(图 3e、图 6a);黄褐土中小麦产量随秸秆施用量增加而显著降低,且这与秸秆施用导致的模块2中的关键微生物Bacillus、Burkholderia、Basidiobolus丰度显著降低有关(图 3f、图 6b)。
秸秆中富含纤维素、半纤维素和木质素,Methylibium具有较强的降解半纤维素和单芳香烃化合物的能力,其对秸秆反应敏感,常被视为秸秆还田和耕作的标志性微生物[23]。但Methylibium的丰度常随着秸秆还田而降低[23],这也限制了秸秆的降解和其所含营养元素的释放,不利于作物生长。研究表明,土壤中如果Methylibium等能够潜在弱化矿化作用并促进腐殖化进程的微生物占有比例高,则土壤拥有更高的土壤有机碳和腐殖质含量[24]。Aspergillus的物种多能够在秸秆上很好的定殖,并分泌葡糖苷酶、葡聚糖酶、木聚糖酶和纤维素酶[25],促进秸秆中纤维素和半纤维素的分解。研究表明,在土壤中接种Aspergillus tubingensis和Aspergillus niger,土壤中有机碳、磷含量和酶活性都明显提升,且显著提高作物产量[26]。本研究中秸秆施用降低了红壤中Methylibium丰度(图 3e),因而小麦产量的增加主要与秸秆施用诱导的Aspergillus丰度增加有关。
Bacillus是典型的植物促生菌,其多数种类具有溶磷、固氮、降解蛋白质及木质素的功能,能分泌多种物质调控细胞内植物激素代谢,提高植物的抗逆性,促进植物生长,防止病原体感染[27-28]。以Bacillus spp.为基础的多种商业生物肥料已广泛用于提高作物产量[28]。研究表明[29],利用Bacillus作为生物防治剂可以减少线虫侵染危害,并分泌有益的酶,从而提高作物产量。Burkholderia的成员占据广泛的生态位,其代谢活动与氮循环密切相关,是植物生长促生菌和固氮菌之一,且能分泌抗真菌化合物,常被用于生物防治、生物修复和促进植物生长的菌剂[30]。Basidiobolus属于腐生真菌,具有利用植物残体中淀粉和多种糖类化合物的能力[31]。因而,秸秆还田导致黄褐土中作物产量显著降低与这些益生菌丰度显著降低密切相关。
3.2 土壤酶活性和化学性质对作物产量的影响红壤中pH和
以往很多研究已表明[32-33],秸秆还田能够显著提升土壤养分含量、酶活性,且这些参数的提升与作物产量密切相关。胡乃娟等[32]报道,连续两季秸秆还田提高了土壤水溶性有机碳、微生物生物量碳和土壤脲酶、蔗糖酶活性,小麦增产达11.5%,且土壤碳库和酶活性的提高与小麦产量显著相关。赵亚丽等[33]研究表明,秸秆还田提高了土壤有机碳和蔗糖酶、脲酶、磷酸酶活性,且它们与小麦产量显著正相关,小麦产量平均提高了约18.6%。而本研究中,秸秆施用不仅改善了红壤化学性质,同时活化了与碳氮磷循环转化有关的酶活性,且二者对作物产量有直接的正效应;并与关键微生物共同作用于作物产量。而黄褐土中,秸秆施用虽然改善了土壤化学性质,活化了酶活性,但其对产量的潜在正效应低于秸秆施用诱导的关键微生物在调节产量中发挥的作用,而关键微生物的作用最终导致了作物产量降低,因此黄褐土中化学性质和酶活性表现出与作物产量显著负相关关系。此外,秸秆还田对不同土壤的物理性质的改变对作物产量的调节作用也不容忽视。本研究基于盆栽实验的结果仍需要后续田间实验的进一步验证。
4 结论随着秸秆施用量增加,红壤上小麦产量显著增加而黄褐土上产量显著降低。秸秆施用均提升了两种土壤中速效养分、可溶性有机碳和微生物生物量碳含量及与碳氮磷循环转化有关的酶活性。土壤化学性质、酶活性、微生物模块丰度在红壤上与小麦产量正相关;而在黄褐土上微生物模块丰度与产量正相关,土壤化学性质和酶活性则与产量负相关。秸秆施用显著降低红壤上与小麦产量显著负相关的关键物种Methylibium丰度而增加与小麦产量显著正相关的关键物种Aspergillus丰度;在黄褐土上,与小麦产量显著正相关的关键微生物Bacillus、Burkholderia、Basidiobolus丰度随着秸秆施用量增加而显著降低。秸秆施用后,红壤上作物产量显著增加与秸秆改善土壤化学性质、活化酶活性、改变关键微生物丰度有关,且上述因素对作物产量的影响有叠加效应;而黄褐土上产量显著降低主要与秸秆施用显著降低了益生菌丰度有关,且其影响效应超过化学性质和酶活性的改善对作物产量的效应。
| [1] |
Zhao H, Sun B F, Lu F, et al. Straw incorporation strategy on cereal crop yield in China[J]. Crop Science, 2015, 55(4): 1773-1781. DOI:10.2135/cropsci2014.09.0599
(  0) 0) |
| [2] |
Gong X J, Qian C R, Cao X, et al. Effects of nitrogen fertilizer on soil enzymatic activity, soil nutrients and decomposition rate of maize straw (In Chinese)[J]. Journal of Maize Sciences, 2020, 28(2): 151-155. DOI:10.13597/j.cnki.maize.science.20200222 [宫秀杰, 钱春荣, 曹旭, 等. 玉米秸秆还田配施氮肥对土壤酶活、土壤养分及秸秆腐解率的影响[J]. 玉米科学, 2020, 28(2): 151-155.]
(  0) 0) |
| [3] |
Yang X R, Xu B, He Z F, et al. Impacts of decomposing microorganism inoculum on straw decomposition and crop yield in China: A meta-analysis (In Chinese)[J]. Scientia Agricultura Sinica, 2020, 53(7): 1359-1367. [杨欣润, 许邶, 何治逢, 等. 整合分析中国农田腐秆剂施用对秸秆腐解和作物产量的影响[J]. 中国农业科学, 2020, 53(7): 1359-1367.]
(  0) 0) |
| [4] |
Fan K K, Delgado-Baquerizo M, Zhu Y G, et al. Crop production correlates with soil multitrophic communities at the large spatial scale[J]. Soil Biology & Biochemistry, 2020, 151: 108047.
(  0) 0) |
| [5] |
Fan K K, Delgado-Baquerizo M, Guo X S, et al. Biodiversity of key-stone phylotypes determines crop production in a 4-decade fertilization experiment[J]. The ISME Journal, 2021, 15(2): 550-561. DOI:10.1038/s41396-020-00796-8
(  0) 0) |
| [6] |
Tian P Y, Shen C, Zhao H, et al. Enzyme activities and microbial communities in rhizospheres of plants in salinized soil in north Yinchuan, China (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 217-226. [田平雅, 沈聪, 赵辉, 等. 银北盐碱区植物根际土壤酶活性及微生物群落特征[J]. 土壤学报, 2020, 57(1): 217-226.]
(  0) 0) |
| [7] |
Pellegrini M, Pagnani G, Bernardi M, et al. Cell-free supernatants of plant growth-promoting bacteria: A review of their use as biostimulant and microbial biocontrol agents in sustainable agriculture[J]. Sustainability, 2020, 12(23): 9917. DOI:10.3390/su12239917
(  0) 0) |
| [8] |
Bashan Y, Holguin G. Proposal for the division of plant growth-promoting rhizobacteria into two classifications: biocontrol-PGPB(plant-growth-promoting bacteria) and PGPB[J]. Soil Biology & Biochemistry, 1998, 30(8/9): 1225-1228.
(  0) 0) |
| [9] |
Aung K, Kim P, Li Z P, et al. Pathogenic bacteria target plant plasmodesmata to colonize and invade surrounding tissues[J]. The Plant Cell, 2020, 32(3): 595-611. DOI:10.1105/tpc.19.00707
(  0) 0) |
| [10] |
Zhou W X, Chen D L, Bu Y J, et al. Effects of rice-straw returning to the field on the metabolic diversity of soil microbial communities (In Chinese)[J]. Acta Scientiae Circumstantiae, 2008, 28(2): 326-330. DOI:10.3321/j.issn:0253-2468.2008.02.016 [周文新, 陈冬林, 卜毓坚, 等. 稻草还田对土壤微生物群落功能多样性的影响[J]. 环境科学学报, 2008, 28(2): 326-330.]
(  0) 0) |
| [11] |
Liu H, Lin Y H, Wang X H, et al. Effect of long-term application of straw on grey desert soil quality (In Chinese)[J]. Ecology and Environment, 2007, 16(5): 1492-1497. [刘骅, 林英华, 王西和, 等. 长期配施秸秆对灰漠土质量的影响[J]. 生态环境, 2007, 16(5): 1492-1497.]
(  0) 0) |
| [12] |
Dong H Y, Dong Z, Liu K J, et al. Effects of different maize straw returning modeson occurrence of main diseases of maize (In Chinese)[J]. Crops, 2020(6): 104-108. [董怀玉, 董智, 刘可杰, 等. 不同秸秆还田模式对玉米主要病害发生为害的影响[J]. 作物杂志, 2020(6): 104-108.]
(  0) 0) |
| [13] |
Banerjee S, Schlaeppi K, van der Heijden M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567-576. DOI:10.1038/s41579-018-0024-1
(  0) 0) |
| [14] |
Duran-Pinedo A E, Paster B, Teles R, et al. Correlation network analysis applied to complex biofilm communities[J]. PLoS One, 2011, 6(12): e28438. DOI:10.1371/journal.pone.0028438
(  0) 0) |
| [15] |
Fan K K, Delgado-Baquerizo M, Guo X S, et al. Microbial resistance promotes plant production in a four-decade nutrient fertilization experiment[J]. Soil Biology & Biochemistry, 2020, 141: 107679.
(  0) 0) |
| [16] |
de Menezes A B, Richardson A E, Thrall P H. Linking fungal-bacterial co-occurrences to soil ecosystem function[J]. Current Opinion in Microbiology, 2017, 37: 135-141. DOI:10.1016/j.mib.2017.06.006
(  0) 0) |
| [17] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [18] |
Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen(DON) and dissolved organic carbon(DOC) in soil[J]. Soil Biology & Biochemistry, 2006, 38(5): 991-999.
(  0) 0) |
| [19] |
Wu J, Joergensen R G, Pommerening B, et al. Measurement of soil microbial biomass C by fumigation-extraction—an automated procedure[J]. Soil Biology & Biochemistry, 1990, 22(8): 1167-1169.
(  0) 0) |
| [20] |
Guan S Y. Soil enzyme and its research methods (In Chinese). Beijing: Agriculture Press, 1986. [关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986.]
(  0) 0) |
| [21] |
Ma L, Guo Z B, Wang D Z, et al. Effect of long-term application of phosphorus fertilizer on soil bacterial community structure and enzymatic activity in lime concretion black soil relative to P application rate (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(6): 1459-1470. [马垒, 郭志彬, 王道中, 等. 长期三水平磷肥施用梯度对砂姜黑土细菌群落结构和酶活性的影响[J]. 土壤学报, 2019, 56(6): 1459-1470.]
(  0) 0) |
| [22] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
(  0) 0) |
| [23] |
Xia X Y, Zhang P P, He L L, et al. Effects of tillage managements and maize straw returning on soil microbiome using 16S rDNA sequencing[J]. Journal of Integrative Plant Biology, 2019, 61(6): 765-777.
(  0) 0) |
| [24] |
Yan J F, Wang L, Hu Y, et al. Plant litter composition selects different soil microbial structures and in turn drives different litter decomposition pattern and soil carbon sequestration capability[J]. Geoderma, 2018, 319: 194-203.
(  0) 0) |
| [25] |
Valle-Pérez A U, Flores-Cosío G, Amaya-Delgado L. Bioconversion of Agave bagasse to produce cellulases and xylanases by Penicillium citrinum and Aspergillus fumigatus in solid-state fermentation[J]. Waste and Biomass Valorization, 2021, 12(11): 5885-5897.
(  0) 0) |
| [26] |
Kaur G, Reddy M S. Improvement of crop yield by phosphate-solubilizing Aspergillus species in organic farming[J]. Archives of Agronomy and Soil Science, 2017, 63(1): 24-34.
(  0) 0) |
| [27] |
Chakraborty U, Chakraborty B N, Dey P L, et al. Bacillus safensis from wheat rhizosphere promotes growth and ameliorates salinity stress in wheat[J]. Indian Journal of Biotechnology, 2018, 17(3): 466-479.
(  0) 0) |
| [28] |
Radhakrishnan R, Hashem A, Abd Allah E F. Bacillus: A biological tool for crop improvement through bio-molecular changes in adverse environments[J]. Frontiers in Physiology, 2017, 8: 667.
(  0) 0) |
| [29] |
Sukumaran S, Dailin D J, Malek R A, et al. Production of high cell mass of Bacillus firmus using statistical medium optimization[J]. Journal of Scientific and Industrial Research, 2019, 78(6): 358-363.
(  0) 0) |
| [30] |
Lu J K, Yang F C, Wang S K, et al. Co-existence of rhizobia and diverse Non-rhizobial bacteria in the rhizosphere and nodules of Dalbergia odorifera seedlings inoculated with Bradyrhizobium elkanii, Rhizobium multihospitium-Like and Burkholderia pyrrocinia-Like strains[J]. Frontiers in Microbiology, 2017, 8: 2255.
(  0) 0) |
| [31] |
Manning R J, Waters S D, Callaghan A A. Saprotrophy of Conidiobolus and Basidiobolus in leaf litter[J]. Mycological Research, 2007, 111(12): 1437-1449.
(  0) 0) |
| [32] |
Hu N J, Han X Z, Yang M F, et al. Short-term influence of straw return on the contents of soil organic carbon fractions, enzyme activities and crop yields in rice-wheat rotation farmland (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(2): 371-377. [胡乃娟, 韩新忠, 杨敏芳, 等. 秸秆还田对稻麦轮作农田活性有机碳组分含量、酶活性及产量的短期效应[J]. 植物营养与肥料学报, 2015, 21(2): 371-377.]
(  0) 0) |
| [33] |
Zhao Y L, Guo H B, Xue Z W, et al. Effects of tillage and straw returning on microorganism quantity, enzyme activities in soils and grain yield (In Chinese)[J]. Chinese Journal of Applied Ecology, 2015, 26(6): 1785-1792. [赵亚丽, 郭海斌, 薛志伟, 等. 耕作方式与秸秆还田对土壤微生物数量、酶活性及作物产量的影响[J]. 应用生态学报, 2015, 26(6): 1785-1792.]
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


