2. 西北农林科技大学生命科学学院, 旱区作物逆境生物学国家重点实验室, 陕西农业与环境微生物重点实验室, 陕西杨凌 712100;
3. 中国农业大学生物学院, 北京 100193;
4. 西北农林科技大学植物保护学院, 陕西杨凌 712100;
5. 陕西省神木市生态保护建设协会, 陕西神木 719399;
6. 中国科学院水利部水土保持研究所, 陕西杨凌 712100
2. College of Life Science, Northwest A&F University, State Key Laboratory of Crop Stress Biology for Arid Areas, Shaanxi Key Laboratory of Agricultural and Environmental Microbiology, Yangling, Shaanxi 712100, China;
3. College of Biological Sciences, China Agricultural University, Beijing 100193, China;
4. College of Plant Protection, Northwest A&F University, Yangling, Shaanxi 712100, China;
5. Shenmu Ecological Protection and Construction Association, Shenmu, Shaanxi 719399, China;
6. Institute of Soil and Water Conservation, Chinese Academy of Sciences and Ministry of Water Resources, Yangling, Shaanxi 712100, China
漠生态系统中沙化土壤贫瘠和生物多样性相对低下,人工林恢复被认为是改善土壤质量和恢复沙化退化生态系统功能的有效方法[1]。土壤氮磷养分是制约植物群落构建和演替及其生态服务功能稳定的关键因素,植被枯落物输入及根际过程等是土壤养分来源的关键途径[2]。土壤微生物作为地下养分循环的重要角色,影响土壤质量并改变生态系统生产力[3]。因此,了解贫瘠沙地人工林恢复过程中土壤化学性质和微生物群落的动态变化可为风沙区人工林的健康经营和土壤肥力培育提供理论依据。
碳、氮和磷作为土壤性质的核心元素,不仅是反映土壤肥力和质量水平的重要指标,更是维持生态系统结构和功能的重要因素[4]。人工林恢复通过凋落物等有机物质返还来增加土壤养分含量[5],并且随着恢复年限增加呈显著上升趋势[6]。土壤微生物群落相比于土壤性质对环境变化更为敏感,植被类型和土壤栖息地环境是决定土壤微生物代谢活性和群落构成的关键因素[3]。在自然生态系统中,土壤微生物和原生植物相互作用和协同进化,影响和推动土壤生物化学循环和植被群落的生态恢复与演替进程[7]。引入外来物种可直接或间接干扰土著植被群落与土壤微生物群落已形成的稳定生态体系[8],进而调控土壤微生物群落的生态与功能演化进程。土壤剖面中微生物群落分布受多重环境因子的影响,如土壤深度、基质有效性、pH及水分等[9]。在农田、森林等生态系统中土壤微生物丰度随土壤深度增加而降低[10],表层土壤微生物丰度较深层土壤的高1~2个数量级,这主要是因为随土壤深度增加基质生物有效性逐步衰减[11]。微生物群落剖面分布与根系分布格局密切相关,根系通过自然更新、向下延展和传导地上光合产物及分泌释放有机无机复合物,共同影响土壤剖面有机质及其轻重组分的分布[12]。此外,随土壤深度增加,剖面缺氧状态逐步加剧,会抑制好氧微生物群落的富集与生长。尽管深层土壤碳氮磷等基质含量偏低,但仍有相当数量的微生物存在并且代谢活性很高,其在联结地上–地下物质能量交换、调节和支撑生态系统稳定方面发挥着关键作用[13-14]。
在我国北方荒漠区,受降雨历时短、强度大和地表蒸发量大的影响,沙化土壤剖面易形成干湿交替与好氧–厌氧环境[15];加之沙化土壤透水性强,碳氮养分与矿物质元素等会向下运移和累积,从而形成复杂的土壤剖面微生境[16]。对分布在该区贫瘠立地环境中的人工林而言,随林龄的增加根系逐渐沿横–纵方向交错延伸扩张以吸收养分与水分,必定会改变土壤剖面水分和养分的空间格局。在此情景下,微生物群落在快速变化的土壤剖面微生境中的群落组成与多样性及生态功能的变化特征尚不明确。因此,本研究以陕北风沙区广泛分布的外来树种樟子松人工林(面积超过10万hm2)为研究对象,分析不同林龄土壤化学性质的空间变化特征,并借助16S rRNA高通量扩增子测序和FAPROTAX(functional annotation of prokaryotic taxa)功能预测相结合的方法,解析土壤剖面细菌群落结构及多样性的变化特征,并揭示细菌群落与土壤环境因子之间的生态联结,以期为风沙区樟子松人工林可持续管理与土壤质量的恢复保育提供理论支撑。
1 材料与方法 1.1 研究区概况研究区位于陕西省神木市生态保护建设协会治沙造林基地(38°53′N,109°52′E),地处毛乌素沙地东南缘,平均海拔高度为1 250~1 280 m,土壤类型主要为风沙土。该地区温带大陆性气候显著,年平均温度和年均降水量分别为8.9℃和440 mm。目前,该地区主要植被类型有沙地樟子松(Pinus sylvestris var. mongolica)、长柄扁桃(Amygdalus pedunculata)、早熟禾(Poa annua)、花棒(Hedysarum scoparium)、蒺藜(Tribulus terrestris)等。
1.2 土壤样品采集与处理2018年7月,根据时空替代法在研究区选择无经营管理措施、长势良好、林下植被相似的5、8、15年(5、8、15 a)的樟子松人工林作为实验组,并选取未造林土壤,即重度荒漠化土壤作为对照组(0 a)。每个林龄布设的样方面积为20 m×20 m。用土钻法在每个土壤深度(0~10、10~20、20~30、30~60和60~100 cm)沿S形钻取9个土样并混合一个样品,其中采样间距约为2 m,共获得60个土壤样品(4个林龄×5个土层×3个重复)。清除每个土壤样品中明显的植物根系和凋落物,将土样充分混合并分成两部分,一部分立即储存于–80℃冰箱内以便进行土壤微生物分析,另一部分风干后进行土壤化学性质分析。
1.3 土壤样品分析土壤化学性质的测定参照鲍士旦[17]的方法进行。土壤有机碳(SOC)采用重铬酸钾容量法测定,全磷(TP)采用硫酸-高氯酸消煮—钼锑抗比色法测定,全氮(TN)采用凯氏定氮法测定,有效磷(AP)采用碳酸氢钠浸提—钼锑抗比色法测定,有效氮(AN)采用碱解扩散法测定,pH采用电位法测定(土:水=1:2.5)。
土壤微生物DNA利用FastDNA™ SPIN Kit for Soil试剂盒(MP Biomedicals,Santa Ana,CA,美国)提取,并通过0.8%琼脂糖电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行浓度和纯度检测。对16S rRNA基因V4~V5可变区进行PCR扩增,扩增引物序列为515F(5′-GTGCCAGC MGCCGCGGTAA-3′)和907R(5′-CCGTCAATTCC TTTGAGTTT-3′)。扩增体系(25 µL):5 µL 5×反应缓冲液,5 µL 5×GC缓冲液,2 µL dNTP(2.5 mmol·L–1),1µL正向引物(10 µmol·L–1),1 µL反向引物(10 µmol·L–1),2 µL DNA模板,8.75 µL灭菌双蒸水,0.25 µL Q5 DNA聚合酶。扩增程序为:98℃预变性2 min;(98℃变性15 s,55℃退火30 s,72℃延伸30 s)×30个循环;72℃延伸5 min。PCR扩增产物经2%琼脂糖凝胶电泳检测,使用AxyPrep凝胶回收试剂盒(AXYGEN,New York,美国)对目标片段进行切胶回收。使用Illumina MiSeq平台(Illumina Corporation,San Diego,美国)进行双端测序(300 bp),测序由上海派森诺生物科技有限公司完成。测序结果使用QIIME软件(Quantitative Insights Into Microbial Ecology,v1.8.0,http://qiime.org/)进行分析。首先调用USEARCH(v5.2.236,http://www.drive5.com/usearch/)检查并剔除嵌合体序列。随后使用UCLUST序列比对工具对保留的高质量序列按97%的相似度进行归并和可操作分类单元(OTU,operational taxonomic unit)划分。采用Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com/)对OTU代表序列进行分类鉴定。根据最低测序深度统一进行随机重抽样,以避免测序深度导致的样本间差异。
1.4 数据处理与分析所有数据分析运用Excel 2019、SPSS 26、Origin 2021、RStudio Version 1.3.1093完成。采用基于多度覆盖的物种估计量(abundance-based coverage estimator,ACE)指数(反映细菌物种丰富度)和香农(Shannon)指数(反映菌群多样性)来表征土壤细菌α多样性;根据样品OTU矩阵内Bray-Curtis距离进行非度量多维尺度分析(non-metric multidimensional scaling analysis,NMDS)揭示不同造林年限土壤细菌群落组成的差异,并进行相似性分析(analysis of similarities,ANOSIM)判断差异是否显著(P < 0.05);细菌群落相似性由1-(Bray-Curtis距离矩阵)获得;使用FAPROTAX数据库来预测细菌潜在生态功能。通过单因素方差分析(one-way ANOVA)并进行最小显著性差异检验(LSD test,P < 0.05)分析不同林龄土壤化学性质、细菌群落α多样性指数、优势菌群相对丰度、群落β多样性及潜在生态功能的差异;土壤化学性质、群落α多样性指数和群落相似性随土层深度的变化通过线性最小二乘回归分析(linear least-squares regression)实现;土壤化学性质与细菌群落结构和潜在生态功能的相关性分别通过冗余分析(redundancy analysis)和皮尔森(Pearson)相关性分析实现。
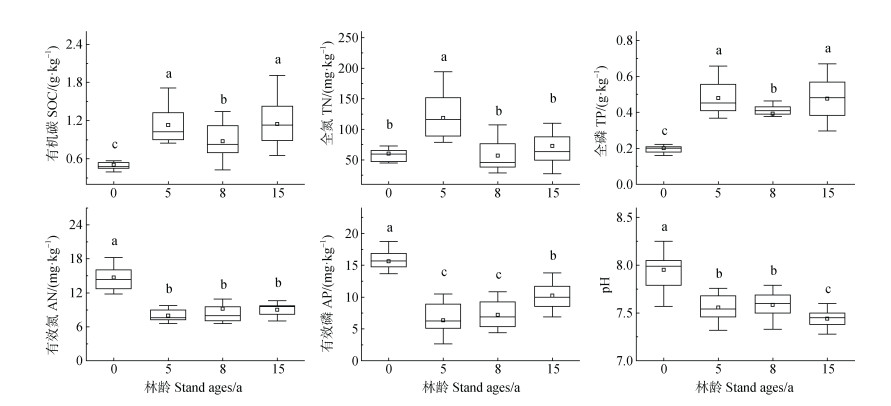
2 结果 2.1 不同林龄土壤化学性质不同林龄土壤的化学性质变化特征如图 1所示。SOC、TN、TP含量随林龄的增加呈波动变化,其中SOC含量在造林15年时达到峰值,均值为1.15 g·kg–1;TN和TP含量在造林初期(5年)时含量最高,均值分别为118.8 mg·kg–1和0.48 g·kg–1。AN含量和pH随林龄增加而显著降低;AP含量表现出随林龄先下降后上升的趋势,在造林初期含量最低,均值为6.33 mg·kg–1。
|
注:不同小写字母表示不同林龄间差异显著(P < 0.05)。下同。 Note: Different lowercase letters indicate significant differences among stand ages at P < 0.05. The same as below. 图 1 不同造林年限土壤化学性质变化 Fig. 1 Variation in soil chemical properties among stand ages |
在土壤剖面(0~100 cm)中,土壤化学性质随土层深度的变化如图 2所示。随土层深度增加,不同林龄土壤TN含量均显著降低,而AP含量和pH均显著增加;TP含量无显著变化。此外,随土层深度增加,SOC含量在未造林土壤中无显著变化,在造林土壤中显著下降;AN含量在未造林土壤中显著下降,而在造林土壤中无显著变化。

|
注:S,斜率。下同。 Note: S, slope. The same as below. 图 2 土壤化学性质随土层深度的变化 Fig. 2 Variation in soil chemical properties across soil depth |
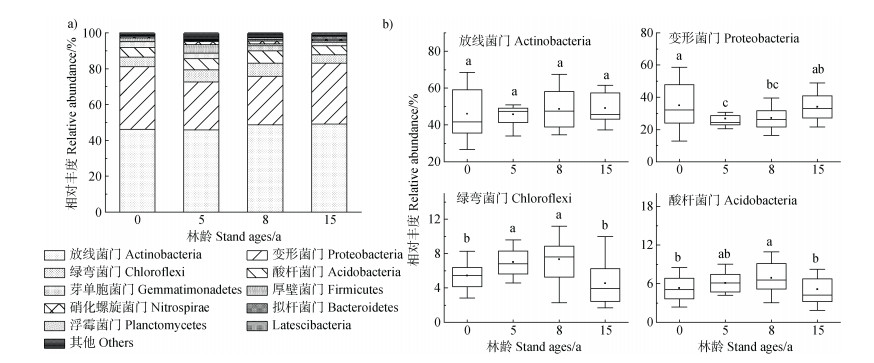
通过16S rRNA基因测序共获得1 785 838条有效序列,经97%相似度过滤聚类后得到9 451个OTUs。土壤细菌群落在门水平上的物种丰度如图 3a所示。其中放线菌门(Actinobacteria)占绝对优势,平均相对丰度为47.39%(45.76%~49.12%);其次是变形菌门(Proteobacteria),平均相对丰度为30.73%(26.75%~34.95%);绿弯菌门(Chloroflexi),平均相对丰度为6.08%(4.54%~7.33%);酸杆菌门(Acidobacteria),平均相对丰度为5.85%(5.10%~6.90%),共占到了所有微生物总数的90%以上。随林龄增加,变形菌门的相对丰度先下降后上升,在5年时具有最低值,均值为26.75%;而绿弯菌门和酸杆菌门的相对丰度先上升后下降,在8年时达到峰值,均值分别为7.33%和6.90%;放线菌门的相对丰度在不同林龄中无显著变化(图 3b)。此外,人工林恢复过程中各优势细菌的相对丰度在不同土壤深度中的变化如表 1所示。与未造林土壤相比,造林15年后,放线菌门的相对丰度在0~10 cm土层中显著下降;变形菌门的相对丰度在0~10 cm的表层土壤显著上升,而在30 cm以下的深层土壤显著下降。30~60 cm土层中酸杆菌门的相对丰度在造林8年后显著上升。60~100 cm土层中绿弯菌门的相对丰度在造林5年后显著上升。
|
图 3 不同造林年限土壤细菌群落门水平组成(a)和优势细菌门相对丰度的变化(b) Fig. 3 Bacterial community composition at the phylum level(a) and variation in the relative abundance of dominant bacterial phyla(b) |
|
|
表 1 不同土层优势细菌门相对丰度变化 Table 1 Variation in the relative abundance of dominant bacterial phyla in soil profiles among stand ages |
人工林恢复提高了土壤细菌群落的ACE指数,但香农指数在不同林龄中无显著差异(图 4a)。在未造林土壤中,细菌ACE指数和香农指数随土壤深度增加而显著降低,但造林后,其在剖面中未表现出明显的变化趋势(图 4b)。

|
注:ACE,基于多度覆盖的物种估计量。 Note: ACE, Abundance-based Coverage Estimator. 图 4 土壤细菌群落ɑ多样性在不同林龄(a)及土壤剖面(b)中的变化 Fig. 4 Variation in the alpha-diversity indices of bacteria community across stand ages(a) and soil profiles(b) |
如图 5a所示,基于Bray-Curtis距离的非度量多维尺度分析(NMDS)表明,不同林龄的土壤细菌群落(0~100 cm)总体上显示出明显区分(ANOSIM检验,P < 0.001),但在5年与8年林龄土壤中重叠较多。在不同造林年限土壤微生物群落β多样性差异分析中,未造林土壤β多样性最高,表明其具有较高的群落分散度(图 5b)。进一步分析群落相似性的垂直距离衰减关系发现,随着造林年限增加其斜率逐渐增加,且在15年造林土壤中变化最显著(图 5c),表明在荒漠生态系统营造人工林后显著降低了细菌群落的垂直空间变异。

|
图 5 人工林恢复过程土壤细菌群落β多样性变化(a. 细菌群落结构的非度量多维尺度分析(NMDS);b. 不同林龄细菌群落的β多样性差异;c. 细菌群落相似性随土层深度的变化) Fig. 5 Variation in beta-diversity of soil bacterial community during stand development(a. Non-metric multidimensional scaling analysis(NMDS) of bacterial community structure; b. Differences in beta-diversity among stand ages were estimated based on Bray–Curtis distance matrix; c. Variation in community similarity across soil depth) |
基于FAPROTAX数据库预测的结果如表 2所示,共有12种与C、N循环有关的功能具有显著变化。营造人工林后,土壤细菌群落对有机物质分解潜力下降,如纤维素分解、芳香族化合物降解和好氧化学异养过程在造林15年后分别下降了54.65%、72.18%和23.53%。与N循环有关的生态功能变化更为显著,人工林恢复增强了微生物对N的固定以及反硝化过程的潜力,在15年时达到最高,与未造林土壤相比分别增加了99.26%和100.5%。此外,尿素分解在造林15年后增加275%。
|
|
表 2 基于FAPROTAX预测的土壤细菌生态功能相对丰度 Table 2 Relative abundance of bacterial ecological functions based on the FAPROTAX database |
通过冗余分析确定了土壤环境因子对细菌优势物种和多样性指数的影响,结果(图 6a)表明,RDA1轴和RDA2轴的解释度分别为15.82%和9.22%,累计解释量为25.04%。各环境因子对细菌群落组成和多样性的影响程度为SOC、pH和AP最大,TP和TN影响次之,AN影响最小。酸杆菌门与TN、TP呈正相关,与AN、AP和pH呈负相关;变形菌门与除TN、TP以外的环境因子均呈正相关;绿弯菌门与所有环境因子均呈负相关;同时,土壤微生物多样性均与SOC、TP和TN呈正相关,与AN、AP和pH呈负相关。此外,对所预测的微生物生态功能和土壤环境因子进行皮尔森相关性分析,结果(图 6b)发现,SOC和pH是影响细菌生态功能的主要因素,其次是AN、TP和AP。SOC与尿素分解、反硝化、亚硝酸盐呼吸、木聚糖分解和固氮过程呈正相关,而与芳香族化合物降解和壳聚糖分解过程呈负相关;pH与固氮、反硝化、尿素分解和亚硝酸盐呼吸呈负相关,而与好氧化学异养、芳香族化合物降解和壳聚糖分解呈正相关。

|
注:a. 红色箭头表示细菌优势物种和多样性指数,蓝色箭头表示土壤环境因子;b. X轴为土壤环境因子,Y轴为细菌群落潜在生态功能。图例颜色表示相关性,*,P < 0.05,**,P < 0.01,***,P < 0.001。 Note: a. Red arrows indicate the major phyla and diversity indices, and blue arrows indicate soil environment factors; b. The X-axis indicates the soil environment factors and Y-axis indicates the putative ecological functions. The color range of the legend indicates correlation. *, P < 0.05, **, P < 0.01, ***, P < 0.001. 图 6 细菌群落及其潜在生态功能与土壤环境因子的关系(a. 土壤细菌群落与环境因子的冗余分析(RDA);b. 细菌群落潜在生态功能与环境因子的皮尔森相关性分析) Fig. 6 Relationships of bacterial community or putative functional groups and soil environment factors(a. Redundancy analysis(RDA) of soil bacterial community and environmental factors; b. Pearson correlation analysis between putative ecological groups and environmental factors) |
本研究发现,沙地生态系统中樟子松人工林土壤性质在很大程度上受到造林年限的显著影响(图 1)。在造林初期(5年),随着植被生物量逐渐增加,土壤中积累的养分主要来自于新输入地表的凋落物和根系分泌物[5],导致SOC含量增加;随林分发育,SOC含量在造林8年时明显减少,这可归因于植物有机残体的少量输入、分解与正处在生长旺盛期的樟子松大量消耗养分之间形成的不平衡状态[18];而到15年时,随着林冠郁闭度增加,植被组成结构更加多样化并趋于稳定,土壤微生物和土壤动物活性提升,加速了凋落物分解及其向土壤中养分的释放,使得SOC含量逐渐上升[19],扭转了沙地土壤质量低下的状况(图 1)。在Laganière等[19]的研究中出现了类似结果,SOC的损失发生在造林后的最初10年中,随后碳储量逐渐恢复并产生净收益。然而,SOC含量在造林土壤中随土层深度增加显著下降(图 2),这可能是因为沙地转为林地后,地上植物残体输入作为养分输入的主要来源,其产生的营养元素通过淋溶作用向土壤深层运移,但受限于风沙区气候和土壤条件,这些营养元素更多滞留在表层土壤[2]。土壤TN含量与SOC的积累以及分解强度显著相关[6],这与本研究中TN含量与SOC含量的变化规律(图 1)基本一致。同时TN含量在8年时期减少,这可能是由于分解森林有机物造成的氮营养供应不足,植物在林冠关闭之前的活跃生长阶段,氮需求通常较高[20];并且氮素淋失也可能导致氮素损失[21]。此外,磷与土壤矿物紧密结合,而毛乌素沙地土壤发育程度较低,对磷的吸附能力较弱[22],这导致人工林恢复过程中TP在土壤剖面的垂直分布特征缺乏规律性(图 2)。
与土壤氮磷养分总量不同,造林后AN、AP的含量在造林初期显著下降(图 1),这可能是由于砂质土壤有效养分含量本身较低,AN、AP作为植物生长直接吸收利用的养分形态,在人工林恢复过程中几乎全被植物吸收利用,出现供不应求的现象。然而随着植被的生长,根系逐渐向下延伸,并促进根系分泌有机酸及磷酸酶等物质,促进无机态磷酸盐的溶解[23],使得土壤中AP含量逐渐上升;并随土层深度而显著增加(图 2),这表明在造林初期人为扰动会对土壤有效养分产生负面影响,但这种影响会随着造林时间的延长而缓慢恢复。同时,林分发育引起土壤pH降低(图 1)。研究[24]表明,造林通过影响凋落物输入和根际过程而改变土壤中阴阳离子的平衡,起到中和土壤pH的作用,即在酸性土壤中提高pH,而在碱性土壤中降低pH,这可能潜在地提高土壤肥力和促进生态系统生产力提升。
3.2 人工林恢复不同年限下土壤细菌群落和功能差异细菌群落由于具有快速的生命周期而具备高度弹性,其组成和结构反映了土壤对造林扰动的响应。在门水平上,沙地造林并未改变土壤细菌群落的优势菌,但如变形菌门、绿弯菌门和酸杆菌门的相对丰度发生了显著变化(图 3),这与同一研究区域油蒿覆盖地的发现[2]一致。在养分受限的生态系统中,植物通过凋落物分解和根系分泌物的结合来为细菌,特别是遵循r-策略的富营养细菌群(如变形菌门)提供了必要的能量来源[25],这解释了本研究中变形菌门的相对丰度在0~10 cm表层土壤中逐渐上升(表 1)的原因。此外,在RDA分析结果中表明酸杆菌门与pH负相关(图 6a),这与多数研究结果[26]一致,偏酸性的生长条件更有利于酸杆菌门成员的生存,但造林15年后酸杆菌门的相对丰度显著下降(图 3b)。Sul等[27]的研究发现,酸杆菌群对SOC的变化最为敏感,通常在低碳基质数量和质量的土壤中表现出最高的相对丰度。
研究[11,13]表明,在山地森林或退耕还林生态系统中土壤细菌群落的ɑ多样性通常随着土层深度增加而降低,但在本研究中该现象仅在未造林土壤中呈现显著降低的变化趋势(图 4b),这可能与各研究区域造林前的土地利用方式、土壤质量及植被类型[10,28]等因素有关。NMDS分析表明,沙地造林显著影响细菌群落的组成,而土壤细菌结构在5年和8年之间重叠较多(图 5a),这与在白垩草原中晚期次生演替阶段的研究[29]类似,在林分发育较早阶段微生物结构的变化相对较小。已有更多的研究证据[30]指出,在不同空间尺度和生态系统中,pH与微生物多样性和结构间的变化密切相关,这与本研究的分析结果(图 6a)一致。在细菌生长最适pH范围较窄的情况下,土壤pH的升高或降低会加剧细菌间的相互作用,这可能改变物种生存竞争的结果,主要表现为细菌群落组成和多样性发生变化[31]。进一步分析发现,土壤细菌群落潜在的生态功能变化与环境因子显著相关(图 6b)。在人工林恢复过程中,植被的入驻为微生物提供了额外的碳源,由于化学计量比的变化,微生物对氮素的需求增加,土壤细菌潜在的固氮过程和反硝化过程总体呈现出增强趋势,这主要是因为逐步增加的SOC为固氮和反硝化微生物提供足够的电子受体[32],并且SOC的矿化过程创造了更有利于反硝化微生物生长的厌氧微环境[33],这可能也是造成土壤AN含量下降的原因之一。同时,造林也降低了与碳循环相关的微生物生态功能,导致土壤细菌对纤维素等碳源物质的分解潜力下降,这可能是由于细菌对土壤条件改变的逐步适应和其所需有效营养物质的低供应状态[34-35]所致。此外,需要注意的是,FAPROTAX仅是一种预测工具,数据库可能仅限于包含具有确定功能的可培养细菌类群的信息,因此需要更进一步的分析来研究微生物功能的变化。
4 结论人工林恢复提高了土壤SOC、TN和TP含量,但降低了AN、AP含量,且TN在土壤剖面中表现出强烈的表聚性。引入樟子松提高了土壤细菌群落ACE指数,降低了β多样性。细菌群落结构及其潜在生态功能变化与SOC和pH具有显著相关性。土壤有效氮磷含量在造林后下降且在15年林分中未能恢复至原有水平,地力呈现衰退趋势。因此,建议可对樟子松人工林适当增加氮输入或干预凋落物分解,以提升沙地人工林土壤质量及相关微生物功能与多样性。
| [1] |
Lu F, Hu H F, Sun W J, et al. Effects of national ecological restoration projects on carbon sequestration in China from 2001 to 2010[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(16): 4039-4044. DOI:10.1073/pnas.1700294115
(  0) 0) |
| [2] |
Bai Y X, She W W, Miao L, et al. Soil microbial interactions modulate the effect of Artemisia ordosica on herbaceous species in a desert ecosystem, northern China[J]. Soil Biology and Biochemistry, 2020, 150: 108013. DOI:10.1016/j.soilbio.2020.108013
(  0) 0) |
| [3] |
Luo G W, Xue C, Jiang Q H, et al. Soil carbon, nitrogen, and phosphorus cycling microbial populations and their resistance to global change depend on soil C: N: P stoichiometry[J]. mSystems, 2020, 5(3): e00162-00120.
(  0) 0) |
| [4] |
Cao X Y, Li J P, Yang J, et al. Stoichiometric characterization of soil C, N, and P of different age-group Chinese fir plantations (In Chinese)[J]. Soils, 2019, 51(2): 290-296. DOI:10.13758/j.cnki.tr.2019.02.012 [曹小玉, 李际平, 杨静, 等. 不同龄组杉木林土壤碳、氮、磷的生态化学计量特征[J]. 土壤, 2019, 51(2): 290-296.]
(  0) 0) |
| [5] |
Zhang B B, Wan X H, Yang J Q, et al. Effects of litters different in quality on soil microbial community structure in Cunninghamia lanceolata plantation (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 1040-1049. [张冰冰, 万晓华, 杨军钱, 等. 不同凋落物质量对杉木人工林土壤微生物群落结构的影响[J]. 土壤学报, 2021, 58(4): 1040-1049.]
(  0) 0) |
| [6] |
Li Z C, Zhang Y Q, Song L G, et al. Storage of soil carbon and nitrogen in Chinese fir plantations at different ages in Dagang Mountain of Jiangxi Province (In Chinese)[J]. Journal of Central South University of Forestry & Technology, 2019, 39(10): 116-122. [李智超, 张勇强, 宋立国, 等. 江西大岗山不同林龄杉木人工林土壤碳氮储量[J]. 中南林业科技大学学报, 2019, 39(10): 116-122.]
(  0) 0) |
| [7] |
Wolfe B E, Klironomos J N. Breaking new ground: Soil communities and exotic plant invasion[J]. BioScience, 2005, 55(6): 477-487. DOI:10.1641/0006-3568(2005)055[0477:BNGSCA]2.0.CO;2
(  0) 0) |
| [8] |
Lazzaro L, Mazza G, d'Errico G, et al. How ecosystems change following invasion by Robinia pseudoacacia: Insights from soil chemical properties and soil microbial, nematode, microarthropod and plant communities[J]. Science of the Total Environment, 2018, 622/623: 1509-1518. DOI:10.1016/j.scitotenv.2017.10.017
(  0) 0) |
| [9] |
Chu H Y, Feng M M, Liu X, et al. Soil microbial biogeography: Recent advances in China and research frontiers in the world (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 515-529. [褚海燕, 冯毛毛, 柳旭, 等. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529.]
(  0) 0) |
| [10] |
Delgado-Baquerizo M, Bardgett R D, Vitousek P M, et al. Changes in belowground biodiversity during ecosystem development[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(14): 6891-6896. DOI:10.1073/pnas.1818400116
(  0) 0) |
| [11] |
Jiao S, Chen W M, Wang J L, et al. Soil microbiomes with distinct assemblies through vertical soil profiles drive the cycling of multiple nutrients in reforested ecosystems[J]. Microbiome, 2018, 6(1): 146. DOI:10.1186/s40168-018-0526-0
(  0) 0) |
| [12] |
Balesdent J, Basile-Doelsch I, Chadoeuf J, et al. Atmosphere- soil carbon transfer as a function of soil depth[J]. Nature, 2018, 559(7715): 599-602. DOI:10.1038/s41586-018-0328-3
(  0) 0) |
| [13] |
Eilers K G, Debenport S, Anderson S, et al. Digging deeper to find unique microbial communities: The strong effect of depth on the structure of bacterial and archaeal communities in soil[J]. Soil Biology and Biochemistry, 2012, 50: 58-65. DOI:10.1016/j.soilbio.2012.03.011
(  0) 0) |
| [14] |
Zhu Y G, Shen R F, He J Z, et al. China soil microbiome initiative: Progress and perspective (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 554-565. [朱永官, 沈仁芳, 贺纪正, 等. 中国土壤微生物组: 进展与展望[J]. 中国科学院院刊, 2017, 32(6): 554-565.]
(  0) 0) |
| [15] |
Allington G R H, Valone T J. Reversal of desertification: The role of physical and chemical soil properties[J]. Journal of Arid Environments, 2010, 74(8): 973-977. DOI:10.1016/j.jaridenv.2009.12.005
(  0) 0) |
| [16] |
Wang H B, Li X, Xiao J F, et al. Carbon fluxes across alpine, oasis, and desert ecosystems in northwestern China: The importance of water availability[J]. Science of the Total Environment, 2019, 697: 133978. DOI:10.1016/j.scitotenv.2019.133978
(  0) 0) |
| [17] |
Bao S D. Soil and agrochemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [18] |
Deng L, Shangguan Z P. Afforestation drives soil carbon and nitrogen changes in China[J]. Land Degradation and Development, 2016, 28(1): 151-165.
(  0) 0) |
| [19] |
Laganière J, Angers D A, Para D. Carbon accumulation in agricultural soils after afforestation: A meta-analysis[J]. Global Change Biology, 2010, 16(1): 439-453. DOI:10.1111/j.1365-2486.2009.01930.x
(  0) 0) |
| [20] |
王方超. 施氮磷肥对杉木林林下植物多样性与养分动态的影响[D]. 南昌: 南昌大学, 2015. Wang F C. Effects of nitrogen and phosphorus additions on understory plant biodiversity and nutrients dynamics in Chinese fir plantation[D]. Nanchang: Nanchang University, 2015. (  0) 0) |
| [21] |
Hou K, Rong X M, Han Y L, et al. Effects of fertilization depth on nitrogen and phosphorus losses and nitrogen and phosphorus contents in aquic sandy soil (In Chinese)[J]. Soils, 2021, 53(4): 707-714. [侯坤, 荣湘民, 韩永亮, 等. 施肥深度对潮砂土氮磷损失及土壤氮磷含量的影响[J]. 土壤, 2021, 53(4): 707-714.]
(  0) 0) |
| [22] |
Yang X, Post W M, Thornton P E, et al. The distribution of soil phosphorus for global biogeochemical modeling[J]. Biogeosciences, 2013, 10(4): 2525-2537. DOI:10.5194/bg-10-2525-2013
(  0) 0) |
| [23] |
Papaioannou A, Chatzistathis T, Papaioannou E, et al. Robinia pseudοacacia as a valuable invasive species for the restoration of degraded croplands[J]. Catena, 2016, 137: 310-317. DOI:10.1016/j.catena.2015.09.019
(  0) 0) |
| [24] |
Hong S B, Piao S L, Chen A P, et al. Afforestation neutralizes soil pH[J]. Nature Communications, 2018, 9(1): 520.
(  0) 0) |
| [25] |
Zhang C, Liu G B, Xue S, et al. Soil bacterial community dynamics reflect changes in plant community and soil properties during the secondary succession of abandoned farmland in the Loess Plateau[J]. Soil Biology and Biochemistry, 2016, 97: 40-49.
(  0) 0) |
| [26] |
Yang A N, Lu Y F, Zhang J H, et al. Changes in soil nutrients and acidobacteria community structure in Cunninghamia lanceolata plantations (In Chinese)[J]. Scientia Silvae Sinicae, 2019, 55(1): 119-127. [杨安娜, 陆云峰, 张俊红, 等. 杉木人工林土壤养分及酸杆菌群落结构变化[J]. 林业科学, 2019, 55(1): 119-127.]
(  0) 0) |
| [27] |
Sul W J, Asuming-Brempong S, Wang Q, et al. Tropical agricultural land management influences on soil microbial communities through its effect on soil organic carbon[J]. Soil Biology and Biochemistry, 2013, 65: 33-38.
(  0) 0) |
| [28] |
Stanek M, Zubek S, Stefanowicz A M. Differences in phenolics produced by invasive Quercus rubra and native plant communities induced changes in soil microbial properties and enzymatic activity[J]. Forest Ecology and Management, 2021, 482: 118901.
(  0) 0) |
| [29] |
Kuramae E, Gamper H, van Veen J, et al. Soil and plant factors driving the community of soil- borne microorganisms across chronosequences of secondary succession of chalk grasslands with a neutral pH[J]. FEMS Microbiology Ecology, 2011, 77(2): 285-294.
(  0) 0) |
| [30] |
Wang X B, Lü X T, Yao J, et al. Habitat-specific patterns and drivers of bacterial β-diversity in China's drylands[J]. ISME Journal, 2017, 11(6): 1345-1358.
(  0) 0) |
| [31] |
Wan W J, Tan J D, Wang Y, et al. Responses of the rhizosphere bacterial community in acidic crop soil to pH: changes in diversity, composition, interaction, and function[J]. Science of the Total Environment, 2020, 700: 134418.
(  0) 0) |
| [32] |
Cayuela M L, Sánchez-Monedero M A, Roig A, et al. Biochar and denitrification in soils: When, how much and why does biochar reduce N2O emissions?[J]. Scientific Reports, 2013, 3: 1732.
(  0) 0) |
| [33] |
Surey R, Schimpf C M, Sauheitl L, et al. Potential denitrification stimulated by water-soluble organic carbon from plant residues during initial decomposition[J]. Soil Biology and Biochemistry, 2020, 147: 107841.
(  0) 0) |
| [34] |
Austin A T, Ballaré C L. Dual role of lignin in plant litter decomposition in terrestrial ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(10): 4618-4622.
(  0) 0) |
| [35] |
Zeng X Y, Dai F P, Leng Y, et al. Study on culturable Streptomyces and its environmental adaptive characteristics in the soils of three ecotype reeds in Hexi Corridor (In Chinese)[J]. Journal of Arid Land Resources and Environment, 2019, 33(2): 164-170. [曾小英, 代芳平, 冷艳, 等. 河西走廊三种生态型芦苇土壤中可培养链霉菌及其环境适应特征的研究[J]. 干旱区资源与环境, 2019, 33(2): 164-170.]
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


