2. 中国科学院大学, 北京 100049;
3. 中国科学院常熟农业生态实验站, 江苏常熟 215555
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Changshu Agro-ecological Experimental Station, Chinese Academy of Sciences, Changshu, Jiangsu 215555, China
农业氮肥的大量施用导致大量活性氮进入环境[1],引发一系列生态环境问题[2]。在自然界氮循环过程中,反硝化过程是使活性氮以惰性氮(N2)的形式离开土壤和水体返回大气的最主要途径[3],土壤和水体中的活性氮也只有转化为N2后对生态环境的不利影响才能够被消除。此外,反硝化过程的中间产物N2O是一种强温室气体[4-5],对全球气候变化有重要影响。有研究表明农田生态系统的N2O排放量贡献了全球排放量的50%以上[6],因此,在农田生态系统中开展有关反硝化过程的相关研究具有非常重要的意义。
空气中极高的背景N2浓度(78%)导致反硝化过程终产物N2的直接测定一直是个世界性难题[7]。虽然目前有关反硝化的研究已取得较大的进展,如可通过膜进样质谱仪结合N2/Ar法对河流湖泊沉积物以及水田反硝化产生的N2进行直接定量[8-10]。但迄今仍没有一种令人满意的方法来实现对旱地N2排放速率的量化[11],这是因为淹水体系上覆水的存在能一定程度阻滞气体交换,水体溶解性N2浓度受大气背景N2影响有限[12-13],而在旱地则很难克服大气背景N2的影响。因此,目前对于旱地N2排放速率的测定多采用间接方法也即乙炔抑制法[14-15]。尽管存在一定的缺陷,但受限于旱地N2直接测定的困难,该方法在旱地N2排放速率的研究中仍被广泛应用[16-20]。
近年来,有学者在前人旱地N2直接测定系统之上进行改进,研制了更适用于旱地N2排放速率测定的氦(He)环境-密闭培养及He环境-气体同步测定系统[21-22]。目前最为常用的He环境-密闭培养系统是Robot系统[22],该系统是通过人为营造一个密闭的环境并使用He或一定比例的He/O2混合气,对该密闭环境的顶空进行置换,使密闭环境内的气体全都被He(He/O2混合气)所取代,随后以一定的时间间隔采集密闭环境中的顶空气体进行测定。由于所营造的密闭环境内N2浓度极低,因此可通过测定顶空气体中N2浓度的变化来直接定量土壤N2的排放速率。除Robot系统外,RoFlow系统也是近年来旱地N2排放速率直接测定应用较多的方法[23],尽管系统构造不同,但原理上均属于He环境-密闭培养系统。其中,Robot系统主要针对纯菌培养或泥浆样品,测定结果可反映体系内N2的累积排放量,测定周期一般小于5 d[24];而RoFlow系统主要针对近似原状土柱样品,测定结果可反映土壤N2排放速率的动态变化,测定周期一般20 d左右,测定效率较低[25]。由于Robot系统平台搭建简单且测定效率高,因此其相比于RoFlow系统使用更为广泛。但是该系统最初研制时主要针对纯菌培养体系,目的是为了测定反硝化细菌在培养基中的N2排放速率,在这种条件下N2排放速率一般较高,即使体系出现微量的N2渗漏也不会显著影响测定结果,因此以往研究对Robot系统测定过程中控制气体渗漏的限制条件关注较少,使用Robot系统对土壤N2排放速率进行研究时也多采用土壤提取液[26]、泥浆或添加外源底物的土壤体系[27]。而Robot系统在运行过程中需要频繁利用微量注射器进行取样和测定,极易造成外界N2的渗漏,进而严重干扰其对低N2排放速率的测定。所以如要将Robot系统用于低N2排放速率研究如旱地土壤背景N2排放速率测定时,必须进一步降低系统的渗漏率。
针对上述问题,本研究通过使用预先置于He环境的橡胶隔垫、采用充He后的蒸馏水配制相关溶液并结合实施破坏性取样技术对Robot系统测定旱地N2排放速率的方法进行优化,利用优化后的Robot系统测定旱地土壤背景N2排放速率及添加碳源和氮源后的N2排放速率,并与乙炔抑制法和RoFlow系统测定结果进行对比,以期验证方法优化后的Robot系统在测定旱地土壤背景N2排放速率上的优势。
1 材料与方法 1.1 供试材料供试土壤采自中国科学院常熟生态实验站附近试验地(31°33′16″ N,120°43′17″ E),试验地土壤为由湖泊沉积物发育而成的水耕人为土。该区域属于亚热带季风气候,年平均降水量990 mm,约60%~70%降水发生在6至9月间,年平均气温16.1 ℃[28]。采集表层土壤(0~20 cm)风干,用于后续培养实验及土壤基本理化性质测定。供试土壤pH为5.82,全碳含量14.20 g·kg–1,全氮含量1.35 g·kg–1,溶解性有机碳含量70.50 mg·kg–1,
培养实验采用同一份风干土样,共设置5个不同碳氮底物浓度的添加处理,分别为:(1)仅添加蒸馏水的对照;(2)添加60 mg·kg–1(以N计,下同)硝酸钾(KNO3)溶液;(3)添加150 mg·kg–1 KNO3溶液;(4)添加60 mg·kg–1(以C计,下同)葡萄糖(C6H12O6)溶液;(5)添加60 mg·kg–1 C6H12O6和60 mg·kg–1 KNO3混合溶液。每个处理设置3个重复,在室温(25℃)和无氧条件下,分别采用三种不同方法/系统(Robot系统、乙炔抑制法和RoFlow系统)测定土壤N2排放速率。
1.3 Robot系统N2排放速率的测定Robot系统主要包括三个组成模块:气体监测模块、自动进样模块和恒温水浴模块[22]。气体监测模块为气相色谱仪(7890B,Agilent,USA),配有热导检测器和电子捕获检测器分别分析N2和N2O的浓度[17]。自动进样模块由自动进样器(PAL 3,CTC Analytics AG,Switzerland)与蠕动泵(Minipuls 3,Gilson,USA)两部分组成。恒温水浴模块为恒温水浴箱(0~40℃)。该系统使用He/O2混合气置换血清瓶内的顶空气体,然后在一定的时间间隔内直接测定瓶内顶空N2的浓度变化来确定其排放量。实验步骤如下:向120 mL血清瓶中加入30 g风干土(质量含水量8%)和3 mL蒸馏水预培养24 h,预培养结束后添加5种不同浓度的碳氮底物溶液(5 mL),底物添加后土壤质量含水量增至38%,随后使用橡胶隔垫及铝盖密封。加入底物溶液后,首先对瓶内顶空气体进行置换:先抽真空300 s,然后用He(纯度99.999%,下同)充满,重复操作6次,最后使用10 mL无活塞注射器(含有2 mL蒸馏水,水层密封隔绝大气交换)插入瓶内平衡压力。随后对瓶内N2和N2O浓度进行在线监测(在0、16、22 h进行采样测定),根据瓶内N2和N2O浓度随时间变化的线性关系计算N2和N2O的排放速率(均以N计)[26]。
1.4 Robot系统测定N2排放速率方法的优化前期预实验表明,空气与橡胶隔垫之间的气体渗漏、吸附在橡胶隔垫中气体的扩散、溶解在底物溶液中的气体扩散和吸附在土壤颗粒上的气体扩散作用均会向血清瓶中带入N2(将这几个过程统称为气体渗漏),并对实验过程中N2测定产生影响。因此需要对以上可能的气体渗漏环节进行优化以提高实验的精度。
针对空气与橡胶隔垫之间的气体渗漏采用如下方式控制:(1)由于隔垫是阻拦空气向血清瓶中扩散的唯一介质,而多次对其穿刺取样将产生较大的创口使渗漏量不断增加,采用破坏性取样的方式进行取样即将每组处理设置更多的平行,所有血清瓶只取样测定一次,可降低该环节导致的气体泄漏。(2)在样品培养期间,由于空气与橡胶隔垫的扩散主要是由外界空气引起,因此在培养期间将血清瓶放入厌氧箱中(厌氧箱使用He作为气源,在箱体内部营造低N2环境)降低外界N2的扩散作用,并在橡胶隔垫外涂上一层硅橡胶可进一步阻隔外界空气的渗漏。
针对吸附在橡胶隔垫中气体的扩散采用如下方式控制:考虑到气体是吸附在橡胶隔垫中因此采用He置换的方式处理橡胶隔垫,使橡胶隔垫预先置于He环境,将吸附在橡胶隔垫中的气体置换出来。具体步骤为:向体积为120 mL的柱形瓶(svg100,Nichiden-rika,Japan)中放入20个橡胶隔垫并密封,接着对柱形瓶进行He置换(先抽真空处理300 s后用He充满,反复进行该过程6次),放置24 h后再进行一次He置换后备用。在对空气与橡胶隔垫之间的气体渗漏采取控制措施后,为验证这两种措施的组合处理效果,设计如下试验:向空血清瓶上安放预先置于He环境的橡胶隔垫以及未预先置于He环境的橡胶隔垫,随后对这两种处理的空血清瓶进行He置换,并采用破坏性取样方式分别在试验开始的36、48、60 h对血清瓶内顶空N2进行测定。通过比较上述两种处理之间的差异,确定破坏性取样和使用预先置于He环境橡胶隔垫处理的组合效果。预实验结果表明,使用未预先置于He环境的橡胶隔垫,血清瓶中顶空N2会在36 h后趋于稳定,因此将实验测定的初始时间设定为36 h。
在对空气与橡胶隔垫之间的气体渗漏及吸附在橡胶隔垫中气体的扩散采取控制措施后,针对溶解在蒸馏水与底物溶液中的气体扩散,采用如下方式控制:对实验用的蒸馏水进行充He处理3 h,并利用充He后的蒸馏水配制相关溶液,设计如下两种实验处理以验证溶解性气体扩散的平衡时间:分别向血清瓶中放入8 mL充He后的蒸馏水(充He水)和8 mL未充He的蒸馏水(非充He水),随后在36、48、60 h使用Robot系统对两种处理的瓶内顶空气体进行监测。而针对吸附在土壤颗粒上的气体扩散,由于实验中会向土壤中加入蒸馏水或底物溶液进行培养,因此对于该扩散作用仅考虑血清瓶中土壤加入蒸馏水或底物溶液后的N2扩散平衡时间,使用该平衡时间作为正式实验的测定起始点,用以消除溶解在底物溶液中和吸附在土壤颗粒上的气体扩散作用。设计如下两种处理:血清瓶中加入30 g风干后的灭菌土(高压蒸汽灭菌,121℃,2.50 h)并加入8 mL充He水和血清瓶中加入30 g风干后的灭菌土并加入8 mL非充He水处理,分别在36、48、60 h使用Robot系统对血清瓶的顶空气体进行监测,以确定吸附与溶解性N2的平衡时间。
1.5 乙炔抑制法测定N2排放速率乙炔抑制法测定N2排放速率的具体操作如下[15,29]:在120 mL的血清瓶中加入30 g风干土(质量含水量8%)和3 mL蒸馏水预培养24 h,添加5种不同浓度的碳氮底物溶液(5 mL)并补充蒸馏水使水土比达1:1,然后将血清瓶密封并使用He置换瓶内顶空气体使其达到厌氧条件。将样品分为两组,一组用注射器从瓶中取出一定体积的顶空气体并向其中注入等体积的高纯乙炔,使顶空的乙炔浓度达到10%(体积百分比),另一组不加乙炔气体作为对照。所有血清瓶置于摇床震荡(25℃,220 r·min–1),在1、2、4、6 h采集瓶中顶空气体使用配有电子捕获检测器的气相色谱(7890A,Agilent,USA)测定N2O浓度。根据瓶内N2O浓度随时间变化的线性关系计算N2O排放速率。
实验中N2O的排放速率由不加乙炔的处理确定,而N2的排放速率由加乙炔与不加乙炔处理之间排放速率的差值计算而来:
| $ F_{\mathrm{N}_2}=F_{\text {乙炔 } \mathrm{N}_2 \mathrm{O}}-\mathrm{F}_{\text {无乙炔 } \mathrm{N}_2 \mathrm{O}}$ | (1) |
式中,FN2为N2排放速率(mg·kg–1·d–1)(以N计);F乙炔N2O和F无乙炔N2O分别为添加和不添加乙炔处理中N2O的排放速率(mg·kg–1·d–1)(以N计)。
1.6 RoFlow系统测定N2排放速率本研究所用的RoFlow系统主要由密封罐、中央控制器以及气相色谱仪(7890B,Agilent,USA)三部分组成[23,28]。该系统采用负压置换的气体置换方式将密封罐内的顶空气体置换为He(或一定比例的He/O2混合气),然后通入一定流速的He(或一定比例的He/O2混合气)吹扫罐内顶部空间,随后以一定的时间间隔取样直接测定密封罐内顶部空间N2和N2O实时浓度。具体流程如下:向密封罐中加入500 g风干土(质量含水量8%)和50 mL蒸馏水预培养24 h,补充加入83 mL的5种不同浓度的碳氮底物溶液(每个处理3个重复),底物添加后土壤含水量增加至38%质量含水量,随后对体系内N2和N2O浓度进行在线监测(测定频率为3.36 h一次,观测时间为20.50 d)。计算N2和N2O排放速率:
| $ F = \frac{{c \times f \times 60 \times 24 \times \rho }}{m} \times {10^6} $ | (2) |
式中,F为N2和N2O的排放通量(mg·kg–1·d–1)(以N计);c为测定的N2浓度(μL·L–1);f为吹扫气体流速(mL·min–1);m为培养罐内干土质量(kg);常数60、24为分转小时、小时转天的转换系数;ρ为常温常压下N2和N2O的密度(g·L–1)(以N计);常数106为换算系数。
1.7 数据处理采用SPSS 18.0对数据进行统计分析,数据以平均值□±□标准差(n=3)表示。使用单因素方差分析(ANOVA)并基于LSD法进行数据均值显著性检验,文中所有图件均采用Origin 2021绘制。
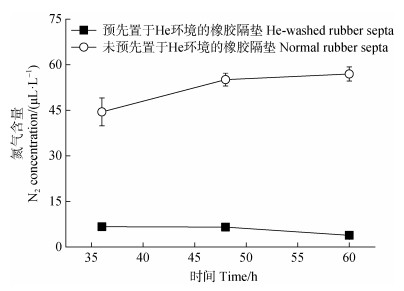
2 结果 2.1 Robot系统反硝化潜势测定方法的优化对比预先置于He环境橡胶隔垫与未预先置于He环境橡胶隔垫处理组N2排放的差异(图 1),可以看出使用预先置于He环境橡胶隔垫的血清瓶在36 h后N2含量基本不变,始终维持在较低的浓度;而使用未预先置于He环境橡胶隔垫的血清瓶在36 h后N2含量仍呈现出上升的趋势,N2含量由36 h的(44.47±4.58)μL·L–1上升至60 h的(56.95±2.30)μL·L–1。此外通过对比整个培养周期内两种处理血清瓶中的N2含量可以看出,使用预先置于He环境处理橡胶隔垫的血清瓶中N2含量最高为(6.67± 0.20)μL·L–1,显著低于使用未置于He环境橡胶隔垫的血清瓶中N2含量最低值(44.47±4.58)μL·L–1(P < 0.05)。
|
图 1 使用预先置于He环境或未预先置于He环境橡胶隔垫血清瓶中N2含量变化 Fig. 1 Concentration of N2 in serum bottles using He-washed rubber septa or normal rubber septa |
进一步对比装有充He水和非充He水血清瓶中的N2含量变化差异(图 2)。在培养期间装有充He水的血清瓶中N2含量基本没有变化,维持在(35.37±4.10~39.1±6.30)μL·L–1之间,并且该数值低于装有非充He水的血清瓶中N2浓度(最低浓度为48 h时的测定值(47.68±13.61)μL·L–1)。而装有非充He水的血清瓶中的N2含量在整个培养期间存在较大的波动,即使在47 h后仍有上升的趋势,N2含量从47 h时的(47.68±13.61)μL·L–1上升至60 h时的(54.03±8.95)μL·L–1。

|
图 2 装有充He水或非充He水的血清瓶中N2含量变化 Fig. 2 Concentration of N2 in serum bottles with He-washed water or normal water |
监测装有30 g灭菌风干土并加入8 mL充He水和非充He水血清瓶中N2含量的变化,结果见图 3。培养期间两种处理下血清瓶中N2含量均基本保持不变,从36 h开始至结束,两组处理瓶内N2含量均无显著变化,表明无论是加入充He水还是加入非充He水的风干土均能在36 h后使吸附于土壤颗粒及溶解于水中的N2与血清瓶的顶空气体达到平衡。但是从36 h测定起始点可以看出,向灭菌风干土加入非充He水的处理N2含量为(34.9±4.58)μL·L–1,高于加入充He水处理中的N2含量(26.27± 5.75)μL·L–1。

|
图 3 装有灭菌风干土并加入充He水或非充He水的血清瓶中N2含量变化 Fig. 3 Concentration of N2 in serum bottles with soil and He-washed water or with soil and normal water |
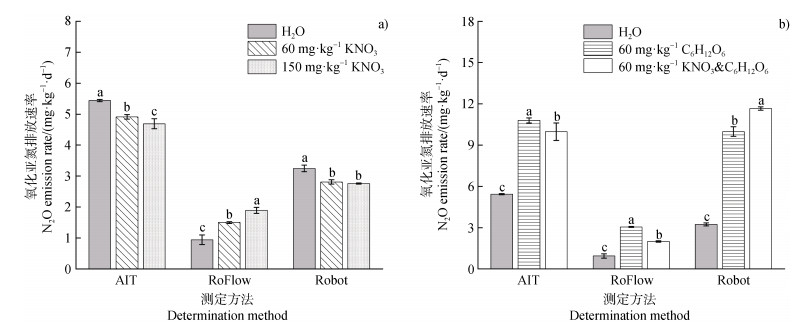
整体而言,旱地土壤N2排放速率以乙炔抑制法测定的结果最高,RoFlow系统次之,而Robot系统测定结果最低(图 4)。同一种处理使用不同方法测定的结果不尽一致。RoFlow系统测定的N2排放速率随外源硝酸盐添加量增加而升高,添加150 mg·kg–1 KNO3处理最高,为(1.26±1.02)mg·kg–1·d–1。乙炔抑制法和Robot系统测定的N2排放速率在添加60 mg·kg–1 KNO3处理最高,分别为(3.14±0.34)和(0.25±0.02)mg·kg–1·d–1。添加150 mg·kg–1 KNO3处理N2排放速率在乙炔抑制法测定结果中显著低于60 mg·kg–1 KNO3处理(P < 0.05),而在Robot系统测定的结果中无显著差异(图 4a)。

|
注:AIT:乙炔抑制法;RoFlow:RoFlow测定系统;Robot:Robot测定系统。不同小写字母代表同一测定方法下不同处理之间差异显著,P < 0.05。 Note: In the legend, AIT, RoFlow, and Robot represent the Acetylene inhibition method, Robotized continuous flow incubation system, and Robotized incubation and analyzing system, respectively. Within the same method, different lowercase letters above the bars indicate significant differences(P < 0.05) among different treatments. 图 4 不同处理及测定方法下N2排放速率 Fig. 4 N2 emission rates under different treatments as determined by three methods |
而对于添加了C6H12O6的处理,无论使用何种测定方法测定,N2排放速率均比仅添加蒸馏水的处理有所升高。相对于仅添加60 mg·kg–1 C6H12O6的处理而言,同时加入60 mg·kg–1 C6H12O6和KNO3的处理中N2排放速率低于前者(图 4b)。在所有的处理中,无论使用何种方法测定,N2排放速率最高的均为仅添加60 mg·kg–1 C6H12O6的处理,而不同测定方法中,使用乙炔抑制法测得的N2排放速率最高,为(6.36±0.52)mg·kg–1·d–1(图 4b)。总体上就三种测定方法测定结果的误差而言,Robot系统的测定误差最小,不同处理之间的误差范围在0.003~0.045 mg·kg–1·d–1(图 4)。
与N2排放速率类似,同一种处理使用不同测定方法测得的旱地土壤N2O排放速率也并不一致(图 5)。相对于仅添加蒸馏水的处理来说,使用RoFlow系统测定的N2O排放速率随着外源硝酸盐添加量增加而升高,在外源添加150 mg·kg–1 KNO3处理中检出了最高的N2O排放速率,为(1.89±0.01)mg·kg–1·d–1(图 5a)。而使用乙炔抑制法和Robot系统测定的N2O排放速率则随着外源硝酸盐添加量增加而降低,在仅添加蒸馏水的处理中检出了最高的N2O排放速率,分别为(5.44±0.04)和(3.25±0.11)mg·kg–1·d–1(图 5a)。而对于添加了C6H12O6的处理,无论使用何种测定方法测定,N2O排放速率均比仅添加蒸馏水的处理显著升高(P < 0.05)(图 5b)。使用乙炔抑制法和RoFlow系统测定的仅添加60 mg·kg–1 C6H12O6处理的N2O排放速率显著高于同时加入60 mg·kg–1 C6H12O6和KNO3的处理(P < 0.05),排放速率分别为(10.80±0.18)和(3.05±0.03)mg·kg–1·d–1(图 5b)。而使用Robot系统测定的N2O排放速率,在同时加入60 mg·kg–1 C6H12O6和KNO3的处理中最高,排放速率为(11.66±0.12)mg·kg–1·d–1(图 5b)。
|
注:AIT:乙炔抑制法;RoFlow:RoFlow测定系统;Robot:Robot测定系统。不同小写字母代表同一测定方法下不同处理之间差异显著,P < 0.05。 Note: In the legend, AIT, RoFlow, and Robot represent the Acetylene inhibition method, Robotized continuous flow incubation system, and Robotized incubation and analyzing system, respectively. Within the same method, different lowercase letters above the bars indicate significant differences(P < 0.05) among different treatments. 图 5 不同处理及测定方法下N2O排放速率 Fig. 5 N2O emission rates under different treatments as determined by three methods |
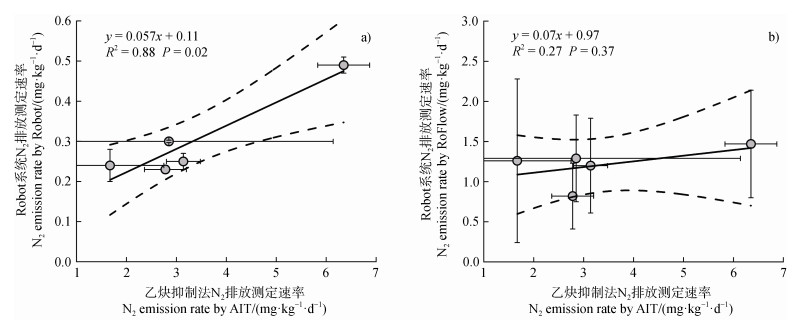
对不同处理中三种测定方法的测定结果进行相关性分析(图 6),发现乙炔抑制法测定结果与Robot系统测定结果存在显著的正相关关系(P < 0.05),而乙炔抑制法测定结果与RoFlow系统测定结果之间不存在显著的相关关系(P > 0.05)。此外Robot系统的测定结果与RoFlow系统的测定结果之间也不存在显著的正相关关系(P > 0.05)。
|
图 6 三种N2排放速率测定方法测定结果的相关性分析 Fig. 6 Correlation analysis among the results from the three methods |
在利用Robot系统测定血清瓶中N2排放速率时,Robot系统的研发者Molstad等[22]指出橡胶隔垫中所吸附的气体可能是血清瓶中N2渗漏的一个重要来源,本研究结果印证了该推测。使用预先置于He环境橡胶隔垫,血清瓶中初始顶空N2浓度显著降低(P < 0.05)(图 1)。同时,本研究结果也表明橡胶隔垫中所吸附N2的释放是一个缓慢的过程,48 h后使用未预先置于He环境橡胶隔垫的血清瓶中N2仍在升高,而使用预先置于He环境橡胶隔垫的血清瓶,从36 h测定开始,瓶中的N2浓度就始终维持在一个较低水平。要实现对血清瓶中N2的准确测定,对橡胶隔垫进行抽真空He置换处理并将其预先置于He环境是有效且必要的。
此外,由于室温下水中溶解有一定浓度的N2,使得培养实验中在向血清瓶中加入蒸馏水以调节土壤含水量时,会向培养体系中引入外界N2。特别是当对血清瓶进行He置换处理后,由于瓶中顶空气体N2含量极低,此时溶解于水中的N2就会逐步扩散出来。本研究发现,装有充He水的血清瓶中顶空气体在整个培养期间内均保持在一个相对稳定的N2浓度,可见血清瓶中加入经过充He的水后,水中溶解的N2可以更快与瓶中顶空气体达到交换平衡且具有更好的平行性,可有效降低水中溶解性N2的渗漏(图 2)。需要指出的是,本研究结果显示,装有非充He水的血清瓶在整个培养周期内的N2扩散速率不稳定,瓶内N2含量虽然在36 h至48 h内较为稳定,但在60 h时又有明显上升(图 2)。本实验采取的是破坏性取样,每个时间点的血清瓶测定结果与上个时间点的血清瓶并不产生关联,因此在60 h时装有非充He水血清瓶内N2浓度的上升应该是由溶解于水中的N2向顶空扩散速度的差异导致。
最后,从装有灭菌风干土并加入充He水与非充He水的血清瓶中N2含量变化中可以发现,无论使用充He水还是非充He水,在经过36 h培养后瓶内N2含量均始终保持稳定(图 3)。说明在血清瓶体系完成He置换后,继续培养36 h可以实现对吸附于土壤颗粒和溶解于蒸馏水中的气体渗漏的良好控制。但是从瓶内36 h初始N2浓度来看,使用灭菌风干土加入非充He水的瓶内初始N2浓度高于灭菌风干土加入充He水处理(图 3),说明加入非充He水的处理在气体平衡之前会释放出更多N2,因此最优的处理应该是向血清瓶体系中加入充He水或经充He水配制的相关溶液。此外,虽然装有灭菌风干土并加入充He水的血清瓶处理中在36 h后瓶中的N2浓度即可保持稳定,但是考虑到不同土壤之间的差异(如土壤质地、有机质含量及团聚体结构等),为了尽可能在实验开始测定之前使整个血清瓶体系内N2浓度保持稳定,在血清瓶体系完成He置换后,继续培养48 h后再开始测定是一个相对合适的起始点。王睿[21]的研究表明,在连续吹扫的条件下去除密闭容器内土壤颗粒吸附的N2需要24 h左右的置换时间,较本实验设定的48 h的时长短,由于本实验是在密闭无连续吹扫环境进行的培养,因此体系所需的平衡时间可能有所延长。
综合以上对Robot系统可能存在N2渗漏环节的优化,通过向装有土样的血清瓶中加入充He水配置的底物溶液,使用预先置于He环境的橡胶隔垫和在培养周期内采用破坏性取样的方式进行测定,并在整个培养周期内将样品瓶置于以He作为气源的厌氧培养箱中,可大幅降低Robot系统的N2渗漏率。Qin等[18]的研究表明Robot系统的渗漏率为5.15 μL·L–1·h–1,而经多次实验验证,使用本文优化后的方法进行培养测定,Robot系统的渗漏率在0~0.78 μL·L–1·h–1之间,大幅降低了渗漏率。
3.2 三种旱地N2排放速率测定方法的比较在三种测定方法测得的所有处理N2排放速率中,乙炔抑制法的测定结果最高,主要原因是乙炔抑制法在测定过程中将水土比设定为了1:1并在摇床中震荡培养,该过程可以使反硝化微生物跟反应底物在整个培养体系内充分接触,有利于反硝化微生物对反应底物的高效利用,所以相对于RoFlow和Robot系统,乙炔抑制法测定的N2排放速率更高。对RoFlow系统而言,由于测定周期更长(20 d)且体系内土柱能更好地反映野外情况下土壤的N2动态排放过程,也能够更好地捕获N2排放的峰值,因此相比于Robot系统,其测定的N2排放速率更高;相对于RoFlow系统,Robot系统测定周期短、体系内土壤质量小,只能反应短时间内土壤反硝化过程产生N2的累积排放量[30],在短时间的测定周期内可能并不能较好地捕获N2的排放峰值,因此测定的N2排放速率结果低于RoFlow系统。对比三种测定方法的测定结果,由于乙炔抑制法在测定时其条件更加有利于土壤反硝化的发生,所以其测定结果理论上应该是三种方法测定N2排放速率的上限(即最高速率),这与我们的结果一致,表现为乙炔抑制法的测定结果高于RoFlow和Robot系统的测定结果,这也从侧面证明了乙炔抑制法的测定结果代表性不如RoFlow和Robot系统测定结果。而对于不同外源底物添加的处理来说,不同测定方法测得的N2排放速率响应不同。在添加外源氮的处理中,使用RoFlow系统和Robot系统测得的不同处理间的N2排放速率差异不显著(图 4a),这可能是受土壤背景硝酸盐含量影响导致。在本研究中供试土壤背景硝酸盐含量较高(57.83 mg·kg–1),此时土壤反硝化过程可能并不受限于硝酸盐浓度,反硝化过程对于外源硝酸盐的添加响应并不敏感,因此并没有检出显著的处理差异。在添加外源碳的处理中,Robot系统测定结果能够反映各处理的差异,仅添加60 mg·kg–1 C6H12O6处理的N2排放速率显著高于同时加入60 mg·kg–1 C6H12O6和KNO3的处理(P < 0.05),而同时加入60 mg·kg–1 C6H12O6和KNO3处理的N2排放速率显著高于仅添加蒸馏水的处理(P < 0.05)(图 4b)。RoFlow系统的测定结果则无法反映外源碳处理间的差异,因此我们认为,相对于RoFlow系统,Robot系统对于外源底物的添加有更好的响应。此外,在所有处理中,N2O的排放速率均高于N2的排放速率,反硝化的产物以N2O为主。这可能是由于供试土壤的低pH和高硝酸盐含量导致,较低的土壤pH或高硝酸盐含量会抑制反硝化过程中N2O还原为N2[28,31],进而造成了反硝化产物以N2O为主,这也一定程度上解释了为何在部分处理的N2排放速率比较中,三种测定方法均未测定出处理之间的显著差异。
虽然乙炔抑制法采用的土水比(1:1)与Robot系统测定所采用的近似田间原位含水量有所差别,但乙炔抑制法与Robot系统均是在含30 g土壤的120 mL血清瓶体系中完成测定,无论是从反应体系还是测定周期上二者都相近,因此两种方法之间的测定结果有显著的正相关关系(图 6a)。但是对于乙炔抑制法与RoFlow系统,二者无论是反应体系还是培养条件上均差别较大,RoFlow系统测定结果可以更好地反映野外情况下的土壤N2动态排放过程,与乙炔抑制法测定结果之间并没有显著的相关关系(图 6b)。虽然Robot系统与RoFlow系统,二者都是直接测定系统,但反应体系的不一致导致了二者的测定结果差异较大也没有显著的相关关系。
尽管Robot系统无法良好地反映田间真实的N2排放情况,但是优化后的Robot系统相比于乙炔抑制法和RoFlow系统具有一定优势。相对于乙炔抑制法,Robot系统既可以实现体系内N2的直接测定又能够还原一定的田间条件;相对于RoFlow系统,Robot系统对于外源底物的添加有更好的响应且测定效率高,虽然Robot系统测定结果低于RoFlow系统测定结果3倍~5倍,但二者还处于同一数量级上,因此Robot系统在机理的研究上会有更好的应用效果。
综合评估以上三种旱地N2排放速率测定方法,我们认为优化后的Robot系统测定结果合理,测定效率高,对外源底物添加的响应较好,未来在研究旱地土壤背景N2排放及相关机理方面有较好的应用前景。但是需要特别指出的是,在使用优化后的Robot系统进行反硝化速率研究时,为了更好地反映田间实际情况,最好采用原状土模拟田间水分情况下进行测定。
4 结论通过使用预先置于He环境的橡胶隔垫、采用充He后的蒸馏水配制溶液和实施破坏性取样的处理,可以大幅降低Robot系统的N2渗漏率,优化后的系统渗漏率在0~0.78 μL·L–1·h–1之间。旱地N2排放速率测定中,不同实验处理之间使用乙炔抑制法测定的N2排放速率最高,RoFlow系统次之,Robot系统最低。三种测定方法之间误差最小的为Robot系统,不同实验处理之间误差范围在0.003~0.045 mg·kg–1·d–1。整体上,相对于乙炔抑制法,优化后的Robot系统优势体现在可以实现N2的直接定量并能还原一定的田间条件。其次,相对于RoFlow系统而言,优化后的Robot系统对外源底物添加的响应较好,具有更高的精确度并且测定周期短。综上,经过优化的Robot系统在测定旱地N2排放速率时具有N2渗漏率低,测定结果精确度高及对外源底物添加响应较好的特点,未来在研究旱地土壤背景N2排放及相关机理的方面有较好的应用前景。
| [1] |
Castaldelli G, Colombani N, Soana E, et al. Reactive nitrogen losses via denitrification assessed in saturated agricultural soils[J]. Geoderma, 2019, 337: 91-98. DOI:10.1016/j.geoderma.2018.09.018
(  0) 0) |
| [2] |
Reis S, Bekunda M, Howard C M, et al. Synthesis and review: Tackling the nitrogen management challenge: From global to local scales[J]. Environmental Research Letters, 2016, 11(12): 120205. DOI:10.1088/1748-9326/11/12/120205
(  0) 0) |
| [3] |
Malique F, Ke P P, Boettcher J, et al. Plant and soil effects on denitrification potential in agricultural soils[J]. Plant and Soil, 2019, 439(1/2): 459-474.
(  0) 0) |
| [4] |
Harter J, Weigold P, El-Hadidi M, et al. Soil biochar amendment shapes the composition of N2O-reducing microbial communities[J]. Science of the Total Environment, 2016, 562: 379-390. DOI:10.1016/j.scitotenv.2016.03.220
(  0) 0) |
| [5] |
Song X T, Liu M, Ju X T, et al. Nitrous oxide emissions increase exponentially when optimum nitrogen fertilizer rates are exceeded in the North China plain[J]. Environmental Science & Technology, 2018, 52(21): 12504-12513.
(  0) 0) |
| [6] |
Hu H W, Chen D L, He J Z. Microbial regulation of terrestrial nitrous oxide formation: Understanding the biological pathways for prediction of emission rates[J]. FEMS Microbiology Reviews, 2015, 39(5): 729-749. DOI:10.1093/femsre/fuv021
(  0) 0) |
| [7] |
Zhang Z J, Qin S P, Yuan H J, et al. Advance in soil dinitrogen emission (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2018, 26(2): 182-189. [张志君, 秦树平, 袁海静, 等. 土壤氮气排放研究进展[J]. 中国生态农业学报, 2018, 26(2): 182-189.]
(  0) 0) |
| [8] |
Kunu T M, Sullivan M B, Cornwell J C, et al. Denitrification in estuarine sediments determined by membrane inlet mass spectrometry[J]. Limnology and Oceanography, 1998, 43(2): 334-339. DOI:10.4319/lo.1998.43.2.0334
(  0) 0) |
| [9] |
Li J F, Chai Y C, Chen S T, et al. Measurement of denitrification, Anammox, DNRA rates, and net N2 flux in paddy soil using a membrane inlet mass spectrometer (In Chinese)[J]. Journal of Agro-Environment Science, 2019, 38(7): 1541-1549. [李进芳, 柴延超, 陈顺涛, 等. 利用膜进样质谱仪测定水稻土几种厌氧氮转化速率[J]. 农业环境科学学报, 2019, 38(7): 1541-1549.]
(  0) 0) |
| [10] |
Li X B, Xia Y Q, Lang M, et al. N2: Ar technique for direct determination of denitrification rate of aquatic ecosystems using membrane inlet mass spectrometry (In Chinese)[J]. Journal of Agro-Environment Science, 2013, 32(6): 1284-1288. [李晓波, 夏永秋, 郎漫, 等. N2: Ar法直接测定淹水环境反硝化产物N2的产生速率[J]. 农业环境科学学报, 2013, 32(6): 1284-1288.]
(  0) 0) |
| [11] |
Butterbach-Bahl K, Baggs E M, Dannenmann M, et al. Nitrous oxide emissions from soils: How well do we understand the processes and their controls?[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2013, 368(1621): 20130122. DOI:10.1098/rstb.2013.0122
(  0) 0) |
| [12] |
Groffman P M, Altabet M A, Böhlke J K, et al. Methods for measuring denitrification: Diverse approaches to a difficult problem[J]. Ecological Applications, 2006, 16(6): 2091-2122. DOI:10.1890/1051-0761(2006)016[2091:MFMDDA]2.0.CO;2
(  0) 0) |
| [13] |
Yan X Y, Zhou W. Groundwater nitrate removal through denitrification under farmland in Yangtze River Delta (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(2): 350-362. [颜晓元, 周伟. 长江三角洲农田地下水反硝化对硝酸盐的去除作用[J]. 土壤学报, 2019, 56(2): 350-362.]
(  0) 0) |
| [14] |
Wang J Y, Yan X Y. Denitrification in upland of China: Magnitude and influencing factors[J]. Journal of Geophysical Research: Biogeosciences, 2016, 121(12): 3060-3071. DOI:10.1002/2016JG003541
(  0) 0) |
| [15] |
Qin S P, Yuan H J, Dong W X, et al. Relationship between soil properties and the bias of N2O reduction by acetylene inhibition technique for analyzing soil denitrification potential[J]. Soil Biology & Biochemistry, 2013, 66: 182-187.
(  0) 0) |
| [16] |
Bowen H, Maul J E, Cavigelli M A, et al. Denitrifier abundance and community composition linked to denitrification activity in an agricultural and wetland soil[J]. Applied Soil Ecology, 2020, 151: 103521. DOI:10.1016/j.apsoil.2020.103521
(  0) 0) |
| [17] |
Yuan H J, Qin S P, Dong W X, et al. Denitrification rate and controlling factors for accumulated nitrate in the deep subsoil of intensive farmlands: A case study in the North China Plain[J]. Pedosphere, 2019, 29(4): 516-526. DOI:10.1016/S1002-0160(17)60472-7
(  0) 0) |
| [18] |
Qin S P, Hu C S, Oenema O. Quantifying the underestimation of soil denitrification potential as determined by the acetylene inhibition method[J]. Soil Biology & Biochemistry, 2012, 47: 14-17.
(  0) 0) |
| [19] |
郝耀旭. 关中平原长期定位施肥农田土壤N2O排放和反硝化潜势的观测研究[D]. 陕西杨凌: 西北农林科技大学, 2017. Hao Y X. Effects of long-term fertilization on N2O emissions and denitrification potential in agricultural soils in Guanzhong Plain[D]. Yangling, Shaanxi: Northwest A & F University, 2017. (  0) 0) |
| [20] |
Malghani S, Kim J, Lee S H, et al. Application of two contrasting rice-residue-based biochars triggered gaseous loss of nitrogen under denitrification-favoring conditions: A short-term study based on acetylene inhibition technique[J]. Applied Soil Ecology, 2018, 127: 112-119. DOI:10.1016/j.apsoil.2018.03.011
(  0) 0) |
| [21] |
王睿. 直接测定N2法与土壤N2、N2O、NO和CO2排放研究[D]. 北京: 中国科学院大学, 2012. Wang R. Measurement of N2, N2O, NO and CO2 emissions from soil with the gas-flow-soil-core technique[D]. Beijing: University of Chinese Academy of Sciences, 2012. (  0) 0) |
| [22] |
Molstad L, Dörsch P, Bakken L R. Robotized incubation system for monitoring gases(O2, NO, N2O N2) in denitrifying cultures[J]. Journal of Microbiological Methods, 2007, 71(3): 202-211. DOI:10.1016/j.mimet.2007.08.011
(  0) 0) |
| [23] |
Senbayram M, Well R, Bol R, et al. Interaction of straw amendment and soil NO3− content controls fungal denitrification and denitrification product stoichiometry in a sandy soil[J]. Soil Biology & Biochemistry, 2018, 126: 204-212.
(  0) 0) |
| [24] |
Gao Y, Mania D, Mousavi S A, et al. Competition for electrons favours N2O reduction in denitrifying Bradyrhizobium isolates[J]. Environmental Microbiology, 2021, 23(4): 2244-2259. DOI:10.1111/1462-2920.15404
(  0) 0) |
| [25] |
Wu D, Wei Z J, Well R, et al. Straw amendment with nitrate-N decreased N2O/(N2O+N2) ratio but increased soil N2O emission: A case study of direct soil-born N2 measurements[J]. Soil Biology & Biochemistry, 2018, 127: 301-304.
(  0) 0) |
| [26] |
Qin S P, Pang Y X, Clough T, et al. N2 production via aerobic pathways may play a significant role in nitrogen cycling in upland soils[J]. Soil Biology & Biochemistry, 2017, 108: 36-40.
(  0) 0) |
| [27] |
Yuan H J, Zhang Z J, Li M Y, et al. Biochar's role as an electron shuttle for mediating soil N2O emissions[J]. Soil Biology & Biochemistry, 2019, 133: 94-96.
(  0) 0) |
| [28] |
Wei Z J, Shan J, Chai Y C, et al. Regulation of the product stoichiometry of denitrification in intensively managed soils[J]. Food and Energy Security, 2020, 9(4): e251.
(  0) 0) |
| [29] |
Smith M S, Tiedje J M. Phases of denitrification following oxygen depletion in soil[J]. Soil Biology & Biochemistry, 1979, 11(3): 261-267.
(  0) 0) |
| [30] |
Senbayram M, Budai A, Bol R, et al. Soil NO3− level and O2 availability are key factors in controlling N2O reduction to N2 following long-term liming of an acidic sandy soil[J]. Soil Biology & Biochemistry, 2019, 132: 165-173.
(  0) 0) |
| [31] |
Giles M, Morley N, Baggs E M, et al. Soil nitrate reducing processes - drivers, mechanisms for spatial variation, and significance for nitrous oxide production[J]. Frontiers in Microbiology, 2012, 3: 407.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


