土壤质量演变和土壤质量的可持续一直是土壤学研究的热点[1]。土壤结构对土壤质量及其生态功能的调节起着举足轻重的作用,它直接影响着水分的入渗和滞留、气体交换、土壤有机质和养分循环以及土壤微生物多样性和活性[2-3]。土壤结构是土壤颗粒和不同粒级团聚体在空间的排列[4],它的形成取决于环境因素(母质、地形和气候等)、生物因素(土壤动物、植物根系和微生物活动等)和人为因素(耕作和机械压实等)[5]。土壤团聚体稳定性是反映土壤结构好坏的重要指标[6]。
目前对于影响团聚体稳定性的因素和相关胶结物质已比较清楚[7–9]。随着Monnier[10]有关团聚体稳定性对外源有机物料响应的概念模型、Tisdall和Oades[4]提出的等级发育模型、Six等[6]进一步补充完善所提出的胚胎发育模型理论和Christensen[11]提出的三级结构划分理论的相继提出,有关团聚体形成和稳定的理论机制逐渐完善。而且,有关有机物和矿物相互作用的理论模型:Wershaw等[12]的“胶束”模型和Kleber等[13]的“涂层”模型相继出现,刷新了人们对于以往有机物质在矿物表面的直接结合的认知,进一步在分子界面水平为团聚体形成和稳定的提供了理论支持。随后有关团聚体是微生物的“孵化器”理论[14]和菌丝-细根所构建的“黏性网袋”理论[15]更是将土壤生物与团聚体的关系提升到了新的高度。但是,对参与团聚体形成和稳定的非生物因素(土壤矿物、有机碳、氧化铁等胶结物质)和生物因素(土壤微生物及其代谢物)的作用机制及其在稻田和滨水土壤的特异影响因素尚缺乏系统总结[16-17]。稻田及滨水土壤团聚体的形成和稳定不仅受干湿交替频率和持续时间影响,还受到动态变化的土壤pH和溶液中Na+/Ca2+离子浓度的控制[16]。上述因素会影响土壤中有机/无机胶结物质的性质、组成、结构和(生物)化学反应特性并最终决定土壤团聚体的形成和稳定[5]。因此,充分认识有机质、金属氧化物和微生物对团聚体形成和稳定的作用机制以及相互耦合关系,对于全面了解土壤的形成演变规律和生态功能,尤其对促进土壤生态系统健康和可持续发展具有重要的理论和应用价值。
本文梳理了土壤团聚体的研究历程,整理和归纳了促进团聚体研究发展的关键理论发现,比较了团聚体的筛分方法及粒级划分依据,详细阐述了不同基本组成单元的特性,总结了不同尺度团聚体形成和稳定机制,进一步探讨了影响稻田及滨水土壤团聚体形成稳定的特异因素,最后提出当前研究的不足并展望其研究前景。
1 土壤团聚体研究的发展历程自20世纪初土壤团聚体分组方法(干筛[18]和湿筛[19]等)确立以来,各国学者相继利用上述方法对不同粒径的团聚体组分进行研究并取得一系列成果(图 1)。1936年,Sideri[20]研究了石英颗粒和土壤腐殖质对黏粒的吸附能力,首先明确了黏粒、石英颗粒和腐殖质是形成土壤团聚体的主要组分。Martin[21]在1945年发现真菌和细菌会导致土壤粉粒和黏粒间显著团聚,最早指出微生物在团聚体的形成中起着黏合剂的作用。此后,有关团聚体的研究步入微米时代。

|
图 1 土壤团聚体形成和稳定机制的重要研究历程 Fig. 1 Milestones of critical advances in understanding the formation and stability mechanism of soil aggregates |
Edwards和Bremner[25]在1964年提出土壤是由大团聚体和微团聚体所组成,其中大团聚体是微团聚体间的弱结合。1967年,Edwards和Bremner[26]又提出有机-无机复合体是团聚体形成的基础,并认为吸附或共沉淀作用是团聚体形成的重要机制。进入80年代,Tisdall和Oades[4]以250 μm为界线将水稳性团聚体分为大团聚体(> 250 μm,macroaggregates)和微团聚体(< 250 μm,microaggregates),这一分组使得以后各类团聚体研究之间具有了可比性,同时,他们认识到多糖、菌丝以及根系在土壤颗粒间胶结团聚过程中的重要性,上述研究均为团聚体和土壤结构及相关科学领域的快速发展奠定了坚实的基础。后来的Oades和Waters[37]根据不同的等级和时间尺度,将胶结物质分为瞬时性(主要是多糖)、短时性(根系和菌丝)和持久性(强吸附性有机聚合物和多价阳离子),并认为小于20 μm的微团聚体主要通过短程范德华力和静电吸附来稳定,其中也包括土壤中阳离子的参与。在此之后,Guggenberger等[38]和Puget等[39]陆续发现微生物来源的碳水化合物会在微团聚体或黏粉粒土壤组分中富集。与此同时,Tisdall[40]在1996年基于前人利用电子显微镜的研究结果,认为微团聚体是黏粒在细菌周围的紧密排列所形成;在细胞死亡和裂解后,微生物残留物(尤其是多糖)仍会使微团聚体保持稳定,而且还指出根系分泌物也有类似的作用。Six等[6]系统总结了自20世纪50年代以来确定的影响土壤团聚体和有机质动态的五个主要因素,它们分别是:土壤动物、微生物、根系、无机物和物理过程;团聚体中的有机质在微生物分解下会引发团聚体结构的破坏,从而促进团聚体的周转。团聚体的稳定性和周转率还取决于不断变化的环境条件,例如土壤含水量、pH、氧化还原电位、离子强度和机械压力等[5]。因此,土壤学者们一致认为团聚体的形成和稳定是物理、化学和生物的相互作用,缺一不可。
进入21世纪前后,各种新兴微观尺度研究技术被引入土壤学领域,包括电子计算机断层扫描技术(CT)、超高分辨率显微镜成像技术与同位素示踪技术相结合的纳米二次离子质谱技术(NanoSIMS)等,使得有关土壤团聚体的研究再次蓬勃发展,全面进入纳米时代。依靠先进的纳米尺度观测技术,微胶体和纳米颗粒大小有机矿物复合体被发现并认为其可形成更小的微团聚体[30-31],该大小的团聚体在土壤中既可作为固相的不可移动组分,也可作为流动相的胶体分散组分[41]。具有两亲性的蛋白质也被发现对矿物表面有机质以及微团聚体的稳定具有重要作用[13]。利用先进的纳米尺度检测技术,众多学者已经开展对团聚体的微结构以及微表面元素分布的定量分析[32,35]。
在近百年的土壤团聚体研究发展过程中,有关形成及稳定机制的概念模型层出不穷,但在学界引起广泛反响并起到积极推动作用的主要有以下几个。①Monnier[10]概念模型根据输入有机物料的性质,认为对团聚体稳定性会产生不同对应时间的效应模式:易分解有机物料对团聚体稳定性具有强烈的瞬时效应,而更稳定的有机物料具有较弱但影响较长的长期效应。②Tisdall和Oades[4]提出的等级发育模型(aggregate hierarchy model)指出,在空间尺度上,大团聚体是由微团聚体在各类胶结物质的作用下逐级形成的,而在时间尺度上,将各类胶结物质分为暂时稳定、短时间稳定和持久稳定的层次性变化。③Six等[6]基于Oades[2]的观点进一步补充完善,提出经典的胚胎发育模型理论(aggregate turnover model),认为新鲜有机物促进大团聚体形成,而大团聚体内的颗粒有机物有助于微团聚体的形成,伴随颗粒有机物的分解及其他干扰过程,大团聚体破碎后将微团聚体释放出来。④Christensen[11]打破以团聚体大小分级的固有观念,将土壤中的有机矿物复合体视为土壤的基本结构单元(一级结构,primary structure),该结构主要受有机物、矿物之间的表面活性所控制;一级结构再团聚的次级复合体,包含不同尺度的团聚体,称为二级结构(secondary structure),基于对有机物和土壤生物的物理保护以及所形成的气体和水分的梯度来控制土壤微循环;三级结构(tertiary structure)是结构完整的土壤(原位土壤),它综合了前两级结构的特性,反映整个土壤系统的物质和能量周转与储存。
随着土壤团聚体领域研究的迅猛发展,各国学者提出了各类指标来评价土壤团聚体结构和稳定性,使量化土壤团聚体的形成过程及其结构和稳定性的动态变化成为可能。团聚体稳定指数(ASI)[19]、平均重量直径(MWD)[22]、几何平均直径(GMD)[24]、分形维数(D)[27]等作为衡量团聚体分布情况和稳定性的重要指标,已被国内外学者广泛运用于团聚体形成过程和稳定程度的研究中。ASI可反映土壤团聚体的保存比例或破坏程度。MWD和GMD反映了土壤团聚体大小分布状况,一定程度上可以说明团聚体的团聚度和稳定性。D则能表征团聚体的均匀程度,还可有效表征团聚体变化过程中土壤理化性质的变化趋势。结构熵(structural entropy)[28]、局部几何熵(local geometry entropy)[29]、归一化熵函数(normalized entropy function)[33]等是评价土壤团聚体结构性质的指数。熵的概念早已被认为是描述多孔介质形态学的最佳参数,是研究土壤结构组织及团聚体形成和周转的一种有价值且敏感的方法。虽然目前这类指数的运用仍然偏少,相信在原位结构测量技术和土壤孔隙理论迅猛发展下,在不久的将来它们一定会为完善团聚体的形成和稳定机制方面提供强大助力。
近年来,国内外仍不断出现突破性进展,相继提出了一系列重要理论观点,如微团聚体的形成与稳定主要由于土壤黏粒包被氧化铁“涂层”后有机质的胶结作用[34]、团聚体作为“孵化器”有利于微生物的进化及实现其特定功能[14]、磷素在土壤团聚体内微循环机制[36]等。目前我国学者在团聚体微结构、微反应和微循环等领域已经走在了世界前列,为土壤结构领域的高速发展提供了强大动力。
2 团聚体的筛分方法与粒级划分团聚体筛分(团聚体分组),即人为将土壤分离为不同大小的土壤颗粒。干筛和湿筛方法由Puchner[18]和Yoder[19]建立以来,经过多年的不断完善,借助特定的仪器设备,逐渐形成了被广泛接受的团聚体筛分方法体系。“干筛”是将土壤样品置于已知孔径的网筛后通过振荡分离得到土壤颗粒。运用干筛的方法研究土壤团聚体大多是经风干或烘箱干燥的土壤样品,也有部分研究直接对鲜土进行筛分,但含水量需要调至田间持水量以下。而对于“湿筛”,就是将土壤样品置于已知孔径网筛并浸入水中,通过振荡而分离得到土壤颗粒。近年来,借助特定的团聚体筛分仪器(振动筛分仪和土壤团聚体分析仪),通过设置固定的振荡频率和时间,大大降低了筛分团聚体过程中的人为误差,使得不同来源的结果具备了可比性。在此基础上,各国研究者通过反复实践,对筛分仪器的操作步骤也形成了约定俗成的规范。例如,Dı́az-Zorita等[42]认为对于多数充分干燥的土壤,在振动筛分仪中振荡30 s足以让土壤充分破碎。此外,Elliott等[43]认为,网筛上下行程约为30 mm,在每分钟30次循环的振荡频率下,持续2 min是较为合理的湿筛程序。一般认为,相对于湿筛,干筛对团聚体的理化及微生物学性质的影响要小。因为在湿筛过程中,土壤浸入水(或其他溶剂)中,势必导致土壤中可溶性成分和微生物细胞从团聚体中流失。总而言之,由于筛分方法的差异,干筛团聚体得到的是力稳性团聚体,而湿筛得到的是水稳性团聚体,研究者需要根据自己的研究目的选择合适的筛分方法(表 1)。
|
|
表 1 两种主要土壤团聚体筛分方法的比较 Table 1 Comparison of two main sieving methods for soil aggregates |
目前团聚体粒级的划分主要是参考《美国农业部土粒分级标准》(United States Department of Agriculture,1951)、《国际土粒分级标准》(International Society of Soil Science,1930)和《国际岩土分析标准》(International Standard of Geotechnical Investigation and Testing,2002)中有关土壤质地分类的相关内容(图 2)。然而,由于不同分级标准之间差异明显,即使参考同一标准也会因为筛分的细致程度不同,最终导致不同研究人员的团聚体划分五花八门。幸运的是,绝大多数研究者均遵照Tisdall和Oades[4]的观点,以250 μm为基准筛分土壤团聚体,这就使得比较不同的研究结果成为可能,促进了有关大团聚体和微团聚体各类理化和生物学数据和理论的积累,是能够客观阐述团聚体形成和稳定机制的关键所在。

|
图 2 土壤团聚体粒级主要的划分依据和分级类型 Fig. 2 The main classification basis and classification type of aggregate particle size |
土壤矿物颗粒是团聚体形成的基础,它们与有机质之间存在强烈的吸附和结合作用[26,44]。Burke等[45]对北美大草原的土壤进行系统分析后发现,土壤有机质与黏粒含量呈显著正相关。随后,Monreal等[46]发现土壤有机碳与绿泥石化蛭石和云母的含量呈正相关,但与总黏粒含量呈负相关。上述结果表明除了黏粒含量外,黏土类型对于土壤有机质的固持同样重要[47]。一般认为蒙脱石为主的黏土矿物较其他矿物(高岭石或绿泥石)更有利于有机碳的固存[48]。一方面是因为蒙脱石表面积和晶层结构的优势,使其可以保护更多的有机碳[49],另一方面是因为蒙脱石和其他类型的黏土矿物与有机物质之间的结合机制不同,高岭石中的有机质富含不稳定的多糖,而蒙脱石中的有机质则富含较稳定的芳香化合物[50]。
黏粒由于较其他粉砂粒有更大的比表面积,似乎是土壤有机质的主要吸附剂以及参与土壤颗粒聚集的主要活性组分。Christensen等[11]发现在温带耕作土壤中,50%~75%的有机质以黏粒大小的有机矿物复合体颗粒的形式存在。然而,Regelink等[34]对欧洲三个土壤质地类型的关键带监测区域进行对比研究后,发现黏粒含量与土壤有机碳(SOC)含量之间无相关性,认为黏粒表面不是有机质的主要吸附位点;此外,还发现黏粒含量与团聚体粒级分布之间的相关性有限。这主要因为矿物的类型和表面活性决定着它与其他物质结合的强度[51],尤其是黏土矿物,它的矿物学性质会影响团聚体的形成和稳定[52]。例如,与膨胀性黏土矿物(如蒙脱石)相比,非膨胀性黏土矿物(如伊利石、高岭石和绿泥石)分散作用更大,不利于矿物颗粒间的团聚[53]。
3.2 有机质和铁氧化物是促进土壤颗粒团聚的重要胶结剂Wershaw等[12]在土壤矿物和有机物间的键合机制以及氨基酸或蛋白质在黏土矿物表面的结合机制基础上,提出了有机-矿物相互作用的“胶束”模型(bilayer model)(图 3)。该模型认为由于有机分子大多数是两亲性的,它们可以胶束的形式通过不同的化学键结合在矿物周围,这与传统Stevenson[54]有机分子形成结构复杂聚合物直接吸附在矿物表面的观点形成鲜明对比。

|
图 3 有机-矿物相互作用的三种理论模型 Fig. 3 Three theoretical models of organo-mineral interactions |
除了有机质与矿物颗粒的直接键合作用外,有机质和金属氧化物之间的相互作用对于团聚体的形成更为重要。例如,铁氧化物对土壤质量的贡献虽然很小(< 1%),但其拥有较大的比表面积[55],在土壤颗粒团聚过程中,尤其在小粒径团聚体形成和稳定过程中起着重要作用[34]。铁氧化物能够与不同大小的土壤颗粒形成牢固的结合,这意味着它可为中等甚至低吸附性颗粒表面提供吸附有机物质的位点[56]。Barberis等[57]表明,对于大多数类型土壤而言,土壤中约50%的无定形铁氧化物与粉砂粒和砂粒相结合。很多学者认为铁氧化物主导有机质的吸附,因为不同形态的铁氧化物(无定形态、络合态等)含量与SOC含量存在显著的相关性[34,58]。但是,在特定土壤类型中(例如,水铝英石质火山灰土),无定形铝氧化物或水铝英石可能对团聚体的形成贡献更大,同时也取决于土壤中存在的相应矿物的数量[59]。
由于铁氧化物远较粉砂粒和砂粒要小,少量铁氧化物的吸附可显著增加粉砂粒/砂粒的表面积。这种铁氧化物的“涂层”显著促进了较大矿物颗粒和有机物质之间的相互作用,且对石英等其他反应性差的矿物尤其有效[13](图 3)。因此,铁氧化物有利于土壤颗粒的相互团聚,从而促进团聚体的形成。光谱分析的结果印证了铁氧化物“涂层”在促进有机质在矿物颗粒表面吸附方面的重要性,其中粉砂粒和砂粒上的有机质主要以富铁的斑块存在,而不是均匀分布[60]。有机质,尤其是腐殖酸,对铁氧化物具有很高的吸附亲和力,容易在铁氧化物表面形成一层厚度约为1~2 nm的单分子层[61]。虽然这层腐殖酸分子会增强黏土颗粒和铁氧化物的结合,但单层腐殖酸所形成的结合力无法克服粉砂粒大小颗粒之间的间隙。因此,需要更厚的有机质层,通过吸附其他大分子有机化合物,特别是多糖和球囊霉素,以便将粉砂粒和砂粒大小的颗粒纳入团聚体中[14]。虽然微生物分泌物与土壤矿物的相互作用同样可用Kleber等[13]的“涂层”模型(zonal model)来解释,但因其与矿物表面通过阳离子架桥和疏水作用的结合相对松散且其本身容易被分解,不利于团聚体的长期稳定[62]。由于土壤中的有机物质和金属氧化物的种类繁多,不同的种类和含量对团聚体的形成和稳定的贡献不同,且容易受到外界环境的影响,因此,彻底厘清有机质和金属氧化物对土壤团聚作用才是真正解开土壤结构形成的关键。
3.3 生物在控制团聚体周转方面起关键作用大多数有关团聚体动态变化的研究均集中在特定单一自然环境或田间管理条件,关注于不同粒径大小团聚体对有机碳的保护或团聚体破碎所导致的有机质和CO2的释放[63]。由于土壤中不同组分复杂的相互作用力,不同大小团聚体形成和破坏的运行机制、有关土壤团聚体周转过程的研究仍然很少。近年来,利用稀土元素作为示踪物质的方法估算大团聚体的周转速率大约在31 d,而小团聚体会持续181 d[64]。这意味着不同大小粒径团聚体的周转是不一致的,而且这一差异主要是受生物因子所控制。
土壤团聚体作为微生物的“孵化器”,提供了抵御捕食的避难所,微生物还可通过改变土壤环境来改善他们的栖息地[14]。而且,土壤团聚体组分和孔隙对微生物群落具有选择性[65-66]。正是因为团聚体的保护和选择作用,才造成了土壤微生物不同粒径团聚体中的差异。很多研究已表明土壤微生物在促进土壤颗粒的团聚和维持团聚体稳定性方面的关键作用(图 4),例如细根和微生物菌丝的缠绕作用[14]及其分泌物(多糖和球囊霉素等)的黏合作用[15]。虽然微生物分泌物与土壤矿物的相互作用同样可用Kleber等[13]的模型来解释,但因其与矿物表面通过阳离子架桥和疏水作用的结合相对松散且其本身容易被分解,不利于团聚体的长期稳定[62]。同时,微生物的代谢过程会伴随土壤团聚体中有机质的分解或解吸,导致团聚体结构的破坏并促进团聚体的周转。此外,根毛和真菌菌丝,尤其是丛枝菌根真菌(AMF)产生的菌丝,对于大团聚体的形成特别重要,是影响土壤结构长期稳定的重要因素。上述瞬时/短时胶结剂将微团聚体和复合体等结构单元聚合在一起形成大团聚体。当瞬时胶结剂被矿物颗粒包裹时,有利于微团聚体在大团聚体内部形成,限制了微团聚体内有机物的分解并减缓了进一步的周转。当瞬时/短时胶结剂受外界影响分解时,微团聚体被释放并有可能进一步破碎为结构更为简单的复合体颗粒。该过程是动态的,大团聚体部分分解或完全破碎,它的组分又被纳入新的微团聚体或大团聚体中(图 4)。具有较长的团聚体周转时间的土壤对新碳的固持能力差,但会长时间稳定其内部的碳,而较短周转时间可能会固持更多的新碳,但如果团聚体未以与其破碎相同的速度再生,土壤结构的整体稳定性可能降低。
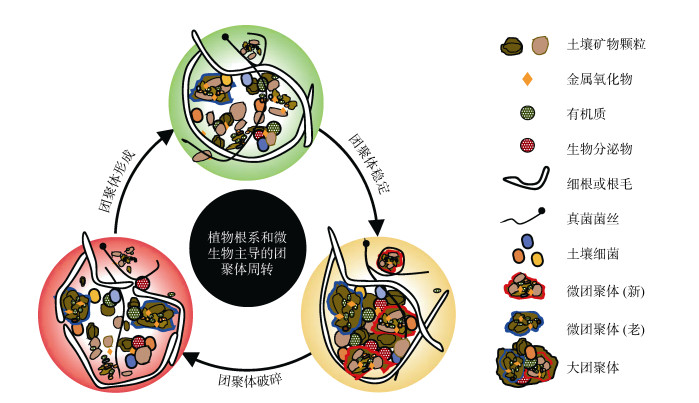
|
图 4 根系和微生物参与下的团聚体周转过程(据Rillig等[14]修改) Fig. 4 Aggregate turnover process with the participation of fine roots and microorganisms(modified from Rillig et al. [14]) |
土壤动物一方面通过取食微生物和植物根系并产生一定分泌物来影响土壤团聚体的形成和稳定,另一方面通过影响土壤的理化性质间接影响团聚体[8,67]。蚯蚓能将消化的植物和土壤残留物以蚓粪的形式并入土壤团聚体中,同时产生黏液促进土壤团聚体的形成和稳定。一般地,大型蚯蚓可形成较大的土壤团聚体,而较小的蚯蚓则破坏大团聚体,并排泄产生微团聚体。土壤线虫通过对土壤有机碳以及真菌菌丝和植物根系的捕食等机制直接影响土壤有机碳的分布和土壤团聚体的稳定,而土壤团聚体的周转变化又反过来影响土壤微生物和线虫活动及土壤有机碳的分布,相互影响,密不可分[68]。总之,微生物通过降解周围的有机物质并产生代谢物来影响团聚体中土壤颗粒的胶结程度,而土壤动物通过掘穴和捕食影响微生物的群落结构和土壤的孔隙结构,但是整个土壤生态系统所形成的食物网对团聚体周转乃至土壤结构形成的影响尚有待深入探究。
4 土壤团聚体的形成和稳定机制团聚体的形成是一个渐进的过程,不同粒级团聚体存在不同的形成机制[4]。大团聚体是由微团聚体聚合而成的,其中微团聚体内在的结合力要强于微团聚体间的结合力。附着在黏粒的有机分子和多价阳离子形成复合体[44],然后再与其他微团聚体胶结在一起形成大团聚体[5]。或者,当大团聚体内部的有机胶结物质被分解或微生物代谢物被释放,微团聚体就成为团聚体的周转产物而出现[5-6]。
4.1 微团聚体的形成和稳定机制微团聚体由多种土壤矿物、有机物和微生物及其代谢物共同组成,它们作为结构单元,即为形成团聚体的核心也起相互胶结的作用。形成微团聚体单个结构单元的空间尺寸会跨越三个甚至六个数量级以上(图 5)。

|
图 5 团聚体组分的空间尺寸大小(据Totsche等[72]修改) Fig. 5 The size of basic units in soil aggregates(modified from Totsche et al. [72]) |
原生矿物风化导致土壤中形成高度活性的次生黏土矿物,其中含有与短程有序相相关的各种层状矿物质,包括金属氧化物和氢氧化物以及铝硅酸盐。当颗粒态有机质被这些矿物颗粒包围时,会相互胶结形成稳定的有机矿物复合结构(< 20 μm)[26,44],逐步形成微团聚体[4,69]。由于表面电荷的相互作用,可溶性有机物和黏土矿物颗粒粘附在一起形成黏粉粒大小的有机矿物复合体[30-31,70]以及纳米大小的有机矿物复合物[59,71](图 5)。
作为微团聚体的复合结构单元,有机矿物复合体的形成可促进有机质的稳定并防止微生物捕获。Kaiser和Guggenberger[51]认为,大部分有机质通过吸附作用与微团聚体中的黏土颗粒紧密结合并在土壤中保持稳定。不同种类的有机碳不仅吸附在矿物表面,而且被包裹在复合体中,与矿物表面紧密接触,并受到物理保护,免受土壤酶的攻击[70]。Asano和Wagai[59]认为耐超声波的纳米有机矿物复合物可作为微团聚体形成的“持久黏合剂”,并进一步发现这些复合体富含微生物来源的有机质。
除形成有机矿物复合体外,通过吸附或共沉淀(取决于金属离子与碳的比例)作用可让无机相更均匀更有效地嵌入有机基质中[73]。Lehmann等[70]认为黏土矿物表面的有机涂层最先形成,然后与其他矿物结合后实现对有机涂层的物理封闭。根据Sideri[20]的早期研究结果,Edwards和Bremner提出[26],多价金属阳离子和有机物可通过吸附或共沉淀与矿物表面相互结合形成微团聚体(图 6)。诸多的研究表明,铁/铝氧化物表面特别有助于该过程[55]。在微团聚体的尺度上,有机-矿物的交界面中有机碳功能基团和各种无机组分的共存具有极大的复杂性,因此,单一的结合机制不可解释有机质的稳定机制[71,74-75](图 6)。这可能是由于参与微团聚体形成和稳定的有机质结构不同,多糖、蛋白质和脂质性质等会形成持久性不同的有机矿物组合[8]。
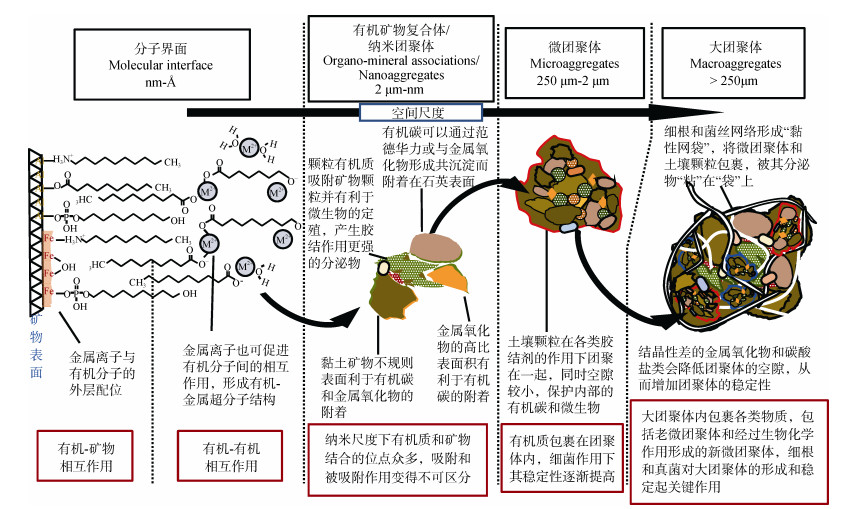
|
图 6 金属氧化物、有机碳和生物因子在团聚体形成和稳定过程中的作用机制 Fig. 6 Mechanism of metal oxides, organic matter and biological factors in the formation and stability of aggregates |
微团聚体的形成和稳定除了有机-矿物相互作用机制外,也归因于其他生物学机制。这两个过程均不唯一,它们一般同时发生。根据Oades和Waters[37]研究,小于20 μm的复合结构单元和微团聚体中几乎无植物碎屑,主要靠微生物及其衍生物质来稳定,包括多糖、菌丝碎片、细菌细胞或菌落,均被黏土颗粒所包裹。
活的微生物可直接通过静电吸附与土壤矿物结合[76]。附着在黏土颗粒或微团聚体上的细菌实际上既可作为“复合结构单元”,也可作为形成团聚体的核。细菌较真菌在微团聚体的形成和稳定中的作用更大[8,11]。细菌产物及其与土壤颗粒(如黏土矿物、多价金属和其他有机物或复合体)的相互作用促进了单个结构单元之间的胶结,尤其是在小于20 μm的微团聚体中[11]。这与多数观察结果一致,即细菌和古菌主要在该粒级中检测到[16,65-66]。胞外聚合物(EPS)以及微生物、植物和某些微生物产生的黏液作为胶结物质,对微团聚体的形成和稳定起着关键作用。有证据[8,39]表明,多糖对小于50 μm的微团聚体的稳定特别重要。
由于丰富的功能基团,特别是羧基、酰胺基和磷酰基,土壤微生物利用EPS将细胞附着至矿物表面[77]。EPS在矿物表面的吸附促进了矿物颗粒的聚集[39]。该种机制被认为在具有高微生物活性表面的矿物颗粒间形成复合结构单元和微团聚体时特别重要[69]。正如Kallenbach等[78]所指出的,微生物群落利用低分子量有机物(如根际分泌物)可产生多样的微生物聚合物。微生物产生的EPS和黏液或植物源的多糖和蛋白质吸附至矿物上时,可能因其有机氮/磷组分不同而形成不同的表面化学结构,进而形成强弱不同的胶结作用[79]。此外,球囊霉素作为一种由丛枝菌根真菌释放的糖蛋白,被认为同样具有与EPS和黏液类似的黏合剂作用[14]。
4.2 大团聚体的形成和稳定机制对大团聚体起稳定作用的同样是作为胶结剂的有机质,以及如铁、锰、铝、硅、铝硅酸盐和碳酸盐的氧化物、氢氧化物和羟基氢氧化物等[37]。而且,大团聚体的形成和稳定也受矿物学性质的影响,例如,高岭土由于和金属氧化物之间较强的物理或静电相互作用,可以在不受生物过程影响的条件下快速形成大团聚体。由于生物过程所产生的伊利土颗粒与生物有机大分子之间的化学键更强,导致伊利土较高岭土中具有长期稳定性的大团聚体更多[80]。
但与微团聚体相比,粉砂粒和砂粒在大团聚体中所起的作用更为重要,是大团聚体的主要组成部分[57]。除了有机质和金属氧化物的胶结,这些较大的土壤颗粒和微团聚体主要通过生物的作用结合在一起。它们利用瞬时(微生物分泌物,包括多糖和蛋白质)和短时黏合剂(如根和菌丝)结合形成大团聚体[6,14](图 6)。随着团聚体尺寸的增加,需要更大的能量和更强的作用力才能保持稳定。细根和真菌的作用逐渐凸显出来,因为它们的丝状结构在物理上使土壤颗粒和微团聚体紧密结合。细根和菌根菌丝网络被认为是一个“黏性网袋”(sticky string bag),将微团聚体和土壤颗粒包裹起来后,被细根和微生物分泌物“粘”在“袋”上[15](图 6)。由于该过程主要是描述不同组分如何在空间上通过不稳定和水溶性的“胶水”结合,因此主要针对大团聚体的形成过程,而通常整体稳定性较差[52]。因此,大团聚体的形成和稳定可能并不会同时发生[2],这也是胚胎发育模型提出的依据之一。
5 稻田和滨水土壤中团聚体形成和稳定的特异影响因素长期以来国内外学者就外界自然环境、人为活动和土壤本质特征对团聚体的影响已作了许多优秀的系统性综述[5,8,67,72,81],并对个别关键影响因子进行详细的机制阐述[68,82-83](图 7)。与此同时,对不同典型生态系统(如森林、草地和旱地农田等)土壤团聚体形成及其相关的稳定性也进行了广泛的研究[6,55,69],而稻田土壤和滨水湿地具有独特的干湿交替过程,目前仍缺乏对此类土壤的团聚和稳定过程的研究和理论认识[16-17]。最新的研究表明全球尺度下水稻土是一个重要的碳库,它们较单位面积农田的碳储量高出20%以上[84]。这主要是因为稻田在特有的水耕熟化作用下有机碳逐渐积累[85-86],有利于土壤团聚体的形成并对有机碳起保护作用[16-17]。而滨水湿地由于扰动较少同样有利于有机碳的积累和团聚体的形成。铁氧化物作为稻田及滨水土壤生态系统中主要的氧化还原物质[58],它与有机质所形成的有机矿物复合体是形成和稳定土壤团聚体的重要胶结物质[44]。但是,目前对于铁氧化物在稻田土壤及滨水湿地中对土壤结构的影响,尤其是土壤团聚体形成和稳定机制尚缺少系统的理论认识。虽然刘艳等[68]对干湿交替条件下土壤团聚体粒径分布和水稳性的变化特征以及团聚体稳定性的影响因素和机制进行了总结,但是并未对干湿交替下团聚体对土壤pH和阳离子浓度以及氧化还原条件变化的响应机制作详细阐述。
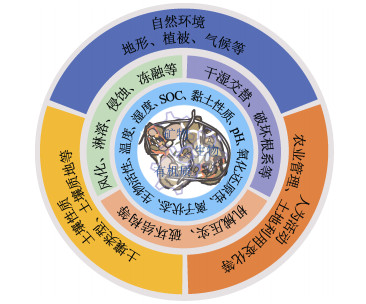
|
注:SOC,土壤有机碳。 Note: SOC, soil organic carbon. 图 7 不同尺度下的土壤团聚体影响因素 Fig. 7 Influencing factors of soil aggregates at different scales |
先前的研究表明,SOC相近的土壤间团聚体组分的不同主要与黏粒含量的差异有关[59]。然而,Regelink等[34]发现与中性至弱碱性的土壤相比,相近SOC含量的酸性土壤拥有更高比例的水稳性团聚体,认为pH可解释在相近SOC含量下形成的团聚体组分的差异。pH在团聚体形成和稳定中的作用逐渐凸显,尤其在随着干湿交替而变化的稻田土壤和滨水湿地中的作用可能更为显著[16-17]。pH主要从三个方面影响土壤团聚体的形成。首先,腐殖酸对铁氧化物和黏土矿物的吸附随着pH的降低而增加[61],这意味着低pH提高矿物表面对腐殖酸的吸附量。其次,随着pH的降低,负电荷胶体物质之间的静电斥力会降低,促进了有机物和矿物颗粒间的胶结[87]。再次,pH较高的土壤中Fe3+等阳离子接近零电荷点[88],这样会降低铁氧化物间的静电排斥,有利于土壤颗粒间的团聚。而且,在高pH条件下,Fe3+等氧化物会较少地吸附有机质,从而有更多的有机质参与土壤颗粒的团聚过程中[89]。因此,pH影响团聚体形成和稳定的原因主要是改变了矿物表面“有机涂层”的厚度和胶体颗粒之间的结合强度。
pH对团聚体的影响不能完全归因于H+浓度本身,因为pH还影响土壤中多价阳离子(Ca2+、Al3+、Fe3+和Na+等)的溶解性。一般认为,高浓度的Na+对土壤团聚体有较强的分散作用,而Ca2+又可促进团聚体的形成。例如,在石灰性土壤中,Ca2+浓度由CaCO3的溶解度控制,Ca2+浓度随pH的增加而降低[90]。此外,pH的降低促进含铁/铝氧化物矿物的溶解,导致Al3+和Fe3+的浓度显著增加。由于阳离子会在黏土矿物和有机分子之间形成桥键,所以土壤溶液中Ca2+、Al3+和Fe3+等浓度的增加会促进团聚体的形成[5]。此外,阳离子交换量(CEC)和可交换阳离子的组成,特别是Na和Mg的含量,也会影响团聚的强度[5]。
然而,pH介于7~8之间的土壤的团聚体组分变化很大,这可能是由于该pH范围内阳离子浓度和组成的巨大差异造成的,土壤中多价阳离子溶解度对pH依赖性放大了上述pH效应。因此,确定与团聚体稳定性相关的土壤离子组成可能会进一步提高对土壤中稳定团聚体组分的预测。
5.2 氧化还原条件变化的影响土壤中的金属氧化物和有机质对氧化还原条件的敏感程度是影响团聚体稳定性的关键因素(图 6)。在有氧条件下,金属氧化物被认为是形成土壤团聚体最为重要的胶结物质[72]。Fe3+和Al3+等金属离子的水解沉淀可能会通过与有机质的共沉淀和黏土的絮凝作用而发生团聚[91]。
在持续缺氧条件下,土壤中的Fe3+可被微生物所还原,在有机物的分解过程中作为电子受体[92],该过程可能导致依赖Fe3+氧化物结合的土壤颗粒分散,进而破坏团聚体的结构[72],同时释放出胶体、纳米粒子、有机物和氧化还原敏感性元素[41,93]。释放出来的有机物质容易被微生物所利用,进而加速土壤有机碳的流失[94]。在淹水厌氧条件下,土壤团聚体稳定性随氧化还原电位的降低而降低,De-Campos等[95]认为该现象与土壤溶液中的可溶性有机碳和Fe2+离子的增加有关。但是,Fritzsche等[93]发现在干湿交替的条件下,土壤对氧化还原、水分和酸碱性的临时变化表现出较强的恢复力,仅有少量的Fe被释放出来。
Fe3+氧化物在厌氧条件下被还原为容易溶解和移动的Fe2+,已有研究表明长期植稻会导致表层土壤全铁含量的下降[58]。然而,在特殊的漫滩环境(滩涂等)下,土壤中含有大量的碳酸盐和硫化物,容易生成Fe2+矿物,如菱铁矿(FeCO3)和黄铁矿(FeS)[96-97]。因此,大部分Fe2+仍会以固相保留于土壤中,而上述铁矿物的表面有利于有机碳的吸附[98]。这时土壤团聚体的稳定性就取决于Fe2+矿物及其络合物在土壤颗粒团聚中的胶结作用。虽然这些Fe2+矿物在还原条件下具有稳定土壤结构的潜力,但目前对于上述过程的认识仍然非常有限。目前已知菱铁矿可在稻田土壤还原条件下与黏粒形成团聚体[99];可胶结石英颗粒和黏土矿物[100]。而且,土壤中的菱铁矿和黄铁矿可同时在砂粒表面形成胶膜[96-97],它们可作为键桥将不同颗粒胶结起来。目前在类似稻田和滨水土壤上开展团聚体形成和稳定机制的研究仍然较少,无法形成较为系统的理论体系,这就需要今后尽快加深对这方面的认识。
6 总结和展望尽管目前矿物颗粒、有机质和微生物各自在土壤团聚体形成和稳定过程中的作用机理以及部分相互作用过程与机制已经取得了丰硕成果,但由于土壤是一个复杂的多相系统,已有的研究在宏观和微观尺度上对形成和稳定机制的揭示尚存在诸多不足。未来的研究应多学科进行融合与交叉,基于新兴和原位的监测技术,将微观与宏观相结合,侧重于量化和原位监测,全面阐述不同尺度土壤团聚体中矿物-有机质-生物的相互耦合作用及其呈现的特有功能,并探讨单一及复合环境因子对不同土壤类型中团聚体影响的差异性及其机制。针对上述问题,未来需要着重从以下几个方向开展后续的研究。
(1)微观尺度上土壤团聚体形成和稳定过程与机制。综合相关学科的研究方法和现代先进的仪器技术(如同步辐射X射线近边吸收光谱、纳米二次离子质谱以及生物组学等),监测微界面上微生物介导的矿物和有机质反应过程,并对相关动力学过程进行定量表征,从而为微观尺度上解读团聚体的形成和稳定提供更加深刻的理解。
(2)特殊土壤类型及长时间尺度团聚体形成和稳定过程与机制。水(氢键作用)和Fe2+氧化物在微团聚体稳定中的作用通常被忽视,尤其是存在干湿交替(稻田及滨水生态系统等)或长期淹水缺氧的土壤,这些特殊类型土壤的团聚体形成过程和稳定机制的研究尚鲜有报道。而且,虽然目前对于上述类型土壤微生物群落结构及数量的研究已有不少报道,但尚未真正了解微生物在改变土壤结构方面所起的作用。此外,土地利用方式改变以及长时间尺度(百/千年,土壤时间序列)下土壤演替过程所伴随的团聚体的动态变化规律仍不清楚,尚需要全面认识这些土壤结构的形成过程及其与有机碳和生物的动态耦合关系。
(3)不同粒径团聚体生态功能的分异规律和形成机制。土壤团聚体作为微生物的“孵化器”,让微生物栖息地实现空间隔离,抵御其他生物的捕食。此外,微生物的数量和群落结构在不同粒径团聚体存在明显的分异特征,而且不同团聚体的营养物质可利用性和水化效应对微生物群落也存在影响。因此,不同粒径团聚体存在特异的微生物种群从而拥有不同的生态功能。目前仅有少数研究论述了微生物生长、活性及功能在不同粒径团聚体中的分布关系,继续提高对土壤团聚体微环境和特定微生物功能之间的相互反馈机制的认识,这对于理解土壤整体功能的实现是必不可少的。
(4)新型土壤结构改良剂的研发与应用。土壤团聚体的组成和稳定性直接影响土壤的物理和化学性质进而影响土壤肥力,因此可人为添加土壤结构改良剂来提高土壤质量。作为天然改良剂的有机肥和绿肥等有机物料能显著提高土壤团聚体,但通常周期较长且所形成团聚体的稳定性较差。而且,其他类型改良剂(如聚丙烯酰胺等)的改良效果十分有限,仅有短暂的促进团聚和稳定作用。因此,需要利用现代化学合成技术,寻找促进土壤颗粒团聚且稳定性强的合成有机甚至无机改良剂,改善土壤结构,提高土壤肥力。
(5)规范土壤团聚体分级标准并与原位观测结果相结合。团聚体分级过程中,由于操作习惯、操作方法以及使用仪器的差异,分级结果容易受到一定的人为因素影响。再者,研究人员参考三种土粒分级标准进行团聚体研究难免造成分组的类型千差万别。因此,非常有必要制定详细的分级和评价标准,这样才能得到相对客观的分级结果。此外,分级得到的团聚体并不能完全体现它在原位土壤中的全部性质,有必要结合X-射线光谱显微镜和断层扫描等技术手段的原位分析结果(如原状土壤的矿物组成和分布以及土壤孔隙等),探索并量化它们之间的相互关系,建立空间结构模型来模拟物质能量的周转过程,认识土壤团聚体在相应土壤系统中的动态作用过程,从而更加全面客观地评价和理解土壤结构。
| [1] |
Cao Z H, Zhou J M. Soil quality of China (In Chinese). Beijing: Science Press, 2008. [曹志洪, 周健民. 中国土壤质量[M]. 北京: 科学出版社, 2008.]
(  0) 0) |
| [2] |
Oades J M. The role of biology in the formation, stabilization and degradation of soil structure. Soil structure/soil biota interrelationships[J]. Geoderma, 1993, 56: 377-400. DOI:10.1016/0016-7061(93)90123-3
(  0) 0) |
| [3] |
Vogel H J, Balseiro‐Romero M, Kravchenko A, et al. A holistic perspective on soil architecture is needed as a key to soil functions[J]. European Journal of Soil Science, 2022, 73(1): e13152.
(  0) 0) |
| [4] |
Tisdall J M, Oades J M. Organic matter and water‐stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141-163. DOI:10.1111/j.1365-2389.1982.tb01755.x
(  0) 0) |
| [5] |
Bronick C J, Lal R. Soil structure and management: A review[J]. Geoderma, 2005, 124(1/2): 3-22.
(  0) 0) |
| [6] |
Six J, Elliott E T, Paustian K. Soil macroaggregate turnover and microaggregate formation: A mechanism for C sequestration under no-tillage agriculture[J]. Soil Biology and Biochemistry, 2000, 32(14): 2099-2103. DOI:10.1016/S0038-0717(00)00179-6
(  0) 0) |
| [7] |
Blankinship J C, Fonte S J, Six J, et al. Plant versus microbial controls on soil aggregate stability in a seasonally dry ecosystem[J]. Geoderma, 2016, 272: 39-50. DOI:10.1016/j.geoderma.2016.03.008
(  0) 0) |
| [8] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between (micro) aggregates, soil biota, and soil organic matter dynamics[J]. Soil and Tillage Research, 2004, 79(1): 7-31. DOI:10.1016/j.still.2004.03.008
(  0) 0) |
| [9] |
Krause L, Rodionov A, Schweizer S A, et al. Microaggregate stability and storage of organic carbon is affected by clay content in arable Luvisols[J]. Soil and Tillage Research, 2018, 182: 123-129. DOI:10.1016/j.still.2018.05.003
(  0) 0) |
| [10] |
Monnier G. The effect of organic matter on the stability of soil structure[J]. African soils, 1965, 10(1): 5-42. Monnier G. Action des matieres organiques sur la stabilite structurale du sol[J]. Sols Africains, 1965, 10(1): 5-42.
(  0) 0) |
| [11] |
Christensen B T. Physical fractionation of soil and structural and functional complexity in organic matter turnover[J]. European Journal of Soil Science, 2001, 52(3): 345-353. DOI:10.1046/j.1365-2389.2001.00417.x
(  0) 0) |
| [12] |
Wershaw R L, Llaguno E C, Leenheer J A. Mechanism of formation of humus coatings on mineral surfaces 3. Composition of adsorbed organic acids from compost leachate on alumina by solid-state 13C NMR[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1996, 108(2/3): 213-223.
(  0) 0) |
| [13] |
Kleber M, Sollins P, Sutton R. A conceptual model of organo-mineral interactions in soils: Self-assembly of organic molecular fragments into zonal structures on mineral surfaces[J]. Biogeochemistry, 2007, 85(1): 9-24. DOI:10.1007/s10533-007-9103-5
(  0) 0) |
| [14] |
Rillig M C, Muller L A, Lehmann A. Soil aggregates as massively concurrent evolutionary incubators[J]. The ISME Journal, 2017, 11(9): 1943-1948. DOI:10.1038/ismej.2017.56
(  0) 0) |
| [15] |
Nichols K A, Halvorson J J. Roles of biology, chemistry, and physics in soil macroaggregate formation and stabilization[J]. The Open Agriculture Journal, 2013, 7: 107-117. DOI:10.2174/1874331520131011003
(  0) 0) |
| [16] |
Liu Y L, Wang P, Ding Y J, et al. Microbial activity promoted with organic carbon accumulation in macroaggregates of paddy soils under long-term rice cultivation[J]. Biogeosciences, 2016, 13(24): 6565-6586. DOI:10.5194/bg-13-6565-2016
(  0) 0) |
| [17] |
Wang P, Liu Y, Li L, et al. Long-term rice cultivation stabilizes soil organic carbon and promotes soil microbial activity in a salt marsh derived soil chronosequence[J]. Scientific Reports, 2015, 5(1): 1-13. DOI:10.9734/JSRR/2015/14076
(  0) 0) |
| [18] |
Puchner H. Aggregate analysis as a means for determining soil structure[J]. Mitteilung der Deutschen Landwirtschafts-Gesellschaft, 1911, 26: 38-40.
(  0) 0) |
| [19] |
Yoder R E. A direct method of aggregate analysis of soils and a study of the physical nature of erosion losses 1[J]. Agronomy Journal, 1936, 28(5): 337-351. DOI:10.2134/agronj1936.00021962002800050001x
(  0) 0) |
| [20] |
Sideri D I. On the formation of structure in soil: Ⅱ. Synthesis of aggregates; on the bonds uniting clay with sand and clay with humus[J]. Soil Science, 1936, 42(6): 461-482. DOI:10.1097/00010694-193612000-00005
(  0) 0) |
| [21] |
Martin J P. Microorganisms and soil aggregation: I. Origin and nature of some of the aggregating substances[J]. Soil Science, 1945, 59(2): 163-174. DOI:10.1097/00010694-194502000-00006
(  0) 0) |
| [22] |
van Bavel C H M. Mean weight-diameter of soil aggregates as a statistical index of aggregation[J]. Soil Science Society of America Journal, 1950, 14: 20-23. DOI:10.2136/sssaj1950.036159950014000C0005x
(  0) 0) |
| [23] |
Wittmuss H D, Mazurak A P. Physical and chemical properties of soil aggregates in a Brunizem soil[J]. Soil Science Society of America Journal, 1958, 22(1): 1-5. DOI:10.2136/sssaj1958.03615995002200010001x
(  0) 0) |
| [24] |
Mazurak A P. Effect of gaseous phase on water-stable synthetic aggregates[J]. Soil Science, 1950, 69(2): 135-148. DOI:10.1097/00010694-195002000-00005
(  0) 0) |
| [25] |
Edwards A P, Bremner J M. Use of sonic vibration for separation of soil particles[J]. Canadian Journal of Soil Science, 1964, 44(3): 366-366. DOI:10.4141/cjss64-053
(  0) 0) |
| [26] |
Edwards A P, Bremner J M. Microaggregates in soils[J]. Journal of Soil Science, 1967, 18(1): 64-73. DOI:10.1111/j.1365-2389.1967.tb01488.x
(  0) 0) |
| [27] |
Turcotte D L. Fractals and fragmentation[J]. Journal of Geophysical Research: Solid Earth, 1986, 91(B2): 1921-1926. DOI:10.1029/JB091iB02p01921
(  0) 0) |
| [28] |
Dexter A R. A statistical measure of the structure of tilled soil[J]. Journal of Agricultural Engineering Research, 1977, 22(1): 101-104. DOI:10.1016/0021-8634(77)90099-3
(  0) 0) |
| [29] |
Andraud C, Beghdadi A, Haslund E, et al. Local entropy characterization of correlated random microstructures[J]. Physica A: Statistical Mechanics and its Applications, 1997, 235(3/4): 307-318.
(  0) 0) |
| [30] |
Chenu C, Stotzky G. Interactions between microorganisms and soil particles: An overview// Huang P M, Bollag J M, Sensi N. Interactions between soil particles and microorganisms and the impact on the terrestrial ecosystem[C]. IUPAC Congress, 2001: 3-40.
(  0) 0) |
| [31] |
Kögel‐Knabner I, Guggenberger G, Kleber M, et al. Organo‐mineral associations in temperate soils: Integrating biology, mineralogy, and organic matter chemistry[J]. Journal of Plant Nutrition and Soil Science, 2008, 171(1): 61-82. DOI:10.1002/jpln.200700048
(  0) 0) |
| [32] |
Remusat L, Hatton P J, Nico P S, et al. NanoSIMS study of organic matter associated with soil aggregates: Advantages, limitations, and combination with STXM[J]. Environmental Science & Technology, 2012, 46(7): 3943-3949.
(  0) 0) |
| [33] |
Chun H C, Giménez D, Yoon S W. Morphology, lacunarity and entropy of intra-aggregate pores: Aggregate size and soil management effects[J]. Geoderma, 2008, 146(1/2): 83-93.
(  0) 0) |
| [34] |
Regelink I C, Stoof C R, Rousseva S, et al. Linkages between aggregate formation, porosity and soil chemical properties[J]. Geoderma, 2015, 247: 24-37.
(  0) 0) |
| [35] |
Zhou H, Peng X, Peth S, et al. Effects of vegetation restoration on soil aggregate microstructure quantified with synchrotron-based micro-computed tomography[J]. Soil and Tillage Research, 2012, 124: 17-23. DOI:10.1016/j.still.2012.04.006
(  0) 0) |
| [36] |
Garland G, Bünemann E K, Oberson A, et al. Phosphorus cycling within soil aggregate fractions of a highly weathered tropical soil: A conceptual model[J]. Soil Biology and Biochemistry, 2018, 116: 91-98. DOI:10.1016/j.soilbio.2017.10.007
(  0) 0) |
| [37] |
Oades J M, Waters A G. Aggregate hierarchy in soils[J]. Soil Research, 1991, 29(6): 815-828. DOI:10.1071/SR9910815
(  0) 0) |
| [38] |
Guggenberger G, Christensen B T, Zech W. Land‐use effects on the composition of organic matter in particle‐size separates of soil: I. Lignin and carbohydrate signature[J]. European Journal of Soil Science, 1994, 45(4): 449-458. DOI:10.1111/j.1365-2389.1994.tb00530.x
(  0) 0) |
| [39] |
Puget P, Angers D A, Chenu C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology and Biochemistry, 1998, 31(1): 55-63. DOI:10.1016/S0038-0717(98)00103-5
(  0) 0) |
| [40] |
Tisdall J M. Formation of soil aggregates and accumulation of soil organic matte// Robertson G P, Coleman D C, Sollins P, et al. Structure and organic matter storage in agricultural soils[M]. Boca Raton: CRC Press, 1996: 57-96.
(  0) 0) |
| [41] |
Buettner S W, Kramer M G, Chadwick O A, et al. Mobilization of colloidal carbon during iron reduction in basaltic soils[J]. Geoderma, 2014, 221: 139-145.
(  0) 0) |
| [42] |
Díaz-Zorita M, Perfect E, Grove J H. Disruptive methods for assessing soil structure[J]. Soil and Tillage Research, 2002, 64(1/2): 3-22.
(  0) 0) |
| [43] |
Elliott E T, Heil J W, Kelly E F, et al. Soil structural and other physical properties// Robertson G P, Coleman D C, Sollins P, et al. Standard soil methods for long-term ecological research[M]. New York: Oxford University Press, 1999: 74-85.
(  0) 0) |
| [44] |
Wei C F, Xie D T, Li B G. Progress in resaerch on soil organo-mineral complexes (In Chinese)[J]. Advance in Earth Sciences, 2003, 18(2): 221-227. DOI:10.3321/j.issn:1001-8166.2003.02.011 [魏朝富, 谢德体, 李保国. 土壤有机无机复合体的研究进展[J]. 地球科学进展, 2003, 18(2): 221-227.]
(  0) 0) |
| [45] |
Burke I C, Yonker C M, Parton W J, et al. Texture, climate, and cultivation effects on soil organic matter content in US grassland soils[J]. Soil Science Society of America Journal, 1989, 53(3): 800-805. DOI:10.2136/sssaj1989.03615995005300030029x
(  0) 0) |
| [46] |
Monreal C M, Schnitzer M, Schulten H R, et al. Soil organic structures in macro and microaggregates of a cultivated brown chernozem[J]. Soil Biology and Biochemistry, 1995, 27(6): 845-853. DOI:10.1016/0038-0717(94)00220-U
(  0) 0) |
| [47] |
Sposito G, Skipper N T, Sutton R, et al. Surface geochemistry of the clay minerals[J]. Proceedings of the National Academy of Sciences, 1999, 96(7): 3358-3364. DOI:10.1073/pnas.96.7.3358
(  0) 0) |
| [48] |
Laird D A, Martens D A, Kingery W L. Nature of clay‐humic complexes in an agricultural soil: I. Chemical, biochemical, and spectroscopic analyses[J]. Soil Science Society of America Journal, 2001, 65(5): 1413-1418. DOI:10.2136/sssaj2001.6551413x
(  0) 0) |
| [49] |
Saggar S, Parshotam A, Sparling G P, et al. 14C-labelled ryegrass turnover and residence times in soils varying in clay content and mineralogy[J]. Soil Biology and Biochemistry, 1996, 28(12): 1677-1686. DOI:10.1016/S0038-0717(96)00250-7
(  0) 0) |
| [50] |
Wattel-Koekkoek E J W, Van Genuchten P P L, Buurman P, et al. Amount and composition of clay-associated soil organic matter in a range of kaolinitic and smectitic soils[J]. Geoderma, 2001, 99(1/2): 27-49.
(  0) 0) |
| [51] |
Kaiser K, Guggenberger G. Mineral surfaces and soil organic matter[J]. European Journal of Soil Science, 2003, 54(2): 219-236. DOI:10.1046/j.1365-2389.2003.00544.x
(  0) 0) |
| [52] |
Six J, Paustian K, Elliott E T, et al. Soil structure and organic matter I. Distribution of aggregate‐size classes and aggregate‐associated carbon[J]. Soil Science Society of America Journal, 2000, 64(2): 681-689. DOI:10.2136/sssaj2000.642681x
(  0) 0) |
| [53] |
Brubaker S C, Holzhey C S, Brasher B R. Estimating the water‐dispersible clay content of soils[J]. Soil Science Society of America Journal, 1992, 56(4): 1226-1232. DOI:10.2136/sssaj1992.03615995005600040036x
(  0) 0) |
| [54] |
Stevenson F J. Geochemistry of soil humic substances . New York: John Wiley and Sons, 1985.
(  0) 0) |
| [55] |
Eusterhues K, Rumpel C, Kögel‐Knabner I. Organo‐mineral associations in sandy acid forest soils: Importance of specific surface area, iron oxides and micropores[J]. European Journal of Soil Science, 2005, 56(6): 753-763.
(  0) 0) |
| [56] |
Arias M, Barral M T, Díaz‐Fierros F. Effects of associations between humic acids and iron or aluminium on the flocculation and aggregation of kaolin and quartz[J]. European Journal of Soil Science, 1996, 47(3): 335-343. DOI:10.1111/j.1365-2389.1996.tb01407.x
(  0) 0) |
| [57] |
Barberis E, Marsan F A, Boero V, et al. Aggregation of soil particles by iron oxides in various size fractions of soil B horizons[J]. Journal of Soil Science, 1991, 42(4): 535-542. DOI:10.1111/j.1365-2389.1991.tb00100.x
(  0) 0) |
| [58] |
Liu Y L, Dong Y Q, Ge T D, et al. Impact of prolonged rice cultivation on coupling relationship among C, Fe, and Fe-reducing bacteria over a 1000-year paddy soil chronosequence[J]. Biology and Fertility of Soils, 2019, 55(6): 589-602. DOI:10.1007/s00374-019-01370-x
(  0) 0) |
| [59] |
Asano M, Wagai R. Evidence of aggregate hierarchy at micro-to submicron scales in an allophanic Andisol[J]. Geoderma, 2014, 216: 62-74. DOI:10.1016/j.geoderma.2013.10.005
(  0) 0) |
| [60] |
Chenu C, Plante A F. Clay‐sized organo‐mineral complexes in a cultivation chronosequence: Revisiting the concept of the 'primary organo‐mineral complex'[J]. European Journal of Soil Science, 2006, 57(4): 596-607. DOI:10.1111/j.1365-2389.2006.00834.x
(  0) 0) |
| [61] |
Weng L P, van Riemsdijk W H, Hiemstra T. Humic nanoparticles at the oxide− water interface: Interactions with phosphate ion adsorption[J]. Environmental Science & Technology, 2008, 42(23): 8747-8752.
(  0) 0) |
| [62] |
Kaiser M, Berhe A A, Sommer M, et al. Application of ultrasound to disperse soil aggregates of high mechanical stability[J]. Journal of Plant Nutrition and Soil Science, 2012, 175(4): 521-526. DOI:10.1002/jpln.201200077
(  0) 0) |
| [63] |
Rong H, Fang H, Zhang Z B, et al. Effects of aggregate size distribution on soil pore structure and soil organic carbon mineralization (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(2): 476-485. [荣慧, 房焕, 张中彬, 等. 团聚体大小分布对孔隙结构和土壤有机碳矿化的影响[J]. 土壤学报, 2022, 59(2): 476-485.]
(  0) 0) |
| [64] |
Segoli M, De Gryze S, Dou F, et al. AggModel: A soil organic matter model with measurable pools for use in incubation studies[J]. Ecological Modelling, 2013, 263: 1-9. DOI:10.1016/j.ecolmodel.2013.04.010
(  0) 0) |
| [65] |
Liu Y, Wang P, Crowley D, et al. Methanogenic abundance and changes in community structure along a rice soil chronosequence from east China[J]. European Journal of Soil Science, 2016, 67(4): 443-455. DOI:10.1111/ejss.12348
(  0) 0) |
| [66] |
Liu Y L, Dong Y Q, Wang P, et al. Distribution of methane production and methanogenic archaeal community structure across soil particle size fractions along a rice chronosequence[J]. Journal of Soil and Water Conservation, 2019, 74(3): 235-246. DOI:10.2489/jswc.74.3.235
(  0) 0) |
| [67] |
Wang Q K, Wang S L. Forming and stable mechanism of soil aggregate and influencing factors (In Chinese)[J]. Chinese Journal of Soil Science, 2005, 36(3): 415-421. DOI:10.3321/j.issn:0564-3945.2005.03.031 [王清奎, 汪思龙. 土壤团聚体形成与稳定机制及影响因素[J]. 土壤通报, 2005, 36(3): 415-421.]
(  0) 0) |
| [68] |
Liu Y, Ma M H, Wu S J, et al. Soil aggregates as affected by wetting-drying cycle: A review (In Chinese)[J]. Soils, 2018, 50(5): 853-865. DOI:10.13758/j.cnki.tr.2018.05.001 [刘艳, 马茂华, 吴胜军, 等. 干湿交替下土壤团聚体稳定性研究进展与展望[J]. 土壤, 2018, 50(5): 853-865.]
(  0) 0) |
| [69] |
Cambardella C A, Elliott E T. Carbon and nitrogen distribution in aggregates from cultivated and native grassland soils[J]. Soil Science Society of America Journal, 1993, 57(4): 1071-1076. DOI:10.2136/sssaj1993.03615995005700040032x
(  0) 0) |
| [70] |
Lehmann J, Kinyangi J, Solomon D. Organic matter stabilization in soil microaggregates: Implications from spatial heterogeneity of organic carbon contents and carbon forms[J]. Biogeochemistry, 2007, 85(1): 45-57. DOI:10.1007/s10533-007-9105-3
(  0) 0) |
| [71] |
Kleber M, Eusterhues K, Keiluweit M, et al. Mineral–organic associations: Formation, properties, and relevance in soil environments[J]. Advances in Agronomy, 2015, 130: 1-140.
(  0) 0) |
| [72] |
Totsche K U, Amelung W, Gerzabek M H, et al. Microaggregates in soils[J]. Journal of Plant Nutrition and Soil Science, 2018, 181(1): 104-136. DOI:10.1002/jpln.201600451
(  0) 0) |
| [73] |
Yu G H, Xiao J, Hu S J, et al. Mineral availability as a key regulator of soil carbon storage[J]. Environmental Science & Technology, 2017, 51(9): 4960-4969.
(  0) 0) |
| [74] |
Chu B J, Yu G H, Liu F F, et al. Characterization of mineral-organic complex in soil microaggregates with synchrotron radiation infrared micro-imaging method (In Chinese)[J]. Acta Pedologica Sinica, 2017, 54(6): 1451-1458. [褚冰杰, 余光辉, 刘飞飞, 等. 土壤微团聚体中矿物-有机复合体特征[J]. 土壤学报, 2017, 54(6): 1451-1458.]
(  0) 0) |
| [75] |
Kögel-Knabner I, Rumpel C. Advances in molecular approaches for understanding soil organic matter composition, origin, and turnover: a historical overview[J]. Advances in Agronomy, 2018, 149: 1-48.
(  0) 0) |
| [76] |
Huang P M, Wang M K, Chiu C Y. Soil mineral–organic matter–microbe interactions: Impacts on biogeochemical processes and biodiversity in soils[J]. Pedobiologia, 2005, 49(6): 609-635. DOI:10.1016/j.pedobi.2005.06.006
(  0) 0) |
| [77] |
Omoike A, Chorover J. Adsorption to goethite of extracellular polymeric substances from Bacillus subtilis[J]. Geochimica et Cosmochimica Acta, 2006, 70(4): 827-838. DOI:10.1016/j.gca.2005.10.012
(  0) 0) |
| [78] |
Kallenbach C M, Frey S D, Grandy A S. Direct evidence for microbial-derived soil organic matter formation and its ecophysiological controls[J]. Nature Communications, 2016, 7(1): 1-10.
(  0) 0) |
| [79] |
Mikutta R, Zang U, Chorover J, et al. Stabilization of extracellular polymeric substances (Bacillus subtilis) by adsorption to and coprecipitation with Al forms[J]. Geochimica et Cosmochimica Acta, 2011, 75(11): 3135-3154. DOI:10.1016/j.gca.2011.03.006
(  0) 0) |
| [80] |
Denef K, Six J. Clay mineralogy determines the importance of biological versus abiotic processes for macroaggregate formation and stabilization[J]. European Journal of Soil Science, 2005, 56(4): 469-479. DOI:10.1111/j.1365-2389.2004.00682.x
(  0) 0) |
| [81] |
Ye L P, Tan W F, Fang L C, et al. Research advances in spatial variability of soil aggregate by using geostatistics (In Chinese)[J]. Science of Soil and Water Conservation, 2019, 17(2): 146-153. [叶露萍, 谭文峰, 方临川, 等. 基于地统计学的土壤团聚体空间变异研究进展[J]. 中国水土保持科学, 2019, 17(2): 146-153.]
(  0) 0) |
| [82] |
Dou S, Li K, Guan S. A review on organic matter in soil aggregates (In Chinese)[J]. Acta Pedologica Sinica, 2011, 48(2): 412-418. [窦森, 李凯, 关松. 土壤团聚体中有机质研究进展[J]. 土壤学报, 2011, 48(2): 412-418.]
(  0) 0) |
| [83] |
Luo X H, Wang Z F, Lu C, et al. Effects of land use type on the content and stability of organic carbon in soil aggregates (In Chinese)[J]. Environmental Science, 2019, 40(8): 3816-3824. DOI:10.13227/j.hjkx.201812140 [罗晓虹, 王子芳, 陆畅, 等. 土地利用方式对土壤团聚体稳定性和有机碳含量的影响[J]. 环境科学, 2019, 40(8): 3816-3824.]
(  0) 0) |
| [84] |
Liu Y L, Ge T D, van Groenigen K J, et al. Rice paddy soils are a quantitatively important carbon store according to a global synthesis[J]. Communications Earth & Environment, 2021, 2(1): 1-9.
(  0) 0) |
| [85] |
Liu Y L, Ge T D, Zhu Z, et al. Carbon input and allocation by rice into paddy soils: A review[J]. Soil Biology and Biochemistry, 2019, 133: 97-107. DOI:10.1016/j.soilbio.2019.02.019
(  0) 0) |
| [86] |
Liu Y L, Wang P, Pan G X, et al. Functional and structural responses of bacterial and fungal communities from paddy fields following long-term rice cultivation[J]. Journal of Soils and Sediments, 2016, 16(5): 1460-1471. DOI:10.1007/s11368-015-1343-8
(  0) 0) |
| [87] |
Nguetnkam J P, Dultz S. Soil degradation in Central North Cameroon: Water-dispersible clay in relation to surface charge in Oxisol A and B horizons[J]. Soil and Tillage Research, 2011, 113(1): 38-47. DOI:10.1016/j.still.2011.01.006
(  0) 0) |
| [88] |
Kosmulski M. pH-dependent surface charging and points of zero charge: Ⅲ. Update[J]. Journal of Colloid and Interface Science, 2006, 298(2): 730-741. DOI:10.1016/j.jcis.2006.01.003
(  0) 0) |
| [89] |
Al-Kaisi M M, Douelle A, Kwaw-Mensah D. Soil microaggregate and macroaggregate decay over time and soil carbon change as influenced by different tillage systems[J]. Journal of Soil and Water Conservation, 2014, 69(6): 574-580. DOI:10.2489/jswc.69.6.574
(  0) 0) |
| [90] |
Weng L P, Vega F A, van Riemsdijk W H. Competitive and synergistic effects in pH dependent phosphate adsorption in soils: LCD modeling[J]. Environmental Science & Technology, 2011, 45(19): 8420-8428.
(  0) 0) |
| [91] |
Duiker S W, Rhoton F E, Torrent J, et al. Iron (hydr) oxide crystallinity effects on soil aggregation[J]. 2003, 67: 606-611.
(  0) 0) |
| [92] |
Lovley D R, Fraga J L, Blunt‐Harris E L, et al. Humic substances as a mediator for microbially catalyzed metal reduction[J]. Acta Hydrochimica et Hydrobiologica, 1998, 26(3): 152-157.
(  0) 0) |
| [93] |
Fritzsche A, Pagels B, Totsche K U. The composition of mobile matter in a floodplain topsoil: A comparative study with soil columns and field lysimeters[J]. Journal of Plant Nutrition and Soil Science, 2016, 179(1): 18-28.
(  0) 0) |
| [94] |
Keil R G, Montluçon D B, Prahl F G, et al. Sorptive preservation of labile organic matter in marine sediments[J]. Nature, 1994, 370(6490): 549-552.
(  0) 0) |
| [95] |
De-Campos A B, Mamedov A I, Huang C. Short‐term reducing conditions decrease soil aggregation[J]. Soil Science Society of America Journal, 2009, 73(2): 550-559.
(  0) 0) |
| [96] |
Dharmasri L C, Hudnall W H, Ferrell Jr R E. Pyrite formation in Louisiana coastal marshes: scanning electron microscopy and X-ray diffraction evidence[J]. Soil Science, 2004, 169(9): 624-631.
(  0) 0) |
| [97] |
Leeder M R. Sedimentology: Process and product . London: Springer Science & Business Media, 2012.
(  0) 0) |
| [98] |
Li F L, Guo H M, Zhou X, Q, et al. Impact of natural organic matter on arsenic removal by modified granular natural siderite: Evidence of ternary complex formation by HPSEC-UV-ICP-MS[J]. Chemosphere, 2017, 168: 777-785.
(  0) 0) |
| [99] |
Togami K, Miura K, Ito K, et al. Elemental affinity for siderite found in a Japanese paddy subsoil[J]. Soil Science and Plant Nutrition, 2017, 63(2): 101-109.
(  0) 0) |
| [100] |
Lim D I, Jung H S, Yang S Y, et al. Sequential growth of early diagenetic freshwater siderites in the Holocene coastal deposits, Korea[J]. Sedimentary Geology, 2004, 169(1/2): 107-120.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


