土壤呼吸是陆地生态系统碳循环重要环节,对调控全球碳平衡具有重要的影响[1]。全球尺度上,每年以土壤呼吸形式释放到大气中的CO2约91 Pg(以C计)[1],占大气中CO2年总释放量的20%~40%[2-3],因此其微小变化将显著地改变全球碳平衡,进而影响全球碳循环和气候变化进程[1]。土壤呼吸主要包括根以及相关根际呼吸活动产生的自养呼吸(RA)和微生物分解土壤有机碳(SOC)产生的异养呼吸(RH)。其中,异养呼吸约占土壤总呼吸的10.3%~94%,是影响土壤有机碳积累的关键因素[2-4]。异养呼吸受土壤有机碳本身的性质和多种环境因子的调控,由于土壤有机碳和环境的高度复杂性和异质性,目前对不同生态系统间土壤异养呼吸变异性的认知仍存在局限性[4],一些关键的过程和机制有待进一步探究。因此,理解不同生态系统中异养呼吸动态特征及其调控因素和作用机制,对于进行全球碳素平衡预算和全球气候变化的潜在效果预估具有十分重要的意义[2-5]。
由于气候和人为活动的影响,我国亚热带红壤区成为了南方典型水土流失区之一[6],高强度水土流失不仅导致该区域土壤有机质大量损耗以及生态系统严重退化,而且进一步加剧了生态治理的难度。过去40年来,该区开展了大量的生态恢复和水土流失治理工作。马尾松(Pinus massoniana)作为我国南方水土流失区主要的先锋树种,在红壤侵蚀区水土流失治理、生态环境改善、增加森林碳汇等方面发挥了至关重要的作用。研究发现,马尾松林恢复短期内有效增加了红壤侵蚀区土壤碳吸存量[6-7],但随着植被恢复进程,碳吸存效率显著降低[6],导致土壤有机质难以积累进而限制土壤养分和林分生产力的提升。土壤异养呼吸作为土壤有机质消耗的主要途径[4],也是制约植被恢复过程中有机质积累的重要环节。相关研究表明,森林生态系统恢复引起植物群落组成、凋落物数量与质量以及土壤养分和土壤微生物群落结构的改变对异养呼吸影响深刻[3-4],并在很大程度上决定森林恢复过程中土壤呼吸的强度以及对未来气候条件变化的响应[8-9]。然而由于区域环境和林分结构的差异[9],目前对退化森林恢复过程中土壤异养呼吸的动态变化未形成统一认知,尤其是对水土流失区马尾松林恢复过程中土壤异养呼吸的变化过程尚缺乏深入了解。鉴于此,本研究以南方典型红壤侵蚀区长汀县河田镇为研究区,以不同恢复年限(Y0、Y14、Y31)马尾松林构成植被恢复序列,观测不同恢复年限马尾松林土壤呼吸及其组分,分析异养呼吸组分在恢复过程中的变化趋势,揭示不同恢复年限土壤碳损失特征,对深入理解退化森林土壤碳循环以及提升退化马尾松林土壤有机质含量具有重要意义。
1 材料与方法 1.1 研究区概况研究区位于福建省长汀县河田镇(25°33′ N,116°18′ E)。该地区平均海拔约400 m,属于典型的中亚热带湿润季风气候,年平均气温18.3℃,年平均降水量为1 700 mm,年平均蒸发量为1 403 mm。年均日照时数1 925 h,无霜期年均260 d,10℃以上的积温4 375℃。区域地带性土壤主要为中粗粒花岗岩发育的红壤,其自身抗蚀抗冲性较弱,加之其他自然因素以及人为因素干扰,造成该区域严重的水土流失现象。该地区地带性植被为中亚热带常绿阔叶林,但由于人类活动以及长期水土流失,常绿阔叶林基本消失,现有植被主要以马尾松次生林和人工林为主,林分结构单一。
1.2 研究方法利用时空代换法,于河田镇选取母岩为花岗岩以及治理前本底条件相似的三个不同恢复年限马尾松林地组成植被恢复序列,分别是:未治理地(Y0,作为恢复前对照)、恢复14 a马尾松林(Y14)、恢复31 a马尾松林(Y31),植被恢复前土壤概况基本相似,均为土壤A层侵蚀殆尽,B层出露。其中,Y0位于来油坑区域,坡度19°,为土壤强度侵蚀科研保留区,立地条件极差,主要植被为稀疏马尾松林,植株密度约为每公顷1 533株;Y14位于石壁下区域,坡度8°,自2002年开始采用穴状征地,通过在坡面马尾松之间挖穴,结合类芦(Neyraudia reynaudiana)以及雀稗(Paspalum thunbergii)种植进行植被恢复,治理后任其自然生长,马尾松密度为每公顷2 933株;Y31位于水东坊区域,坡度11°,从1984年开始采用水平撩壕整地,种植黑荆(Acacia mearnsii),之后通过封禁管理以减少人为干扰和破坏,使其自然恢复,马尾松密度为每公顷1 867株。在每个恢复年限马尾松林分别建3个20 m×20 m的标准样方进行植被和土壤调查。具体情况见表 1。
|
|
表 1 试验样地概况 Table 1 General information of the experimental sites |
于2015年4月,在每个恢复年限林分内的每个标准样方内随机布设3组用于测定土壤总呼吸和异养呼吸的硬聚氯乙烯管(PVC)环并对土壤呼吸进行监测,其中异养呼吸小区布设在3个测定总呼吸圈附近,另选取1 m×1 m的小区,采取壕沟法,垂直下挖0.6~0.8 m,利用孔径不超过0.149 mm的尼龙网包围阻断根系进入小区,在隔离小区内插入3个土壤呼吸圈以用于异养呼吸测定,并定期对小区内植被进行清理。
壕沟处理一年后,于2016年5月至2017年4月,每个月中旬选择晴天的9:00~12:00采用LI-8100开路式土壤碳通量测量系统(LI8100-COR,Nebraska,美国)测定各处理的土壤呼吸,每个测定点测定时间2 min,其中,土壤呼吸为对照小区内土壤呼吸监测值,异养呼吸为隔离小区内土壤呼吸监测值,自养呼吸则计算土壤呼吸与异养呼吸的差值获得;采用时域反射仪(TDR,Model TDR 300,Specturm Company,Aurora,美国)观测土壤体积含水量,长杆电子温度探针(SK-250WP,Sato Keir-Yoki,Kanda,日本)测定附近5 cm土壤温度,每个土壤呼吸测定点周围测量3次,取平均值。
在每个试验样地,随机布设5个80 cm×80 cm凋落物框,期间每个月一次定期收集凋落物,并进行分类烘干,根据各器官的含水量计算每个月凋落物量;利用内径5 cm土钻在每个样地随机取6钻,放水中浸泡1 h,清洗干净,并挑出大于2 mm细根,于65℃下烘干并称其干物质量,本研究所采用的数据为10 cm土壤深度细根量。同时,利用2.5 cm土钻按照“S”型随机取土,混合均匀放入保温箱带回实验室,去除砾石、细根以及枯枝落叶等,取其中部分风干以测定土壤碳、氮,而另一部分用超低温冰箱保存,用于土壤微生物丰度测定。采用碳氮元素分析仪(Elementar Vario MAX,德国)对土壤总有机碳和全氮含量进行测定。表层土壤基本理化性质见表 1。
土壤高通量测序样品先利用E.Z.N.A.®soil试剂盒(Omega Bio-tek,Norcross,GA,美国)对土壤总DNA进行提取。提取后DNA利用NanoDrop 2000进行浓度和纯度检测,利用1%琼脂糖凝胶电泳在电压5 V·cm–1,电泳时间为20 min检测DNA提取质量。经过纯化检测后达到测定标准的样品送至上海美吉生物医药科技有限公司采用Illumina Miseq测序平台进行高通量测序。
1.3 数据分析土壤呼吸年通量通过月通量累加法计算,见式(1);土壤呼吸与温度以及土壤呼吸与水分含量的关系分别采用指数模型(式(2))、线性模型(式(3))进行拟合;Q10计算沿用Fang和Moncrieff[10]计算法,见式(4);异养呼吸比例计算公式见式(5);为了进一步量化单位SOC储量下土壤异养呼吸强度,利用SOC标准化的异养呼吸通量(RH)计算公式进行计算,见式(6)。
| $ R=\sum \mathrm{ae}^{b T} \times 3600 \times 24 \times(12 / 100000) $ | (1) |
| $ R_{\mathrm{S}}=\mathrm{ae}^{\mathrm{b} T} $ | (2) |
| $ \begin{gathered} R_{\mathrm{S}}=\mathrm{a} W+\mathrm{b} \end{gathered} $ | (3) |
式中,R为土壤呼吸年通量,g·m–2·a–1;RS为土壤呼吸速率,μmol·m–2·s–1;T为5 cm土壤温度,℃;W为土壤水分含量,%;a、b为待定系数。
| $\begin{gathered} Q_{10}=e^{10 \mathrm{~b}} \end{gathered} $ | (4) |
| $ H_{\mathrm{c}}=R_{\mathrm{H}} / R \times 100 \%$ | (5) |
式中,Q10为土壤呼吸温度敏感性;Hc为异养年通量占土壤总呼吸年通量比例,%;RH为异养呼吸通量,g·m–2·a–1。
| $ R_{\mathrm{H}} / \mathrm{SOC}=R_{\mathrm{H}} / \mathrm{SOCP}(\mathrm{C}) $ | (6) |
式中,RH /SOC为SOC标准化的RH,g·m–2;SOCP(C)为0~10 cm土壤中的碳储量,g·m–2。
本文中所有数据均利用Excel 2019初步处理。数据统计分析采用SPSS 25.0软件进行,运用单因素方差分析比较不同恢复时期土壤理化性质、细根生物量、土壤呼吸通量、温度敏感性以及土壤呼吸速率的差异。运用皮尔森(Pearson)相关系数评价数据之间的相关性,显著性水平设定为P=0.05。相关图表均用Origin 26.0完成。图表中的数据均为平均值±标准误。
利用Amos 24建立结构方程模型(SEM)分析凋落物、土壤温度、土壤养分以及土壤微生物与异养呼吸之间的相互关系,分析马尾松林恢复过程中影响异养呼吸的主要因子,比较各因子的相对贡献。
2 结果 2.1 不同恢复时期土壤温度和水分含量的变化不同恢复时期土壤温度和水分含量季节变化模式一致,最高土壤温度出现在7、8月份,而最低温度出现在1月份(图 1)。土壤含水量在5月出现峰值,在2月份最低(图 1)。方差分析表明,植被恢复对隔离小区和对照小区内温度和水分无显著影响(P > 0.05),且对照小区和隔离小区间土壤温度、水分含量无显著差异(P > 0.05)。
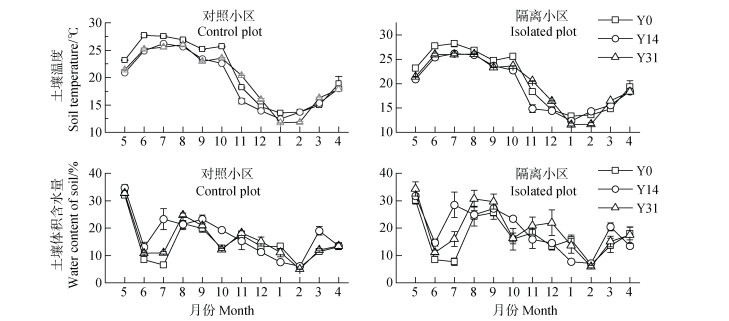
|
注:图中误差线为标准误。下同。 Note: Error bars in the figure indicate standard error. The same below. 图 1 不同恢复年限土壤温度和土壤体积含水量月动态 Fig. 1 Monthly dynamics of soil temperature and soil moisture content in different restoration years |
不同恢复时期马尾松林凋落物量差异显著(图 2)。相比Y0,Y14和Y31林地内马尾松凋落物量分别显著增加3.34倍、4.89倍(P < 0.05)。然而根系生物量以及芒萁凋落物量仅表现为Y14和Y31显著高于Y0,而Y14和Y31之间根系生物量和芒萁凋落物量无显著差异(P>0.05)。
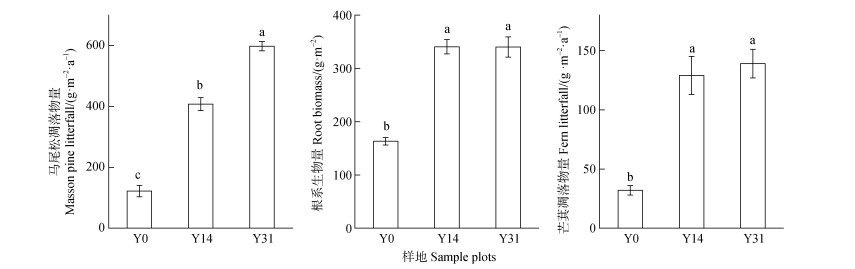
|
注:不同小写字母表示不同恢复年限的差异显著(P < 0.05)。 Note: Different lowercase letters indicate significant differences in different restoration years(P < 0.05). 图 2 不同恢复年限马尾松凋落物量、根系生物量以及芒萁凋落物量比较 Fig. 2 Comparison of Masson pine litterfall, root biomass and fern litterfall in different restoration years |
不同恢复时期土壤呼吸及其组分差异显著(图 3)。相比于Y0,Y14和Y31马尾松林土壤呼吸、异养呼吸以及自养呼吸速率均显著提升(P < 0.05),但Y14和Y31之间自养呼吸速率并无显著差异(P > 0.05)。此外,植被恢复后土壤呼吸和异养呼吸表现出明显的季节变化(P < 0.05)(图 3),其变化规律与土壤温度的变化(图 1)基本一致。
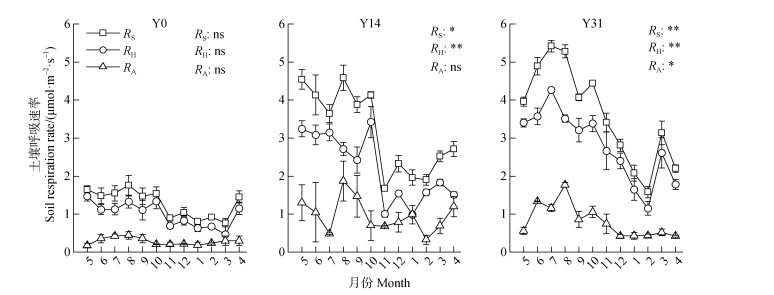
|
注:RS表示土壤呼吸速率,RH表示异养呼吸速率,RA表示自养呼吸速率。*、**表示不同季节间土壤呼吸速率存在显著差异(P < 0.05,P < 0.01),ns表示不存在显著差异。 Note: RS represents soil respiration rate, RH represents heterotrophic respiration rate and RA represents autotrophic respiration rate. * and * indicate that there is significant difference in soil respiration rate between different seasons(P < 0.05, P < 0.01), while ns indicates that there is no significant difference. 图 3 不同恢复年限土壤呼吸月动态 Fig. 3 Monthly dynamics of soil respiration in different restoration years |
由表 2可知,与Y0相比,Y14、Y31土壤呼吸、异养呼吸年通量均显著增加(P < 0.05),但除异养呼吸年通量外,Y14、Y31处理的土壤呼吸年通量和自养呼吸年通量均无显著差异(P > 0.05)。同时,方差分析结果表明,异养呼吸、自养呼吸比例在植被恢复过程中并无明显的差异(P > 0.05),但在不同时期异养呼吸比例均远高于自养呼吸(表 2)。
|
|
表 2 土壤呼吸年通量及各组分所占比例 Table 2 Annual soil CO2 efflux and pro-portion of different components to soil respiration |
植被恢复对微生物OTU丰度及其群落结构具有显著影响(图 4)。Y31细菌OTU丰度较Y0、Y14显著增加(P < 0.05),而Y14与Y0之间细菌OTU丰度并无显著差异,且随植被恢复土壤细菌优势种门分类水平发生显著变化,Y0中细菌群落优势种主要以变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)为主,而植被恢复后变形菌门(Proteobacteria)、绿弯菌门(Chloroflex)占比相对下降,而酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)含量相对增加,其他细菌的丰度变化则不明显。同时,真菌OTU丰度随植被恢复显著增加(P < 0.05),但在门分类水平上土壤真菌优势种在植被恢复前后无显著变化,主要以子囊菌门(Ascomycota)、担子菌门(Basidiomycota)为主,在植被恢复前后子囊菌门(Ascomycota)均占据绝对优势种地位。
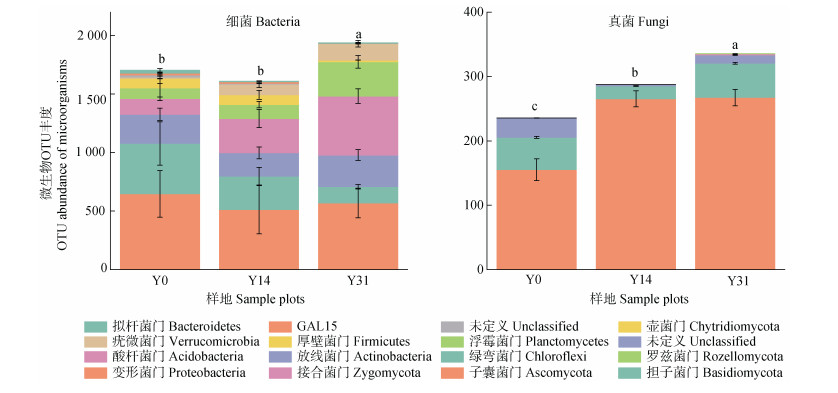
|
图 4 不同恢复年限土壤门分类水平细菌、真菌优势种操作分类单元(OTUs)丰度 Fig. 4 Histogram of operational taxonomic units(OTUs)abundance of dominant species of bacteria and fungi in different soil phyla classification levels in different restoration years |
季节尺度上,不同恢复时期异养呼吸与土壤温度呈极显著的相关关系(图 5),而与土壤含水量仅在部分时期呈显著相关性(P < 0.05)。植被恢复后土壤温度对异养呼吸的季节变化解释效果显著优于植被恢复前。方差分析显示,植被恢复显著增加异养呼吸Q10,而Y14(1.93)、Y14(1.82)之间无显著差异(P > 0.05)。
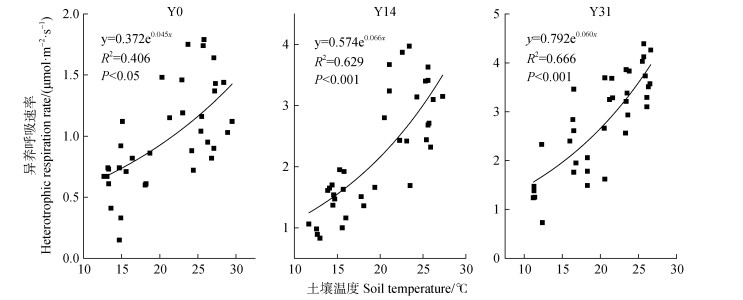
|
图 5 不同恢复年限5 cm深度土壤温度与土壤呼吸的关系 Fig. 5 Relationships between soil temperature at the 5 cm soil depth and soil respiration rate in different restoration years |
结构方程分析结果(图 6)表明,该模型解释了植被恢复过程中异养呼吸通量变化的96.8%。植被恢复过程中土壤有机碳含量、细菌OTU丰度、真菌OTU丰度以及土壤温度是驱动异养呼吸变化的主要因子,其中,土壤有机碳含量、细菌OTU丰度、真菌OTU丰度对土壤异养呼吸具有直接的正面影响,并且土壤有机碳含量对异养呼吸作用最强,真菌OTU丰度与细菌OTU丰度次之,植被恢复过程中土壤温度的变化对异养呼吸产生直接的负影响,而植被恢复过程中凋落物输入的变化通过作用于土壤有机碳含量以及土壤温度、土壤细菌OTU丰度和真菌OTU丰度对异养呼吸产生间接影响.
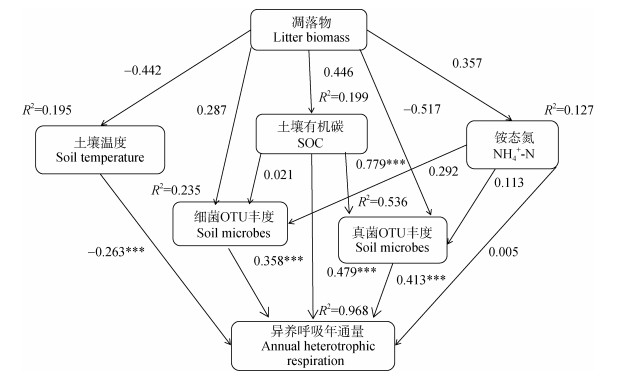
|
注:环境因子与异养呼吸相关性(R2=10.94,P=0.141,RMSEA = 0.00),其中,实线表示正效应,虚线表示负效应,箭头粗细表示影响强弱;箭头旁指数为权重系数;R2表示解释变量大小;RMSEA近似误差均方根;*,P < 0.05;**,P < 0.01;***,P < 0.001。 Note: Correlation between environmental factors and heterotrophic respiration (R2=7.544, P=0.479, RMSEA = 0.00), Continuous or dashed line indicates positive or negative relationships, respectively. The width of the arrow indicates the strength of the effect. The digits besides the arrow are weight coefficients; R2 stands for the size of the variable and RMSEA for root mean square error of approximation; *, P < 0.05;**, P < 0.01;***, P < 0.001. 图 6 结构方程模型模拟各因子对异养呼吸的影响 Fig. 6 Structural equation modeling simulates the effect of each factor on heterotrophic respiration |
本研究中红壤侵蚀区马尾松林恢复不仅增加了土壤有机碳含量,也显著增加了异养呼吸碳排放(图 3)。其中,Y0异养呼吸年通量仅为383.0 g·m–2·a–1,远低于同纬度其他森林类型,而Y14和Y31异养呼吸年通量分别达到849.8和1078.5 g m–2·a–1,高于同纬度已报道的大多数森林类型[11-16]。与此同时,研究发现红壤侵蚀区马尾松林的异养呼吸比例(表 2)远高于全球森林生态系统RH/RS平均值(48%)以及中国陆地生态系统平均值(65%)[17-18]和同纬度亚热带森林(表 3)。尽管本研究区土壤有机质含量较
|
|
表 3 亚热带季风气候区不同植被类型异养呼吸及其相对贡献的比较 Table 3 Comparison of heterotrophic respiration and its relative contribution among different vegetation types in subtropical monsoon climate region |
其他地区低,但通过计算RH/SOCP发现),红壤侵蚀区单位质量土壤有机质能够产生更强烈的异养呼吸,这表明红壤侵蚀区土壤有机质更易被分解消耗,从而导致强烈的异养呼吸碳排放,削弱了植被恢复过程中土壤有机质的积累效率,但在其他研究中异养呼吸比例通常伴随着植被恢复过程中土壤有机质质量提升趋于稳定或相对下降[5]。进一步研究发现,侵蚀退化地异养呼吸温度敏感性植被恢复后由1.58(Y0)显著增加至1.93(Y14)和1.82(Y31)。而根据传统“碳质量-温度”假说,由于低质量底物的分解需要更高的活化能,其对于温度提升更为敏感,因而表现出更高的温度敏感性[19],因此,随着植被恢复土壤有机质质量提升,土壤呼吸温度敏感性一般呈现下降趋势[20],这已经在前期土壤呼吸研究以及亚热带相关研究[21]中被证实,而本研究中侵蚀退化地异养呼吸敏感性在植被恢复后显著增加,说明植被恢复后异养呼吸过程对温度的变化更为敏感。
3.2 红壤侵蚀区马尾松植被恢复过程中异养呼吸影响因素一般认为,植被恢复过程中异养呼吸的变化主要取决于植物所介导的凋落物和根系碳输入以及土壤微环境变化、土壤基质供应等[4-5,11],而近来相关研究[4,22]发现,土壤微生物、土壤有机质稳定性以及可用性等潜在因素在控制异养呼吸过程中发挥着同等重要的作用。本研究中,环境因子对植被恢复过程中异养呼吸变化的解释达到96.8%,其中土壤有机质对异养呼吸的影响最强,微生物次之(图 6)。土壤有机质是异养呼吸产生的物质基础[9],植被恢复后植被生产力的提高促进了凋落物养分归还,增加了土壤有机质的积累,缓解了微生物碳限制,刺激微生物生长和活性的增加,从而促进土壤微生物对有机质的同化[23],因此土壤有机质通常与异养呼吸表现出显著相关性[4]。然而对比同纬度其他地区,本研究中红壤侵蚀区马尾松林有机碳含量低却表现出更强烈的异养呼吸,这与传统研究[8,11]不符。最新的一项研究[4]指出土壤有机质数量对异养呼吸的主导作用仅发生在局部尺度上,而区域以及全球尺度上异养呼吸强度主要由土壤有机质质量以及可用性主导[4]。因此,土壤碳含量低并不一定表示异养呼吸低,土壤碳含量、质量、可利用性和周转的相互作用最终决定了异养呼吸的时空格局。相比于稳定性有机质,由于缺乏有效的物理和化学保护,不稳定性碳源具有更高的生物有效性[24],是异养呼吸的主要来源。前期研究发现红壤侵蚀区有机碳的积累主要以非保护性有机碳为主[25]。其中,活性碳库的积累在植被恢复前期显著快于缓效性碳库,并且在植被恢复30年后仍保持较高的比例,这意味着该区域土壤有机碳稳定性差、活性高更易被微生物利用[22,24]。而培养实验也证明,侵蚀红壤有机碳易被分解,矿化潜力较高[26]。此外,不同地区恢复措施的差异对于土壤结构的影响也是造成有机碳稳定性变化的重要因素[15],因此,虽然红壤侵蚀区有机质含量低,但是由于稳定性差导致该区域异养呼吸显著高于其他地区。
土壤微生物对碳和养分需求导致的有机质降解和碳释放过程是异养呼吸产生的主要原因[27],而这一过程通常受到土壤细菌和真菌群落丰度及其组成的调控[28],不同细菌和真菌碳利用效率的差异以及对基质的偏好最终决定土壤有机碳的分解策略。前期研究表明,侵蚀红壤区植被恢复显著增加微生物磷脂脂肪酸含量并降低真菌细菌比(F/B)值[23],说明马尾松林恢复刺激了微生物的生长并且增加了细菌相对丰度。就微生物群落结构而言,由于细菌更低的碳利用效率和更高的养分需求,当微生物群以细菌为主时将产生更强烈的异养呼吸[7]。本研究利用高通量测序进一步研究发现(图 4),红壤侵蚀区植被恢复过程中细菌、真菌OTU丰度持续增加,但细菌群落丰富度变化较真菌群落更为显著,主要表现为富营养菌群—变形菌门(Proteobacteria)丰度相对下降但仍占据主导地位,而寡营养菌群—酸杆菌门(Proteobacteria)丰度相对增加。其中,变形菌作为富营养细菌,被认为是土壤中易分解有机质消耗的主要细菌类群[29],而植被恢复过程中变形菌均保持较高的占比,这意味着变形菌较高的养分需求导致土壤中活性碳源的大量消耗[29],抑制了活性碳源在土壤中的长期固存以及向稳定性碳源的转变。此外,作为一种寡营养型细菌,酸杆菌分泌β-葡萄糖苷酶和木聚糖酶对于分解植物残渣起着重要作用[29],因而酸杆菌门丰度持续增加会加剧细菌对土壤惰性碳源的分解,并且进一步研究发现在碳质量较高的背景下,由于富营养型细菌和寡营养细菌类型对不同碳源利用偏好导致的生态位分化将促使土壤活性碳库和惰性碳库的矿化[30],而这可能进一步加剧恢复过程中细菌对有机质消耗。与细菌相比,真菌对惰性碳化合物具有更高的分解速率[30,31]。其中,子囊菌作为典型的腐生菌在分解角质素和木质素等许多较难降解的有机物质中扮演重要角色[30],担子菌门主要与植物形成共生关系并能产生大量的降解酶[32],提高对有机质的降解速率。因而,植被恢复过程中子囊菌门(Ascomycota)、担子菌门(Basidiomycota)丰度的持续增加(图 4),意味着土壤顽固性有机质的分解以及凋落物中纤维素、木质素的水解,进而限制土壤中惰性碳库的积累[30-31],从而减少了有机质的累积量。
土壤温度控制并调节了决定碳循环的一系列生物地球化学过程[3-4]。本研究中,季节上土壤温度与异养呼吸呈显著正相关这与已有研究结果[12-16]保持一致,但植被恢复过程中土壤温度与异养呼吸变化呈显著负相关(图 6),说明土壤温度对异养呼吸的影响存在尺度依赖,其原因可能是未治理地极端高温导致微生物酶失活,养分限制更是制约了异养呼吸的温度响应,而植被恢复后凋落物覆盖降低地表温度并促进土壤养分的积累[7,21],导致植被恢复后土壤温度与呼吸的负相关。此外,红壤区马尾松林异养呼吸强烈也可能与该区域的氮元素限制有关[7]。虽然马尾松林恢复有效地提高土壤氮元素水平(表 1),但单一林分限制了有机质积累和微生物的生长,导致氮矿化水平难以提升[33]以及土壤氮限制难以缓解[7],并且菌根真菌与腐生菌之间的养分竞争会进一步加剧微生物氮限制[34],而氮限制状况下,微生物通常会利用不稳定的碳源,分解顽固性有机质获取氮来满足自身的生长需求[35],导致更强烈的异养呼吸过程。
3.3 红壤侵蚀区马尾松植被恢复过程中异养呼吸温度敏感性影响因素Q10是反映土壤呼吸强度的重要指标,植被恢复过程中土壤呼吸温度敏感性变化与有机质质量变化密切相关[4,18,36]。通常认为土壤呼吸温度敏感性随有机质质量提升而降低[19],而本研究中异养呼吸敏感性与有机质质量呈相反趋势,Tang等[3]也发现增温过程中活性与稳定有机质组分温度敏感性的响应一致。事实上,土壤碳的分解是能量以及其他养分元素循环的耦合过程[36],并且该过程与微生物群落变化导致其代谢活性和碳利用效率的差异有关[37]。相关研究发现,由于南北方森林土壤氮限制状况差异导致微生物碳源利用的不同,北方森林中有机质分解过程相比于南方森林表现出更低的温度敏感性[36]。而马尾松林中氮限制,刺激微生物“氮挖掘效应”促进了顽固性碳源的分解[36],导致植被恢复后异养呼吸过程表现出更高的温度敏感性。此外,未治理地异养呼吸敏感性低可能与底物限制有关[7,33],由于土壤侵蚀过程中富含有机碳的材料优先侵蚀,导致侵蚀土壤有机质含量低,而水稳性团聚体的破坏以及未治理地中极端高温更进一步加快土壤有机质的消耗[24-25],并且微生物“热适应”也可能降低异养呼吸的温度敏感性[26];而植被恢复后底物供应的增加以及微生物丰度的增加[8],尤其是细菌相对丰度的增加[23],提高了异养呼吸对温度季节性变化的敏感性[38],这种土壤微生物群落的适应能力与土壤有机质的质量和呼吸底物有效性无关[38]。此外,由于马尾松林恢复过程中有机质稳定性难以提升[25],进一步增加了微生物对底物的利用强度,进而导致温度升高后微生物代谢速率提升,因而马尾松林恢复过程中异养呼吸的温度敏感性显著增加。
4 结论红壤侵蚀区马尾林恢复显著增加了土壤异养呼吸碳排放和异养呼吸的季节变化,并且异养呼吸作为红壤侵蚀区土壤呼吸的主体在植被恢复过程中均维持较大比例;季节上,异养呼吸与土壤温度呈显著正相关,而恢复过程中异养呼吸与土壤温度呈显著负相关,且植被恢复后异养呼吸温度敏感性显著增加;植被恢复过程中SOC、土壤温度以及土壤微生物是影响植被恢复过程中异养呼吸变化的主要驱动因子,而缺乏有效的物理化学保护、氮限制是导致红壤侵蚀区异养呼吸强烈的另一重要因素。因此,较高的土壤呼吸碳排放速率严重制约了该区域土壤有机质的积累以及林分生产力的提升,直接影响了红壤侵蚀区马尾松林的可持续发展。
| [1] |
Hashimoto S. A new estimation of global soil greenhouse gas fluxes using a simple data-oriented model[J]. PLoS One, 2012, 7(8): e41962. DOI:10.1371/journal.pone.0041962
(  0) 0) |
| [2] |
Bond-Lamberty B, Bailey V L, Chen M, et al. Globally rising soil heterotrophic respiration over recent decades[J]. Nature, 2018, 560(7716): 80-83. DOI:10.1038/s41586-018-0358-x
(  0) 0) |
| [3] |
Tang J, Cheng H, Fang C. The temperature sensitivity of soil organic carbon decomposition is not related to labile and recalcitrant carbon[J]. PLoS One, 2017, 12(11): e0186675. DOI:10.1371/journal.pone.0186675
(  0) 0) |
| [4] |
Tang X L, Du J, Shi Y H, et al. Global patterns of soil heterotrophic respiration - A meta-analysis of available dataset[J]. Catena, 2020, 191: 104574. DOI:10.1016/j.catena.2020.104574
(  0) 0) |
| [5] |
Zheng H, Ouyang Z Y, Wang X K, et al. Effects of forest restoration types on soil quality in red soil eroded region, Southern China (In Chinese)[J]. Acta Ecologica Sinica, 2004, 24(9): 1994-2002. [郑华, 欧阳志云, 王效科, 等. 不同森林恢复类型对南方红壤侵蚀区土壤质量的影响[J]. 生态学报, 2004, 24(9): 1994-2002.]
(  0) 0) |
| [6] |
He S J, Xie J S, Zeng H D, et al. Dynamic of soil organic carbon pool after restoration of Pinus massoniana in eroded red soil area (In Chinese)[J]. Acta Ecologica Sinica, 2013, 33(10): 2964-2973. [何圣嘉, 谢锦升, 曾宏达, 等. 红壤侵蚀地马尾松林恢复后土壤有机碳库动态[J]. 生态学报, 2013, 33(10): 2964-2973.]
(  0) 0) |
| [7] |
Zhang Q F, Chen N S, Chen T, et al. Ecological stoichiometry characteristics of eroded red soil in different restoration years (In Chinese)[J]. Science of Soil and Water Conservation, 2016, 14(2): 59-66. [张秋芳, 陈奶寿, 陈坦, 等. 不同恢复年限侵蚀红壤生态化学计量特征[J]. 中国水土保持科学, 2016, 14(2): 59-66.]
(  0) 0) |
| [8] |
Xu M, Shang H. Contribution of soil respiration to the global carbon equation[J]. Journal of Plant Physiology, 2016, 203: 16-28. DOI:10.1016/j.jplph.2016.08.007
(  0) 0) |
| [9] |
Kukumägi M, Ostonen I, Uri V, et al. Variation of soil respiration and its components in hemiboreal Norway spruce stands of different ages[J]. Plant and Soil, 2017, 414(1): 265-280.
(  0) 0) |
| [10] |
Fang C, Moncrieff J B. The dependence of soil CO2 efflux on temperature[J]. Soil Biology and Biochemistry, 2001, 33(2): 155-165. DOI:10.1016/S0038-0717(00)00125-5
(  0) 0) |
| [11] |
Hu S D, Li Y F, Chang S X, et al. Soil autotrophic and heterotrophic respiration respond differently to land-use change and variations in environmental factors[J]. Agricultural and Forest Meteorology, 2018, 250/251: 290-298. DOI:10.1016/j.agrformet.2018.01.003
(  0) 0) |
| [12] |
Han T F, Zhou G Y, Li Y L, et al. Partitioning soil respiration in lower subtropical forests at different successional stages in Southern China (In Chinese)[J]. Chinese Journal of Plant Ecology, 2011, 35(9): 946-954. [韩天丰, 周国逸, 李跃林, 等. 中国南亚热带森林不同演替阶段土壤呼吸的分离量化[J]. 植物生态学报, 2011, 35(9): 946-954.]
(  0) 0) |
| [13] |
李先锋. 中亚热带格氏栲天然林和杉木人工林土壤呼吸及其组分对土壤增温的响应[D]. 福州: 福建师范大学, 2018. Li X F. Responses of soil respiration and its components to soil warming in natural forests of subtropical Castanopsis kawakamii and in Cunninghamia lanceolata plantations[D]. Fuzhou: Fujian Normal University, 2018. (  0) 0) |
| [14] |
Wu J J, Yang Z J, Liu X F, et al. Analysis of soil respiration and components in Castanopsis carlesii and Cunninghamia lanceo-lata plantations (In Chinese)[J]. Chinese Journal of Plant Ecology, 2014, 38(1): 45-53. [吴君君, 杨智杰, 刘小飞, 等. 米槠和杉木人工林土壤呼吸及其组分分析[J]. 植物生态学报, 2014, 38(1): 45-53.]
(  0) 0) |
| [15] |
Lei L, Xiao W F, Zeng L X, et al. Responses of soil respiration and its components to forest management in Pinus massoniana stands (In Chinese)[J]. Acta Ecologica Sinica, 2016, 36(17): 5360-5370. [雷蕾, 肖文发, 曾立雄, 等. 马尾松林土壤呼吸组分对不同营林措施的响应[J]. 生态学报, 2016, 36(17): 5360-5370.]
(  0) 0) |
| [16] |
Luo L, Shen G Z, Xie Z Q, et al. Components of soil respiration and its temperature sensitivity in four types of forests along an elevational gradient in Shennongjia, China (In Chinese)[J]. Chinese Journal of Plant Ecology, 2011, 35(7): 722-730. [罗璐, 申国珍, 谢宗强, 等. 神农架海拔梯度上4种典型森林的土壤呼吸组分及其对温度的敏感性[J]. 植物生态学报, 2011, 35(7): 722-730.]
(  0) 0) |
| [17] |
Chen G S, Yang Y S, Guo J F, et al. Relationships between carbon allocation and partitioning of soil respiration across world mature forests[J]. Plant Ecology, 2011, 212(2): 195-206. DOI:10.1007/s11258-010-9814-x
(  0) 0) |
| [18] |
Xie W, Chen S T, Hu Z H. Factors influencing the variability in soil heterotrophic rspiration from terrestrial ecosystem in China (In Chinese)[J]. Environmental Science, 2014, 35(1): 334-340. [谢薇, 陈书涛, 胡正华. 中国陆地生态系统土壤异养呼吸变异的影响因素[J]. 环境科学, 2014, 35(1): 334-340.]
(  0) 0) |
| [19] |
Fierer N, Craine J M, Schimel M, et al. Litter quality and the temperature sensitivity of decomposition[J]. Ecology, 2005, 86(2): 320-326. DOI:10.1890/04-1254
(  0) 0) |
| [20] |
Fan Y X, Yang Y S, Guo J F, et al. Changes in soil respiration and its temperature sensitivity at different successional stages of evergreen broadleaved forests in mid-subtropical China (In Chinese)[J]. Chinese Journal of Plant Ecology, 2014, 38(11): 1155-1165. [范跃新, 杨玉盛, 郭剑芬, 等. 中亚热带常绿阔叶林不同演替阶段土壤呼吸及其温度敏感性的变化[J]. 植物生态学报, 2014, 38(11): 1155-1165.]
(  0) 0) |
| [21] |
邓翠. 红壤侵蚀区马尾松—芒萁群落恢复对土壤呼吸的影响[D]. 福州: 福建师范大学, 2018. Deng C. Effects of Pinus massoniana-dicranopteris dichotoma community restoration on soil respiration in eroded red soil areas[D]. Fuzhou: Fujian Normal University, 2018. (  0) 0) |
| [22] |
Waseem H, Safdar B, Niaz A, et al. Labile organic carbon fractions, regulator of CO2 emission: Effect of plant residues and water regimes[J]. CLEAN - Soil, Air, Water, 2016, 44(10): 1358-1367.
(  0) 0) |
| [23] |
Zhang H, Lü M K, Xie J S. Effect of Dicranopteris dichotoma on soil microbial community structure in red soil erosion area (In Chinese)[J]. Acta Ecologica Sinica, 2018, 38(5): 1639-1649. [张浩, 吕茂奎, 谢锦升. 红壤侵蚀区芒萁对土壤微生物群落结构的影响[J]. 生态学报, 2018, 38(5): 1639-1649.]
(  0) 0) |
| [24] |
Iqbal J, Hu R, Feng M, et al. Microbial biomass, and dissolved organic carbon and nitrogen strongly affect soil respiration in different land uses: A case study at Three Gorges Reservoir Area, South China[J]. Agriculture, Ecosystems and Environment, 2010, 137(3): 294-307.
(  0) 0) |
| [25] |
Lü M K, Xie J S, Zhou Y X, et al. Dynamics of unprotected soil organic carbon with the restoration process of Pinus massoniana plantation in red soil erosion area (In Chinese)[J]. Chinese Journal of Applied Ecology, 2014, 25(1): 37-44. [吕茂奎, 谢锦升, 周艳翔, 等. 红壤侵蚀地马尾松人工林恢复过程中土壤非保护性有机碳的变化[J]. 应用生态学报, 2014, 25(1): 37-44.]
(  0) 0) |
| [26] |
Qiu X, Lü M K, Huang J X, et al. Characteristics of soil organic carbon mineralization at different temperatures in severely eroded red soil (In Chinese)[J]. Chinese Journal of Plant Ecology, 2016, 40(3): 236-245. [邱曦, 吕茂奎, 黄锦学, 等. 不同培养温度下严重侵蚀红壤的有机碳矿化特征[J]. 植物生态学报, 2016, 40(3): 236-245.]
(  0) 0) |
| [27] |
Bardgett R D, van der Putten W H. Belowground biodiversity and ecosystem functioning[J]. Nature, 2014, 515(7528): 505-511.
(  0) 0) |
| [28] |
Zhang K R, Cheng X L, Shu X, et al. Linking soil bacterial and fungal communities to vegetation succession following agricultural abandonment[J]. Plant and Soil, 2018, 431(1/2): 19-36.
(  0) 0) |
| [29] |
Yao F, Yang S, Wang Z R, et al. Microbial taxa distribution is associated with ecological trophic cascades along an elevation gradient[J]. Frontiers in Microbiology, 2017, 8: 2071.
(  0) 0) |
| [30] |
Razanamalala K, Razafimbelo T, Maron P A, et al. Soil microbial diversity drives the priming effect along climate gradients: A case study in Madagascar[J]. The ISME Journal, 2018, 12(2): 451-462.
(  0) 0) |
| [31] |
Zheng J, Chen J, Pan G, et al. A long-term hybrid poplar plantation on cropland reduces soil organic carbon mineralization and shifts microbial community abundance and composition[J]. Applied Soil Ecology, 2017, 111: 94-104.
(  0) 0) |
| [32] |
Boddy L. Interspecific combative interactions between wood-decaying basidiomycetes[J]. FEMS Microbiology Ecology, 2000, 31(3): 185-194.
(  0) 0) |
| [33] |
Huang Q M, Huang J, Lü M K, et al. Effects of restoration duration, understory vegetation and seasons on soil nitrogen trans- formation in Pinus massoniana forests (In Chinese)[J]. Chinese Journal of Ecology, 2020, 39(8): 2556-2564. [黄桥明, 黄俊, 吕茂奎, 等. 恢复年限、林下植被及季节对马尾松林土壤氮转化的影响[J]. 生态学杂志, 2020, 39(8): 2556-2564.]
(  0) 0) |
| [34] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization(MEMS)framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988-995.
(  0) 0) |
| [35] |
Chen R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367.
(  0) 0) |
| [36] |
杨山. 东北温带森林土壤有机碳矿化温度敏感性研究[D]. 沈阳: 沈阳农业大学, 2019. Yang S. Temperature sensitivity of soil organic carbon mineralization in temperate forests in northeast China[D]. Shenyang: Shenyang Agricultural University, 2019. (  0) 0) |
| [37] |
Thiessen S, Gleixner G, Wutzler T, et al. Both priming and temperature sensitivity of soil organic matter decomposition depend on microbial biomass-An incubation study[J]. Soil Biology and Biochemistry, 2013, 57: 739-748.
(  0) 0) |
| [38] |
Lange O L, Green T G A. Lichens show that fungi can acclimate their respiration to seasonal changes in temperature[J]. Oecologia, 2005, 142(1): 11-19.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


