2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008;
3. 生态环境部南京环境科学研究所, 南京 210042
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. Nanjing Institute of Environmental Science, Ministry of Ecology and Environment, Nanjing 210042, China
我国南方热带、亚热带地区分布有大面积酸性土壤,其酸害、铝(Al)毒和养分匮乏严重限制了农作物生长。近年来,由于酸沉降和过量铵态氮肥施用,导致我国农田土壤酸化速度急剧加快。1980年至2010年,南方农田土壤pH平均下降0.23个单位[1]。随着土壤pH降低,土壤固相Al活化,土壤活性Al浓度指数上升,成为酸性土壤作物生长的制约因素[2-3]。研究[4-5]表明,土壤pH下降1个单位,土壤活性Al3+浓度可增加1 000倍。Al3+浓度达到5 μmol·L–1即可破坏根尖细胞质膜完整性,抑制作物根系伸长,导致农作物减产甚至绝产。因此,如何有效降低土壤酸度,缓解土壤铝毒害始终是酸性土壤改良研究的热点之一[6]。
酸性土壤改良剂种类繁多。传统上多以熟石灰、生石灰等石灰类物质作为酸性土壤改良剂。近年来研究发现,生物质炭中含有丰富的碳酸盐和表面含氧官能团等碱性物质,能够有效改良土壤酸度,降低酸性土壤活性铝含量,缓解植物铝毒害[7-9]。田间研究发现,一次施用石灰类改良剂和生物质炭后,随施用时间延长改良效果逐渐减弱,土壤再次发生酸化和铝毒害[10-12]。外源酸输入和持续淋溶作用导致改良剂中碱性物质耗竭是土壤复酸化的主要原因。不同改良剂中碱性物质组成不同,对外源酸和淋溶作用的响应不同,因此土壤复酸化过程必然存在差异。然而,目前尚缺乏针对不同改良剂施用后土壤复酸化过程的比较研究。
通过添加不同浓度梯度的酸溶液模拟酸化,比较生物质炭与熟石灰(Ca(OH)2)等效处理(相同pH水平)土壤的复酸化过程,发现生物质炭能够通过表面有机阴离子官能团质子化作用提高土壤酸缓冲容量,减缓土壤pH降低,抑制土壤铝活化[13]。在模拟酸化过程中,生物质炭处理土壤能够释放更多K+、Mg2+。研究[14]表明,盐基阳离子的存在也能够一定程度上缓解植物铝毒害。然而,利用不同浓度酸模拟外源酸输入,无法模拟实际田间条件下外源酸持续输入和淋溶作用。生物质炭与Ca(OH)2改良后土壤的复酸化过程和铝毒害作用需进一步比较研究。
为更好地模拟田间条件下外源酸持续输入和淋溶作用,本研究通过循环酸浸洗土壤的方法快速模拟外源酸淋洗过程,结合根伸长试验比较生物质炭和Ca(OH)2等效改良后酸性红壤的复酸化过程及其对植物的铝毒害作用,探究生物质炭相较于Ca(OH)2缓解酸性土壤铝毒害的长效潜力与作用机制,以期为我国农田土壤酸化的长效阻控提供理论依据和技术支撑。
1 材料与方法 1.1 供试土壤与生物质炭供试土壤为采自江西省鹰潭市(28°12′N,116°56′E)的第四纪红黏土。采集0~15 cm耕作层土壤样品,经自然风干后,研磨过2 mm筛,用于测定土壤pH和培养实验,过0.25 mm筛用于测定土壤阳离子交换量(CEC)、有机质、交换性酸、交换性盐基阳离子等基本理化性质。在土水比1︰2.5条件下,利用Orion pH计(Thermo Scientific Orion Star A211,美国)和复合pH电极测定土壤pH。通过重铬酸钾滴定法测定土壤有机质含量,采用醋酸铵法(pH 7.0)测定土壤CEC和交换性盐基阳离子(K+、Na+、Ca2+和Mg2+),土壤交换性酸(H+和Al3+)通过氯化钾溶液淋洗提取后用0.01 mol·L–1 NaOH滴定测得[13]。供试土壤基本性质如表 1所示。
所用生物质炭为花生秸秆在400 ℃下限氧热解3 h制得。花生秸秆经风干磨细过2 mm筛后,填置于30 mL陶瓷坩埚中压实,并套置100 mL陶瓷坩埚,盖盖密封后放入马弗炉。热解温度每分钟升高20 ℃至400 ℃后保持3 h。生物质炭冷却至室温后,研磨过0.25 mm筛,用于测定生物质炭基本理化性质。在1︰20炭水比条件下测定生物质炭pH;利用自动电位滴定仪(T50 Titrator,Mettler Toledo,Urdorf,瑞士)通过酸碱滴定法测定生物质炭酸中和容量(ANC);生物质炭交换性盐基阳离子(K+、Ca2+和Mg2+)含量和CEC通过改进的醋酸铵取代法[13,15]测定。生物质炭基本理化性质列于表 1。
1.2 土壤培养试验通过室内土壤培养试验分别制备生物质炭和Ca(OH)2改良土壤样品。称取300 g供试土壤于塑料杯中,添加3%花生秸秆炭并混匀,调节含水量达70%田间持水量,用留有通气孔的塑料保鲜膜封口,以保证气体交换的同时减少水分损失。将装有土壤样品的塑料杯置于25 ℃恒温培养箱中培养30 d,每3天称重补充去离子水。培养结束后,土壤样品风干磨细过0.25 mm筛,制得生物质炭改良土壤样品。另取一份土壤样品与一定量Ca(OH)2混匀后进行上述培养试验,以制备与生物质炭处理土壤pH相近的熟石灰改良土壤样品。通过土壤酸缓冲容量与土壤初始pH和目标pH的差值估算Ca(OH)2添加量[13],并以此为基准以设置6个不同添加量的熟石灰处理梯度。每个处理进行三次重复。培养结束后测定土壤pH,选择与生物质炭处理土壤pH相同水平的Ca(OH)2处理作为对照。在土水比1︰2.5条件下,生物质炭和Ca(OH)2改良后土壤pH分别为6.33和6.32,Ca(OH)2添加量为1.875 g·kg–1。
1.3 循环酸浸洗与根伸长试验通过循环酸浸洗模拟长期酸输入条件,观察改良后土壤的复酸化过程[16]。由于导致农田土壤酸化的质子来源主要是过量铵态氮肥施用引起的硝化产酸[17],因此,本研究选取HNO3作为模式酸洗液。根据田间实验铵态氮肥年产酸量(13.6 kmol·hm–2·a–1)和年降雨量(2 000 mm),设定HNO3浓度为0.69 mmol·L–1(pH≈3.2)[18],按10.00 g土壤样品接受300 mL模式酸溶液模拟4年酸输入量。选取铝敏感玉米品种苏玉糯5号作为指示作物,在模拟酸化前进行催芽处理,以玉米幼根对酸化过程的响应表征酸化过程植物Al毒害情况。
具体操作如下:称取10.00 g改良后土壤样品置于500 mL的玻璃烧杯中,加入300 mL酸溶液,磁力搅拌24 h平衡3 d,每天搅拌5 min。反应结束后,以玻璃pH电极作指示电极、双盐桥(LiCl)甘汞电极作参比电极,利用Orion pH计测定悬液体系pH[19]。取20 mL悬液10 000 r·min–1离心5 min,过0.22 μm微孔滤膜后测定溶液Al和盐基阳离子(K+、Ca2+、Mg2+)含量。选取10株根长3~5 cm玉米幼苗移植于土壤悬液体系中,在25 ℃恒温培养箱中避光培养48 h后,收集植株样品,测定幼苗根伸长量和伊文斯蓝染色量。将残余土壤与溶液通过离心分离后,土壤样品于50 ℃烘干,溶液样品过0.22 μm微孔滤膜后,测定溶液盐基阳离子含量。烘干后的土壤样品再次进行相同的酸浸洗过程,重复浸洗3次,分别模拟4年、8年和12年酸化过程。在模拟酸化前,以去离子水代替酸溶液作为空白对照,表征酸化前土壤和植物状态。每个处理重复三次。
1.4 测定方法与计算玉米幼根相对伸长率表征酸化过程对植物根系生长的影响,计算公式为:
| $ {\text{RRE/}}\% = \frac{{{L_i}}}{{{L_0}}} \times 100 $ | (1) |
式中,RRE为相对根伸长率,%;Li为不同酸浸洗次数的根伸长量,cm;L0为空白对照处理根伸长,cm[20]。
伊文斯蓝染色法可表征根尖细胞死亡情况和细胞膜完整性破坏程度。选取三根恒温培养后的玉米幼苗根尖(1 cm),在1 mL的伊文斯蓝溶液浸泡30 min后,用去离子水洗去多余的染料。将染色的根尖用均质仪混匀、搅碎、均质后用1.5 mL含1%十二烷基磺酸钠和50%甲醇的混合水溶液,在50 ℃下水浴浸提15 min。用紫外可见分光光度计(UV- 3000,Mapada,上海)测定浸提液在600 nm波长处的吸光度[20-21]。相对伊文斯蓝染色率用下述公式计算:
| $ {\text{REBU/}}\% = \frac{{{\text{Ab}}{{\text{s}}_i}}}{{{\text{Ab}}{{\text{s}}_0}}} \times 100 $ | (2) |
式中,REBU为相对伊文斯蓝染色,%;Absi为不同酸浸洗次数吸光度,Abs0为空白对照处理吸光度[20-21]。
溶液Al含量通过8-羟基喹啉比色法测定[22]。溶液中K+采用火焰光度法(Sherwood M410,Sherwood Scientific Ltd,Cambridge,英国)测定,Ca2+和Mg2+通过原子吸收光谱法(nov AA350,Analytik,Jena AG,德国)测定。根据根伸长实验前后土壤溶液中K+、Ca2+和Mg2+含量之差计算根生长过程中对K、Ca、Mg元素的吸收量。
1.5 统计分析利用SPSS 20.0软件进行统计分析。通过单因素方差分析(ANOVA)不同处理之间的差异性,并采用最小显著差异(LSD)法检验差异的显著性(P < 0.05)。
2 结果与讨论 2.1 生物质炭缓解模拟酸化过程中植物铝毒害效应如图 1a所示,随着模拟酸化年限的增加,玉米根伸长逐渐受到抑制。根尖吸收伊文斯蓝量增加说明根尖细胞的质膜完整性下降,铝毒害作用加重(图 1b)。模拟12年的外源酸输入时,生物质炭和Ca(OH)2处理中根伸长量较未酸化时分别降低20%和32%(图 1a),根尖伊文斯蓝相对吸收量较未酸化时分别增加1.6倍和2.3倍(图 1b)。铝毒害是土壤酸化引起植物根尖细胞损伤的主要原因[23]。随着外源酸的输入,根尖铝毒害程度加深,说明生物质炭和Ca(OH)2对酸性土壤的改良效果均呈现减弱趋势。这与长期田间实验观察到的结果一致,Meng等[10]和Jin等[12]分别在浙江和江西酸性红壤中开展了一次性施用石灰和生物质炭的田间改良实验,发现石灰和生物质炭施用后,土壤pH和作物产量均呈现逐年降低趋势。比较生物质炭和Ca(OH)2处理发现,模拟酸化对生物质炭处理中玉米根伸长的抑制作用显著弱于Ca(OH)2处理,根尖细胞受铝毒害损伤程度同样低于Ca(OH)2处理。在模拟12年酸输入时,生物质炭处理土壤中玉米根相对伸长量较Ca(OH)2处理高18.6%,伊文斯蓝相对吸收量较Ca(OH)2处理低19.6%(图 1)。可见,生物质炭相较于Ca(OH)2处理能够有效地缓解土壤复酸化过程引起的植物根系铝毒害效应,展现出更为长效的酸化改良潜力。
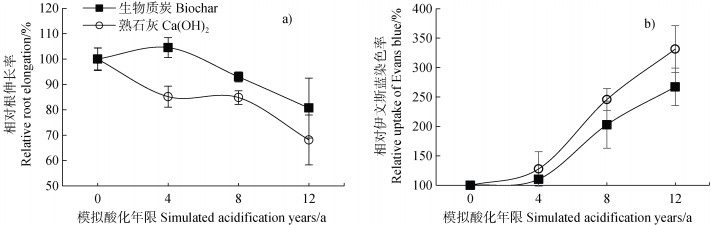
|
图 1 玉米相对根伸长率(a)和根尖相对伊文斯蓝染色率(b)随模拟酸化年限的变化趋势 Fig. 1 Change trends of maize relative root elongation(a)and relative Evans blue uptake by maize root tips(b)with simulated acidification years |
大量研究表明,土壤铝毒害的程度与土壤溶液中Al3+浓度和其他养分离子的含量密切相关[24]。因此,生物质炭对土壤酸化过程中植物铝毒害的缓解机理可能与生物质炭影响土壤酸化过程中铝的活化和盐基阳离子(K+、Ca2+和Mg2+)的释放有关。
2.2 生物质炭抑制模拟酸化过程中土壤铝溶出pH是影响土壤溶液Al浓度的关键因素,土壤溶液Al浓度随土壤pH降低呈指数上升[2]。如图 2和图 3所示,随着酸浸洗循环次数的增加,生物质炭和Ca(OH)2处理土壤的pH逐渐下降,土壤溶液Al浓度呈指数增加,表明土壤发生复酸化,土壤固相铝活化形成溶液Al3+。比较生物质炭和Ca(OH)2处理土壤酸化过程发现,相较于Ca(OH)2处理,生物质炭明显减缓了土壤pH降低过程,抑制了土壤Al的活化。在模拟4、8、12年酸化过程中,生物质炭处理土壤pH分别较Ca(OH)2处理土壤高0.55、0.25和0.12个pH单位(图 2)。模拟4年酸输入时,生物质炭处理土壤溶液Al浓度与Ca(OH)2处理无显著差异。随着模拟酸化年限增加,Ca(OH)2处理土壤溶液Al浓度逐渐高于生物质炭处理,且差距呈增加趋势。在模拟12年酸输入时,生物质炭处理中溶液Al浓度较熟石灰处理低33%(图 3a)。由图 2可知,在模拟酸化初期,生物质炭和熟石灰处理土壤pH均在5.20以上,此时土壤溶液Al浓度极低,因此,生物质炭和熟石灰处理之间并无显著差异。随着外源酸输入和淋洗次数增加,土壤pH持续降低,土壤溶液Al浓度呈指数增加。单位pH差异所引起的溶液Al浓度差异也逐渐增加。因此,生物质炭与熟石灰处理之间土壤溶液Al浓度差异在酸化后期更为显著。生物质炭与Ca(OH)2处理之间土壤Al浓度的变化趋势与酸化过程对玉米根系伸长的抑制和根尖细胞的损害特征完全一致(图 1),说明生物质炭能够通过抑制酸化过程中土壤Al活化而缓解植物铝毒害作用。
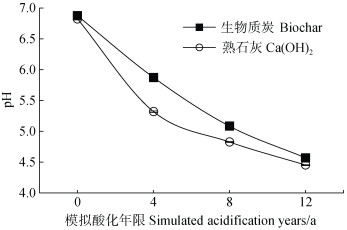
|
图 2 土壤pH随模拟酸化年限的变化趋势 Fig. 2 Change trends of soil pH with simulated acidification years |
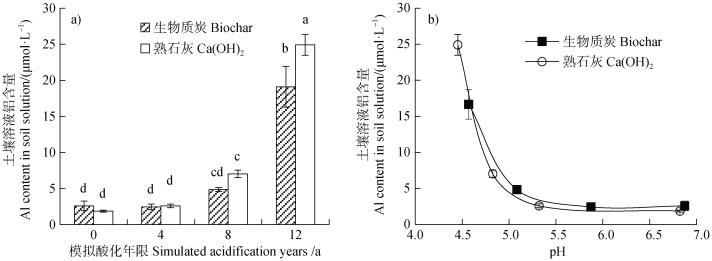
|
注:图中不同小写字母表示不同土壤间差异显著(P < 0.05)。下同。 Note: The different letters mean the significant differences among different soils(P < 0.05). The same below. 图 3 土壤溶液Al浓度随模拟酸化年限(a)和土壤pH(b)的变化趋势 Fig. 3 Change trends of aluminum content in soil solution with simulated acidification years(a)and soil pH(b) |
生物质炭和Ca(OH)2处理土壤溶液Al浓度随体系pH的变化曲线基本重叠。在等pH条件下,生物质炭与Ca(OH)2处理土壤溶液Al浓度无显著差异(图 3b)。可见,生物质炭降低酸化过程中土壤溶液Al浓度的主要机制是减缓了酸化过程中土壤pH的降低。生物质炭减缓外源酸输入导致的土壤pH下降过程与其提高土壤酸缓冲能力有关。生物质炭表面富含羧基等含氧官能团,这些表面含氧官能团在中性条件下多以阴离子形态(如-COO–、-O–等)存在。当外源酸输入土壤时,表面阴离子含氧官能团与外源质子缔和形成电中性分子(如-COOH、-OH),减缓了土壤pH的降低,增强了土壤酸缓冲能力[25]。因此,在等量酸输入时,生物质炭处理土壤pH较熟石灰处理高,有效降低了土壤溶液Al浓度。有关生物质炭缓解植物铝毒害的研究表明,除石灰效应外,生物质炭还能够通过表面络合作用和共沉淀作用固定土壤溶液Al3+,缓解土壤铝毒害[23,26]。然而,根据本研究结果(图 3b)表明,生物质炭表面络合作用和共沉淀作用对土壤复酸化过程中植物铝毒害的缓解作用并不明显。这是由于土壤中的铝硅酸盐、铝(氢)氧化物和其他潜在活性Al构成了巨大的土壤固相铝Al库,在酸化过程中作为Al源释放进入土壤溶液。根据溶解平衡原理可知,土壤溶液Al3+浓度主要受土壤中溶解度最大的含铝化合物控制[24]。虽然生物质炭能够通过表面络合作用和共沉淀作用固定部分溶液Al3+,然而在土壤pH恒定的情况下,土壤中巨大的固相Al库将进一步释放Al3+进入土壤溶液直至达到土壤固相Al所控制的溶解沉淀平衡,掩盖了生物质炭对溶液Al的表面络合和共沉淀等作用。
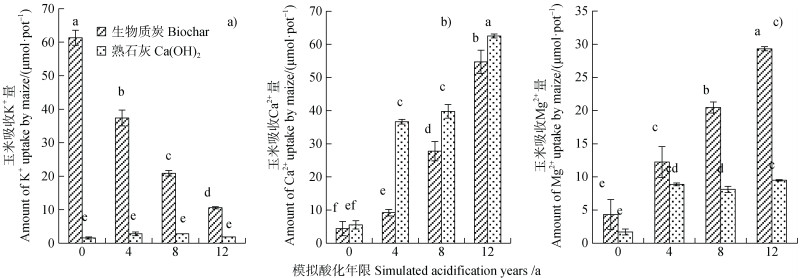
2.3 生物质炭对模拟酸化过程中土壤盐基阳离子释放的影响除土壤固相Al活化外,土壤酸化过程还伴随着土壤盐基阳离子(K+、Ca2+和Mg2+)的释放[27-28]。如图 4所示,生物质炭和Ca(OH)2处理土壤溶液中Ca2+浓度均随模拟酸浸洗次数增加而增加。Ca(OH)2处理土壤溶液K+和Mg2+浓度较低,随酸浸洗次数变化不明显。生物质炭则显著增加了土壤溶液中K+和Mg2+含量,土壤溶液K+浓度随模拟酸浸洗次数增加快速下降,土壤溶液Mg2+浓度则呈增加趋势。这主要是由于生物质炭中含有较多K+和Mg2+,K+交换能力较Ca2+、Mg2+等二价阳离子弱,极易随酸淋失[29];H+输入土壤后通过交换作用促使土壤交换位点上的Ca2+和Mg2+释放进入土壤溶液。相较于Ca(OH)2处理,生物质炭显著增加了酸化过程中土壤溶液中K+和Mg2+的浓度,而Ca(OH)2处理土壤溶液中Ca2+浓度较生物质炭处理高。这与两种改良剂中盐基阳离子组成一致。在模拟12年酸化年限时,生物质炭处理土壤溶液中K+浓度和Mg2+浓度分别较Ca(OH)2处理高3.1倍和2.3倍,Ca2+浓度则较Ca(OH)2处理低15%(图 4)。玉米根系对盐基阳离子的吸收与土壤溶液中盐基阳离子浓度变化趋势相同(图 5)。生物质炭促进了酸化过程中玉米对K+和Mg2+的吸收,Ca(OH)2则促进了根系对Ca2+的吸收。在模拟12年酸化年限时,玉米根系吸收K+和Mg2+的量分别较熟石灰处理高4.7倍和2.1倍,吸收Ca2+量较熟石灰处理低12.5%(图 5)。
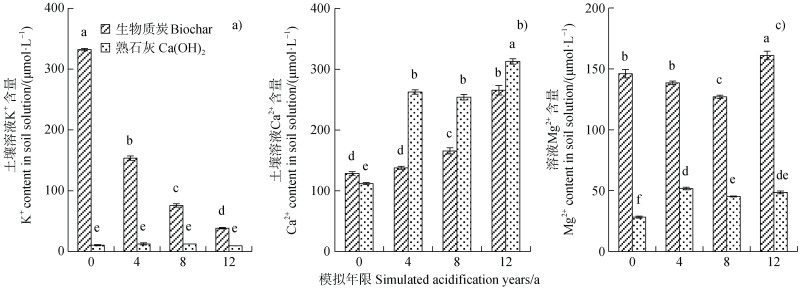
|
图 4 土壤溶液盐基阳离子(K+(a)、Ca2+(b)和Mg2+(c))浓度随模拟酸化年限的变化趋势 Fig. 4 Change trends of base cations(K+(a), Ca2+(b)and Mg2+(c))in soil solution with simulated acidification years |
|
图 5 玉米吸收盐基阳离子量(K+(a)、Ca2+(b)和Mg2+(c))随模拟酸化年限的变化趋势 Fig. 5 Change trends of base cations(K+(a), Ca2+(b)and Mg2+(c))absorbed by maize with simulated acidification years |
研究表明,在铝胁迫条件下,供给Ca2+和Mg2+等盐基阳离子均能够有效缓解Al3+对植物根伸长的抑制[14,30]。盐基阳离子可通过竞争植物根表Al3+位点,降低根细胞质膜表面的Al3+活性,进而缓解Al3+对根系的毒害作用,且一般认为Ca2+的竞争能力较Mg2+强[14]。然而,近年研究表明,Mg2+作为酶的激活剂,可通过调节铝胁迫下植物的生理过程缓解Al3+对根系的毒害作用,相较于Ca2+展现出一定的优势[31-32]。例如,Silva等[32-33]比较发现,通过促进根系柠檬酸的分泌,Mg2+缓解大豆根铝毒害的效果较Ca2+强100倍。Kong等[34]对Mg2+缓解玉米根系Al3+毒害作用的研究发现,Mg2+增强了编码超氧化物歧化酶、过氧化氢酶和过氧化物酶的基因活性与表达,有效缓解了Al3+诱导的植物根系氧化应激反应,进而促进玉米根系生长。虽然在酸化过程中供给Ca2+的能力不如Ca(OH)2,但生物质炭中含有大量Mg2+,在土壤酸化过程中能够持续释放进入土壤溶液,促进了玉米幼苗对Mg2+的吸收。可见,生物质炭在酸化过程中释放的Mg2+对缓解植物Al毒害症状也有一定的贡献。
3 结论循环酸浸洗的方法有效模拟了外源酸输入和淋溶作用引起的酸性土壤改良后复酸化过程。生物质炭和熟石灰对酸性土壤的改良效果均随循环酸浸洗次数增加而减弱,玉米根系伸长逐渐受到抑制。与熟石灰相比,生物质炭一定程度上缓解了模拟酸化过程对玉米根系伸长的抑制作用。一方面是由于生物质炭表面含有丰富的有机阴离子,通过质子化作用减缓了土壤pH降低,抑制了酸化过程中土壤Al的活化,使生物质炭处理土壤在相同模拟酸化年限内溶液Al浓度较熟石灰处理低。另一方面,生物质炭中含有大量Mg2+,在酸化过程中逐渐释放进入土壤溶液,可通过调控植物对Al3+的生理响应,缓解植物铝毒害症状。生物质炭相较于熟石灰展现出更为长效的酸性土壤改良潜力。未来可在控制等效改良效果的基础上通过长期田间试验进一步探究生物质炭对土壤复酸化过程影响及其长效性能。
| [1] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [2] |
Xu R K, Ji G L. Influence of pH on dissolution of aluminum in acid soils and the distribution of aluminum ion species (In Chinese)[J]. Acta Pedologica Sinica, 1998, 35(2): 162-171. [徐仁扣, 季国亮. pH对酸性土壤中铝的溶出和铝离子形态分布的影响[J]. 土壤学报, 1998, 35(2): 162-171.]
(  0) 0) |
| [3] |
Zhang Y P, Zong L G, Shi Y F. Effects of soil pH on characteristics of soil Al in tea plantations (In Chinese)[J]. Soils, 2019, 51(4): 746-751. [张艳萍, 宗良纲, 史艳芙. 茶园土壤pH变化对土壤中铝特性的影响[J]. 土壤, 2019, 51(4): 746-751.]
(  0) 0) |
| [4] |
Kopittke P M, Blamey F P C. Theoretical and experimental assessment of nutrient solution composition in short-term studies of aluminium rhizotoxicity[J]. Plant and Soil, 2016, 406(1/2): 311-326.
(  0) 0) |
| [5] |
Yamamoto Y. Aluminum toxicity in plant cells: Mechanisms of cell death and inhibition of cell elongation[J]. Soil Science and Plant Nutrition, 2019, 65(1): 41-55. DOI:10.1080/00380768.2018.1553484
(  0) 0) |
| [6] |
Xu R K, Li J Y, Zhou S W, et al. Scientific issues and controlling strategies of soil acidification of croplands in China (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(2): 160-167. [徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160-167.]
(  0) 0) |
| [7] |
Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3): 3488-3497. DOI:10.1016/j.biortech.2010.11.018
(  0) 0) |
| [8] |
Fidel R B, Laird D A, Thompson M L, et al. Characterization and quantification of biochar alkalinity[J]. Chemosphere, 2017, 167: 367-373. DOI:10.1016/j.chemosphere.2016.09.151
(  0) 0) |
| [9] |
Shi R Y, Li J Y, Ni N, et al. Understanding the biochar's role in ameliorating soil acidity[J]. Journal of Integrative Agriculture, 2019, 18(7): 1508-1517. DOI:10.1016/S2095-3119(18)62148-3
(  0) 0) |
| [10] |
Meng C F, Lu X N, Cao Z H, et al. Long-term effects of lime application on soil acidity and crop yields on a red soil in Central Zhejiang[J]. Plant and Soil, 2004, 265(1/2): 101-109.
(  0) 0) |
| [11] |
Cornelissen G, Jubaedah, Nurida N L, et al. Fading positive effect of biochar on crop yield and soil acidity during five growth seasons in an Indonesian Ultisol[J]. Science of the Total Environment, 2018, 634: 561-568. DOI:10.1016/j.scitotenv.2018.03.380
(  0) 0) |
| [12] |
Jin Z W, Chen C, Chen X M, et al. The crucial factors of soil fertility and rapeseed yield - A five year field trial with biochar addition in upland red soil, China[J]. Science of the Total Environment, 2019, 649: 1467-1480. DOI:10.1016/j.scitotenv.2018.08.412
(  0) 0) |
| [13] |
Shi R Y, Hong Z N, Li J Y, et al. Peanut straw biochar increases the resistance of two Ultisols derived from different parent materials to acidification: A mechanism study[J]. Journal of Environmental Management, 2018, 210: 171-179. DOI:10.1016/j.jenvman.2018.01.028
(  0) 0) |
| [14] |
Watanabe T, Okada K. Interactive effects of Al, Ca and other cations on root elongation of rice cultivars under low pH[J]. Annals of Botany, 2004, 95(2): 379-385.
(  0) 0) |
| [15] |
Dong Y, Shao J, Xu R K, et al. Amelioration of ultisol acidity by biochars derived from canola straws from different areas (In Chinese)[J]. Soils, 2020, 52(1): 134-138. [董颖, 邵捷, 徐仁扣, 等. 不同地区油菜秸秆制备的生物质炭对酸性红壤的改良效果[J]. 土壤, 2020, 52(1): 134-138.]
(  0) 0) |
| [16] |
Zhu M X, Ji G L. The effect of long-term acidification on size and depletion of reactive solid-phase aluminum in red soils (In Chinese)[J]. Chinese Journal of Soil Science, 2004, 35(2): 106-111. [朱茂旭, 季国亮. 长期酸化对红壤中活性固相铝库大小及亏损程度的影响[J]. 土壤通报, 2004, 35(2): 106-111.]
(  0) 0) |
| [17] |
Wang J D, Xu X J, Ning Y W, et al. Progresses in agricultural driving factors on accelerated acidification of soils (In Chinese)[J]. Soils, 2015, 47(4): 627-633. [汪吉东, 许仙菊, 宁运旺, 等. 土壤加速酸化的主要农业驱动因素研究进展[J]. 土壤, 2015, 47(4): 627-633.]
(  0) 0) |
| [18] |
Zhou H Y, Xu M G, Cai Z J, et al. Quantitative analysis of driving-factors of soil acidification in Qiyang County, Hunan Province (In Chinese)[J]. Scientia Agricultura Sinica, 2019, 52(8): 1400-1412. [周海燕, 徐明岗, 蔡泽江, 等. 湖南祁阳县土壤酸化主要驱动因素贡献解析[J]. 中国农业科学, 2019, 52(8): 1400-1412.]
(  0) 0) |
| [19] |
Pan X Y, Shi R Y, Hong Z N, et al. Effect of fulvic acid on ameliorating soil acidity and pH buffering capacity of two ultisols (In Chinese)[J]. Soils, 2020, 52(4): 685-690. [潘晓莹, 时仁勇, 洪志能, 等. 富里酸对红壤酸度的改良及酸化阻控效果[J]. 土壤, 2020, 52(4): 685-690.]
(  0) 0) |
| [20] |
Dong Y, Wang H, Chang E, et al. Alleviation of aluminum phytotoxicity by canola straw biochars varied with their cultivating soils through an investigation of wheat seedling root elongation[J]. Chemosphere, 2019, 218: 907-914.
(  0) 0) |
| [21] |
Shi R Y, Ni N, Nkoh J N, et al. Biochar retards Al toxicity to maize(Zea mays L.)during soil acidification: The effects and mechanisms[J]. Science of the Total Environment, 2020, 719: 137448.
(  0) 0) |
| [22] |
Li J Y, Wang N, Xu R K, et al. Potential of industrial byproducts in ameliorating acidity and aluminum toxicity of soils under tea plantation[J]. Pedosphere, 2010, 20(5): 645-654.
(  0) 0) |
| [23] |
Qian L B, Chen B L, Chen M F. Novel alleviation mechanisms of aluminum phytotoxicity via released biosilicon from rice straw-derived biochars[J]. Scientific Reports, 2016, 6: 29346.
(  0) 0) |
| [24] |
Shen R F. Behavior of aluminum in soil-plant and plant adaptation mechanism (In Chinese). Beijing: Science Press, 2008. [沈仁芳. 铝在土壤-植物中的行为及植物的适应机制[M]. 北京: 科学出版社, 2008.]
(  0) 0) |
| [25] |
Shi R Y, Hong Z N, Li J Y, et al. Mechanisms for increasing the pH buffering capacity of an acidic ultisol by crop residue-derived biochars[J]. Journal of Agricultural and Food Chemistry, 2017, 65(37): 8111-8119.
(  0) 0) |
| [26] |
Qian L B, Chen B L, Hu D F. Effective alleviation of aluminum phytotoxicity by manure-derived biochar[J]. Environmental Science & Technology, 2013, 47(6): 2737-2745.
(  0) 0) |
| [27] |
Zhao Y, Yang J L, Dong Y, et al. Stoichiometry of soil mineral weathering in intensely weathered soil as leached by simulated acid rain (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(2): 310-319. [赵越, 杨金玲, 董岳, 等. 模拟酸雨淋溶下强风化土壤矿物风化计量关系研究[J]. 土壤学报, 2019, 56(2): 310-319.]
(  0) 0) |
| [28] |
Liu L, Xie D T, Li Z Y, et al. Cations exchange and its effect on acid buffering capacity of acid purple soil (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(4): 887-897. [刘莉, 谢德体, 李忠意, 等. 酸性紫色土的阳离子交换特征及其对酸缓冲容量的影响[J]. 土壤学报, 2020, 57(4): 887-897.]
(  0) 0) |
| [29] |
Yuan J H, Xu R K, E S Z, et al. Forms of base cations in biochars and their roles in acid soil amelioration (In Chinese)[J]. Soils, 2019, 51(1): 75-82. [袁金华, 徐仁扣, 俄胜哲, 等. 生物质炭中盐基离子存在形态及其与改良酸性土壤的关系[J]. 土壤, 2019, 51(1): 75-82.]
(  0) 0) |
| [30] |
Zhang F Q, Shen Z G, Liu Y L. Effects of Al3+ and Al3++Ca2+ on ATPases and membrane fluidities of plasma membrane and tonoplast vesicles from root tips of wheat seedlings (In Chinese)[J]. Acta Photophysiologica Sinica, 2000, 26(2): 105-110. [张芬琴, 沈振国, 刘友良. 铝和铝+钙对小麦幼苗根尖质膜、液泡膜微囊ATP酶和膜流动性的影响[J]. 植物生理学报, 2000, 26(2): 105-110.]
(  0) 0) |
| [31] |
Bose J, Babourina O, Rengel Z. Role of magnesium in alleviation of aluminium toxicity in plants[J]. Journal of Experimental Botany, 2011, 62(7): 2251-2264.
(  0) 0) |
| [32] |
Silva I R, Smyth T J, Israel D W, et al. Magnesium is more efficient than calcium in alleviating aluminum rhizotoxicity in soybean and its ameliorative effect is not explained by the Gouy-Chapman-Stern model[J]. Plant and Cell Physiology, 2001, 42(5): 538-545.
(  0) 0) |
| [33] |
Silva I R, Smyth T J, Israel D W, et al. Altered aluminum inhibition of soybean root elongation in the presence of magnesium[J]. Plant and Soil, 2001, 230(2): 223-230.
(  0) 0) |
| [34] |
Kong X Y, Peng Z P, Li D X, et al. Magnesium decreases aluminum accumulation and plays a role in protecting maize from aluminum-induced oxidative stress[J]. Plant and Soil, 2020, 457(1/2): 71-81.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


