重金属暴露是全世界普遍存在的环境问题。据报道,自然和人为原因导致水、土壤和沉积物中的重金属含量持续增加。重金属天然存在于富含金属的铁(氢)氧化物和/或硫化物矿物中,是污染的主要地质成因与来源[1]。同时,重金属的浓度和空间分布与人类活动密切相关,采矿、冶炼、木材加工和农业等实践活动均可能造成人为来源的重金属暴露。土壤重金属污染是一个重大的生态环境问题,修复土壤及地下水重金属污染势在必行。
微生物能形成矿物、分解以及转化矿物,而矿物的存在能够促进微生物的生长,使微生物与矿物之间协同作用得到强化,微生物和矿物的交互作用影响着土壤中重金属的环境行为[2]。而细菌诱导重金属成矿已成为一种环保、高效的固化稳定化方法。在污染介质中,重金属与细菌生命活动生成的酸性阴离子沉淀可达到类似水泥的稳定效果[3],细菌诱导成矿法对重金属的固定率可达70%~99%[4]。细菌诱导成矿固化稳定化技术环境友好,具有较好的透水性、强度提升能力和长期稳定性,对土壤中砷(As)、镉(Cd)、锌(Zn)、铬(Cr)、铜(Cu)、铅(Pb)等重金属均具有修复潜力。
1 重金属与生物成矿 1.1 微生物与生物成矿生物成矿是在生物的参与下,无机元素选择性地沉积在环境中特殊有机物表面的过程。生物成矿与非生物成矿的显著区别在于是否存在生物基质的调控,生物成矿产物的形态、特征及晶型等会受到生物代谢过程或环境因素的影响调控[5]。生物成矿根据其类型可分为生物诱导成矿(biologically induced mineralization,BIM)和生物控制成矿(biologically controlled mineralization,BCM)。生物诱导成矿是由生物生理活动引起的,并通过改变周围环境的物理化学条件来诱导发生。在BIM过程中,生物体细胞成分(如胞外聚合物、细胞壁和一些孢子)进入局部微环境时,生物诱导成矿发生。这些细胞成分具有带电荷表面,可作为吸附位点与金属离子发生相互作用,从而导致矿物的成核和生长。生物控制成矿是由生物生理活动引起的,其成矿过程不受各种环境因素影响或诱发。在BCM过程中,生物质对矿物的成核和生长有高度的控制,该过程通常发生在细胞内或划定的封闭空间。通过这种方法形成的矿物通常含有大量有机物,且具有矿物形状均匀、结晶习性独特、排列规则等特点。
环境中的重金属污染具有隐蔽性、持久性、不可逆转性等特点,其无法被生物降解修复,主要通过凝聚、吸附沉淀、氧化还原、甲基化等作用进行转化以降低其在环境中的生物利用性。而传统的物理化学修复技术成本较高,易破坏土壤生态环境,造成二次污染等。微生物诱导的生物成矿是一种很有前景的环境重金属污染原位修复技术。生物矿物的组成各不相同,根据成矿产物的类型主要可分为碳酸盐矿物、铁锰氧化物、硫化物和磷酸盐矿物[6],而适于介导成矿的细菌应无毒、能成矿,并能在土壤基质的真实环境中存活,其中与铁锰氧化物的形成过程相对应的微生物为铁细菌和锰氧化菌。在成矿过程中,铁呼吸是最重要的微生物胞外呼吸,纤铁矿、水铁矿、赤铁矿和磁赤铁矿等能够接受胞外电子,直接参与胞外呼吸电子传递过程,铁细菌介导的电子传递过程对铁生物成矿耦合重金属固定具有重要意义[7]。
1.2 微生物诱导铁锰氧化物沉淀铁锰氧化物(矿物)形成过程包括非生物过程和生物过程,铁锰氧化物的形成机制可能涉及非生物反应、酶催化或两者的结合。如在中性pH附近氧化条件下Fe(Ⅱ)可通过非生物氧化使之转化为溶解性较小的Fe(Ⅲ)矿,活性铁渗透Fe(Ⅱ)-针铁矿系统,或过氧化氢反应可形成的Fe(Ⅵ)等[7]。而在生物过程中,环境氧化还原反应可通过微生物氧化不稳定有机碳或无机化合物作为电子供体,再加上电子受体(包括腐殖物质、过渡金属、类金属和锕系元素),其在铁锰矿物相的形成过程中起着重要作用[7]。此外,氮的循环与铁、锰的氧化还原循环之间存在诸多联系,由微生物参与的固氮、硝化、反硝化等反应会影响氮的可利用性,从而影响矿物相的形成[8]。
铁/锰氧化菌是一个系统发育多样的类群,能够催化Fe(Ⅱ)、Mn(Ⅱ)形成铁锰氧化物,其广泛分布于土壤环境中[9]。铁/锰氧化菌介导Fe(Ⅱ)、Mn(Ⅱ)氧化形成铁锰氧化物过程中,通过吸附共沉淀和氧化来影响重金属在环境中的迁移转化。铁/锰氧化菌能够将Fe(Ⅱ)、Mn(Ⅱ)作为电子供体,将其氧化为Fe(Ⅲ)、Mn(Ⅲ)和Mn(Ⅳ),这类氧化态的Fe(Ⅲ)、Mn(Ⅳ)容易发生水解而生成不溶性的氧化铁与氧化锰沉淀,从而使这类细菌在铁、锰自然循环中起重要作用[10](图 1)。Mn(Ⅱ)氧化为Mn(Ⅲ)并生成锰氧化物沉淀,通常由锰氧化菌(manganese-oxidizing bacteria,MOB)的代谢活性催化,而铁氧化菌(iron- oxidizing bacteria,FeOB)能够催化Fe(Ⅱ)氧化为Fe(Ⅲ),耦合生成铁氧化物,上述铁锰氧化物具有较大的比表面积和表面正电荷,其特殊的化学和结构性质使其对重金属离子有很强的吸附和沉淀能力[11],上述铁锰氧化物能够将As、Pb、Cd、Zn等重金属结合固定到它们的结构中或吸附在它们的表面[12],从而固定环境中的重金属。典型的锰氧化菌包括海洋芽孢杆菌(Bacillus sp.)、恶臭假单胞菌(Pseudomonas putida)和松下短杆菌(Brevibacillus panacihumi),其促进了生物锰氧化物的形成[13]。而铁氧化菌在环境中广泛存在,如嗜酸氧化亚铁硫杆菌、假单胞菌、沼泽红假单胞菌和脱氮硫杆菌等[14]。上述细菌生成的铁锰氧化物对重金属具有很高的亲和力。锰氧化物与铁/锰氧化菌的代谢活动有关,也可通过Mn(Ⅱ)在铁锰氧化物表面进行非生物氧化形成。大多数锰氧化菌可通过产生与锰氧化相关的多铜氧化酶(multicopper oxidase,MCO),将可溶性Mn(Ⅱ)转化为不溶性生物锰氧化物[15]。生物锰氧化物是一类短程和纳米尺寸的锰氧化物[16-17]。Nelson等[18]通过X射线晶体学研究表明,生物铁锰氧化物主要是无定形的或结晶差的矿物。
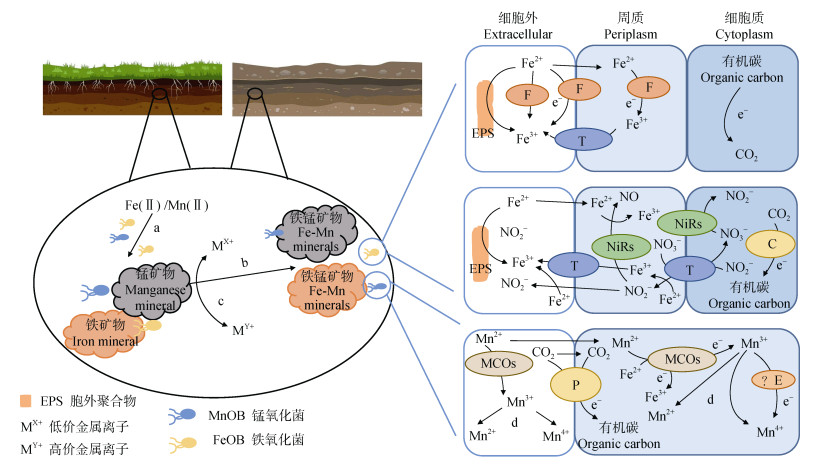
|
注:a,氧化;b,吸附/共沉淀;c,氧化还原;d,歧化;T,转运蛋白;F,铁氧化酶;C,固碳酶;NiRs,亚硝酸盐还原酶;P,固碳循环途径;?E,?酶;MCOs,多铜氧化酶。Note:a,Oxidization;b,Adsorption/co-precipitation;c,Redox reaction;d,Disproportionation;T,Transfer protein;F,Ferroxidase;C,Carbon fixation enzymes;NiRs,Nitrite reductase;P,Carbon cycle pathways;?E,? enzymes;MCOs,Multicopper oxidase. 图 1 铁/锰氧化菌诱导生物成矿[11, 15, 19] Fig. 1 The biomineralization induced by iron/manganese-oxidizing bacteria[11, 15, 19] |
土壤矿物是土壤固相的主要组成部分,约占土壤质量的95%以上。其中铁(氢)氧化物是土壤中重要的次生黏粒矿物,它们不仅具有巨大的比表面积,而且表面还拥有大量的活性官能团,对污染物有很强的界面反应能力,对重金属离子的固定能力强。已有研究[20]发现,重金属Pb、Cd、Cu、镍(Ni)、Zn、As、锑(Sb)、Cr等可被含铁矿物沉淀而稳定。铁(氢)氧化物对重金属滞留作用影响重金属的赋存形态进而影响重金属的迁移转化,可通过沉淀、络合、晶格取代等滞固Pb、Cd、As等。嗜中性铁氧化菌介导下,Fe(Ⅱ)快速氧化生成结晶度低的无定形Fe(Ⅲ)氧化物,钴(Co)、Cr、Cd、Pb、铀(U)和镭(Ra)等金属会被这种铁矿物形态快速吸附,但其在环境中处于亚稳定状态,被吸附或络合的重金属也会解吸或解离[21]。在化学或微生物作用下,无定形Fe(Ⅲ)氧化物还会转化为结晶度较高的针铁矿或赤铁矿等矿物。重金属可通过与这些矿物的晶体结构结合共沉淀或通过吸附至它们的表面而被固定[12]。Wu等[22]报道,在淹水的水稻土中,铁膜通过吸附或与铁氧化物共沉淀来固定As,从而影响根际As的生物有效性,降低As向水稻根内部的迁移。Wu等[23]研究脱氮新草螺菌(Noviherbaspirillum destinicicans HC18)氧化Fe(Ⅱ)产生的针铁矿对As(Ⅲ)的吸附氧化可达95%,而不存在菌株HC18的缺氧条件下,少于5%的As(Ⅲ)被针铁矿氧化为As(Ⅴ)。此外,在天然土壤环境中,重金属从铁(氢)氧化物上的溶解释放与二次固定通常伴随着微生物的铁还原过程。在富含铁矿物的环境中,铁还原细菌可将Fe(Ⅲ)还原为Fe(Ⅱ),从而影响土壤中重金属的形态与迁移转化[21]。
锰氧化物是环境中重要的强氧化剂,已证明可氧化As(Ⅲ)、Fe(Ⅱ)、Co(Ⅱ)、U(Ⅳ)和Cr(Ⅲ)等。Fe和Mn的氢氧化物特别是Mn的氢氧化物对Pb2+、Cd2+有很强的专性吸附能力。由于生物锰氧化物的表面积和单位面积的结合能均较高,生物锰氧化物较非生物锰氧化物吸附重金属的能力更强[17],其对铅的吸附能力是非生物锰氧化物的2倍至5倍[18]。He等[9]发现,恶臭假单胞菌(Pseudomonas putida MnB1)介导生成的锰氧化物可能通过其空位层八面体结构将As(Ⅲ)螯合固定,从而降低土壤As污染程度。Mayanna等[24]在酸性土壤环境中鉴定并表征了沙福芽孢杆菌(Bacillus safensis)、高地芽孢杆菌(Bacillus altitudinis)和短芽孢杆菌(Brevibacillus reuszeri)等六株锰氧化细菌,发现生成的不稳定结晶六方水钠锰矿有效地固定了钡(Ba)、Ni、Co、Cd、Zn和铈(Ce)。此外,锰氧化菌表面结壳的锰氧化物可能起到保护性屏障作用,使其免受有毒金属离子的危害[25]。
2 铁/锰氧化菌生物成矿在重金属污染土壤修复中的应用 2.1 铁/锰氧化菌生物成矿方式不同铁/锰氧化菌通过不同的氧化和转运机制,导致铁锰矿物与细胞之间的各种相互作用。在适宜环境条件下,不同的Fe(Ⅱ)氧化菌使用O2(需氧和微需氧Fe(Ⅱ)氧化菌)或硝酸盐/氯酸盐(厌氧Fe(Ⅱ)氧化菌)作为电子受体进行酶催化,将Fe(Ⅱ)氧化为Fe(Ⅲ),而锰氧化菌也可利用O2作为电子受体将Mn(Ⅱ)氧化为Mn(Ⅲ)。此外,重金属(As和Cd等)可能与细胞膜上的膜羟基、磷酰基、氨基等相互作用[26],并促进细胞产生酶蛋白,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽转移酶(glutathione S-transferase,GST)[27]。微生物的这些官能团、酶蛋白等使它们能通过吸附络合、共沉淀和氧化还原等方式固定/稳定土壤中的重金属。
铁/锰氧化菌可通过直接或间接途径氧化Fe(Ⅱ)和/或Mn(Ⅱ),该氧化过程有两种方式:(1)通过蛋白/酶,例如,铁氧化酶、多铜氧化酶(MCO)催化氧化Fe(Ⅱ)和/或Mn(Ⅱ)生成矿物;(2)通过改变环境因子产生相同的结果[28]。
2.1.1 通过蛋白/酶催化成矿Fe(Ⅱ)氧化蛋白/酶可直接氧化Fe(Ⅱ)。可溶性Fe(Ⅱ)游离至细胞表面,可通过扩散吸收或运输机制进入周质或结合至细胞表面,被分别位于周质或细胞表面的铁氧化酶蛋白氧化[29]。铁蛋白是一种可促进铁氧化物成核过程的铁储存蛋白,而氧化Fe(Ⅱ)的电子转移机制和蛋白/酶是多种多样的。细胞色素C4、CBB3型细胞色素氧化酶亚单位和外膜细胞色素C是表达最高的蛋白质,参与了需氧、嗜酸性亚铁氧化菌氧化Fe(Ⅱ)过程[30]。其中,外膜细胞色素c(Cyc2)是一种已知的存在于嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)的铁氧化酶[31],常被认为是与环境中重金属直接作用的电子转移蛋白[32]。另一个广泛研究的是中性厌氧铁氧化菌氧化Fe(Ⅱ)的蛋白/酶机制。紫色非硫细菌(Rhodobacter ferrooxidans SW2)通过foxEYZ编码的细胞色素c操纵Fe(Ⅱ)氧化过程[33]。Miot等[34]在厌氧硝酸盐依赖性铁氧化菌株Acidovorax sp. BoFeN1的周质内发现无定形磷酸铁沉淀,胞外聚合物可能促进磷酸铁成核或磷酸铁胶体在细胞外聚集。
蛋白/酶可间接氧化Fe(Ⅱ)。在缺氧且存在硝酸盐条件下,硝酸盐依赖型铁氧化菌氧化Fe(Ⅱ)存在不同途径[35]。首先,自养型硝酸盐还原Fe(Ⅱ)氧化菌(NRFeOx)可用Fe(Ⅱ)作为电子供体,硝酸盐作为氮源,二氧化碳作为碳源[35]。有学者报道,自养型Fe(Ⅱ)氧化细菌,如硫单胞菌属株(Thiomonas strains)[36],在固定无机碳过程中可能同时氧化Fe(Ⅱ)和As(Ⅲ)。据报道,含有亚砷酸氧化酶基因(aioA)同源物的细菌在微氧条件下能氧化As(Ⅲ)和Fe(Ⅱ)[37],表明Fe(Ⅱ)氧化过程也可能氧化As(Ⅲ),但亚砷酸氧化酶基因(aioA)是否直接或间接参与Fe(Ⅱ)氧化过程尚不确定。其次,缺氧条件下,铁氧化菌介导硝酸盐还原生成亚硝酸盐,Fe(Ⅱ)与亚硝酸盐进行非生物反应驱动Fe(Ⅱ)氧化,但该途径无酶/蛋白直接参与[38-39]。部分铁氧化菌菌株中亚硝酸盐还原酶功能性nirK基因的不表达或缺失可能导致亚硝酸盐积累,并赋予突变菌株间接氧化Fe(Ⅱ)的能力,例如Paracoccus sp. QY30菌株[11]。Wu等[23]获得了一株As(Ⅲ)和Fe(Ⅱ)氧化菌——脱氮新草螺菌(Noviherbaspirillum denitrificans HC18),发现在厌氧硝酸盐还原条件下,菌株HC18对As(Ⅲ)的固定发生在As(Ⅲ)生物氧化和Fe(Ⅱ)的非生物氧化形成Fe(Ⅲ)矿物后。第三,许多NRFeOx细菌是混合营养的,它们利用Fe(Ⅱ)作为电子供体,有机碳基质作为生长能源[39-40]。与紫硫细菌(Thiodictyon sp. strain F4)、绿细菌(Chlorobium ferrooxidans strain KoFox)、紫色非硫细菌(Rhodobacter ferrooxidans strain SW2)等菌株相对比,混合营养型硝酸盐还原铁氧化菌株Acidovorax sp. BoFeN1与铁沉淀物相关程度最大[29]。
Mn(Ⅱ)氧化酶可催化Mn(Ⅱ)进行双电子转移反应。锰氧化是双电子转移过程,锰氧化菌使用细胞表面或胞内独特的Mn(Ⅱ)氧化酶通过单电子转移直接介导Mn(Ⅱ)生成Mn(Ⅲ),随后可能歧化为Mn(Ⅱ)和Mn(Ⅳ)[41],或通过第二个电子转移反应形成Mn(Ⅳ)[15]。这两个连续的单电子步骤均为酶催化的,但这两步单电子转移反应是否为同一Mn(Ⅱ)氧化酶催化尚不能确定。Mn(Ⅱ)氧化酶包括多铜氧化酶(MCOs)和锰过氧化物酶[15]。多铜氧化酶是一种单电子氧化剂,其将单电子通过铜离子从底物转移至氧气来氧化底物[41]。研究较多的多铜氧化酶是MnxG(Bacillus sp. strain SG-1)[42]、CumA(Pseudomonas putida GB-1)[28]、CopA(Brevibacillus panacihumi MK-8)[43]和CotA(Bacillus pumilus WH4)[44]。来自芽孢杆菌属(Bacillus sp.)的Mn(Ⅱ)氧化酶MnxG是目前最具特征的氧化酶[45]。遗传证据表明,MnxG是一种与MnO2形成相关的一条单一天然凝胶蛋白带,MnxG的大尺寸和结构使其在一定程度上类似于人类的一种铁氧化酶——铜蓝蛋白[42]。此外,锰氧化酶(CotA和CopA)能在胞体外氧化Mn(Ⅱ),而MnxG从大肠杆菌(E. coli)表达载体中产生时,不能在体外氧化Mn(Ⅱ)[41, 43-44]。
2.1.2 诱导成矿作用在复杂环境中,细胞产生的蛋白质与外界干扰因素有关,重金属胁迫可使细胞产生蛋白质。(1)生物成矿过程中存在的不同矿物表面可改变成矿产物[8]。在Fe(Ⅱ)氧化过程中,不添加矿物及存在针铁矿或赤铁矿的情况下会形成针铁矿,仅磁铁矿的存在会导致除针铁矿外还生成磁铁矿,而腐殖酸和磁铁矿的添加仅会形成针铁矿而无磁铁矿[8]。这项研究表明,矿物的形成不仅取决于铁的地球化学循环,而且还可能受到其他矿物成核点的影响,这些不同矿物成核点可能引发相同的矿物相沉淀。在硝酸盐还原过程中,亚硝酸盐作为代谢中间产物出现,亚硝酸盐可非生物氧化Fe(Ⅱ),导致针铁矿、磁铁矿等矿物成核点的生长或生成亚稳定状态Fe(Ⅱ)-Fe(Ⅲ)混合价矿物相,如绿锈[8]。该亚稳矿物的形成揭示了成矿途径,即通过铁氧化菌和厌氧硝酸盐还原过程来氧化Fe(Ⅱ),生成沉淀绿锈,然后绿锈再转化为Fe(Ⅲ)或Fe(Ⅱ)–Fe(Ⅲ)矿物相[35]。亚稳矿物相的再结晶也可能促进磁铁矿等矿物的生长[46]。(2)除了矿物表面,缓冲液、氧气等也可影响成矿产物。对于Acidovorax sp. BoFeN1,研究[47]表明,不同的缓冲液(碳酸氢盐或3-吗啉丙磺酸缓冲液)和磷酸盐的存在影响了Fe(Ⅲ)矿物的矿物学特征。As的存在也可改变氧化产物的结晶度和特性,尤其是As(Ⅴ)浓度的增加会导致矿物结晶度降低,并形成由针铁矿和铁氢化物组成的矿物混合物[48]。而在矿物介质碳酸氢盐缓冲液中,其他厌氧铁氧化菌氧化Fe(Ⅱ)的最终产物会形成针铁矿[40]。Shewanella loihica PV-4和其他属于Shewanella属的菌株是典型的Mn(Ⅳ)还原菌,可利用MnO2作为厌氧呼吸的电子受体[49]。然而,它们在好氧条件具有氧化Mn(Ⅱ)的能力,这表明相同菌株在不同条件下可以可逆地驱动Mn氧化还原反应,从而诱导生成或溶解锰矿物[50]。(3)重金属浓度的变化可改变成矿产物。Xiu等[51]发现Pseudogulbenkiania sp. strain 2002在厌氧条件下能生成水铁矿-针铁矿两相铁矿物,且初始Fe/As比会导致铁砷成矿方式不同,从而影响As的固定效果。当铁锰比为1︰5时,As(42%)、Pb(6%)和Cu(1%)的去除效果最好,而有效态镉在铁锰比为5︰1时的去除率最高[52]。生物成因的水钠锰矿及其合成类似物吸附的Pb/Mn的摩尔比与比表面积之间的强正相关性,表明Pb(Ⅱ)在颗粒边缘表面显著保留[53]。
2.2 铁/锰氧化菌诱导的生物成矿过程对土壤重金属的稳定化机制铁/锰氧化菌可通过诱导铁锰氧化物沉淀固化/稳定化修复土壤重金属污染。以专性吸附形式吸附在土壤铁锰氧化物上的铁锰结合态重金属迁移性很低,相对较稳定,且相对而言不具有生物有效性。(1)固化修复主要是通过微生物产生的矿物联结土壤颗粒或增加土壤密度来固化土壤[54]。对于泥沙或粉土,除上述功能外,微生物的黏性分泌物还可在一定程度上提高土体强度。生物矿物含量越高,土体强度越高。研究人员得出,经处理土壤的无侧限抗压强度随生物矿物含量增多而呈指数增长[54-55]。细菌诱导成矿处理土壤的黏结剂含量大多在2%~10%范围内,其最大无侧限抗压强度可达16 MPa。而水泥基处理的土壤中黏结剂含量大多高于10%,但在黏结剂含量为10%~30%范围内,土壤的最大无侧限抗压强度仅达到4 MPa。细菌介导成矿抗压强度更高。经固结处理后,在0~3 MPa的无侧限抗压强度范围内,细菌介导成矿土壤的渗透性明显优于水泥基固化土壤的渗透性[56]。干湿循环和冻融循环对细菌介导成矿处理后的土壤破坏较小,细菌诱导成矿处理过的土壤在大多数情况下可使用超过50年[57],表明细菌介导成矿固化修复的土壤有较好的长期稳定性。固化体中重金属易由离子交换态和碳酸盐结合态这类生物有效性高的形态向铁锰氧化物结合态、有机结合态和残渣态转换,重金属的稳定性逐渐增加。(2)稳定化修复细菌主要通过三种形式实现:沉淀或共沉淀、吸附或络合、氧化还原反应。其中,生物沉淀和共沉淀起主要作用,因为细胞吸附、络合以及重金属氧化还原反应均伴随着沉淀生成。
2.2.1 沉淀/共沉淀重金属离子与细菌分泌的阴离子结合形成不溶性沉淀[58]。一些学者对铁/锰氧化菌通过沉淀/共沉淀这一主要途径修复重金属污染应用进行了研究(表 1)。铁氧化菌形成的铁矿物特性和形态可能受到As、硅(Si)等共存离子的影响[59-60]。例如,在矿物初始形成过程中,As的存在可将矿物形成导向为结晶性较差的无定形Fe(Ⅲ)矿物,而不是结晶性更强的针铁矿[59]。如果矿物与Si共沉淀,则该转化过程可能受到抑制,因为Si可稳定铁(氢)氧化物和针铁矿等矿物相[60]。与硝酸盐依赖型铁氧化菌产生的生物源铁矿物类似,光合铁氧化菌产生的铁矿物与环境中某物质发生反应,可通过沉淀或共沉淀过程去除环境中的重金属,这种结合是通过形成铁-金属键来介导的[35]。通过扫描透射X射线显微镜(STXM)发现,Rhodobacter ferrooxidans SW2或Rhodovulum iodosum产生的生物源铁矿物中镍优先与铁而非硅关联[61]。Dong等[62]证实了铁/锰氧化细菌能促进水稻根系铁锰膜的形成,减少Cd在根系铁膜和水稻叶片中的积累。据文献[63]报道,土壤中无定形铁氧化物通过酸碱度升高形成不溶性氢氧化物或在铁氧化物形成过程中与镉吸附共沉淀来降低土壤中镉的生物有效性。Morin等[12]发现,一种氧化亚铁硫杆菌基因型的菌株,在有足够的Fe(Ⅱ)氧化下,快速氧化Fe(Ⅱ)导致大量的As与Fe(Ⅲ)共沉淀,从而促进混合As(Ⅴ)-Fe(Ⅲ)和As(Ⅲ)-Fe(Ⅲ)氢氧化物的形成。Peng等[64]根据扫描电镜能谱分析(SEM-EDS)和X射线光电子能谱分析(XPS)推断,Mn2+被芽孢杆菌氧化并生成多孔海绵状水钠锰矿过程中,Cd被捕获并嵌入固定在锰氧化物晶格结构中,大大降低了Cd的生物有效性。在Fe(Ⅱ)-Mn(Ⅱ)-As(Ⅲ & Ⅴ)-锰氧化菌体系中,原位形成的生物锰氧化物可进一步氧化Fe(Ⅱ)和As(Ⅲ)生成FeOOH和As(Ⅴ),同时生物铁锰氧化物可通过形成双齿双核内球配合物有效固定As(Ⅴ)[65]。
|
|
表 1 铁/锰氧化菌通过沉淀/共沉淀对重金属的修复应用 Table 1 Application of heavy metal remediation by iron/manganese-oxidizing bacteria through the precipitation/coprecipitation |
细菌表面官能团和细胞周围胞外聚合物对重金属的吸附与络合是稳定重金属的第二大途径[70]。铁/锰氧化菌的成矿过程可通过吸附/络合作用机制固定或者转化重金属(表 2)。Satapute等[27]对Pseudomonas taiwanensis的研究中发现金属胁迫促进了细胞蛋白质的合成,P. taiwanensis细胞表面的官能团(羟基、羧基、磷酸盐、氨基等)与金属离子相互作用,完成了对重金属离子的吸附。有证据证明Acinetobacter sp. SZ28在以Fe(Ⅱ)和Mn(Ⅱ)作电子供体时,Cd(Ⅱ)的最大去除效率分别为80.63%和84.58%[71]。同时,镉在微生物成因锰氧化物上的吸附速率较在蒙脱石上的吸附速率快[25]。Lack等[72]研究表明,Dechlorosoma suillum strain PS在厌氧条件下,以醋酸盐、硝酸盐或氯酸盐为电子受体快速氧化Fe(Ⅱ),铀以U(Ⅵ)的形式结合至生物Fe(Ⅲ)氧化物上,并在表面形成双齿和三齿内球络合物。锰氧化菌介导生成的锰氧化物能强烈结合金属阳离子,如Zn(Ⅱ)(八面体和四面体配位)、Pb(Ⅱ)(具有立体活性电子孤对的扭曲三角锥体)和U(Ⅵ)(六角双锥体)[41],而成熟的层状锰氧化物主要是表面与重金属相互作用[73]。在Mn(Ⅱ)-Sb(Ⅲ)-锰氧化微生物体系中,生成的生物锰氧化物能够将Sb(Ⅲ)氧化为Sb(Ⅴ),并将Sb(Ⅴ)吸附至其表面[16],可能由于在锰氧化物的表面形成了内球络合物。最近的研究表明,生物铁矿物对As(Ⅴ)的吸附能力大约为化学合成水铁矿的三倍[74]。在大多数条件下,镉的吸附是一个自发过程。生物锰氧化物较低的ΔG0值表明,Cd(Ⅱ)优先吸附在生物锰氧化物上,而不是非生物合成的锰氧化物上,这是由于它们较非生物锰氧化物(二氧化锰和酸性水钠锰矿)具有更高的Cd(Ⅱ)吸附容量和更多的Cd(Ⅱ)吸附位点[75]。
|
|
表 2 铁/锰氧化菌通过吸附/络合对重金属的修复应用 Table 2 Application of heavy metal remediation by iron/manganese-oxidizing bacteria through the adsorption/complexation |
对于铁还原菌、铁氧化菌等微生物,与其代谢相关的氧化还原过程可改变剧毒重金属离子的价态,形成毒性较小的离子[3]。锰氧化细菌氧化Mn(Ⅱ)生成Mn(Ⅳ)氧化物过程中产生的酶-Mn(Ⅲ)中间体是潜在的Cr(Ⅲ)氧化剂[78]。钚(Pu)在环境中的氧化主要通过与Mn(Ⅳ)矿物的反应发生,Mn(Ⅳ)矿物可将Pu(Ⅲ)、Pu(Ⅳ)和Pu(Ⅴ)迅速氧化为Pu(Ⅵ)[79]。而在缺氧和中性pH环境中,铁的氧化还原过程在很大程度上受微生物的驱动[46],针铁矿和Fe(Ⅱ)同时存在可将As(Ⅲ)氧化为As(Ⅴ)。此外,依赖硝酸盐型铁氧化菌生成的亚硝酸盐的积累导致了Fe(Ⅱ)氧化,同时还可间接氧化U(Ⅳ),增加了U(Ⅳ)氧化的反应速率。电子转移是任何氧化还原过程的基础,而微生物和矿物之间的电子转移机制和速率仍需进一步研究。Borch等[7]表示电子转移的三种主要机制可能是通过外膜细胞色素或导电菌毛直接转移至矿物表面中心,或通过电子穿梭,或通过配体介导的增溶。这些矿物的还原溶解可能导致被固定的重金属再活化。由于不同Fe(Ⅲ)矿物的溶解度和特性不同,了解Fe(Ⅱ)氧化过程中形成的矿物特性参数对于评估重金属行为和制定修复策略非常重要,也可通过控制Fe(Ⅱ)矿物的形成过程增强铁矿物对重金属的固化稳定化去除效率。因此,对于铁还原菌、铁氧化菌、锰氧化菌等微生物对可变价重金属氧化还原能力的影响仍需进一步研究(表 3)。
|
|
表 3 铁/锰氧化菌通过氧化还原对重金属的修复应用 Table 3 Application of heavy metal remediation by iron/manganese-oxidizing bacteria through redox |
生物矿物的形成通常受到各种因素的共同作用,包括生物体与有机基质、反应条件(酸碱度、温度等)、共存离子、腐殖质与其他因素等。
3.1 胞外聚合物生物矿物中的有机基质可定义为与组分表面结合的任何有机物质,如蛋白质、磷脂、胶原和碳水化合物等。特别是细胞代谢所产生的大分子有机物——胞外聚合物(EPS),在微生物成矿过程中扮演着至关重要的角色(图 2)。EPS主要存在于细胞外部和微生物聚集体内部,它们大多具有生物吸附、螯合和络合多种有毒重金属的能力,在重金属固定和成矿方面有着不可替代的作用[82]。尽管生物成矿中微生物的重要性被普遍认可,但其形成的过程与机制尚不明确。Nouha等[83]发现在镍和锌共存下,金属去除效率随着EPS浓度的增加而增加,当EPS浓度从35 mg·L–1提高至50 mg·L–1时,镍和锌的去除效率分别从80%和56%提高至85% 和65%,这可能是由于随着胞外聚合物浓度的增加,可用于金属离子的结合位点的数量也增加。Miot等[34]描述了铁细菌BoFeN1通过氧化Fe(Ⅱ)形成不同的Fe(Ⅲ)矿物,并发现胞外沉淀与富含EPS的细丝有关,可能是胞外多糖诱导的磷酸铁胶体聚集的结果。在生物成矿过程中,大量有机基质参与无机材料的形成,控制无机晶体的成核、生长、结晶形式和趋势,该过程也叫分子识别。大分子也在引发成核和晶体生长中起指导作用。不同种类微生物代谢产生的矿物类型也不尽相同,例如铁氧化菌氧化Fe(Ⅱ)所形成的铁(氢)氧化物包括无定形铁氢氧化物、水铁矿、针铁矿、纤铁矿、菱铁矿、磁铁矿、绿锈等。
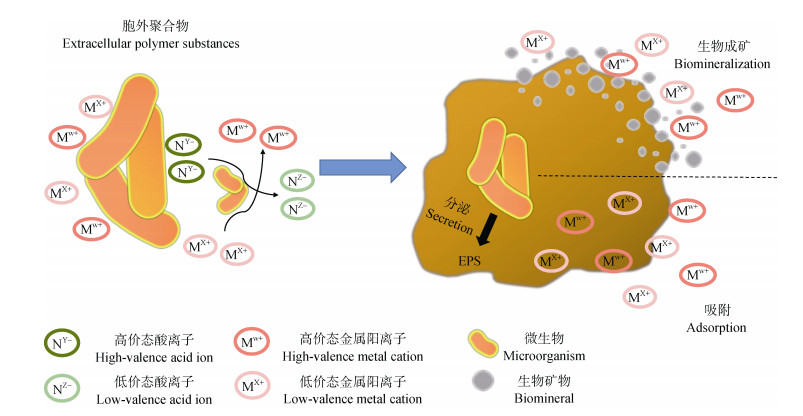
|
图 2 胞外聚合物(EPS)在生物成矿过程中的作用[34, 82-83] Fig. 2 The role of extracellular polymeric substances(EPS) in the biomineralization[34, 82-83] |
温度是影响生物成矿反应过程的重要因素。通常,温度对生物成矿的影响因微生物而异,而且温度和酸碱度的影响通常会有协同作用。pH的升高会影响菌株的生长和重金属离子的沉淀。酸性条件不利于Mn(Ⅱ)的氧化,而Fe(Ⅲ)在碱性条件下易形成铁(氢)氧化物沉淀[25]。Fe(Ⅱ)生物氧化常见于pH较低的环境中,在该环境中,生物氧化较化学氧化更有利。在中性pH的环境下中,需氧铁氧化菌必须与Fe(Ⅱ)的快速化学氧化竞争,光营养和硝酸盐依赖型Fe(Ⅱ)氧化菌在中性、缺氧环境中介导Fe(Ⅱ)氧化,而生成的亚硝酸盐又可作为Fe(Ⅱ)的化学氧化剂[39]。据文献报道,在嗜酸性铁氧化菌A. ferrooxidans的生物成矿过程中,所生成的最终矿物相会因环境的pH条件而发生改变。当pH介于2.5~4.5时,次生矿物的最终矿相以施威特曼石为主;而在pH低于2.5时,生成的施威特曼石不稳定,容易向黄钾铁矾转化;当pH大于4.5时,最终矿相则多为针铁矿或水铁矿[84-85]。此外,微生物在适宜温度和酸碱度环境中具有较强的活性,其代谢和酶活性较强,从而能促进生物成矿反应过程[86]。
3.3 共存离子反应体系中存在的各种离子、腐殖质以及其他因素也是影响生物成矿多样性和复杂性的重要因素之一(图 3)。在嗜酸性铁氧化菌A. ferrooxidans生物成矿的相关研究中,有研究[87]报道,SO42–是铁氧化菌生长代谢所必须的离子,而相反Cl–、NO3–可能会对细菌的生长代谢及亚铁的氧化过程起一定的抑制效果。而对于嗜中性的铁氧化菌而言,一些厌氧硝酸依赖铁氧化菌的作用与环境介质中的NO3–浓度密切相关,这类细菌通过将亚铁的氧化和硝酸盐的还原耦合,从中得到自身生长代谢所需能量,并可能产生多种类型的铁(氢)氧化物。而产生的铁氧化物和硝酸盐共存时,可能通过铁循环将被还原的U(Ⅳ)再次氧化为U(Ⅵ),从而抑制了U(Ⅵ)的生物成矿[88]。Newsome等[89]推测氮、硫和铁氧化还原循环的反硝化细菌能够通过消耗有机物(例如来自生物质或自身代谢活动的有机物)产生硝酸盐还原中间体来氧化U(Ⅵ)和Fe(Ⅱ)。Wei等[90]发现K+、Na+和Mg2+的共存略微促进苏云金芽孢杆菌(Bacillus thuringiensis 016)对U(Ⅵ)的细胞内生物成矿,相反Fe3+和CO32–明显抑制胞外生物吸附。
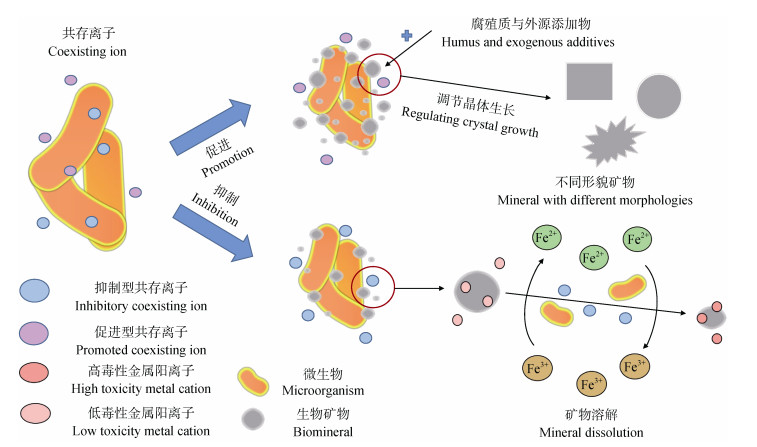
|
图 3 共存离子与腐殖质等其他因素在生物成矿过程中的作用[86-96] Fig. 3 The role of coexisting ions and other factors in the biomineralization process[86-96] |
腐殖质作为天然有机质,是微生物生长的重要营养物质,主要由腐殖酸、黄腐酸和胡敏素等组成[91]。腐殖酸和黄腐酸等有机质能与重金属离子结合形成稳定的配体络合物,大大降低了重金属离子的生物可利用性[92],或通过吸附至矿物表面,进一步影响铁/锰氧化菌生物成矿过程,通常导致较少的结晶矿物形成[93](图 3)。在颗粒状腐殖酸存在下,As(Ⅲ)与有机单硫化物的结合增强,可有效地捕获As(Ⅲ)并降低其生物可利用性和毒性[94]。一些研究报道腐殖酸和黄腐酸对铀磷酸盐矿物的形成无明显的促进或抑制,腐殖酸和黄腐酸的存在仅仅影响了这些矿物的微观结构,使其矿物形态从小颗粒增加变化至层状堆积结构[86, 95]。此外,一些其他外源物质的添加也会影响细菌的生物成矿过程。Gebauer[96]报道,含不溶性和可溶性有机物的添加剂能够为成矿提供非均相成核位点,通过其吸附调节晶体生长。
4 展望生物成矿研究的发展使其在土壤重金属固化/稳定化修复方面成为一个有前途的可持续解决方案。不同铁/锰氧化菌诱导生物成矿形成的矿物类型、晶体结构等性质显著不同,在一定条件下,铁锰矿物还可进行二次成矿,耦合和固定更多的重金属。不同晶型的矿物固定重金属及促使重金属价态变化的机制更为复杂,未来研究可进一步聚焦:(1)矿物稳定重金属的长效性研究:固化/稳定化之后的重金属可能重新活化、随环境条件变化等重新溶出,未来的研究可提高生成矿物的晶格稳定性和抗侵蚀性;(2)复合菌效果研究:铁/锰氧化菌的成矿方式类似,两种类别菌株复合对As、Cr、Cd等重金属是否存在协同效果;(3)研究生物成矿在场地土壤复合重金属污染的修复应用:大多数关于重金属铁锰(氢)氧化物生物成矿的研究是在实验室、水溶液条件及针对单一重金属的探讨,实际的土壤污染通常是多种金属的复合污染,且不同土壤的理化性质存在较大差异,因此,亟需研究生物成矿对实际污染场地多种重金属复合污染的修复机制及应用。
| [1] |
Bhunia B, Prasad Uday U S, Oinam G, et al. Characterization, genetic regulation and production of Cyanobacterial exopolysaccharides and its applicability for heavy metal removal[J]. Carbohydrate Polymers, 2018, 179: 228-243. DOI:10.1016/j.carbpol.2017.09.091
(  0) 0) |
| [2] |
Luo X, Jiang X, Xue S, et al. Arsenic biomineralization by iron oxidizing strain(Ochrobactrum sp.) isolated from a paddy soil in Hunan, China[J]. Land Degradation & Development, 2020, 32(6): 2082-2093.
(  0) 0) |
| [3] |
Maity J P, Chen G S, Huang Y H, et al. Ecofriendly heavy metal stabilization: Microbial induced mineral precipitation(MIMP) and biomineralization for heavy metals within the contaminated soil by indigenous bacteria[J]. Geomicrobiology Journal, 2019, 36(7): 612-623. DOI:10.1080/01490451.2019.1597216
(  0) 0) |
| [4] |
Gupta A, Joia J. Microbes as potential tool for remediation of heavy metals: A review[J]. Journal of Microbial & Biochemical Technology, 2016, 8(4): 364-372.
(  0) 0) |
| [5] |
Addadi L, Weiner S. Biomineralization: Mineral formation by organisms[J]. Physica Scripta, 2014, 89(9): 98003. DOI:10.1088/0031-8949/89/9/098003
(  0) 0) |
| [6] |
Li M, Cheng X, Guo H. Heavy metal removal by biomineralization of urease producing bacteria isolated from soil[J]. International Biodeterioration & Biodegradation, 2013, 76: 81-85.
(  0) 0) |
| [7] |
Borch T, Kretzschmar R, Kappler A, et al. Biogeochemical redox processes and their impact on contaminant dynamics[J]. Environmental Science & Technology, 2010, 44(1): 15-23.
(  0) 0) |
| [8] |
Dippon U, Pantke C, Porsch K, et al. Potential function of added minerals as nucleation sites and effect of humic substances on mineral formation by the nitrate-reducing Fe(Ⅱ)-oxidizer Acidovorax sp. BoFeN1[J]. Environmental Science & Technology, 2012, 46(12): 6556-6565.
(  0) 0) |
| [9] |
He Z, Li Z, Zhang Q, et al. Simultaneous remediation of As(Ⅲ) and dibutyl phthalate(DBP) in soil by a manganese-oxidizing bacterium and its mechanisms[J]. Chemosphere, 2019, 220: 837-844. DOI:10.1016/j.chemosphere.2018.12.213
(  0) 0) |
| [10] |
Chen H, Lei J, Tong H, et al. Effects of Mn(Ⅱ) on the oxidation of Fe in soils and the uptake of cadmium by rice(Oryza sativa)[J]. Water, Air, & Soil Pollution, 2019, 230(8): 1-13.
(  0) 0) |
| [11] |
Zhang J, Chai C W, ThomasArrigo L K, et al. Nitrite accumulation is required for microbial anaerobic iron oxidation, but not for arsenite oxidation, in two heterotrophic denitrifiers[J]. Environmental Science & Technology, 2020, 54(7): 4036-4045.
(  0) 0) |
| [12] |
Morin G, Juillot F, Casiot C, et al. Bacterial formation of tooeleite and mixed arsenic(Ⅲ) or arsenic(Ⅴ)-iron(Ⅲ) gels in the Carnoulès acid mine drainage, France. A XANES, XRD, and SEM study[J]. Environmental Science & Technology, 2003, 37(9): 1705-1712.
(  0) 0) |
| [13] |
Wang Y N, Tsang Y F, Wang H, et al. Effective stabilization of arsenic in contaminated soils with biogenic manganese oxide(BMO) materials[J]. Environmental Pollution, 2020, 258: 113481. DOI:10.1016/j.envpol.2019.113481
(  0) 0) |
| [14] |
Hedrich S, Schlömann M, Johnson D B. The iron-oxidizing proteobacteria[J]. Microbiology, 2011, 157(6): 1551-1564. DOI:10.1099/mic.0.045344-0
(  0) 0) |
| [15] |
Butterfield C N, Soldatova A V, Lee S W, et al. Mn(Ⅱ, Ⅲ) oxidation and MnO2 mineralization by an expressed bacterial multicopper oxidase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(29): 11731-11735. DOI:10.1073/pnas.1303677110
(  0) 0) |
| [16] |
Bai Y, Jefferson W A, Liang J, et al. Antimony oxidation and adsorption by in-situ formed biogenic Mn oxide and Fe-Mn oxides[J]. Journal of Environmental Sciences, 2017, 54: 126-134. DOI:10.1016/j.jes.2016.05.026
(  0) 0) |
| [17] |
Meng Y T, Zheng Y M, Zhang L M, et al. Biogenic Mn oxides for effective adsorption of Cd from aquatic environment[J]. Environmental Pollution, 2009, 157(8/9): 2577-2583.
(  0) 0) |
| [18] |
Nelson Y M, Lion L W, Shuler M L, et al. Effect of oxide formation mechanisms on lead adsorption by biogenic manganese(hydr)oxides, iron(hydr)oxides, and their mixtures[J]. Environmental Science & Technology, 2002, 36(3): 421-425.
(  0) 0) |
| [19] |
Klueglein N, Zeitvogel F, Stierhof Y, et al. Potential role of nitrite for abiotic Fe(Ⅱ) oxidation and cell encrustation during nitrate reduction by denitrifying bacteria[J]. Applied and Environmental Microbiology, 2014, 80(3): 1051-1061. DOI:10.1128/AEM.03277-13
(  0) 0) |
| [20] |
Yeongkyoo K. Effects of different oxyanions in solution on the precipitation of jarosite at room temperature[J]. Journal of Hazardous Materials, 2018, 353: 118-126. DOI:10.1016/j.jhazmat.2018.04.016
(  0) 0) |
| [21] |
Qian Z Y, Wu C, He X, et al. Study on the influence of iron redox cycling microorganisms on heavy metals in the environment (In Chinese)[J]. Environmental Chemistry, 2021, 40(3): 834-850. [钱子妍, 吴川, 何璇, 等. 铁循环微生物对环境中重金属的影响研究进展[J]. 环境化学, 2021, 40(3): 834-850.]
(  0) 0) |
| [22] |
Wu C, Zou Q, Xue S, et al. Effects of silicon(Si) on arsenic(As) accumulation and speciation in rice(Oryza sativa L.) genotypes with different radial oxygen loss(ROL)[J]. Chemosphere, 2015, 138: 447-453. DOI:10.1016/j.chemosphere.2015.06.081
(  0) 0) |
| [23] |
Wu Y, Chai C, Li Y, et al. Anaerobic As(Ⅲ) oxidation coupled with nitrate reduction and attenuation of dissolved arsenic by Noviherbaspirillum species[J]. ACS Earth and Space Chemistry, 2021, 5(8): 2115-2123. DOI:10.1021/acsearthspacechem.1c00155
(  0) 0) |
| [24] |
Mayanna S, Peacock C L, Schäffner F, et al. Biogenic precipitation of manganese oxides and enrichment of heavy metals at acidic soil pH[J]. Chemical Geology, 2015, 402: 6-17. DOI:10.1016/j.chemgeo.2015.02.029
(  0) 0) |
| [25] |
Akob D M, Bohu T, Beyer A, et al. Identification of Mn(Ⅱ)-oxidizing bacteria from a low-pH contaminated former uranium mine[J]. Applied and Environmental Microbiology, 2014, 80(16): 5086-5097. DOI:10.1128/AEM.01296-14
(  0) 0) |
| [26] |
Raja C E, Anbazhagan K, Selvam G S. Isolation and characterization of a metal-resistant Pseudomonas aeruginosa strain[J]. World Journal of Microbiology & Biotechnology, 2006, 22(6): 577-585.
(  0) 0) |
| [27] |
Satapute P, Paidi M K, Kurjogi M, et al. Physiological adaptation and spectral annotation of arsenic and cadmium heavy metal-resistant and susceptible strain Pseudomonas taiwanensis[J]. Environmental Pollution, 2019, 251: 555-563. DOI:10.1016/j.envpol.2019.05.054
(  0) 0) |
| [28] |
Brouwers G J, Vijgenboom E, Corstjens P L A M, et al. Bacterial Mn2+ oxidizing systems and multicopper oxidases: An overview of mechanisms and functions[J]. Geomicrobiology Journal, 2000, 17(1): 1-24. DOI:10.1080/014904500270459
(  0) 0) |
| [29] |
Schädler S, Burkhardt C, Hegler F, et al. Formation of cell-iron-mineral aggregates by phototrophic and nitrate-reducing anaerobic Fe(Ⅱ)-oxidizing bacteria[J]. Geomicrobiology Journal, 2009, 26(2): 93-103. DOI:10.1080/01490450802660573
(  0) 0) |
| [30] |
Barco R A, Emerson D, Sylvan J B, et al. New insight into microbial iron oxidation as revealed by the proteomic profile of an obligate iron-oxidizing chemolithoautotroph[J]. Applied and Environmental Microbiology, 2015, 81(17): 5927-5937. DOI:10.1128/AEM.01374-15
(  0) 0) |
| [31] |
Yarzábal A, Brasseur G, Ratouchniak J, et al. The high-molecular-weight cytochrome c Cyc2 of Acidithiobacillus ferrooxidans is an outer membrane protein[J]. Journal of Bacteriology, 2002, 184(1): 313-317. DOI:10.1128/JB.184.1.313-317.2002
(  0) 0) |
| [32] |
Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: Anaerobic microbial iron oxidation and reduction[J]. Nature Reviews. Microbiology, 2006, 4(10): 752-764. DOI:10.1038/nrmicro1490
(  0) 0) |
| [33] |
Croal L R, Jiao Y, Newman D K. The fox operon from Rhodobacter strain SW2 promotes phototrophic Fe(Ⅱ) oxidation in Rhodobacter capsulatus SB1003[J]. Journal of Bacteriology, 2007, 189(5): 1774-1782. DOI:10.1128/JB.01395-06
(  0) 0) |
| [34] |
Miot J, Benzerara K, Morin G, et al. Iron biomineralization by anaerobic neutrophilic iron-oxidizing bacteria[J]. Geochimica et Cosmochimica Acta, 2009, 73(3): 696-711. DOI:10.1016/j.gca.2008.10.033
(  0) 0) |
| [35] |
Bryce C, Blackwell N, Schmidt C, et al. Microbial anaerobic Fe(Ⅱ) oxidation - Ecology, mechanisms and environmental implications[J]. Environmental Microbiology, 2018, 20(10): 3462-3483. DOI:10.1111/1462-2920.14328
(  0) 0) |
| [36] |
Bryan C G, Marchal M, Battaglia-Brunet F, et al. Carbon and arsenic metabolism in Thiomonas strains: Differences revealed diverse adaptation processes[J]. BMC Microbiology, 2009, 9: 127. DOI:10.1186/1471-2180-9-127
(  0) 0) |
| [37] |
Zhang S Y, Zhao F J, Sun G X, et al. Diversity and abundance of arsenic biotransformation genes in paddy soils from Southern China[J]. Environmental Science & Technology, 2015, 49(7): 4138-4146.
(  0) 0) |
| [38] |
Klueglein N, Kappler A. Abiotic oxidation of Fe(Ⅱ) by reactive nitrogen species in cultures of the nitrate-reducing Fe(Ⅱ) oxidizer Acidovorax sp. BoFeN1 - questioning the existence of enzymatic Fe(Ⅱ) oxidation[J]. Geobiology, 2013, 11(2): 180-190. DOI:10.1111/gbi.12019
(  0) 0) |
| [39] |
Carlson H K, Clark I C, Blazewicz S J, et al. Fe(Ⅱ) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions[J]. Journal of Bacteriology, 2013, 195(14): 3260-3268. DOI:10.1128/JB.00058-13
(  0) 0) |
| [40] |
Kappler A, Newman D K. Formation of Fe(Ⅲ)-minerals by Fe(Ⅱ)-oxidizing photoautotrophic bacteria[J]. Geochimica et Cosmochimica Acta, 2004, 68(6): 1217-1226. DOI:10.1016/j.gca.2003.09.006
(  0) 0) |
| [41] |
Tebo B M, Bargar J R, Clement B G, et al. Biogenic manganese oxides: Properties and mechanisms of formation[J]. Annual review of earth and planetary sciences, 2004, 32(1): 287-328. DOI:10.1146/annurev.earth.32.101802.120213
(  0) 0) |
| [42] |
Dick G J, Torpey J W, Beveridge T J, et al. Direct identification of a bacterial manganese(Ⅱ) oxidase, the multicopper oxidase MnxG, from spores of several different marine Bacillus species[J]. Applied and Environmental Microbiology, 2008, 74(5): 1527-1534. DOI:10.1128/AEM.01240-07
(  0) 0) |
| [43] |
Zeng X, Zhang M, Liu Y, et al. Manganese(Ⅱ) oxidation by the multi-copper oxidase CopA from Brevibacillus panacihumi MK-8[J]. Enzyme and Microbial Technology, 2018, 117: 79-83. DOI:10.1016/j.enzmictec.2018.04.011
(  0) 0) |
| [44] |
Su J, Bao P, Bai T, et al. CotA, a multicopper oxidase from Bacillus pumilus WH4, exhibits manganese-oxidase activity[J]. PLoS One, 2013, 8(4): e60573. DOI:10.1371/journal.pone.0060573
(  0) 0) |
| [45] |
Geszvain K, Butterfield C, Davis R E, et al. The molecular biogeochemistry of manganese(Ⅱ) oxidation[J]. Biochemical Society Transactions, 2012, 40(6): 1244-1248. DOI:10.1042/BST20120229
(  0) 0) |
| [46] |
Kappler A, Schink B, Newman D K. Fe(Ⅲ) mineral formation and cell encrustation by the nitrate-dependent Fe(Ⅱ)-oxidizer strain BoFeN1[J]. Geobiology, 2005, 3(4): 235-245. DOI:10.1111/j.1472-4669.2006.00056.x
(  0) 0) |
| [47] |
Larese-Casanova P, Haderlein S B, Kappler A. Biomineralization of lepidocrocite and goethite by nitrate-reducing Fe(Ⅱ)-oxidizing bacteria: Effect of pH, bicarbonate, phosphate, and humic acids[J]. Geochimica et Cosmochimica Acta, 2010, 74(13): 3721-3734. DOI:10.1016/j.gca.2010.03.037
(  0) 0) |
| [48] |
Hohmann C, Winkler E, Morin G, et al. Anaerobic Fe(Ⅱ)-oxidizing bacteria show as resistance and immobilize as during Fe(Ⅲ) mineral precipitation[J]. Environmental Science & Technology, 2010, 44(1): 94-101.
(  0) 0) |
| [49] |
Wright M H, Farooqui S M, White A R, et al. Production of manganese oxide nanoparticles by Shewanella species[J]. Applied and Environmental Microbiology, 2016, 82(17): 5402-5409. DOI:10.1128/AEM.00663-16
(  0) 0) |
| [50] |
Zhou H, Fu C. Manganese-oxidizing microbes and biogenic manganese oxides: Characterization, Mn(Ⅱ) oxidation mechanism and environmental relevance[J]. Reviews in Environmental Science and Biotechnology, 2020, 19(3): 489-507. DOI:10.1007/s11157-020-09541-1
(  0) 0) |
| [51] |
Xiu W, Yu X, Guo H, et al. Facilitated arsenic immobilization by biogenic ferrihydrite-goethite biphasic Fe(Ⅲ) minerals(Fh-Gt Bio-bi-minerals)[J]. Chemosphere, 2019, 225: 755-764. DOI:10.1016/j.chemosphere.2019.02.098
(  0) 0) |
| [52] |
Liu M B, Wang S L, Yang M, et al. Experimental study on treatment of heavy metal-contaminated soil by manganese-oxidizing bacteria[J]. Environmental Science and Pollution Research, 2022, 29(4): 5526-5540. DOI:10.1007/s11356-021-15475-0
(  0) 0) |
| [53] |
Villalobos M, Bargar J, Sposito G. Mechanisms of Pb(Ⅱ) sorption on a biogenic manganese oxide[J]. Environmental Science & Technology, 2005, 39(2): 569-576.
(  0) 0) |
| [54] |
Cui M J, Zheng J J, Zhang R J, et al. Influence of cementation level on the strength behaviour of bio-cemented sand[J]. Acta Geotechnica, 2017, 12(5): 971-986. DOI:10.1007/s11440-017-0574-9
(  0) 0) |
| [55] |
Mahawish A, Bouazza A, Gates W P. Unconfined compressive strength and visualization of the microstructure of coarse sand subjected to different biocementation levels[J]. Journal of Geotechnical and Geoenvironmental Engineering, 2019, 145(8): 04019033. DOI:10.1061/(ASCE)GT.1943-5606.0002066
(  0) 0) |
| [56] |
Kogbara R B, Al-Tabbaa A, Yi Y, et al. Cement-fly ash stabilisation/solidification of contaminated soil: Performance properties and initiation of operating envelopes[J]. Applied Geochemistry, 2013, 33: 64-75. DOI:10.1016/j.apgeochem.2013.02.001
(  0) 0) |
| [57] |
Skurtveit E, Torabi A, Alikarami R, et al. Fault baffle to conduit developments: Reactivation and calcite cementation of deformation band fault in aeolian sandstone[J]. Petroleum Geoscience, 2015, 21(1): 3-16. DOI:10.1144/petgeo2014-031
(  0) 0) |
| [58] |
Zhao X, Do H, Zhou Y, et al. Rahnella sp. LRP3 induces phosphate precipitation of Cu(Ⅱ) and its role in copper-contaminated soil remediation[J]. Journal of Hazardous Materials, 2019, 368: 133-140. DOI:10.1016/j.jhazmat.2019.01.029
(  0) 0) |
| [59] |
Kleinert S, Muehe E M, Posth N R, et al. Biogenic Fe(Ⅲ) minerals lower the efficiency of iron-mineral-based commercial filter systems for arsenic removal[J]. Environmental Science & Technology, 2011, 45(17): 7533-7541.
(  0) 0) |
| [60] |
Picard A, Obst M, Schmid G, et al. Limited influence of Si on the preservation of Fe mineral-encrusted microbial cells during experimental diagenesis[J]. Geobiology, 2016, 14(3): 276-292. DOI:10.1111/gbi.12171
(  0) 0) |
| [61] |
Eickhoff M, Obst M, Schröder C, et al. Nickel partitioning in biogenic and abiogenic ferrihydrite: The influence of silica and implications for ancient environments[J]. Geochimica et Cosmochimica Acta, 2014, 140: 65-79. DOI:10.1016/j.gca.2014.05.021
(  0) 0) |
| [62] |
Dong M F, Feng R W, Wang R G, et al. Inoculation of Fe/Mn-oxidizing bacteria enhances Fe/Mn plaque formation and reduces Cd and As accumulation in rice plant tissues[J]. Plant and Soil, 2016, 404(1/2): 75-83.
(  0) 0) |
| [63] |
Lin J, Sun M, Su B, et al. Immobilization of cadmium in polluted soils by phytogenic iron oxide nanoparticles[J]. Science of the Total Environment, 2019, 659: 491-498. DOI:10.1016/j.scitotenv.2018.12.391
(  0) 0) |
| [64] |
Peng L, Deng X, Song H, et al. Manganese enhances the immobilization of trace cadmium from irrigation water in biological soil crust[J]. Ecotoxicology and Environmental Safety, 2019, 168: 369-377. DOI:10.1016/j.ecoenv.2018.10.087
(  0) 0) |
| [65] |
Bai Y, Yang T, Liang J, et al. The role of biogenic Fe-Mn oxides formed in situ for arsenic oxidation and adsorption in aquatic ecosystems[J]. Water Research, 2016, 98: 119-127. DOI:10.1016/j.watres.2016.03.068
(  0) 0) |
| [66] |
Caspi R, Tebo B M, Haygood M G. C-type cytochromes and manganese oxidation in Pseudomonas putida MnB1[J]. Applied and Environmental Microbiology, 1998, 64(10): 3549-3555. DOI:10.1128/AEM.64.10.3549-3555.1998
(  0) 0) |
| [67] |
Johnson H A, Tebo B M. In vitro studies indicate a quinone is involved in bacterial Mn(Ⅱ) oxidation[J]. Archives of Microbiology, 2008, 189(1): 59-69.
(  0) 0) |
| [68] |
Quatrini R, Appia-Ayme C, Denis Y, et al. Extending the models for iron and sulfur oxidation in the extreme acidophile Acidithiobacillus ferrooxidans[J]. BMC Genomics, 2009, 10: 394. DOI:10.1186/1471-2164-10-394
(  0) 0) |
| [69] |
Zhou N N, Bai Y H, Liang J S, et al. Characterization of manganese oxidation by Pseudomonas sp.QJX-1 (In Chinese)[J]. Environmental Science, 2004, 35(2): 740-745. [周娜娜, 柏耀辉, 梁金松, 等. Pseudomonas sp.QJX-1的锰氧化特性研究[J]. 环境科学, 2004, 35(2): 740-745.]
(  0) 0) |
| [70] |
Teng Z, Shao W, Zhang K, et al. Enhanced passivation of lead with immobilized phosphate solubilizing bacteria beads loaded with biochar/ nanoscale zero valent iron composite[J]. Journal of Hazardous Materials, 2020, 384: 121505. DOI:10.1016/j.jhazmat.2019.121505
(  0) 0) |
| [71] |
Su J F, Gao C Y, Huang T L, et al. Characterization of the Cd(Ⅱ) and nitrate removal by bacterium Acinetobacter sp. SZ28 under different electron donor conditions[J]. Environmental Science and Pollution Research, 2019, 26(13): 12698-12708. DOI:10.1007/s11356-019-04770-6
(  0) 0) |
| [72] |
Lack J G, Chaudhuri S K, Kelly S D, et al. Immobilization of radionuclides and heavy metals through anaerobic bio-oxidation of Fe(Ⅱ)[J]. Applied and Environmental Microbiology, 2002, 68(6): 2704-2710. DOI:10.1128/AEM.68.6.2704-2710.2002
(  0) 0) |
| [73] |
Manning B A, Fendorf S E, Bostick B, et al. Arsenic(Ⅲ) oxidation and arsenic (Ⅴ) adsorption reactions on synthetic birnessite[J]. Environmental Science & Technology, 2002, 36(5): 976-981.
(  0) 0) |
| [74] |
Sowers T D, Harrington J M, Polizzotto M L, et al. Sorption of arsenic to biogenic iron(oxyhydr) oxides produced in circumneutral environments[J]. Geochimica et Cosmochimica Acta, 2017, 198: 194-207. DOI:10.1016/j.gca.2016.10.049
(  0) 0) |
| [75] |
Wang M, Xu Z, Dong B, et al. An efficient manganese-oxidizing fungus Cladosporium halotolerans strain XM01:Mn(Ⅱ) oxidization and Cd adsorption behavior[J]. Chemosphere, 2022, 287: 132026. DOI:10.1016/j.chemosphere.2021.132026
(  0) 0) |
| [76] |
Pishchik V N, Vorob'Ev N I, Provorov N A. Experimental and mathematical simulation of population dynamics of rhizospheric bacteria under conditions of cadmium stress[J]. Microbiology, 2005, 74(6): 735-740. DOI:10.1007/s11021-005-0132-6
(  0) 0) |
| [77] |
Su J F, Zheng S C, Huang T L, et al. Characterization of the anaerobic denitrification bacterium Acinetobacter sp. SZ28 and its application for groundwater treatment[J]. Bioresource Technology, 2015, 192: 654-659. DOI:10.1016/j.biortech.2015.06.020
(  0) 0) |
| [78] |
Murray K J, Tebo B M. Cr(Ⅲ) is indirectly oxidized by the Mn(Ⅱ)-oxidizing bacterium Bacillus sp. strain SG-1[J]. Environmental Science & Technology, 2007, 41(2): 528-533.
(  0) 0) |
| [79] |
Icopini G A, Lack J G, Hersman L E, et al. Plutonium(Ⅴ/Ⅵ) reduction by the metal-reducing bacteria geobacter metallireducens GS-15 and Shewanella oneidensis MR-1[J]. Applied and Environmental Microbiology, 2009, 75(11): 3641-3647. DOI:10.1128/AEM.00022-09
(  0) 0) |
| [80] |
Geszvain K, Smesrud L, Tebo B M. Identification of a third Mn(Ⅱ) oxidase enzyme in Pseudomonas putida GB-1[J]. Applied and Environmental Microbiology, 2016, 82(13): 3774-3782. DOI:10.1128/AEM.00046-16
(  0) 0) |
| [81] |
Murray K J, Mozafarzadeh M L, Tebo B M. Cr(Ⅲ) oxidation and Cr toxicity in cultures of the manganese(Ⅱ)-oxidizing Pseudomonas putida strain GB-1[J]. Geomicrobiology Journal, 2005, 22(3/4): 151-159.
(  0) 0) |
| [82] |
Li W W, Yu H Q. Insight into the roles of microbial extracellular polymer substances in metal biosorption[J]. Bioresource Technology, 2014, 160: 15-23. DOI:10.1016/j.biortech.2013.11.074
(  0) 0) |
| [83] |
Nouha K, Kumar R S, Tyagi R D. Heavy metals removal from wastewater using extracellular polymeric substances produced by Cloacibacterium normanense in wastewater sludge supplemented with crude glycerol and study of extracellular polymeric substances extraction by different methods[J]. Bioresource Technology, 2016, 212: 120-129. DOI:10.1016/j.biortech.2016.04.021
(  0) 0) |
| [84] |
Daoud J, Karamanev D. Formation of jarosite during Fe2+ oxidation by Acidithiobacillus ferrooxidans[J]. Minerals Engineering, 2006, 19(9): 960-967. DOI:10.1016/j.mineng.2005.10.024
(  0) 0) |
| [85] |
Burton E D, Bush R T, Sullivan L A. Sedimentary iron geochemistry in acidic waterways associated with coastal lowland acid sulfate soils[J]. Geochimica et Cosmochimica Acta, 2006, 70(22): 5455-5468. DOI:10.1016/j.gca.2006.08.016
(  0) 0) |
| [86] |
Jiang L, Liu X, Yin H, et al. The utilization of biomineralization technique based on microbial induced phosphate precipitation in remediation of potentially toxic ions contaminated soil: A mini review[J]. Ecotoxicology and Environmental Safety, 2020, 191: 110009. DOI:10.1016/j.ecoenv.2019.110009
(  0) 0) |
| [87] |
Gu X, Wong J W C. Identification of inhibitory substances affecting bioleaching of heavy metals from anaerobically digested sewage sludge[J]. Environmental Science & Technology, 2004, 38(10): 2934-2939.
(  0) 0) |
| [88] |
Zhang J, Song H, Deng H, et al. Research progress on interaction between uranium and microorganism (In Chinese)[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2018, 37(1): 55. [张健, 宋晗, 邓洪, 等. 铀与微生物相互作用研究进展[J]. 矿物岩石地球化学通报, 2018, 37(1): 55.]
(  0) 0) |
| [89] |
Newsome L, Morris K, Shaw S, et al. The stability of microbially reduced U(Ⅳ); impact of residual electron donor and sediment ageing[J]. Chemical Geology, 2015, 409: 125-135. DOI:10.1016/j.chemgeo.2015.05.016
(  0) 0) |
| [90] |
Wei Y, Chen Z, Song H, et al. The immobilization mechanism of U(Ⅵ) induced by Bacillus thuringiensis 016 and the effects of coexisting ions[J]. Biochemical Engineering Journal, 2019, 144: 57-63. DOI:10.1016/j.bej.2019.01.013
(  0) 0) |
| [91] |
Zhang D, Chen X, Larson S L, et al. Uranium biomineralization with phosphate—biogeochemical process and its application[J]. ACS Earth and Space Chemistry, 2020, 4(12): 2205-2214. DOI:10.1021/acsearthspacechem.0c00252
(  0) 0) |
| [92] |
Boiteau R M, Shaw J B, Pasa-Tolic L, et al. Micronutrient metal speciation is controlled by competitive organic chelation in grassland soils[J]. Soil Biology and Biochemistry, 2018, 120: 283-291. DOI:10.1016/j.soilbio.2018.02.018
(  0) 0) |
| [93] |
Jones A M, Collins R N, Rose J, et al. The effect of silica and natural organic matter on the Fe(Ⅱ)-catalysed transformation and reactivity of Fe(Ⅲ) minerals[J]. Geochimica et Cosmochimica Acta, 2009, 73: 4409-4422. DOI:10.1016/j.gca.2009.04.025
(  0) 0) |
| [94] |
Hoffmann M, Mikutta C, Kretzschmar R. Bisulfide reaction with natural organic matter enhances arsenite sorption: Insights from X-ray absorption spectroscopy[J]. Environmental Science & Technology, 2012, 46(21): 11788-11797.
(  0) 0) |
| [95] |
Tu H, Lan T, Yuan G, et al. The influence of humic substances on uranium biomineralization induced by Bacillus sp. dwc-2[J]. Journal of Environmental Radioactivity, 2019, 197: 23-29. DOI:10.1016/j.jenvrad.2018.11.010
(  0) 0) |
| [96] |
Gebauer D. How can additives control the early stages of mineralisation?[J]. Minerals, 2018, 8(5): 179. DOI:10.3390/min8050179
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


