2. 浙江农林大学, 浙江省森林生态系统碳循环与固碳减排重点实验室, 杭州 311300
2. Zhejiang Provincial Key Laboratory of Carbon Cycling in Forest Ecosystems and Carbon Sequestration, Zhejiang A & F University, Hangzhou 311300, China
养分添加作为提高土壤养分,增加人工林产量和林农的经济收入的主要措施,被广泛应用于人工林的管理。然而,养分的类型、用量以及施肥方式会显著影响土壤养分有效性,同时也会通过影响土壤pH,改变微生物群落结构以及碳循环功能基因丰度,从而对土壤有机碳(Soil organic carbon,SOC)储量和稳定性以及碳汇功能产生显著影响[1-2]。基于全球71项研究的Meta分析结果发现,养分添加对土壤有机碳周转的影响主要取决于土壤微生物呼吸的氮限制[3]。此外,养分输入剂量的增加对土壤有机碳固定的影响存在促进[4-5]或抑制[6]两种不同的效应,且不同剂量养分输入对土壤碳库的影响也与土壤初始养分有效性紧密相关[7]。因此,研究不同类型养分添加对人工林土壤碳循环的影响,对探明人工林土壤有机碳库的调控机制具有非常重要的意义。
养分添加在短期内会引发土壤有机质周转的强烈变化,即土壤有机碳矿化的激发效应(Priming effect,PE)。研究表明,土壤养分循环与碳循环之间存在由微生物介导的紧密关系,氮、磷输入可通过改变土壤pH以及土壤养分有效性来影响土壤微生物群落结构与功能,从而对土壤原有有机碳的矿化产生显著影响。但养分添加所引发的激发效应强度和方向在不同研究间存在较大的差异[8-10]。近期有Meta分析研究表明,氮素及其与磷素养分联合添加使土壤有机碳激发效应分别下降了70%和68%[3]。Liu等[11]指出,施肥处理会通过影响土壤微生物周转来减少稻田土壤有机碳降解。但也有研究发现尿素添加显著促进了土壤有机碳的分解[12]。此外,Feng等[13]的研究表明,养分添加对激发效应的影响与土壤初始养分有效性显著相关,其中氮肥影响激发效应强度随土壤氮素有效性的增加而显著降低,磷肥和氮磷肥联合施用影响激发效应的强度随土壤磷素有效性的增加而降低。此外,养分添加对土壤有机碳激发效应的影响效应也会因土壤活性碳氮含量的不同而产生显著差异[14-15]。综上,研究养分添加对土壤活性碳氮含量、碳降解功能微生物的影响,有助于进一步揭示养分添加对土壤有机碳激发效应的调控机制。
毛竹(Phyllostachys edulis)作为亚热带重要的人工林资源,在我国总面积达467.75万公顷[16]。近年来,人们注意到毛竹林生态系统在固碳方面具有巨大潜力[17]。但长期集约经营(以化肥施用和林下植被去除为主)却导致毛竹林土壤有机碳库的储量和化学结构稳定性均显著下降[18-19]。土壤有机碳矿化是土壤生态系统碳循环的关键过程之一。理论上,不同养分输入会引起土壤理化及微生物学性质的变化,从而对土壤有机碳激发作用的方向与强度产生显著影响,但亚热带人工林土壤有机碳激发效应对不同类型养分输入的响应及其机制尚鲜见报道。鉴于此,本研究以亚热带典型毛竹人工林土壤为研究对象,通过室内培养试验,研究氮素、磷素及两者联合添加对毛竹林土壤有机碳矿化及其激发效应、微生物群落功能以及土壤理化性质的影响,并探讨在不同养分添加条件下土壤有机碳激发效应与不同土壤环境因子的关系,从而为亚热带人工林土壤有机碳矿化及其激发效应的调控提供理论基础与科学依据。
1 材料与方法 1.1 供试土壤土壤样品采自浙江省杭州市临安区三口镇(30°14′ N,119°42′ E)亚热带典型毛竹人工林0~ 20 cm土层。该地区属亚热带季风气候,年平均气温15.9℃,年平均降水量1 450 mm。土壤类型为红壤,土壤pH 4.72,有机碳17.6 g·kg–1,全氮1.85 g·kg–1,全磷1.02 g·kg–1,有效磷8.16 mg·kg–1,速效钾85.2 mg·kg–1,砂粒、粉粒、黏粒含量分别为354、372、274 g·kg–1。
1.2 试验设计共设4个处理:(1)无养分添加(CT);(2)氮素添加(N);(3)磷素添加(P);(4)氮素和磷素联合添加(NP),每个处理3个重复。氮磷养分分别以CO(NH2)2和NaH2PO4的形式添加到土壤,添加比例为N 0.2 g·kg–1干土和P 0.05 g·kg–1干土。将养分与过2 mm筛的新鲜土壤(相当于200 g烘干土)均匀混合,调整含水量约为土壤田间持水量60%。不同处理土壤分别装入500 mL梅森瓶中。
土壤产生的CO2用碱液吸收法采集,并通过酸碱滴定法测定CO2排放量。简而言之,将鲜土(相当于200 g烘干土)和一个装有20 mL 0.5 mol·L–1 NaOH溶液(用于吸收CO2)的小瓶放入500 mL梅森瓶中,并将梅森瓶密封,在黑暗中培养80 d(25℃),试验期间保持土壤含水量为土壤田间持水量的60%左右。考虑到梅森瓶中的空气CO2,设置三个空白对照(无土壤)。在培养的第2、7、14、28、42、56、80天进行CO2测量(使用0.1 mol·L–1 HCl溶液滴定),并更换NaOH溶液。
激发效应的计算基于养分添加下土壤原有有机碳矿化的变化,公式如下[20]:
| $ PE={\text{CO}}_{2, {\rm{养分添加}}}-{\text{CO}}_{\text{2, }{\rm{对照}}} $ | (1) |
式中,
相对激发效应是PE与对照土壤中的有机碳矿化量比值,计算方法如下[21]:
| $ {\rm{相对}}\text{PE}(\%)=\frac{{\rm{PE}}}{{\text{CO}}_{\text{2, }{\rm{对照}}}}\times 100 $ | (2) |
式中,PE表示养分添加下的激发效应,mg·kg–1;
每个试验单元设置同样条件的梅森瓶(内置相当于200 g烘干土的新鲜土壤)用于破坏性取样。不同土壤类型、不同外源碳类型等因素均会对土壤激发效应的动态变化规律产生显著影响[22-23]。通常在培养前2周,土壤激发效应的动态变化较活跃;而2~10周,土壤激发效应的动态变化相对较稳定。因此,选择培养的第14天(土壤激发效应变化活跃阶段)和第56天(土壤激发效应变化稳定阶段)进行破坏性取样,并测定土壤理化性质、酶活性和碳降解功能微生物基因(cbhI和GH48)丰度。
土壤基本理化性质:土壤pH以超纯水浸提,土水比1︰2.5(w/v);土壤SOC和全氮含量使用元素分析仪(CHN-O-RAPID,德国)测定;有效磷(Available phosphorus,AP)含量使用HCl-NH4F法测定;速效钾含量使用火焰光度法测定;铵态氮(
土壤有机碳组分:样品经氢氟酸溶液预处理后,使用13C核磁共振(13C-nuclear magnetic resonance,13C-NMR)测定土壤有机碳组分[27]。光谱分为4个区域:δ=0~46(烷基碳)、δ=46~114(烷氧基碳)、δ=114~164(芳香碳)和δ=164~220(羰基碳),以此得到土壤不同有机碳组分的含量。
土壤酶活性:土壤-葡萄糖苷酶活性的测定方法参考Alef和Nannipieri[28](以对硝基酚--D-吡喃葡糖苷为底物);土壤蔗糖酶活性的测定方法参考Frankenberger和Johanson[29](以蔗糖为底物);核酮糖-1,5-二磷酸羧化酶加氧酶(RubisCO)活性测定的方法参考Guo等[30];土壤多酚氧化酶活性的测定方法参考German等[31]。
1.4 土壤DNA提取和实时荧光定量PCR分析称取1.0 g新鲜土壤,使用Fast DNA Spin Kit(MP Biomedals,美国)提取DNA总量并溶于TE缓冲液,提取的土壤DNA样品保存于–70℃。
采用引物组GH481F(5'-RRCATBTACGGBA TGCACTGGCT-3')和GH481R(5'-VCCGCCCCCC ABGMGTARTACC-3')扩增细菌GH48功能基因,用引物组fungcbhIF(5'-ACCAAYTGCTAYACIRG YAA-3')和fungcbhIR(5'-GCYTCCCAIATRTCC ATC-3')扩增真菌cbhI基因。PCR采用AP221-02试剂盒(TransStart Fastpfu DNA聚合酶,20 μL反应体系)(南京诺唯赞生物科技有限公司,中国)在ABI GeneAmp®9700型PCR仪(Applied Biosystems,美国)中进行。细菌GH48的PCR扩增条件为95℃下变性3 min,然后进行46次热循环(95℃进行30 s,50℃退火30 s,72℃进行45 s),最终在72℃停留10 min。真菌cbhI的PCR扩增在95℃下变性5 min,随后进行40次热循环(94 ℃进行30 s,48℃退火30 s,72℃进行90 s),最后再进行84℃延伸10 s。扩增结束后对产物进行纯化。
PCR扩增后,通过熔解曲线分析和琼脂糖凝胶电泳观察产物,证实了扩增的特异性。随后用QuantiFluor™-ST蓝色荧光定量系统(Promega公司,美国)测定细菌GH48和真菌cbhI的基因拷贝数。土壤样品中目的基因的拷贝数以纯化的模板质粒DNA产生的标准曲线为基础,实时荧光聚合酶链反应效率为82.00%~89.13%,两种功能基因的R2值均大于0.998,用土壤干重计算基因拷贝数结果。
1.5 数据处理利用双因素方差分析(Two-way ANOVA)检验氮素和磷素添加两个因子及其交互作用对土壤CO2累积排放量、累积激发效应、土壤理化性质、酶活性以及cbhI和GH48功能基因丰度的影响。利用重复测量方差分析(Repeated measures ANOVA)检验养分添加处理(对照、氮添加、磷添加和氮磷联合添加)、培养时间及其交互作用对土壤CO2排放速率、激发效应速率、土壤理化性质、酶活性以及cbhI和GH48功能基因丰度的影响。采用皮尔逊相关分析研究了累积有机碳矿化与土壤理化性质、有机碳组分、酶活性以及碳降解功能基因丰度)之间的相关性。本试验数据的统计分析均采用SPSS 25软件,绘图在Origin 9.0软件中进行。
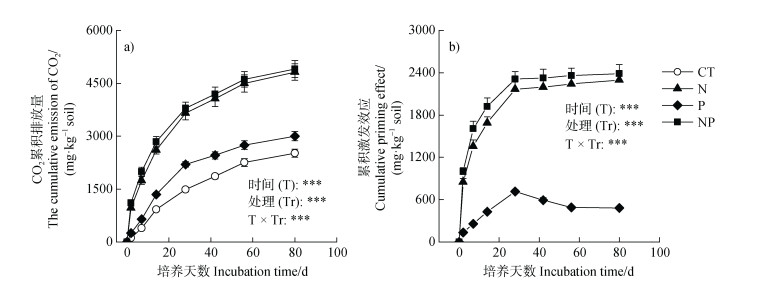
2 结果 2.1 氮磷添加对毛竹林土壤有机碳矿化与激发效应的影响N、P养分添加及其交互作用均影响了毛竹林土壤有机碳矿化及其激发效应(表 1)。由图 1a可知,对照、氮素添加、磷素添加和氮磷联合添加处理下,毛竹林土壤有机碳矿化CO2累积排放量分别为2 517、4 816、3 000和4 906 mg·kg–1。与对照相比,N、P和NP处理使土壤有机碳矿化CO2累积排放量分别提高了91.3%、19.2%和94.9%。由图 1b可知,N、P和NP处理下的累积激发效应分别为2 299、483和2 388 mg·kg–1,N和NP处理引发的毛竹林土壤有机碳矿化激发效应累积量高于P处理(图 1)。
|
|
表 1 氮、磷养分添加及两者交互作用对毛竹林土壤CO2累积排放量和累积激发效应的影响 Table 1 Effects of nitrogen addition, phosphorus addition and their interaction on cumulative CO2 emission and cumulative priming effect(PE)of Moso bamboo plantation soil |
|
注:CT表示对照处理,N表示氮添加处理,P表示磷添加处理,NP表示氮磷联合添加处理;*、**和***分别表示不同因素在P < 0.05、P < 0.01和P < 0.001显著水平下对因变量的影响,ns则表示因素对因变量影响不显著(P > 0.05)。下同。 Note: CT = control treatment, N = N nutrient addition treatment, P = P nutrient addition treatment, NP = N and P combined addition treatment; *, ** and *** represent the effects by different factors on dependent variable at the significant level of P < 0.05, P < 0.01 and P < 0.001, respectively. ns represent no significant effect(P > 0.05). The same below. 图 1 氮磷添加对毛竹林土壤CO2累积排放量(a)和累积激发效应(b)动态变化的影响 Fig. 1 Effects of nitrogen and phosphorus addition on the temporal dynamics of cumulative CO2 emission(a)and cumulative priming effect(b)in a Moso bamboo plantation soil |
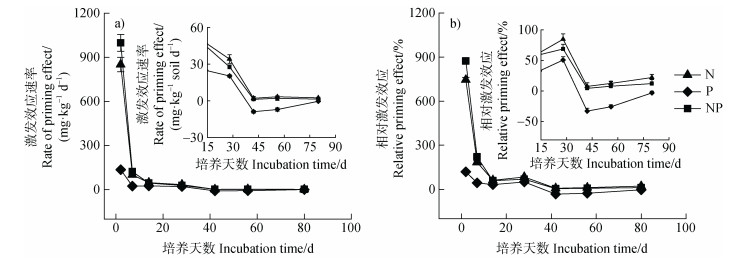
重复测量方差分析结果表明(图 1),培养时间对土壤有机碳矿化与激发效应产生极显著影响(P < 0.001)。同时,如图 2a所示,所有养分添加处理下的土壤有机碳激发效应速率均呈现随时间推移逐渐下降的规律(图 2a)。培养28 d后,P处理下的激发效应逐渐由正激发转向负激发,NP处理产生的正激发效应速率开始低于N处理。与激发效应速率的时间动态类似,所有养分处理下的相对激发效应随时间推移呈下降趋势(图 1和图 2b),不同处理下相对激发效应的最高值均出现在第2天,最低值均出现在第42天。培养28 d后,P处理下的相对激发效应逐渐由正转负,NP处理产生的相对激发效应开始低于N处理。
|
图 2 氮磷添加对毛竹林土壤激发效应速率(a)和相对激发效应动态(b)变化的影响 Fig. 2 Effects of nitrogen and phosphorus addition on the temporal dynamics of rate of priming effect(a)and relative priming effect(b)in a Moso bamboo plantation soil |
重复测量方差分析表明,试验处理对所有土壤环境因子均产生极显著影响(P < 0.01),培养时间对除pH和-葡萄糖苷酶以外的其他土壤环境因子均产生显著影响(P < 0.05)(表 2)。与对照相比,在养分添加处理下,毛竹林土壤pH以及MBC、DOC、
|
|
表 2 处理、培养时间及其交互作用对毛竹林土壤环境因子的影响(基于重复测量方差分析结果) Table 2 Effects of treatments, incubation time and their interactions on soil environmental factors in a Moso bamboo plantation soil(based on repeated measures ANOVA) |
|
|
表 3 氮、磷养分添加及两者交互作用对毛竹林土壤理化性质的影响 Table 3 Effects of nitrogen addition, phosphorus addition and their interaction on soil physicochemical properties in a Moso bamboo plantation soil |
在培养的第14天,与对照处理相比,N、P和NP处理使MBC含量分别提高74.4%、22.0%和79.2%,培养第56天后养分添加对MBC含量的影响与此类似。相比较而言,土壤DOC含量仅受N添加影响显著(P < 0.05,表 3),培养14 d后,N和NP处理中DOC含量分别提高152.7%和146.6%(与对照处理相比),同样的规律也存在于第56天的样品中(表 3)。
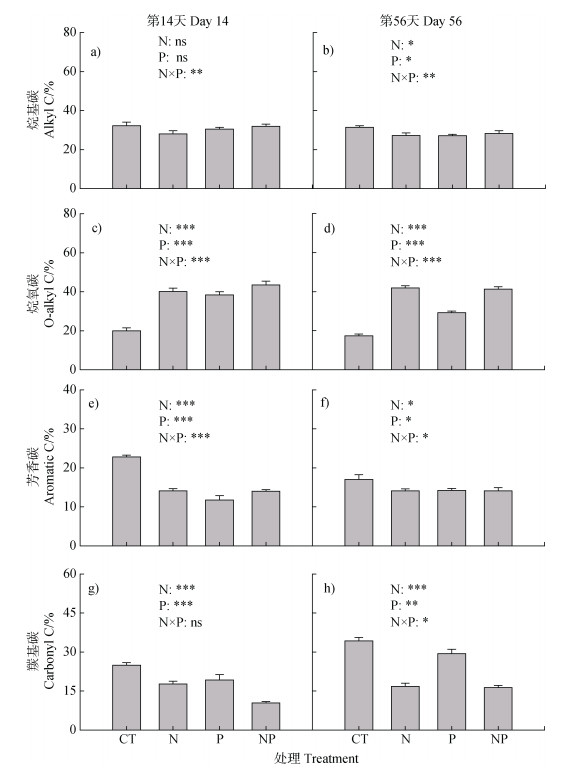
由图 3可见,养分添加处理显著影响了毛竹林土壤有机碳组分含量。在培养的第14天和56天,N、P和NP处理下的烷氧碳组分较对照处理均有不同程度的上升,而芳香碳组分则有不同程度下降,此外,P处理下的烷氧碳组分低于N和NP处理。
|
图 3 氮、磷养分添加及两者交互作用对毛竹林土壤有机碳组分的影响 Fig. 3 Effects of nitrogen addition, phosphorus addition and their interaction on the SOC chemical composition in a Moso bamboo plantation soil |
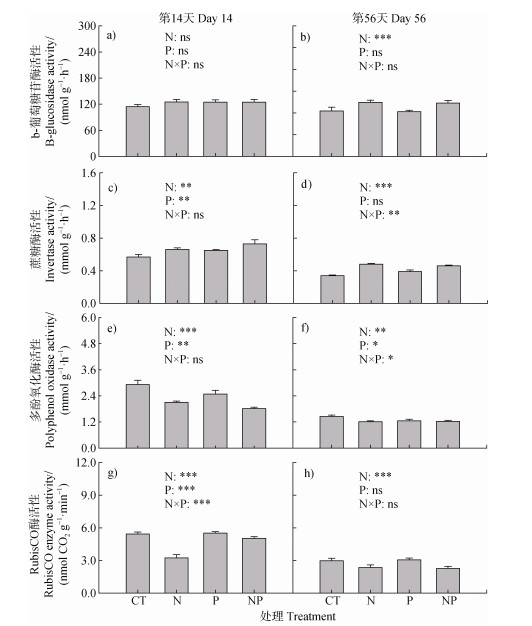
毛竹林土壤酶活性受N、P以及NP交互作用的影响(图 4)。由图 4a和4b可知,在培养的第14天,养分添加对-葡萄糖苷酶活性无显著影响,第56天,N和NP处理下的-葡萄糖苷酶活性均显著高于对照处理。由图 4c和图 4d可知,在第14和56天,N处理、P处理以及NP处理均显著提高了蔗糖酶活性(P < 0.05)。与此相反,在第14和56天,N处理、P处理以及NP处理均显著降低了多酚氧化酶活性(P < 0.05,图 4e和图 4f)。此外,第14和56天,与对照处理相比,N处理使RubisCO酶活性分别下降了21.0%和40.6%(图 4g和4h)。
|
图 4 氮、磷养分添加及两者交互作用对毛竹林土壤对毛竹林土壤酶活性的影响 Fig. 4 Effects of nitrogen addition, phosphorus addition and their interaction on enzyme activities in a Moso bamboo plantation soil |
N、P及其交互作用对毛竹林土壤碳降解微生物功能基因丰度的影响如图 5所示。在培养的第14天,N、P以及NP联合添加下碳降解功能基因(cbhI和GH48)丰度均上升,其中cbhI功能基因丰度的增幅分别是205%、13.6%和233%,GH48功能基因丰度的增幅分别为100%、21.7%和69.8%。P处理下碳降解功能基因丰度(cbhI和GH48)均明显低于N和NP处理。在培养的第56天,与对照处理相比,N和NP处理使cbhI功能基因丰度分别提高80.8%和169%,使GH48功能基因丰度分别提高51.2%和34.9%。然而,P处理则显著降低了cbhI功能基因丰度(P < 0.05),其降幅为33.5%(图 5)。
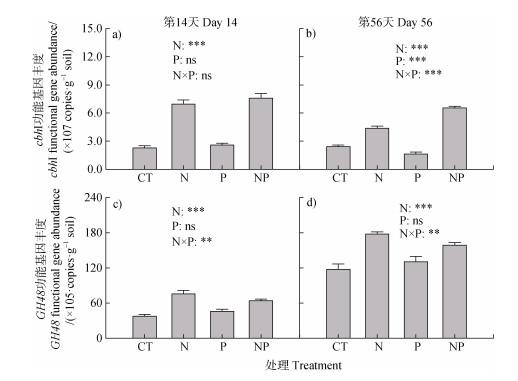
|
图 5 氮、磷养分添加及两者交互作用对毛竹林土壤cbhI和GH48基因丰度的影响 Fig. 5 Effects of nitrogen addition, phosphorus addition, and their interaction on the abundances of soil cbhI and GH48 gene in a Moso bamboo plantation soil |
由表 4可知,在培养的第14天,毛竹林土壤有机碳矿化的激发效应与pH、MBC、DOC、烷氧碳、芳香碳、
|
|
表 4 毛竹林土壤激发效应与环境因子的相关性 Table 4 Relationships between soil cumulative priming effect and environmental factors in a Moso bamboo plantation soil |
施肥是提高土壤肥力、增加作物产量的常用措施,氮磷养分添加会对土壤原有有机碳矿化产生显著影响,从而影响激发效应的方向和强度[32-33]。本研究中,养分输入,尤其是氮素的添加,产生了累积正激发效应(表 1,图 1b),N和NP处理导致土壤原有有机碳矿化分别增加了91%和94%(图 1a),上述结果与以往在森林[34]和稻田[11]生态系统中的研究结果类似。这可能是由于在本试验中,氮素添加显著提高了土壤氮素养分的有效性,提升了土壤微生物的活性,促进了土壤原有有机碳的分解,从而产生正激发效应[13,35]。同时,本研究也发现,在培养试验的42 d后,无论是否添加氮素,磷素的输入均对激发效应速率和相对激发效应产生负面效应(图 2a和2b)。杉木林土壤中的研究结果也显示[36],磷添加抑制了土壤有机碳的分解(7.5%)。综上,本研究结果表明,养分输入整体上促进了毛竹人工林土壤原有有机质的矿化,增加土壤碳库损失,对土壤的碳汇功能产生负面影响。
3.2 氮磷添加影响毛竹林土壤有机碳激发效应的机制养分添加诱导的激发效应强度和方向与土壤pH[37-38]和有机碳库[39-41]有关。本试验中,所有养分添加处理下的土壤pH均高于对照土壤,其中氮添加(N和NP)下的pH均显著高于磷单独添加(表 3)。而在以往文献中,化肥施用普遍导致土壤酸化,这主要是选用的氮肥品种不同所致[42-44]。以往研究大多选用生理酸性的铵态氮肥(如硫酸铵、氯化铵),由于作物和微生物吸收利用阳离子(
土壤养分有效性的增加可促进土壤微生物生物量的增长,引起土壤有机碳矿化的正激发效应[33]。本研究的两次取样中(第14和56天),与对照相比,N和NP处理使土壤
养分有效性的改变会影响土壤微生物群落并改变其分泌的胞外酶活性,最终影响土壤有机碳的周转速率[55-57]。本培养试验的初期(第14天),三种养分添加处理均提高了土壤蔗糖酶活性以及碳降解功能基因(cbhI和GH48)丰度,并抑制了多酚氧化酶活性和RubisCO活性(图 4和图 5);多酚氧化酶活性和碳降解功能基因丰度影响了试验初期的激发效应(表 4)。相比较而言,在培养试验的后期(第56天),氮添加(N和NP)处理提高了-葡萄糖苷酶活性(图 4),而单独添加磷显著降低了cbhI功能基因丰度;培养试验后期的激发效应由-葡萄糖苷酶、蔗糖酶和RubisCO活性以及碳降解功能基因丰度共同调控(表 4)。因此,氮磷养分添加处理对土壤正激发效应的影响机制在培养前期和后期存在明显的差异,这可能是由于培养时间对土壤环境因子具有显著影响效应所致(表 2)。推测在培养初始阶段,养分添加处理刺激了土壤微生物碳降解功能(cbhI和GH48功能基因),并抑制了易分解有机碳向难分解有机碳转化的过程(多酚氧化酶),从而提高了底物有效性,导致正激发效应。而在培养后期,氮添加(N和NP)处理促进碳降解胞外酶的分泌(-葡萄糖苷酶和蔗糖酶活性),同时降低CO2固定过程的暗反应速率(RubisCO活性),从而延续了正激发效应。此外,磷添加处理在培养后期抑制土壤微生物碳降解功能,降低了cbhI功能基因丰度,因此产生负激发效应。根据“化学计量分解假说”,土壤有效养分化学计量与微生物需求相匹配时,微生物的活性最高,对有机质分解速率最大[8]。因此,在氮素养分初始有效性偏低的毛竹林土壤中,氮添加提高有效氮磷比,同时提高底物质量[58],从而缓解微生物生长、繁殖等生命活动的养分限制,促进功能微生物的丰度和活性,最终在短时间内提高土壤CO2排放。
4 结论氮素、磷素单独添加或者两者协同添加,均显著增加了毛竹林土壤有机碳矿化的累积激发效应。其中,P处理下的累积激发效应显著低于N和NP处理,其激发效应速率在第42天前后由正激发转向负激发。氮磷养分添加可能是通过影响土壤pH、活性碳氮含量,并提升微生物的活性和功能,从而显著提高土壤原有有机碳的矿化速率。养分添加引起的毛竹林土壤正激发效应会对其碳汇功能产生负面影响。今后在制订毛竹林土壤的施肥方案时,应综合考虑氮磷添加对土壤养分有效性以及碳汇功能的双重效应。
| [1] |
Jandl R, Lindner M, Vesterdal L, et al. How strongly can forest management influence soil carbon sequestration?[J]. Geoderma, 2007, 137(3/4): 253-268.
(  0) 0) |
| [2] |
Liu S R, Yang Y J, Wang H. Development strategy and management countermeasures of planted forests in China: Transforming from timber-centered single objective management towards multi-purpose management for enhancing quality and benefits of ecosystem services (In Chinese)[J]. Acta Ecologica Sinica, 2018, 38(1): 1-10. [刘世荣, 杨予静, 王晖. 中国人工林经营发展战略与对策: 从追求木材产量的单一目标经营转向提升生态系统服务质量和效益的多目标经营[J]. 生态学报, 2018, 38(1): 1-10.]
(  0) 0) |
| [3] |
Feng J G, Zhu B. Global patterns and associated drivers of priming effect in response to nutrient addition[J]. Soil Biology & Biochemistry, 2021, 153: 108118.
(  0) 0) |
| [4] |
Poeplau C, Zopf D, Greiner B, et al. Why does mineral fertilization increase soil carbon stocks in temperate grasslands?[J]. Agriculture, Ecosystems & Environment, 2018, 265: 144-155.
(  0) 0) |
| [5] |
Álvaro-Fuentes J, Morell F J, Plaza-Bonilla D, et al. Modelling tillage and nitrogen fertilization effects on soil organic carbon dynamics[J]. Soil & Tillage Research, 2012, 120: 32-39.
(  0) 0) |
| [6] |
Tonitto C, Goodale C L, Weiss M S, et al. The effect of nitrogen addition on soil organic matter dynamics: A model analysis of the Harvard Forest Chronic Nitrogen Amendment Study and soil carbon response to anthropogenic N deposition[J]. Biogeochemistry, 2014, 117(2/3): 431-454.
(  0) 0) |
| [7] |
Liang F, Li J W, Zhang S Q, et al. Two-decade long fertilization induced changes in subsurface soil organic carbon stock vary with indigenous site characteristics[J]. Geoderma, 2019, 337: 853-862. DOI:10.1016/j.geoderma.2018.10.033
(  0) 0) |
| [8] |
Hessen D O, Ågren G I, Anderson T R, et al. Carbon sequestration in ecosystems: The role of stoichiometry[J]. Ecology, 2004, 85(5): 1179-1192. DOI:10.1890/02-0251
(  0) 0) |
| [9] |
Wu L, Xu H, Xiao Q, et al. Soil carbon balance by priming differs with single versus repeated addition of glucose and soil fertility level[J]. Soil Biology & Biochemistry, 2020, 148: 107913.
(  0) 0) |
| [10] |
Wang Q K, Chen L C, Yang Q P, et al. Different effects of single versus repeated additions of glucose on the soil organic carbon turnover in a temperate forest receiving long-term N addition[J]. Geoderma, 2019, 341: 59-67. DOI:10.1016/j.geoderma.2019.01.032
(  0) 0) |
| [11] |
Liu Y H, Zang H D, Ge T D, et al. Intensive fertilization (N, P, K, Ca, and S) decreases organic matter decomposition in paddy soil[J]. Applied Soil Ecology, 2018, 127: 51-57. DOI:10.1016/j.apsoil.2018.02.012
(  0) 0) |
| [12] |
Qiu Q Y, Wu L F, Ouyang Z, et al. Priming effect of maize residue and urea N on soil organic matter changes with time[J]. Applied Soil Ecology, 2016, 100: 65-74. DOI:10.1016/j.apsoil.2015.11.016
(  0) 0) |
| [13] |
Feng J G, Tang M, Zhu B. Soil priming effect and its responses to nutrient addition along a tropical forest elevation gradient[J]. Global Change Biology, 2021, 27(12): 2793-2806. DOI:10.1111/gcb.15587
(  0) 0) |
| [14] |
Song M H, Guo Y, Yu F H, et al. Shifts in priming partly explain impacts of long-term nitrogen input in different chemical forms on soil organic carbon storage[J]. Global Change Biology, 2018, 24(9): 4160-4172. DOI:10.1111/gcb.14304
(  0) 0) |
| [15] |
Li J Y, Han G X, Wang G M, et al. Imbalanced nitrogen-phosphorus input alters soil organic carbon storage and mineralisation in a salt marsh[J]. Catena, 2022, 208: 105720. DOI:10.1016/j.catena.2021.105720
(  0) 0) |
| [16] |
Li Y M, Feng P F. Bamboo resources in China based on the ninth national forest inventory data (In Chinese)[J]. World Bamboo and Rattan, 2019, 17(6): 45-48. [李玉敏, 冯鹏飞. 基于第九次全国森林资源清查的中国竹资源分析[J]. 世界竹藤通讯, 2019, 17(6): 45-48.]
(  0) 0) |
| [17] |
Song X Z, Zhou G M, Jiang H, et al. Carbon sequestration by Chinese bamboo forests and their ecological benefits: Assessment of potential, problems, and future challenges[J]. Environmental Reviews, 2011, 19(NA): 418-428. DOI:10.1139/a11-015
(  0) 0) |
| [18] |
Li Y F, Zhang J J, Chang S X, et al. Long-term intensive management effects on soil organic carbon pools and chemical composition in Moso bamboo(Phyllostachys pubescens)forests in subtropical China[J]. Forest Ecology and Management, 2013, 303: 121-130. DOI:10.1016/j.foreco.2013.04.021
(  0) 0) |
| [19] |
Zhang J J, Li Y F, Chang S X, et al. Understory management and fertilization affected soil greenhouse gas emissions and labile organic carbon pools in a Chinese chestnut plantation[J]. Forest Ecology and Management, 2015, 337: 126-134. DOI:10.1016/j.foreco.2014.11.004
(  0) 0) |
| [20] |
Balesdent J, Balabane M. Maize root-derived soil organic carbon estimated by natural 15C abundance[J]. Soil Biology & Biochemistry, 1992, 24(2): 97-101.
(  0) 0) |
| [21] |
Wang H, Boutton T W, Xu W H, et al. Quality of fresh organic matter affects priming of soil organic matter and substrate utilization patterns of microbes[J]. Scientific Reports, 2015, 5: 10102. DOI:10.1038/srep10102
(  0) 0) |
| [22] |
Yu Z, Chen L, Pan S, et al. Feedstock determines biochar-induced soil priming effects by stimulating the activity of specific microorganisms[J]. European Journal of Soil Science, 2018, 69(3): 521-534. DOI:10.1111/ejss.12542
(  0) 0) |
| [23] |
Fang Y Y, Singh B, Singh B P. Effect of temperature on biochar priming effects and its stability in soils[J]. Soil Biology & Biochemistry, 2015, 80: 136-145.
(  0) 0) |
| [24] |
Page A L, Miller R H, Keeney D R. Methods of soil analysis . Madison, WI, USA: American Society of Agronomy, Soil Science Society of America, 1982.
(  0) 0) |
| [25] |
Gregorich E G, Beare M H, Stoklas U, et al. Biodegradability of soluble organic matter in maize-cropped soils[J]. Geoderma, 2003, 113(3/4): 237-252.
(  0) 0) |
| [26] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 1987, 19(6): 703-707.
(  0) 0) |
| [27] |
Li Y C, Li Y F, Chang S X, et al. Bamboo invasion of broadleaf forests altered soil fungal community closely linked to changes in soil organic C chemical composition and mineral N production[J]. Plant and Soil, 2017, 418(1/2): 507-521.
(  0) 0) |
| [28] |
Alef K, Nannipieri P. Methods in applied soil microbiology and biochemistry . Amsterdam: Elsevier, 1995.
(  0) 0) |
| [29] |
Frankenberger W T, Johanson J B. Factors affecting invertase activity in soils[J]. Plant and Soil, 1983, 74(3): 313-323. DOI:10.1007/BF02181349
(  0) 0) |
| [30] |
Guo G X, Kong W D, Liu J B, et al. Diversity and distribution of autotrophic microbial community along environmental gradients in grassland soils on the Tibetan Plateau[J]. Applied Microbiology and Biotechnology, 2015, 99(20): 8765-8776. DOI:10.1007/s00253-015-6723-x
(  0) 0) |
| [31] |
German D P, Weintraub M N, Grandy A S, et al. Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies[J]. Soil Biology & Biochemistry, 2011, 43(7): 1387-1397.
(  0) 0) |
| [32] |
Chen L J, Jiang Y J, Liang C, et al. Competitive interaction with keystone taxa induced negative priming under biochar amendments[J]. Microbiome, 2019, 7(1): 77. DOI:10.1186/s40168-019-0693-7
(  0) 0) |
| [33] |
Li J Y, Han G X, Wang G M, et al. Imbalanced nitrogen-phosphorus input alters soil organic carbon storage and mineralisation in a salt marsh[J]. Catena, 2022, 208: 105720. DOI:10.1016/j.catena.2021.105720
(  0) 0) |
| [34] |
Nottingham A T, Turner B L, Chamberlain P M, et al. Priming and microbial nutrient limitation in lowland tropical forest soils of contrasting fertility[J]. Biogeochemistry, 2012, 111(1/2/3): 219-237.
(  0) 0) |
| [35] |
Fan Y X, Zhong X J, Lin T C, et al. Effects of nitrogen addition on DOM-induced soil priming effects in a subtropical plantation forest and a natural forest[J]. Biology and Fertility of Soils, 2020, 56(2): 205-216. DOI:10.1007/s00374-019-01416-0
(  0) 0) |
| [36] |
Fang X M, Zhang X L, Chen F S, et al. Phosphorus addition alters the response of soil organic carbon decomposition to nitrogen deposition in a subtropical forest[J]. Soil Biology & Biochemistry, 2019, 133: 119-128.
(  0) 0) |
| [37] |
Xiao Q, Huang Y P, Wu L, et al. Long-term manuring increases microbial carbon use efficiency and mitigates priming effect via alleviated soil acidification and resource limitation[J]. Biology and Fertility of Soils, 2021, 57(7): 925-934. DOI:10.1007/s00374-021-01583-z
(  0) 0) |
| [38] |
Aye N S, Butterly C R, Sale P W G, et al. Interactive effects of initial pH and nitrogen status on soil organic carbon priming by glucose and lignocellulose[J]. Soil Biology & Biochemistry, 2018, 123: 33-44.
(  0) 0) |
| [39] |
Azeem M, Hayat R, Hussain Q, et al. Effects of biochar and NPK on soil microbial biomass and enzyme activity during 2 years of application in the arid region[J]. Arabian Journal of Geosciences, 2019, 12(10): 1-13.
(  0) 0) |
| [40] |
Li L J, Ye R Z, Zhu-Barker X, et al. Soil microbial biomass size and nitrogen availability regulate the incorporation of residue carbon into dissolved organic pool and microbial biomass[J]. Soil Science Society of America Journal, 2019, 83(4): 1083-1092. DOI:10.2136/sssaj2018.11.0446
(  0) 0) |
| [41] |
Zhang Y L, Yao S H, Mao J D, et al. Chemical composition of organic matter in a deep soil changed with a positive priming effect due to glucose addition as investigated by 13C NMR spectroscopy[J]. Soil Biology & Biochemistry, 2015, 85: 137-144.
(  0) 0) |
| [42] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570
(  0) 0) |
| [43] |
Jiang Z H, Zeng Q R, Pi H J, et al. Change of pH and volatilization of ammonia by fertilizing different types of urea in soil (In Chinese)[J]. Environmental Chemistry, 2009, 28(2): 177-180. [蒋朝晖, 曾清如, 皮荷杰, 等. 不同品种尿素施入土壤后pH值的变化和氨气释放差异[J]. 环境化学, 2009, 28(2): 177-180.]
(  0) 0) |
| [44] |
Hamidi N H, Ahmed O H, Omar L, et al. Combined use of charcoal, sago bark ash, and urea mitigate soil acidity and aluminium toxicity[J]. Agronomy, 2021, 11(9): 1799. DOI:10.3390/agronomy11091799
(  0) 0) |
| [45] |
Xing W, Lu X M, Ying J Y, et al. Disentangling the effects of nitrogen availability and soil acidification on microbial taxa and soil carbon dynamics in natural grasslands[J]. Soil Biology & Biochemistry, 2022, 164: 108495.
(  0) 0) |
| [46] |
Müller T, Walter B, Wirtz A, et al. Ammonium toxicity in bacteria[J]. Current Microbiology, 2006, 52(5): 400-406. DOI:10.1007/s00284-005-0370-x
(  0) 0) |
| [47] |
Wang C, Liu D W, Bai E. Decreasing soil microbial diversity is associated with decreasing microbial biomass under nitrogen addition[J]. Soil Biology & Biochemistry, 2018, 120: 126-133.
(  0) 0) |
| [48] |
Chen G H, Fang Y Y, van Zwieten L, et al. Priming, stabilization and temperature sensitivity of native SOC is controlled by microbial responses and physicochemical properties of biochar[J]. Soil Biology & Biochemistry, 2021, 154: 108139.
(  0) 0) |
| [49] |
Rousk J, Hill P W, Jones D L. Priming of the decomposition of ageing soil organic matter: Concentration dependence and microbial control[J]. Functional Ecology, 2015, 29(2): 285-296. DOI:10.1111/1365-2435.12377
(  0) 0) |
| [50] |
Liu X J A, Sun J R, Mau R L, et al. Labile carbon input determines the direction and magnitude of the priming effect[J]. Applied Soil Ecology, 2017, 109: 7-13. DOI:10.1016/j.apsoil.2016.10.002
(  0) 0) |
| [51] |
Feng S Z, Huang Y, Ge Y H, et al. Variations in the patterns of soil organic carbon mineralization and microbial communities in response to exogenous application of rice straw and calcium carbonate[J]. Science of the Total Environment, 2016, 571: 615-623. DOI:10.1016/j.scitotenv.2016.07.029
(  0) 0) |
| [52] |
Cheng Y, Wang J, Sun N, et al. Phosphorus addition enhances gross microbial N cycling in phosphorus-poor soils: A 15N study from two long-term fertilization experiments[J]. Biology and Fertility of Soils, 2018, 54(6): 783-789. DOI:10.1007/s00374-018-1294-5
(  0) 0) |
| [53] |
Sullivan B W, Hart S C. Evaluation of mechanisms controlling the priming of soil carbon along a substrate age gradient[J]. Soil Biology & Biochemistry, 2013, 58: 293-301.
(  0) 0) |
| [54] |
Chen R R, Senbayram M, Blagodatsky S, et al. Soil C and N availability determine the priming effect: Microbial N mining and stoichiometric decomposition theories[J]. Global Change Biology, 2014, 20(7): 2356-2367. DOI:10.1111/gcb.12475
(  0) 0) |
| [55] |
Fan F L, Yu B, Wang B R, et al. Microbial mechanisms of the contrast residue decomposition and priming effect in soils with different organic and chemical fertilization histories[J]. Soil Biology & Biochemistry, 2019, 135: 213-221.
(  0) 0) |
| [56] |
Zhou Z F, Wei W L, Shi X J, et al. Twenty-six years of chemical fertilization decreased soil RubisCO activity and changed the ecological characteristics of soil cbbL-carrying bacteria in an entisol[J]. Applied Soil Ecology, 2019, 141: 1-9.
(  0) 0) |
| [57] |
Zhang Q F, Cheng L, Feng J G, et al. Nitrogen addition stimulates priming effect in a subtropical forest soil[J]. Soil Biology & Biochemistry, 2021, 160: 108339.
(  0) 0) |
| [58] |
Angst G, Mueller K E, Nierop K G J, et al. Plant- or microbial-derived? A review on the molecular composition of stabilized soil organic matter[J]. Soil Biology & Biochemistry, 2021, 156: 108189.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


