2. 中国科学院大学, 北京 100049;
3. 农业农村部长江下游平原农业环境重点实验室, 江苏省农业科学院农业资源与环境研究所, 南京 210014
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Key Laboratory of Agro-Environment in Downstream of Yangtze Plain, Ministry of Agriculture and Rural Affairs, Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类由2个或2个以上苯环以线状、角状或簇状排列而成的持久性有机污染物,主要来自于化石燃料的不完全燃烧、石油泄漏和垃圾焚烧等[1-3]。PAHs因其具有致癌、致畸、致突变的“三致”效应,已经引起人们的高度关注,美国环保署在20世纪80年代初已将16种PAHs归为环境中优先控制的污染物[2,4-5]。PAHs具有疏水性强、热稳定性高、不易降解等特性,能够长期累积于土壤、沉积物、水和大气环境中,对人体健康和生态环境具有潜在风险[6-7]。
微生物降解是土壤环境中PAHs衰减的主要机制,也是去除PAHs最为彻底的方法[8-10]。与物理化学方法相比,微生物修复技术具有环境友好、成本效益高等特点[11-12]。但游离微生物也存在难以与土著微生物竞争、抗毒性能力差、难以适应复杂的环境条件等缺点,而将游离微生物固定在载体表面可以克服这些弊端[13]。Wang等[14]将PAHs降解菌固定在菠萝皮生物炭和海藻酸钠载体上,其对土壤中芘的去除效果优于游离菌。附着在蒙脱土和腐殖酸上的生物膜相较于游离微生物处理,提高了苯并[a]芘的降解速率,大大缩短了降解的半衰期[8]。目前有不少研究人员采用黏土矿物、生物炭等天然材料负载微生物,但不同材料的组成、结构、表面积等存在极大差异,可能对微生物固定及活性带来差异,从而影响微生物对污染物的降解。
生物膜在降解有机污染物的优势可能是群体感应在发挥作用,生物膜的形成和有机物污染物的降解受群体感应调控,是强化污染物去除的重要环节[15]。群体感应是细菌通过信号分子进行密度感应进而调控基因表达来协调细菌群体行为的一种内在机制,因此,可以通过信号分子检测细胞的生理功能,其中革兰氏阴性菌分泌信号分子酰基高丝氨酸内酯(N-acyl homoserine lactones,AHLs)[16-18]。群体感应通过向胞外释放特定的信号分子可以调控胞外聚合物(Extracellular polymeric substance,EPS)的产生[19],EPS中的多糖和蛋白质等组分可以通过氢键、静电力作用吸附络合有机污染物,从而提高其生物有效性和去除效率[20]。有研究表明特定的信号分子C12-HSL可能是不动杆菌DR1在十六烷降解和生物膜形成过程中的关键因素[21]。Mangwani等[17,22]发现,海洋铜绿假单胞菌N6P6合成信号分子C4-HSL和3OC12-HSL,而且外源添加3OC12-HSL显著提高了其对PAHs的降解率。Sheng等[23]曾报道过生物膜形成过程中主导型信号分子3OC12-HSL的生成与1,2,4-三氯苯的矿化密切相关。以上研究表明,细菌群体感应在生物膜的形成过程和有机污染物降解中发挥着至关重要的作用。然而,在不同载体存在下,污染物降解过程中生物膜内信号分子的释放规律尚不明确。
本研究以典型PAHs化合物菲为模式污染物,革兰氏阴性-鞘脂菌PHE3(Sphingobium sp. PHE3)为降解菌,探究了蒙脱石、针铁矿和玉米秸秆炭三种不同的载体材料对微生物降解菲的影响,分析菌株PHE3在生物膜形成和菲降解过程中EPS的产量,并识别其AHLs,研究群体感应对不同载体体系中生物膜形成过程以及菲降解的影响,为后期开发群体感应介导微生物膜菌剂修复多环芳烃污染场地提供理论依据。
1 材料与方法 1.1 供试材料菲标准品,纯度 > 97%,购自TCI梯希爱(上海)化成工业发展有限公司。实验过程中所用色谱纯有机溶剂丙酮、二氯甲烷、乙腈和AHLs标准品(C4-HSL、C6-HSL、C7-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL、3OC6-HSL、3OC8-HSL、3OC10- HSL、3OC12-HSL和3OC14-HSL),纯度 > 99.9%,购自美国Sigma-Aldrich公司。蒙脱石、高岭石、针铁矿,纯度 > 98%,购自国药集团化学试剂有限公司,过100目筛。玉米秸秆炭以玉米秸秆为原料,去离子水洗涤,烘箱烘干12 h后,于马弗炉中热解,热解温度为500℃。制备好的玉米秸秆炭研磨过100目筛。营养肉汤培养基购自青岛高科技工业海博生物技术有限公司,其他化学试剂均购自国药集团化学试剂有限公司。实验所用营养肉汤培养基配方为:蛋白胨10 g·L–1,牛肉浸粉3 g·L–1,NaCl 5 g·L–1。无机盐培养基的配制方法[24]如下:称取2.3 mg MnCl2·2H2O、3.0 mg MnCl4·H2O、3.1 mg H3BO3、3.6 mg CoCl2·6H2O、1.0 mg CuCl2·2H2O、2.0 mg NiCl2·6H2O、3.0 mg Na2MoO4·2H2O和5.0 mg ZnCl2溶于100 mL去离子水配制微量元素溶液,调节pH为7;之后称取8.8 g Na2HPO4·12H2O、3.0 g KH2PO4、1.0 g NH4Cl和0.5 g NaCl,加入1 mL 1 mol·L–1 MgSO4和2.5 mL微量元素溶液,定容至1 L。
菲降解菌鞘脂菌PHE3(Sphingobium sp. PHE3)为本课题组从多环芳烃污染土壤中分离到的一株革兰氏阴性菌,能够以菲为唯一碳源生长,命名为PHE3,保存于中国典型培养物保藏中心,保藏号CCTCC AB 2010361。菌株PHE3在灭菌的营养肉汤培养基中活化和进一步扩大培养,于28℃、160 r·min–1避光振荡培养,待菌株生长到对数期,离心收集菌体,用磷酸盐缓冲液清洗2次后,加入无机盐培养基重新悬浮菌体,调节OD600值为0.85备用。
1.2 载体筛选向40 mL离心管中添加0.1 g载体(蒙脱石、高岭石、针铁矿和玉米秸秆炭),经灭菌处理后,继续添加9 mL灭菌的营养肉汤培养基,按照10%的接种比例[24],接种1 mL菌悬液,于28℃、160 r·min–1条件下避光振荡培养2 d。培养结束后,离心收集载体,根据Zhang等[25]报道的方法观察附着在载体表面的细菌,首先用磷酸盐缓冲液清洗2次,接着加入2.5%的戊二醛溶液固定2 h,然后依次用30%、50%、70%和90%的乙醇脱水10 min。最后样品经超临界干燥仪(Emitech K850,英国)干燥后采用扫描电镜(FEI Quanta 200,芬兰)观测。
1.3 不同载体体系中菲的微生物降解向40 mL玻璃离心管中添加0.1 g载体(蒙脱石、玉米秸秆炭、针铁矿),经灭菌处理后,向每支离心管中添加9 mL灭菌的无机盐培养基,随后分别添加10 μL或50 μL菲的丙酮溶液(2×104 mg·L–1),使两种体系中菲浓度为20或100 mg·L–1,然后按照10%的接种比例,接种1 mL已制备的菌液[25],用盐酸将体系pH调整至6.8左右,同时设置不添加载体的接菌处理、只添加载体和不添加载体不接菌的对照处理。将所有的离心管置于摇床中,28℃、160 r·min–1避光振荡培养,每隔一定时间破坏性取三组平行样品,测定菲残留量。另外取三组测定EPS以及AHLs。降解实验结束后,离心收集载体,采用扫描电镜观测载体上降解菌的负载情况。
1.4 菲的提取和测定每个处理取三组平行样品,每个离心管中加入20 mL萃取剂(丙酮:二氯甲烷=1:3,v/v)振荡混合,超声处理2 h,提取残留菲[26]。取悬浮液2 000 r·min–1离心5 min,分离水相和有机相。有机相经0.22 μm尼龙有机滤膜过滤。采用高效液相色谱法(Agilent1260,Agilent,美国),配备多环芳烃专用柱(250 mm×4.6 mm,5 μm)和荧光检测器,测定萃取物中的菲[11]。菲的激发波长为245 nm,发射波长为365 nm。流动相为乙腈和超纯水(9:1,v/v),流速为1.5 mL·min–1。
在不同载体体系加入菲(20 mg·L–1)进行质量控制实验,采样和分析步骤与上述相同。菲的回收率在99.7%~105.2%之间。
1.5 胞外聚合物的提取和测定采用阳离子交换树脂法提取降解菌产生的EPS[8]。向不同处理组的离心管中加入1.0 g阳离子交换树脂(CER,001×7,钠型,三兴),2 500 r·min–1振荡2 h,静置5 min以分离CER。将上悬液在4 000 r·min–1、4℃条件下离心20 min,取上清液通过0.45 µm水系滤膜过滤去除颗粒和细菌细胞,4℃储存,之后用于EPS的生化成分分析。EPS中的多糖含量采用苯酚硫酸法测定,以葡萄糖为标准物质绘制标准曲线[27]。EPS中的蛋白质含量采用Folin-酚法测定,以牛血清白蛋白为标准物质绘制标准曲线[25]。
1.6 AHLs的提取和测定在菲的微生物降解过程中,提取并测定不同降解体系中菌株生成的AHLs。将悬浮液转移至离心管中,加入20 mL 0.02 mol·L–1冰醋酸的乙酸乙酯萃取AHLs[28],超声处理1 h,离心取上层有机相,按同样的方法重复萃取两次,混合有机相,旋转蒸发至近干,用乙腈定容至100 μL,过0.22 μm尼龙有机滤膜。采用高效液相色谱/串联质谱(HPLC-MS/MS)对提取物中AHLs进行分析[29],建立了12种AHLs的检测方法。流动相由0.1%的甲酸水溶液和乙腈组成,流速为0.25 mL·min–1。
1.7 数据统计分析采用一级动力学模型和Logistics动力学模型[30]对菲的降解动力学数据进行拟合:
| $ \begin{gathered} C / C_0=\exp (-k t) \end{gathered}$ | (1) |
| $ C / C_0=1 /(1+\exp (k(\ln t-c))) $ | (2) |
式中,C0和C分别为初始菲浓度和特定培养时间t(d)时体系中菲的残留浓度(mg·L–1),k为菲降解速率常数(d–1),exp(c)为Logistics菲降解动力学的半衰期(d)。
2 结果 2.1 鞘脂菌PHE3在不同载体表面的附着利用扫描电镜(SEM)对营养肉汤培养基中鞘脂菌PHE3在不同载体表面的负载情况进行表征(图 1)。鞘脂菌PHE3呈杆状或椭球状附着在载体表面,菌体大小约0.5~1.5 μm,菌形态完好。在玉米秸秆炭的表面可以清晰观察到大量细菌附着生长,排列紧密,有生物膜形成。同样在蒙脱石的表面及狭缝的微孔中也有较多的细菌定殖,负载效果较好。而在高岭石体系中,高岭石表现出团聚现象,仅有极少数的细菌附着在其表面。针铁矿呈现独特的针状结构,其表面负载的菌也较少。简言之,鞘脂菌PHE3在玉米秸秆炭和蒙脱石载体表面附生效果较好,而在高岭石和针铁矿载体表面负载效果较差,这可能与载体本身的性质以及载体与细菌之间的静电作用等相互作用有关。

|
图 1 营养肉汤培养基中培养2 d后鞘脂菌PHE3在不同载体表面负载的扫描电镜图 Fig. 1 Scanning electron microscope results of Sphingobium sp. PHE3 on different carriers in nutrient broth medium after 2 days incubation |
根据载体筛选的扫描电镜结果(图 1),选择菌株负载效果较好的蒙脱石和玉米秸秆炭以及具有独特结构的针铁矿为载体,添加到菲的降解体系中。如图 2所示,添加蒙脱石、玉米秸秆炭和针铁矿载体均能在一定程度上促进微生物对菲的降解。当菲初始浓度较低为20 mg·L–1时,3 d后添加和不添加载体的不接菌对照处理菲的非生物损失小于10.9%(图 2a)。添加玉米秸秆生物炭的微生物降解体系中菲的降解速率最快,3 d内降解率达到68.3%(表 1)。同时,添加蒙脱石和针铁矿的微生物降解体系,3 d内菲的降解率分别为54.8%和49.5%,而未添加载体只接种菌的处理中菲的降解速率最低(图 2a)。一级动力学模型可较好表征低浓度下菲的降解动力学(表 1),不同体系中菲的微生物降解速率常数从高到低依次为:添加玉米秸秆炭接菌处理、添加蒙脱石接菌处理、添加针铁矿接菌处理、只接菌处理。
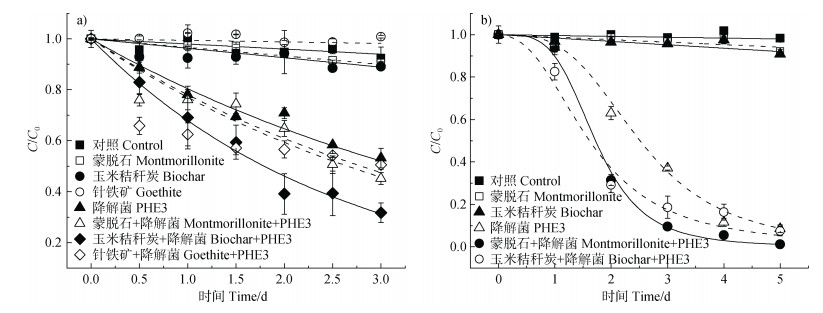
|
注:a),菲初始浓度20 mg·L–1时的一级动力学模型拟合。b),菲初始浓度100 mg·L–1时的Logistics动力学模型拟合。 Note: a), First-order kinetic model fitting of phenanthrene at the initial concentration of 20 mg·L–1. b), Logistics kinetic model fitting of phenanthrene at the initial concentration of 100 mg·L–1. 图 2 不同载体体系中鞘脂菌PHE3对菲的降解 Fig. 2 Degradation of phenanthrene by Sphingobium sp. PHE3 in different carrier systems |
|
|
表 1 不同载体体系中菲的降解动力学 Table 1 Kinetics of phenanthrene biodegradation in different carrier systems |
根据以上结果,菲的初始浓度增至100 mg·L–1时,选用对菲微生物降解促进作用较好的蒙脱石和玉米秸秆炭为载体,结果表明5 d后未添加以及添加载体的未接种对照处理的非生物损失在菲初始浓度的9.2%以内(图 2b)。在菲降解初期第1天内,只接菌处理和添加蒙脱石的接菌处理中菲的降解比较缓慢,这可能是因为降解菌在接种到降解体系的最初一段时间内活性较低,处于迟滞适应阶段[7,31](图 2b)。未添加载体的接种处理在培养3 d后微生物降解率约为63%,添加蒙脱石和玉米秸秆炭均显著提高了鞘脂菌PHE3对菲的降解效率。与只接种降解菌处理组相比,添加蒙脱石和玉米秸秆炭对菲的微生物降解率分别提高了44%和29%(表 1)。在菲降解后期,添加玉米秸秆炭的接菌处理对菲的降解增加变缓,降解率低于添加蒙脱石的接菌处理,这可能是由于随着菲残留浓度的降低,有限的碳源菲又被生物炭紧密吸附,进入生物炭的微孔结构中,微生物及其降解酶难以有效接触,导致其微生物可利用性降低[32]。5 d内添加蒙脱石的接种处理几乎彻底降解体系中的菲,降解率高达98.8%,这可能是由于蒙脱石较高的比表面积刺激了菲的微生物降解[11]。所有接菌处理中菲的降解过程均可以用Logistics降解动力学模型进行很好地拟合(表 1)。菲在添加蒙脱石体系中的微生物降解速率最高,为4.31 d–1,其次是只接菌不添加载体的体系(3.52 d–1),添加玉米秸秆炭体系的微生物降解速率较低。然而,只接菌体系和蒙脱石接菌体系中菲的微生物降解有1 d的延迟,但在添加玉米秸秆炭的接菌体系中未观察到此现象(图 2b),说明高浓度的菲对降解菌活性有一定抑制[33],而玉米秸秆炭对菲较强的吸附能力减弱了高浓度菲的毒性胁迫,这也导致了菲在玉米秸秆炭接菌处理中的降解半衰期最短,仅为1.62 d(表 1)。
2.3 不同载体体系中EPS的生成胞外聚合物提取测定结果表明,随培养时间的增加,不同载体体系中EPS的多糖和蛋白质组分均表现出先增加后减少的趋势(图 3)。因为在培养初期,菲浓度较高,对于微生物来说碳源充足,降解菌生长繁殖较快,其分泌的EPS随之增加,随着培养时间增加,菲逐渐被降解而浓度降低,碳源受限,降解菌生长变缓,活性降低,其产生的EPS随之减少。与只接种降解菌的体系相比,添加蒙脱石和玉米秸秆炭明显增加细菌EPS的产生,而添加针铁矿对降解菌生成EPS的促进作用不明显,甚至出现抑制。菲初始浓度为20 mg·L–1时,不同载体体系中降解菌产生的多糖在1.5 d后达最大值,其中只接菌体系中多糖含量为8.9 mg·L–1,添加蒙脱石和玉米秸秆炭载体促进了降解菌分泌多糖,而添加针铁矿则抑制了这一过程(图 3a)。菲降解3 d后,不同载体体系中的蛋白质含量表现为:添加玉米秸秆炭处理中生成量最高,达10.2 mg·L–1,添加蒙脱石和针铁矿处理的蛋白质含量分别为8.7和7.3 mg·L–1,而只接菌处理中蛋白质含量最低(图 3b)。这与上述不同载体体系中菲的微生物降解率结果一致(图 2a),说明EPS产量的增加与菲的微生物降解密切相关。
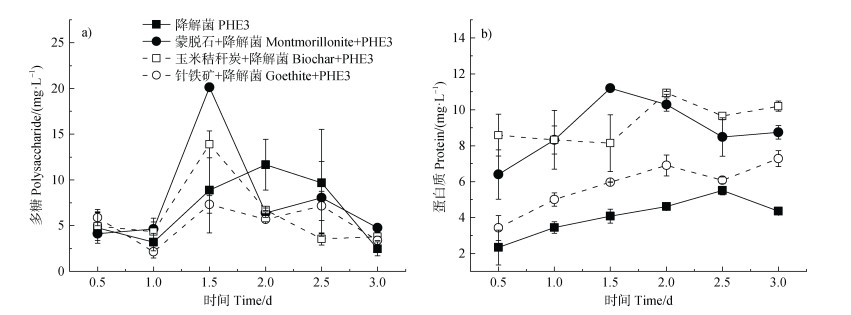
|
图 3 菲(20 mg·L–1)降解过程中不同载体体系中EPS多糖(a)和蛋白质(b)的含量 Fig. 3 Polysaccharide(a)and protein(b)content of the EPS in different carrier systems during phenanthrene biodegradation at an initial concentration of 20 mg·L–1 |
降解菌在不同载体表面的负载情况如图 4所示,鞘脂菌PHE3在降解菲的过程中,能够在玉米秸秆炭和蒙脱石表面附着生长,而且降解菌与载体表面结合牢固,形态大小生长良好,能够很好地定殖在载体表面。与添加蒙脱石处理相比,可以观察到玉米秸秆炭表面负载的降解菌数量更多。蒙脱石的双层片状结构可能导致降解菌进入到蒙脱石的内部而不易被观测到。随着降解时间的延长,载体表面负载的降解菌数量呈现先增加后减少的变化,在降解后期,随着体系中菲残留浓度的降低,可供利用的碳源能源减少,细菌的活性降低,细菌细胞形态受损,饱和度有所下降。
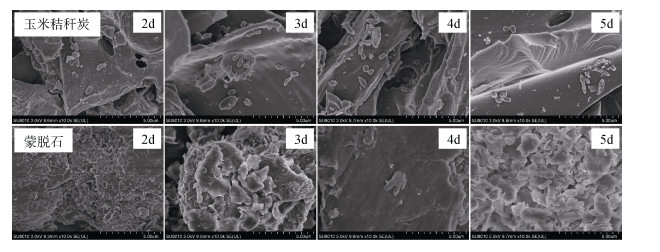
|
图 4 菲(100 mg·L–1)降解过程中鞘脂菌PHE3在不同载体表面负载的扫描电镜图 Fig. 4 Scanning electron microscope results of Sphingobium sp. PHE3 loading on different carriers during phenanthrene biodegradation at an initial concentration of 100 mg·L–1 |
在菲降解过程中,对所有接菌体系的12种AHLs检测发现,其中,菲降解2 d后,不同载体体系中菌株产生的AHLs的浓度最高。在所有接菌体系中均只检测到C8-HSL和C12-HSL两种AHLs的生成(图 5)。只接菌处理中产生的C8-HSL和C12-HSL的含量均最高,分别达89.0和76.4 ng·L–1,远高于另两组添加载体的接菌处理,添加玉米秸秆炭的接菌处理次之,添加蒙脱石的接菌处理中生成的C8-HSL和C12-HSL最少,分别为0.41和0.12 ng·L–1。可见,蒙脱石和玉米秸秆炭载体材料的添加对菲微生物降解过程中信号分子AHLs的释放规律产生了一定影响。
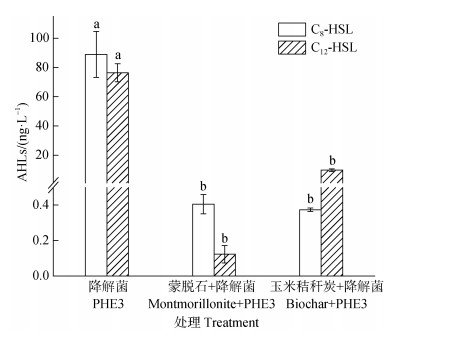
|
注:菲初始浓度为100 mg·L–1。横线上不同字母表示处理间差异显著(P < 0.05)。 Note: The initial concentration of phenanthrene was 100 mg·L–1. Different letters on the bars indicate a significant difference between treatments(P < 0.05). 图 5 菲降解2 d后不同载体体系中AHLs的含量 Fig. 5 Content of AHLs in different carrier systems after 2 days of phenanthrene biodegradation |
鞘脂菌PHE3能够在玉米秸秆炭和蒙脱石表面形成生物膜,负载效果较好,但在高岭石和针铁矿表面负载的细菌数量较少(图 1)。这归因于玉米秸秆炭具有丰富的孔隙结构,其较大的比表面积可以为细菌提供更多的附着空间。生物炭中富含碳、氮等营养元素,可以为细菌在其表面的生长繁殖提供所需的营养物质。通常,细菌表面带负电荷,针铁矿表面带正电荷,针铁矿表面与细菌之间表现为较强的静电引力,其特有的针状结构可以刺破细菌细胞膜引起细胞失活,受损或死亡的细菌可能会通过释放信号分子调控体系中活细胞的行为,使细菌远离针铁矿表面,向水相培养基移动[34-35]。而蒙脱石和高岭石表面均带负电荷,且高岭石的电负性大于蒙脱石,因此蒙脱石对细菌的静电斥力较小,其较高的比表面积也有利于细菌的附着生长,细菌可以越过能障固定在蒙脱石表面,进而在其表面生长繁殖形成生物膜[36]。而高岭石与细菌之间的静电斥力较强,细菌难以突破能障附着在其表面,而且高岭石释放的溶解性铝能够通过改变细胞膜的通透性降低细菌细胞活性,从而影响细菌在高岭石表面负载[36-37]。
与只接种降解菌的处理相比,添加蒙脱石和玉米秸秆炭载体明显促进了菲的微生物降解,而添加针铁矿对菲微生物降解的促进作用不明显(图 2,表 1)。这是由于菲的降解效率主要受降解菌细胞活性的控制,针铁矿与降解菌之间强烈的相互作用会导致细胞受损或死亡。针铁矿的存在可与降解菌分泌的氧化酶产生H2O2构成类芬顿体系,催化产生活性自由基,对降解菌的活性具有一定毒害作用,可以引起细胞的氧化应激反应增加对碳源菲的摄取利用,而且产生的羟基自由基可能参与了菲的氧化降解,导致在降解初期0.5 d内菲的下降较快,但针铁矿长期的毒害胁迫导致降解菌活性下降、数量减少,从而使菲的降解速率在后期减缓[38]。此外,Gan等[38]发现相较于活的降解菌细胞,致死的细胞对PAHs的吸附亲和力更强,从而造成活细胞对PAHs的有效接触受到限制,进一步影响PAHs的降解效率。蒙脱石和玉米秸秆炭均具有较高的比表面积,可以为细菌提供大量的附着位点。玉米秸秆炭含有丰富的大孔结构,而大孔是细菌生存和繁殖的主要场所[39],在菲降解过程中可以看到降解菌能够较容易定殖在这两种载体表面,且在玉米秸秆炭表面的附生效果最好(图 4),表明添加这两种载体尤其是玉米秸秆炭增加了降解菌的稳定性,增强了其耐受高浓度污染环境胁迫的能力,从而加快菲微生物降解的反应启动速度[40]。此外,蒙脱石的疏水性大于针铁矿[35],玉米秸秆炭对PAHs具有较强的吸附能力[41-42],因此蒙脱石和玉米秸秆炭可以富集疏水性化合物菲,有助于定殖在载体表面的降解菌集中利用污染物菲[39,43],从而提高降解菌对菲的降解效率。
添加不同载体材料对鞘脂菌PHE3降解菲的促进作用还与降解菌EPS的生成密切相关。相较于只接菌的处理,添加蒙脱石和玉米秸秆炭载体促进了降解菌EPS中多糖和蛋白质的生成,而针铁矿的促进作用不明显(图 3),这与不同载体体系中菲微生物降解结果一致(图 2)。细菌附着在非生物表面会刺激生物膜形成过程中EPS的合成[44]。蒙脱石和玉米秸秆炭载体较高的比表面积为降解菌的附着提供更多空间,细菌黏附到载体表面后,大量分泌EPS,进一步生长繁殖形成生物膜[45]。通常,细菌通过生成的EPS来应对恶劣的环境条件[25],EPS通过包裹细菌为细菌细胞外环境提供了一个相对稳定的缓冲区[8]。在本研究中,菲是疏水性的有机污染物,不易被微生物接触。而EPS中表面活性剂的生成有利于增加细菌表面的疏水性[20],能够促进多环芳烃从细菌胞外到胞内的传质过程[8],从而增加疏水化合物与降解菌结合。同时,EPS中蛋白质和多糖产量的增加可以吸附更多菲及其中间产物,提高其生物可及性,从而增强微生物对多环芳烃的降解效率。此外,EPS中的氧化还原酶如漆酶、多酚氧化酶和过氧化氢酶,在多环芳烃的降解过程中起着至关重要的作用[46]。
降解菌在载体表面定殖,缩短了微生物之间的距离,增加了细胞密度(图 4),这将有利于细菌群体感应的发生,促进细菌之间进行信息交流,提高信号传导的效率。本实验中鞘脂菌PHE3在降解菲过程中产生C8-HSL和C12-HSL两种AHLs,且只接菌处理中产生的两种AHLs的含量显著高于添加蒙脱石和玉米秸秆炭载体的接菌处理(图 5)。群体感应信号分子AHLs可直接调控降解基因表达影响有机污染物的降解,也能通过调控EPS组分变化间接促进污染物降解[15]。有报道曾指出信号分子AHLs的浓度可通过非生物降解反应而降低,且AHLs的水解失活通常发生在碱性条件下[47]。本实验中整个培养过程pH控制在6.8左右。根据Englmann等[48]的研究结果,室温条件下、pH为6.8时,C8-HSL和C10-HSL的水解半衰期均大于10 d,因而在实验中控制的pH条件下,水解反应受到抑制,AHLs比较稳定。Wang等[49]研究表明附着在黏土颗粒载体上的微生物群落产生的不同AHLs比游离的微生物群落少,这与本研究结果一致,这可能是因为附着在载体材料上的微生物群落在降解污染物时更具有优势,它能够以较少的能量产生信号分子来实现良好的细胞间通信,从而达到1,2,4-三氯苯的高效矿化。因此,添加载体后微生物的对多环芳烃菲的降解能力得到增强有可能是群体感应在发挥作用,此处还需要进一步的研究来验证。
4 结论鞘脂菌PHE3能够附着在载体表面形成生物膜,添加蒙脱石和玉米秸秆炭载体明显促进了细菌EPS产量的增加,提高了菲的生物有效性,从而增强了菲的微生物降解,而添加针铁矿载体对菲降解的促进作用不明显。在生物炭和蒙脱石载体体系中,群体感应可能在调控微生物高效降解菲过程中发挥了一定作用,鞘脂菌PHE3在降解过程中分泌C8-HSL和C12-HSL两种AHLs,可能在一定程度上调控EPS的产生,使降解菌在载体表面快速定殖和生长,强化对菲的传质和降解作用。
| [1] |
Du Z D, Dai Y L, Li Y J, et al. Bioaugmentation of polycyclic aromatic hydrocarbons-contaminated soil with Pleurotus ostreatus and Sphingobium sp. NS7 and their synergistic effect (In Chinese)[J]. Microbiology China, 2021, 48(12): 4530-4540. [杜志德, 戴叶亮, 李艳洁, 等. 糙皮侧耳和鞘脂菌NS7对多环芳烃污染土壤的生物强化与协同作用[J]. 微生物学通报, 2021, 48(12): 4530-4540.]
(  0) 0) |
| [2] |
Seo J S, Keum Y S, Li Q X. Bacterial degradation of aromatic compounds[J]. International Journal of Environmental Research and Public Health, 2009, 6(1): 278-309. DOI:10.3390/ijerph6010278
(  0) 0) |
| [3] |
Li C, Yang L L, Liu X Y, et al. Bridging the energy benefit and POPs emission risk from waste incineration[J]. The Innovation, 2021, 2(1): 100075. DOI:10.1016/j.xinn.2020.100075
(  0) 0) |
| [4] |
Bamforth S M, Singleton I. Bioremediation of polycyclic aromatic hydrocarbons: Current knowledge and future directions[J]. Journal of Chemical Technology & Biotechnology, 2005, 80(7): 723-736.
(  0) 0) |
| [5] |
Samanta S K, Singh O V, Jain R K. Polycyclic aromatic hydrocarbons: Environmental pollution and bioremediation[J]. Trends in Biotechnology, 2002, 20(6): 243-248. DOI:10.1016/S0167-7799(02)01943-1
(  0) 0) |
| [6] |
Alegbeleye O O, Opeolu B O, Jackson V A. Polycyclic aromatic hydrocarbons: A critical review of environmental occurrence and bioremediation[J]. Environmental Management, 2017, 60(4): 758-783. DOI:10.1007/s00267-017-0896-2
(  0) 0) |
| [7] |
Liu S L, Luo Y M, Wu L H, et al. Remediation of benzo[a]pyrene-contaminated soil through its co-metabolism with soil microbes (In Chinese)[J]. Acta Pedologica Sinica, 2010, 47(2): 364-369. [刘世亮, 骆永明, 吴龙华, 等. 污染土壤中苯并[a]芘的微生物共代谢修复研究[J]. 土壤学报, 2010, 47(2): 364-369.]
(  0) 0) |
| [8] |
Han C, Zhang Y P, Redmile-Gordon M, et al. Organic and inorganic model soil fractions instigate the formation of distinct microbial biofilms for enhanced biodegradation of benzo[a]pyrene[J]. Journal of Hazardous Materials, 2021, 404: 124071. DOI:10.1016/j.jhazmat.2020.124071
(  0) 0) |
| [9] |
Li X, Zhang X Y, Zhou J, et al. Degradation characteristics and metabolic pathway of a pyrene-degrading Pseudomonas aeruginosa strain (In Chinese)[J]. Environmental Science, 2018, 39(4): 1794-1803. [李想, 张雪英, 周俊, 等. 1株铜绿假单胞菌对芘的降解特性及代谢途径[J]. 环境科学, 2018, 39(4): 1794-1803.]
(  0) 0) |
| [10] |
Liu W W, Yin R, Lin X G, et al. Effect of biosurfactant enhancing bioremediation of polycyclic aromatic hydrocarbons(PAHs)contaminated soils (In Chinese)[J]. Acta Pedologica Sinica, 2010, 47(6): 1118-1125. [刘魏魏, 尹睿, 林先贵, 等. 生物表面活性剂强化微生物修复多环芳烃污染土壤的初探[J]. 土壤学报, 2010, 47(6): 1118-1125.]
(  0) 0) |
| [11] |
Wang Z Q, Sheng H J, Xiang L L, et al. Different performance of pyrene biodegradation on metal-modified montmorillonite: Role of surface metal ions from a bioelectrochemical perspective[J]. Science of the Total Environment, 2022, 805: 150324. DOI:10.1016/j.scitotenv.2021.150324
(  0) 0) |
| [12] |
Ghosal D, Ghosh S, Dutta T K, et al. Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons(PAHs): A review[J]. Frontiers in Microbiology, 2016, 7: 1369.
(  0) 0) |
| [13] |
Zhang X N, Jia H B, Wang W, et al. Impacts of different immobilization materials for Fusarium. sp on the remediation of aged soils polluted with HMW-PAHs (In Chinese)[J]. Acta Scientiae Circumstantiae, 2017, 37(3): 1107-1114. [张雪娜, 贾海滨, 王伟, 等. 不同载体材料固定化Fusarium.sp修复老化污染土壤中HMW-PAHs的研究[J]. 环境科学学报, 2017, 37(3): 1107-1114.]
(  0) 0) |
| [14] |
Wang C H, Gu L F, Ge S M, et al. Remediation potential of immobilized bacterial consortium with biochar as carrier in pyrene-Cr(VI)co-contaminated soil[J]. Environmental Technology, 2019, 40(18): 2345-2353. DOI:10.1080/09593330.2018.1441328
(  0) 0) |
| [15] |
Liu Y N, Zhu Y N, Wang J F, et al. The extracellular removal mechanism of organic pollutants and the regulation characteristics of microbial quorum sensing (In Chinese)[J]. Industrial Water Treatment, 2021, 41(6): 1-13. [刘亚南, 朱颖楠, 王瑾丰, 等. 有机污染物胞外作用机理及微生物群体感应调控特征[J]. 工业水处理, 2021, 41(6): 1-13.]
(  0) 0) |
| [16] |
Papenfort K, Bassler B L. Quorum sensing signal–response systems in Gram-negative bacteria[J]. Nature Reviews Microbiology, 2016, 14(9): 576-588. DOI:10.1038/nrmicro.2016.89
(  0) 0) |
| [17] |
Mangwani N, Kumari S, Das S. Involvement of quorum sensing genes in biofilm development and degradation of polycyclic aromatic hydrocarbons by a marine bacterium Pseudomonas aeruginosa N6P6[J]. Applied Microbiology and Biotechnology, 2015, 99(23): 10283-10297. DOI:10.1007/s00253-015-6868-7
(  0) 0) |
| [18] |
Huang J H, Shi Y H, Zeng G M, et al. Acyl-homoserine lactone-based quorum sensing and quorum quenching hold promise to determine the performance of biological wastewater treatments: An overview[J]. Chemosphere, 2016, 157: 137-151. DOI:10.1016/j.chemosphere.2016.05.032
(  0) 0) |
| [19] |
Sun Y P, Guan Y T, Wang D, et al. Potential roles of acyl homoserine lactone based quorum sensing in sequencing batch nitrifying biofilm reactors with or without the addition of organic carbon[J]. Bioresource Technology, 2018, 259: 136-145. DOI:10.1016/j.biortech.2018.03.025
(  0) 0) |
| [20] |
Pacwa-Płociniczak M, Płaza G A, Piotrowska-Seget Z, et al. Environmental applications of biosurfactants: Recent advances[J]. International Journal of Molecular Sciences, 2011, 12(1): 633-654. DOI:10.3390/ijms12010633
(  0) 0) |
| [21] |
Kang Y S, Park W. Contribution of quorum-sensing system to hexadecane degradation and biofilm formation in Acinetobacter sp. strain DR1[J]. Journal of Applied Microbiology, 2010, 109(5): 1650-1659.
(  0) 0) |
| [22] |
Mangwani N, Kumari S, Das S. Effect of synthetic N-acylhomoserine lactones on cell-cell interactions in marine Pseudomonas and biofilm mediated degradation of polycyclic aromatic hydrocarbons[J]. Chemical Engineering Journal, 2016, 302: 172-186. DOI:10.1016/j.cej.2016.05.042
(  0) 0) |
| [23] |
Sheng H J, Harir M, Boughner L A, et al. N-acyl-homoserine lactone dynamics during biofilm formation of a 1, 2, 4-trichlorobenzene mineralizing community on clay[J]. Science of the Total Environment, 2017, 605/606: 1031-1038. DOI:10.1016/j.scitotenv.2017.06.233
(  0) 0) |
| [24] |
生弘杰. 生物膜群体感应协同微生物降解持久性有机污染物作用机制[D]. 北京: 中国科学院大学, 2018. Sheng H J. Biodegradation mechanism of persistent organic pollutants(POPs)by biofilm quorum sensing[D]. Beijing: University of Chinese Academy of Sciences, 2018. (  0) 0) |
| [25] |
Zhang Y P, Wang F, Zhu X S, et al. Extracellular polymeric substances govern the development of biofilm and mass transfer of polycyclic aromatic hydrocarbons for improved biodegradation[J]. Bioresource Technology, 2015, 193: 274-280. DOI:10.1016/j.biortech.2015.06.110
(  0) 0) |
| [26] |
Jia H Z, Zhao S, Shi Y F, et al. Transformation of polycyclic aromatic hydrocarbons and formation of environmentally persistent free radicals on modified montmorillonite: The role of surface metal ions and polycyclic aromatic hydrocarbon molecular properties[J]. Environmental Science & Technology, 2018, 52(10): 5725-5733.
(  0) 0) |
| [27] |
Jiang Q, Xie Y. Improvement of method for determination of polysaccharide by phenol-sulfuric acid method (In Chinese)[J]. Jiangsu Agricultural Sciences, 2013, 41(12): 316-318. [姜琼, 谢妤. 苯酚-硫酸法测定多糖方法的改进[J]. 江苏农业科学, 2013, 41(12): 316-318.]
(  0) 0) |
| [28] |
Ma C C, Li B L, Ou J, et al. Detection of N-acyl-homoserine lactones class signal molecules of quorum sensing secreted by bacteria using high performance liquid chromatography-mass spectrometry/mass spectrometry (In Chinese)[J]. Chinese Journal of Analytical Chemistry, 2010, 38(10): 1428-1432. [马晨晨, 李柏林, 欧杰, 等. 高效液相色谱-串联质谱法同时测定细菌群体感应效应的11种AHLs类信号分子[J]. 分析化学, 2010, 38(10): 1428-1432.]
(  0) 0) |
| [29] |
Xu Y, Curtis T, Dolfing J, et al. N-acyl-homoserine-lactones signaling as a critical control point for phosphorus entrapment by multi-species microbial aggregates[J]. Water Research, 2021, 204: 117627. DOI:10.1016/j.watres.2021.117627
(  0) 0) |
| [30] |
Wang Z Q, Li Y B, Tan X P, et al. Effect of arsenate contamination on free, immobilized and soil alkaline phosphatases: Activity, kinetics and thermodynamics[J]. European Journal of Soil Science, 2017, 68(1): 126-135. DOI:10.1111/ejss.12397
(  0) 0) |
| [31] |
Yu H Y, Zhang X X, Jiang Q W, et al. Adsorption- degradation of polycyclic aromatic hydrocarbons by biochar microbial inoculants (In Chinese)[J]. Environmental Science & Technology, 2020, 43(12): 120-124. [于红艳, 张昕欣, 江巧文, 等. 生物炭菌剂对多环芳烃的吸附及降解作用研究[J]. 环境科学与技术, 2020, 43(12): 120-124.]
(  0) 0) |
| [32] |
Shi H L, Zhou Q X. Research progresses in the effect of biochar on soil-environmental behaviors of pollutants (In Chinese)[J]. Chinese Journal of Ecology, 2014, 33(2): 486-494. [石红蕾, 周启星. 生物炭对污染物的土壤环境行为影响研究进展[J]. 生态学杂志, 2014, 33(2): 486-494.]
(  0) 0) |
| [33] |
Lu X X, Li X L, Ma J, et al. Enhanced bioremediation of coking plant soils contaminated with polycyclic aromatic hydrocarbons (In Chinese)[J]. Environmental Science, 2011, 32(3): 864-869. [卢晓霞, 李秀利, 马杰, 等. 焦化厂多环芳烃污染土壤的强化微生物修复研究[J]. 环境科学, 2011, 32(3): 864-869.]
(  0) 0) |
| [34] |
马文婷. 土壤矿物介导下细菌生物膜形成过程及机制[D]. 武汉: 华中农业大学, 2017. Ma W T. The processes and mechanisms of bacteria biofilm formation in the precence of soil minerals[D]. Wuhan: Huazhong Agricultural University, 2017. (  0) 0) |
| [35] |
Ma W T, Peng D H, Walker S L, et al. Bacillus subtilis biofilm development in the presence of soil clay minerals and iron oxides[J]. NPJ Biofilms and Microbiomes, 2017, 3: 4.
(  0) 0) |
| [36] |
Gan X H, Teng Y, Xu J, et al. Influence of kaolinite and montmorillonite on benzo[a]pyrene biodegradation by Paracoccus aminovorans HPD-2 and the underlying interface interaction mechanisms[J]. Pedosphere, 2022, 32(2): 246-255.
(  0) 0) |
| [37] |
Londono S C, Hartnett H E, Williams L B. Antibacterial activity of aluminum in clay from the Colombian Amazon[J]. Environmental Science & Technology, 2017, 51(4): 2401-2408.
(  0) 0) |
| [38] |
Gan X H, Teng Y, Zhao L, et al. Influencing mechanisms of hematite on benzo(a)pyrene degradation by the PAH-degrading bacterium Paracoccus sp. Strain HPD-2:Insight from benzo(a)pyrene bioaccessibility and bacteria activity[J]. Journal of Hazardous Materials, 2018, 359: 348-355.
(  0) 0) |
| [39] |
孙安琪. 炭基材料固定化微生物及其对PAHs污染土壤的修复研究[D]. 福建泉州: 华侨大学, 2019. Sun A Q. Study of biochar immobilized bacteria and its removal of PAHs in soil[D]. Quanzhou, Fujian: Huaqiao University, 2019. (  0) 0) |
| [40] |
Qian L B, Yuan M X, Chen B L. Research progress about bioremediation of polycyclic aromatic hydrocarbons contaminated soil with immobilized microorganism technique (In Chinese)[J]. Environmental Science, 2012, 33(5): 1767-1776. [钱林波, 元妙新, 陈宝梁. 固定化微生物技术修复PAHs污染土壤的研究进展[J]. 环境科学, 2012, 33(5): 1767-1776.]
(  0) 0) |
| [41] |
刘伟鹏. 不同热解温度生物炭对多环芳烃的吸附—解吸附特性研究[D]. 沈阳: 辽宁大学, 2018. Liu W P. Study on adsorption-desorption properties of PAHs by biochar with different pyrolysis temperatures[D]. Shenyang: Liaoning University, 2018. (  0) 0) |
| [42] |
Zhang M, Jia M Y, Bian Y R, et al. Sorption kinetics and mechanism of naphthalene on corn-stalkderived biochar with different pyrolysis temperature (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(5): 1106-1115. [张默, 贾明云, 卞永荣, 等. 不同温度玉米秸秆生物炭对萘的吸附动力学特征与机理[J]. 土壤学报, 2015, 52(5): 1106-1115.]
(  0) 0) |
| [43] |
阮博. 蒙脱石介导鞘氨醇单胞菌GY2B降解菲过程的作用机制研究[D]. 广州: 华南理工大学, 2020. Ruan B. Mechanism of montmorillonite-mediated biodegradation of phenanthrene by Sphingomonas sp. GY2B[D]. Guangzhou: South China University of Technology, 2020. (  0) 0) |
| [44] |
Jayasinghearachchi H S, Seneviratne G. Fungal solubilization of rock phosphate is enhanced by forming fungal-rhizobial biofilms[J]. Soil Biology & Biochemistry, 2006, 38(2): 405-408.
(  0) 0) |
| [45] |
Dong R Y, Yu X Q, Zeng M Y, et al. Effects of quorum sensing on biofilm formation and regulation of bacteria-A review (In Chinese)[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(3): 271-277. [董汝月, 于晓倩, 曾名湧, et al. 细菌群体感应对细菌生物膜形成与调控的研究进展[J]. 生物加工过程, 2019, 17(3): 271-277.]
(  0) 0) |
| [46] |
Jia C Y, Li P J, Li X J, et al. Degradation of pyrene in soils by extracellular polymeric substances(EPS)extracted from liquid cultures[J]. Process Biochemistry, 2011, 46(8): 1627-1631.
(  0) 0) |
| [47] |
Gao X D, Cheng H Y, del Valle I, et al. Charcoal disrupts soil microbial communication through a combination of signal sorption and hydrolysis[J]. ACS Omega, 2016, 1(2): 226-233.
(  0) 0) |
| [48] |
Englmann M, Fekete A, Kuttler C, et al. The hydrolysis of unsubstituted N-acylhomoserine lactones to their homoserine metabolites: Analytical approaches using ultra performance liquid chromatography[J]. Journal of Chromatography A, 2007, 1160(1/2): 184-193.
(  0) 0) |
| [49] |
Wang F, Fekete A, Harir M, et al. Soil remediation with a microbial community established on a carrier: Strong hints for microbial communication during 1, 2, 4-Trichlorobenzene degradation[J]. Chemosphere, 2013, 92(11): 1403-1409.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


