2. 中国科学院大学, 北京 100049;
3. 中国科学院常熟农业生态实验站, 江苏常熟 215555;
4. 南京大学环境学院, 南京 210023
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Changshu Agro-ecological Experimental Station, Chinese Academy of Sciences, Changshu, Jiangsu 215555, China;
4. School of Environment, Nanjing University, Nanjing 210023, China
反硝化和硝酸根异化还原成铵(Dissimilatory nitrate reduction to ammonium,DNRA)是氮素生物地球化学循环中两种重要的厌氧氮转化过程[1-2]。其中反硝化是将硝酸根(NO3–)或亚硝酸根(NO2–)逐步还原为一氧化氮(NO)、氧化亚氮(N2O)和氮气(N2)的过程,而DNRA则是将NO3–还原为铵根(NH4+)的过程。水稻田长期淹水所形成的厌氧环境为上述两种过程提供了适宜的环境。对于稻田生态系统而言,反硝化和DNRA所产生的环境效应截然相反[3]。反硝化是稻田土壤氮素损失的最主要途径,不仅降低氮肥利用率和土壤肥力,还会增加温室气体N2O的排放,而DNRA通过将易淋溶的NO3–转化为更有利于土壤固持的NH4+可以保氮,是农学上所希望看到的[4-5]。因此,明确稻田土壤NO3–还原过程速率及其在反硝化和DNRA之间分配,对于探寻潜在农学调控措施提高稻田土壤保氮和减少硝态氮还原导致的负面环境效应具有重要意义。
过去有关稻田土壤NO3–还原过程的研究多偏重于反硝化,对DNRA过程的关注相对较少[6]。由于DNRA过程需要消耗更多的能量,只有在大量易氧化态有机物和强还原条件下才能进行,因此,以往研究通常认为厌氧条件下反硝化较DNRA更易发生[7-8]。但是近期很多研究表明,DNRA过程的发生对环境条件的要求可能并不像过去认为的那样严格,在微厌氧的河口湿地生态系统中,DNRA较反硝化更具竞争力[9]。近期研究显示,稻田土壤DNRA过程的发生速率介于0.03~5.01 nmol·g–1·h–1,对稻田土壤NO3–还原过程的贡献最高可达17.6%[10],因此DNRA过程不容忽视。
由于NO3–是反硝化和DNRA的共同底物,同一体系中二者对NO3–的竞争不可避免。此外反硝化和DNRA均为异养微生物介导的酶促还原反应,温度和pH通过影响NO3–还原微生物和酶活性进而影响这两个过程[11]。有机碳、Fe2+和S2–等可作为电子供体为反硝化和DNRA提供电子,不同电子供体的具体反应式[12-13]如下:
| $ {\rm{5CH_{2}O + 4NO_{3}^{−} + 4H^{+} → 6N_{2} + 5CO_{2} + 7H_{2}O}} $ |
| $ {\rm{2CH_{2}O + NO_{3}^{−} + 2H^{+} → NH_{4}^{+} + H_{2}O + 2CO_{2}}} $ |
| $ {\rm{10Fe^{2+} + 2NO_{3}^{−} + 24H_{2}O → 10Fe(OH)_{3} + N_{2} + 18H^{+} }} $ |
| $ {\rm{8Fe^{2+} + NO_{3}^{−} + 10H^{+} → 8Fe^{3+} + NH_{4}^{+} + 3H_{2}O }}$ |
| $ {\rm{5S^{2−} + 8NO_{3}^{−} + 8H^{+} → 5SO_{4}^{2−} + 4N_{2} + 4H_{2}O }}$ |
| $ {\rm{S^{2−} + NO_{3}^{−} + H_{2}O + 2H^{+} → NH_{4}^{+} + SO_{4}^{2−} }}$ |
理论上,还原等量的NO3–,DNRA过程传递的电子数高于反硝化过程,因此,NO3–供应有限和电子供体充足(也即高OC/NO3–)状况下,更利于DNRA过程[14]。但也有研究指出,DNRA过程速率与OC/NO3–相关性不大,电子供体尤其是活性有机碳的含量才是控制DNRA过程的主要因子[15-16]。河口湿地和海洋环境中有关NO3–还原在反硝化和DNRA之间分配的研究已有很多[17-20]。如Wang等[20]对芦苇根际沉积物NO3–异化还原过程的研究发现,反硝化和DNRA对NO3–还原的贡献分别为32.0%~91.8%和4.4%~67.5%,DNRA所占比例甚至与反硝化相当。Deng等[17]发现,长江河口沉积物中DNRA占NO3–还原过程的比重最高可达45%。Rahman等[18-19]发现,相较于反硝化,城市湿地沉积物体系中DNRA的速率对温度、有机碳、NO3–和Fe2+等环境因子变化响应更敏感,其中在添加有机碳和Fe2+的处理中,DNRA速率的增幅要显著高于反硝化速率,即NO3–还原过程更倾向于DNRA发生。通过相关性分析发现,稻田土壤反硝化速率与NO3–、有机碳和nosZ clade I功能基因丰度显著正相关,而DNRA速率与土壤C/N、温度、pH、Fe2+和S2–浓度显著正相关[6,10,21]。然而目前有关环境因子对水稻土NO3–还原过程在反硝化和DNRA之间分配的研究还相对较少,环境因子对NO3–的异化还原途径的调控作用仍不清楚。
基于此,本研究以五常、常熟和雅安水稻土为研究对象,利用15N同位素示踪技术和膜进样质谱仪,研究温度、pH、NO3–浓度、C/N、Fe2+和S2–浓度对反硝化速率、DNRA速率及二者在NO3–还原过程中相对贡献的影响,以期明确环境因子对NO3–异化还原过程速率和分配的调控作用,为提高稻田氮肥利用率及合理制定农田土壤氮素管理措施提供科学依据。
1 材料与方法 1.1 供试材料供试稻田土样分别采集于黑龙江五常(45°18'N,126°48'E)、江苏常熟(31°55'N,120°70'E)和四川雅安(30°10'N,102°55'E)。用土钻采集稻田表层0~20 cm土壤,置于装有冰袋的保温箱中并尽快带回实验室。新鲜土样在通风阴凉处略风干后过10目筛混匀分成两份,一份自然风干,用于土壤基本理化性质测定(表 1);另一份置于4 ℃冰箱短暂保存,随后用于室内培养测定反硝化和DNRA速率。
|
|
表 1 三种水稻土的基本理化性质 Table 1 Basic physicochemical properties of the three tested paddy soils |
采用15N示踪与膜进样质谱仪(Membrane Inlet Mass Spectrometer,MIMS)测定水稻土反硝化和DNRA速率[10]。具体操作流程如下:称取1.5 g过筛鲜土与纯水按质量比1︰7混合成泥浆,曝氦气0.5 h后在厌氧氦环境中将泥浆分装入12 mL Labco顶空瓶中,拧紧瓶盖并保证瓶中没有气泡,置于竖直旋转培养箱内室温避光预培养7 d(消耗体系中背景的NO3–和O2)。预培养结束加入K15NO3(15N丰度99.3%)进行标记,使得体系中15N浓度在100 µmol·L–1(该值依据田面水和土壤背景NO3–浓度而设定)。在1、3、6 h时间点取样并用微量进样针加入200 µL 7 mol·L–1 ZnCl2溶液(ZnCl2通过破坏细菌细胞膜而起到灭菌作用)终止反应。
温度梯度设置为5、15、20、25和35 ℃,预培养结束后,在相应温度下继续培养6 h后加入K15NO3标记继续在该温度下培养;通过添加稀硫酸和氢氧化钠溶液将体系中pH调节为5、6、7、8.5和9.5的目标范围,待体系pH稳定后进行预培养;NO3–浓度梯度设为50、100、150、200和300 µmol·L–1;通过添加葡萄糖调节体系中碳氮比(以质量计)梯度为control、2.5、5、12和30;在厌氧箱中添加硫酸亚铁溶液调节体系中亚铁浓度为0、300、500、800和1 000 µmol·L–1(其中500和800 µmol·L–1分别对应反硝化和DNRA反应化学式中最优化学计量比值设定);在厌氧箱中添加硫化钠溶液调节体系中硫离子浓度为0、50、62.5、100和125 µmol·L–1(其中62.5和100 µmol·L–1分别对应反硝化和DNRA反应化学式中最优化学计量比值设定)。每个处理设置7个重复,其中测定反硝化速率每组为3个重复,测定DNRA速率每组为4个重复。值得指出的是,利用基于MIMS的15N同位素配对技术,在反硝化速率测定组中,同时分析了厌氧氨氧化过程(anaerobic ammonium oxidation,anammox)的速率,发现三种水稻土中anammox速率的占比始终小于硝酸根还原过程的0.05%,近似可以忽略,故在本文中未对anammox过程进行讨论和涉及。
1.3 反硝化和DNRA过程潜势测定培养结束后的样品以2 000 r·min–1的转速离心5 min后,通过MIMS测定上清液中的30N2信号强度。反硝化速率的计算公式[10]如下:
| $ \begin{array}{c}{D}_{29}=\frac{2{P}_{30}\times (1–{\text{F}}_{\mathrm{n}})}{{\text{F}}_{\mathrm{n}}}\\ {D}_{30}={P}_{30}\\ {D}_{\rm{total}}={D}_{29}\text{+}2\times {D}_{30}\\ S_{反硝化}=\frac{\mathrm{slope}_{D\mathrm{total}}\times V}{W}\end{array} $ |
式中,D29和D30分别为反硝化产生的28N2和29N2的量,µmol·L–1;P29和P30分别为MIMS测得的系统中29N2和30N2的量,µmol·L–1;Dtotal为样品中反硝化产生的15N量,µmol·L–1;Fn为加入的NO3–中15 NO3–的比例;S反硝化表示反硝化速率,nmol·g–1·h–1;slopeDtotal为N2浓度与培养时间回归得到的斜率,表示反硝化速率,μmol·L–1·h–1;V表示顶空瓶容积,mL;W表示干土质量,g。
另一批样品则倒入100 mL广口瓶中进行充氦0.5 h,置换出样品中反硝化过程产生的28N2、29N2和30N2后,重新分装到干净的12 mL顶空瓶中,用微量进样针加入200 µL次溴酸钠碘溶液(将液溴与16 mol·L–1 NaOH溶液以1︰5体积比缓慢混合,混合过程需要持续搅拌并保持溶液温度在5 ℃以下,混合后的溶液于4 ℃冰箱静置一周后取出,取上清液与0.2%的KI溶液等体积混合),充分摇匀使得样品完全氧化。用离心机以2 000 r·min–1的转速离心5 min后,利用MMS测定上清液中15N(29N2 + 2 × 30N2)信号强度。
DNRA速率计算需要先绘制标准曲线:制备0、0.5、2、4、8、10、20 µmol·L–1的15NH4Cl溶液分装于12 mL顶空瓶中,用微量进样针往顶空瓶中加入200 µL次溴酸钠碘溶液将15NH4+氧化为N2(29N2和30N2),利用MIMS测定溶液中15N信号强度,得到15N信号强度与15NH4Cl浓度之间的对应曲线,每个浓度设置三个重复。DNRA速率的计算公式如下:
| $ S_{\text{DNRA}} = \frac{{{\text{slop}}{{\text{e}}_{[^{15}{{\text{NH}_4}^ + ]}}} \times V}}{W} $ |
式中,SDNRA表示DNRA速率,nmol·g–1·h–1;slope[15NH4+]为15NH4+浓度与培养时间回归得到的斜率,表示产NH4+速率,μmol·L–1·h–1;V表示顶空瓶容积,mL;W表示干土重,g。
DNRA占NO3–异化还原的比例计算公式为:
| $ R_\text{DNRA}=\frac{S_\text{DNRA}}{S_{反硝化}\text{+}S_\text{DNRA}}\times 100 $ |
式中,RDNRA表示DNRA占NO3–异化还原的比例,%。
1.4 数据处理本研究中,反硝化和DNRA速率均为三个重复的算术平均值。不同实验处理间的差异,使用IBM SPSS统计软件21.0进行单因素方差分析进行检验(Duncan检验,显著性水平为P < 0.05)前已对数据进行正态性分布分析和方差齐性检验。采用Sigma Plot 14.0软件的回归函数分别对温度影响实验和NO3–影响实验进行指数拟合和米氏方程曲线拟合。利用Origin 2021和Sigma Plot 14.0软件进行制图。
2 结果 2.1 不同温度和pH下水稻土NO3–异化还原过程速率及分配在5、15、20、25和35 ℃处理下,五常、常熟和雅安水稻土的反硝化速率分别为15.42~40.39、18.36~114.07和13.59~67.84 nmol·g–1·h–1;DNRA速率分别为1.53~11.03、1.79~20.65和1.24~ 9.57 nmol·g–1·h–1(图 1)。三种水稻土反硝化和DNRA速率对温度变化响应趋势基本相似,均随着温度的升高呈指数上升(P < 0.05),五常、常熟和雅安水稻土反硝化速率拟合函数分别为y = 13.46e0.03x(R2 = 0.99)、y = 17.69e0.06x(R2 = 0.89)和y = 10.96e0.06x(R2 = 0.97),DNRA速率拟合函数分别为y = 1.21e0.07x(R2 = 0.97)、y = 1.12e0.09x(R2 = 0.96)和y = 0.71e0.08x(R2 = 0.90)。通过计算得出五常、常熟和雅安反硝化速率的Q10(即温度每升高10 ℃反应速率增加的倍数)分别为1.38、1.99和1.73;三种水稻土DNRA速率的Q10分别为1.93、2.45和2.38。其中,同一土壤中,反硝化的Q10小于DNRA的Q10。在35 ℃处理中,五常、常熟和雅安水稻土RDNRA最高分别为21.45%、15.33%和12.37%(图 1c)。
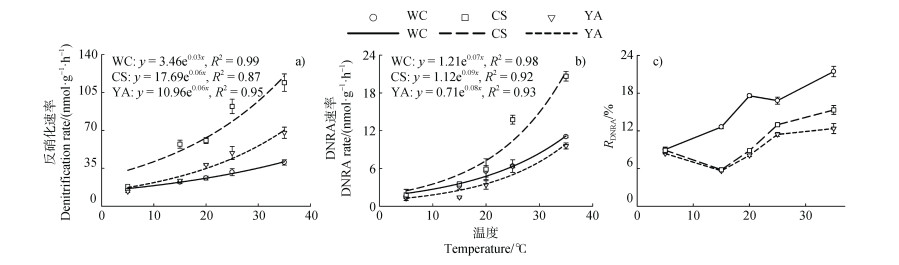
|
注:WC:五常;CS:常熟;YA:雅安。下同。 Note: In the legend, WC, CS and YA represent Wuchang, Changshu and Ya'an paddy soils, respectively. Similarly hereafter for WC, CS, and YA in the following figures. 图 1 温度对三种水稻土反硝化、DNRA速率和RDNRA的影响 Fig. 1 Effects of temperature on denitrification rate, DNRA rate and RDNRA of three paddy soils |
通过土壤pH的调节发现,三种水稻土反硝化和DNRA速率均随着pH升高呈现先升高后下降的趋势。不同土壤反硝化和DNRA的最适pH略有不同,五常水稻土反硝化和DNRA以及常熟水稻土DNRA最适pH为7,而常熟水稻土反硝化以及雅安水稻土反硝化和DNRA最适pH为8.5。五常、常熟和雅安水稻土反硝化速率分别为23.65~40.82、14.53~43.81和28.72~43.89 nmol·g–1·h–1;DNRA速率分别为3.03~6.96、0.97~2.95和4.46~7.55 nmol·g–1·h–1(图 2),相对于酸性环境,三种水稻土的反硝化和DNRA速率在碱性环境中更高。五常、常熟和雅安水稻土的RDNRA分别为11.37%~15.45%、4.91%~9.71%和11.95%~15.56%(图 2c),总体而言相对于碱性环境,酸性环境下DNRA在NO3–异化还原的占比更高。
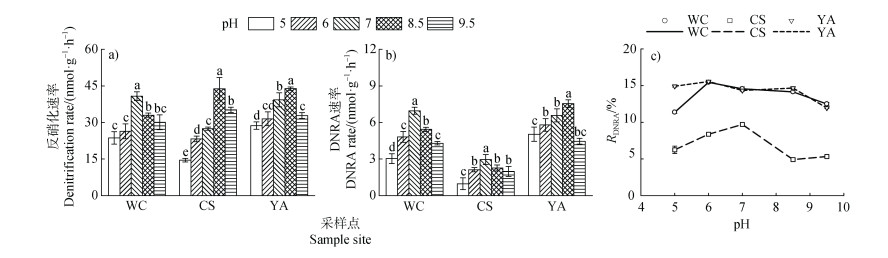
|
注:不同小写字母代表不同pH处理之间差异显著,P < 0.05。 Note: In each soil, different lowercase letters above the bars indicate significant differences(P < 0.05)among different pH treatments. 图 2 pH对三种水稻土反硝化、DNRA速率和RDNRA的影响 Fig. 2 Effects of pH on denitrification rate, DNRA rate and RDNRA of three paddy soils |
在体系NO3–为50、100、150、200和300 µmol·L–1中,五常、常熟和雅安水稻土的反硝化速率分别为20.70~95.43、72.51~143.72和12.95~97.07 nmol·g–1·h–1;DNRA速率分别为1.98~8.23、6.62~14.57和0.50~14.66 nmol·g–1·h–1(图 3)。三种水稻土的反硝化和DNRA速率对NO3–浓度变化的响应趋势基本相似,均可与NO3–浓度拟合为米氏方程。五常、常熟和雅安水稻土的反硝化速率拟合函数分别为y = – 55.40 + 185.39x/(72.20 + x)(R2 = 0.98)、y=151.61x/(41.09 + x)(R2 = 0.67)和y = – 45.06+ 211.03x/(135.44 + x)(R2=0.98),DNRA速率拟合函数分别为y = – 5.91 + 15.57x/(46.56 + x)(R2= 0.89)、y = 11.40x/(14.05 + x)(R2 = 0.78)和y = – 19.53 + 40.11x/(51.14 + x)(R2 = 0.98)。五常、常熟和雅安水稻土反硝化最大反应速率(Vmax)分别为129.99、151.61和165.97 nmol·g–1·h–1;DNRA的Vmax分别为9.66、11.40和20.58 nmol·g–1·h–1,三种水稻土反硝化的Vmax均大于DNRA的Vmax。反硝化米氏常数(Km)分别为72.20、41.09和135.44 µmol·L–1;DNRA的Km分别为46.56、14.05和51.14 µmol·L–1,三种水稻土反硝化的Km大于DNRA的Km。五常、常熟和雅安水稻土的RDNRA分别为6.79%~9.99%、5.41%~9.71%和3.70%~16.64%(图 3c),在中低NO3–浓度(即50~150 µmol·L–1)时,RDNRA最高,随着NO3–浓度增加RDNRA逐渐降低。
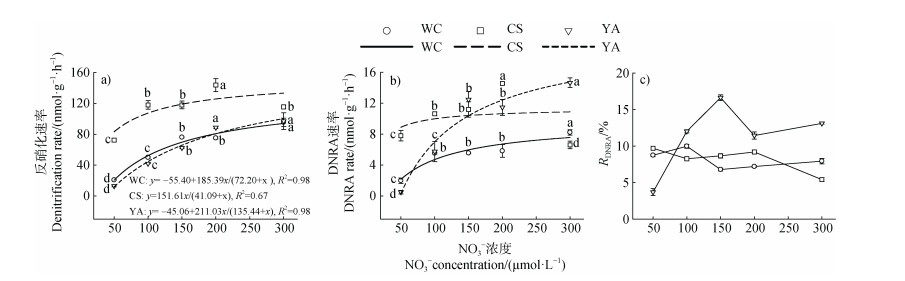
|
注:不同小写字母代表不同NO3–浓度处理之间差异显著,P < 0.05。 Note: In each soil, different lowercase letters above the bars indicate significant differences(P < 0.05)among different NO3– concentration treatments. 图 3 NO3–浓度对三种水稻土反硝化、DNRA速率和RDNRA的影响 Fig. 3 Effects of NO3– concentration on denitrification rate, DNRA rate and RDNRA of three paddy soils |
在添加葡萄糖调节体系C/N为0、2.5、5、12和30处理下,五常、常熟和雅安水稻土的反硝化速率分别为49.91~69.33、118.00~159.65和42.07~52.21 nmol·g–1·h–1;DNRA速率分别为5.53~9.61、10.63~31.80和5.75~16.42 nmol·g–1·h–1(图 4)。添加葡萄糖后显著提高了三种水稻土反硝化和DNRA速率,其中反硝化速率在低C/N的体系中显著提高而DNRA速率高C/N的体系中显著提高。当在C/N为2.5时,五常、常熟和雅安水稻土的反硝化速率分别提高了21.89%、35.30%和24.12%;而C/N > 2.5时,DNRA速率分别最高提高了73.69%、198.98%和185.55%。进一步计算DNRA占比发现,五常、常熟和雅安水稻土的RDNRA分别为8.98%~12.63%、6.01%~19.43%和11.40%~25.91%,且总体上,RDNRA随着C/N的升高呈现上升趋势,表明高C/N更有利提高DNRA占NO3–异化还原的比例(图 4c)。
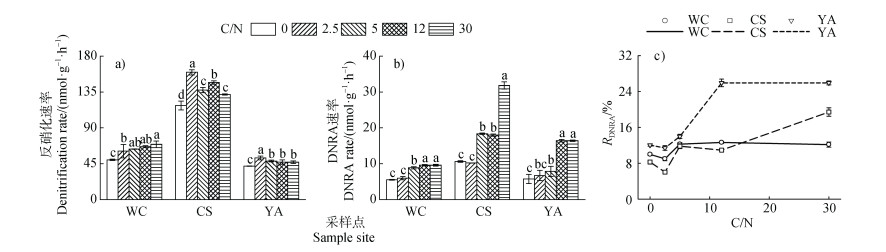
|
注:不同小写字母代表不同C/N处理之间差异显著,P < 0.05。 Note: In each soil, different lowercase letters above the bars indicate significant differences(P < 0.05)among different C/N treatments. 图 4 C/N对三种水稻土反硝化、DNRA速率和RDNRA的影响 Fig. 4 Effects of C/N on denitrification rate, DNRA rate and RDNRA of three paddy soils |
在添加FeSO4调节体系Fe2+浓度为0、300、500、800和1 000 µmol·L–1处理中,Fe2+浓度的升高显著提高了三种水稻土反硝化和DNRA速率,其中五常、常熟和雅安水稻土反硝化速率分别最高提高了40.69%、27.43%和23.63%;DNRA速率分别最高提高了52.92%、105.14%和90.27%(图 5),表明相对于反硝化而言,DNRA反应对Fe2+浓度变化响应更敏感。在Fe2+浓度为300 µmol·L–1时,雅安水稻土的反硝化速率最高为52.01 nmol·g–1·h–1,而五常和常熟水稻土的反硝化速率在Fe2+浓度为500 µmol·L–1时最高分别为70.22和138.13 nmol·g–1·h–1,五常和常熟水稻土的DNRA速率在Fe2+浓度为800 µmol·L–1时最高分别为8.46和10.31 nmol·g–1·h–1,且RDNRA分别为12.81%和9.01%,雅安水稻土的DNRA速率在Fe2+浓度为1 000 µmol·L–1时达到最高,为10.95 nmol·g–1·h–1,且RDNRA最高,为20.48%。高浓度的Fe2+对水稻土反硝化和DNRA速率存在抑制作用,且对不同水稻土的影响存在差异。
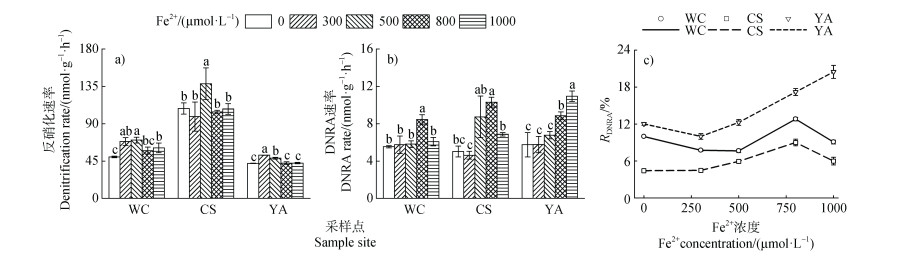
|
注:不同小写字母代表不同Fe2+浓度处理之间差异显著,P < 0.05。 Note: In each soil, different lowercase letters above the bars indicate significant differences(P < 0.05)among different Fe2+ concentration treatments. 图 5 Fe2+浓度对三种水稻土反硝化、DNRA速率和RDNRA的影响 Fig. 5 Effects of Fe2+ concentration on denitrification rate, DNRA rate and RDNRA of three paddy soils |
添加外源S2–后显著提高了五常、常熟和雅安水稻土反硝化和DNRA速率,但对两个过程的促进存在差异,S2–浓度为50 µmol·L–1时,五常和常熟水稻土的反硝化速率最高分别为69.47和164.40 nmol·g–1·h–1;S2–浓度为62.5 µmol·L–1时,雅安水稻土的反硝化速率最高为58.28 nmol·g–1·h–1,随着S2–浓度升高,三种水稻土反硝化速率被显著抑制(图 6)。在S2–浓度为100 µmol·L–1时,五常和雅安水稻土的DNRA速率最高分别为9.34和9.60 nmol·g–1·h–1,且RDNRA最高分别为13.22%和14.74%,而S2–浓度为125 µmol·L–1时,常熟水稻土的DNRA速率最高为13.65 nmol·g–1·h–1,且RDNRA最高为8.29%。
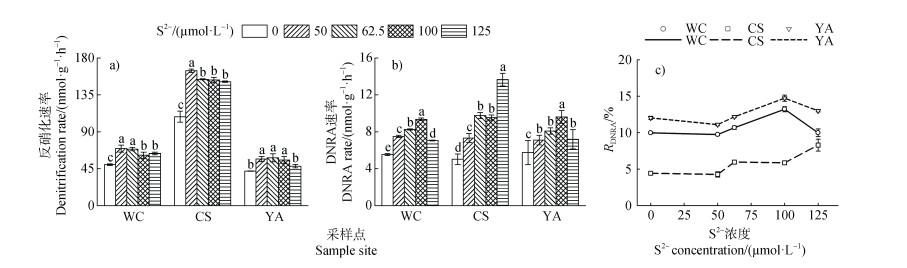
|
注:不同小写字母代表不同S2–浓度处理之间差异显著,P < 0.05。 Note: In each soil, different lowercase letters above bars indicate significant differences(P < 0.05)among different S2– concentration treatments. 图 6 S2–浓度对三种水稻土反硝化、DNRA速率和RDNRA的影响 Fig. 6 Effects of S2– concentration on denitrification rate, DNRA rate and RDNRA of three paddy soils |
前人研究表明温度升高可以显著促进反硝化和DNRA速率[18,22]。本研究表明供试三种水稻土的反硝化和DNRA速率均随着温度升高呈指数型增长(图 1)。通过对反硝化和DNRA温度敏感性的计算,发现反硝化和DNRA的Q10分别介于1.38~1.99和1.93~2.45之间,该范围与Rahman等[18]研究人工城市湿地报导的反硝化Q10(1.3~2.4)和DNRA的Q10(1.2~3.4)一致。值得指出的是,不同土壤中反硝化和DNRA速率对温度升高响应的差异可能与其初始理化性质差异有关(表 1)。其中,同一土壤中反硝化的Q10小于DNRA的Q10且RDNRA随温度升高呈增长趋势,说明DNRA对环境温度变化的响应较反硝化更为敏感,这可能与温度升高更有利于硝酸根氨化细菌的生长有关。此外,Lai等[23]发现N2O会在温度较高的情况下大量积累,反硝化生成的最终产物(N2)受到抑制,因此,反硝化速率增幅下降既可能与DNRA对底物NO3–的竞争有关,也可能与生成N2O有关。
在自然生态系统中,反硝化和DNRA过程可发生的pH范围分别为6~8和5~9[22-25]。本研究中反硝化和DNRA过程在pH为5~9.5的水稻土中均可发生,三种水稻土的反硝化和DNRA速率均随pH升高呈现先显著上升后显著下降的趋势,最适pH为中性或者弱碱性(图 2)。此外,相对于碱性环境,三种水稻土的反硝化和DNRA速率在酸性环境下降幅更大。与本研究结果类似,Xue等[26]的研究也发现NO3–的消耗速率在中性环境中最高,在酸性和碱性环境中均较低。Kim等[27]在纯菌培养系统中研究发现在pH为6时会抑制主导nosZ基因(编码氧化亚氮还原酶)的表达,从而导致反硝化不完全以及体系中N2O的累积,而当pH > 8时,nrfA(编码亚硝酸根还原酶)功能基因表达量显著升高。
3.2 NO3–浓度和C/N对水稻土NO3–异化还原的影响在NO3–浓度为50~300 µmol·L–1的范围内,三种水稻土的反硝化和DNRA速率对NO3–浓度的响应均符合米氏动力学方程,且反硝化速率对高浓度NO3–更敏感(图 3)。Strohm等[28]研究也发现在电子供体相对受限的体系中,反硝化可以还原更多的NO3–,这主要是由于将每摩尔NO3–还原成N2较还原成NH4+所需的自由能更低。Pandey等[4]对比施用氮肥和未施氮肥的稻田土壤反硝化和DNRA速率差异,发现施氮肥土壤的高浓度NO3–会通过降低编码亚硝酸根还原酶的nrfA基因丰度抑制DNRA过程,从而导致反硝化在NO3–还原中占优势。这种高浓度NO3–的抑制作用与本研究随着NO3–浓度升高RDNRA呈现下降趋势一致(图 3c)。此外,本研究结果显示,常熟水稻土反硝化速率(即29N2和30N2产生速率)在NO3–浓度为300 µmol·L–1时被显著抑制(图 3a),与Blackmer和Bremner[29]发现当NO3–浓度大于10 μg·g–1时,反硝化产物以N2O为主,抑制了反硝化最终产物N2的产生的结果相同。
本研究发现,通过添加葡萄糖提高体系C/N后,反硝化和DNRA速率均随着C/N的增加而显著提高。相对于control处理,低碳氮比(C/N = 2.5)显著增加反硝化速率,而对DNRA速率增加并不显著;而当C/N提高至5后,伴随着DNRA速率的显著提高,RDNRA呈现增长趋势,这表明高C/N更有利于DNRA过程的发生。Rahman等[19]对湿地的研究也发现有机碳的升高会显著提高反硝化和DNRA速率且对DNRA的促进更显著。纯菌实验显示,还原等量的NO3–,DNRA过程所能提供的细胞生物量是反硝化过程的两倍[28],因而在碳源充足的环境中更有利于提高NO3–异化还原向DNRA分配的比例。
3.3 Fe2+浓度和S2–浓度对水稻土NO3–异化还原的影响本研究结果显示,外源Fe2+的添加均显著提高了反硝化和DNRA速率,这进一步证实了Fe2+氧化与NO3–异化还原在水稻土中存在着耦合作用[30]。Fe2+浓度较低(300~500 µmol·L–1)时,反硝化速率最高,而DNRA速率达到峰值所需要的Fe2+浓度更高(800~1 000 µmol·L–1),Fe2+对反硝化和DNRA
促进的最佳浓度与其作为电子供体参与反硝化和DNRA过程的化学计量比接近[13]。RDNRA的峰值出现在Fe2+浓度为800~1 000 µmol·L–1处理中也佐证了该推断。Cojean等[31]对湖泊沉积物的研究也发现,当体系Fe2+浓度低于258 µmol·L–1时会促进反硝化速率,当Fe2+浓度高于258 µmol·L–1时反硝化速率被显著抑制,而DNRA速率则显著增加。此外,反硝化速率在Fe2+浓度高于500 µmol·L–1时会受到显著抑制,当Fe2+离子浓度为1 000 µmol·L–1时五常和常熟水稻土DNRA速率也显著下降。该抑制作用主要是由于添加高浓度的Fe2+后,体系内易形成铁氧化物并包覆在微生物细胞表面限制底物吸收并造成细胞损坏,进而抑制微生物代谢活性[32]。
纯菌试验表明,S2–添加可有效促进反硝化和DNRA过程[31],本研究也发现添加外源S2–显著提高了稻田土壤反硝化和DNRA速率,进一步说明S2–可以通过为NO3–异化还原过程提供电子供体,从而促进反硝化和DNRA过程速率。在对长江口沉积物研究中也发现,速率与S2–浓度显著相关[17]。Yin等[33]对污水处理厂污泥培养发现,当体系S2–/NO3–为0.27~1.08时有利于发生反硝化过程,而当体系S2–/ NO3–为1.6时,DNRA对NO3–还原的贡献达到76.3%。本研究发现,在低S2–浓度(即50~62.5 µmol·L–1)时反硝化速率最高,随着S2–浓度增加,DNRA速率才达到峰值,与上述结果类似。Li等[34]对湖泊沉积物体系研究发现添加S2–显著促进了N2O排放,从而抑制了反硝化过程最终产物N2的产生。此外,本研究还发现在S2–浓度为125 µmol·L–1时,显著抑制了五常和雅安水稻土的DNRA速率,说明高浓度S2–也会抑制DNRA微生物的活性。Murphy等[35]对盐沼地沉积物的研究发现S2–浓度为1 000 µmol·L–1时,反硝化和DNRA速率均被显著抑制,其中对反硝化的抑制尤为明显。造成这种现象的可能原因是在厌氧环境中,高浓度S2–会与游离的Fe2+形成FeS沉淀,导致体系中电子供体浓度降低,从而抑制了NO3–异化还原过程。
4 结论在所研究的三种水稻土中,反硝化过程主导了NO3–异化还原过程,其贡献可达87.97%~91.73%,DNRA仅占8.27%~12.03%。环境因子显著改变了NO3–还原过程的速率及其在反硝化和DNRA之间的分配。随着温度升高,三种水稻土反硝化和DNRA速率均呈指数增长,高温更有利于提高DNRA在NO3–还原过程中的分配比例;反硝化和DNRA速率的最适pH均为中性或弱碱性;提高NO3–浓度有利于提高NO3–向反硝化过程的分配;提高C/N、Fe2+和S2–浓度有利于提高NO3–向DNRA过程的分配。本研究加深了对稻田土壤NO3–异化还原过程的认识,对未来探寻潜在农学措施提高DNRA过程速率和占比,进而提高稻田氮素固持和氮肥利用率具有理论指导意义。
| [1] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9
(  0) 0) |
| [2] |
Cai Z C. Effects of urea and KNO3 on processes and products of inorganic nitrogen transformation in paddy soils I. Processes of inorganic nitrogen (In Chinese)[J]. Acta Pedologica Sinica, 2003, 40(2): 239-245. [蔡祖聪. 尿素和KNO3对水稻土无机氮转化过程和产物的影响Ⅰ. 无机氮转化过程[J]. 土壤学报, 2003, 40(2): 239-245.]
(  0) 0) |
| [3] |
Ishii S, Ikeda S, Minamisawa K, et al. Nitrogen cycling in rice paddy environments: Past achievements and future challenges[J]. Microbes and Environments, 2011, 26(4): 282-292. DOI:10.1264/jsme2.ME11293
(  0) 0) |
| [4] |
Pandey A, Suter H, He J Z, et al. Dissimilatory nitrate reduction to ammonium dominates nitrate reduction in long-term low nitrogen fertilized rice paddies[J]. Soil Biology & Biochemistry, 2019, 131: 149-156.
(  0) 0) |
| [5] |
Wu M, Li J F, Wei Z J, et al. Dissimilatory nitrate reduction to ammonium coupled to Fe2+ oxidation in paddy soils as affected by oxygen presence and carbon addition (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 253-262. [吴敏, 李进芳, 魏志军, 等. 水稻土Fe2+氧化耦合硝酸根异化还原成铵(DNRA)及其对氧气存在和碳源添加的响应[J]. 土壤学报, 2022, 59(1): 253-262.]
(  0) 0) |
| [6] |
Li X F, Sardans J, Gargallo-Garriga A, et al. Nitrogen reduction processes in paddy soils across climatic gradients: Key controlling factors and environmental implications[J]. Geoderma, 2020, 368: 114275. DOI:10.1016/j.geoderma.2020.114275
(  0) 0) |
| [7] |
Rütting T, Boeckx P, Müller C, et al. Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle[J]. Biogeosciences, 2011, 8(7): 1779-1791. DOI:10.5194/bg-8-1779-2011
(  0) 0) |
| [8] |
Yin S X, Chen D, Chen L M, et al. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils[J]. Soil Biology & Biochemistry, 2002, 34(8): 1131-1137.
(  0) 0) |
| [9] |
Zhao B J, Li X S, Wang Y, et al. Dissimilatory nitrate reduction and functional genes in two subtropical rivers, China[J]. Environmental Science and Pollution Research International, 2021, 28(48): 68155-68173. DOI:10.1007/s11356-021-15197-3
(  0) 0) |
| [10] |
Shan J, Zhao X, Sheng R, et al. Dissimilatory nitrate reduction processes in typical Chinese paddy soils: Rates, relative contributions, and influencing factors[J]. Environmental Science & Technology, 2016, 50(18): 9972-9980.
(  0) 0) |
| [11] |
Simon J. Enzymology and bioenergetics of respiratory nitrite ammonification[J]. FEMS Microbiology Reviews, 2002, 26(3): 285-309. DOI:10.1111/j.1574-6976.2002.tb00616.x
(  0) 0) |
| [12] |
Pang Y M, Wang J L. Various electron donors for biological nitrate removal: A review[J]. Science of the Total Environment, 2021, 794: 148699. DOI:10.1016/j.scitotenv.2021.148699
(  0) 0) |
| [13] |
Robertson E K, Thamdrup B. The fate of nitrogen is linked to iron(Ⅱ)availability in a freshwater lake sediment[J]. Geochimica et Cosmochimica Acta, 2017, 205: 84-99. DOI:10.1016/j.gca.2017.02.014
(  0) 0) |
| [14] |
Tiedje J M, Sexstone A J, Myrold D D, et al. Denitrification: ecological niches, competition and survival[J]. Antonie van Leeuwenhoek, 1982, 48(6): 569-583.
(  0) 0) |
| [15] |
Sotta E D, Corre M D, Veldkamp E. Differing N status and N retention processes of soils under old-growth lowland forest in Eastern Amazonia, Caxiuanã, Brazil[J]. Soil Biology & Biochemistry, 2008, 40(3): 740-750.
(  0) 0) |
| [16] |
Schmidt C S, Richardson D J, Baggs E M. Constraining the conditions conducive to dissimilatory nitrate reduction to ammonium in temperate arable soils[J]. Soil Biology & Biochemistry, 2011, 43(7): 1607-1611.
(  0) 0) |
| [17] |
Deng F Y, Hou L J, Liu M, et al. Dissimilatory nitrate reduction processes and associated contribution to nitrogen removal in sediments of the Yangtze Estuary[J]. Journal of Geophysical Research: Biogeosciences, 2015, 120(8): 1521-1531. DOI:10.1002/2015JG003007
(  0) 0) |
| [18] |
Rahman M, Grace M R, Roberts K L, et al. Effect of temperature and drying-rewetting of sediments on the partitioning between denitrification and DNRA in constructed urban stormwater wetlands[J]. Ecological Engineering, 2019, 140: 105586. DOI:10.1016/j.ecoleng.2019.105586
(  0) 0) |
| [19] |
Rahman M M, Roberts K L, Grace M R, et al. Role of organic carbon, nitrate and ferrous iron on the partitioning between denitrification and DNRA in constructed stormwater urban wetlands[J]. Science of the Total Environment, 2019, 666: 608-617. DOI:10.1016/j.scitotenv.2019.02.225
(  0) 0) |
| [20] |
Wang S Y, Pi Y X, Jiang Y Y, et al. Nitrate reduction in the reed rhizosphere of a riparian zone: From functional genes to activity and contribution[J]. Environmental Research, 2020, 180: 108867. DOI:10.1016/j.envres.2019.108867
(  0) 0) |
| [21] |
Cheng Y, Elrys A S, Merwad A R M, et al. Global patterns and drivers of soil dissimilatory nitrate reduction to ammonium[J]. Environmental Science & Technology, 2022, 56(6): 3791-3800.
(  0) 0) |
| [22] |
Shan J, Yang P P, Shang X X, et al. Anaerobic ammonium oxidation and denitrification in a paddy soil as affected by temperature, pH, organic carbon, and substrates[J]. Biology and Fertility of Soils, 2018, 54(3): 341-348. DOI:10.1007/s00374-018-1263-z
(  0) 0) |
| [23] |
Lai T V, Ryder M H, Rathjen J R, et al. Dissimilatory nitrate reduction to ammonium increased with rising temperature[J]. Biology and Fertility of Soils, 2021, 57(3): 363-372. DOI:10.1007/s00374-020-01529-x
(  0) 0) |
| [24] |
Brin L D, Giblin A E, Rich J J. Effects of experimental warming and carbon addition on nitrate reduction and respiration in coastal sediments[J]. Biogeochemistry, 2015, 125(1): 81-95. DOI:10.1007/s10533-015-0113-4
(  0) 0) |
| [25] |
Yang S, Wu S J, Cai Y J, et al. The synergetic and competitive mechanism and the dominant factors of dissimilatory nitrate reduction processes: A review (In Chinese)[J]. Acta Ecologica Sinica, 2016, 36(5): 1224-1232. [杨杉, 吴胜军, 蔡延江, 等. 硝态氮异化还原机制及其主导因素研究进展[J]. 生态学报, 2016, 36(5): 1224-1232.]
(  0) 0) |
| [26] |
Xue D M, Yu H, Fang Y T, et al. 15N-tracer approach to assess nitrogen cycling processes: Nitrate reduction, anammox and denitrification in different pH cropland soils[J]. Catena, 2020, 193: 104611. DOI:10.1016/j.catena.2020.104611
(  0) 0) |
| [27] |
Kim H, Park D, Yoon S. pH control enables simultaneous enhancement of nitrogen retention and N2O reduction in Shewanella loihica strain PV-4[J]. Frontiers in Microbiology, 2017, 8: 1820. DOI:10.3389/fmicb.2017.01820
(  0) 0) |
| [28] |
Strohm T O, Griffin B, Zumft W G, et al. Growth yields in bacterial denitrification and nitrate ammonification[J]. Applied and Environmental Microbiology, 2007, 73(5): 1420-1424. DOI:10.1128/AEM.02508-06
(  0) 0) |
| [29] |
Blackmer A M, Bremner J M. Inhibitory effect of nitrate on reduction of N2O to N2 by soil microorganisms[J]. Soil Biology & Biochemistry, 1978, 10(3): 187-191.
(  0) 0) |
| [30] |
Li J F, Chai Y C, Chen S T, et al. Measurement of denitrification, Anammox, DNRA rates, and net N2 flux in paddy soil using a membrane inlet mass spectrometer (In Chinese)[J]. Journal of Agro-Environment Science, 2019, 38(7): 1541-1549. [李进芳, 柴延超, 陈顺涛, 等. 利用膜进样质谱仪测定水稻土几种厌氧氮转化速率[J]. 农业环境科学学报, 2019, 38(7): 1541-1549.]
(  0) 0) |
| [31] |
Cojean A N Y, Lehmann M F, Robertson E K, et al. Controls of H2S, Fe2+, and Mn2+ on microbial NO3--Reducing processes in sediments of an eutrophic lake[J]. Frontiers in Microbiology, 2020, 11: 1158. DOI:10.3389/fmicb.2020.01158
(  0) 0) |
| [32] |
Klueglein N, Zeitvogel F, Stierhof Y D, et al. Potential role of nitrite for abiotic Fe(Ⅱ)oxidation and cell encrustation during nitrate reduction by denitrifying bacteria[J]. Applied and Environmental Microbiology, 2014, 80(3): 1051-1061. DOI:10.1128/AEM.03277-13
(  0) 0) |
| [33] |
Yin Z X, Xie L, Zhou Q. Effects of sulfide on the integration of denitrification with anaerobic digestion[J]. Journal of Bioscience and Bioengineering, 2015, 120(4): 426-431. DOI:10.1016/j.jbiosc.2015.02.004
(  0) 0) |
| [34] |
Li S J, Pang Y M, Ji G D. Increase of N2O production during nitrate reduction after long-term sulfide addition in lake sediment microcosms[J]. Environmental Pollution, 2021, 291: 118231. DOI:10.1016/j.envpol.2021.118231
(  0) 0) |
| [35] |
Murphy A E, Bulseco A N, Ackerman R, et al. Sulphide addition favours respiratory ammonification(DNRA)over complete denitrification and alters the active microbial community in salt marsh sediments[J]. Environmental Microbiology, 2020, 22(6): 2124-2139. DOI:10.1111/1462-2920.14969
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


