2. 华南师范大学环境学院, 广州 510006;
3. 广州大学环境科学与工程学院, 广州 510006
2. School of Environment, South China Normal University, Guangzhou 510006, China;
3. School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006, China
铁(Fe)是一种生命体生长必需的微量营养元素。水稻根部须从土壤中摄取铁,以维持正常的生长发育。然而,水稻的铁元素缺乏通常与土壤缺铁或者土壤碱性有关,因为土壤与水稻根部紧密相连,是水稻正常生长所需各种元素的直接提供者。长期摄入缺铁稻米可能导致人体出现所谓的“隐性营养不良”,可导致贫血,且对人体生长、免疫功能产生不利影响。铁从土壤迁移至稻米涉及多个过程且受植物体转运蛋白控制,其相关基因表达依赖于外界环境。其次,由于化学性质的相似性,其他营养元素如锌(Zn)和有毒元素镉(Cd)可通过Fe等转运通道进入水稻体内[1]。因此,全面理解土壤-水稻系统铁元素的吸收与转运机制至关重要。
一般而言,土壤中的矿质元素首先被水稻根部吸收,然后伴随着细胞中离子的稳态平衡调节,进一步向地上部各组织及稻米中转移,上述过程主要由细胞中各种转运蛋白完成。缺铁条件下可刺激负责铁络合与转运的多种基因表达水平上调以提高水稻对铁的吸收。尽管矿质元素对水稻的生长和维持必不可少,但这些元素在细胞中积累过多,也会导致水稻中毒,从而抑制水稻的生产。水稻对矿质元素的吸收和转运,受植物自身的调节系统严格调控,即仅允许适量而非中毒水平的元素在细胞中积累。假如矿质元素在细胞中过量积累,则可能通过细胞膜上的转运蛋白排出细胞外,或转移并储存于液泡中,或结合至细胞壁等代谢不活跃区域,或被植物螯合肽、有机酸等螯合,以减少细胞内矿质元素的含量或活性[2]。其中,细胞质中液泡储存的部分元素,可调节细胞内元素的稳态平衡,限制其向木质部转运,避免细胞中毒[3]。上述结果与铁过量诱导负责铁转运和储存的多种基因表达水平上调有关。
铁有54Fe(5.85%)、56Fe(91.75%)、57Fe(2.12%)与58Fe(0.28%)四种稳定同位素。铁同位素分馏成为地球科学领域的重要研究方向,为追踪土壤中铁的地球化学行为和植物铁吸收与转运机制提供新的证据和认知[4]。铁同位素对氧化还原过程极其敏感,而铁的络合过程产生较小的同位素分馏尺度,因而铁同位素指纹可用于研究土壤环境的铁循环过程。水稻可通过两种吸收策略从根际土壤获取铁,以往的研究表明,策略Ⅰ植物吸收Fe2+,导致植物相比于土壤富集轻铁同位素,且植物组织中铁同位素在向上转运过程中由于铁的逐步还原而变得更轻。在缺铁条件下,水稻被认为是策略Ⅱ植物,分泌铁载体脱氧麦根酸(DMA)溶解并螯合Fe(Ⅲ),使得DMA-Fe(Ⅲ)螯合物随即被吸收至根细胞中[5]。该策略Ⅱ植物被认为不改变植物部位中铁同位素组成或者各部位之间的分馏尺度较小[6]。另一方面,据密度泛函理论计算,与单一的配体交换相比,氧化还原反应可引起更大的铁同位素分馏尺度[7]。然而,在高等植物铁转运过程中,铁在不同配体交换时产生的铁同位素分馏尺度高达1.5‰[8];Guelke等[9]提出铁在植物内部转运过程中可能不改变其氧化还原状态,尽管植物各组织部位的铁同位素组成差异较大。因而,同位素指纹可作为解析铁吸收和转运机理的重要手段,这有利于解决水稻缺铁或富铁,以及进一步厘清铁对水稻根部锌与镉吸收转运的影响机理。
据此,本文以土壤-植物体系铁的迁移转化和累积为切入点,从基因定量、同位素分馏、光谱分析视角出发,阐述水稻铁的吸收转运和累积机制以及铁对水稻根部锌和镉吸收的影响机制,以期为粮食作物质量提升和减毒脱毒提供理论基础和科学依据。
1 转运蛋白调控铁吸收转运过程 1.1 转运蛋白介导铁在水稻体的吸收和转运过程 1.1.1 铁吸收过程大多数非禾本科植物和双子叶植物通过释放H+以降低根际的pH的方式促进Fe(Ⅲ)溶解,而Fe(Ⅲ)被还原为Fe2+,然后再通过Fe2+转运蛋白(IRT1)进行吸收(策略Ⅰ,Fe2+吸收)[10, -11]。而禾本植物还能通过麦根酸家族植物铁载体转运蛋白(TOM1/2)分泌铁载体脱氧麦根酸(DMA)以螯合Fe(Ⅲ),然后通过黄色条纹蛋白家族(YSL)/YS1等载体转运铁(策略Ⅱ)[5,10]。在稻田土壤中,Fe以亚铁(Fe2+)和三价铁(Fe3+)两种形式存在,因而水稻对Fe的吸收除了通过类策略Ⅰ,还可依赖策略Ⅱ(图 1)。尽管据报道水稻根部缺乏铁还原酶(FRO),但淹水条件下,土壤异化铁还原使得土壤孔隙水Fe主要以Fe2+形式存在。水稻中铁转运蛋白基因(ZIP)家族的两个成员,即OsIRT1与OsIRT2,以及自然抗性相关巨噬蛋白家族(NRAMP)家族的成员OsNRAMP1,均可介导根部细胞对Fe2+的吸收。据此,淹水条件下水稻被认为主要依赖类策略Ⅰ摄取Fe2+[12]。失去吸收策略Ⅱ的尼克酰胺基转移酶(NAAT1)突变株中亦主要依赖策略Ⅰ吸收Fe[13]。
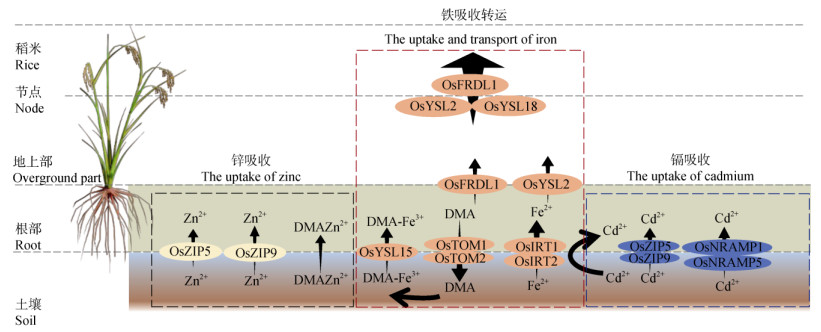
|
注:OsFRDL:柠檬酸盐转运蛋白基因;OsZIP:锌铁调控转运蛋白;OsYSL:黄色条纹蛋白家族;OsTOM:麦根酸家族植物铁载体转运蛋白;OsIRT:Fe 2+转运蛋白;OsNRAMP:自然抗性相关巨噬蛋白家族;DMA:脱氧麦根酸deoxymugineic acid。 Note: OsFRDL: Ferric Reductase Defective Like; OsZIP: ZRT-and IRT-like protein; OsYSL: Yellow Stripe-Like; OsTOM: transporter of mugineic acid family phytosiderophores; OsIRT: Iron Regulated Transporter; OsNRAMP: Natural Resistance Associated Macrophage Proteins; DMA: Deoxymugineic acid. 图 1 铁、锌与镉相关转运蛋白的分布位置和主要作用 Fig. 1 The distribution locations and major roles of iron-, zinc- and cadmium-related transport proteins. |
在吸收机理Ⅱ中,水稻根部会分泌一种植物铁载体即脱氧麦根酸(DMA)。DMA是在尼克酰胺合成酶(NAS)、尼克酰胺基转移酶(NAAT)的作用下,从尼克酰胺(NA)前驱体合成而来[14]。水稻根部细胞质膜上的转运蛋白TOM1、TOM2负责将根部细胞内的DMA分泌至根际中[15]。DMA与根际的Fe3+可形成稳定的螯合物,然后质膜上的YSL家族成员OsYSL15可将Fe3+-DMA螯合物摄取至细胞内。敲除OsYSL15基因,可显著降低水稻根、茎、叶中的Fe浓度[16]。OsYSL15在水稻根的表皮、内皮层、维管束以及缺铁条件下的叶组织中表达,且OsYSL15在铁缺乏时强烈诱导,但不受Zn、Mn缺乏的影响。稻田排水阶段导致土壤中的铁矿物难以溶解并以Fe3+氧化形式存在,因此,落干条件下水稻可能主要依赖策略Ⅱ吸收铁。
1.1.2 根部-地上部转运铁被水稻根部吸收进入细胞后,部分铁被液泡膜上的液泡铁转运蛋白(OsVIT 1/2)转移至液泡中储存,以调节细胞内Fe的稳态平衡[17](图 1)。其余铁则可能被装载至木质部,然后向地上部转移。在液泡中,铁主要以铁-植酸(Fe-phytate)、铁-尼克酰胺(Fe-NA)等复合物形式存在。木质部汁液(呈酸性)中,铁主要以金属螯合物的形式运输,如铁-柠檬酸(Fe(Ⅲ)- citrate)络合物。在中柱鞘细胞中表达的多药物和有毒化合物排出家族(MATE)转运蛋白,即OsFRDL1,可转运Fe3+-柠檬酸盐复合物,可将其外排至木质部导管中,因而OsFRDL1是水稻铁从根部向地上部转运所必需的转运蛋白[18]。尼克酰胺(NA)不仅是合成麦根酸(DMA)的前体,且能螯合Fe2+、Mn2+,主要在水稻韧皮部、发育种子中表达的OsYSL2,能转运Fe(Ⅱ)-NA、Mn(Ⅱ)-NA复合物,因而OsYSL2在Fe、Mn的韧皮部装载及Fe、Mn的长距离运输中发挥重要作用[19](图 1)。在具备Fe吸收系统Ⅱ的植物中,麦根酸(DMA)与Fe3+络合,水稻OsYSL15不仅能吸收根部的Fe(Ⅲ)-DMA络合物,也负责体内Fe(Ⅲ)-DMA络合物的长途运输[20]。显然,水稻作为策略Ⅰ和策略Ⅱ的植物,这些铁物种均可能通过木质部转运至地上部。
1.1.3 韧皮部转运至稻米过程叶片中,液泡OsVIT1与OsVIT2转运蛋白亦能将铁从胞质固存至液泡中,致使更多的缓冲贮存于水稻叶片。在水稻的剑叶和叶鞘中,OsVIT1与OsVIT2基因的表达水平均较高,但是OsVIT1、OsVIT2突变体的剑叶中Fe、Zn的积累减少,而Mn积累却未发生改变,表明OsVIT1、OsVIT2在水稻中的作用,主要是介导Fe、Zn的液泡隔离[17]。液泡膜上的Zn转运蛋白OsMTP1也能转运Fe,参与水稻细胞内Fe稳态的调节。据研究报道[14],当NA:DMA更高时,有利于提高稻米的铁含量,这可能与NA促进叶片Fe的回迁有关。水稻中的铁蛋白基因(OsFER1/2)可编码铁蛋白,以储存约4 500个铁原子,并在水稻各组织部位中充当铁缓冲库的作用[17];据报道[21],铁蛋白的表达受光调控。
节点(Node)是指茎秆的坚实部分。它可能产生叶片、分蘖或不定根。OsFRDL1在节点中表达,促使柠檬酸通过络合节点内薄壁细胞桥中沉积的铁,将铁分配至穗轴。Che等[22]进一步研究报道OsVIT2主要在节点Ⅰ处以及叶鞘的茎鞘表达,且在节点Ⅰ维管束木质部的薄壁组织细胞桥位置高度表达。敲除OsVIT2可通过促进Fe从节点至稻米的转运,增加稻米中Fe的积累,且不影响产量。
1.2 铁影响根部锌吸收过程锌是一种水稻生长必需的微量营养素。缺锌会限制其生产,导致稻米锌缺乏以及不可逆转的严重健康问题。缺锌目前正面临诊断和治疗的挑战,因此被认为是矿物质缺乏症中的终极“隐性饥饿”[23]。铁在水稻锌吸收过程扮演着重要角色。锌调控转运蛋白和铁调控转运蛋白(ZIP)的成员如OsZIP4、OsZIP7可控制水稻根部对锌的吸收[24]。除了外界锌浓度,缺铁条件亦可诱导OsZIP9基因在根部的表达,因此缺铁可能有利于根部ZIP的表达,促进根部对锌的吸收[25]。其次,当土壤缺铁时,水稻根部会诱导铁载体的分泌,这提高了土壤中锌的溶出和络合,以及水稻根部对Zn-DMA络合物的摄取。相反,富铁的条件下如土壤淹水环节则不利于水稻对锌的吸收。这也证实了水稻在缺铁和富铁的条件下可维持水稻锌的内稳态。因此,土壤富含铁或锌为前提下,实现水稻对土壤锌的高效率摄取是增产提质的关键。
1.3 铁影响根部镉吸收过程镉作为非必需元素,根细胞吸收镉是由于根对营养元素的非选择性吸收,研究表明镉共享铁转运蛋白OsIRT1和OsIRT2以及锰转运蛋白OsNRAMP1和OsNRAMP5吸收转运进入水稻根部[26]。该转运过程与分子竞争效应和转运蛋白的表达水平有关。水稻根部定位于根部皮层细胞外侧质膜上的OsNRAMP5转运蛋白,在吸收锰的同时可高效吸收镉,同样位于细胞质膜上的内运转运蛋白OsNRAMP1在根部表达,参与水稻根部对镉的吸收[27]。水稻根对镉的吸收与铁的吸收密切相关。缺铁提高OsNRAMP1、OsIRT1和OsIRT2的相对表达量,而促进铁吸收的同时也增强对镉的吸收[27]。有进一步研究证实相比淹水模式,落干环节有利于提高OsNRAMP1、OsIRT1和OsIRT2基因在根部的表达水平,增强水稻根部对镉的吸收和稻米镉的累积[28]。另一方面,水稻根部通过机理Ⅱ摄取Fe(Ⅲ),即根部分泌的麦根酸类物质的铁载体与三价铁形成络合物从而被根部吸收[10]。水稻根部分泌的多种有机酸会降低根际的pH,且易与镉形成络合物,提高根际土壤镉的淋溶和活性[29]。目前,根部低分子有机酸分泌淋溶活化镉并促进吸收,该观点有待进一步研究。
2 土壤-植物系统铁同位素分馏铁是生命必需元素,且广泛参与多种地球化学与生物化学过程。地壳中铁元素丰度与活性均较高,土壤干湿交替过程均会驱动铁元素氧化还原[30],矿物发生晶相转变。铁的生物化学过程主要有:异化铁还原菌驱动的铁还原[31]与亚铁氧化菌驱动的中性厌氧亚铁氧化[32]等微生物胞外过程、微生物铁蛋白吸收铁的胞内过程[33]以及高等植物吸收铁的植物体吸收转运过程[6]。化学过程主要包括亚铁催化铁矿物的晶相转换、矿物对Fe(Ⅱ)的吸附固定以及亚铁的化学氧化如水稻根表铁膜的生成。阐述铁的生物地球化学过程尤为重要,一方面影响着铁的活性与水稻对铁的获取;另一方面,铁循环过程能够驱动重金属迁移转化[34-35]。此外,铁同位素对于氧化还原和络合过程的敏感性使得该方法广泛用于追踪植物中铁吸收和转运机制[6,36]。铁的生物地球化学过程可诱导铁发生同位素分馏,因而通过铁同位素指纹可反演铁转化过程。
2.1 土壤铁同位素分馏 2.1.1 晶相转变诱导铁同位素分馏当Fe2+吸附至氧化铁表面后将改变氧化铁表面价态,促进电子转移与催化铁矿物晶相转变[37]。该过程不仅可提高氧化铁的吸附量且有利于重金属内嵌于矿物。也有研究[38]报道大量Fe(Ⅱ)与针铁矿发生铁交换,但该交换能力与矿物结晶度匹配性较高。上述过程易导致轻铁同位素富集于矿物,降低矿物与液相之间的分馏尺度[39]。结晶度较低的氧化铁矿物更容易发生亚铁催化氧化铁重结晶,如Fe(Ⅱ)作用下水铁矿和纤铁矿易发生晶相转换形成磁赤铁矿和针铁矿等次生矿物[40-41]。而结晶度高的氧化铁矿物,如针铁矿和赤铁矿,在Fe2+作用下认为仅发生晶相外延生长[42]。在水铁矿转换为针铁矿的过程,随着水铁矿:针铁矿比例的降低,固液两相的同位素组成差异∆56FeFe(液相)-Fe(固相)从0.03‰提高至0.30‰[43],这证实晶相转变过程倾向于重组轻铁同位素。
2.1.2 铁循环过程产生大尺度的同位素分馏Geobacter还原溶解针铁矿与赤铁矿,溶解态Fe(Ⅱ)与矿物Fe(Ⅲ)的56Fe/54Fe分馏高达−3‰[44]。Beard等[45]发现溶解态Fe(Ⅱ)与矿物Fe(Ⅲ)的铁同位素分馏∆57FeFe(Ⅲ)-Fe(Ⅱ)为2.75‰。近期有研究表明,淹水环节土壤与土壤溶液可产生大幅度的铁同位素分馏∆56Fe土壤溶液−非根际土壤为−1.66‰ ± 0.03‰,且随着氧化还原电位的降低,分馏尺度逐渐增大[46];而落干条件分馏尺度较低(Δ56Fe土壤溶液−非根际土壤 = −0.35‰ ± 0.05‰),说明该条件下土壤-孔隙水界面的还原性铁溶解较少。根表铁膜的生成过程中,淹水条件下可产生大尺度的铁同位素分馏∆56Fe铁膜−溶液为2.43‰±0.03‰,然而落干条件下铁同位素分馏则较低(∆56Fe铁膜−溶液为0.79‰±0.06‰)。铁价态的改变及沉淀形成固相沉积物,该固相对于水相键强度更强,因此该过程产生的分馏系数α56Fe溶液-固体为1.00027‰[47]。进一步研究表明,液相Fe(Ⅲ)的56Fe/54Fe比值一般等于或大于沉淀物Fe(Ⅲ),且随着沉淀速率的增加和晶粒尺寸的减小,两相之间的同位素分馏尺度减少。因而,铁氧化与还原过程可产生不同的方向以及尺度较大的分馏[48],且基于铁同位素分馏对铁循环过程的高敏感性,铁同位素指纹可用于研究土壤系统铁循环过程。
2.1.3 络合过程的铁同位素分馏指纹Wiederhold等[49]研究表明,Fe(Ⅲ)-草酸配合物重于针铁矿的Fe同位素组成(∆57Fe溶液-针铁矿= 0.5‰)。Dideriksen等[47]报道不受无机铁比例的影响,甲磺酸去铁胺与Fe(Ⅲ)之间的平均平衡分馏因子∆56Fe甲磺酸去铁胺- Fe(Ⅲ)-无机铁为0.60‰±0.15‰。因此,强配位有机配体诱导的平衡铁同位素分馏可能是导致自然界中铁同位素分馏的关键原因。Morgan等[50]进一步通过甲磺酸去铁胺- Fe(Ⅲ)(DFOM-Fe(Ⅲ))与乙二胺四乙酸-Fe(Ⅲ)(EDTA-Fe(Ⅲ))的络合物,以及甲磺酸去铁胺Fe(Ⅲ)与草酸结合铁(Oxalate-Fe(Ⅲ))之间的平衡分馏研究表明,DFOM -Fe(Ⅲ)与EDTA-Fe(Ⅲ)之间无同位素组成上的差异,甲磺酸去铁胺-Fe(Ⅲ)重于Oxalate-Fe(Ⅲ)(∆56/54Fe甲磺酸去铁胺- Fe(Ⅲ)/乙二胺四乙酸-Fe(Ⅲ) ≈0.02‰±0.11‰,∆56/54Fe甲磺酸去铁胺- Fe(Ⅲ)/草酸结合铁= 0.20‰± 0.11‰),且证实分馏因子与配体的铁结合亲和力呈显著正相关。乙二胺四乙酸(EDTA)、三亚甲基二硝基四乙酸(TmDTA)、环己二胺四乙酸(CyDTA)和脱氧麦根酸(DMA)对锌的络合过程分别可产生0.33‰± 0.07‰(1sd)、0.45‰± 0.02 ‰(1sd)、0.62‰ ± 0.05‰(1sd)和0.30‰ ± 0.07‰(1sd),且分馏尺度与络合稳定常数成正比[51]。Fujii等[52]研究报道,Zn与含氧供体、含氮供体和含硫供体有机物的络合过程导致络合物依次富集轻锌同位素。除了有机络合之外,无机络合在土壤相中同样起重要作用。Cl–可络合溶液中Fe而改变Fe的形态,据密度泛函理论研究表明,Cl–取代Fe(H2O)63+中的H2O分子时,可导致络合物富集轻铁同位素,其中当随Cl–的配位数提高而更轻[53]。
2.2 植物铁同位素分馏 2.2.1 铁吸收过程的分馏效应目前,大量研究报道了燕麦、菜豆、水稻、高山植物和高等植物的铁分馏机制[54]。生物吸收铁过程的同位素分馏受到生物吸收与转运两个过程控制,与铁的价态和形态变化特别有关[55]。如前所述水稻享有两种有效吸收铁的机制,即类策略Ⅰ和策略Ⅱ[56-57],其中类策略Ⅰ涉及铁还原过程。然而,铁还原过程难以通过水稻根际还原效应实现,主要依赖于淹水还原条件下异化铁还原过程产生[13]。研究表明,该过程可导致植物富集轻Fe同位素或者无同位素组成上的改变[58]。而策略Ⅱ吸收机理下可导致植物相对于土壤富集重铁同位素∆56Fe植物-可提取铁 = 0.20‰[6]。大多数禾本科单子叶植物为策略Ⅱ植物。目前报道表明,稻田中同时含有二价铁和三价铁复合物,因此水稻兼具机理Ⅰ和机理Ⅱ的特性[36,46,48]。Liu等[36]认为,水稻铁同位素分馏明显或可忽略分别归因于田间水稻和水培水稻分别利用策略Ⅰ与策略Ⅱ的吸收方式,表明水稻对铁的吸收与缺铁和富铁有关(图 2a)。Garnier等[59]通过田间实验研究,表明根部铁同位素较土壤溶液中的明显更重(Δ56Fe根−土壤溶液=1.74‰),但较铁膜中的轻(Δ56Fe根−土壤溶液=−0.51‰),表明铁膜可能是水稻铁的主要来源(图 2b)。有进一步研究表明,水稻植株相比于土壤略富集较重的δ56Fe(∆56Fe水稻植株-土壤 =0.3‰),其中中柱和皮层的δ56Fe铁值相似,表明水稻植株对铁的吸收主要通过铁(Ⅲ)-植物铁载体(Fe(Ⅲ)-DMA)螯合作用发生,而不是通过铁(Ⅲ)还原作用发生[46,48]。Zhong等[46]通过淹水与落干处理表明,水稻整体植株的铁同位素组成分别与土壤相近(∆56Fe水稻植株-土壤 = 0.05‰)和轻于土壤(∆56Fe水稻植株-土壤 = −0.41‰),该研究揭示淹水与落干条件下水稻分别主要吸收来自根表铁膜的Fe(Ⅲ)-DMA与孔隙水的Fe2+(图 2c)。
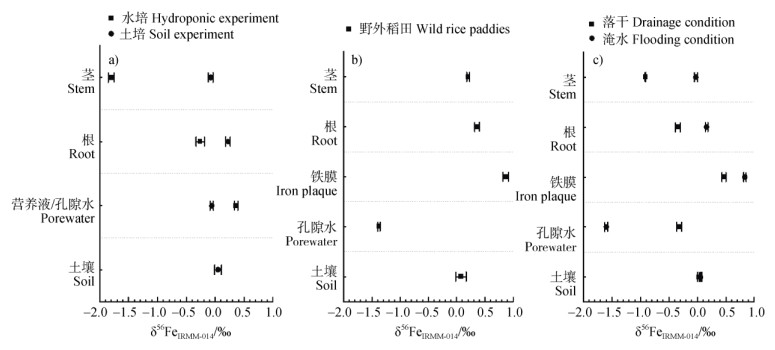
|
注:δ56FeIRMM-014:相对于IRMM-014标准物质的铁同位素组。下同。 Note: δ56FeIRMM-014: Fe isotopic compositions of the samples were expressed using a delta per mil(‰)notation relative to the standard IRMM-014. The same below. 图 2 土壤-水稻系统土壤-营养液/孔隙水-铁膜-根部-茎的铁同位素分馏特征(a. 水培与土培处理[36],b. 野外稻田区域[59],c. 落干与淹水处理[46]) Fig. 2 The isotopic fractionation characteristics of different parts in the soil-rice system(a. Hydroponic or soil treatment[36], b. Wild rice paddy area[59], and c. Drop-dry or flooded treatment[46]) |
先前研究表明,机理Ⅰ和机理Ⅱ植物中铁的转运过程产生的分馏与吸收过程相似,均分别受还原和有机络合铁过程控制。先前的研究表明,机理Ⅰ植物中,幼叶逐渐积累稍轻的铁同位素。据Guelke和von Blanckenburg[6]研究指出,机理Ⅰ植物目前的观点是,植物的细胞内Fe(Ⅱ)被尼克酰胺(NA)螯合,然后转运至木质部导管。铁在装载至木质部导管中时被氧化,然后作为铁元素转运Fe(Ⅲ)-柠檬酸络合物。机理Ⅱ植物中,植物在整个生长过程中几乎不存在铁同位素分馏,且各组织部位的铁同位素在2sd范围内无差异[60]。因此,Guelke和von Blanckenburg[6]推测铁在转运过程中不会改变其氧化还原状态,或者还原/氧化在所有步骤中均为确定的。对于水稻而言,兼具类机理Ⅰ和机理Ⅱ的吸收策略,显然根部-茎部/地上部的铁同位素分馏尺度和方向能很好地反演该迁移过程的关键铁络合物。Moynier等[8]通过密度泛函理论计算的研究表明,Fe(Ⅲ)-植物铁载体较Fe(Ⅲ)-柠檬酸重1.5%,较Fe(Ⅱ)−NA重约3%。作为Fe(Ⅲ)-植物铁载体复合物之一的Fe(Ⅲ)−DMA被认为富含较柠檬酸−铁(Ⅲ)和Fe(Ⅱ)−NA更重的同位素。其中,Chen等[48]研究表明,茎和根之间的δ56Fe值(Δ56Fe茎−根)相似(成熟期和拔节期分别为−1.39‰±0.13‰和−1.30‰± 0.28‰),与理论计算结果木质部中的Fe(Ⅲ)-柠檬酸盐和根中的Fe(Ⅲ)-DMA之间的铁同位素分馏值−1.43‰相一致。Zhong等[46]指出茎中的铁同位素较根中的轻,这可能归因于木质部中存在Fe(Ⅲ)−柠檬酸,以及茎韧皮部中存在Fe(Ⅱ)−NA和Fe(Ⅲ)–DMA的混合物,而同位素最重的Fe(Ⅲ)−DMA被认为是根细胞中积累的铁的主要形式。本课题组的研究亦表明该过程受到外界锌浓度的影响,提高锌浓度可降低该过程产生的分馏尺度,其中也可能受到不同生长时期影响(数据未发表,图 3)。上述研究为全面准确地阐述铁在植物体的迁移过程提供了强有力的基础。
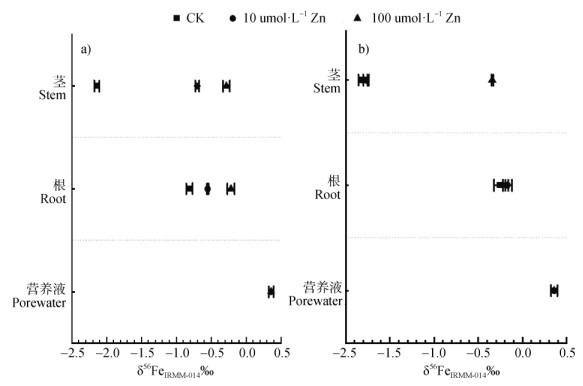
|
注:该结果采用Neptune Plus MC-ICP-MS(Thermo Fisher Scientific,Bremen,Germany)分析;CK:对照组;该数据均未发表。 Note: The isotopic data were acquired using the Neptune Plus MC-ICP-MS; CK: Control Check; the data are unpublished. 图 3 不同锌处理下水培水稻系统中营养液-根-茎的铁同位素组成(a. 分蘖期,b. 成熟期) Fig. 3 The iron isotope composition of nutrient solution-root-stem in hydroponically grown rice systems under different Zn treatments(a. Tillering stage and b. Maturity stage) |
要理解水稻中矿质元素吸收和转运的生理机制,就必须详细了解各组织中亚细胞分布。利用激光剥蚀电感耦合等离子体质谱(LA-ICP-MS)技术研究水稻节点主要的元素分布,发现铁在节点的维管束间组织高度积累[61]。本课题组研究同样发现铁在节点维管束间高度累积,且拔节期和成熟期叶面喷硅处理可改变铁在节点的亚细胞分布(数据未发表,图 4)。利用同步加速器X射线荧光(SXRF)可分析体内金属元素的亚细胞定位,其分辨率低至250 nm。结合纳米离子探针(NanoSIMS)技术,推断铁主要定位于水稻节中的基本薄壁细胞,且铁和磷在液泡内强烈地累积,可能以不溶物的形式存在[62]。采用徕卡激光扫描共聚焦显微镜(TCS-SP8x HyVolusion,Leica Microsystems)可观测高分辨率立体图像,包括节点内的韧皮部、木质部和薄壁细胞组织[63]。
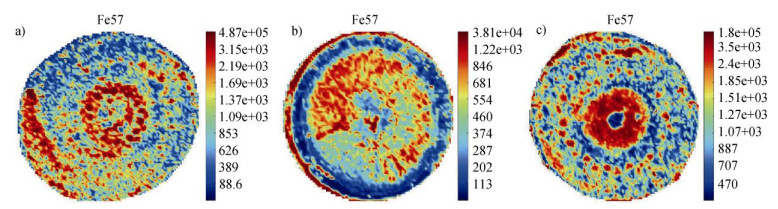
|
注:该数据均未发表。 Note: The data are unpublished. 图 4 水稻成熟期节点中铁元素分布图(a. 叶面未喷硅处理的节点,b. 拔节期喷硅处理的节点,c. 成熟期叶面喷硅处理的节点) Fig. 4 The distribution of Fe in nodes of rice at maturity(a. Nodes without foliar silicon spray treatment, b. Nodes sprayed with silicon at the nodulation stage and c. Nodes sprayed with silicon at the maturity stage. |
从光学显微镜(OM,要求前期染色)到高分辨率的立体成像,如扫描电子显微镜(SEM),结合能量色散X射线分析(EDXA)和激光剥蚀电感耦合等离子体质谱以及同步加速器X射线荧光等,可获得样品组织的详细电子显微照片[64]。当上述光谱方法运用于野生稻背景下特定基因敲除和敲减的突变株系时,可揭示特定转运蛋白在亚细胞水平上负责铁转运的过程和机制。比如在VIT1突变种子的这些细胞中未检测到铁,而铁更广泛地分布在下胚轴和胚根以及叶的表皮细胞中,这表明VIT1在液泡铁储存中的作用[62]。
4 研究展望本研究为解析土壤-水稻系统铁的迁移转运机制,从植物转运蛋白在铁转运过程中的功能、铁在土壤-水稻系统的同位素分馏特征与铁的亚细胞定位三个层面的研究进展深入讨论,旨在为粮食作物质量提升和作物安全生产提供理论基础。基因表达定量、同位素分馏与亚细胞定位分析三者相结合,为铁在水稻体内的转运提供新的科学证据和认知。因此,为更精准地识别土壤-植物系统中多种重金属的迁移转运过程,结合同位素特征和光谱技术与基因表达等工具能为深入理解金属种类和归趋、生物过程与非生物过程中的金属同位素特征,或验证具体假说提供更多科学信息。基于目前研究,有以下几点研究有待阐明:(1)铁的吸收策略在缺铁或富铁以及淹水或落干条件已经通过同位素分馏方法进一步佐证,然而在典型的干湿交替过程中,铁氧化还原驱动水稻全生育期过程对铁吸收的响应机制尚不明确;(2)由于缺铁会促进锌和镉的共同转运蛋白OsZIP5、OsZIP9以及镉转运蛋白OsNRAMP1和OsNRAMP5的基因表达,而水稻在干湿交替过程能维持铁与锌的内稳态,因此推测可通过适当调节环境缺铁的方式以增强OsZIP5、OsZIP9的表达,同时通过外源抑制OsNRAMP1和OsNRAMP5的表达以减少镉的吸收,进而实现水稻对铁的高效吸收以及同步促进锌的吸收和降低镉的摄取,尚有待进一步研究阐明。
| [1] |
Zhang J, Zhang M, Song H, et al. A novel plasma membrane-based NRAMP transporter contributes to Cd and Zn hyperaccumulation in Sedum alfredii Hance[J]. Environmental and Experimental Botany, 2020, 176: 104121. DOI:10.1016/j.envexpbot.2020.104121
(  0) 0) |
| [2] |
Huang S, Wang P T, Yamaji N, et al. Plant nutrition for human nutrition: Hints from rice research and future perspectives[J]. Molecular Plant, 2020, 13(6): 825-835. DOI:10.1016/j.molp.2020.05.007
(  0) 0) |
| [3] |
Ricachenevsky F K, Punshon T, Lee S, et al. Elemental profiling of rice FOX lines leads to characterization of a new Zn plasma membrane transporter, OsZIP7[J]. Frontiers in Plant Science, 2018, 9: 865. DOI:10.3389/fpls.2018.00865
(  0) 0) |
| [4] |
Zhong S X, Li X M, Li F B. Cadmium isotopes fractionation in soil-plant systems: A review (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 825-836. [钟松雄, 李晓敏, 李芳柏. 镉同位素分馏在土壤-植物体系中的研究进展[J]. 土壤学报, 2021, 58(4): 825-836.]
(  0) 0) |
| [5] |
Singh P, Kumar R, Khan A, et al. Bacillibactin siderophore induces iron mobilisation responses inside aerobic rice variety through YSL15 transporter[J]. Rhizosphere, 2023, 100724.
(  0) 0) |
| [6] |
Guelke M, von Blanckenburg F. Fractionation of stable iron isotopes in higher plants[J]. Environmental Science & Technology, 2007, 41(6): 1896-1901.
(  0) 0) |
| [7] |
Domagal-Goldman S D, Kubicki J D. Density functional theory predictions of equilibrium isotope fractionation of iron due to redox changes and organic complexation[J]. Geochimica et Cosmochimica Acta, 2008, 72(21): 5201-5216. DOI:10.1016/j.gca.2008.05.066
(  0) 0) |
| [8] |
Moynier F, Fujii T, Wang K, et al. Ab initio calculations of the Fe(Ⅱ) and Fe(Ⅲ) isotopic effects in citrates, nicotianamine, and phytosiderophore, and new Fe isotopic measurements in higher plants[J]. Comptes Rendus Geoscience, 2013, 345(5/6): 230-240.
(  0) 0) |
| [9] |
Guelke M, von Blanckenburg F, Schoenberg R, et al. Determining the stable Fe isotope signature of plant-available iron in soils[J]. Chemical Geology, 2010, 277(3/4): 269-280.
(  0) 0) |
| [10] |
Liang G. Iron uptake, signaling, and sensing in plants[J]. Plant Communications, 2022, 3(5): 100349. DOI:10.1016/j.xplc.2022.100349
(  0) 0) |
| [11] |
Li W F, Zhu H Y, Lan P. Research progress of iron homeostasis regulation in strategy Ⅰ plants (In Chinese)[J]. Soils, 2021, 53(6): 1101-1106. DOI:10.13758/j.cnki.tr.2021.06.001 [李文凤, 朱海焰, 兰平. 策略Ⅰ植物铁吸收稳态调控研究进展[J]. 土壤, 2021, 53(6): 1101-1106.]
(  0) 0) |
| [12] |
Kobayashi T, Nakanishi Itai R, Nishizawa N K. Iron deficiency responses in rice roots[J]. Rice, 2014, 7: 27. DOI:10.1186/s12284-014-0027-0
(  0) 0) |
| [13] |
Cheng L J, Wang F, Shou H X, et al. Mutation in nicotianamine aminotransferase stimulated the Fe(Ⅱ) acquisition system and led to iron accumulation in rice[J]. Plant Physiology, 2007, 145(4): 1647-1657. DOI:10.1104/pp.107.107912
(  0) 0) |
| [14] |
Banakar R, Fernandez A A, Zhu C F, et al. The ratio of phytosiderophores nicotianamine to deoxymugenic acid controls metal homeostasis in rice[J]. Planta, 2019, 250(4): 1339-1354. DOI:10.1007/s00425-019-03230-2
(  0) 0) |
| [15] |
Nongbri E L, Das S, Bhutia K L, et al. Differential expression of iron deficiency responsive rice genes under low phosphorus and iron toxicity conditions and association of OsIRO3 with yield in acidic soils[J]. Rice Science, 2023, 30(1): 58-69. DOI:10.1016/j.rsci.2022.07.009
(  0) 0) |
| [16] |
Inoue H, Kobayashi T, Nozoye T, et al. Rice OsYSL15 is an iron-regulated iron(Ⅲ)-deoxymugineic acid transporter expressed in the roots and is essential for iron uptake in early growth of the seedlings[J]. Journal of Biological Chemistry, 2009, 284(6): 3470-3479. DOI:10.1074/jbc.M806042200
(  0) 0) |
| [17] |
Zhang C, Ge Y, Yao H, et al. Iron oxidation-reduction and its impacts on cadmium bioavailability in paddy soils: A review[J]. Frontiers of Environmental Science & Engineering, 2012, 6: 509-517.
(  0) 0) |
| [18] |
Zhu C Q, Zhang J H, Zhu L F, et al. NH4+ facilitates iron reutilization in the cell walls of rice (Oryza sativa) roots under iron-deficiency conditions[J]. Environmental and Experimental Botany, 2018, 151: 21-31. DOI:10.1016/j.envexpbot.2018.03.018
(  0) 0) |
| [19] |
Ishimaru Y, Masuda H, Bashir K, et al. Rice metal-nicotianamine transporter, OsYSL2, is required for the long-distance transport of iron and manganese[J]. The Plant Journal, 2010, 62(3): 379-390. DOI:10.1111/j.1365-313X.2010.04158.x
(  0) 0) |
| [20] |
Singh P, Khan A, Kumar R, et al. In silico analysis of comparative affinity of phytosiderophore and bacillibactin for iron uptake by YSL15 and YSL18 receptors of Oryza sativa[J]. Journal of Biomolecular Structure and Dynamics, 2023, 41(7): 2733-2746. DOI:10.1080/07391102.2022.2037464
(  0) 0) |
| [21] |
Kobayashi T, Nozoye T, Nishizawa N K. Iron transport and its regulation in plants[J]. Free Radical Biology and Medicine, 2019, 133: 11-20. DOI:10.1016/j.freeradbiomed.2018.10.439
(  0) 0) |
| [22] |
Che J, Yamaji N, Ma J F. Role of a vacuolar iron transporter OsVIT2 in the distribution of iron to rice grains[J]. New Phytologist, 2021, 230(3): 1049-1062. DOI:10.1111/nph.17219
(  0) 0) |
| [23] |
Zeng H, Wu H, Yan F, et al. Molecular regulation of zinc deficiency responses in plants[J]. Journal of Plant Physiology, 2021, 261: 153419. DOI:10.1016/j.jplph.2021.153419
(  0) 0) |
| [24] |
Zhao Y N, Li C, Li H, et al. OsZIP11 is a trans-Golgi-residing transporter required for rice iron accumulation and development[J]. Gene, 2022, 836: 146678. DOI:10.1016/j.gene.2022.146678
(  0) 0) |
| [25] |
Huang S, Sasaki A, Yamaji N, et al. The ZIP transporter family member OsZIP9 contributes to root zinc uptake in rice under zinc-limited conditions[J]. Plant Physiology, 2020, 183(3): 1224-1234. DOI:10.1104/pp.20.00125
(  0) 0) |
| [26] |
Tan L T, Qu M M, Zhu Y X, et al. ZINC TRANSPORTER5 and ZINC TRANSPORTER9 function synergistically in zinc/cadmium uptake[J]. Plant Physiology, 2020, 183(3): 1235-1249. DOI:10.1104/pp.19.01569
(  0) 0) |
| [27] |
Sasaki A, Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. The Plant Cell, 2012, 24(5): 2155-2167. DOI:10.1105/tpc.112.096925
(  0) 0) |
| [28] |
Zhong S, Li X, Li F, et al. Cadmium isotope fractionation and gene expression evidence for tracking sources of Cd in grains during grain filling in a soil-rice system[J]. Science of the Total Environment, 2023, 873: 162325. DOI:10.1016/j.scitotenv.2023.162325
(  0) 0) |
| [29] |
Zhang Q, Huang D Y, Xu C, et al. Fe fortification limits rice Cd accumulation by promoting root cell wall chelation and reducing the mobility of Cd in xylem[J]. Ecotoxicology and Environmental Safety, 2022, 240: 113700. DOI:10.1016/j.ecoenv.2022.113700
(  0) 0) |
| [30] |
Bughio N, Yamaguchi H, Nishizawa N K, et al. Cloning an iron‐regulated metal transporter from rice[J]. Journal of Experimental Botany, 2002, 53(374): 1677-1682. DOI:10.1093/jxb/erf004
(  0) 0) |
| [31] |
Zhu X, Guo Y, Williams R, et al. Mass fractionation processes of transition metal isotopes[J]. Earth and Planetary Science Letters, 2002, 200(1/2): 47-62.
(  0) 0) |
| [32] |
Balci N, Bullen T D, Witte-Lien K, et al. Iron isotope fractionation during microbially stimulated Fe(Ⅱ) oxidation and Fe(Ⅲ) precipitation[J]. Geochimica et Cosmochimica Acta, 2006, 70(3): 622-639. DOI:10.1016/j.gca.2005.09.025
(  0) 0) |
| [33] |
Beard B L, Johnson C M, Cox L, et al. Iron isotope biosignatures[J]. Science, 1999, 285(5435): 1889-1892. DOI:10.1126/science.285.5435.1889
(  0) 0) |
| [34] |
Zhong S X, He H F, Chen Z L, et al. Advancement in study on biochemical behavior of arsenic in flooded paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(1): 1-17. [钟松雄, 何宏飞, 陈志良, 等. 水淹条件下水稻土中砷的生物化学行为研究进展[J]. 土壤学报, 2018, 55(1): 1-17.]
(  0) 0) |
| [35] |
Zhong S X, Yin G C, Chen Z L, et al. Iron induced effects on arsenic's environmental chemical behavior in paddy soil: A review (In Chinese)[J]. Soils, 2016, 48(5): 854-862. DOI:10.13758/j.cnki.tr.2016.05.003 [钟松雄, 尹光彩, 陈志良, 等. 水稻土中砷的环境化学行为及铁对砷形态影响研究进展[J]. 土壤, 2016, 48(5): 854-862.]
(  0) 0) |
| [36] |
Liu C, Gao T, Liu Y, et al. Isotopic fingerprints indicate distinct strategies of Fe uptake in rice[J]. Chemical Geology, 2019, 524: 323-328. DOI:10.1016/j.chemgeo.2019.07.002
(  0) 0) |
| [37] |
Jeon B H, Dempsey B A, Burgos W D. Kinetics and mechanisms for reactions of Fe(Ⅱ) with iron(Ⅲ)oxides[J]. Environmental Science & Technology, 2003, 37(15): 3309-3315.
(  0) 0) |
| [38] |
Southall S C, Micklethwaite S, Wilson S, et al. Changes in crystallinity and tracer-isotope distribution of goethite during Fe(Ⅱ)-accelerated recrystallization[J]. ACS Earth and Space Chemistry, 2018, 2(12): 1271-1282. DOI:10.1021/acsearthspacechem.8b00100
(  0) 0) |
| [39] |
Crosby H A, Johnson C M, Roden E E, et al. Coupled Fe(Ⅱ)−Fe(Ⅲ)electron and atom exchange as a mechanism for Fe isotope fractionation during dissimilatory iron oxide reduction[J]. Environmental Science & Technology, 2005, 39(17): 6698-6704.
(  0) 0) |
| [40] |
Jeon B-H, Dempsey B A, Burgos W D, et al. Sorption kinetics of Fe(Ⅱ), Zn(Ⅱ), Co(Ⅱ), Ni(Ⅱ), Cd(Ⅱ), and Fe(Ⅱ)/Me(Ⅱ)onto hematite[J]. Water Research, 2003, 37(17): 4135-4142. DOI:10.1016/S0043-1354(03)00342-7
(  0) 0) |
| [41] |
Tamaura Y, Ito K, Katsura T. Transformation of γ-FeO(OH)to Fe3O4 by adsorption of iron(Ⅱ)ion on γ-FeO(OH)[J]. Journal of the Chemical Society, Dalton Transactions, 1983(2): 189-194. DOI:10.1039/DT9830000189
(  0) 0) |
| [42] |
Hansel C M, Benner S G, Fendorf S. Competing Fe(Ⅱ)-induced mineralization pathways of ferrihydrite[J]. Environmental Science & Technology, 2005, 39(18): 7147-7153.
(  0) 0) |
| [43] |
Latta D E, Bachman J E, Scherer M M. Fe electron transfer and atom exchange in goethite: Influence of Al-substitution and anion sorption[J]. Environmental Science & Technology, 2012, 46(19): 10614-10623.
(  0) 0) |
| [44] |
Clayton R, Hudson-Edwards K, Malinovsky D, et al. Fe isotope fractionation during the precipitation of ferrihydrite and transformation of ferrihydrite to goethite[J]. Mineralogical Magazine, 2005, 69(5): 667-676. DOI:10.1180/0026461056950278
(  0) 0) |
| [45] |
Beard B L, Johnson C M, Skulan J L, et al. Application of Fe isotopes to tracing the geochemical and biological cycling of Fe[J]. Chemical Geology, 2003, 195(1/4): 87-117.
(  0) 0) |
| [46] |
Zhong S X, Li X, Li F B, et al. Source and strategy of iron uptake by rice grown in flooded and drained soils: insights from Fe isotope fractionation and gene expression[J]. Journal of Agricultural and Food Chemistry, 2022, 70(8): 2564-2573. DOI:10.1021/acs.jafc.1c08034
(  0) 0) |
| [47] |
Dideriksen K, Baker J, Stipp S. Fe isotope fractionation between inorganic aqueous Fe(Ⅲ) and a Fe siderophore complex[J]. Mineralogical Magazine, 2008, 72(1): 313-316. DOI:10.1180/minmag.2008.072.1.313
(  0) 0) |
| [48] |
Chen G, Liu T, Li Y, et al. New insight into iron biogeochemical cycling in soil-rice plant system using iron isotope fractionation[J]. Fundamental Research, 2021, 1(3): 277-84. DOI:10.1016/j.fmre.2021.04.006
(  0) 0) |
| [49] |
Wiederhold J G, Kraemer S M, Teutsch N, et al. Iron isotope fractionation during proton-promoted, ligand-controlled, and reductive dissolution of goethite[J]. Environmental Science & Technology, 2006, 40(12): 3787-3793.
(  0) 0) |
| [50] |
Morgan J L, Wasylenki L E, Nuester J, et al. Fe isotope fractionation during equilibration of Fe− organic complexes[J]. Environmental Science & Technology, 2010, 44(16): 6095-6101.
(  0) 0) |
| [51] |
Markovic T, Manzoor S, Humphreys-Williams E, et al. Experimental determination of zinc isotope fractionation in complexes with the phytosiderophore 2'-deoxymugeneic acid(DMA)and its structural analogues, and implications for plant uptake mechanisms[J]. Environmental Science & Technology, 2017, 51(1): 98-107.
(  0) 0) |
| [52] |
Fujii T, Moynier F, Blichert-Toft J, et al. Density functional theory estimation of isotope fractionation of Fe, Ni, Cu, and Zn among species relevant to geochemical and biological environments[J]. Geochimica et Cosmochimica Acta, 2014, 140: 553-576. DOI:10.1016/j.gca.2014.05.051
(  0) 0) |
| [53] |
Hill P S, Schauble E A, Young E D. Effects of changing solution chemistry on Fe3+/Fe2+ isotope fractionation in aqueous Fe–Cl solutions[J]. Geochimica et Cosmochimica Acta, 2010, 74(23): 6669-6689. DOI:10.1016/j.gca.2010.08.038
(  0) 0) |
| [54] |
Wu Q, Liu C, Wang Z, et al. Zinc regulation of iron uptake and translocation in rice(Oryza sativa L.): Implication from stable iron isotopes and transporter genes[J]. Environmental Pollution, 2022, 297: 118818. DOI:10.1016/j.envpol.2022.118818
(  0) 0) |
| [55] |
Johnson C M, Skulan J L, Beard B L, et al. Isotopic fractionation between Fe(Ⅲ)and Fe(Ⅱ)in aqueous solutions[J]. Earth and Planetary Science Letters, 2002, 195(1/2): 141-153.
(  0) 0) |
| [56] |
Wairich A, de Oliveira B H N, Arend E B, et al. The combined strategy for iron uptake is not exclusive to domesticated rice(Oryza sativa)[J]. Scientific Reports, 2019, 9(1): 16144. DOI:10.1038/s41598-019-52502-0
(  0) 0) |
| [57] |
Kobayashi T, Nagano A J, Nishizawa N K. Iron deficiency-inducible peptide-coding genes OsIMA1 and OsIMA2 positively regulate a major pathway of iron uptake and translocation in rice[J]. Journal of Experimental Botany, 2021, 72(6): 2196-2211. DOI:10.1093/jxb/eraa546
(  0) 0) |
| [58] |
Wu B, Amelung W, Xing Y, et al. Iron cycling and isotope fractionation in terrestrial ecosystems[J]. Earth-Science Reviews, 2019, 190: 323-52. DOI:10.1016/j.earscirev.2018.12.012
(  0) 0) |
| [59] |
Garnier J, Garnier J, Vieira C, et al. Iron isotope fingerprints of redox and biogeochemical cycling in the soil-water-rice plant system of a paddy field[J]. Science of the Total Environment, 2017, 574: 1622-1632. DOI:10.1016/j.scitotenv.2016.08.202
(  0) 0) |
| [60] |
Swanner E D, Bayer T, Wu W, et al. Iron isotope fractionation during Fe(Ⅱ)oxidation mediated by the oxygen-producing marine cyanobacterium Synechococcus PCC 7002[J]. Environmental Science & Technology, 2017, 51(9): 4897-4906.
(  0) 0) |
| [61] |
Yamaji N, Ma J F. Bioimaging of multiple elements by high-resolution LA-ICP-MS reveals altered distribution of mineral elements in the nodes of rice mutants[J]. The Plant Journal, 2019, 99(6): 1254-1263. DOI:10.1111/tpj.14410
(  0) 0) |
| [62] |
Zhao F J, Moore K L, Lombi E, et al. Imaging element distribution and speciation in plant cells[J]. Trends in Plant Science, 2014, 19(3): 183-192. DOI:10.1016/j.tplants.2013.12.001
(  0) 0) |
| [63] |
Yamaji N, Ma J F. Node-controlled allocation of mineral elements in Poaceae[J]. Current Opinion in Plant Biology, 2017, 39: 18-24. DOI:10.1016/j.pbi.2017.05.002
(  0) 0) |
| [64] |
Yokosho K, Yamaji N, Ma J F. OsFRDL1 expressed in nodes is required for distribution of iron to grains in rice[J]. Journal of Experimental Botany, 2016, 67(18): 5485-5494. DOI:10.1093/jxb/erw314
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


