土壤作为地球表层生态系统中的核心和最为活跃的圈层,是人类赖以生存和发展的关键物质基础。土壤健康作为维持动植物和人类健康的基础,是支撑陆地生态系统功能和服务的关键[1]。2000年,Doran和Zeiss[2]首次提出土壤健康的概念,即土壤维持植物、动物和人类的重要生命系统的持续能力。与土壤质量的概念范畴不同[3],土壤健康不仅涵盖与人类相关的生态系统服务,而且延伸到包括地球健康在内更广泛的可持续性目标,是地球“同一健康”(“One health”)的重要组成部分[4]。健康的土壤在增强作物抗逆、提高土壤肥力和作物产量以及维持根际生命共同体和区域农业生态系统可持续性方面发挥至关重要的作用[5]。深入认识农田生态系统土壤健康特征有助于人们更好地理解土壤微生物组功能及其介导的养分转化过程,进而为发掘土壤关键功能微生物资源、提高区域农业生态系统生产力和保障粮食安全提供重要科技支撑[6-7]。前期评价土壤健康的指标主要包括物理和化学因素[8],但理想的评价指标体系应对管理实践表现出敏感的动态响应[9],鉴于传统的物理和化学指标存在敏感性低和覆盖度差的问题,近期研究提出生物学指标能更好地指示土壤健康特征[10]。这是由于土壤微生物在土壤养分转化和肥力提升方面发挥着关键的作用,是调控和维护土壤质量与生产力的核心,而且土壤微生物群落对农业管理措施高度敏感[11-15]。因此,在土壤健康评价体系中纳入更多生物学相关指标是准确预测土壤健康状况的关键。
旱区(drylands)约占全球陆地表面积的41%,是地球陆地生态系统的重要组成部分[16]。我国旱区主要集中在西北地区,耕地面积3.67亿亩(1亩为666.7 m2),作为我国主要的粮食生产后备区,对于保障国家粮食安全具有重要战略地位[17]。当前,关于我国土壤健康的研究主要集中于东北平原、华北平原、长江流域平原和东南丘陵山地等地区[18-19]。对于西北旱区土壤健康相关研究仍不足。考虑到环境异质性对土壤性质和微生物群落等因素的影响,不同地区的度量指标存在差异,需加入地区特异性指标评估土壤健康状况。西北旱区生态环境脆弱,干旱、盐碱等恶劣生境及长期粗放式耕作导致土壤微生物多样性丧失、代谢功能失调、土壤质量下降等突出的土壤健康风险。由此,评估西北旱区土壤健康时应充分考虑加入能够表征该地区土壤特征的生物和非生物指标。值得关注的是,生物指标中涵盖的土壤微生物可以调控自身代谢或加强种间合作来抵御逆境胁迫并帮助宿主植物抗逆[20-21],并改善逆境条件下土壤养分循环过程。为此,土壤微生物组对西北旱区土壤健康和农业可持续发展具有重要意义。进一步研究表明,个体体积小且繁殖速度快的土壤微生物能够对区域环境变化作出快速响应[22]。而且,土壤核心微生物菌群可增强群落对环境扰动的抗性,进而维持生态系统功能的稳定发挥[23]。考虑到土壤健康指标的敏感性和可检测性,土壤微生物组更适合作为评价受气候变化剧烈影响的西北旱区土壤健康的关键指标。
全球气候变化日益剧烈,国际社会已认识到维持土壤健康是人类当代及未来生存与发展所面临的重大挑战之一,采取积极有效措施改善土壤健康已成为全球共识。对旱区土壤生态系统而言,微生物特征与旱区生态系统服务功能之间的关系还不清楚,对土壤微生物组在评价旱区土壤健康中发挥的作用仍不够深入,这阻碍了发展基于旱区土壤微生物组的土壤健康指标。因此,如何精准挖掘未知的土壤微生物组,丰富土壤健康评价指标体系,调控旱区土壤健康状态,提高旱区农业生态系统综合生态效益是未来旱区农业核心技术攻关方向之一。本文系统综述了土壤微生物组与多重生态系统服务之间的关系、旱区土壤健康研究进展以及对旱区土壤微生物组的调控途径,并对未来土壤微生物组和旱区土壤健康研究趋势提出展望,旨在为实现旱区农业绿色可持续发展提供重要科学指导。
1 土壤微生物组调控生态系统服务的作用机制 1.1 土壤微生物与作物生产作物产量和安全生产是集约化农业的主要目标,也是土壤健康的一个重要反映,因为它与动物和人类健康直接相关[24-25]。植物根际促生菌(PGPR)对植物生长和维持土壤健康维持至关重要[26]。自然条件下植物宿主通过分泌有机酸、酶、黄酮类物质和挥发性有机物等根系分泌物定向招募PGPR,并通过植物-土壤-微生物反馈环进一步增加土壤养分有效性,促进土壤养分转化及植物生长[27]。菌根真菌与植物形成共生体,通过获取植物光合作用同化产物的同时为植物提供氮磷等有效养分来促进植物生长[28-29]。此外,核心微生物对于作物产量的积极作用也得到证实[30]。原生生物作为土壤微生物的重要组成部分,研究表明原生动物中的消费者在土壤中占主导地位,表明其在营养物质周转和营养水平转移的重要性[31]。同时,原生生物可通过相互作用影响细菌和真菌的群落结构从而对土壤养分周转产生影响[32]。微生物跨界相互作用是实现物质流通和能量交换的基础[33-35],研究发现芽孢杆菌和捕食性原生生物间的互作是提高植物生物量的关键[36]。同时细菌和真菌间的跨界相互作用能显著抑制植物病害的发生,从而促进植物生长[37]。最近研究表明微生物能增加植物的抗逆性,接种来自干旱、高温或寒冷地点的微生物群落可帮助植物在相应胁迫条件下表现出更高的存活率,且这些接种的微生物在种植3年后的植物根中仍可被检测到[38]。Schmitz等[39]研究也表明利用沙漠植物的根际微生物菌群能显著提升番茄抗盐能力。可见,作物根际稳定和健康的微生物群落体系对于增强土壤养分转化、防御土传病害以及最终提高作物产能方面具有重要作用(图 1)。未来研究应关注微生物介导作物促生和抗逆的潜在机制,为后续利用微生物资源促进作物生长和粮食安全提供依据。
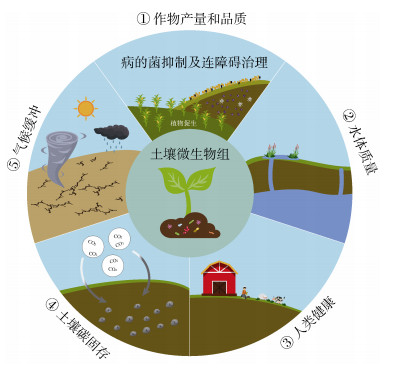
|
图 1 土壤微生物与土壤健康间的关系 Fig. 1 The relationship between soil microorganism and soil health |
连作障碍是农业生产中极为普遍的现象,也是难以防治的问题。土壤连作障碍形成原因是多方面的,包括植物化感自毒物质积累[40-41]、土壤理化性质劣化[42]、土传病原菌富集和微生物多样性下降等[43-44],其最终导致作物抗逆性下降、病害高发、产量减少和品质下降[45]。化感物质除了与植物直接作用之外,与土壤中微生物活性和群落组成密切相关。化感物质进入土壤后作为微生物碳源使得一些有益微生物数量下降而有害微生物丰度增加[46],土壤细菌多样性下降,所以化感物质和微生物群落组成综合影响了作物的生长发育。由于微生物代谢途径多样,筛选化感物质降解菌并将其使用到连作土壤中,这对缓解连作障碍起到了一定的作用[47]。此外,通过多元化种植、有机肥等农业措施改变土壤微生物群落结构和细菌多样性,这对土壤连作障碍的缓解效果也较为显著[48-49]。连作中植物残体进入土壤会导致病原菌和寄生性线虫大量富集,有学者认为在所有连作障碍成因中土传病害也是导致作物生长受抑制的主要因素[50]。病原菌拮抗微生物被公认是一种绿色环保的作物土传病害防控手段,在多种作物中被广泛应用。近年来,通过分析健康土壤中微生物组成发现其中包含更多的有益微生物,据此构建人工合成菌群用于土传病害的防治取得了很好的效果[51]。土壤病毒在防控土传病害方面也具有重要作用,研究表明通过添加以青枯菌为宿主的噬菌体可有效防控番茄青枯病的发生[52]。因此,通过调节微生物组成来消减土壤中化感物质、抑制土传病原菌和线虫生长、提高土壤细菌多样性,进而缓解土壤连作障碍方面具有很好的应用前景(图 1)。
1.3 土壤微生物与水体质量农业肥料使用造成的环境污染是一个全球性问题,导致水体富营养化,促进有害藻华过度繁殖,并对饮用水质量产生负面影响[53]。研究表明微生物通过脱氮作用可降低氮素含量,首先硝化细菌将氮转化为硝酸盐,然后由反硝化细菌将硝酸盐转化为N2[54]。在富磷条件下,微生物通过增加无机磷酸盐转运蛋白基因丰度对磷进行固定[55]。重金属污染环境中,微生物可将铅、镉、砷等重金属进行生物转化以减少有毒重金属物质的传播风险[56-57]。以铅污染为例,目前消除铅的有效方法是微生物诱导碳酸钙沉淀技术,其主要原理是脲酶首先将尿素分解为铵盐和碳酸根离子,随后由表面具有较多负电荷的矿化细菌通过吸附作用,有效吸附阳离子(如Ca2+),进一步形成不规则团聚体形式的CaCO3结晶,最终有效地对金属铅进行沉积[58]。对于镉污染,细菌可通过胞外吸附、细胞表面吸附和胞内积累等方式减少土壤中镉的含量[58-59]。此外,硫还原菌和产甲烷古菌协同调控水稻土中二甲基砷的积累与降解[60]。土壤微生物可通过土壤有机质的含量来影响水体质量,研究表明高有机碳含量土壤可通过吸附作用降低有毒物质含量[61]。因此,利用土壤微生物消减土壤有害物质含量、减少其向水体传播是保持水体质量的有效途径(图 1)。
1.4 土壤微生物与人类健康健康的土壤不仅是维持动植物生产力的基础,而且人类健康在很大程度上也取决于土壤健康,人类生存繁衍所需的必要元素均来源于粮食作物。微生物一方面可调控土壤中养分的有效性来影响作物生长,另一方面可通过植物-微生物互作来调控作物品质[62]。例如,土壤微生物可影响微量元素循环从而决定作物中微量元素的积累[63],进而对人类健康产生影响。另一方面,土壤是抗生素抗性基因的重要来源[64-65],随着人类活动影响的加剧,粪肥、污泥农用及再生水灌溉等因素使得土壤抗生素抗性基因水平显著升高[66-69]。土壤-植物系统是抗生素抗性基因从环境向人类传播扩散的重要途径之一,是环境抗性基因人群暴露的主要来源[70]。当人们摄入生食的蔬菜、水果等时,蔬果携带的抗性细菌和抗性基因将直接进入人体,从而对人类健康造成潜在威胁[71]。抗生素抗性基因的传播并不完全是有害的,研究表明抗生素抗性基因与抗噬菌体侵染相关基因可同时进行水平转移,抗生素抗性基因的转移可赋予细菌抗噬菌体侵染能力有利于细菌群落的稳定,有利于维持细菌介导的土壤养分循环[72]。同时,土壤病毒也是人类健康的危害之一,病毒作为非细胞生物只能通过宿主寄生来进行繁衍,土壤微生物可作为土壤病毒的主要载体进入人体并危害人类健康[73]。土壤微塑料作为重要的环境污染物,在人类血液中已经被发现并且与人类疾病相关[74]。土壤微生物作为主要的分解者,其决定土壤中微塑料的含量,是消减微塑料危害的有效途径[75]。气候干旱的加剧会诱发土壤病原微生物的释放,并显著增加土壤病原微生物丰度[76],使得其分泌的有机毒素可通过食物链进行传播而危害人类健康。总之,土壤微生物作为作物生长和养分循环的重要调控者,在驱动生物地球化学循环的过程中会携带不利于人类健康的抗生素抗性基因或有机毒素,进而影响人类健康。因此,有效操控土壤微生物群落对维持人类健康至关重要(图 1)。
1.5 土壤微生物与碳固存2020年我国提出“碳达峰”和“碳中和”双碳目标,土壤作为陆地二氧化碳排放的主要来源对于实现双碳目标具有重要意义。土壤微生物通过呼吸作用降解有机碳产生二氧化碳,据估算每年陆地生态系统排放的碳中有约1/2来自于异养微生物呼吸[77]。最近研究表明干旱条件下微生物多样性损失并伴随自身活性下降导致二氧化碳排放降低和土壤碳含量增加[78]。微生物碳利用效率指征微生物利用外源碳合成自身生物量的效率,其与全球尺度下的土壤碳含量显著相关,表明微生物自身特性在土壤碳周转中的重要作用[79]。病毒作为最丰富的生物实体,可以通过裂解作用影响微生物的丰度和群落结构进而影响土壤碳循环。例如,土壤病毒可通过病毒分流和病毒穿梭两种途径影响土壤中有机碳含量。进一步研究表明土壤噬菌体可通过“穿梭体”增加顽固性可溶性有机碳的成分[80]。除活性微生物外,微生物残体同样对土壤有机碳含量具有重要作用。微生物残体是土壤有机碳的重要组成部分,其可与土壤矿物相结合形成矿物结合态有机碳,这种稳定的碳组分被认为是气候变化背景下增加土壤碳固存的有效途径[81]。西北旱区气候干旱,深刻理解该地区微生物与土壤有机碳之间的关系,对于理解旱区土壤碳周转过程和增加土壤碳固存具有重要意义(图 1)。
1.6 土壤微生物与气候缓冲气候变化是造成生物多样性丧失和陆地生态系统功能改变的重要因素[82-83]。土壤微生物在面临增温、降雨、大气氮沉降等气候变化多因子共同影响时,其活性动态对于维持区域土壤生态系统功能稳定,增强区域农业生态系统气候韧性至关重要[23]。研究表明土壤革兰氏阳性菌和阴性菌的比值是青藏高原土壤有机碳分解温度敏感性的主导因素,对于减少土壤碳损失和二氧化碳排放具有重要意义[84]。旱区降雨稀少,水资源匮乏是制约旱区社会经济发展的关键障碍因素之一。近期研究揭示,土壤微生物群落在周期性干旱扰动下产生生态记忆,可在后续干旱时表现出更强的抵抗力和恢复力,并维持土壤生态系统功能[85]。进一步研究表明,土壤中真菌群落在响应干旱时较细菌具有更高的稳定性[86],后续可更多考虑利用真菌资源来抵御干旱所带来的负面影响。由于全球二氧化碳排放的增加和工业化的快速发展导致大气温度和自然氮沉降速率显著增加。研究表明长时间增温导致微生物群落结构显著变化,并且通过增加甲烷氧化基因和降低产甲烷基因,增加土壤微生物对甲烷的吸收使土壤成为碳汇[87]。同时,长期增温可增加微生物间相互作用和稳定性,表明保持微生物相互作用对于减轻变暖引起的生物多样性丧失对生态系统功能的不利影响至关重要[88]。原位模拟实验表明氮添加导致微生物多样性下降,并降低土壤二氧化碳排放有利于土壤碳固存[89]。土壤病毒作为影响微生物群落组成的重要因素,在维持气候变化下的微生物群落组成和养分循环方面具有重要作用。研究表明气候扰动可改变土壤病毒群落结构,从而导致微生物群落结构发生显著变化并最终影响土壤碳周转过程[73]。未来研究应重点关注微生物抵御逆境胁迫的潜在作用机制,为精准发掘微生物资源缓解气候变化带来的潜在影响提供重要理论依据(图 1)。
2 土壤微生物作为土壤健康评价指标的发展准确全面的评价指标对于评估土壤健康状况至关重要。传统的土壤质量评估指标包括物理指标(土壤粒径、团聚体稳定性、含水量、容重和最大持水率等)和化学指标(pH、电导率、阳离子交换容量和有效土壤养分等)[89]。目前,土壤健康的评估框架包括了物理、化学和生物过程指标,例如美国康奈尔土壤健康综合评估框架(Comprehensive Assessment of Soil Health,CASH)和土壤管理评估框架(Soil Management Assessment Framework,SMAF)。如前所述,土壤微生物组参与和调控关键的生态系统服务,但现有土壤健康评价体系并没有纳入微生物物种和多样性信息[90-91]。而使用单一指标评估在物种数量上具有压倒性优势的微生物并不全面,将微生物功能指标整合至土壤健康评估体系才更为可靠和具有说服力。
越来越多的土壤学家建议将微生物指标纳入土壤健康评估框架中来,也有越来越多的以微生物为基础的评估土壤健康的指标在许多领域广泛使用。目前已有多种微生物和微生物过程指标被用于表征土壤健康,如微生物酶活性、微生物多样性、微生物生物量、细菌真菌比、硝化微生物丰度、细菌真菌病原体、植物根际促生菌、菌根真菌丰度、微生物功能基因组成和丰度、菌群网络复杂性与稳定性、碳氮磷硫元素转化速率等[92]。微生物酶活性与土壤物理化学性质、微生物多样性及微生物活性高度相关,可用作土壤多功能性的量度;功能基因与微生物的生物地球化学循环密切相关,可用于量化土壤关键过程速率和养分利用效率[93];构成物种与基因互作网络中的关键节点的微生物类群或者功能类群与土壤生态系统的复杂性和稳定性息息相关,可用于锚定决定土壤微生物代谢功能的核心微生物[94];土壤中病原菌或病毒可作为诊断植物健康和土壤质量优劣的重要指标;农田生态系统地上作物生产力的高低也与地下土壤健康有着紧密联系等[95]。但土壤健康评价体系中生物指标所占比例仍不足20%[96-97],主要由于其对生态系统功能的影响机制不明确。将微生物指标纳入土壤健康评估框架中,已在国际科学界中产生广泛共识。由此,建立标志土壤健康的关键生物学指标并界定其内涵对于理解农田生态系统功能稳定性与作物生产力的生态关联至关重要。
3 旱区土壤微生物与土壤健康研究进展由于持续性干旱、气候变暖和人为活动加剧,旱区土壤生态系统功能和服务显著降低[98]。在旱区,土壤动物和植物多样性较低,而土壤微生物对于维持该地区的生态系统功能(如养分循环)至关重要[99]。全球土壤微生物生物地理分布模式研究表明旱区土壤微生物组成和结构与其他地区显著不同,参与养分循环相关功能的微生物多样性较低[100]。干旱地区土壤微生物群落结构主要受非生物因素驱动[101],气候变化导致的干旱会显著影响微生物多样性、群落组成和共发生关系[102]。随着干旱程度的加剧,旱区土壤中核心功能类群的丰度显著下降,氮循环相关功能也明显减弱[102]。此外,研究显示,土壤遗留效应对微生物群落和功能具有重要影响,当功能受到群落组成影响时,土壤群落不一定能够在更加极端或更频繁的未来干旱期间维持相同的功能。干旱可能会继续影响微生物群落组成,例如,在具有干旱历史的土壤中,真菌比例往往会增加,而细菌的比例和多样性则降低[103]。除直接影响微生物群落外,干旱还可以通过影响土壤有机质的周转间接影响土壤细菌群落[104]。在干旱条件下,革兰氏阳性菌相对于革兰氏阴性菌具有更高的抗性。变形菌作为一种革兰氏阴性菌,在土壤中具有重要作用,并参与碳、氮和硫的循环,因此,干旱可能会对土壤中的多个养分循环过程产生不利影响[105]。最近的研究还表明,微生物的抗旱性会导致土壤有机质的稳定性降低[106]。此外,许多研究已经证实,相较于细菌,真菌具有更强的抗干旱特性。丛枝菌根真菌作为植物共生体对于植物的生长发育至关重要。在轻度到中度干旱条件下,由于植物获取养分更加困难,丛枝菌根真菌的侵染率将会增加,导致植物与真菌之间的共生关系更加紧密。然而,在重度干旱情况下,真菌和宿主之间的“资源竞争”可能会导致植物生长受阻[107]。
全球气候正在显著变暖。20世纪中叶以来,全球平均温度每10年增速达0.15℃,预计到本世纪中期,气候系统的变暖仍将持续,气候变化的不利影响和风险将不断加剧。在此背景下,21世纪末干旱半干旱区面积将占全球陆地表面的50%以上。旱区作为对气候变化异常敏感的生态脆弱区之一,干旱会导致土壤水分有效性显著降低,并直接影响土壤养分循环。研究表明,随着干旱程度增加,土壤有机质、全氮、全磷等土壤有效养分含量呈下降趋势[108]。进一步研究表明,干旱可导致土壤碳、氮和磷循环发生解耦,不利于土壤的养分供应,严重阻碍了植物的正常生长发育[109]。此外,干旱是陆地生态系统植被覆盖率下降的主要驱动因素。干旱程度的加剧会通过降低植物凋落物质量,改变根系分泌物种类和数量,最终影响土壤有效养分含量[110-111]。尤其,干旱显著降低了有机生物体相关活性,使得土壤凋落物的降解速率和土壤养分周转速率变慢甚至停滞,最终影响地上植被的养分获取和土壤养分积累。研究表明干旱是原生生物群落结构的主要影响因素,干旱导致原生生物网络的复杂性和稳定性显著降低,进而影响土壤的养分周转过程[112]。由此,干旱通过影响土壤有效养分利用水平和植物-土壤间反馈对土壤健康产生不利影响。
人为扰动和气候变化导致陆地生态系统土壤退化,干旱地区尤为严重[113-114]。由于人类活动的加剧,土地的过度开垦对土壤有机碳产生不利影响[115]。目前,对于旱区土壤健康的评价方法已经纳入了整体土壤健康评价框架。一项关于旱区草地土壤健康评价研究中,作者基于层次分析法对所选定的物理、化学和生物指标进行加权以获取土壤健康状况。同时研究也指出干旱地区土壤健康状况同作物产量具有正相关关系[116]。全球旱地生态系统功能研究也指出利用与土壤养分循环相关理化性质和生物活性相关指标评估土壤状况[117]。此外,人类活动对旱区土壤的影响也主要集中于土壤理化指标和生物相关指标的变化[118]。然而,现有的评价体系和方法仍然局限于传统评价框架,主要关注土壤养分循环和作物生产。因此,其他生态系统服务仍然需要考虑,尤其是对于环境脆弱的旱区而言,这对于提升旱区土壤质量至关重要。
微生物作为陆地生态系统功能的主要驱动者,是联结地上和地下部分的主要纽带。近几十年研究表明微生物多样性驱动生态系统功能[119-121],生物多样性较高的土壤具有更高养分有效性和潜在植物促生长能力,并对持续变化的气候具有更高的抗胁迫能力[122-123]。微生物由于其环境敏感性以及其对环境变化的快速响应使其可作为良好的土壤健康表征指标。将土壤微生物与生态系统功能联系起来对于深刻理解土壤微生物与土壤健康间的关系具有重要意义,尤其在生态系统较为脆弱的干旱地区。微生物可维持干旱条件下生态系统功能的稳定,在维持旱区土壤养分循环和植物生长中不可或缺[108]。最近一项研究发现自养微生物可通过自身的碳固定作用增加旱区土壤有机碳含量,这表明土壤微生物对于旱区有机碳的积累具有重要作用[124]。对于土壤氮循环,干旱条件下活性氨氧化细菌是土壤有效氮水平的重要调节者[125]。微生物之间的相互作用也是维持旱区作物生长的关键。研究表明干旱条件下节杆菌可抑制拟南芥和高粱根系生长发育,然而有益微生物群落的加入,如贪噬菌属,可有效缓解植物的生长限制[126]。最近一项基于大尺度的土壤调查实验也直接证实了细菌和真菌之间的相互作用驱动了旱区土壤养分循环[127]。干旱条件下病毒在维持土壤健康方面也具有重要作用,研究表明干旱可导致植物病毒宿主之间的关系从致病性向互惠性发展,经过干旱环境进化的病毒株系赋予植物更大的抗旱性从而有利于植物生长[128]。旱区由于其生态脆弱性,深入阐明环境扰动下旱区生态系统的稳定性机制对于调控旱区土壤健康至关重要。基于全球59个旱地生态系统的大尺度研究表明土壤微生物维持了气候变化下生态系统多功能的稳定[129]。因此,土壤微生物组更适合作为生态脆弱的旱区土壤健康的关键性评价指标。
除传统微生物指标外,微生物的遗传和功能特征同样可作为土壤健康的表征。微生物具有资源获取、自身生物量积累和抵御逆境胁迫相关功能特征,在不同环境下其自身性状存在权衡。研究表明,干旱条件下微生物会增加逆境胁迫相关的能量投入,细胞渗透压相关基因和代谢产物表达增加,以更好适应干旱环境[130]。管理措施同样影响微生物的性状权衡,最近研究表明相对于免耕,常规耕作方式导致细菌群落具有更大的基因组和rrn拷贝数[131]。同细菌群落一样,随干旱程度增加基因组较大和GC含量较低的真菌类群占主导以减少合成GC碱基较大的能量投入,并且真菌基因组影响土壤养分含量[131]。未来研究应考虑微生物遗传和功能特征等生物学相关指标,以丰富和完善逆境(如旱区)土壤健康评价体系。
4 展望微生物介导多种生态系统功能并同时参与土壤碳、氮、磷和硫循环[132],对于土壤健康至关重要。多组学技术的发展为特定环境或扰动下微生物的功能表达和代谢潜力提供了新的视角,但旱区土壤微生物对于土壤健康的重要性尚未充分揭示。同时,由于旱区水分短缺显著影响微生物的功能特征,对土壤健康的影响也未得到充分验证。随着社会的发展,基于生态系统功能/服务的评价体系已成为必要,但现有研究中,土壤微生物对土壤健康的影响仍较多关注于作物生产,对于其余生态系统服务的影响和调控机制尚不明确。加强土壤微生物功能研究,明晰其在土壤生态功能中的作用,利用微生物资源改善土壤健康状况,对于实现农业绿色的可持续发展具有重要意义。虽然土壤微生物对于土壤健康的重要性已得到证实,但旱区微生物与土壤健康的研究仍未得到广泛关注。未来研究建议从以下几个方面进行:
(1)建立旱区土壤微生物与土壤生态系统服务和功能间的联系
旱区水资源短缺,导致作物生长受到严重制约。剖析干旱条件下植物-微生物相互作用关系的改变以及微生物协同植物抵御干旱的潜在机制对于增加粮食产量至关重要。随着人类社会的快速发展,健康的土壤不应只为人类提供基本需求还应从多个方面保障人类和地球的健康。如今,越来越多的研究人员建议,几个主要面向非农业土壤服务的新指标,如人类健康、水质和抵御环境扰动的能力等,需要成为常规土壤健康检测的一部分。微生物由于其环境敏感性,揭示干旱胁迫下微生物功能特征的变化并建立同生态系统功能间的关系对于实现旱区农业可持续发展至关重要。未来研究应利用宏基因组、宏代谢组和转录组等多组学手段充分了解旱区土壤微生物在各个生态系统服务中所发挥的作用和功能,为后续利用微生物群落提升作物生产、改善水体质量、保障人类健康和减缓气候变化的负面影响提供依据。
(2)完善旱区土壤健康评估中的生物指标
土壤微生物由于其自身的环境敏感性和快速响应能力是土壤健康的理想指标。但如今土壤健康评价指标体系中生物指标的比例相对较低,仍以物理和化学指标为主。考虑到微生物同多种生态系统服务间的关系,更多的生物指标纳入到土壤健康评价体系已成为必要。由于旱区气候条件较为恶劣,微生物将通过调整自身生理代谢活动以适应当前生存环境。考虑到微生物对于生态系统的重要性,厘清微生物自身功能特征的改变对生态系统的潜在影响对于其所维持的生态系统服务至关重要。逆境条件下微生物表现出一定的性状权衡,微生物在干旱条件下逆境胁迫相关性状的表达(如细胞壁合成、胞外多糖的产生和孢子形成等)导致的生态系统服务的变化亟待明确。同时微生物基因组特征(如基因组大小等)也应考虑,最近研究揭示其基因组特征同土壤养分循环相关[133]。干旱可导致众多病原体的丰度显著上升并且病原微生物可加速抗生素抗性基因的传播[134],在综合评价作物生产、水体质量和人类健康时,细菌真菌病原菌、寄生虫和抗生素抗性基因等应纳入到评价体系中。干旱限制微生物活性、制约土壤养分循环,相关循环的酶活性和土壤呼吸速率也应纳入到评价体系中,其对气候缓冲和土壤碳固存至关重要。后续研究应结合宏基因组和宏代谢组技术挖掘干旱胁迫下微生物功能特征和基因组特征的改变,将更多的生物指标纳入到土壤健康评价体系,以更好评估土壤健康状况。
(3)利用土壤微生物资源提升旱区土壤健康状况
微生物维持土壤所提供的多种生态系统功能服务,利用土壤微生物资源改善土壤健康状况是实现绿色可持续发展的有效手段。旱区土壤由于长期受干旱影响,养分含量较低,参与养分循环相关的功能微生物多样性和活性较低。后续研究应确定具备提质增效能力的活性功能微生物,并利用高通量分离技术等精准分离纯化相关菌株。同时结合宏代谢组学技术,确定利于功能微生物定植和功能发挥的专性营养物质。采用合成生物学方法,基于“自下而上”的合成菌群构建策略,构建利于生态系统可持续发展和环境友好型微生物菌群,促进作物生长、缓解气候胁迫并保障动植物和人类健康。此外,微生物群落结构和功能受环境异质性的影响,管理和区域因素可显著影响群落的功能发挥。后续研究应充分考虑环境导致的微生物功能差异,构建适用于旱区土壤健康提升的合成群落,更好地实现农业生态系统的绿色可持续发展。同时,由于分子技术手段的快速发展,研究人员可通过分子手段对微生物进行定向改造,优化微生物特定功能,获取具有更高活性的土壤微生物更高效的提升土壤健康状况。
| [1] |
Zhu Y G, Peng J J, Wei Z, et al. Soil microbiome and soil health (In Chinese)[J]. Science China: Life Sciences, 2021, 51(1): 11. [朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学: 生命科学, 2021, 51(1): 11.]
(  0) 0) |
| [2] |
Doran J W, Zeiss M R. Soil health and sustainability: Managing the biotic component of soil quality[J]. Applied Soil Ecology, 2000, 15(1): 3-11. DOI:10.1016/S0929-1393(00)00067-6
(  0) 0) |
| [3] |
Bunemann E K, Bongiorno G, Bai Z G, et al. Soil quality - A critical review[J]. Soil Biology & Biochemistry, 2018, 120: 105-125.
(  0) 0) |
| [4] |
Banerjee S, van der Heijden M G A. Soil microbiomes and one health[J]. Nature Reviews Microbiology, 2023, 21: 6-20. DOI:10.1038/s41579-022-00779-w
(  0) 0) |
| [5] |
Shen J B, Bai Y, Wei Z, et al. Rhizobiont: An interdisciplinary innovation and perspective for harmonizing resources, environment, and food security (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(4): 805-813. [申建波, 白洋, 韦中, 等. 根际生命共同体: 协调资源、环境和粮食安全的学术思路与交叉创新[J]. 土壤学报, 2021, 58(4): 805-813.]
(  0) 0) |
| [6] |
Shen R F, Wang C, Sun B. Soil related scientific and technological problems in implementing strategy of "Storing Grain in Land and Technology" (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(2): 135-144. [沈仁芳, 王超, 孙波. "藏粮于地、藏粮于技"战略实施中的土壤科学与技术问题[J]. 中国科学院院刊, 2018, 33(2): 135-144.]
(  0) 0) |
| [7] |
Chen X, Zhang X D, Yu W T, et al. Efficient management on soil and fertilizer to promote sustainable development of local agro-ecosystems in Liaohe Plain, China (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(9): 992-999. [陈欣, 张旭东, 宇万太, 等. 坚持土肥高效管理促进区域农田生态系统可持续发展[J]. 中国科学院院刊, 2018, 33(9): 992-999.]
(  0) 0) |
| [8] |
Li X Z, Luo Y M, Hou D Y. The indicators, framework and procedures for soil health: A critical review (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(3): 617-624. [李烜桢, 骆永明, 侯德义. 土壤健康评估指标、框架及程序研究进展[J]. 土壤学报, 2022, 59(3): 617-624.]
(  0) 0) |
| [9] |
Rinot O, Levy G J, Steinberger Y, et al. Soil health assessment: A critical review of current methodologies and a proposed new approach[J]. Science of the Total Environment, 2019, 648: 1484-1491. DOI:10.1016/j.scitotenv.2018.08.259
(  0) 0) |
| [10] |
Fierer N, Wood S A, de Mesquita C P B. How microbes can, and cannot, be used to assess soil health[J]. Soil Biology & Biochemistry, 2021, 153: 108111.
(  0) 0) |
| [11] |
Govaerts B, Mezzalama M, Unno Y, et al. Influence of tillage, residue management, and crop rotation on soil microbial biomass and catabolic diversity[J]. Applied Soil Ecology, 2007, 37(1/2): 18-30.
(  0) 0) |
| [12] |
Li Y, Chang S X, Tian L H, et al. Conservation agriculture practices increase soil microbial biomass carbon and nitrogen in agricultural soils: A global meta-analysis[J]. Soil Biology & Biochemistry, 2018, 121: 50-58.
(  0) 0) |
| [13] |
Li Y Z, Long M, Hou Y T, et al. Root exudation processes induce the utilization of microbial-derived components by rhizoplane microbiota under conservation agriculture[J]. Soil Biology & Biochemistry, 2023, 178: 108956.
(  0) 0) |
| [14] |
Liu B, Arlotti D, Huyghebaert B, et al. Disentangling the impact of contrasting agricultural management practices on soil microbial communities-importance of rare bacterial community members[J]. Soil Biology & Biochemistry, 2022, 166: 108573.
(  0) 0) |
| [15] |
Man M, Tosi M, Dunfield K E, et al. Tillage management exerts stronger controls on soil microbial community structure and organic matter molecular composition than N fertilization[J]. Agriculture Ecosystems & Environment, 2022, 336: 108028.
(  0) 0) |
| [16] |
Lian X, Piao S L, Chen A P, et al. Multifaceted characteristics of dryland aridity changes in a warming world[J]. Nature Reviews Earth & Environment, 2021, 2(4): 232-250.
(  0) 0) |
| [17] |
Liu X, Shi L J, Qian H Y, et al. New problems of food security in northwest china: A sustainability perspective[J]. Land Degradation & Development, 2020, 31(8): 975-989.
(  0) 0) |
| [18] |
Gao W S, Chen Y Q, Shi Y Q, et al. Constructing an index system for ecological health evaluation of cropping system in China main food production areas (In Chinese)[J]. Chinese Agricultural Science Bulletin, 2007, 23(10): 131-137. DOI:10.3969/j.issn.1000-6850.2007.10.030 [高旺盛, 陈源泉, 石彦琴, 等. 中国集约高产农田生态健康评价方法及指标体系初探[J]. 中国农学通报, 2007, 23(10): 131-137.]
(  0) 0) |
| [19] |
Sun B, Zhang T L, Zhao Q G. Comprehensive evaluation of soil fertility in the hilly and mountainous region of southeastern China (In Chinese)[J]. Acta Pedologica Sinica, 1995, 32(4): 362-369. DOI:10.3321/j.issn:0564-3929.1995.04.002 [孙波, 张桃林, 赵其国. 我国东南丘陵山区土壤肥力的综合评价[J]. 土壤学报, 1995, 32(4): 362-369.]
(  0) 0) |
| [20] |
Luo Z, Li Z, Sun J, et al. Multiple mechanisms collectively mediate tungsten homeostasis and resistance in Citrobacter sp. Lzp2[J]. Journal of Hazardous Materials, 2023, 448: 130877. DOI:10.1016/j.jhazmat.2023.130877
(  0) 0) |
| [21] |
Zhou Y Q, Sun B Y, Xie B H, et al. Warming reshaped the microbial hierarchical interactions[J]. Global Change Biology, 2021, 27(24): 6331-6347. DOI:10.1111/gcb.15891
(  0) 0) |
| [22] |
Zhang D D, Sheng H, Xiao H C, et al. Assessment methods of soil health and their applications (In Chinese)[J]. Soils and Crops, 2023, 12(1): 109-116. [张丹丹, 盛浩, 肖华翠, 等. 土壤健康的评价方法及应用[J]. 土壤与作物, 2023, 12(1): 109-116.]
(  0) 0) |
| [23] |
Jiao S, Qi J J, Jin C J, et al. Core phylotypes enhance the resistance of soil microbiome to environmental changes to maintain multifunctionality in agricultural ecosystems[J]. Global Change Biology, 2022, 28(22): 6653-6664. DOI:10.1111/gcb.16387
(  0) 0) |
| [24] |
Jian J S, Du X, Stewart R D. A database for global soil health assessment[J]. Scientific Data, 2020, 7(1): 16. DOI:10.1038/s41597-020-0356-3
(  0) 0) |
| [25] |
Karlen D, Veum K S, Sudduth K A, et al. Soil health assessment: Past accomplishments, current activities, and future opportunities[J]. Soil & Tillage Research, 2019, 195: 104365.
(  0) 0) |
| [26] |
Vacheron J, Desbrosses G, Bouffaud M L, et al. Plant growth-promoting rhizobacteria and root system functioning[J]. Frontiers in Plant Science, 2013, 4: 356.
(  0) 0) |
| [27] |
Kang Y J, Cheng J, Mei L J, et al. Action mechanisms of soil plant growth-promoting rhizobacteria(PGPR): A review (In Chinese)[J]. Chinese Journal of Applied Ecology, 2010, 21(1): 232-238. DOI:10.13287/j.1001-9332.2010.0050 [康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌作用机制研究进展[J]. 应用生态学报, 2010, 21(1): 232-238.]
(  0) 0) |
| [28] |
Dierks J, Blaser-Hart W J, Gamper H A, et al. Mycorrhizal fungi-mediated uptake of tree-derived nitrogen by maize in smallholder farms[J]. Nature Sustainability, 2022, 5(1): 64-70.
(  0) 0) |
| [29] |
Wang G W, Jin Z X, George T S, et al. Arbuscular mycorrhizal fungi enhance plant phosphorus uptake through stimulating hyphosphere soil microbiome functional profiles for phosphorus turnover[J]. New Phytologist, 2023, 238(6): 2578-2593. DOI:10.1111/nph.18772
(  0) 0) |
| [30] |
Fan K K, Delgado-Baquerizo M, Guo X S, et al. Biodiversity of key-stone phylotypes determines crop production in a 4-decade fertilization experiment[J]. The ISME Journal, 2021, 15(2): 550-561. DOI:10.1038/s41396-020-00796-8
(  0) 0) |
| [31] |
Oliverio A M, Geisen S, Delgado-Baquerizo M, et al. The global-scale distributions of soil protists and their contributions to belowground systems[J]. Science Advances, 2020, 6(4): eaax8787. DOI:10.1126/sciadv.aax8787
(  0) 0) |
| [32] |
Chen B B, Xiong W, Qi J J, et al. Trophic interrelationships drive the biogeography of protistan community in agricultural ecosystems[J]. Soil Biology & Biochemistry, 2021, 163: 108445.
(  0) 0) |
| [33] |
Bardgett R D, van der Putten W H. Belowground biodiversity and ecosystem functioning[J]. Nature, 2014, 515(7528): 505-511. DOI:10.1038/nature13855
(  0) 0) |
| [34] |
de Vries F T, Liiri M E, Bjornlund L, et al. Land use alters the resistance and resilience of soil food webs to drought[J]. Nature Climate Change, 2012, 2(4): 276-280. DOI:10.1038/nclimate1368
(  0) 0) |
| [35] |
Wagg C, Schlaeppi K, Banerjee S, et al. Fungal-bacterial diversity and microbiome complexity predict ecosystem functioning[J]. Nature Communications, 2019, 10(1): 4841. DOI:10.1038/s41467-019-12798-y
(  0) 0) |
| [36] |
Guo S, Tao C Y, Jousset A, et al. Trophic interactions between predatory protists and pathogen-suppressive bacteria impact plant health[J]. The ISME Journal, 2022, 16(8): 1932-1943. DOI:10.1038/s41396-022-01244-5
(  0) 0) |
| [37] |
Zhou X, Wang J T, Liu F, et al. Cross-kingdom synthetic microbiota supports tomato suppression of fusarium wilt disease[J]. Nature Communications, 2022, 13(1): 7890. DOI:10.1038/s41467-022-35452-6
(  0) 0) |
| [38] |
Allsup C M, George I, Lankau R A. Shifting microbial communities can enhance tree tolerance to changing climates[J]. Science, 2023, 380(6647): 835-840. DOI:10.1126/science.adf2027
(  0) 0) |
| [39] |
Schmitz L, Yan Z C, Schneijderberg M, et al. Synthetic bacterial community derived from a desert rhizosphere confers salt stress resilience to tomato in the presence of a soil microbiome[J]. The ISME Journal, 2022, 16(8): 1907-1920. DOI:10.1038/s41396-022-01238-3
(  0) 0) |
| [40] |
Huang C Z, Xu L, Sun J J, et al. Allelochemical p-hydroxybenzoic acid inhibits root growth via regulating ROS accumulation in cucumber(Cucumis sativus L.)[J]. Journal of Integrative Agriculture, 2020, 19(2): 518-527. DOI:10.1016/S2095-3119(19)62781-4
(  0) 0) |
| [41] |
Chen F H, Shen N K, Jiang M G, et al. Research progress of autotoxic secretions in crops replant successive cropping obstacles[J]. Journal of Agricultural Science and Technology, 2022, 24(10): 125-132.
(  0) 0) |
| [42] |
Li C W, Chen G Z, Zhang J L, et al. The comprehensive changes in soil properties are continuous cropping obstacles associated with American ginseng(Panax quinquefolius)cultivation[J]. Scientific Reports, 2021, 11(1): 5068. DOI:10.1038/s41598-021-84436-x
(  0) 0) |
| [43] |
Ali A, Ghani M I, Ding H Y, et al. Garlic substrate induces cucumber growth development and decreases fusarium wilt through regulation of soil microbial community structure and diversity in replanted disturbed soil[J]. International Journal of Molecular Sciences, 2020, 21(17): 6008. DOI:10.3390/ijms21176008
(  0) 0) |
| [44] |
Mazzola M, Manici L M. Apple replant disease: Role of microbial ecology in cause and control[J]. Annual Review of Phytopathology, 2012, 50: 45-65. DOI:10.1146/annurev-phyto-081211-173005
(  0) 0) |
| [45] |
Zhao J, Zhang X D, Wang L C, et al. Detection and allelopathic effect of allelochemicals in the rhizosphere soil of continuously cropped Panax notoginseng(Burk.) (In Chinese)[J]. Chinese Journal of Microecology, 2018, 30(2): 146-154. DOI:10.13381/j.cnki.cjm.201802005 [赵静, 张晓东, 王连春, 等. 三七重茬根际土壤中化感物质的测定及其对三七根腐菌的生长作用[J]. 中国微生态学杂志, 2018, 30(2): 146-154.]
(  0) 0) |
| [46] |
Zhu B T, Jia X L, Hai X, et al. Screening and identification of p-hydroxybenzoic acid-degrading strain ZL22 from Wuyi tea continuous cropping soil[J]. Microbiology, 2022, 91(6): 727-734. DOI:10.1134/S0026261722100769
(  0) 0) |
| [47] |
Liu Y, Wang H, Qian X, et al. Metagenomics insights into responses of rhizobacteria and their alleviation role in licorice allelopathy[J]. Microbiome, 2023, 11(1): 109. DOI:10.1186/s40168-023-01511-3
(  0) 0) |
| [48] |
Khorram M S, Zhang G, Fatemi A, et al. Impact of biochar and compost amendment on soil quality, growth and yield of a replanted apple orchard in a 4-year field study[J]. Journal of the Science of Food and Agriculture, 2019, 99(4): 1862-1869. DOI:10.1002/jsfa.9380
(  0) 0) |
| [49] |
Zhang H Y, Yang W F. Effect of cucumbers and red peppers-rice rotation mode on continuous cropping obstacles (In Chinese)[J]. Journal of Guangxi Agriculture, 2017, 30(3): 9-13. DOI:10.3969/j.issn.1003-4374.2017.03.003 [张红叶, 杨文飞. 黄瓜、红辣椒-水稻轮作模式对连作障碍的影响[J]. 广西农学报, 2017, 30(3): 9-13.]
(  0) 0) |
| [50] |
Duan Y A, Zhao L, Jiang W T, et al. The phlorizin-degrading Bacillus licheniformis XNRB-3 mediates soil microorganisms to alleviate apple replant disease[J]. Frontiers in Microbiology, 2022, 13.
(  0) 0) |
| [51] |
Li Z F, Bai X L, Jiao S, et al. A simplified synthetic community rescues Astragalus mongholicus from root rot disease by activating plant-induced systemic resistance[J]. Microbiome, 2021, 9(1): 217. DOI:10.1186/s40168-021-01169-9
(  0) 0) |
| [52] |
Wang X F, Wei Z, Yang K M, et al. Phage combination therapies for bacterial wilt disease in tomato[J]. Nature Biotechnology, 2019, 37(12): 1513-1520. DOI:10.1038/s41587-019-0328-3
(  0) 0) |
| [53] |
Zimnicki T, Boring T, Evenson G, et al. On quantifying water quality benefits of healthy soils[J]. Bioscience, 2020, 70(4): 343-352. DOI:10.1093/biosci/biaa011
(  0) 0) |
| [54] |
Zuo X, Xu W, Wei S, et al. Aerobic denitrifying bacterial-fungal consortium mediating nitrate removal: Dynamics, network patterns and interactions[J]. iScience, 2023, 26(6): 106824. DOI:10.1016/j.isci.2023.106824
(  0) 0) |
| [55] |
Dai Z M, Liu G F, Chen H H, et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems[J]. The ISME Journal, 2020, 14(3): 757-770. DOI:10.1038/s41396-019-0567-9
(  0) 0) |
| [56] |
Chen Q L, Ding J, Zhu Y G, et al. Soil bacterial taxonomic diversity is critical to maintaining the plant productivity[J]. Environment International, 2020, 140: 105766. DOI:10.1016/j.envint.2020.105766
(  0) 0) |
| [57] |
Li G, Sun G X, Williams P N, et al. Inorganic arsenic in Chinese food and its cancer risk[J]. Environment International, 2011, 37(7): 1219-1225. DOI:10.1016/j.envint.2011.05.007
(  0) 0) |
| [58] |
Fu T Y, Gao X T, Wang L, et al. Research progress on microbial transformation and metabolic mechanism of heavy metals in contaminated soil (In Chinese)[J]. Hydrometallurgy of China, 2022, 41(4): 295-300. DOI:10.13355/j.cnki.sfyj.2022.04.003 [付田雨, 高小童, 王磊, 等. 污染土壤中重金属铅镉的微生物转化与代谢机制研究进展[J]. 湿法冶金, 2022, 41(4): 295-300.]
(  0) 0) |
| [59] |
Wang X, Xu Q, Hu K, et al. A coculture of enterobacter and comamonas species reduces cadmium accumulation in rice[J]. Molecular Plant-Microbe Interactions, 2023, 36(2): 95-108. DOI:10.1094/MPMI-09-22-0186-R
(  0) 0) |
| [60] |
Chen C, Li L Y, Huang K, et al. Sulfate-reducing bacteria and methanogens are involved in arsenic methylation and demethylation in paddy soils[J]. The ISME Journal, 2019, 13(10): 2523-2535. DOI:10.1038/s41396-019-0451-7
(  0) 0) |
| [61] |
Lamichhane S, Krishna K C B, Sarukkalige R. Polycyclic aromatic hydrocarbons(PAHs)removal by sorption: A review[J]. Chemosphere, 2016, 148: 336-353. DOI:10.1016/j.chemosphere.2016.01.036
(  0) 0) |
| [62] |
Gao S, Zhou G, Chang D, et al. Southern China can produce more high-quality rice with less N by green manuring[J]. Resources, Conservation and Recycling, 2023, 196: 107025. DOI:10.1016/j.resconrec.2023.107025
(  0) 0) |
| [63] |
Jansson J K, Hofmockel K S. Soil microbiomes and climate change[J]. Nature Reviews Microbiology, 2020, 18(1): 35-46. DOI:10.1038/s41579-019-0265-7
(  0) 0) |
| [64] |
Zheng D S, Yin G Y, Liu M, et al. Global biogeography and projection of soil antibiotic resistance genes[J]. Science Advances, 2022, 8(46): eabq8015. DOI:10.1126/sciadv.abq8015
(  0) 0) |
| [65] |
Zhu Y G, Zhao Y, Zhu D, et al. Soil biota, antimicrobial resistance and planetary health[J]. Environment International, 2019, 131: 105059. DOI:10.1016/j.envint.2019.105059
(  0) 0) |
| [66] |
Du S, Shen J P, Hu H W, et al. Large-scale patterns of soil antibiotic resistome in Chinese croplands[J]. Science of the Total Environment, 2020, 712: 136418. DOI:10.1016/j.scitotenv.2019.136418
(  0) 0) |
| [67] |
Dungan R S, Strausbaugh C A, Leytem A B. Survey of selected antibiotic resistance genes in agricultural and non-agricultural soils in south-central Idaho[J]. FEMS Microbiology Ecology, 2019, 95(6): fiz071. DOI:10.1093/femsec/fiz071
(  0) 0) |
| [68] |
Lemos L N, Pedrinho A, de Vasconcelos A T R, et al. Amazon deforestation enriches antibiotic resistance genes[J]. Soil Biology & Biochemistry, 2021, 153: 108110.
(  0) 0) |
| [69] |
Sun J T, Jin L, He T T, et al. Antibiotic resistance genes(ARGs)in agricultural soils from the Yangtze River Delta, China[J]. Science of the Total Environment, 2020, 740: 140001. DOI:10.1016/j.scitotenv.2020.140001
(  0) 0) |
| [70] |
Zhu D, Chen Q L, Ding J, et al. Antibiotic resistance genes in the soil ecosystem and planetary health: Progress and prospect (In Chinese)[J]. Science China: Life Sciences, 2019, 49(12): 1652-1663. [朱冬, 陈青林, 丁晶, 等. 土壤生态系统中抗生素抗性基因与星球健康: 进展与展望[J]. 中国科学: 生命科学, 2019, 49(12): 1652-1663.]
(  0) 0) |
| [71] |
Zhu D, Ding J, Wang Y F, et al. Effects of trophic level and land use on the variation of animal antibiotic resistome in the soil food web[J]. Environmental Science & Technology, 2022, 56(21): 14937-14947.
(  0) 0) |
| [72] |
LeGault K N, Hays S G, Angermeyer A, et al. Temporal shifts in antibiotic resistance elements govern phage-pathogen conflicts[J]. Science, 2021, 373(6554): eabg2166. DOI:10.1126/science.abg2166
(  0) 0) |
| [73] |
Jansson J K, Wu R N. Soil viral diversity, ecology and climate change[J]. Nature Reviews Microbiology, 2023, 21(5): 296-311. DOI:10.1038/s41579-022-00811-z
(  0) 0) |
| [74] |
Leslie H A, van Velzen M J M, Brandsma S H, et al. Discovery and quantification of plastic particle pollution in human blood[J]. Environment International, 2022, 163: 107199. DOI:10.1016/j.envint.2022.107199
(  0) 0) |
| [75] |
Liu L C, Xu M J, Ye Y H, et al. On the degradation of(micro)plastics: Degradation methods, influencing factors, environmental impacts[J]. Science of the Total Environment, 2022, 806: 151312. DOI:10.1016/j.scitotenv.2021.151312
(  0) 0) |
| [76] |
Lin T, Tang J, Li S, et al. Drought stress mediated differences in phyllosphere microbiome and associated pathogen resistance between male and female poplars[J]. The Plant Journal: for Cell and Molecular Biology, 2023, 115(4): 1100-1113. DOI:10.1111/tpj.16283
(  0) 0) |
| [77] |
Hartmann M, Six J. Soil structure and microbiome functions in agroecosystems[J]. Nature Reviews Earth & Environment, 2023, 4(1): 4-18.
(  0) 0) |
| [78] |
Zhou L G, Liu Y T, Zhang Y P, et al. Soil respiration after six years of continuous drought stress in the tropical rainforest in southwest China[J]. Soil Biology & Biochemistry, 2019, 138: 107564.
(  0) 0) |
| [79] |
Tao F, Huang Y, Hungate B A, et al. Microbial carbon use efficiency promotes global soil carbon storage[J]. Nature, 2023, 618(7967): 981-985. DOI:10.1038/s41586-023-06042-3
(  0) 0) |
| [80] |
Tong D, Wang Y, Yu H, et al. Viral lysing can alleviate microbial nutrient limitations and accumulate recalcitrant dissolved organic matter components in soil[J]. The ISME Journal, 2023, 17(8): 1247-1256. DOI:10.1038/s41396-023-01438-5
(  0) 0) |
| [81] |
Baldock J A, Beare M H, Curtin D, et al. Stocks, composition and vulnerability to loss of soil organic carbon predicted using mid-infrared spectroscopy[J]. Soil Research, 2018, 56(5): 468-480. DOI:10.1071/SR17221
(  0) 0) |
| [82] |
Garcia R A, Cabeza M, Rahbek C, et al. Multiple dimensions of climate change and their implications for biodiversity[J]. Science, 2014, 344(6183): 1247579-1247579. DOI:10.1126/science.1247579
(  0) 0) |
| [83] |
Trisos C H, Merow C, Pigot A L. The projected timing of abrupt ecological disruption from climate change[J]. Nature, 2020, 580(7804): 496-501. DOI:10.1038/s41586-020-2189-9
(  0) 0) |
| [84] |
Xu M, Li X L, Kuyper T W, et al. High microbial diversity stabilizes the responses of soil organic carbon decomposition to warming in the subsoil on the Tibetan Plateau[J]. Global Change Biology, 2021, 27(10): 2061-2075. DOI:10.1111/gcb.15553
(  0) 0) |
| [85] |
Canarini A, Schmidt H, Fuchslueger L, et al. Ecological memory of recurrent drought modifies soil processes via changes in soil microbial community[J]. Nature Communications, 2021, 12(1): 5308. DOI:10.1038/s41467-021-25675-4
(  0) 0) |
| [86] |
de Vries F T, Griffiths R I, Bailey M, et al. Soil bacterial networks are less stable under drought than fungal networks[J]. Nature Communications, 2018, 9(1): 3033. DOI:10.1038/s41467-018-05516-7
(  0) 0) |
| [87] |
Qi Q, Zhao J S, Tian R M, et al. Microbially enhanced methane uptake under warming enlarges ecosystem carbon sink in a Tibetan alpine grassland[J]. Global Change Biology, 2022, 28(23): 6906-6920. DOI:10.1111/gcb.16444
(  0) 0) |
| [88] |
Yuan M M, Guo X, Wu L W, et al. Climate warming enhances microbial network complexity and stability[J]. Nature Climate Change, 2021, 11(4): 343-348. DOI:10.1038/s41558-021-00989-9
(  0) 0) |
| [89] |
Dai Z M, Su W Q, Chen H H, et al. Long-term nitrogen fertilization decreases bacterial diversity and favors the growth of Actinobacteria and Proteobacteria in agro-ecosystems across the globe[J]. Global Change Biology, 2018, 24(8): 3452-3461. DOI:10.1111/gcb.14163
(  0) 0) |
| [90] |
Cherubin M R, Karlen D L, Franco A L C, et al. A soil management assessment framework(SMAF)evaluation of Brazilian sugarcane expansion on soil quality[J]. Soil Science Society of America Journal, 2016, 80(1): 215-226. DOI:10.2136/sssaj2015.09.0328
(  0) 0) |
| [91] |
van Es H M, Karlen D L. Reanalysis validates soil health indicator sensitivity and correlation with long-term crop yields[J]. Soil Science Society of America Journal, 2019, 83(3): 721-732. DOI:10.2136/sssaj2018.09.0338
(  0) 0) |
| [92] |
Lehmann J, Bossio D A, Kögel-Knabner I, et al. The concept and future prospects of soil health[J]. Nature Reviews Earth & Environment, 2020, 1(10): 544-553.
(  0) 0) |
| [93] |
Stewart R D, Jian J, Gyawali A J, et al. What we talk about when we talk about soil health[J]. Agricultural & Environmental Letters, 2018, 3(1): 180033.
(  0) 0) |
| [94] |
Banerjee S, Schlaeppi K, van der Heijden M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567-576. DOI:10.1038/s41579-018-0024-1
(  0) 0) |
| [95] |
Yang T, Siddique K H, Liu K. Cropping systems in agriculture and their impact on soil health-A review[J]. Global Ecology and Conservation, 2020, 23: e01118. DOI:10.1016/j.gecco.2020.e01118
(  0) 0) |
| [96] |
Nunes M R, Karlen D L, Veum K S, et al. Biological soil health indicators respond to tillage intensity: A US meta-analysis[J]. Geoderma, 2020, 369: 114335. DOI:10.1016/j.geoderma.2020.114335
(  0) 0) |
| [97] |
Liang W J, Dong Y H, Li Y B, et al. Biological characterization and regulation of soil health (In Chinese)[J]. Chinese Journal of Applied Ecology, 2021, 32(2): 719-728. [梁文举, 董元华, 李英滨, 等. 土壤健康的生物学表征与调控[J]. 应用土壤学报, 2021, 32(2): 719-728.]
(  0) 0) |
| [98] |
Verstraete M M, Scholes R J, Smith M S. Climate and desertification: Looking at an old problem through new lenses[J]. Frontiers in Ecology and the Environment, 2009, 7(8): 421-428. DOI:10.1890/080119
(  0) 0) |
| [99] |
Makhalanyane T P, Valverde A, Gunnigle E, et al. Microbial ecology of hot desert edaphic systems[J]. FEMS Microbiology Reviews, 2015, 39(2): 203-221. DOI:10.1093/femsre/fuu011
(  0) 0) |
| [100] |
Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21390-21395.
(  0) 0) |
| [101] |
Johnson R M, Ramond J B, Gunnigle E, et al. Namib desert edaphic bacterial, fungal and archaeal communities assemble through deterministic processes but are influenced by different abiotic parameters[J]. Extremophiles, 2017, 21(2): 381-392. DOI:10.1007/s00792-016-0911-1
(  0) 0) |
| [102] |
Neilson J W, Califf K, Cardona C, et al. Significant impacts of increasing aridity on the arid soil microbiome[J]. mSystems, 2017, 2(3): e00195-16.
(  0) 0) |
| [103] |
Preece C, Verbruggen E, Liu L, et al. Effects of past and current drought on the composition and diversity of soil microbial communities[J]. Soil Biology & Biochemistry, 2019, 131: 28-39.
(  0) 0) |
| [104] |
Llado S, Lopez-Mondejar R, Baldrian P. Forest soil bacteria: Diversity, involvement in ecosystem processes, and response to global change[J]. Microbiology and Molecular Biology Reviews, 2017, 81(2): e00063.
(  0) 0) |
| [105] |
Manzoni S, Schimel J P, Porporato A. Responses of soil microbial communities to water stress: Results from a meta-analysis[J]. Ecology, 2012, 93(4): 930-938. DOI:10.1890/11-0026.1
(  0) 0) |
| [106] |
Allison S D. Microbial drought resistance may destabilize soil carbon[J]. Trends in Microbiology, 2023, 31(8): 780-787. DOI:10.1016/j.tim.2023.03.002
(  0) 0) |
| [107] |
Chen Y L, Xu Z W, Xu T L, et al. Nitrogen deposition and precipitation induced phylogenetic clustering of arbuscular mycorrhizal fungal communities[J]. Soil Biology & Biochemistry, 2017, 115: 233-242.
(  0) 0) |
| [108] |
Hu W G, Ran J Z, Dong L W, et al. Aridity-driven shift in biodiversity-soil multifunctionality relationships[J]. Nature Communications, 2021, 12(1): 5350. DOI:10.1038/s41467-021-25641-0
(  0) 0) |
| [109] |
Delgado-Baquerizo M, Maestre F T, Gallardol A, et al. Decoupling of soil nutrient cycles as a function of aridity in global drylands[J]. Nature, 2013, 502(7473): 672-676. DOI:10.1038/nature12670
(  0) 0) |
| [110] |
de Vries F T, Williams A, Stringer F, et al. Changes in root-exudate-induced respiration reveal a novel mechanism through which drought affects ecosystem carbon cycling[J]. New Phytologist, 2019, 224(1): 132-145. DOI:10.1111/nph.16001
(  0) 0) |
| [111] |
Kelso M A, Wigginton R D, Grosholz E D. Nutrients mitigate the impacts of extreme drought on plant invasions[J]. Ecology, 2020, 101(4): e02980. DOI:10.1002/ecy.2980
(  0) 0) |
| [112] |
Chen Q L, Hu H W, Sun A Q, et al. Aridity decreases soil protistan network complexity and stability[J]. Soil Biology & Biochemistry, 2022, 166: 108575.
(  0) 0) |
| [113] |
Huang J P, Yu H P, Guan X D, et al. Accelerated dryland expansion under climate change[J]. Nature Climate Change, 2016, 6(2): 166-171. DOI:10.1038/nclimate2837
(  0) 0) |
| [114] |
Schlesinger W H, Reynolds J F, Cunningham G L, et al. Biological feedbacks in global desertification[J]. Science, 1990, 247(4946): 1043-1048. DOI:10.1126/science.247.4946.1043
(  0) 0) |
| [115] |
Wang Y G, Luo G P, Li C F, et al. Effects of land clearing for agriculture on soil organic carbon stocks in drylands: A meta-analysis[J]. Global Change Biology, 2023, 29(2): 547-562. DOI:10.1111/gcb.16481
(  0) 0) |
| [116] |
Karaca S, Dengiz O, Turan I D, et al. An assessment of pasture soils quality based on multi-indicator weighting approaches in semi-arid ecosystem[J]. Ecological Indicators, 2021, 121: 107001. DOI:10.1016/j.ecolind.2020.107001
(  0) 0) |
| [117] |
Eldridge D J, Delgado-Baquerizo M, Quero J L, et al. Surface indicators are correlated with soil multifunctionality in global drylands[J]. Journal of Applied Ecology, 2020, 57(2): 424-435. DOI:10.1111/1365-2664.13540
(  0) 0) |
| [118] |
Zhang X, Shen S W, Xue S Q, et al. Long-term tillage and cropping systems affect soil organic carbon components and mineralization in aggregates in semiarid regions[J]. Soil & Tillage Research, 2023, 231: 105742.
(  0) 0) |
| [119] |
Barberan A, McGuire K L, Wolf J A, et al. Relating belowground microbial composition to the taxonomic, phylogenetic, and functional trait distributions of trees in a tropical forest[J]. Ecology Letters, 2015, 18(12): 1397-1405. DOI:10.1111/ele.12536
(  0) 0) |
| [120] |
Delgado-Baquerizo M, Maestre F T, Reich P B, et al. Microbial diversity drives multifunctionality in terrestrial ecosystems[J]. Nature Communications, 2016, 7: 10541. DOI:10.1038/ncomms10541
(  0) 0) |
| [121] |
Delgado-Baquerizo M, Trivedi P, Trivedi C, et al. Microbial richness and composition independently drive soil multifunctionality[J]. Functional Ecology, 2017, 31(12): 2330-2343. DOI:10.1111/1365-2435.12924
(  0) 0) |
| [122] |
Saleem M, Hu J, Jousset A. More than the sum of its parts: Microbiome biodiversity as a driver of plant growth and soil health[J]. Annual Review of Ecology, Evolution, and Systematics, 2019, 50: 145-168. DOI:10.1146/annurev-ecolsys-110617-062605
(  0) 0) |
| [123] |
Silverstein M R, Segre D, Bhatnagar J M. Environmental microbiome engineering for the mitigation of climate change[J]. Global Change Biology, 2023, 29(8): 2050-2066. DOI:10.1111/gcb.16609
(  0) 0) |
| [124] |
Zheng Z C, Liu B Y, Fang X, et al. Dryland farm soil may fix atmospheric carbon through autotrophic microbial pathways[J]. Catena, 2022, 214: 106299. DOI:10.1016/j.catena.2022.106299
(  0) 0) |
| [125] |
Seneca J, Pjevac P, Canarini A, et al. Composition and activity of nitrifier communities in soil are unresponsive to elevated temperature and CO2, but strongly affected by drought[J]. The ISME Journal, 2020, 14(12): 3038-3053. DOI:10.1038/s41396-020-00735-7
(  0) 0) |
| [126] |
Qi M S, Berry J C, Veley K W, et al. Identification of beneficial and detrimental bacteria impacting sorghum responses to drought using multi-scale and multi-system microbiome comparisons[J]. The ISME Journal, 2022, 16(8): 1957-1969. DOI:10.1038/s41396-022-01245-4
(  0) 0) |
| [127] |
Jiao S, Peng Z H, Qi J J, et al. Linking bacterial-fungal relationships to microbial diversity and soil nutrient cycling[J]. mSystems, 2021, 6(2): e01052-20.
(  0) 0) |
| [128] |
Gonzalez R, Butkovic A, Escaray F J, et al. Plant virus evolution under strong drought conditions results in a transition from parasitism to mutualism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(6): e2020990118.
(  0) 0) |
| [129] |
Delgado-Baquerizo M, Eldridge D J, Ochoa V, et al. Soil microbial communities drive the resistance of ecosystem multifunctionality to global change in drylands across the globe[J]. Ecology Letters, 2017, 20(10): 1295-1305. DOI:10.1111/ele.12826
(  0) 0) |
| [130] |
Malik A A, Swenson T, Weihe C, et al. Drought and plant litter chemistry alter microbial gene expression and metabolite production[J]. The ISME Journal, 2020, 14(9): 2236-2247. DOI:10.1038/s41396-020-0683-6
(  0) 0) |
| [131] |
Wilhelm R C, Amsili J P, Kurtz K S M, et al. Correction: Ecological insights into soil health according to the genomic traits and environment-wide associations of bacteria in agricultural soils[J]. ISME Communications, 2023, 3(1): 35. DOI:10.1038/s43705-023-00236-6
(  0) 0) |
| [132] |
Jiao S, Xu Y Q, Zhang J, et al. Core microbiota in agricultural soils and their potential associations with nutrient cycling[J]. mSystems, 2019, 4(2): e00313-18.
(  0) 0) |
| [133] |
Zhang H Y, Bissett A, Aguilar-Trigueros C A, et al. Fungal genome size and composition reflect ecological strategies along soil fertility gradients[J]. Ecology Letters, 2023, 26(7): 1108-1118. DOI:10.1111/ele.14224
(  0) 0) |
| [134] |
Li H, Luo Q P, Zhao S, et al. Watershed urbanization enhances the enrichment of pathogenic bacteria and antibiotic resistance genes on microplastics in the water environment[J]. Environmental Pollution, 2022, 313: 120185. DOI:10.1016/j.envpol.2022.120185
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


