2. 湖北秭归三峡库区生态系统水利部野外科学观测研究站, 湖北宜昌 443605;
3. 中国科学院大学资源环境学院, 北京 100049
2. Zigui Three Gorges Reservoir Ecosystem, Observation and Research Station of Ministry of Water Resources of the People's Republic of China, Yichang, Hubei 443605, China;
3. College of Resource and Environment, University of Chinese Academy of Sciences, Beijing 100049, China
磷是作物生长必需的营养元素,直接影响作物生长发育和农业生产力[1]。稻田是磷肥的最大用户之一,然而,目前我国稻田磷肥当季利用率仅为10%~20%[2],一定程度上限制了我国水稻的高产高效发展。为提高水稻产量,提高磷肥施用量是有效措施之一,但是磷肥的过度施用会导致大量磷被固定在土壤或因地表径流、侵蚀或淋溶而损失[3-4],造成土壤板结和水体富营养化,危害生态系统健康和人居环境安全[5]。因此,探索一种能够拦截与捕获盈余磷的新理论新途径迫在眉睫。
周丛生物是附着在淹水基质表面的微生物与非生物物质的聚集体[6-7],由藻类、细菌、真菌、原生动物及后生动物等生物部分与胞外聚合物、生物碎屑、矿物质及营养物质等非生物部分集合而成[8]。研究表明,周丛生物在水生生态系统中发挥着重要作用[9]。周丛生物能在0℃至75℃的温度下旺盛生长[10],对提高水体的初级生产力产生了巨大的贡献,为一些水生生物提供了能量来源。与单一的微生物群落相比,周丛生物具有更为复杂的群落结构和良好的功能冗余性[11]。譬如,周丛生物可通过吸附、降解转化等机制去除面源污染中的Cd和Hg,平均去除效率可达79%(Cd)和66%(Hg)[12];周丛生物可以通过自身代谢降解吸附的有机物,从而达到改善生境、改善水质的目的,使得生物池生态系统恢复到健康状态[13]。
周丛生物广泛分布在土-水界面之间,附着生在土壤表面[14]。大量研究表明,周丛生物的存在可改变稻田土-水界面的理化性质与微环境,影响土-水界面之间的氮磷等养分循环与能量流动[15-17]。比如,Wu等[8]发现丝状藻类和细菌促进了多层结构微孔的形成,有利于磷的吸附和吸收;周丛生物中的微藻光合作用会引起水体pH升高,导致水相中磷沉淀[15];周丛生物可分泌黏液分解方解石,在周丛生物微表面形成晶体,增强对磷的吸附[8]。与此同时,气候、土壤理化性质、pH等环境因素也会影响微生物的群落组成[18-19],进而影响周丛生物群落组成。比如,细菌群落之间的系统发育距离与土壤pH和土壤质地显著相关[20];土壤细菌与古菌的分布差异与土壤pH和土壤碳氮比相关[21];湖水pH的不同导致了周丛生物藻类组成的差异[19]。按照“组成决定功能”的法则,不同的微生物群落组成决定了其功能状态,影响着氮磷等养分循环和利用效率。高浓度磷肥的施用会导致溶磷微生物的富集,从而加强土壤磷的周转[22];在强化生物除磷体系中,聚磷菌与藻类共存会显著提高其除磷能力[23],但过多的聚糖菌会与聚磷菌形成竞争关系,从而降低了其除磷效率;我们前期研究也发现,相比单独施用巨大芽孢杆菌,配施小球藻后能更大程度提高土壤磷的有效性[3]。
因此,为了解全国不同地区稻田周丛生物对磷元素循环的影响,本研究通过野外采样,分析了华南地区、长江中下游地区、东北地区这三个地区稻田周丛生物对磷的捕获量,同时借助高通量测序Illumina HisSeq 2500平台,揭示了这三个地区周丛生物群落组成、结构,探究了三个地区稻田周丛生物磷捕获差异的影响因子。这为进一步了解周丛生物对稻田磷迁移转化行为的影响,提高稻田生态系统中磷利用率和开发不同地区针对性的周丛生物磷捕获技术提供了理论参考。
1 材料与方法 1.1 样品采集与处理按照我国稻作区分类原则,在全国范围内选取22个稻田周丛生物采样点,覆盖华南地区(A)、长江中下游地区(B)、东北地区(C)三个水稻种植区(表 1)。每个采样点采集10份样品(为保证样品的代表性,在10 km2范围内随机选取10个位置,每个位置采集一份样品),包括田面水、周丛生物及表层土样。用取样瓶采取田面水100 mL,在同一区域用小刀刮取土壤表层周丛生物50 g,同时采集0~5 cm无周丛生物的表层土样100 g,装入塑封袋中置于便携冰箱中,运回实验室放置于–20℃冰箱保存备用。所有样品均在水稻移栽7~15 d后采集,此时水稻植株正处于分蘖期,稻田周丛生物生物量大且生长活性高。
|
|
表 1 不同地区稻田土壤理化性质 Table 1 The physical and chemical properties of paddy soils in the studied paddy regions |
将采集的周丛生物进行冷冻干燥(–56℃,48 h),土壤样品置于室内自然风干[24]。周丛生物及土壤总有机碳(TOC)和全氮(TN)使用C/N分析仪(FLASH 2000 NC Analyzer,Thermo Scientific)测定;全磷(TP)采用高氯酸-硫酸湿热消解及钼锑抗比色法测定;周丛生物多糖和蛋白质含量由氢氧化钠提取周丛生物胞外聚合物(Extracellular Polymeric Substances,EPS)后,分别用蒽酮比色法和考马斯亮蓝法测定;田面水pH使用pH计测定。
1.3 周丛生物高通量测序使用土壤DNA提取试剂盒(FastDNA™ SPIN Kit for Soil,MP Biomedicals)提取周丛生物DNA,并用1%的琼脂糖凝胶电泳检测DNA浓度与纯度。分别使用引物515F/907R(5’-GTGCCAGCMGCCG CGGTAA-3’)/(5’-CCGTCAATTCMTTTRAGTTT- 3’)和528F/706R(5’-GCGGTAATTCCAGCTCCAA- 3’)/(5’-AATCCRAGAATTTCACCTCT-3’)对周丛生物16S rRNA及18S rRNA进行PCR扩增,将PCR产物纯化后在Illumina HisSeq 2500平台进行高通量测序分析[25]。
1.4 数据分析利用Excel对数据进行初处理。采用SPSS 21.0软件对数据进行单因素方差分析,采用Tukey检验(P < 0.05)分析不同地区之间的差异。利用R 4.1.2、GraphPad、Origin进行数据可视化。使用R 4.1.2中的vegan包计算周从生物物种多样性及PCoA主坐标分析,利用psych包计算Person相关性。采用偏最小二乘路径模型(PLS-PM)探索土壤理化性质、周丛生物物种组成、胞外聚合物(Extracellular polymeric substances,EPS)与周丛生物富集磷之间的关系,其中路径系数和确定系数(R2)的估计由R 4.1.2和plspm包验证[26]。
2 结果 2.1 稻田土壤理化性质不同地区稻田土壤理化性质存在显著差异(表 1)。华南地区土壤TOC含量为17.78±0.92 g·kg–1,全氮含量为1.59±0.09 g·kg–1,全磷含量为0.69±0.04 g·kg–1,土壤田面水pH为6.17±0.12;长江中下游地区土壤TOC、全氮、全磷及土壤田面水pH分别为23.16±0.67 g·kg–1、2.23±0.06 g·kg–1、0.74±0.04 g·kg–1、7.05±0.04;东北地区土壤TOC、全氮、全磷及土壤田面水pH分别为20.8±1.06 g·kg–1、1.59±0.06 g·kg–1、0.7±0.01 g·kg–1、7.29±0.09。与其他两个地区相比,长江中下游地区土壤具有较高的TOC和全氮含量(P < 0.05),但三个地区土壤全磷含量差异不大。华南地区稻田田面水pH最低,呈现弱酸性,与其他两个地区存在显著差异(P < 0.05,表 1)。
2.2 周丛生物生物量及其磷含量和空间分布特征周丛生物主要由微生物与非生物物质(如蛋白、多糖、核酸等有机质)组成,因此,利用周丛生物TOC含量和ATP酶活表征周丛生物生物量。结果如图 1a所示,华南地区和长江中下游地区周丛生物TOC含量显著高于东北地区周丛生物TOC含量(20.78±0.75 g·kg–1,P=0.023);图 1b显示,华南地区和长江中下游地区周丛生物ATP酶活显著高于东北地区周丛生物ATP酶活(0.26±0.07 U·g–1,P < 0.05),表明华南地区和长江中下游地区周丛生物生物量高于东北地区。

|
注:A:华南地区;B:长江中下游地区;C:东北地区。下同。 Note: A: South China; B: Middle and lower reaches of the Yangtze River; C: Northeast China. The same below. 图 1 不同地区周丛生物TOC含量(a)及ATP酶活性(b) Fig. 1 TOC content(a)and ATP enzyme activity(b)in periphytic biofilms in different regions |
如图 1a所示,在华南地区,海南、台山等南部地区周丛生物TOC(TOC含量分别为41.11±3.30 g·kg–1、34.03±1.76 g·kg–1)显著高于福州、南平等北部地区(TOC含量分别为16.15±1.31 g·kg–1、22.99±1.83 g·kg–1,P < 0.05)。在长江中下游地区,周丛生物TOC沿长江由西向东呈现递增的趋势,芜湖、杭州等下游地区TOC含量显著高于南昌、荆州等上游地区(P < 0.05)。在东北地区,周丛生物TOC由南向北递增,齐齐哈尔地区周丛生物TOC(26.68±0.91 g·kg–1)显著高于丹东周丛生物TOC含量(15.55±0.52 g·kg–1)。
如图 1b所示,华南地区海南周丛生物ATP酶活显著高于南平地区(P < 0.05);长江中下游地区芜湖、杭州地区ATP酶活显著高于南昌、荆州地区(P < 0.05),这与周丛生物TOC含量分布情况一致;东北地区周丛生物ATP酶活最高为齐齐哈尔(0.31±0.07 U·g–1),显著高于其他地点周丛生物ATP酶活(P < 0.05,图 1)。
如图 2所示,周丛生物磷含量从南到北呈现递减的趋势(0.35±0.09 g·kg–1~2.24±0.33 g·kg–1)。华南地区周丛生物磷捕获含量最高(1.06±0.09 g·kg–1),显著高于(P < 0.001,F=13.632)长江中下游地区(0.81±0.03 g·kg–1)和东北地区(0.62±0.03 g·kg–1)。
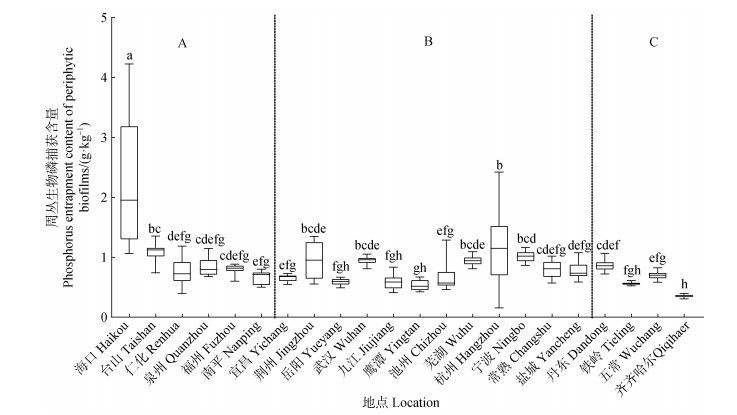
|
图 2 不同地区周丛生物磷捕获含量 Fig. 2 Phosphorus entrapment content of periphytic biofilms in different regions |
在华南地区和东北地区,周丛生物磷捕获含量沿采样点从南到北递减。华南地区最南部的海南采样点中稻田周丛生物磷捕获含量为2.24±0.33 g·kg–1,而最北部的南平采样点稻田周丛生物磷捕获含量为仅有0.66±0.03 g·kg–1;同样,处于东北地区最南部的丹东采样点稻田周丛生物磷捕获含量为0.87±0.03 g·kg–1,处于最北部的齐齐哈尔采样点稻田周丛生物磷捕获含量为0.35±0.01 g·kg–1,这与全国周丛生物磷含量分布情况一致。而在长江中下游地区,周丛生物磷捕获含量沿长江由西向东呈现递增的趋势,宜昌、岳阳、九江、鹰潭等地稻田周丛生物磷捕获含量分别为0.65±0.02 g·kg–1、0.59±0.02 g·kg–1、0.58±0.04 g·kg–1、0.53±0.03 g·kg–1,而相对处于下游的芜湖、杭州、宁波等地稻田周丛生物捕获磷含量分别0.94±0.03 g·kg–1、1.17±0.2 g·kg–1、1.01±0.03 g·kg–1,显著高于(P < 0.05)宜昌、岳阳、九江、鹰潭等地。
2.3 不同地区稻田周丛生物微生物群落组成在门分类水平,不同地区周丛生物微生物群落组成相似(图 3a、图 3c),原核微生物主要包括变形菌门(Proteobacteria,38.7%)、拟杆菌门(Bacteroidetes,13.2%)、绿弯菌门(Chloroflexi,12.2%)、酸杆菌门(Acidobacteria,9.2%)、厚壁菌门(Firmicutes,9.1%)、浮霉菌门(Planctomycetes,3.6%)、放线菌门(Actinobacteria,3.5%)等;真核微生物主要包括尾虫门(Cercozoa,9.8%)、纤毛虫(Ciliophora,9.3%)、隐真菌门(Cryptomycota,8.7%)、线虫动物门(Nematoda,8.7%)、子囊菌门(Ascomycota,5.9%)、节肢动物门(Arthropoda,5.8%)、顶复门(Apicomplexa,3.8%)等。但在属水平分类上,不同地区周丛生物微生物组成差异显著。如图 3b、图 3d所示,华南地区周丛生物原核微生物以Acinetobacter、Proteiniclasticum为优势物种,真核微生物以Gregarina、Adriamonas为优势物种;长江中下游地区周丛生物原核微生物主要以Bacillus、Cloacibacterium为主,真核微生物主要以Gregarina、Vermamoeba为主;在东北地区,周丛生物由以Flavisolibacter、Anaerolinea为优势的原核微生物和以Adriamonas、Vermamoeba为优势的真核微生物组成。
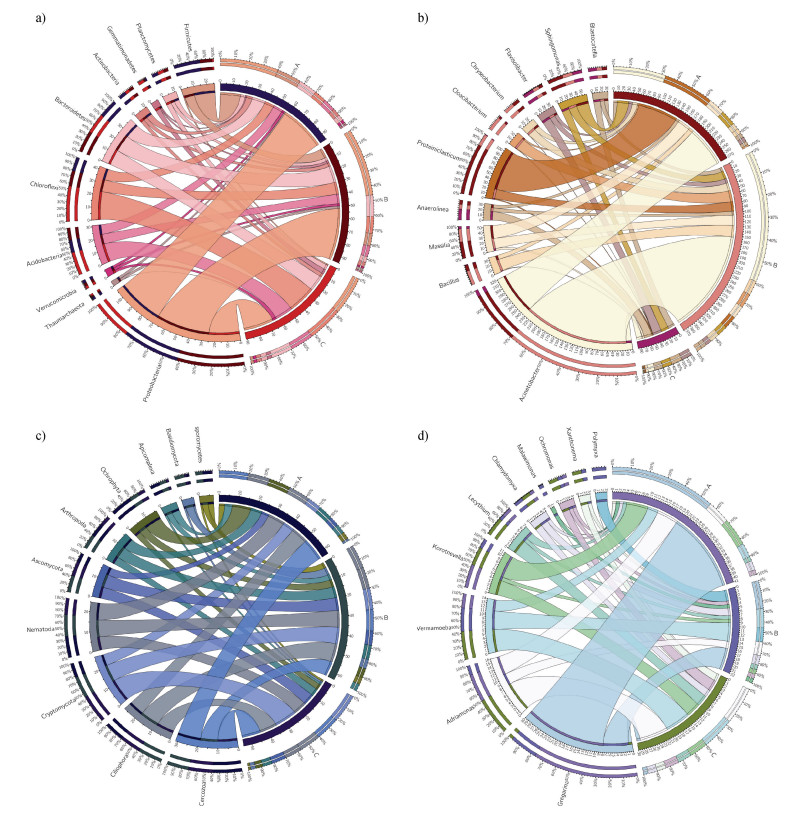
|
注:图(a)、(b)分别为原核生物门水平和属水平群落组成;图(c)、(d)分别为真核生物门水平和属水平群落组成。 Note: Figures(a)and(b)show the community composition at the prokaryotic phylum level and the genus level, respectively; Figures(c)and(d)are respectively the eukaryotic phylum level and the genus level community composition. 图 3 不同地区周丛生物微生物群落组成 Fig. 3 The composition of microbial communities of periphytic biofilms in different regions |
周丛生物群落的丰富度和多样性在不同区域内有所差异。Shannon指数反映物种群落的多样性,由图 4可知,东北地区周丛生物原核微生物与真核微生物的Shannon指数显著高于其他两个地区(P < 0.05),而华南地区和长江中下游地区周丛生物微生物的Shannon指数之间无显著性差异。Chao1指数反映物种丰富度,由图 4a所示,周丛生物原核微生物Chao1指数由南向北呈现递增的趋势,东北地区最高,并显著高于其他两个地区(P < 0.05)。
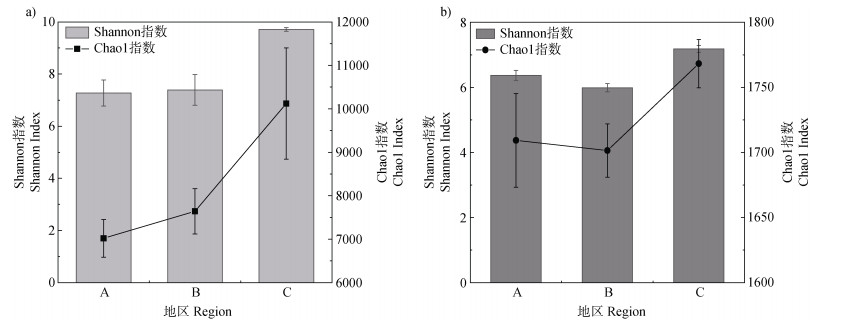
|
图 4 周丛生物原核微生物(a)与真核微生物(b)群落多样性和丰富度 Fig. 4 Diversity and abundance of the communities of prokaryotic microorganisms(a)and eukaryotic microorganisms(b)in periphytic biofilms |
为进一步探究不同地区稻田周丛生物微生物群落组成差异,利用主坐标分析(PCoA)对三个地区周丛生物群落的相似性进行二维分析,并用置换多元方差分析(PERMANOVA)对结果进行显著性统计。结果表明,三个地区周丛生物群落组成差异显著(P < 0.05,图 5)。如图 5a,华南地区与东北地区周丛生物原核微生物群落差异显著(P < 0.05),第一主成分(PC1)和第二主成分(PC2)分别可以解释所有变量的22.75%和11.74%;图 5b表示三个地区周丛生物真核微生物群落组成之间的差异,第一主成分(PC1)和第二主成分(PC2)分别可以解释所有变量的11.12%和8.26%。
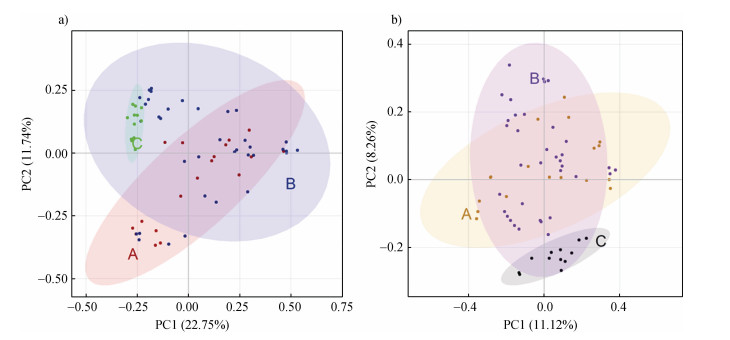
|
图 5 周丛生物微生物群落结构PCoA分析 Fig. 5 PCoA analysis of the microbial community structure of periphytic biofilms |
研究表明,周丛生物捕获磷含量与微藻与聚磷菌相关[14]。进一步分析稻田周丛生物微藻与聚磷菌的分布,结果表明,聚磷菌中相对丰度最高的是不动杆菌属(Acinetobacter),占所有聚磷菌相对丰度1/2以上,长江中下游地区该菌相对丰度最高,为73.2%(图 6a)。东北地区丛毛单胞菌属(Comamonas)和假单胞菌属(Pseudomonas)相对丰度显著高于其他两个地区。伯克氏菌属(Burkholderia)在华南地区相对丰度最高,约为其他地区的2倍。周丛生物藻类组成如图 6b所示,棕鞭藻属(Ochromonas)、鞘丝藻属(Leptolyngbya)、微囊藻属(Microcystis)是周丛生物中相对丰度最高的三个属,三者累计占微藻类1/2以上。其中,棕鞭藻属(Ochromonas)在东北地区相对丰度最高,达到41.7%。菱板藻属(Hantzschia)在长江中下游地区的相对丰度要显著高于其他两个地区。真眼点藻属(Eustigmatos)在华南地区相对丰度最高,约为长江中下游地区的3倍,东北地区的15倍。
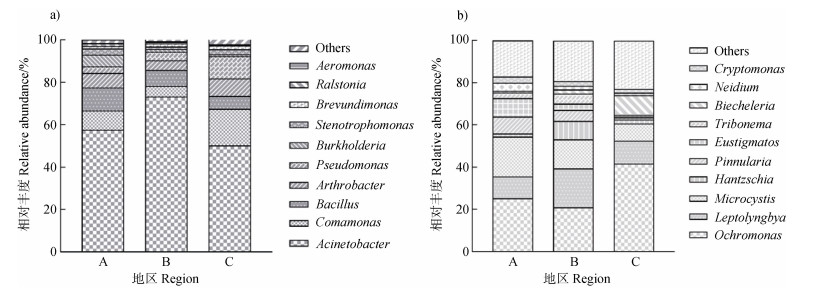
|
图 6 华南地区(A)、长江中下游地区(B)、东北地区(C)周丛生物聚磷菌(a)和微藻(b)群落组成 Fig. 6 The community composition of PAOs(a)and microalgae(b)of periphytic biofilms in South China(A), the middle and lower reaches of the Yangtze River(B)and Northeast China(C) |
如表 2所示,华南地区土壤TOC和田面水pH与周丛生物群落多样性呈现显著负相关,但田面水pH对聚磷菌和微藻的多样性有正向作用;在长江中下游地区,土壤田面水pH对周丛生物群落有正向影响,特别是对微藻多样性正向影响较为显著;在东北地区,土壤田面水pH对周丛生物群落有正向作用,但并不显著,而土壤TOC与真核微生物多样性呈现显著正相关。
|
|
表 2 土壤理化性质与周丛生物群落多样性的皮尔森相关性 Table 2 Pearson's correlation coefficients for soil chemical properties and periphytic biofilms microbial diversity |
胞外聚合物(EPS)中蛋白含量占比较大,利用线性回归分析不同地区聚磷菌(Polyphosphate accumulating organisms,PAOs)及微藻多样性和EPS蛋白含量对周丛生物磷捕获能力的影响。如图 7所示,在华南地区周丛生物中聚磷菌的多样性与其磷捕获量呈现弱负相关,而随着微藻多样性和EPS蛋白含量的增加,周丛生物磷捕获含量也增加;长江中下游地区,EPS蛋白、聚磷菌和微藻的多样性与周丛生物磷捕获量相关性不明显;东北地区,聚磷菌多样性和EPS蛋白与周丛生物捕获磷能力具有正相关,微藻多样性与其捕获磷能力呈现弱负相关。

|
注:聚磷菌与微藻多样性利用其Shannon指数表示,EPS指标采用其蛋白含量表征。 Note: The diversity of PAOs and microalgae are expressed by their Shannon index, the EPS index is characterized by their protein content. 图 7 聚磷菌多样性、微藻多样性、EPS与周丛生物磷捕获量的回归分析 Fig. 7 Regression analysis of PAOs diversity, microalga diversity and EPS content to phosphorus entrapment content of periphytic biofilms |
环境因子、微生物群落组成、胞外聚合物等因素均可直接或间接影响周丛生物磷捕获能力。因此,为探究不同地区周丛生物捕获磷能力,将土壤、稻田田面水、聚磷菌与微藻的多样性、周丛生物胞外聚合物作为影响因子,利用偏最小二乘路径模型(PLS-PM)分析评估这五个因子对周丛生物富集磷能力直接或间接的影响。
如图 8所示,在华南地区(模型拟合度GOF= 0.525,模型可靠[27]),微藻和胞外聚合物对周丛生物捕获磷能力具有较强的直接正效应,其影响周丛生物富集磷的路径系数分别为0.261和0.155,而聚磷菌对周丛生物富集磷具有负影响作用,其路径系数为–0.248。土壤和稻田田面水通过影响聚磷菌与微藻的群落组成而间接地影响周丛生物富集磷能力。总体而言,土壤因子促进了华南地区周丛生物磷的富集,而稻田田面水抑制了周丛生物磷的富集。在长江中下游地区(GOF=0.434,模型可靠),胞外聚合物是周丛生物富集磷能力的最直接正向驱动因素,其路径系数为0.134。而在此地区,聚磷菌和微藻影响周丛生物磷富集的路径系数分别为–0.257和–0.221,影响效应为负。土壤和稻田田面水影响周丛生物磷富集的间接路径系数分别为–0.069和0.072(表 3)。在气候较为严寒的东北地区(GOF=0.384,模型可靠),聚磷菌和胞外聚合物是影响该地区周丛生物富集磷能力的最直接正向效应。与华南地区相反,东北地区的微藻对周丛生物磷富集能力影响为负。土壤因子通过间接途径对周丛生物富集磷能力产生负影响,其间接路径系数为–0.038,而稻田田面水间接促进了周丛生物磷的富集。
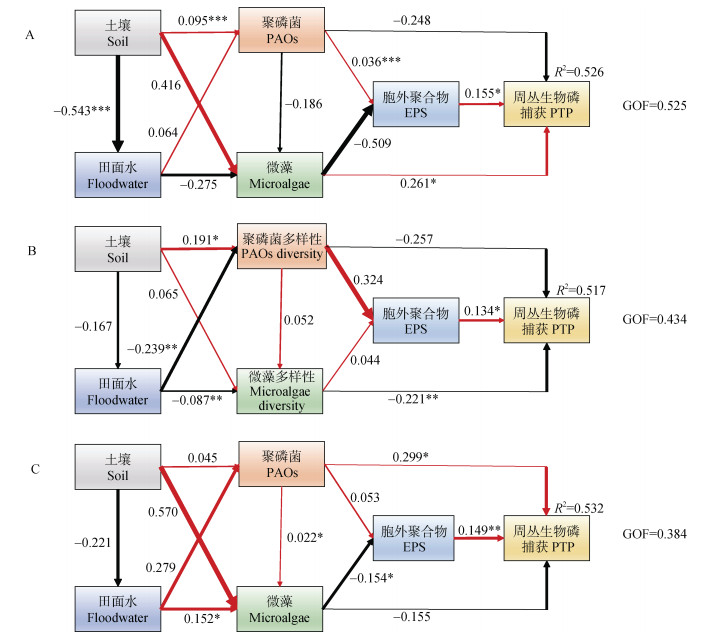
|
注:土壤指标以土壤TOC表征[28],田面水指标以田面水pH表征,聚磷菌及微藻指标分别以其多样性Shannon指数表征,EPS指标以其蛋白含量表征。红线表示正向效应,黑线表示负向效应,线条宽度表示直接效应强度,线条越宽直接效应越强。线上数字为直接效应路径系数。R2为周丛生物磷捕获(PTP)决定系数,GOF为模型拟合度。*P < 0.05,**P < 0.01,***P < 0.001。 Note: The soil index is characterized by soil total organic carbon[28], the floodwater index is characterized by the pH of the floodwater, the phosphorus accumulating bacteria and microalgae are characterized by their diversity Shannon index, and the EPS index is characterized by their protein content. The red line represents the positive effect, the black line represents the negative effect, the width of the line represents the strength of the direct effect, and the wider the line, the stronger the direct effect. The numbers on the line are the path coefficients of direct effect. R2 is the phosphorus entrapment content of periphytic biofilms. GOF is the model fit. *P < 0.05, **P < 0.01;***P < 0.001. 图 8 稻田周丛生物磷捕获含量影响因素的偏最小二乘路径模型分析 Fig. 8 Partial Least Squares Path Model(PLS-PM)analysis of factors affecting phosphorus entrapment content of paddy periphytic biofilms |
|
|
表 3 PLS-PM模型路径直接效应、间接效应及总效应 Table 3 Direct effect, indirect effect and the total effect of the PLS-PM model |
本研究通过高通量测序分析,探究了不同地区稻田周丛生物群落结构组成。以往研究证明,pH和土壤TOC是影响土壤微生物群落组成的重要因素[29-30]。三个地区稻田土壤田面水pH与土壤TOC存在差异,这可能也是导致附着在土水界面周丛生物群落组成差异的重要因素。刘有华等[31]发现聚磷菌P6-1在pH 6.7的条件下生长情况与除磷效果最佳;徐烨等[32]研究证明了聚磷菌JPA1菌株最适扩增培养pH为6.5。华南地区稻田土壤田面水pH值偏低,这可能促进了耐酸性聚磷菌的生长,从而导致此地区周丛生物聚磷菌群落多样性的增加,继而影响周丛生物捕获磷能力。但目前已知的绝大数细菌均适宜在中性环境(pH 7.0)中生存,这可能是导致华南地区周丛生物群落多样性较低的原因。土壤TOC是周丛生物群落组成及其多样性变化的核心因素[28]。土壤TOC能为细菌代谢提供必需的能量,并限制有机磷的矿化[33];有机碳的供应还会引发藻类多样性的改变,尤其是对绿藻多样性有显著正相关,与周丛生物EPS含量也呈显著相关性[28]。因此,可以认为,三个地区土壤TOC的差异引起了其周丛生物细菌和藻类群落的组成差异。
3.2 不同地区影响周丛生物磷捕获能力的因素存在差异聚磷菌(PAOs)能通过吸收周围环境中多余的磷[34],将磷转化为自身结构和功能大分子或储能材料,从而达到吸附磷的目的。在有氧气存在时,聚磷菌细胞内聚羟基链烷酸酯(Poly-hydroxyalkanoate,PHA)裂解酶基因被激活,合成PHA裂解酶,储存在细胞内的PHA被代谢并释放能量,同时利用从外界水环境中吸收的磷酸盐合成多聚磷酸盐(Polyphosphate,Poly-p)[35]。在东北地区,聚磷菌群落的多样性与周丛生物磷捕获能力存在一定的正相关,因此可以推测聚磷菌吸收稻田中多余的磷元素是周丛生物富集磷的可能原因之一。
藻类能够有效地将营养元素(包括磷)从城市污水转移到藻类生物质[36];微藻可以诱导磷酸酶吸收外界的有机磷,也会合成高亲和力的无机磷转运蛋白来辅助无机磷的吸收[37];在无机磷过量的情况下,微藻可以吸收过量的磷并以不溶性多磷酸的形式沉积,用于在无机磷缺乏时的细胞代谢[38-39]。在华南地区,微藻群落的多样性影响周丛生物磷捕获能力的路径系数为0.261,呈现一定的正相关,因此可以认为,相较于聚磷菌,华南地区周丛生物中微藻群落多样性可能是磷富集的驱动因素之一。
胞外聚合物(EPS)是由细菌、微藻等分泌的脂质、蛋白质、核酸及多糖[40]等,混合外界环境有机物而组成的化合物。根据我们前期研究发现,EPS是周丛生物重要的磷储存库[41-42],占周丛生物总磷含量的约50%。EPS中蛋白质上常见的官能团,如带正电荷的季胺(NH4+)和叔胺(NH3+),这些官能团能与带负电荷的磷酸盐结合,从而达到捕获磷的效果[42]。EPS中也有带负电荷的官能团[17](如羧基、磷酰基、巯基、酚基和羟基),这些可以与金属阳离子(如Mg2+、Al3+、Ca2+、Fe3+、Fe2+、Mn2+)结合并在EPS中形成矿物沉淀[42],而矿物与磷酸盐可以形成磷酸盐矿物沉淀(如羟基磷灰石和鸟粪石)。前期团队试验验证EPS是周丛生物捕获磷的重要因素之一,根据回归及PLS-PM分析显示EPS含量与周丛生物磷捕获量呈微弱的正相关关系,这可能是由于稻田中调查的其他土水影响因子作为磷捕获的主导因素,而且不同地理环境条件下周丛生物的EPS组分和性质差异很大,具体原因有待后续进一步深入验证。
4 结论我国主要稻区周丛生物微生物群落组成和结构差异明显,显著受到土壤理化性质的影响,尤其是土壤TOC和田面水pH与周丛生物微生物群落多样性呈现明显的相关性。不同的微生物群落组成也导致了周丛生物对磷捕获能力的差异,在全国范围内周丛生物磷的捕获能力由南到北呈现递减趋势。根据回归分析及PLS-PM结果显示,华南地区微藻与周丛生物磷捕获可能存在一定的正相关关系,长江中下游地区微藻、聚磷菌和EPS含量与周丛生物磷捕获量均无显著的相关性,在东北地区周丛生物EPS和聚磷菌可能对磷的捕获起到一定的作用。研究结果揭示了不同稻区周丛生物磷捕获能力的差异及其影响因素,可为稻田磷肥高效利用、微生物磷捕获技术开发和可持续农业生态管理模式的发展提供理论基础。
| [1] |
Tarayre C, Nguyen H T, Brognaux A, et al. Characterisation of phosphate accumulating organisms and techniques for polyphosphate detection: A review[J]. Sensors: Basel, Switzerland, 2016, 16(6): 797. DOI:10.3390/s16060797
(  0) 0) |
| [2] |
Wu Y H, Liu J Z, Rene E R. Periphytic biofilms: A promising nutrient utilization regulator in wetlands[J]. Bioresource Technology, 2018, 248: 44-48. DOI:10.1016/j.biortech.2017.07.081
(  0) 0) |
| [3] |
Zhang H J, Liu J Z, Wu Y H. Effects of combined application of algae and bacteria on paddy soil phosphorus availability and microbial community (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(5): 1369-1377. [张慧洁, 刘俊琢, 吴永红. 藻、菌配合施用对水稻土磷有效性及微生物群落的影响[J]. 土壤学报, 2022, 59(5): 1369-1377.]
(  0) 0) |
| [4] |
Peñuelas J, Poulter B, Sardans J, et al. Human-induced nitrogen–phosphorus imbalances alter natural and managed ecosystems across the globe[J]. Nature Communications, 2013, 4: 2934. DOI:10.1038/ncomms3934
(  0) 0) |
| [5] |
Ma F F, Xing S L, Xu Y L, et al. Effects of fertilization on nitrogen and phosphorus loss in paddy field (In Chinese)[J]. China Rice, 2018, 24(2): 14-18. DOI:10.3969/j.issn.1006-8082.2018.02.005 [马凡凡, 邢素林, 徐云连, 等. 肥料施用对稻田氮磷流失的影响[J]. 中国稻米, 2018, 24(2): 14-18.]
(  0) 0) |
| [6] |
Sun R, Sun P F, Wu Y H. Effects of paddy periphyton biofilms on rice germination and seedling growth relative to paddy ecosystems (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 231-241. [孙瑞, 孙朋飞, 吴永红. 不同稻田生态系统周丛生物对水稻种子萌发和幼苗生长的影响[J]. 土壤学报, 2022, 59(1): 231-241.]
(  0) 0) |
| [7] |
Gao M N, Xu Y, Wu Y H. Design of highly phosphorus- enriched periphytic biofilm and its characteristics (In Chinese)[J]. Journal of Agro-Environment Science, 2021, 40(9): 1982-1989. [高孟宁, 徐滢, 吴永红. 高效富集磷的周丛生物构建及其特征分析[J]. 农业环境科学学报, 2021, 40(9): 1982-1989.]
(  0) 0) |
| [8] |
Wu Y H, Liu J Z, Lu H Y, et al. Periphyton: an important regulator in optimizing soil phosphorus bioavailability in paddy fields[J]. Environmental Science and Pollution Research International, 2016, 23(21): 21377-21384. DOI:10.1007/s11356-016-7363-0
(  0) 0) |
| [9] |
Lu H Y, Wan J J, Li J Y, et al. Periphytic biofilm: A buffer for phosphorus precipitation and release between sediments and water[J]. Chemosphere, 2016, 144: 2058-2064. DOI:10.1016/j.chemosphere.2015.10.129
(  0) 0) |
| [10] |
DeNicola D M. Periphyton responses to temperature at different ecological levels[M]//Stevenson R J, Bothwell M L, Lowe R L. Algal Ecology: Freshwater Benthic Ecosystems. Pittsburgh, United States: Academic Press, 1996: 149—181.
(  0) 0) |
| [11] |
Liu J Z, Tang J, Wan J J, et al. Functional sustainability of periphytic biofilms in organic matter and Cu2+ removal during prolonged exposure to TiO2 nanoparticles[J]. Journal of Hazardous Materials, 2019, 370: 4-12. DOI:10.1016/j.jhazmat.2017.08.068
(  0) 0) |
| [12] |
Yan R, Yang F, Wu Y H, et al. Cadmium and mercury removal from non-point source wastewater by a hybrid bioreactor[J]. Bioresource Technology, 2011, 102(21): 9927-9932. DOI:10.1016/j.biortech.2011.08.049
(  0) 0) |
| [13] |
Wu Y H, Kerr P G, Hu Z Y, et al. Removal of cyanobacterial bloom from a biopond-wetland system and the associated response of zoobenthic diversity[J]. Bioresource Technology, 2010, 101(11): 3903-3908. DOI:10.1016/j.biortech.2009.12.144
(  0) 0) |
| [14] |
Wu Y H. Periphyton: Functions and application in environmental remediation . Amsterdam: Elsevier, 2017.
(  0) 0) |
| [15] |
Liu J Z, Danneels B, Vanormelingen P, et al. Nutrient removal from horticultural wastewater by benthic filamentous algae Klebsormidium sp., Stigeoclonium spp. and their communities: From laboratory flask to outdoor Algal Turf Scrubber(ATS)[J]. Water Research, 2016, 92: 61-68. DOI:10.1016/j.watres.2016.01.049
(  0) 0) |
| [16] |
Lu H Y, Feng Y F, Shao H B, et al. Periphyton-induced changes in the phosphorus sorption characteristics of a paddy soil from coastal mudflat reclamation[J]. Land Degradation & Development, 2018, 29(11): 4209-4218.
(  0) 0) |
| [17] |
Sun P F, Zhang J H, Esquivel-Elizondo S, et al. Uncovering the flocculating potential of extracellular polymeric substances produced by periphytic biofilms[J]. Bioresource Technology, 2018, 248: 56-60. DOI:10.1016/j.biortech.2017.06.103
(  0) 0) |
| [18] |
Kang B T, Hou F J, Bowatte S. Characterization of soil bacterial communities in alpine and desert grasslands in the Qilian Mountain range (In Chinese)[J]. Pratacultural Science, 2020, 37(1): 10-19. [康宝天, 侯扶江, Saman Bowatte. 祁连山高寒草甸和荒漠草原土壤细菌群落的结构特征[J]. 草业科学, 2020, 37(1): 10-19.]
(  0) 0) |
| [19] |
Li H J, Zhang N, Li W. Research progress about effect of environmental factors on periphyton (In Chinese)[J]. Journal of Xinyang Normal University: Natural Science Edition, 2013, 26(2): 245-249. [李红敬, 张娜, 李伟. 环境因子对周丛生物的影响研究进展[J]. 信阳师范学院学报: 自然科学版, 2013, 26(2): 245-249.]
(  0) 0) |
| [20] |
Lauber C L, Strickland M S, Bradford M A, et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology & Biochemistry, 2008, 40(9): 2407-2415.
(  0) 0) |
| [21] |
Nielsen U N, Osler G H R, Campbell C D, et al. The influence of vegetation type, soil properties and precipitation on the composition of soil mite and microbial communities at the landscape scale[J]. Journal of Biogeography, 2010, 37(7): 1317-1328. DOI:10.1111/j.1365-2699.2010.02281.x
(  0) 0) |
| [22] |
Li H Z, Bi Q F, Yang K, et al. High starter phosphorus fertilization facilitates soil phosphorus turnover by promoting microbial functional interaction in an arable soil[J]. Journal of Environmental Sciences, 2020, 94: 179-185. DOI:10.1016/j.jes.2020.03.040
(  0) 0) |
| [23] |
Meng F S, Huang W W, Liu D F, et al. Application of aerobic granules-continuous flow reactor for saline wastewater treatment: Granular stability, lipid production and symbiotic relationship between bacteria and algae[J]. Bioresource Technology, 2020, 295: 122291. DOI:10.1016/j.biortech.2019.122291
(  0) 0) |
| [24] |
Lu L, Tang K Z, Wu C, et al. Influence of air drying and freeze drying on cadmium fractions in paddy soils (In Chinese)[J]. Journal of Agro-Environment Science, 2022, 41(7): 1433-1441. [卢兰, 唐开钊, 吴聪, 等. 风干和冻干对稻田土壤镉形态分析的影响[J]. 农业环境科学学报, 2022, 41(7): 1433-1441.]
(  0) 0) |
| [25] |
Huang W, Gong B Z, Wang Y M, et al. Metagenomic analysis reveals enhanced nutrients removal from low C/N municipal wastewater in a pilot-scale modified AAO system coupling electrolysis[J]. Water Research, 2020, 173: 115530. DOI:10.1016/j.watres.2020.115530
(  0) 0) |
| [26] |
Tenenhaus M, Vinzi V E, Chatelin Y M, et al. PLS path modeling[J]. Computational Statistics & Data Analysis, 2005, 48(1): 159-205.
(  0) 0) |
| [27] |
Henseler J, Sarstedt M. Goodness-of-fit indices for partial least squares path modeling[J]. Computational Statistics, 2013, 28(2): 565-580. DOI:10.1007/s00180-012-0317-1
(  0) 0) |
| [28] |
Liu J Z, Sun P F, Sun R, et al. Carbon-nutrient stoichiometry drives phosphorus immobilization in phototrophic biofilms at the soil-water interface in paddy fields[J]. Water Research, 2019, 167: 115129. DOI:10.1016/j.watres.2019.115129
(  0) 0) |
| [29] |
Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626-631.
(  0) 0) |
| [30] |
Demoling F, Ola Nilsson L, Bååth E. Bacterial and fungal response to nitrogen fertilization in three coniferous forest soils[J]. Soil Biology & Biochemistry, 2008, 40(2): 370-379.
(  0) 0) |
| [31] |
Liu Y H, Wang Q N, Pi Q M, et al. Optimization of phosphorus removal conditions by phosphorus- accumulating bacteria P6-1 by response surface methodology (In Chinese)[J]. Journal of Jiangsu Ocean University: Natural Science Edition, 2020, 29(3): 13-18. [刘有华, 王倩楠, 皮乔木, 等. 响应面法优化聚磷菌P6-1除磷条件研究[J]. 江苏海洋大学学报: 自然科学版, 2020, 29(3): 13-18.]
(  0) 0) |
| [32] |
Xu Y, Huang Z H, Guo H F. Growth characteristics of phosphorus accumulating organism JPA1 strain and optimization of phosphorus accumulation condition (In Chinese)[J]. Chinese Journal of Bioprocess Engineering, 2012, 10(2): 29-33. [徐烨, 黄志华, 郭洪芳. 聚磷菌JPA1菌株的生长特性和聚磷条件的优化[J]. 生物加工过程, 2012, 10(2): 29-33.]
(  0) 0) |
| [33] |
Heuck C, Weig A, Spohn M. Soil microbial biomass C: N: P stoichiometry and microbial use of organic phosphorus[J]. Soil Biology & Biochemistry, 2015, 85: 119-129.
(  0) 0) |
| [34] |
Wu G P, Gao M N, Tang J, et al. Progress of researches on nitrogen and phosphorus removal by periphytic biofilm from non-point source wastewater (In Chinese)[J]. Journal of Ecology and Rural Environment, 2019, 35(7): 817-825. [吴国平, 高孟宁, 唐骏, 等. 自然生物膜对面源污水中氮磷去除的研究进展[J]. 生态与农村环境学报, 2019, 35(7): 817-825.]
(  0) 0) |
| [35] |
Meng Q G, Zeng W, Wang B G, et al. New insights in the competition of polyphosphate-accumulating organisms and glycogen-accumulating organisms under glycogen accumulating metabolism with trace Poly-P using flow cytometry[J]. Chemical Engineering Journal, 2020, 385: 123915.
(  0) 0) |
| [36] |
Mao Y L, Xiong R W, Gao X F, et al. Analysis of the status and improvement of microalgal phosphorus removal from municipal wastewater[J]. Processes, 2021, 9(9): 1486.
(  0) 0) |
| [37] |
Donald K M, Scanlan D J, Carr N G, et al. Comparative phosphorus nutrition of the marine cyanobacterium Synechococcus WH7803 and the marine diatom Thalassiosira weissflogii[J]. Journal of Plankton Research, 1997, 19(12): 1793-1813.
(  0) 0) |
| [38] |
Whitton R, Ometto F, Pidou M, et al. Microalgae for municipal wastewater nutrient remediation: Mechanisms, reactors and outlook for tertiary treatment[J]. Environmental Technology Reviews, 2015, 4(1): 133-148.
(  0) 0) |
| [39] |
Voronkov A, Sinetova M. Polyphosphate accumulation dynamics in a population of Synechocystis sp. PCC 6803 cells under phosphate overplus[J]. Protoplasma, 2019, 256(4): 1153-1164.
(  0) 0) |
| [40] |
Ajao V, Nam K, Chatzopoulos P, et al. Regeneration and reuse of microbial extracellular polymers immobilised on a bed column for heavy metal recovery[J]. Water Research, 2020, 171: 115472.
(  0) 0) |
| [41] |
Xu Y, Curtis T, Dolfing J, et al. N-acyl-homoserine- lactones signaling as a critical control point for phosphorus entrapment by multi-species microbial aggregates[J]. Water Research, 2021, 204: 117627.
(  0) 0) |
| [42] |
Xu Y, Wu Y H, Esquivel-Elizondo S, et al. Using microbial aggregates to entrap aqueous phosphorus[J]. Trends in Biotechnology, 2020, 38(11): 1292-1303.
(  0) 0) |
 2023, Vol. 60
2023, Vol. 60


