2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
铁是植物生长发育所必需的微量营养元素,参与各种生理、生化和代谢过程,也是许多功能蛋白的辅助因子[1]。尽管矿质土壤中铁含量丰富,但是在温带或旱地生产地区的高pH土壤中,铁以氧化物或氢氧化物形式存在,难以被植物吸收利用。在灌溉排水、水旱交替耕作下,稻田土壤形成了不同于一般旱地的土壤类型,称为水稻土。水稻土中氧化还原电位较低,在厌氧条件下,三价铁被还原为易被植物吸收利用的亚铁,亚铁离子被植物根系快速吸收[2]。细胞内铁浓度过高会因为活性氧的大量产生而引起毒性,影响细胞结构成分和生理过程。不同种植区的水稻在不同的发育阶段可能面临不同的铁营养条件,这使得缺铁和高铁胁迫均成为影响水稻产量和品质的限制因子。缺铁胁迫时,水稻株系变矮,光合作用受到抑制,叶片失绿,根系构型发生变化[3]。铁过量容易诱发叶片褐斑。高铁胁迫下,游离态的铁通过芬顿(Fenton)反应形成活性氧催化氧化应激,增强了光合系统中光系统II对光抑制的敏感性,导致光合速率降低[4]。铁稳态失衡会导致水稻的代谢系统紊乱,抑制植物的生长,最终使作物产量和品质降低。
在长期的进化过程中,水稻已演化出一系列调控策略来增强其对铁胁迫的耐受性。目前已有大量研究报道了水稻铁吸收利用的生理机制,一些学者也对水稻响应缺铁和高铁胁迫的适应机制及其参与调控铁胁迫的关键基因进行了研究[5]。缺铁胁迫下,水稻采用两种铁吸收机制,还原机理(机理I)和螯合机理(机理II)。水稻一方面采用机理I通过根表皮细胞质膜上的Fe2+转运蛋白IRT1(iron-regulated transporter 1)和IRT2吸收Fe2+[6];另一方面也采用机理II产生和分泌脱氧麦根酸(deoxymugineic acid,DMA),通过麦根酸家族转运体TOM1(transporter of mugineic acid family phytosiderophores 1)分泌至根际,DMA与Fe3+结合后形成Fe3+-DMA螯合物,最后通过转运体YSL15(yellow stripe-like 15)将Fe3+-DMA螯合物吸收进入水稻体内[7]。此外,次生代谢物也在植物缺铁响应中发挥重要作用。例如,有机酸[8]和酚类物质[9]能够促进植物对铁的吸收。高铁胁迫时,水稻首先通过根表面根际氧化形成的铁斑块避免过量的亚铁离子进入根系[10]。其次,水稻可将铁存储于液泡或质外体中,或以铁蛋白的形式分隔在叶绿体中[11]。水稻铁蛋白FER1/2(ferritin)、液泡膜转运蛋白VIT2(vacuolar membrane transporters)和烟酰胺合成酶NAS3(nicotianamine synthesis 3)在铁过量条件下的根部和地上部被诱导[12]。随着铁过量的加剧还会进一步诱导产生大量的活性氧(reactive oxygen species,ROS)。作为应对,水稻可通过抗氧化酶系统或者抗氧化剂解毒ROS,增加植株对铁毒的耐受性。编码过氧化物酶、超氧化物歧化酶和谷胱甘肽S-转移酶的基因参与了高铁胁迫ROS的解毒过程[13]。
近年来,转录组、蛋白质组被广泛用于鉴定与植物铁吸收利用和铁胁迫响应相关的基因和蛋白[12,14-16],但现有研究多关注植物对单一铁胁迫的调控。此外,绝大多数基因需转录翻译为蛋白质才能发挥功能,故在蛋白水平的调控对基因、蛋白功能的实现非常重要。然而,目前尚未在蛋白质水平上系统地比较和解析植物对缺铁和高铁胁迫的响应机制。本研究从蛋白质水平上研究了水稻地上部在不同浓度铁处理下的响应机制。该研究鉴定到的缺铁和高铁响应蛋白质与已报道的转录谱结果存在一定的差异,为转录组学数据提供了互补与延伸的信息。缺铁和高铁胁迫的蛋白质组学分析有助于更好地理解植物对铁胁迫的完整响应,为铁抗性水稻品种的培育提供理论基础。
1 材料与方法 1.1 供试材料和生长条件实验水稻为日本晴(Oryza sativa L. cv. Nipponbare),本实验室保存。水稻种子在去离子水中避光浸泡3 d诱导发芽后,将种子转移至含有0.5 mmol·L–1 CaCl2(pH 4.5)的溶液中3 d,然后在改良后的1/2霍格兰营养液中生长7 d。随后将幼苗转移至分别含有0 μmol·L–1(缺铁)、40 μmol·L–1(铁充足)、350 μmol·L–1(高铁)和500 μmol·L–1(高铁)Fe(Ⅱ)-EDTA改良后的霍格兰溶液中处理10 d。霍格兰营养液组成成分为:1.43 mmol·L–1 NH4NO3,0.3 mmol·L–1 KH2PO4,0.35 mmol·L–1 K2SO4,1 mmol·L–1 CaCl2·2H2O,1 mmol·L–1 MgSO4·7H2O,0.5 mmol·L–1 Na2SiO3·9H2O,40 μmol·L–1 Fe(Ⅱ)-EDTA,9 μmol·L–1 MnCl2·4H2O,0.32 μmol·L–1 CuSO4·5H2O,0.77 μmol·L–1 ZnSO4·7H2O,0.02 mmol·L–1 H3BO3和0.39 μmol·L–1 NaMoO4·2H2O[17]。水稻光照培养箱温度为30℃/25℃,相对湿度为70%,光周期为16 h光照/8 h黑暗。所有溶液均用去离子水配制,每3天更换一次营养液,营养液pH用稀酸和稀碱调节至5.5。
1.2 蛋白质提取和定量分析分别选取水培处理10 d的水稻地上部幼苗,使用三氯乙酸(trichloroacetic acid,TCA)-丙酮法提取总蛋白质,每个处理组三个生物学重复[18]。总蛋白质粉末溶解于SDT溶液(2%(w/v)十二烷基硫酸钠,0.1 mol·L–1二硫苏糖醇,0.1 mol·L–1 Tris-HCl,1 mmol·L–1苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF),pH 7.6)2~4 h,以10 000 ×g离心5 min,取上清作为总蛋白提取液。使用295 nm的激发光波长,通过350 nm的色氨酸荧光波长测定样品中蛋白质的浓度。
1.3 蛋白质酶解和肽段脱盐蛋白质样品采用过滤辅助样品制备(filter-aided sample preparation,FASP)方法进行处理[19]。将总蛋白溶液加入蛋白浓缩器(10K MWCO,0.5 mL PierceTM Protein Concentrator,Thermo Scientific,美国),用8 mol·L–1尿素对样品进行稀释,并在还原和烷基化后,在37℃下用胰蛋白酶消化过夜。消化结束后,10 000×g离心15 min,收集滤液,再用50 µL NH4HCO3溶液滤洗两次。随后,加入10%三氟乙酸(TFA),终浓度为0.4%时,反应终止。蛋白酶解产物在旋转蒸发仪中旋蒸至体积小于50 µL,然后加buffer A(64% 乙腈,0.2% TFA)至约200 µL备用。肽段脱盐采用PierceTM C-18脱盐柱(PierceTM C-18 Spin columns,Thermo Scientific,美国)实现。脱盐柱经甲醇活化后,将酶解产物加入脱盐柱,1 000 ×g离心30 s,滤出样品重新加回脱盐柱和离心,合并滤液,浓缩干燥。
1.4 nano-LC-ESI-MS/MS检测和非标记(label-free)定量分析采用纳升液相色谱-电喷雾-串联质谱法(nano liquid chromatography-electrospray ionizationtandem mass spectrometry,nanoLC-ESI-MS/MS)进行质谱分析。脱盐后的肽段样品用30 µL 0.1%甲酸重新溶解,上样至DIONEX UltiMate 3000 RSLC nano液相色谱系统(Thermo Fisher Scientific,美国)。用缓冲液A(0.1%甲酸水溶液)平衡C18分析柱(Acclaim PepMapTM 100,100 µm × 2cm,Thermo Fisher Scientific,美国),直至系统稳定,肽段溶液自动加载至柱子上。用缓冲液B(含0.1%甲酸的乙腈溶液)梯度洗脱肽90 min,流速为0.3 µL·min–1。洗脱梯度为:先3%保持8.5 min,在1.5 min内升至7%,50 min内升至22%,10 min内升至35%,然后在1 min内升至80%,保持5 min。最后在30 s内降至3%并保持至结束。在母离子全扫描范围为350~1 700 m/z的正电离模式下获得了所有的质谱。质谱和串联质谱的分辨率分别为60 000和15 000。选择每次质谱扫描中最丰富的20个母离子进行高能碰撞解离碎片化进行串联质谱分析。质谱分析中,每个样品的三次生物学重复各进行了两次技术重复的检测。
1.5 蛋白质鉴定和差异蛋白的筛选使用Proteome Discoverer软件(version 2.3,Thermo Scientific)对质谱数据进行搜库和蛋白质定量分析。使用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中的IRGSP-1.0作为参考数据库。将蛋白质置信度高于99%且至少一种处理标记为“High”、肽段可信度高于95%、Exp. q < 0.01的蛋白质鉴定为高可信度蛋白。蛋白质丰度变化大于1.5或小于0.67,且调整后的P < 0.05的高可信度蛋白被认为是差异蛋白(differently accumulated proteins,DAPs)。
1.6 生物信息学分析使用网络工具g:Profiler(https://biit.cs.ut.ee/gprofiler/gost)进行差异蛋白的基因本体(gene ontology,GO)注释和富集分析,显著性阈值设置为0.05(采用本杰米尼-霍赫伯格(Benjamini- Hochberg)方法对多重检验进行校正)[20]。R软件包clusterProfiler 3.18.1用于检索差异蛋白参与的京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)代谢通路,显著性阈值设置为P < 0.1[21]。使用STRING数据库(https://string-db.org/)进行差异蛋白的互作网路分析,通过Cytoscape软件中cytoHubba应用程序中的最大群体中心性(maximal clique centrality,MCC)算法进行候选蛋白的筛选。
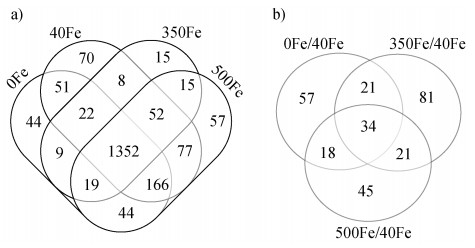
2 结果与讨论 2.1 缺铁和高铁胁迫差异蛋白质的筛选为了确定铁胁迫对水稻地上部蛋白水平的影响,将在1/2霍格兰营养液中生长7 d的水稻幼苗在缺铁、铁充足和2种浓度的高铁水培处理10 d后,取地上部组织分别提取总蛋白质。四种条件下共鉴定到高可信度蛋白质2 001个。其中,在缺铁处理、铁充足条件和2种浓度的高铁处理中分别鉴定到1 707、1 798、1 492和1 782个蛋白质,其中有1 352个(67.6%)蛋白质是四种条件下所共有的(图 1a)。与铁充足相比,从缺铁和两种浓度的高铁胁迫处理分别筛选出130、157和118个差异蛋白(图 1b)。其中,有34个蛋白质在3种胁迫中均有响应,分别有57、81和45个蛋白质仅出现在缺铁和两种浓度的高铁条件下。
|
注:0Fe、40Fe、350Fe和500Fe分别表示0 μmol·L–1、40 μmol·L–1、350 μmol·L–1和500 μmol·L–1 Fe(Ⅱ)-EDTA。下同。 Note: 0Fe, 40Fe, 350Fe and 500Fe represent 0 μmol·L–1, 40 μmol·L–1, 350 μmol·L–1 and 500 μmol·L–1 Fe(Ⅱ)-EDTA, respectively. The same below. 图 1 水稻地上部不同铁处理蛋白组检测概览(a.缺铁和高铁胁迫下地上部总蛋白质的数目;b.缺铁和高铁胁迫下地上部差异蛋白的数目) Fig. 1 Protein profiles of rice shoot under different Fe treatments(a. Venn diagrams of the overlap of total proteins detected in each treatment. b. Venn diagrams of overlap of total differentially accumulated proteins(DAPs)from comparisons between 0Fe, 350 Fe, 500Fe and 40Fe) |
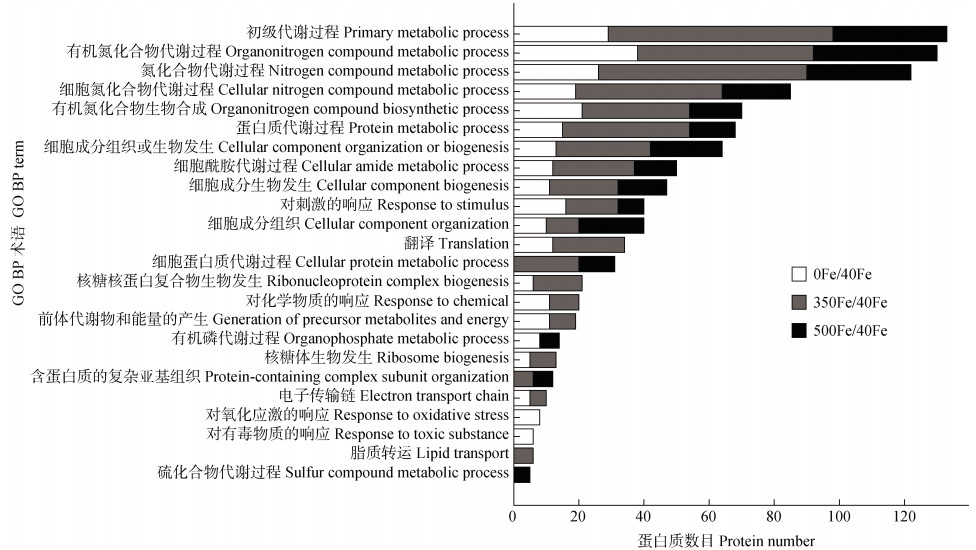
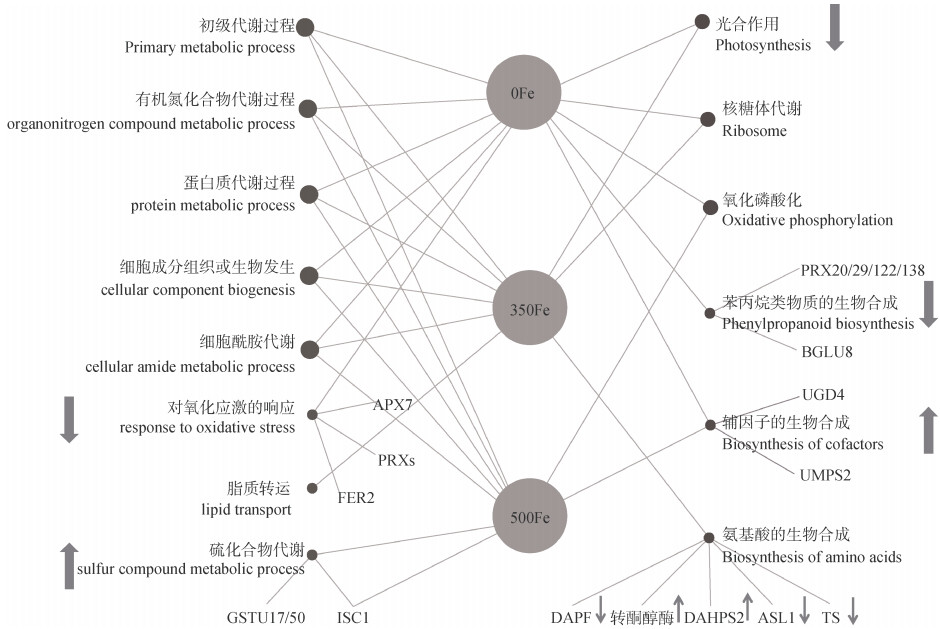
为比较水稻缺铁和高铁胁迫影响的生物学过程,本研究对来自缺铁和高铁胁迫的差异蛋白分别进行了GO生物学过程注释和富集分析。富集结果显示,缺铁和高铁胁迫的差异蛋白富集到了大致相同的生物学过程(图 2)。其中,富集到差异蛋白数量最多的术语是初级代谢过程、有机氮化合物代谢过程、蛋白质代谢过程、细胞成分组织或生物发生和细胞酰胺代谢。此外,对氧化应激的响应在缺铁胁迫特异性富集,而脂质转运和硫化合物代谢过程在高铁胁迫特异性富集。对氧化应激的响应是缺铁胁迫最显著富集的生物学过程,其中6个过氧化物酶(PRX29/20/122/125/138和APX7)、铁蛋白(Ferritin,FER2)和Os02g0612900的丰度在缺铁胁迫时均降低,这可能导致水稻地上部活性氧的积累和氧化损伤,从而抑制水稻的正常生长[13]。参与脂质转运过程和硫化合物代谢过程的差异蛋白丰度在高铁胁迫均增加,例如半胱氨酸脱硫酶(ISC1)和类谷胱甘肽S-转移酶(GSTU17、GSTU50)。谷胱甘肽-S-转移酶还是重要的是抗氧化酶,参与氧化应激产物的解毒[13]。
|
图 2 水稻地上部响应缺铁和高铁胁迫差异蛋白的基因本体(GO)富集分析 Fig. 2 Gene Ontology(GO)enrichment analysis results of differentially accumulated proteins in response to iron deficiency and excess |
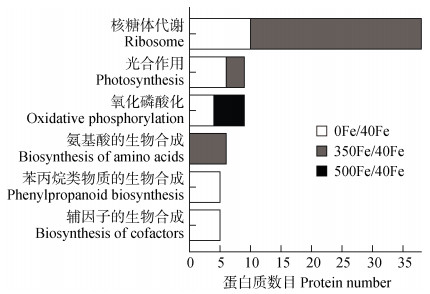
为了全面了解缺铁和高铁胁迫响应蛋白所涉及的代谢过程,本研究进一步对差异蛋白进行了KEGG富集分析。结果表明,缺铁和高铁胁迫中的差异蛋白均富集到核糖体、光合作用和氧化磷酸化代谢过程,而苯丙烷类物质的生物合成和辅因子的生物合成主要受缺铁胁迫的影响,氨基酸的生物合成主要受高铁胁迫的影响(图 3)。为了阐明参与上述代谢过程的蛋白质在缺铁和高铁胁迫下的调节模式,本文进一步标注了与这些代谢过程相关的差异蛋白在缺铁和高铁胁迫下的改变(图 4,图 5)。
|
图 3 水稻地上部响应缺铁和高铁胁迫差异蛋白的京都基因和基因组百科全书(KEGG)富集分析 Fig. 3 Kyoto Encyclopedia of Genes and Genomes(KEGG)pathway enrichment analysis results of differentially accumulated proteins in response to iron deficiency and excess |

|
图 4 显著富集的京都基因和基因组百科全书(KEGG)通路中的差异表达蛋白 Fig. 4 Differentially accumulated proteins in the significantly enriched Kyoto Encyclopedia of Genes and Genomes(KEGG)pathways |
|
注:不同处理与生物学或代谢过程之间的连线表示该过程在缺铁或高铁胁迫被富集。圆圈的大小与被富集的铁胁迫类型的数目有关。仅标注部分缺铁或高铁胁迫特异性富集的生物学或代谢过程中的差异蛋白;蛋白质丰度的变化方向用箭头表示(↑:丰度增加;↓:丰度减少)。 Note: Lines between different treatments and biological or metabolic processes indicated that the process was enriched under Fe deficiency or excess stresses. The size of the circles was related to the number of enriched Fe stress types. Only some differential accumulated proteins involved in biological or metabolic processes specifically enriched by Fe deficiency or excess were annotated. The direction of change of protein abundance is indicated by the arrows(↑: increase in abundance; ↓: reduction in abundance). 图 5 水稻地上部对缺铁和高铁胁迫调控策略示意图 Fig. 5 Schematic diagram of the regulation strategy of rice shoots to Fe deficiency and excess |
核糖体蛋白除参与翻译过程外,还参与植物生长的调节和环境胁迫的响应。本研究表明,缺铁和高铁胁迫均显著改变了大量核糖体蛋白的丰度。其中,仅有6个核糖体蛋白同时受到缺铁和高铁的影响,并且变化趋势一致,而其他核糖体蛋白仅受缺铁或高铁胁迫的调控。RPS15和RPS17(Os10g0411800)的丰度在缺铁和高铁胁迫均显著增加,而RPS18和RPS6(Os03g0390000)的丰度分别仅在缺铁和高铁胁迫(350 μmol·L–1)增加和降低。RPS18和RPS15的功能已在烟草中得到验证,RPS18的缺失导致烟草叶片发育受阻[22],而RPS15在高温条件下对于提高核糖体的生物合成效率是必需的[23]。RPS17的缺失导致玉米光系统Ⅱ功能复合物的数量变少,植物的光合电子传递受到抑制[24]。这表明不同植物对RPS17的调控方式可能存在差异。热敏叶绿素缺陷11(THERMO-SENSITIVE CHLOROPHYLL-DEFICIENT 11,TCD11)编码RPS6,水稻tcd11突变体在低温下表现出白化表型[25]。这表明RPS6是正常叶绿体发育所必需的,RPS6可能在水稻高铁胁迫的光合代谢中发挥作用。然而,大部分核糖体蛋白在逆境胁迫中的调控机制仍不清楚,这些核糖体蛋白在植物生长发育和铁胁迫调控中的功能有待进一步研究。
2.3.2 缺铁和高铁胁迫损害水稻的光合作用铁是细胞色素的辅酶,缺铁胁迫时,植物叶绿素含量降低、光合作用减弱,最终导致生物量下降[26]。除ATP合酶亚基(ATPF)外,其他差异蛋白的丰度在缺铁时均显著降低,包括铁氧还原蛋白1(FD1)、细胞色素b6(PETB)、细胞色素b559亚基β(PSBF)、光系统I反应中心亚基VI(PSAH)和细胞色素b6-f复合铁硫亚基(PETC)。植物中的铁毒性影响光系统II,细胞色素b6/f含量增加,植物的光合速率降低[4]。本研究中,高铁胁迫时,光系统II11kD蛋白(Os03g0333400)和释氧增强蛋白3(Os07g0544800)显示出增强的丰度,而FD1的丰度降低。FD1是光合生物中主要的含铁蛋白,在电子传输和氧化还原稳态中起着重要作用。此外,在非生物胁迫下,水稻光合组织中的RuBisCO亚基下调导致净光合作用降低。在本研究的数据中,类RuBisCO亚基结合蛋白β亚基的丰度在缺铁和高铁(350 μmol·L–1)时显著降低。上述数据表明缺铁和高铁胁迫均破坏了水稻正常的光合能力。
2.3.3 高铁胁迫影响地上部氨基酸代谢高铁胁迫时,氨基酸生物合成途径中有6个蛋白质的丰度发生显著变化。其中,转酮醇酶(Os04g0266900)和磷酸化-2-脱氢-3-脱羟庚酸醛缩酶(DAHPS2)的丰度显著增加,而二氨基庚二酸差向异构酶(DAPF)、苏氨酸合成酶(TS)、精氨琥珀酸裂解酶(ASL1)和丙酮酸激酶家族蛋白(Os12g0145700)的丰度降低。此外,转酮醇酶的蛋白丰度在缺铁胁迫时也显著增加。转酮醇酶是磷酸戊糖途径的关键酶,参与植物的光合作用、次生代谢和对氧化应激的响应[27]。转酮醇酶还被鉴定为镉胁迫、盐胁迫和热胁迫条件下的上调蛋白[28-29]。铁胁迫下转酮醇酶丰度的增加有利于缓解缺铁和高铁胁迫对水稻光合作用和生长的抑制效应。DAPF和TS是天冬氨酸途径的关键酶,分别参与赖氨酸和苏氨酸的合成。赖氨酸是谷氨酸的前体,而谷氨酸是调节植物生长和环境响应的重要信号氨基酸[30]。ASL1催化精氨酸琥珀酸裂解生成精氨酸和富马酸[31]。精氨酸是21种蛋白质氨基酸中碳氮比最高的氨基酸,是植物体内氮素运输和储存的重要介质[32]。精氨酸还是信号分子一氧化氮(NO)的合成前体,参与了植物对铁胁迫的响应[33]。这表明赖氨酸、苏氨酸和精氨酸的合成在高铁胁迫时受到抑制。
2.3.4 其他此外,氧化磷酸化通路中共有8个蛋白质的丰度在缺铁和高铁胁迫时发生显著变化,并且仅有NADH脱氢酶铁硫蛋白(Os8g0161700)和质膜ATP酶(Os7g0191200)同时受到缺铁和高铁的调控。参与苯丙烷类物质生物合成代谢过程的差异蛋白丰度在缺铁时均显著降低,包括β-葡萄糖苷酶8(BGLU8)和过氧化物酶(PRX20/29/122/138)。BGLU8和PRX122的蛋白丰度在高铁胁迫也降低。苯丙烷类物质的生物合成是植物产生次生代谢的途径,次生代谢及次生代谢产物在植物非生物胁迫响应中具有重要作用[34]。与之相反,除NADPH脱氢酶(Os05g0501300)外,参与辅因子生物合成的差异蛋白丰度在缺铁时均显著增加。
2.4 差异蛋白的互作网络分析和关键蛋白的筛选对差异蛋白的互作网络进行分析显示,在互作网络中,细胞色素b6-f复合铁硫亚基(cytochrome b6-f complex iron-sulfur subunit,Os07g0556200)、鸟嘌呤核苷酸结合蛋白亚基β样蛋白A(guanine nucleotide-binding protein subunit beta-like protein A,Os01g0686800)和Os03g0844900分别是缺铁和两种浓度的高铁差异蛋白中互作数目最多的蛋白质(图 6a,图 6b,图 6c)。基于互作网络,进一步使用Cytoscape中的cytoHubba插件,分别筛选出3种胁迫处理下的前15个枢纽蛋白作为后续研究的候选蛋白(图 6d,图 6e,图 6f)。其中,30S核糖体蛋白S16、Os03g0798600和RPL17分别是3个互作网络中得分最高的候选蛋白。缺铁胁迫筛选到的候选蛋白主要与光合作用(5个)和核糖体(7个)代谢过程有关;大部分的350 μmol·L–1高铁候选蛋白均为核糖体或推测的核糖体蛋白(12个);500 μmol·L–1高铁胁迫候选蛋白有3个与氧化磷酸化有关,包括V型质子ATP酶亚基G(Os04g0601700)、NADH脱氢酶铁硫蛋白6(Os08g0161700)和GRIM-19家族蛋白(Os03g0192400),此外,BGLU8与淀粉和蔗糖代谢有关,而RPL17是一个核糖体蛋白。这表明核糖体、光合作用和氧化磷酸化确实是水稻调控铁胁迫耐受性的关键途径。
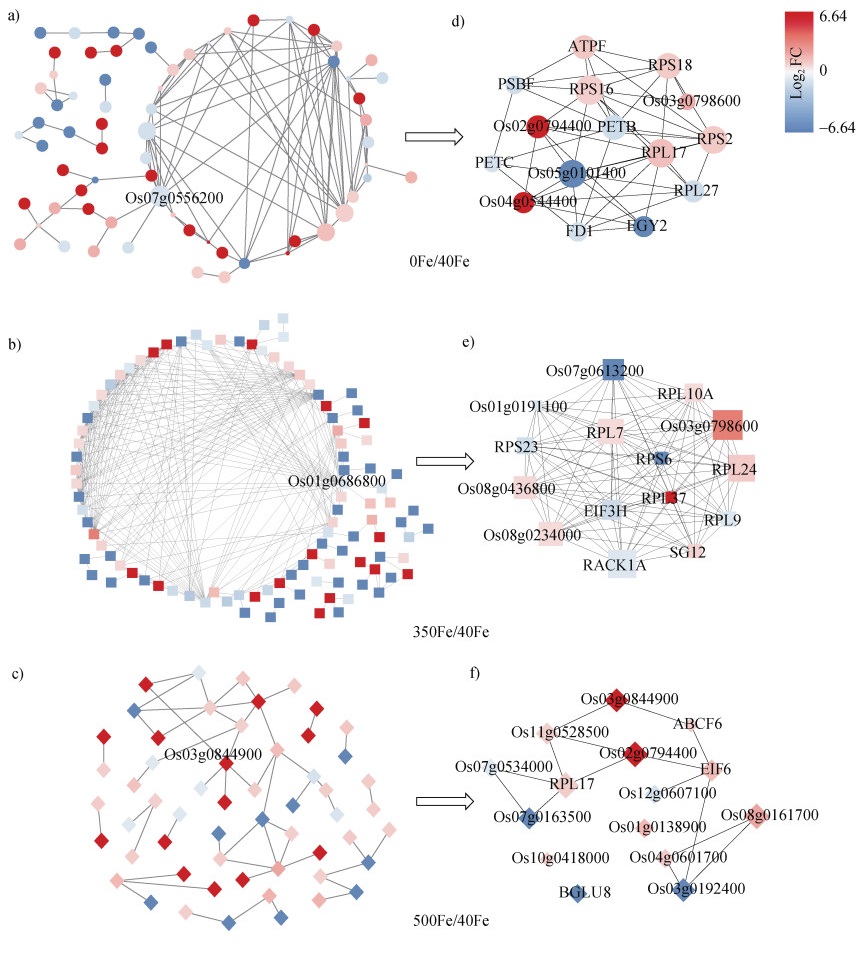
|
注:缺铁和两种不同浓度的高铁胁迫鉴定到的差异蛋白分别用圆形、正方形、棱形标记。蛋白质之间的连线表示蛋白质之间存在相互作用。a、b、c使用STRING数据库进行差异蛋白的互作网路分析,缺铁和两种水平的高铁胁迫分别得到115、142和106个相互作用的差异蛋白。图中仅展示差异蛋白中互作数目最多的蛋白质。d、e、f根据Cytoscape软件中cytoHubba应用程序中的最大群体中心性(MCC)算法,从图 6a、图 6b、图 6c中分别筛选得到缺铁和两种水平高铁胁迫下排名前15的候选蛋白。圆形、正方形和棱形的大小与差异蛋白的排名顺序成正比。d:RPS16,30S核糖体蛋白S16;RPS2,30S核糖体蛋白S2;RPS18,30S核糖体蛋白S18;PETB,细胞色素b6;ATPF,ATP合酶亚基b;RPL27,50S核糖体蛋白L27;EGY2,锌金属蛋白酶EGY2;PSBF,细胞色素b559亚基β;FD1,铁氧还蛋白1;PETC,细胞色素b6-f复合铁硫亚基。e:RACK1A,鸟嘌呤核苷酸结合蛋白亚基β样蛋白A;RPL24,核糖体蛋白L24e结构域含有蛋白;RPL7,60S核糖体蛋白L7-2;EIF3H,真核翻译起始因子3亚基H;RPL10A,60S核糖体蛋白L10a;RPS23,40S核糖体蛋白S23;RPL9,60S核糖体蛋白L9;SG12,60S核糖体蛋白L10-2;RPS6,40S核糖体蛋白S6;RPL37,60S核糖体蛋白L37。f:RPL17,50S核糖体蛋白L17;ABCF6,ABC转运蛋白家族蛋白;BGLU8,β-葡萄糖苷酶8;EIF6,真核翻译起始因子6。 Note: Differential accumulated proteins identified by Fe deficiency and two levels of Fe excess were marked with circles, squares and prisms, respectively. The line between proteins indicated that proteins interact with each other. a, b, c. Using the STRING online database, a total of 115, 142, and 106 DAPs were filtered into the PPI network and visualized by Cytoscape. Only the proteins with the largest number of interactions among the differentially accumulated proteins are shown in the figure. d, e, f. Top 15 DAPs analyzed by maximal clique centrality(MCC)method in cytoHubba. The size of the lable was proportional to the rank order of the candidate proteins. d: RPS16, 30S ribosomal protein S16;RPS2, 30S ribosomal protein S2;RPS18, 30S ribosomal protein S18;PETB, Cytochrome b6;ATPF, ATP synthase subunit b; RPL27, 50S ribosomal protein L27;EGY2, zinc metalloprotease EGY2;PSBF, Cytochrome b559 subunit beta; FD1, Ferredoxin 1;PETC, Cytochrome b6-f complex iron-sulfur subunit. e: RACK1A, Guanine nucleotide-binding protein subunit beta-like protein A; RPL24, Ribosomal protein L24e domain-containing protein; RPL7, 60S ribosomal protein L7-2;EIF3H, Eukaryotic translation initiation factor 3 subunit H; RPL10A, 60S ribosomal protein L10a;RPS23, 40S ribosomal protein S23;RPL9, 60S ribosomal protein L9;SG12, 60S ribosomal protein L10-2;RPS6, 40S ribosomal protein S6;RPL37, 60S ribosomal protein L37. f: RPL17, 50S ribosomal protein L17;ABCF6, ABC transporter family protein; BGLU8, Beta-glucosidase 8;EIF6, Eukaryotic translation initiation factor 6. 图 6 缺铁和高铁胁迫差异蛋白的互作网络和候选蛋白的筛选 Fig. 6 Protein-protein interaction(PPI)relationship of differentially accumulated proteins(DAPs)and candidate proteins under Fe deficiency and excess |
转录组学和蛋白质组学分别从mRNA和蛋白质水平分析植物对胁迫响应的调控,将蛋白质组学和转录组学数据进行比较分析,有利于更好地理解植物对胁迫的响应。Bashir等[14]报道了水稻响应缺铁和高铁胁迫的转录组,选择该数据集与本研究获得的蛋白组数据进行了比较。缺铁胁迫时,FER2、PRX20/125、皮质细胞定界蛋白(cortical cell delineating protein,Os10g0552700)、葡聚糖内切1,3-β-D-葡萄糖苷酶(Os07g0168600)和Os01g0871500同时受到转录和蛋白水平的调控,并且表达趋势一致。同样的,高铁胁迫时,S样核糖核酸酶(RNS4)、类病毒RNA结合蛋白(Os04g0614600)和类CLP蛋白酶调节亚基CLPX前体(Os01g0886600)在转录和蛋白水平的调控一致。然而,尽管转录组和蛋白组数据均显示Os02g0209100和硫酸腺苷酸转移酶(Os03g0743900)受到高铁胁迫的调控,但其表达趋势存在差异。此外,转录组数据显示类轮廓蛋白-2(Os06g0152100)、水通道蛋白(TIP1)、RPL27、网格蛋白轻链家族蛋白(Os06g0731800)、类Atranbp1b蛋白(Os05g0350600)也受到高铁胁迫的调控,但在本研究数据中,他们仅在某一种高铁浓度受到调控,表明水稻对不同铁胁迫程度的调控也有差异。此外,诸多新的受高铁胁迫调控的蛋白质在现有研究中被鉴定,如RPS6、类RuBisCO亚基结合蛋白β亚基(Os02g0102900)和含有ABC转运蛋白整合膜1型结构域的蛋白质(ABCD1,Os01g0218700)等。综上可知,蛋白质在转录和翻译水平上的调控存在差异,本研究蛋白质组数据为理解植物应对铁胁迫的调控提供了新的信息。
3 结论本研究从蛋白质水平鉴定了水稻响应缺铁和高铁胁迫的关键蛋白,对差异蛋白参与的主要生物学过程和代谢途径进行了比较分析。缺铁和高铁胁迫均影响光合作用和核糖体等代谢过程,苯丙烷的物质合成主要受到缺铁胁迫的调控,而氨基酸代谢主要受到高铁胁迫的调控。铁胁迫下的水稻可通过调控代谢响应(如辅因子的生物合成)减少或修复逆境造成的损害,以维持基本的生理活动。本研究还鉴定出了一些新的可能受铁胁迫调控的蛋白质,为水稻响应铁胁迫机制的进一步研究提供了数据基础。
| [1] |
Li W F, Zhu H Y, Lan P. Research progress of iron homeostasis regulation in strategy Ⅰ plants (In Chinese)[J]. Soils, 2021, 53(6): 1101-1106. [李文凤, 朱海焰, 兰平. 策略Ⅰ植物铁吸收稳态调控研究进展[J]. 土壤, 2021, 53(6): 1101-1106.]
(  0) 0) |
| [2] |
Wang Y Q, Li Y H, Zhu Z K, et al. The Effect of iron oxides on mineralization, transformation and priming effect of acetate in anoxic paddy soils (In Chinese)[J]. Acta Pedologica Sinica, 2020. DOI:10.11766/trxb202105270277 [王云秋, 李宇虹, 祝贞科, 等. 铁氧化物对厌氧水稻土中乙酸矿化、转化及其激发效应的影响[J]. 土壤学报, 2020.]
(  0) 0) |
| [3] |
Zhang X, Zhang D, Sun W, et al. The adaptive mechanism of plants to iron deficiency via iron uptake, transport, and homeostasis[J]. International Journal of Molecular Sciences, 2019, 20(10): 2424. DOI:10.3390/ijms20102424
(  0) 0) |
| [4] |
Suh H J, Kim C S, Lee J Y, et al. Photodynamic effect of iron excess on photosystem II function in pea plants[J]. Photochemistry and Photobiology, 2002, 75(5): 513-518. DOI:10.1562/0031-8655(2002)075<0513:PEOIEO>2.0.CO;2
(  0) 0) |
| [5] |
Zhang N N, Shangguan Z P, Chen J. Molecular physiological mechanism and regulation of plant responses to iron deficiency stress (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(5): 1365-1377. [张妮娜, 上官周平, 陈娟. 植物应答缺铁胁迫的分子生理机制及其调控[J]. 植物营养与肥料学报, 2018, 24(5): 1365-1377.]
(  0) 0) |
| [6] |
Ishimaru Y, Suzuki M, Tsukamoto T, et al. Rice plants take up iron as an Fe3+-phytosiderophore and as Fe2+[J]. The Plant Journal, 2006, 45(3): 335-346. DOI:10.1111/j.1365-313X.2005.02624.x
(  0) 0) |
| [7] |
Inoue H, Kobayashi T, Nozoye T, et al. Rice OsYSL15 is an iron-regulated iron(III)-deoxymugineic acid transporter expressed in the roots and is essential for iron uptake in early growth of the seedlings[J]. Journal of Biological Chemistry, 2009, 284(6): 3470-3479. DOI:10.1074/jbc.M806042200
(  0) 0) |
| [8] |
Kabir A H, Paltridge N G, Able A J, et al. Natural variation for Fe-efficiency is associated with upregulation of strategy I mechanisms and enhanced citrate and ethylene synthesis in Pisum sativum L[J]. Planta, 2012, 235(6): 1409-1419. DOI:10.1007/s00425-011-1583-9
(  0) 0) |
| [9] |
Jin C W, He Y F, Tang C X, et al. Mechanisms of microbially enhanced Fe acquisition in red clover(Trifolium pratense L.)[J]. Plant, Cell and Environment, 2006, 29(5): 888-897. DOI:10.1111/j.1365-3040.2005.01468.x
(  0) 0) |
| [10] |
Becker M, Asch F. Iron toxicity in rice—conditions and management concepts[J]. Journal of Plant Nutrition and Soil Science, 2005, 168(4): 558-573. DOI:10.1002/jpln.200520504
(  0) 0) |
| [11] |
Briat J F, Duc C, Ravet K, et al. Ferritins and iron storage in plants[J]. Biochimica et Biophysica Acta, 2010, 1800(8): 806-814. DOI:10.1016/j.bbagen.2009.12.003
(  0) 0) |
| [12] |
Aung M S, Masuda H, Kobayashi T, et al. Physiological and transcriptomic analysis of responses to different levels of iron excess stress in various rice tissues[J]. Soil Science and Plant Nutrition, 2018, 64(3): 370-385. DOI:10.1080/00380768.2018.1443754
(  0) 0) |
| [13] |
Huang H L, Ullah F, Zhou D X, et al. Mechanisms of ROS regulation of plant development and stress responses[J]. Frontiers in Plant Science, 2019, 10: 800. DOI:10.3389/fpls.2019.00800
(  0) 0) |
| [14] |
Bashir K, Hanada K, Shimizu M, et al. Transcriptomic analysis of rice in response to iron deficiency and excess[J]. Rice, 2014, 7(1): 18. DOI:10.1186/s12284-014-0018-1
(  0) 0) |
| [15] |
Chen L, Ding C Q, Zhao X F, et al. Differential regulation of proteins in rice(Oryza sativa L.)under iron deficiency[J]. Plant Cell Reports, 2015, 34(1): 83-96. DOI:10.1007/s00299-014-1689-1
(  0) 0) |
| [16] |
Kar S, Mai H J, Khalouf H, et al. Comparative transcriptomics of lowland rice varieties uncovers novel candidate genes for adaptive iron excess tolerance[J]. Plant & Cell Physiology, 2021, 62(4): 624-640.
(  0) 0) |
| [17] |
Chaiwong N, Bouain N, Prom-U-Thai C, et al. Interplay between silicon and iron signaling pathways to regulate silicon transporter Lsi1 expression in rice[J]. Frontiers in Plant Science, 2020, 11: 1065. DOI:10.3389/fpls.2020.01065
(  0) 0) |
| [18] |
Lan P, Li W, Schmidt W. Complementary proteome and transcriptome profiling in phosphate-deficient arabidopsis roots reveals multiple levels of gene regulation[J]. Molecular & Cellular Proteomics, 2012, 11(11): 1156-1166.
(  0) 0) |
| [19] |
Wiśniewski J R, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis[J]. Nature Methods, 2009, 6(5): 359-362. DOI:10.1038/nmeth.1322
(  0) 0) |
| [20] |
Reimand J, Isserlin R, Voisin V, et al. Pathway enrichment analysis and visualization of omics data using g: Profiler, GSEA, Cytoscape and EnrichmentMap[J]. Nature Protocols, 2019, 14(2): 482-517. DOI:10.1038/s41596-018-0103-9
(  0) 0) |
| [21] |
Wu T Z, Hu E Q, Xu S B, et al. ClusterProfiler 4.0: A universal enrichment tool for interpreting omics data[J]. The Innovation, 2021, 2(3): 100141. DOI:10.1016/j.xinn.2021.100141
(  0) 0) |
| [22] |
Rogalski M, Ruf S, Bock R. Tobacco plastid ribosomal protein S18 is essential for cell survival[J]. Nucleic Acids Research, 2006, 34(16): 4537-4545. DOI:10.1093/nar/gkl634
(  0) 0) |
| [23] |
Ehrnthaler M, Scharff L B, Fleischmann T T, et al. Synthetic lethality in the tobacco plastid ribosome and its rescue at elevated growth temperatures[J]. The Plant Cell, 2014, 26(2): 765-776. DOI:10.1105/tpc.114.123240
(  0) 0) |
| [24] |
Schultes N P, Sawers R J H, Brutnell T P, et al. Maize high chlorophyll fluorescent 60 mutation is caused by an ac disruption of the gene encoding the chloroplast ribosomal small subunit protein 17[J]. The Plant Journal, 2000, 21(4): 317-327. DOI:10.1046/j.1365-313x.2000.00676.x
(  0) 0) |
| [25] |
Wang W J, Zheng K L, Gong X D, et al. The rice tcd11 encoding plastid ribosomal protein S6 is essential for chloroplast development at low temperature[J]. Plant Science, 2017, 259: 1-11. DOI:10.1016/j.plantsci.2017.02.007
(  0) 0) |
| [26] |
Mallikarjuna M G, Thirunavukkarasu N, Sharma R, et al. Comparative transcriptome analysis of iron and zinc deficiency in maize(Zea mays L.)[J]. Plants, 2020, 9(12): 1812. DOI:10.3390/plants9121812
(  0) 0) |
| [27] |
Khozaei M, Fisk S, Lawson T, et al. Overexpression of plastid transketolase in tobacco results in a thiamine auxotrophic phenotype[J]. The Plant Cell, 2015, 27(2): 432-447. DOI:10.1105/tpc.114.131011
(  0) 0) |
| [28] |
Yin Z K, Stead D, Walker J, et al. A proteomic analysis of the salt, cadmium and peroxide stress responses in Candida albicans and the role of the Hog1 stress-activated MAPK in regulating the stress-induced proteome[J]. Proteomics, 2009, 9(20): 4686-4703. DOI:10.1002/pmic.200800958
(  0) 0) |
| [29] |
Lee D G, Ahsan N, Lee S H, et al. A proteomic approach in analyzing heat-responsive proteins in rice leaves[J]. Proteomics, 2007, 7(18): 3369-3383. DOI:10.1002/pmic.200700266
(  0) 0) |
| [30] |
Galili G. New insights into the regulation and functional significance of lysine metabolism in plants[J]. Annual Review of Plant Biology, 2002, 53: 27-43. DOI:10.1146/annurev.arplant.53.091401.110929
(  0) 0) |
| [31] |
Caldwell R W, Rodriguez P C, Toque H A, et al. Arginase: A multifaceted enzyme important in health and disease[J]. Physiological Reviews, 2018, 98(2): 641-665. DOI:10.1152/physrev.00037.2016
(  0) 0) |
| [32] |
Winter G, Todd C D, Trovato M, et al. Physiological implications of arginine metabolism in plants[J]. Frontiers in Plant Science, 2015, 6: 534.
(  0) 0) |
| [33] |
Sun H W, Feng F, Liu J, et al. The interaction between auxin and nitric oxide regulates root growth in response to iron deficiency in rice[J]. Frontiers in Plant Science, 2017, 8: 2169. DOI:10.3389/fpls.2017.02169
(  0) 0) |
| [34] |
Sharma A, Badola P K, Bhatia C, et al. Primary transcript of miR858 encodes regulatory peptide and controls flavonoid biosynthesis and development in Arabidopsis[J]. Nature Plants, 2020, 6(10): 1262-1274. DOI:10.1038/s41477-020-00769-x
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


