土壤是陆地生态系统的重要组成部分,土壤碳、氮循环对于提高生态系统的初级生产力和土壤肥力以及解决当今重要的生态环境问题至关重要[1-2]。生物质炭是生物质在无氧或限氧条件下热解产生的一种富含碳的物质,主要由难降解的芳香族化合物和少量易分解的可溶性化合物组成[3]。由于具有难分解的化学成分和特殊的表面特性[3],生物质炭施入土壤可以增加土壤碳汇、改善养分循环并提高作物产量[4]。
利用稳定同位素技术可以区分土壤碳、氮的来源[5-6],是研究土壤元素循环的重要技术手段。为同时研究生物质炭对土壤碳、氮转化的影响,有必要获取13C和15N双标记的生物质炭[7],这需要首先获得同位素标记的生物质原料。植物残体是制备生物质炭的重要原料之一。有研究指出,标记后的停留时间的长短通过影响13C在植物体内的运输和代谢过程而影响植物体不同部位及不同化学组分的δ13C[8-9]。相似地,标记后植物体内15N的运输和代谢过程也会随着停留时间长短的不同而不同。例如,李永旗等[10]通过叶面喷施15N-尿素对棉花进行标记,发现标记后4~6 h内15N的吸收速率达到最大,并且叶面吸收的氮会向根部进行转移。在热解植物制备生物质炭的过程中,植物的易分解组分优先损失而难分解组分更容易被保留[11-12]。因此,标记后的停留时间通过影响植物的δ13C和δ15N而可能影响生物质炭的δ13C和δ15N。但是,目前还没有同时研究标记停留时间对植物及其制备的生物质炭的δ13C和δ15N影响的报道。
植物13C标记的方法主要包括13CO2的脉冲标记和连续标记[13-14]。连续标记更容易获得13C在不同化学组分中分布均匀的植物材料,但是连续标记成本高,时间较久,且不适合野外等情况[13]。脉冲标记设备需求低,操作简单,已被广泛使用[14-15]。脉冲标记后被植物所同化碳的13C/12C比率会随时间而变化[16],导致植物标记的均匀性改变。而且,制炭条件和温度也会造成生物质炭不同组分δ13C的变化[11]。植物标记后的停留时间通过影响植物体内13C分布均匀性可能影响生物质炭的13C分布均匀性。然而,目前还没有标记停留时间对生物质炭的13C分布均匀性影响的研究报道。
我国是水稻种植大国,水稻种植面积约占中国总耕地面积的24%,每年产生的水稻秸秆质量约为6×108 t。因此,利用水稻秸秆作为制备生物质炭的原料是对农业废弃物的循环再利用的重要途径之一。本研究以水稻为原料,利用13C单次脉冲标记和15N叶面喷施的方法进行双标记实验,标记完成后设置不同的停留时间,然后将标记后的水稻分别在300℃和500℃制备成生物质炭。本研究的假设如下:(1)随着标记后停留时间的延长,由于13C和15N由水稻地上部分运输至地下部分,水稻地上部分的δ13C和δ15N均降低而地下部分的δ13C和δ15N均升高;(2)由于热解过程对不同化学组分的分解存在选择性,停留时间对水稻生物质炭的δ13C和δ15N的影响与对水稻原料δ13C和δ15N的影响可能不同;(3)随着停留时间的延长,由于水稻吸收的13C逐渐被同化进入不同化学组分,水稻生物质炭的13C在不同化学组分的分布可能更均匀。本研究将为13C和15N双标记生物质炭的制备提供参考,并为深入研究生物质炭对土壤碳、氮过程的影响提供基础。
1 材料与方法 1.1 研究区概况研究区位于江苏省镇江市下蜀林场(32°7′32″N,119°13′28″E),该地区的气候属于亚热带季风气候,年平均气温为15.2℃,年平均日照时数为2 157 h,年降水量为1 055.6 mm。下蜀林场地区土壤以黄棕壤和山地黄棕壤为主[17],根据美国农业部USDA(1994)分类为耕层湿淋溶土[6],土壤pH为5.90,全碳13.95 g·kg–1,全氮0.68 g·kg–1。
1.2 水稻盆栽实验2019年5月在下蜀林场开展了水稻盆栽实验。供试土壤采自下蜀林场附近田地0~20 cm耕层土壤。挑去土壤碎石与碎根,并过10 mm筛用于盆栽实验。盆栽实验所用的花盆大小为直径25 cm、高25 cm,每个花盆装入过10 mm筛的鲜土5 kg。2019年4月,将水稻播种至育苗盘中进行发芽育苗,等待水稻长至幼苗期时将其移入花盆,每个花盆中移植3株水稻。盆栽水稻按照当地农民的常规管理方式进行水分和施肥管理。
1.3 植物的同位素标记水稻进入灌浆期后,选择了晴朗的天气进行13C和15N同位素双标记。2019年9月27日上午10点,首先利用叶面喷施的方法对水稻进行15N标记,然后利用脉冲标记的方法进行13C标记[18-19]。15N标记时,首先去除水稻衰老的叶片,然后将15N-尿素(10 atom % 15N,上海化工研究院)溶解为浓度0.2%(w/v)的溶液,即2 g·L–1。使用雾化瓶均匀地将15N-尿素溶液喷施在水稻叶片,每株水稻叶面共喷施含有49 mg尿素的溶液24.5 mL(叶面施氮量相当于10 kg·hm–2)。每盆水稻大约喷施5 min,注意避免喷施过量造成叶片表面径流。为了使水稻更好的吸收15N-尿素溶液,在尿素溶液中加入0.05%(v/v)的表面活性剂TritonX-100[20]。15N-尿素喷施完成后,通风10 min后立即放入特制的透明有机玻璃箱(长×宽×高为106 cm×71cm×100 cm)中进行13C-CO2脉冲标记,有机玻璃箱中脉冲标记使用的Ba13CO3(98 atom % 13C,上海化工研究院)的总量为5.3g,标记方法参考刘萍等[14]的方法。13C脉冲标记共持续4 h,13C标记完成后,收获水稻的时间分别为0 h、2 h和20 h,即15N标记完成后的4 h、6 h和24 h,每个停留时间设置3个重复。本文中对停留时间的描述统一选择使用15N标记完成后的时间。水稻收获后,将水稻植株分为地上部分和地下部分,使用去离子水洗净根部泥土,带回实验室。在实验室,将植物放入烘箱,105℃下杀青30 min,70℃烘干至恒重。将烘干后地上部分和地下部分的水稻植株使用研磨机磨碎并过100目筛(0.149 mm),混匀,取一部分用以测定13C和15N的同位素丰度,其余密封保存用以制备生物质炭。
1.4 生物质炭的制备使用马弗炉(Carbolite,GPC12/131,英国)将13C和15N双标记的水稻在限氧条件下高温热解制备生物质炭[21]。马弗炉的升温程序设置为10℃·min–1,目标温度分别设定为300℃和500℃,达到目标温度后持续热解4 h,制备得到的生物质炭分别记为BC300和BC500。将制备好的生物质炭磨碎并过100目筛,密封保存,用以测定δ13C和δ15N。
1.5 生物质炭的热水可提取有机碳(DOC)和同位素丰度的测定为了区分生物质炭DOC和残留固体两种组分的δ13C,使用热水浸提生物质炭样品[22],简要过程如下:称取2.00 g生物质炭样品,加入30 mL去离子水,使用100℃的沸水浸提1 h,待浸提液冷却至室温后,以3 000 r·min–1速度离心5 min,然后将浸提液过0.45 μm滤膜。使用冷冻干燥机(Labconco,美国)将滤液冻干,残留固体风干后,用于δ13C的测定。使用元素分析仪-稳定同位素比例质谱仪(Flash EA-δV advantage,Thermo-Fisher科技有限公司,美国)分别测定水稻和生物质炭的δ13C和δ15N。
1.6 数据处理植物和生物质炭的13C和15N丰度用δ13C和δ15N来表示,其计算公式为[18]:
| $ δχ(‰)=(R_{样品}/R_\text{ref} – 1)× 1 000 $ | (1) |
式中,χ为13C或15N,R样品 = 13C/12C或15N/14N,13C或15N的Rref分别为0.011 237和0.003 676。
根据原子丰度(atom%)计算植物样品的13C和15N回收率13Crec(%)和15Nrec(%),计算公式分别为[23]:
| $ ^{13}C_\text{rec}\% = \frac{{F}_{样品}-{C}_{\text{ref}}}{{C}_{\text{add}}}\times \frac{{C}_{\text{pool}}}{{C}_{\text{tracer}}} $ | (2) |
| $ ^{15}N_\text{rec}\% = \frac{{F}_{样品}-{\text{N}}_{\text{ref}}}{{\text{N}}_{\text{add}}}\times \frac{{\text{N}}_{\text{pool}}}{{\text{N}}_{\text{tracer}}} $ | (3) |
式中,F样品为植物13C或15N的原子丰度(atom%);Cref为自然状态下13C的原子丰度(atom%)1.111 2,Nref为自然状态下15N的原子丰度(atom%)0.366 3;Cadd和Nadd分别表示所添加的示踪剂13C或15N的原子丰度(atom%);Cpool和Npool分别表示植物体C或N的物质的量(mol);Ctracer或Ntracer表示施加示踪剂中C或N的物质的量(mol)。
13C或15N的原子丰度atom%与δ13C和δ15N自然丰度的换算公式为[19]:
| $ \text{Atom%} = \frac{{(\delta \chi {\text{ + }}1000) \times {R_{{\text{ref}}}}}}{{((\delta \chi {\text{ + }}1000) \times {R_{{\text{ref}}}}{\text{ + }}1000)}} \times 100 $ | (4) |
式中,δ χ(‰)分别为δ13C和δ15N的自然丰度,Rref同式(1)。
1.7 统计分析使用单因素方差分析(One-way ANOVA)和LSD多重比较分析不同停留时间的水稻或生物质炭的δ13C和δ15N的差异,显著性水平均设为P < 0.05。统计分析使用软件SPSS 22.0,使用Origin 2017进行作图。
2 结果 2.1 标记的停留时间对水稻和生物质炭δ13C的影响水稻地上部分13C的回收率仅在停留时间从6 h增至24 h时,回收率出现显著增加,由17.6%增至21.0%,增加了19%(P < 0.05,n=3);而地下部分13C的回收率在24 h出现最高值,相较于4 h和6 h分别显著增加了1 059%和725%(P < 0.05,n=3)(表 1)。总体而言,水稻地上部分13C的回收率均高于地下部分(表 1)。从地上和地下部分的总回收率看,13C回收率在标记停留24 h时最高,为37.5%(表 1)。
|
|
表 1 停留时间为4 h、6 h、24 h的标记水稻地上部分和地下部分13C的回收率 Table 1 Recovery of 13C of aboveground and underground tissues of labeled rice plants harvested at the residence time of 4 h, 6 h, and 24 h, respectively |
对水稻植株地上部分的δ13C而言,停留时间由4 h增至6 h,δ13C由872‰降至565‰,降低了35%(P < 0.05,n=3),但停留时间由6 h继续增加至24 h时,δ13C并无明显变化(图 1a)。随着停留时间的增加,水稻地上部分制备的BC300-δ13C和BC500-δ13C均呈现先减少后增加的趋势(图 1a)。对水稻植株地下部分的δ13C而言,停留时间由4 h增至6 h,δ13C无显著变化,但停留时间由6 h增至24 h时,δ13C由125‰增至868‰,显著增加了594%(P < 0.05,n=3,图 1b)。停留时间为4 h和24 h时,水稻地下部分δ13C分别为地上部分δ13C的26%和1.5倍(图 1)。随着停留时间的增加,水稻地下部分制备的BC300-δ13C呈现增加的趋势,BC500-δ13C呈现先减少后增加的趋势(图 1b)。

|
注:图中误差线为平均值的标准误,n=3。不同小写字母表示相同停留时间、不同材料(水稻、BC300、BC500)之间存在显著性差异,P < 0.05;不同大写字母表示不同停留时间(4 h、6 h、24 h)、相同材料之间存在显著性差异,P < 0.05。下同。 Note: Vertical bars denote the standard errors of the means, n=3. Within one residence time, different lowercase letters denote significant differences between different materials(rice plants, BC300 and BC500), P < 0.05;Within one material, different uppercase letters denote significant differences between different residence times(4 h, 6 h and 24 h), P < 0.05. The same below. 图 1 停留时间为4 h、6 h、24 h的标记水稻的地上部分(a)和地下部分(b)及其在300℃和500℃制备的生物质炭的δ13C Fig. 1 δ13C values of the aboveground(a)and underground(b)tissues and the biochars produced at 300℃ and 500℃ from the tissues of the labelled rice plants harvested at the residence time of 4 h, 6 h, and 24 h, respectively |
随着停留时间由4 h增至24 h,水稻地上部分制备的BC300的DOC-δ13C提高了25.4%(P < 0.05,n=3),残留固体-δ13C提高了33.7%(P < 0.05,n=3),DOC-δ13C较残留固体-δ13C降低的比例由4.14%(P > 0.05,n=3)增至11.0%(P < 0.05,n=3)(图 2)。对于BC500而言,DOC-δ13C显著增加了15.7%(P < 0.05,n=3),残留固体-δ13C在不同停留时间的差异很小,DOC-δ13C较残留固体-δ13C降低的比例从32.3%(P < 0.05,n=3)降至18.9%(P < 0.05,n=3)(图 2)。
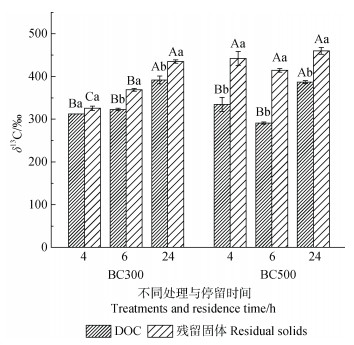
|
注:不同小写字母表示相同停留时间、相同制备温度的生物质炭,DOC和残留固体之间的显著性差异,P < 0.05;不同大写字母表示相同制备温度的生物质炭的相同组分,不同停留时间之间的显著性差异,P < 0.05。图中误差线为平均值的标准误,n=3。 Note: Within one residence time and one biochar, different lowercase letters denote significant differences between DOC and residual solids, P < 0.05;Within one component of one biochar, different uppercase letters denote significant differences between different residence times, P < 0.05. Vertical bars denote the standard errors of the means, n=3. 图 2 停留时间为4 h、6 h、24 h的标记水稻的地上部分分别在300℃(BC300)和500℃(BC500)制备的生物质炭的热水可提取有机碳(DOC)和残留固体的δ13C Fig. 2 δ13C values of hot water extractable dissolved organic carbon(DOC)and the residual solid of the biochars produced at 300℃(BC300)and 500℃(BC500), respectively from the aboveground tissues of labeled rice plants harvested at residence times of 4 h, 6 h and 24 h, respectively |
随着停留时间的延长,水稻地上部分15N的回收率与δ15N丰度变化相似,均呈现先增加后降低的趋势,在6 h时,回收率达到最高值77.5%(表 2)。水稻地下部分15N的回收率则在停留时间为24 h时达到最高值24.8%,相较于4 h和6 h显著增加了294%和179%(P < 0.05,n=3)。从地上和地下部分的总回收率看,15N的回收率在停留6 h时最高,为86.4%,但与停留24 h的相差并不显著(P > 0.05,n=3,表 2)。
|
|
表 2 停留时间为4 h、6 h、24 h的标记水稻地上部分和地下部分15N的回收率 Table 2 Recovery of 15N of aboveground and underground tissues of labeled rice plants harvested at the residence time of 4 h, 6 h, and 24 h, respectively |
随停留时间的延长,水稻植株地上部分的δ15N呈现先升高后降低的趋势,在6 h处理时达最高值1 764‰(图 3a)。停留时间为4 h和6 h的水稻地上部分制备成生物质炭后,BC300-δ15N分别较水稻植物材料降低了24%和44%,BC500-δ15N则分别较植物材料降低6%和32%(图 3a)。随着停留时间的延长,水稻地上部分制备的BC300-δ15N不断增加,而BC500-δ15N先增加后降低(图 3a)。水稻地下部分的δ15N的变化趋势与地上部分相反,呈现先降低后增加的趋势(图 3b)。水稻植物地下部分制备为生物质炭后,停留时间对BC300-δ15N和BC500-δ15N没有明显影响(图 3b)。
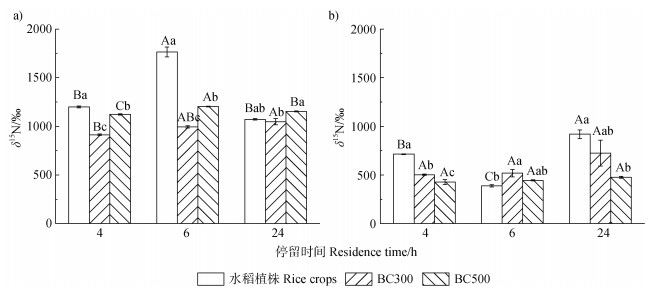
|
图 3 停留时间为4 h、6 h和24 h的标记水稻的地上部分(a)和地下部分(b)及其在300℃和500℃制备的生物质炭的δ15N Fig. 3 δ15N values of the aboveground(a)and underground(b)tissues and the biochars produced at 300℃ and 500℃ from the tissues of the labelled rice plants harvested at the residence time of 4 h, 6 h and 24 h, respectively |
Tahir等[15]研究发现,豌豆、小麦和野豌豆标记后13C在植物与土壤的总回收率在34.7%~44.8%范围内,且13C在土壤中的分配率较低[15],本研究中24 h处理的水稻总13C回收率(37.5%)接近该研究报道。同时,停留时间的延长能显著提高水稻根系部分13C的回收率,这也说明了水稻同化13C的向下运输现象。本研究发现,随着停留时间的延长,水稻植株地上部分的δ13C降低而地下部分的δ13C升高(图 1),与以往的研究结果相符[24-25],也与我们提出的研究假设1相符。水稻通过光合作用将13CO2同化,随着停留时间的延长,这些被水稻所同化的13C会向下运输到地下部分用于根系的生长和呼吸[22,24],甚至部分会转移至土壤中累积成为土壤有机碳[26-27]。
叶面施肥后,不同停留时间的水稻地上部分15N的回收率在文献报道的30%~89.5%的范围内[18,28-29]。由于水稻对15N的吸收需要一段时间并且随着时间的延长15N发生向下运输,当停留时间为6 h时,地上部分15N的回收率最高。随停留时间的延长,水稻地上部分的δ15N呈现先增加后降低的趋势,而地下部分呈现相反的趋势,说明水稻的δ15N和δ13C随停留时间的变化规律不同,这与我们的研究假设1不相符。叶面施尿素后,尿素中的氮会在叶片内同化形成氨基酸或其他可溶性氮,然后被转移到植物体内需氮的组织中[30],如优先分配给嫩枝、嫩叶、果实等新生器官或生长中心以供生长[31],并最终会以多种营养蛋白形式储存[32]。所以,水稻不同的氮代谢和碳代谢过程决定了停留时间对地上和地下部分的13C和15N丰度的影响不同。本研究中,水稻植株叶面喷施15N尿素后的第6 h时就出现了水稻地上部分最大的δ15N(图 3a)。但是,李延菊等[20]采用叶面喷施的方法发现油桃叶面在停留24 h后产生最大的δ15N。不同的研究结果可能是由于不同植物和器官对氮的代谢不同而导致。
3.2 标记的停留时间对水稻制备的生物质炭的δ13C和δ15N的影响有研究表明,热解温度越高生物质炭的δ13C也会越高,这是因为秸秆燃烧过程中优先释放12CO2气体,造成残留部分13C的富集[33]。这与本研究中水稻地上部分制备的BC500-δ13C高于BC300-δ13C的结果一致(图 1a)。整体而言,植物地上和地下部分制备的两种温度生物质炭的δ13C均在停留时间为24 h时最高,且没有出现水稻植株地上与地下部分δ13C的此消彼长的规律(图 1),这与研究假设2符合。Krull等[34]也提出炭化后植物材料的同位素丰度特征可能与植物不一致。随着停留时间的延长,光合同化为简单糖类的13C会进一步转化为植物其他组分[35-36]。因此,停留时间能够影响植物不同化学组分的δ13C[37]。而且,制炭热解过程中这些化学组分损失的程度也不同[12],高温生物质一般含有更少的易分解碳和更多的芳基碳[6,17]。因此,受到标记后停留时间和制炭温度的共同影响,停留时间对水稻原料的δ13C和制备成的生物质炭的δ13C的影响不同。随停留时间的延长,BC300-δ13C均匀性出现降低的趋势,BC500-δ13C的均匀性呈现增加的趋势(图 2),这与我们所提出的研究假设3不相符,这与不同热解温度下植物组分的热化学过程和同位素分馏有关。
水稻地上部分制备的BC500-δ15N均显著高于BC300-δ15N,这与δ13C的结果相同(图 3a和图 1a)。Taghizadeh-Toosi等[38]使用15N标记后的松树材料制备生物质炭,同样发现高温(500℃)生物质炭-δ15N高于低温(350℃)生物质炭-δ15N。但是,Yuan等[39]的研究认为制备温度越高,生物质炭15N的损失也越多。与水稻植株地上部分的δ15N相比,停留24 h后制备的生物质炭δ15N降幅在3种处理中最低(图 3a),同样,这一现象也出现在生物质炭的δ13C(图 1a),说明延长停留时间能够提高水稻地上部分制备的生物质炭的同位素丰度,减少制备过程中同位素的损失。这可能是因为标记后的停留时间越长,植物同化的15N和13C更多地进入在热解过程中不易损失的植物难分解组分[35-36]。
4 结论随着停留时间的延长,由于植物光合吸收的13C向下运输,水稻植株地上部分的δ13C降低而地下部分的δ13C升高。但是,水稻植株δ15N并不遵循与δ13C相同的变化规律。与水稻原料的δ13C和δ15N相比,制炭过程能够引起生物质炭的同位素丰度的降低。由于水稻热解过程的影响,停留时间对水稻的δ13C和δ15N的影响特征并不能延续至生物质炭。停留时间的延长降低了水稻地上部分在300℃制备的生物质炭的13C均匀性,但提高了500℃制备的生物质炭的13C均匀性。
| [1] |
LeBauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed[J]. Ecology, 2008, 89(2): 371-379. DOI:10.1890/06-2057.1
(  0) 0) |
| [2] |
Bhattacharya S S, Kim K H, Das S, et al. A review on the role of organic inputs in maintaining the soil carbon pool of the terrestrial ecosystem[J]. Journal of Environmental Management, 2016, 167: 214-227.
(  0) 0) |
| [3] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota - A review[J]. Soil Biology & Biochemistry, 2011, 43(9): 1812-1836.
(  0) 0) |
| [4] |
Lehmann J. A handful of carbon[J]. Nature, 2007, 447(7141): 143-144. DOI:10.1038/447143a
(  0) 0) |
| [5] |
Rütting T, Huygens D, Staelens J, et al. Advances in 15N-tracing experiments: New labelling and data analysis approaches[J]. Biochemical Society Transactions, 2011, 39(1): 279-283. DOI:10.1042/BST0390279
(  0) 0) |
| [6] |
Lu W W, Zha Q Z, Zhang H L, et al. Changes in soil microbial communities and priming effects induced by rice straw pyrogenic organic matter produced at two temperatures[J]. Geoderma, 2021, 400: 115217. DOI:10.1016/j.geoderma.2021.115217
(  0) 0) |
| [7] |
Weng Z, Liu X H, Eldridge S, et al. Priming of soil organic carbon induced by sugarcane residues and its biochar control the source of nitrogen for plant uptake: A dual 13C and 15N isotope three-source-partitioning study[J]. Soil Biology & Biochemistry, 2020, 146: 107792.
(  0) 0) |
| [8] |
Kim T H, Takebe M, Engelaar W M H G, et al. Interaction between assimilations of fixed carbon and newly absorbed nitrate estimated by 13C and 15N tracing in intact spinach[J]. Journal of Plant Nutrition, 2002, 25(7): 1527-1547. DOI:10.1081/PLN-120005406
(  0) 0) |
| [9] |
Meng M, Xu Y Y. 13C traces the dynamic distribution characteristics of photosynthetic carbon of different plants in different organ-soil systems (In Chinese)[J]. Research of Soil and Water Conservation, 2021, 28(1): 331—336, 344. [孟猛, 徐永艳. 植物光合碳在不同器官-土壤系统的动态分布特征13C示踪[J]. 水土保持研究, 2021, 28(1): 331—336, 344.]
(  0) 0) |
| [10] |
Li Y Q, Dong H L, Li P C, et al. Physiological and biochemical mechanism of 15N-urea foliage spraying in increasing the nitrogen uptake and utilization of cotton seedlings (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(6): 1553-1559. [李永旗, 董合林, 李鹏程, 等. 叶施15N-尿素增加棉花苗期氮素吸收利用的生理生化机制研究[J]. 植物营养与肥料学报, 2014, 20(6): 1553-1559.]
(  0) 0) |
| [11] |
Bird M I, Ascough P L. Isotopes in pyrogenic carbon: A review[J]. Organic Geochemistry, 2012, 42(12): 1529-1539. DOI:10.1016/j.orggeochem.2010.09.005
(  0) 0) |
| [12] |
Kim P, Hamilton C, Elder T, et al. Effect of non-structural organics and inorganics constituents of switchgrass during pyrolysis[J]. Frontiers in Energy Research, 2018, 6: 96. DOI:10.3389/fenrg.2018.00096
(  0) 0) |
| [13] |
Zhu B, Cheng W X. Rhizosphere priming effect increases the temperature sensitivity of soil organic matter decomposition[J]. Global Change Biology, 2011, 17(6): 2172-2183. DOI:10.1111/j.1365-2486.2010.02354.x
(  0) 0) |
| [14] |
Liu P, Jiang C Y, Li Z P. Quantitative research on effects of nitrogen application rate on distribution of photosynthetic carbon in rice-soil system using 13C pulse labeling technique (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(3): 567-575. [刘萍, 江春玉, 李忠佩. 13C脉冲标记定量研究施氮量对光合碳在水稻-土壤系统中分布的影响[J]. 土壤学报, 2015, 52(3): 567-575.]
(  0) 0) |
| [15] |
Tahir M M, Recous S, Aita C, et al. Field 13C pulse labeling of pea, wheat, and vetch plants for subsequent root and shoot decomposition studies[J]. Revista Brasileira de Ciência do Solo, 2018, 42: e0160449.
(  0) 0) |
| [16] |
Bromand S, Whalen J K, Janzen H H, et al. A pulse-labelling method to generate 13C-enriched plant materials[J]. Plant and soil, 2001, 235(2): 253-257. DOI:10.1023/A:1011922103323
(  0) 0) |
| [17] |
Zha Q Z, Lu W W, Hu J X. In situ stability of biochars pyrolyzed at two different temperatures in a Zelkova serrata plantation soil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 59(3): 854-863. [查全智, 卢伟伟, 胡嘉欣. 两种温度制备生物质炭在榉树人工林土壤中的原位稳定性[J]. 土壤学报, 2021, 59(3): 854-863.]
(  0) 0) |
| [18] |
Schmidt O, Scrimgeour C. A simple urea leaf-feeding method for the production of 13C and 15N labelled plant material[J]. Plant and Soil, 2001, 229: 197-202. DOI:10.1023/A:1004815404197
(  0) 0) |
| [19] |
Sha J C, Jia Z H, Xu X X, et al. Effects of nitrogen application levels on translocation and distribution of 13C-photosynthate and 15N to fruit from leaves of apple tree (In Chinese)[J]. Chinese Journal of Applied Ecology, 2019, 30(4): 1373-1379. [沙建川, 贾志航, 徐新翔, 等. 氮水平对苹果叶片13C光合产物和15N向果实转移分配的影响[J]. 应用生态学报, 2019, 30(4): 1373-1379.]
(  0) 0) |
| [20] |
Li Y J, Li X L, Gao D S, et al. Study of the absorption and distribution characteristics of 15N-urea applied to leaves of nectarine planted in greenhouse (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 2007, 13(4): 678-683. DOI:10.3321/j.issn:1008-505X.2007.04.022 [李延菊, 李宪利, 高东升, 等. 设施栽培油桃对叶面施15N的吸收、分配特性研究[J]. 植物营养与肥料学报, 2007, 13(4): 678-683.]
(  0) 0) |
| [21] |
Cheng H G, Hill P W, Bastami M S, et al. Biochar stimulates the decomposition of simple organic matter and suppresses the decomposition of complex organic matter in a sandy loam soil[J]. GCB Bioenergy, 2017, 9(6): 1110-1121. DOI:10.1111/gcbb.12402
(  0) 0) |
| [22] |
Chodak M, Khanna P, Beese F. Hot water extractable C and N in relation to microbiological properties of soils under beech forests[J]. Biology and Fertility of Soils, 2003, 39(2): 123-130. DOI:10.1007/s00374-003-0688-0
(  0) 0) |
| [23] |
Templer P H, Mack M C, Iii F S C, et al. Sinks for nitrogen inputs in terrestrial ecosystems: A meta-analysis of 15N tracer field studies[J]. Ecology, 2012, 93(8): 1816-1829. DOI:10.1890/11-1146.1
(  0) 0) |
| [24] |
Butler J L, Bottomley P J, Griffith S M, et al. Distribution and turnover of recently fixed photosynthate in ryegrass rhizospheres[J]. Soil Biology & Biochemistry, 2004, 36(2): 371-382.
(  0) 0) |
| [25] |
Wang Q Y, Zhu Z K, Yuan H Z, et al. Allocation and input efficiency of assimilated carbon in rice-soil systems at different growth stages (In Chinese)[J]. Research of Environmental Sciences, 2016, 29(10): 1471-1478. [王群艳, 祝贞科, 袁红朝, 等. 不同生育期光合碳在水稻-土壤系统中的分配及输入效率[J]. 环境科学研究, 2016, 29(10): 1471-1478.]
(  0) 0) |
| [26] |
Farrar J, Hawes M, Jones D, et al. How roots control the flux of carbon to the rhizosphere[J]. Ecology, 2003, 84(4): 827-837. DOI:10.1890/0012-9658(2003)084[0827:HRCTFO]2.0.CO;2
(  0) 0) |
| [27] |
Rees R M, Bingham I J, Baddeley J A, et al. The role of plants and land management in sequestering soil carbon in temperate arable and grassland ecosystems[J]. Geoderma, 2005, 128(1/2): 130-154.
(  0) 0) |
| [28] |
Tran T S, Giroux M. Fate of 15N-labelled fertilizer applied to corn grown on different soil types[J]. Canadian Journal of Soil Science, 1998, 78(4): 597-605. DOI:10.4141/S97-086
(  0) 0) |
| [29] |
Shen Q R, Xu G H. Foliar absorption and translocation of labelled urea-15N in corn and wheat (In Chinese)[J]. Acta Pedologica Sinica, 2001, 38(1): 67-74. DOI:10.3321/j.issn:0564-3929.2001.01.010 [沈其荣, 徐国华. 小麦和玉米叶面标记尿素态15N的吸收和运输[J]. 土壤学报, 2001, 38(1): 67-74.]
(  0) 0) |
| [30] |
Dong S F, Cheng L L, Scagel C F, et al. Nitrogen absorption, translocation and distribution from urea applied in autumn to leaves of young potted apple(Malus domestica)trees[J]. Tree Physiology, 2002, 22(18): 1305-1310. DOI:10.1093/treephys/22.18.1305
(  0) 0) |
| [31] |
Martínez-Alcántara B, Iglesias D J, Reig C, et al. Carbon utilization by fruit limits shoot growth in alternate- bearing citrus trees[J]. Journal of Plant Physiology, 2015, 176: 108-117. DOI:10.1016/j.jplph.2014.12.001
(  0) 0) |
| [32] |
Millard P, Sommerkorn M, Grelet G A. Environmental change and carbon limitation in trees: A biochemical, ecophysiological and ecosystem appraisal[J]. New Phytologist, 2007, 175(1): 11-28. DOI:10.1111/j.1469-8137.2007.02079.x
(  0) 0) |
| [33] |
Liu Y P. Effect of black carbon addition on soil organic carbon decomposition[D]. Fuzhou: Fujian Normal University, 2011.[刘燕萍. 黑碳添加对土壤有机碳分解的影响[D]. 福州: 福建师范大学, 2011.]
(  0) 0) |
| [34] |
Krull E S, Skjemstad J O, Graetz D, et al. 13C-depleted charcoal from C4 grasses and the role of occluded carbon in phytoliths[J]. Organic Geochemistry, 2003, 34(9): 1337-1352. DOI:10.1016/S0146-6380(03)00100-1
(  0) 0) |
| [35] |
Keel S G, Campbell C D, Högberg M N, et al. Allocation of carbon to fine root compounds and their residence times in a boreal forest depend on root size class and season[J]. New Phytologist, 2012, 194(4): 972-981. DOI:10.1111/j.1469-8137.2012.04120.x
(  0) 0) |
| [36] |
Streit K, Rinne K T, Hagedorn F, et al. Tracing fresh assimilates through Larix decidua exposed to elevated CO2 and soil warming at the alpine treeline using compound-specific stable isotope analysis[J]. New Phytologist, 2013, 197(3): 838-849. DOI:10.1111/nph.12074
(  0) 0) |
| [37] |
Soong J L, Reuss D, Pinney C, et al. Design and operation of a continuous 13C and 15N labeling chamber for uniform or differential, metabolic and structural, plant isotope labeling[J]. Journal of Visualized Experiments, 2014(83): e51117.
(  0) 0) |
| [38] |
Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. Biochar adsorbed ammonia is bioavailable[J]. Plant and Soil, 2012, 350(1/2): 57-69.
(  0) 0) |
| [39] |
Yuan S N, Huang Q Y, Tan Z X. Study of the mechanism of migration and transformation of biochar-N and its utilization by plants in farmland ecosystems[J]. ACS Sustainable Chemistry & Engineering, 2019, 7(21): 17606-17615.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


