土壤微生物是生态系统的重要组成部分,驱动和影响土壤物质循环、能量流动和信息传递等诸多生态系统过程,其物种及功能多样性是影响生态系统稳定性的关键因子[1]。群落构建(Community assembly)过程决定了微生物组成和多样性,进而影响其生态功能与服务[2-3]。随机性过程和确定性过程共同驱动微生物群落构建,二者之间形成此消彼长的连续体,确定性过程强调环境和生物因素对物种的可预测过滤作用,而随机性过程则是通过随机的扩散、出生、死亡和漂移进行的[4]。近年来,应用生态过程理论解释不同时空尺度下微生物群落演替机制的相关研究取得了一系列进展[3, 5],并且用于评价农田生态系统可持续性,从微生物群落层面为解析农业生产体系与土壤功能稳定性提供了新视角。刘文静等[6]指出旱作、水旱轮作、稻田三种生态系统微生物群落构建中随机性过程从20%增至50%,随着确定性过程主导向随机性过程主导转变,细菌多样性及物种生态网络的交互度和稳定性均显著提高,阐明了稻田可持续性生态系统的微生物学机制。但总体上,随机性过程和确定性过程之间的平衡机制(或称为相对重要性)及其对环境变化的响应仍是目前生态学最具争议的问题[3],土壤微生物群落构建对维持土壤多功能性和生态系统服务重要性的研究仍处于初级阶段,现有的理论和模型均需在更多的微生物类群(特别是有重要生态功能的微生物)和更广泛的时空尺度上(尤其是特殊生境)进行验证[7]。
丛枝菌根(Arbuscular mycorrhiza,AM)真菌是一类在土壤中广泛存在的专性共生真菌,能与绝大多数陆地植物形成互惠互利的共生关系,从而促进植物养分吸收、提高植物的多种抗逆性、影响地上及地下生物群落结构、改善土壤结构、调控生物地球化学循环等[8],而AM真菌这些生理生态功能高度依赖其群落多样性,甚至有研究者认为AM真菌多样性是衡量生态系统可持续性的重要指标之一[9],因此它们的物种多样性、群落构建机制及其与环境相互作用的研究越来越受重视。目前普遍认为AM真菌多样性及群落结构受多种与确定性过程相关的因素驱动:例如土壤性质(pH、养分、水分)、气候因素(光照强度、温度、CO2浓度)等非生物因素[10],以及宿主植物特性等生物因素[11]。同时,随机性过程也影响AM真菌群落构建,例如扩散限制[10]。群落构建验证方法也从传统的基于物种丰度的分布模型发展到结合物种进化历史的谱系分析、共生网络分析等一系列更复杂的统计模型[9]。然而,尽管从理论和方法上均取得了长足的进步,对于不同生境和时空尺度下随机性过程和确定性过程在AM真菌多样性维持、群落构建以及平衡机制对环境变化的响应仍知之甚少,极大地限制了对生物多样性影响生态系统稳定性和可持续性根源的认识[7]。
设施大棚是一种半开放的特殊农业生境,加之不合理的水肥管理,极易出现土壤退化等生态环境问题,使得我国设施生态系统可持续性受到不同程度的威胁[12]。相较于传统理化指标,土壤微生物对环境变化更敏感。研究表明,设施农业土壤微生物多样性随种植年限增加而显著降低[13],且群落结构发生退化(例如土壤细菌与真菌比值降低、有益菌群减少、病原微生物数量增加等)[14]。近年来,AM真菌作为“生物肥料”、“生物农药”及其具有的在生态环境改善方面的潜在作用,在设施农业中开始得到广泛关注。但与农田相比,设施土壤微生物研究在我国起步较晚,对不同设施生产条件及设施蔬菜种类下土壤AM真菌群落结构与功能的变化认识仍有很大的局限性,群落构建机制更鲜有报道。因此,为阐明AM真菌多样性和群落构建机制对设施蔬菜高集约化生产方式的响应规律,本研究选取河北省饶阳县设施番茄不同生长季(休耕期、花期、果期)土壤为研究对象,利用Illumina MiSeq高通量测序技术探索设施土壤AM真菌多样性和群落构建机制及其对不同环境变化的响应规律,对揭示设施蔬菜栽培条件引起的土壤质量退化及其过程中的微生物组演变规律具有重要意义,为保持和恢复设施土壤功能提供科学依据。
1 材料与方法 1.1 试验区概况研究区位于衡水国家农业科技园区河北省农林科学院饶阳试验基地(38°16′14″N,115°50′82″E),该区设施蔬菜种植规模居河北省第一,典型种植模式为秋冬茬番茄-冬春茬甜瓜轮作,一年两茬。研究区地属冀中平原黑龙港流域,地貌类型为滹沱河洪积平原,土壤类型为潮土,质地为砂壤。年均温12.2℃,年均降雨量552.6 mm,属于温带大陆季风气候。
1.2 试验设计定位试验开始于2018年6月,番茄于每年7月底施入牛粪加复合肥作为底肥,每穗果坐果后追化肥一次(共5次),N、P2O5、K2O总投入量为775、420、1 150 kg·hm–2;甜瓜于每年1月中旬施入羊粪加复合肥作为底肥,坐果后每2~3周追化肥一次(共6次),N、P2O5、K2O总投入量为800、450、1 200 kg·hm–2;每年6月30日至7月15日进行漫灌高温闷棚(水深20 cm左右、棚内气温60~70℃),之后进行通风。
2020年番茄季(定位试验第三年第五茬)进行土壤样品采集,分别于7月28日(休耕期)、9月17日(花期)和12月4日(果期)采样。其中,休耕期取样在底肥施用前3天进行,从南到北随机选取9个样方(1 m×1 m),每个样方随机采集3个表层土壤(0~20 cm)样品混合为一个样品;花期取样在追施平衡肥(N 17%、P2O5 17%、K2O 17%)之后7天进行,果期取样在追施高钾肥(N 20%、P2O5 4%、K2O 34%)之后6天进行,考虑到生育期追肥灌溉均为从东向西畦灌(10 m),可能引起东、西养分差异,花期和果期增加取样样点,分别在大棚偏东和偏西的部分各选取9个样方(1 m×1 m),即每次18个样方,每个样方随机采集3个表层土壤(0~20 cm)样品混合,3个生育期共采集45个土壤样品(9 + 18 + 18)。采集的土壤样品放入冰盒带回实验室,过2 mm筛,分成两份,一份–20℃保存,用于微生物测定,一份4℃保存,用于土壤化学性质测定。
1.3 测定项目与方法土壤化学性质测定参照《土壤农化分析》[15],全氮测定采用凯氏法,硝态氮采用酚二磺酸比色法,全磷采用氢氧化钠熔融—钼锑抗比色法,Olsen-P用0.5 mol·L–1 NaHCO3(pH = 8.5)溶液浸提(土水比w/v 20︰1)钼锑抗比色法,全钾用碱熔—火焰光度法,水溶性盐采用电导法,有机质用油浴加热重铬酸钾氧化—容量法,土壤pH用1 mol·L–1 KCl浸提(土水比w/v 1︰2.5)电位法测定。
土壤温湿度变化采用BL141高精度空气土壤温湿度监测系统测量,传感器埋于距离陇上15 cm的土壤中,日平均温湿度为当天从0:00至23:50共144个数据的平均值(每10 min采集一次数据)。
1.4 土壤高通量测序和序列处理采用E.Z.N.A.® soil DNA kit(Omega Bio-tek,Norcross,GA,美国)试剂盒提取土壤DNA,用NanoDrop 2000测定DNA浓度和纯度。AM真菌扩增采用巢式PCR,第一对引物为AML1F(5'-ATC AACTTTCGATGGTAGGATAGA-3')和AML2R(5'- GAACCCAAACACTTTGGTTTCC-3'),第二对引物为AMV4-5NF(5'-AAGCTCGTAGTTGAATTTCG-3')和AMDGR(5'-CCCAACTATCCCTATTAATCAT-3')。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。测序获得的原始序列经过QIIME平台筛选和序列优化后,依据97%的相似度聚类成操作分类单元(Operational taxonomic unit,OTU)(UPARSE 7.1)。将OTU代表序列与MaarjAM数据库进行BLAST,保留覆盖率(Query coverage) > 97%、一致性(Identity) > 97%、期望值(E-value) < 1e-50的序列;将不符合的序列再与GenBank数据库进行BLAST,保留覆盖率≥ 90%、一致性≥ 90%、期望值< 1e-50的序列,以数据库对比结果确定分类学信息。最后,删除序列数小于等于5的OTU以及unidentified序列[16]。将所有样品基于序列数13300进行抽平和后续计算。
1.5 数据处理采用单因素方差分析(one-way ANOVA)比较不同生长季对土壤性质、AM真菌α多样性及相对多度的影响,并用LSD检验(方差齐性)或Games- Howell(方差非齐性)检验进行多重比较,在SPSS 18.0中进行。采用R软件vegan程序包计算AM真菌α多样性和群落结构,OTU丰富度、Shannon多样性指数和Pielou均匀度指数采用“diversity”函数计算,采用“metaMDS”函数进行非度量多维度分析(Non-metric multidimensional scaling analysis,NMDS)计算基于物种组成(OTU)的AM真菌群落在不同生长季的Bray-Curtis相异指数,群落数据进行平方根转化。采用“adonis”函数进行置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)检验组间差异显著性,置换次数999[17]。AM真菌谱系多样性和结构采用R软件picante程序包计算,分析前将所有OTU代表序列在mega 6.0中构建谱系树,Faith谱系多样性指数(Phylogenetic diversity,PD)指在一个局域群落内所有物种(OTU)在谱系树上所占枝长的总和[18],采用“pd”函数计算。平均成对谱系距离(Mean pairwise phylogenetic distance,MPD)表示同一群落内AM物种(OTU)在系统发育树上距离的平均值,采用“ses.mpd”函数计算;以不同群落间MPD,即βMPD,表征不同AM真菌群落谱系结构差异,采用“comdist”函数计算[19]。以净亲缘关系指数(Net relatedness index,NRI)表征群落谱系结构,通过与零进行显著性检验推测AM真菌群落构建过程,NRI指数的计算原理是先计算出样方中所有OTU对儿的MPD,然后保持OTU数量及相对多度不变,将小样方中OTU从全部OTU中随机抽取999次,从而获得该样方中OTU在随机零模型下的MPD分布,最后利用随机分布结果将观测值标准化,NRI= –1×(MPDsample–MPDrandsample)/SD(MPDrandsample),式中,MPDsample代表观察值,MPDrandsample代表随机抽取999次MPD的平均值,SD为标准偏差。NRI > 0表示AM真菌群落在谱系结构上聚集,NRI < 0表示AM真菌群落谱系结构发散,NRI=0表示AM真菌在谱系结构上是随机的,NRI值与零的差异显著性采用双尾T检验(95%置信区间),在SPSS 18.0中进行[17]。采用与上述基于物种组成相同的方法,进行基于谱系结构(βMPD)的NMDS和PERMANOVA分析,计算不同生长季AM真菌谱系结构差异[19]。基于物种组成(Bray-Curtis距离)和谱系组成(βMPD)的AM真菌多样性和群落结构与土壤/环境(经标准化后的Euclidean距离)之间的关系采用Mantel检验计算,在R软件“ecodist”函数中进行,置换次数1 000[20]。采用Sloan中性群落模型(Neutral community model,NCM)进一步验证随机性过程对AM真菌群落构建的潜在重要性,该模型将局域群落观测到的OTU出现频率和它们在源群落(Metacommunity)中的多度(以所有局域群落中平均相对多度估算)关系进行拟合,R2越高代表随机性过程在群落构建中占比越大,采用R软件“minpack.lm”程序包中非线性最小二乘法(Non- linear least squares,NLS)拟合模型参数,用“HMisc”程序包中Wilson score interval计算95%置信区间[21]。
2 结果 2.1 不同生长季土壤性质变化土壤性质随生长季显著变化,其中休耕期pH和土壤养分(有机碳、全氮、全磷、全钾、有效磷)、盐分显著低于生育期,而土壤温湿度显著高于生育期(表 1)。花期土壤全氮、全磷和有效磷显著低于果期,土壤温度显著高于果期(表 1)。
|
|
表 1 不同生长季土壤性质 Table 1 Soil properties across growing stage |
从不同生长季45个土壤样本中测序得到1 436 136条序列,平均长度247 bp。其中,AM真菌序列1 145 764条,经过一系列筛选最终保留773 060条AM真菌序列进行后续分析,共划分为96个OTUs,鉴定为8个属,分别为球囊霉属Glomus、原囊霉属Archaeospora、近明球囊霉属Claroideoglomus、两性囊霉属Ambispora、无梗囊霉属Acauspora、多孢囊霉属Diversispora、盾巨孢囊霉属Scutellospora和类球囊霉属Paraglomus。
AM真菌α多样性随生长季发生显著变化,且基于物种组成和谱系组成的指标均表现为休耕期显著高于生育期(花期、果期),从休耕期到花期、果期,AM真菌丰富度、Shannon多样性和Pielou均匀度分别显著下降了42.82%~59.18%、43.25%~48.31%和17.46%~25.40%(表 2),谱系多样性(PD)和平均成对谱系距离(MPD)分别显著下降了57.14%~67.86%和50.00%(表 2)。
|
|
表 2 不同生长季AM真菌物种和谱系α多样性指数 Table 2 Taxonomic and phylogenetic α-diversity indices of AM fungal communities at different growing stages |
AM真菌群落组成也随生长季显著变化,从图 1看出球囊霉属和原囊霉属虽然都是设施土壤AM真菌的优势种群,但两者相对多度随生长季动态变化规律不同,其中,球囊霉属从休耕期到花期、果期相对多度显著增加了1.4倍~1.8倍,而原囊霉属相对多度从休耕期到花期增加了1.4倍,但与果期差异不显著。此外,近明球囊霉属和类球囊霉属相对多度均呈现从休耕期到生育期显著下降的规律。
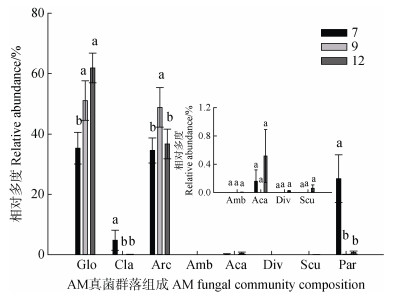
|
注:Glo:球囊霉属;Cla:近明球囊霉属;Arc:原囊霉属;Amb:两性囊霉属;Aca:无梗囊霉属;Div:多孢囊霉属;Scu:盾巨孢囊霉属;Par:类球囊霉属。7:7月(休耕期),9:9月(花期),12:12月(果期)。不同小写字母表示生长季间差异显著(P < 0.05)。下同。 Note: Glo: Glomus; Cla: Claroideoglomus; Arc: Archaeospora; Amb: Ambispora; Aca: Acauspora; Div: Diversispora; Scu: Scutellospora; Par: Paraglomus. 7:July(fallow), 9:September(flowering), 12:December(fruiting). Different lowercase letters indicated a significant difference between different growing stages at P < 0.05. The same below. 图 1 不同生长季AM真菌属水平相对多度差异 Fig. 1 Variations in the relative abundance of AM fungal genus at different growing stages |
从NMDS结果可以看出,无论是基于物种组成还是谱系组成的AM真菌群落结构均受生长季显著影响,休耕期AM真菌群落显著差别于花期和果期(图 2)。置换多元方差分析(PERMANOVA)结果也表明生长季对AM真菌群落结构影响显著(物种组成:R2 = 0.285,P = 0.001;谱系组成:R2 = 0.204,P = 0.020),但花期和果期之间AM真菌群落差异不显著(物种组成:R2 = 0.019,P = 0.619;谱系组成:R2 = 0.023,P = 0.568)。
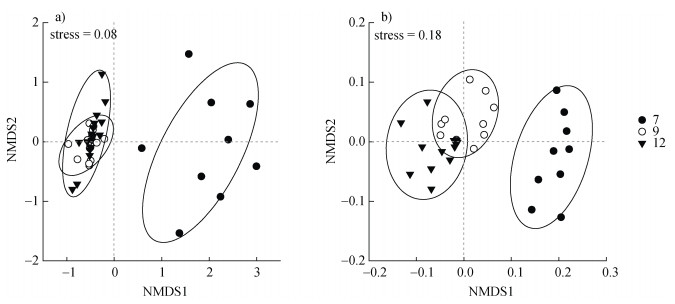
|
图 2 生长季基于物种组成(a)和谱系组成(b)的AM真菌群落NMDS分布图 Fig. 2 Non-metric multidimensional scaling(NMDS)plot of AM fungal community dissimilarities among different growing stages using the data of OTU composition(a)and phylogenetic composition(b) |
无论是基于物种组成还是谱系组成的AM真菌多样性和群落结构均与土壤性质显著相关,表 3可以看出,pH与AM真菌多样性和群落结构指标均呈显著/极显著相关关系,且相关系数较高,强烈影响AM真菌群落。除了土壤硝态氮,AM真菌α多样性与土壤养分含量(有机碳、全量氮磷钾和有效磷)、盐分均呈显著负相关,与土壤温湿度显著正相关(表 3)。
|
|
表 3 基于物种组成和谱系组成的AM真菌α多样性和群落结构与土壤性质的相关分析 Table 3 Relationship between soil properties and taxonomic and phylogenetic α-diversity indices and community dissimilarity of AM fungi |
生长季显著改变了AM真菌群落构建过程。休耕期NRI = 0,表明群落构建初期AM真菌在谱系结构上是随机的,进入番茄生育期后随着扰动增加(例如施肥、翻耕等)受环境选择更强,NRI > 0,谱系结构呈现聚集状态(图 3)。优势度检验结果也表明休耕期AM真菌相对于花期和果期更符合中性群落模型(图 4),即随机性过程在休耕期AM真菌群落构建中发挥更主要作用,而生育期群落构建则由确定性过程主导,与NRI结果相一致。

|
注:星号表明NRI显著大于零(双尾T检验),ns不显著,*** P < 0.001。 Note: Asterisk indicates that the NRI is significantly greater than zero after the two-way t-test(ns, non-significant; ***P < 0.001). 图 3 生长季对AM真菌群落净亲缘关系指数的影响 Fig. 3 The net relatedness index(NRI)of AM fungal community varied across different growth stages |
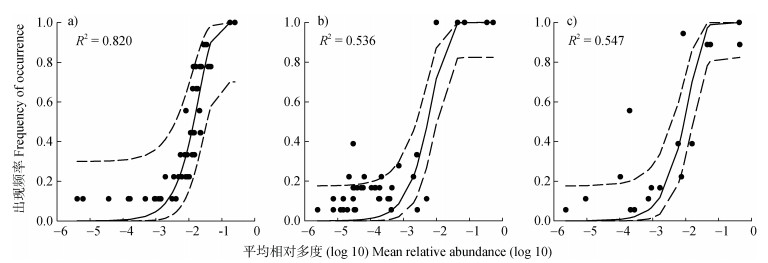
|
注:虚线表示模型预测(实线)的95%置信区间。 Note: Dashed lines represent 95% confidence intervals around the model prediction(solid line). 图 4 休耕期(a)、花期(b)和果期(c)AM真菌群落装配过程的中性群落模型 Fig. 4 Community assembly process measurements by the neutral community model at the fallow period(a), flowering stage(b)and fruiting stage(c) |
近年来,研究设施蔬菜种植过程中土壤微生物多样性、群落组成和结构变化,从而评估土壤受损程度和质量变化成为探索设施土壤质量保持和功能恢复的热点[14, 22],而土著AM真菌作为土壤微生物群落的核心组分之一,也成为评价设施蔬菜土壤健康的重要预警指标[23]。与在自然生态系统和露地农田中AM真菌群落存在显著季节性变化的结论相同[24],本研究设施农业系统中生长季也显著改变了土壤AM真菌多样性、群落组成和结构(表 2,图 1,图 2),这种群落动态变化是各物种基于生理或生态差异以其独特方式响应环境时空变化的结果[4]。以pH为例,以往研究发现球囊霉属孢子萌发、丛枝形成和根外菌丝的生长及侵染在酸性土壤中会受到抑制,因此偏好pH较高的土壤[25]。本研究高温闷棚过程中有机物厌氧分解产生的有机酸等酸性物质引起休耕期土壤pH降低,随着生育期有机肥施用等原因,土壤恢复至中性或碱性(表 1),pH的升高可能是导致球囊霉属相对多度从休耕期到生育期显著增加的原因(图 2),球囊霉属在花期和果期迅速增殖成为绝对优势种(Overdominance),引起群落均匀度降低和多样性下降(图 1,表 2)。与球囊霉属相反,类球囊霉属在碱性土壤中产孢和与宿主互惠功能的发挥均会受到不同程度的抑制[26],可能导致其相对多度随pH升高在花期和果期显著下降(图 1)。除了土壤pH值,AM真菌-植物共生特性决定了其群落特征对土壤养分变化也十分敏感,番茄生产需要施用大量有机肥和化肥,导致生育期土壤有机质和氮磷含量显著高于休耕期,不利于AM真菌的侵染和生长[27],可能是导致生育期多样性显著下降的另一个重要原因。同时,进入生育期后番茄的选择偏好也会影响AM真菌的群落变化。比如生育期土壤水分降低,番茄倾向于主动选择吸水能力强的类群,如球囊霉属[28]。除了土壤和宿主,生育期整地翻耕[29]、温度下降[30]也会降低AM真菌多样性并影响群落组成,比如生育期球囊霉属相对多度显著增加可能与其抗干扰能力强且增殖更快密切相关[28]。由此看出,进入生育期后,土壤性质、气候因素、宿主植物等生物及非生物因素形成强而有效的过滤器,束缚AM真菌的生态位空间,进而影响AM真菌的多样性及群落构建过程[16]。
3.2 设施蔬菜土壤AM真菌群落构建机制尽管越来越多的证据支持随机性过程和确定性过程连续体假说,但在微生物群落构建中两者之间的平衡机制(相对重要性)仍然是目前微生物生态学最具争议的问题,尤其伴随生态演替过程[3]。研究表明,环境扰动(Disturbance)会促进随机性过程/确定性过程之间平衡的时间依赖性转变[3],在次生演替初期随机性过程主导微生物群落构建,随后确定性过程的相对重要性逐渐增加直至成为主要生态过程[31],与本研究结果一致(图 3,图 4)。在休耕期随机性过程主导设施土壤AM真菌群落构建的原因可能包括:首先,淹水剧烈扰动结束后带来的生态功能等价(Ecological equivalence)显著提高随机性过程的重要性[31],同时水的流动也会促进微生物随机扩散。其次,有研究表明,随机性过程在环境压力较小的生境下起主导作用,浸泡闷棚后土体气相和液相比例改变、物理结构明显改善,同时盐分和氧化还原电位降低、速效养分下降,重新构成了相对理想的土壤化学条件[32],较低的有机质分解率等特性均使得休耕期土壤内部物质周转缓和,从而缓解了外部扰动对微生物的影响[33],促使随机性过程主导设施土壤AM真菌初期群落构建,该推论在稻田微生物群落构建中得到印证[6]。与前面提到AM真菌多样性从休耕期到生育期显著降低的原因相同,随着大量的水肥投入、翻耕等非生物因素,以及宿主选择等生物因素扰动增加,土壤环境日趋极端(例如有效磷高达500 mg·kg–1、电导率超过200 μS·cm–1),压力增加使得环境的筛选作用被强化[3],选择相似的AM真菌进入相同的生态位,导致群落呈现谱系聚集状态(图 3),随机性/确定性过程相对重要性发生转变。为揭示生物演替过程中随机性和确定性过程之间的平衡机制,各种生态模拟模型不断被提出,然而在复杂的田间系统理解我们观测到的微生物群落模式背后的生态过程平衡机制,及其对环境的变化的响应仍然面临巨大挑战,甚至对单一环境扰动引起的微生物群落变化和相应规律,不同研究结果之间都有很大差异。以施肥为例,有研究表明养分投入可以通过增强生态漂移提高随机性过程的重要性,并向微生物提供更多资源(例如碳源、能量)、缓解环境选择,从而弱化确定性过程[34],与本研究结论相反。然而,Liu等[19]指出少量养分投入可以提高AM真菌群落构建中随机性过程的重要性,但高量施肥处理中AM真菌群落构建受确定性过程主导,与本研究结论一致。Xun等[2]研究也表明随机性构建过程在高多样性群落中占主导地位,而低多样性群落中确定性过程占主导地位,并且,这一过程转变与“特异性”功能微生物的减少密切相关,故而会限制群落功能,导致其生态系统服务退化。因此,本研究也可以从群落构建的层面更好地揭示微生物群落与设施土壤质量退化的相关性,微生物群落构建初期在较高的随机性过程影响下,物种及功能多样性丰富,有利于养分循环和毒害物质降解。伴随高集约化的生产方式和不合理的田间管理,环境选择压力增加,确定性过程主导下仅一部分微生物可以在特定的生态位中定殖并发挥功能,多样性的丧失导致特异性功能显著下降,如潜在的反硝化活性和农药矿化能力,引起营养有效性降低和毒害物质积累,进一步增加环境压力,威胁设施生态系统的稳定性和可持续性。由此可见,虽然确定性过程可以强化特定环境下微生物的功能,随机性过程却可以维持更多样化的群落功能,从而促进生态系统的稳定性和可持续性[35]。因此下一步应深入研究微生物多样性维持和群落构建机制与其在生态系统功能及服务之间的相互关系,及其对不同生物及非生物因素的响应规律,为制定适宜设施农业可持续发展的田间管理提供理论支撑。
4 结论设施生态系统AM真菌群落构建受随机性过程和确定性过程共同驱动,但高集约化生产方式促进了随机性/确定性过程相对重要性发生转变,进入生育期后生物及非生物因素扰动增加,局域环境筛选作用增强,引起群落构建随机性过程下降、确定性过程增加,导致基于物种组成和谱系组成的AM真菌多样性显著降低、群落结构发生变化。土壤pH、养分(有机碳、全量氮磷钾和有效磷)、盐分含量以及土壤温湿度作为确定性因素显著影响设施土壤AM真菌群落的季相变化。未来应深入研究群落构建机制变化对其生态系统功能与服务的影响,为制定适宜设施农业可持续发展的田间管理提供理论支撑。
| [1] |
Zhang J L, Zhang J Z, Shen J B, et al. Soil health and agriculture green development: Opportunities and challenges (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(4): 783-796. [张俊伶, 张江周, 申建波, 等. 土壤健康与农业绿色发展: 机遇与对策[J]. 土壤学报, 2020, 57(4): 783-796.]
(  0) 0) |
| [2] |
Xun W B, Li W, Xiong W, et al. Diversity-triggered deterministic bacterial assembly constrains community functions[J]. Nature Communications, 2019, 10: 3833. DOI:10.1038/s41467-019-11787-5
(  0) 0) |
| [3] |
Dini-Andreote F, Stegen J C, van Elsas J D, et al. Disentangling mechanisms that mediate the balance between stochastic and deterministic processes in microbial succession[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(11): E1326-E1332.
(  0) 0) |
| [4] |
Niu K C, Liu Y N, Shen Z H, et al. Community assembly: The relative importance of neutral theory and niche theory (In Chinese)[J]. Biodiversity Science, 2009, 17(6): 579-593. [牛克昌, 刘怿宁, 沈泽昊, 等. 群落构建的中性理论和生态位理论[J]. 生物多样性, 2009, 17(6): 579-593.]
(  0) 0) |
| [5] |
Tripathi B M, Stegen J C, Kim M, et al. Soil pH mediates the balance between stochastic and deterministic assembly of bacteria[J]. The ISME Journal, 2018, 12(4): 1072-1083. DOI:10.1038/s41396-018-0082-4
(  0) 0) |
| [6] |
Liu W J, Zhang J W, Qiu C W, et al. Study on community assembly processes under paddy-upland rotation (In Chinese)[J]. Soils, 2020, 52(4): 710-717. [刘文静, 张建伟, 邱崇文, 等. 水旱轮作对土壤微生物群落构建过程的影响机制[J]. 土壤, 2020, 52(4): 710-717.]
(  0) 0) |
| [7] |
Chu H Y, Feng M M, Liu X, et al. Soil microbial biogeography: Recent advances in China and research frontiers in the world (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 515-529. [褚海燕, 冯毛毛, 柳旭, 等. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529.]
(  0) 0) |
| [8] |
Rillig M C. Arbuscular mycorrhizae and terrestrial ecosystem processes[J]. Ecology Letters, 2004, 7(8): 740-754. DOI:10.1111/j.1461-0248.2004.00620.x
(  0) 0) |
| [9] |
Jiang S J, Liu Y J, Shi G X, et al. The diversity and community assembly of arbuscular mycorrhizal fungi: A review (In Chinese)[J]. Chinese Bulletin of Life Sciences, 2014, 26(2): 169-180. [蒋胜竞, 刘永俊, 石国玺, 等. 丛枝菌根真菌物种多样性及其群落构建机制研究进展[J]. 生命科学, 2014, 26(2): 169-180.]
(  0) 0) |
| [10] |
Dumbrell A J, Nelson M, Helgason T, et al. Relative roles of niche and neutral processes in structuring a soil microbial community[J]. The ISME Journal, 2010, 4(3): 337-345. DOI:10.1038/ismej.2009.122
(  0) 0) |
| [11] |
Vályi K, Mardhiah U, Rillig M C, et al. Community assembly and coexistence in communities of arbuscular mycorrhizal fungi[J]. The ISME Journal, 2016, 10(10): 2341-2351. DOI:10.1038/ismej.2016.46
(  0) 0) |
| [12] |
Liu L, Wang L, Liu X Y, et al. Problems and countermeasures of water and fertilizer management in protected vegetables production in Hebei Province (In Chinese)[J]. Journal of Hebei Agricultural Sciences, 2017, 21(3): 59-62. [刘蕾, 王凌, 刘晓艳, 等. 河北省设施蔬菜生产中水肥管理存在的问题与发展策略[J]. 河北农业科学, 2017, 21(3): 59-62.]
(  0) 0) |
| [13] |
Liu X, Zhang J L, Gu T Y, et al. Microbial community diversities and taxa abundances in soils along a seven-year gradient of potato monoculture using high throughput pyrosequencing approach[J]. PLoS One, 2014, 9(1): e86610. DOI:10.1371/journal.pone.0086610
(  0) 0) |
| [14] |
Zhang X M, Zhang Q, Liang B, et al. Changes in the abundance and structure of bacterial communities in the greenhouse tomato cultivation system under long-term fertilization treatments[J]. Applied Soil Ecology, 2017, 121: 82-89. DOI:10.1016/j.apsoil.2017.08.016
(  0) 0) |
| [15] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [16] |
Chai Y X, Jiang S J, Guo W J, et al. The effect of slope aspect on the phylogenetic structure of arbuscular mycorrhizal fungal communities in an alpine ecosystem[J]. Soil Biology & Biochemistry, 2018, 126: 103-113.
(  0) 0) |
| [17] |
Li X L, Qi Z Q, Yu X L, et al. Soil pH drives the phylogenetic clustering of the arbuscular mycorrhizal fungal community across subtropical and tropical pepper fields of China[J]. Applied Soil Ecology, 2021, 165: 103978. DOI:10.1016/j.apsoil.2021.103978
(  0) 0) |
| [18] |
Faith D P. Conservation evaluation and phylogenetic diversity[J]. Biological Conservation, 1992, 61(1): 1-10. DOI:10.1016/0006-3207(92)91201-3
(  0) 0) |
| [19] |
Liu Y J, Johnson N C, Mao L, et al. Phylogenetic structure of arbuscular mycorrhizal community shifts in response to increasing soil fertility[J]. Soil Biology & Biochemistry, 2015, 89: 196-205.
(  0) 0) |
| [20] |
Feng M M, Adams J M, Fan K K, et al. Long-term fertilization influences community assembly processes of soil diazotrophs[J]. Soil Biology & Biochemistry, 2018, 126: 151-158.
(  0) 0) |
| [21] |
Burns A R, Stephens W Z, Stagaman K, et al. Contribution of neutral processes to the assembly of gut microbial communities in the zebrafish over host development[J]. The ISME Journal, 2016, 10(3): 655-664. DOI:10.1038/ismej.2015.142
(  0) 0) |
| [22] |
Zhang J, Wang P C, Tian H M, et al. Pyrosequencing-based assessment of soil microbial community structure and analysis of soil properties with vegetable planted at different years under greenhouse conditions[J]. Soil and Tillage Research, 2019, 187: 1-10. DOI:10.1016/j.still.2018.11.008
(  0) 0) |
| [23] |
Kapoulas N, Ilić Z S, Koukounaras A, et al. Application of arbuscular mycorrhizal inoculum in greenhouse soil with manure induced salinity for organic pepper production[J]. Acta Scientiarum Polonorum Hortorum Cultus, 2019, 18(1): 129-139. DOI:10.24326/asphc.2019.1.13
(  0) 0) |
| [24] |
Dumbrell A J, Ashton P D, Aziz N, et al. Distinct seasonal assemblages of arbuscular mycorrhizal fungi revealed by massively parallel pyrosequencing[J]. New Phytologist, 2011, 190(3): 794-804. DOI:10.1111/j.1469-8137.2010.03636.x
(  0) 0) |
| [25] |
van Aarle I M, Söderström B, Olsson P A. Growth and interactions of arbuscular mycorrhizal fungi in soils from limestone and acid rock habitats[J]. Soil Biology & Biochemistry, 2003, 35(12): 1557-1564.
(  0) 0) |
| [26] |
Lekberg Y, Meadow J, Rohr J R, et al. Importance of dispersal and thermal environment for mycorrhizal communities: Lessons from Yellowstone National Park[J]. Ecology, 2011, 92(6): 1292-1302. DOI:10.1890/10-1516.1
(  0) 0) |
| [27] |
Zhang S B, Wang Y S, Yin X F, et al. Development of arbuscular mycorrhizal(AM)fungi and their influences on the absorption of N and P of maize at different soil phosphorus application levels (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(3): 649-657. [张淑彬, 王幼珊, 殷晓芳, 等. 不同施磷水平下AM真菌发育及其对玉米氮磷吸收的影响[J]. 植物营养与肥料学报, 2017, 23(3): 649-657.]
(  0) 0) |
| [28] |
Daniell T J, Husband R, Fitter A H, et al. Molecular diversity of arbuscular mycorrhizal fungi colonising arable crops[J]. FEMS Microbiology Ecology, 2001, 36(2/3): 203-209.
(  0) 0) |
| [29] |
Jansa J, Mozafar A, Anken T, et al. Diversity and structure of AMF communities as affected by tillage in a temperate soil[J]. Mycorrhiza, 2002, 12(5): 225-234. DOI:10.1007/s00572-002-0163-z
(  0) 0) |
| [30] |
Liu L, Hart M M, Zhang J L, et al. Altitudinal distribution patterns of AM fungal assemblages in a Tibetan alpine grassland[J]. FEMS Microbiology Ecology, 2015, 91(7): fiv078. DOI:10.1093/femsec/fiv078
(  0) 0) |
| [31] |
Ferrenberg S, O'Neill S P, Knelman J E, et al. Changes in assembly processes in soil bacterial communities following a wildfire disturbance[J]. The ISME Journal, 2013, 7(6): 1102-1111. DOI:10.1038/ismej.2013.11
(  0) 0) |
| [32] |
Gu H P, Yuan X X, Chen X, et al. Effect of high temperature soaking on soil remediation and disease control in continuous cropping greenhouses (In Chinese)[J]. Jiangsu Agricultural Sciences, 2013, 41(7): 348-351. [顾和平, 袁星星, 陈新, 等. 高温浸泡土壤对连作大棚土体修复和病害防治的效果[J]. 江苏农业科学, 2013, 41(7): 348-351.]
(  0) 0) |
| [33] |
Stegen J C, Lin X J, Konopka A E, et al. Stochastic and deterministic assembly processes in subsurface microbial communities[J]. The ISME Journal, 2012, 6(9): 1653-1664. DOI:10.1038/ismej.2012.22
(  0) 0) |
| [34] |
Chase J M, Myers J A. Disentangling the importance of ecological niches from stochastic processes across scales[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2011, 366(1576): 2351-2363. DOI:10.1098/rstb.2011.0063
(  0) 0) |
| [35] |
Knelman J E, Nemergut D R. Changes in community assembly may shift the relationship between biodiversity and ecosystem function[J]. Frontiers in Microbiology, 2014, 5: 424.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61

