土壤团聚体是土壤的重要组成部分,是最基本的土壤结构单元。根据多级团聚[1]及自组装理论[2],土壤黏土颗粒在金属离子、土壤腐殖质及微生物和根系分泌的有机物质作用下,先通过胶结作用形成小的微团聚体(< 250 μm),再通过聚集形成不同粒径的大团聚体。因此,在团聚体形成过程中,有机胶结物一直被认为是团聚体形成的基础及核心[3]。在土壤环境中,除了常见的腐殖质外,微生物和根系的代谢产物糖占有很大的比例[4],可通过羟基直接与矿物晶面的氧原子形成氢键,将微小土粒胶结起来,这对团聚体形成中的粒级大小及稳定性具有重要的作用[5],而良好的团聚体结构又将对土壤肥力、养分元素循环等过程起到直接的调控作用[6]。
磷是植物生长过程中所需的大量营养元素之一[7-8],而土壤团聚体是磷素固存、释放及循环的重要载体,直接影响土壤的磷素储存容量及供磷效率[9-10]。研究表明,土壤中的磷可通过氢键、阴离子交换吸附、表面沉淀以及配位吸附等方式吸附到团聚体表面,从而调控土壤磷素的有效性[11-13]。土壤团聚体的性质,例如团聚体粒径、团聚体中有机质含量及性质均会影响团聚体对磷的吸附[9,14-15]。例如,随着土壤中 > 1 mm粒级团聚体数量的增多,旱地红壤磷素储量显著增加,磷素固持能力显著下降,土壤磷释放潜能随之增大[9]。并且土壤磷的形态与分布状况与土壤团聚体粒径有关,小团聚体含有较高的活性磷和易矿化的有机磷[16]。同时,土壤中的糖等有机质可以影响土壤微团聚体结构,进而影响团聚体的表面基团、粒径等性质,调控土壤中养分如磷的有效性[9,15]。有机质改变团聚体的表面基团后,会影响团聚体和磷的作用方式[15];改变团聚体粒径后,可以影响团聚体的比表面积,通过影响团聚体的表面活性位点来调控磷和团聚体的结合[9]。
总之,微生物及植物分泌的糖不仅对初始微团聚体的形成及后续大团聚体的组装均有重要胶结作用,而且形成后的团聚体又会对土壤中磷素固持产生影响。前期研究主要聚焦在已形成的团聚体与磷养分的关系[9,11,16],由于研究技术的局限性,鲜有研究关注纳米尺度下糖介导的微团聚体初始形成过程及对养分磷的吸附作用。因此本研究选择与蒙脱石结构类似、人工改性的纳米黏土矿物硅酸镁锂作为模式化的黏土矿物,同时选择土壤中大量存在的单糖葡萄糖以及与葡萄糖有相同分子结构和表面基团,分子量分别为5 kD和20 kD的葡聚糖(葡聚糖-5、葡聚糖-20)作为代表性的多糖。首先借助激光共聚焦拉曼光谱和原子力显微镜观察了不同分子量糖和黏土矿物形成的微团聚体结构;之后利用原子力显微镜的单分子力谱(SMFS)技术,从糖和黏土矿物之间的相互作用力的差异,揭示不同分子量糖对微团聚体形成的影响;最后测定不同微团聚体对溶液中磷素的吸附能力。本试验拟研究糖介导的土壤微团聚体形成过程及对磷素吸附固定的微观机制,以期为深入阐明团聚体与磷素的地球化学循环过程提供新方法及理论依据。
1 材料与方法 1.1 供试材料黏土矿物硅酸镁锂购买自美国毕克化学有限公司(BYK USA Inc.),三种不同分子量的糖(葡萄糖、葡聚糖-5和葡聚糖-20)购买自阿拉丁公司(上海)。试验中所需的超纯水通过三蒸处理后,再通过Milli-Q进行去离子化处理。
1.2 糖-黏土微团聚体的制备分别取5 mL浓度为5 g·L–1的硅酸镁锂和糖的母液混合,加水稀释至溶液总体积50 mL,得到糖和硅酸镁锂浓度均为0.5 g·L–1的溶液,用氯化钠调节溶液的离子强度为50 mmol·L–1,用盐酸或氢氧化钠调节溶液的pH为6。然后将混合溶液在磁力搅拌器搅拌24 h,诱导微团聚体的形成,并用于进行后续拉曼光谱及原子力显微镜(AFM)试验观察。
1.3 激光共聚焦拉曼光谱表征糖-黏土微团聚体将溶液中的微团聚体滴在锡箔纸表面沉积2 h后,用Horiba LabRAM HR800共聚焦拉曼显微镜进行表征。样品使用激光波长为532 nm、共焦孔50 μm和50倍显微镜物镜进行分析。测得的拉曼光谱数据用LabSpec 6分析软件处理。
1.4 原子力显微镜观察糖-黏土微团聚体用带正电的多聚赖氨酸修饰新解理的云母表面使其带正电,然后将微团聚体溶液滴在正电修饰的云母表面,吸附30 min后用去离子水清洗云母表面,再用氮气吹干,之后使用NanoScope V-Multimode 8型号的AFM进行微团聚体形貌观察。试验选择自动扫描模式,使用的探针型号为Scanasyst+。收集的图像使用NanoScope Analysis软件进行处理和数据分析。
1.5 单分子力谱测量糖与硅酸镁锂间的相互作用力将氨基修饰的糖用交联剂琥珀酰亚胺基6-(3-2-吡啶基二硫代-丙酰胺基)己酸酯(LC-SPDP)修饰到表面覆盖金的AFM探针(DNP-10)针尖上[17-18]。随后利用原子力显微镜的Force Volume模式,在pH为6、离子强度为50 mmol·L–1的溶液条件下测定糖和硅酸镁锂相互作用的力-距离曲线。在该过程中,需先校正针尖的弹性系数[19-20]。之后使探针以200 nm·s–1进针速度和不同的退针速度测定糖与硅酸镁锂表面的相互作用。获取力-距离曲线后,计算三种糖和黏土矿物的平衡力以及结合面积。
1.6 不同微团聚体对无机磷吸附的测定在温度为25℃的条件下,进行微团聚体对磷的吸附试验。具体步骤为在pH为6、离子强度为50 mmol·L–1、体积为45 mL不同糖处理的微团聚体溶液中(酸镁锂的浓度为0.5 g·L–1,糖的浓度为0.5 g·L–1)加入不同体积磷酸二氢钾母液,配置磷的终浓度为10 ~ 300 mg·L–1的混合溶液,然后再用盐酸或氢氧化钠调节溶液pH为6,溶液总体积为50 mL,并在该条件下反应24 h(经测定,反应后pH没有明显变化)。随后12 000 r·min–1离心20 min去除溶液底部的微团聚体,钼蓝比色法测定上清液中残余的磷浓度,计算不同糖-黏土微团聚体对磷素吸附效果,并进行等温吸附曲线拟合。
1.7 糖-黏土微团聚体Zeta电位的测定使用Zeta电位仪(Zatasizer Nano ZS90,Malvern,Worcestershire,UK)测量糖-黏土微团聚体在溶液中的Zeta电位。测试溶液pH为6,离子强度为50 mmol·L–1,糖和硅酸镁锂浓度均为0.5 g·L–1。
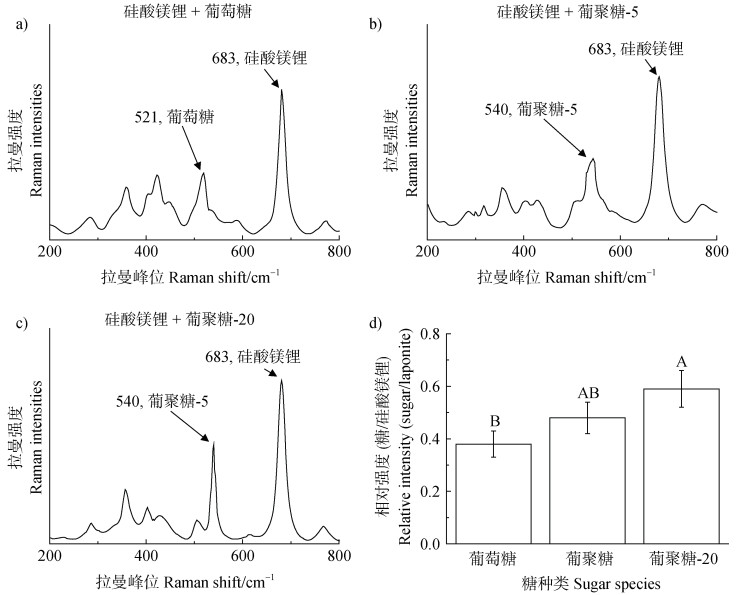
2 结果与讨论 2.1 微团聚体颗粒的表征利用拉曼光谱检测沉积在锡箔纸表面的糖-硅酸镁锂微团聚体中糖和黏土矿物相应的官能团信号强度。结果显示,样品同时包含位于683 cm–1([SiO4]晶格模型)的硅酸镁锂拉曼特征峰以及位于521 cm–1葡萄糖(CCO弯曲振动)或540 cm–1葡聚糖(CCO弯曲振动)拉曼特征峰(图 1a-图 1c)[21-23],这说明了糖-硅酸镁锂微团聚体的形成过程。在这个过程中,糖一般通过氢键、范德华力等弱相互作用和硅酸镁锂的颗粒结合,之后这些有机-矿物复合体进一步聚合,形成微团聚体结构[24]。进一步计算微团聚体中糖和硅酸镁锂拉曼峰强的比值,可以半定量分析糖在微团聚体的含量。结果表明,随着糖分子量的提升,与黏土矿物结合的糖比例逐渐升高(图 1d)。之后进一步借助原子力显微镜观察形成的糖-黏土微团聚体形貌(图 2),并且由于团聚体往往是类球状的颗粒,因此本试验利用AFM测量了微团聚体的高度来定量比较微团聚体颗粒的大小(图 2e-图 2h),结果显示,硅酸镁锂纳米颗粒会在糖的胶结作用下进一步聚合形成不同尺寸的微团聚体,其中在葡萄糖作为胶结物质时,微团聚体颗粒的高度由(3.94 ± 0.03)nm变为(6.20 ± 0.14)nm;在添加葡聚糖-5时升高到(8.39 ± 0.12)nm,以及添加葡聚糖-20时,进一步增加到(10.99 ± 0.12)nm,这表明糖分子量越高,与硅酸镁锂结合能力更强,从而更有利于形成较大尺寸的微团聚体结构。
|
注:葡萄糖(a)、葡聚糖-5(b)、葡聚糖-20(c)与硅酸镁锂混合后形成微团聚体的相关官能团信号强度;d)微团聚体中糖(521或540 cm–1)和硅酸镁锂(683 cm–1)拉曼特征峰峰强的比值。图中大写字母表示不同处理间存在极显著性差异(P < 0.01)。 Notes: Raman spectra of microaggregates for glucose(a), Dex-5(b)or Dex-20(c)mixed with clay minerals; d)Raman signal ratios of sugar/laponite(523 or 540/ 683 cm–1)for microaggregates. Different uppercase letters indicate significant differences at P < 0.01. 图 1 拉曼光谱鉴定糖-硅酸镁锂微团聚体结构 Fig. 1 Raman spectra identification of Sugar-laponite microaggregates |

|
图 2 原子力显微镜表征糖-黏土微团聚体 Fig. 2 AFM characterization of sugar-laponite aggregates |
根据已有研究结果,糖和黏土矿物主要是通过氢键、范德华力、疏水作用和库伦作用等非共价键进行相互作用[25]。本试验中硅酸镁锂是层状的2︰1型硅酸盐矿物,在pH为6的溶液条件下,硅酸镁锂的表面会带有羟基,表面呈现电负性[21]。同时由于葡萄糖和葡聚糖含有羟基,因此糖主要是通过(硅酸镁锂)-O-…H-O-(糖)或者(糖)-O-…H-O-(硅酸镁锂)的氢键来胶结硅酸镁锂,形成糖-硅酸镁锂复合体,并进一步聚集成纳米尺度的微团聚体,这类似于黏土矿物和土壤多糖的相互作用过程。Lee等[24]通过分子动力学模拟计算了葡萄糖和纤维二糖与伊利石的相互作用,结果发现,这两种糖均是通过氢键作用与伊利石结合。
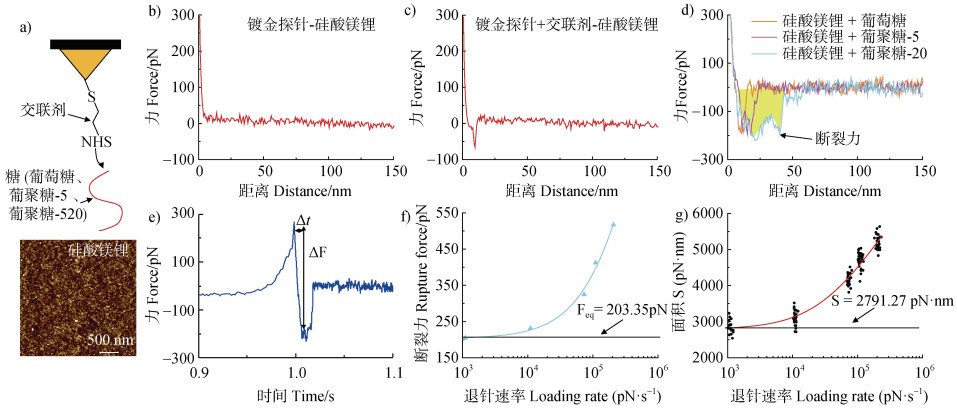
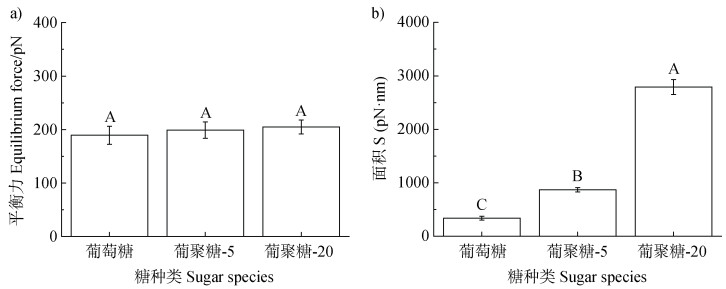
2.2 单分子力谱测定糖和硅酸镁锂的相互作用利用原子力显微镜的单分子力谱(SMFS)技术,测定和比较不同分子量糖和矿物表面的结合能力。根据糖与硅酸镁锂间的力-距离曲线(图 3b-图 3d),显示镀金探针针尖和LC-SPDP与硅酸镁锂表面没有明显的作用力(图 3b-图 3c),但是糖和硅酸镁锂之间存在较明显的作用力(图 3d)。进一步拟合及计算糖与硅酸镁锂作用过程的平衡力(Feq)以及结合面积S(图 3f-图 3g)[25-26]。其中,平衡力表示糖从硅酸镁锂表面脱离时的力,即糖上单一基团(羟基)和硅酸镁锂之间作用力,结合面积则表示糖和硅酸镁锂作用过程中的总力,与糖和硅酸镁锂之间作用的功正相关。由图 4可知,不同分子量的糖与硅酸镁锂的平衡力相近,没有明显差异(图 4a),大小均在200 pN左右,但是结合面积却存在明显差异(图 4b)。其中葡萄糖与硅酸镁锂的结合面积为(337.2 ± 35.7)pN·nm,而葡聚糖-5和葡聚糖-20与硅酸镁锂的结合面积分别升高到(868.9 ± 41.6)pN·nm和(2 791.2 ± 141.3)pN·nm。这主要是由于三种糖有类似的表面羟基功能基团,在羟基从硅酸镁锂表面脱附时,其作用力相近,但葡聚糖-5和葡聚糖-20分子量更大,有更多羟基与硅酸镁锂作用,因此会有更大的作用面积,这进一步说明糖分子量越高,与硅酸镁锂间结合能力更强。由2.1结果可知,随着糖分子量的提高,更多葡聚糖可以和硅酸镁锂结合,从而促进微团聚体聚合成尺寸更大的颗粒结构。在这个过程中,由于葡萄糖和葡聚糖有类似功能基团,因此糖分子量可能是调控糖和硅酸镁锂相互作用的主要影响因素,SMFS的结果很好地解释了这一现象。该结果与Yang等[27]之前的结果类似,即糖和黏土矿物结合后,低分子量的糖更易从黏土矿物上解吸,但高分子量的糖难以解吸。
|
注:a)单分子力谱的示意图;b)镀金探针、c)交联剂LC-SPDP、d)不同分子量糖和硅酸镁锂相互作用过程中代表性的力-距离曲线;e)葡聚糖-20和硅酸镁锂相互作用过程中代表性的力-时间曲线;f)动力学力谱拟合葡聚糖-20和硅酸镁锂表面的平衡力;g)动力学力谱拟合不同退针速度下葡聚糖-20和硅酸镁锂的结合面积。 Notes: a)Schematic images of SMFS; Representative force-distance curves of the interactions between b)bare Au-coated tips, c)Au-coated tips modified with LC-SPDP and d)Dex-20 and laponite surfaces; e)A representative force-time curve of the interactions between Dex-20 and laponite surface; f)The fitted rupture force curve of Dex-20 interacting with laponite; g)The fitted binding area curves of Dex-20 interacted with laponite. 图 3 原子力显微镜单分子力谱测定糖-黏土矿物相互作用 Fig. 3 AFM-based SMFS measurements of the interactions between sugar and laponite |
|
注:图中大写字母表示不同处理间存在极显著性差异(P < 0.01)。 Note: Different uppercase letters indicate significant differences at P < 0.01. 图 4 不同分子量的糖和硅酸镁锂之间的平衡力和结合面积 Fig. 4 The equilibrium force and the binding area between different molecular-weight sugars and laponite |
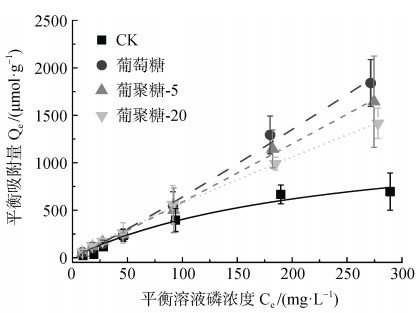
团聚体是重要的土壤结构单元,可参与到多种土壤养分地球化学循环过程[3]。磷作为植物生长发育必需的营养元素,黏土矿物团聚体会对其有效性具有重要的影响[7]。本试验进一步测定糖-硅酸镁锂微团聚体形成后对不同磷素的平衡吸附量,并根据吸附量拟合得到了等温吸附曲线(图 5)。结果显示,硅酸镁锂对磷酸盐的吸附可用Langmuir方程进行拟合(R2 = 0.99),当磷浓度达到200 mg·L–1左右时,吸附就可以达到相对平衡的状态,说明硅酸镁锂对磷的吸附主要是单层吸附;而加入葡萄糖,葡聚糖-5及葡聚糖-20后,糖-黏土矿物微团聚体对磷的吸附在磷浓度为300 mg·L–1时,吸附仍未达饱和,因此无法用Langmuir方程拟合,而用Freundlichr方程拟合的效果相对较好(R2 = 0.99),说明微团聚体对磷的吸附可能是多层吸附(图 5)。通过等温吸附曲线可知,在试验的各浓度下,糖-硅酸镁锂微团聚体能较硅酸镁锂吸附更多的磷,但是随着糖分子量的提高,微团聚体对磷的吸附能力又有了一定程度的降低。
|
图 5 硅酸镁锂或糖-硅酸镁锂微团聚体对磷酸盐吸附的等温吸附曲线 Fig. 5 Sorpfion isotherms of phosphate by laponite or sugar-laponite micro aggregates |
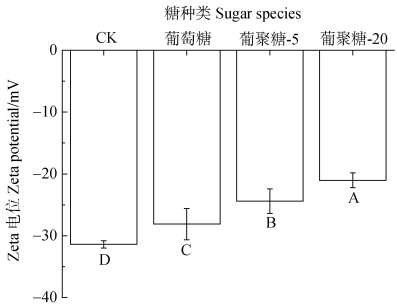
试验溶液选择的pH为6,溶液中的磷主要是以磷酸二氢根的形式存在,硅酸镁锂或糖-硅酸镁锂团聚体可以通过表面羟基的氢键吸附溶液中的磷酸二氢根,同时,硅酸镁锂层间富含的金属阳离子也可以通过离子交换作用或库伦作用吸附溶液中的磷酸二氢根[28-29]。在本试验中,糖介导的微团聚体形成后,对磷的吸附能力有明显加强,这种吸附能力的变化可能受到多种因素的共同调控:首先,糖的存在增加了微团聚体表面的羟基数量,进而通过形成更多的氢键吸附溶液中的磷酸盐;其次,通过等温吸附曲线可知,添加糖之前硅酸镁锂对磷的吸附可用Langmuir方程进行拟合,但加糖之后吸附则只能用Freundlichr方程拟合,这说明微团聚体在糖存在时其结构发生了一定的变化,对磷的吸附由单层吸附变为了多层吸附,从而在一定程度上增加了微团聚体对磷的吸附能力;此外,和糖结合后微团聚体表面带电性可能发生了一定变化。试验测定了加糖前后微团聚体的Zeta电位,由于这三种糖均是中性糖,因此糖和硅酸镁锂结合后微团聚体的Zeta电位显著降低,这可能会减弱对同样带负电的磷酸二氢根的静电斥力,从而促进微团聚体对磷的吸附。而糖分子量的提高,反而稍降低了磷的吸附量,这主要是由于高分子量糖对团聚体粒径的影响。微团聚体表面都富含有羟基,且由等温吸附曲线可知,三种糖形成的团聚体对磷的吸附均是多层吸附,因此微团聚体的粒径是影响吸附效率的重要因素[30-31],即在高分子量的葡聚糖存在时,微团聚体颗粒明显变大(图 6),而此时微团聚体的比表面积会降低,比表面积作为影响吸附过程的重要参数,其降低会影响微团聚体对磷的吸附效应。
|
注:图中大写字母表示不同处理间存在极显著性差异(P < 0.01)。 Notes: Different uppercase letters indicate significant differences at P < 0.01. 图 6 硅酸镁锂及糖-硅酸镁锂微团聚体在溶液中的Zeta电位 Fig. 6 Aqueous Zeta potentials of laponite and sugar-laponite micro aggregates |
土壤环境中,糖分子量越大,越有利于与硅酸镁锂结合,形成尺寸更大的微团聚体结构。同时,糖-硅酸镁锂微团聚体形成后增加了微团聚体羟基的含量,对磷的吸附作用会加强,但由于高分子糖会增加微团聚体的粒径,吸附磷的能力随着糖分子量提升反而降低。不同分子量的糖可调控团聚体尺寸和表面基团数量,而微团聚体表面基团尺寸将影响磷的吸附效果,从而调节磷的有效性及动态循环过程。该模式体系下的研究可以反映土壤中糖介导的团聚体形成对磷的吸附结合机制,这将为团聚体作用下的土壤磷素的生物地球化学循环提供科学的理论依据。
| [1] |
Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141-163. DOI:10.1111/j.1365-2389.1982.tb01755.x
(  0) 0) |
| [2] |
Young I M, Crawford J W. Interactions and self-organization in the soil-microbe complex[J]. Science, 2004, 304(5677): 1634-1637. DOI:10.1126/science.1097394
(  0) 0) |
| [3] |
Remusat L, Hatton P J, Nico P S, et al. NanoSIMS study of organic matter associated with soil aggregates: Advantages, limitations, and combination with STXM[J]. Environmental Science & Technology, 2012, 46(7): 3943-3949.
(  0) 0) |
| [4] |
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter[J]. Soil Biology & Biochemistry, 2002, 34(2): 139-162.
(  0) 0) |
| [5] |
Zhang Y F, Zhao S W, Wang Z L, et al. Distribution and function of cementing materials of soil aggregates on the Loess Plateau, Western China (In Chinese)[J]. Science of Soil and Water Conservation, 2015, 13(5): 145-150. DOI:10.3969/j.issn.1672-3007.2015.05.022 [张耀方, 赵世伟, 王子龙, 等. 黄土高原土壤团聚体胶结物质的分布及作用综述[J]. 中国水土保持科学, 2015, 13(5): 145-150.]
(  0) 0) |
| [6] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68. DOI:10.1038/nature16069
(  0) 0) |
| [7] |
Shen J B, Yuan L X, Zhang J L, et al. Phosphorus dynamics: From soil to plant[J]. Plant Physiology, 2011, 156(3): 997-1005. DOI:10.1104/pp.111.175232
(  0) 0) |
| [8] |
Wang X, Li H G, Cheng L Y, et al. Advances of root-soil interface effect of phosphorus and water interaction and mechanisms of their efficient use (In Chinese)[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(4): 1054-1064. [王昕, 李海港, 程凌云, 等. 磷与水分互作的根土界面效应及其高效利用机制研究进展[J]. 植物营养与肥料学报, 2017, 23(4): 1054-1064.]
(  0) 0) |
| [9] |
Xu X H, Wang Y L, Yao Y, et al. Effects of long-term fertilization on phosphorus storage capacity of soil aggregates in red soil upland (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(3): 730-738. [许杏红, 王艳玲, 姚怡, 等. 长期施肥对红壤旱地团聚体磷素储存容量的影响[J]. 土壤学报, 2020, 57(3): 730-738.]
(  0) 0) |
| [10] |
Yan Y P, Wang X M, Xiong J, et al. Progresses in studies on sorption mechanisms of phosphate on minerals using multiple analytic approaches (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 22-35. [严玉鹏, 王小明, 熊娟, 等. 基于不同分析方法研究磷酸根在矿物表面吸附机制的进展[J]. 土壤学报, 2020, 57(1): 22-35.]
(  0) 0) |
| [11] |
Wang J W, Wang Y L, Yao Y, et al. Effects of long-term fertilization on phosphorus retention and release of soil aggregates in upland red soils (In Chinese)[J]. Acta Pedologica Sinica, 2017, 54(5): 1240-1250. [王经纬, 王艳玲, 姚怡, 等. 长期施肥对旱地红壤团聚体磷素固持与释放能力的影响[J]. 土壤学报, 2017, 54(5): 1240-1250.]
(  0) 0) |
| [12] |
Gérard F. Clay minerals, iron/aluminum oxides, and their contribution to phosphate sorption in soils—A myth revisited[J]. Geoderma, 2016, 262: 213-226. DOI:10.1016/j.geoderma.2015.08.036
(  0) 0) |
| [13] |
Hu Z, Jaisi D P, Yan Y P, et al. Adsorption and precipitation of myo-inositol hexakisphosphate onto kaolinite[J]. European Journal of Soil Science, 2020, 71(2): 226-235. DOI:10.1111/ejss.12849
(  0) 0) |
| [14] |
Xiong J, Liu Z H, Yan Y P, et al. Role of clay minerals in controlling phosphorus availability in a subtropical Alfisol[J]. Geoderma, 2022, 409: 115592. DOI:10.1016/j.geoderma.2021.115592
(  0) 0) |
| [15] |
Tao L, Wen X C, Li H, et al. Influence of manure fertilization on soil phosphorous retention and clay mineral transformation: Evidence from a 16-year long-term fertilization experiment[J]. Applied Clay Science, 2021, 204: 106021. DOI:10.1016/j.clay.2021.106021
(  0) 0) |
| [16] |
Guo W W, Xiao H A, Wu J S, et al. Distribution of phosphorus in water-stable aggregates in upland and paddy red earths (In Chinese)[J]. Acta Pedologica Sinica, 2009, 46(1): 85-92. [郭万伟, 肖和艾, 吴金水, 等. 红壤旱土和水稻土团聚体中磷素的分布特点[J]. 土壤学报, 2009, 46(1): 85-92.]
(  0) 0) |
| [17] |
Bergkvist M, Cady N C. Chemical functionalization and bioconjugation strategies for atomic force microscope cantilevers[J]. Methods in Molecular Biology, 2011, 751: 381-400.
(  0) 0) |
| [18] |
Chi J L, Jia C H, Zhang W J, et al. In situ observations of the occlusion of a clay—sugar compound within calcite[J]. Environmental Science: Nano, 2022, 9(2): 523-531. DOI:10.1039/D1EN00902H
(  0) 0) |
| [19] |
Zhai H, Zhang W J, Wang L J, et al. Dynamic force spectroscopy for quantifying single-molecule organo–mineral interactions[J]. CrystEngComm, 2021, 23(1): 11-23. DOI:10.1039/D0CE00949K
(  0) 0) |
| [20] |
Müller D J, Dumitru A C, Lo Giudice C, et al. Atomic force microscopy-based force spectroscopy and multiparametric imaging of biomolecular and cellular systems[J]. Chemical Reviews, 2021, 121(19): 11701-11725. DOI:10.1021/acs.chemrev.0c00617
(  0) 0) |
| [21] |
Perotti G F, Tronto J, Bizeto M A, et al. Biopolymer-clay nanocomposites: Cassava starch and synthetic clay cast films[J]. Journal of the Brazilian Chemical Society, 2014, 25(2): 320-330.
(  0) 0) |
| [22] |
Mathlouthi M, Vinh Luu D. Laser-Raman spectra of d-glucose and sucrose in aqueous solution[J]. Carbohydrate Research, 1980, 81(2): 203-212. DOI:10.1016/S0008-6215(00)85652-9
(  0) 0) |
| [23] |
Larsson M, Lindgren J, Ljunglöf A, et al. Ligand distributions in agarose particles as determined by confocal Raman spectroscopy and confocal scanning laser microscopy[J]. Applied Spectroscopy, 2003, 57(3): 251-255. DOI:10.1366/000370203321558146
(  0) 0) |
| [24] |
Lee S G, Choi J I, Koh W, et al. Adsorption of β-D-glucose and cellobiose on kaolinite surfaces: Density functional theory(DFT)approach[J]. Applied Clay Science, 2013, 71: 73-81. DOI:10.1016/j.clay.2012.11.002
(  0) 0) |
| [25] |
Newcomb C J, Qafoku N P, Grate J W, et al. Developing a molecular picture of soil organic matter–mineral interactions by quantifying organo–mineral binding[J]. Nature Communications, 2017, 8: 396. DOI:10.1038/s41467-017-00407-9
(  0) 0) |
| [26] |
Friddle R W, Noy A, de Yoreo J J. Interpreting the widespread nonlinear force spectra of intermolecular bonds[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(34): 13573-13578.
(  0) 0) |
| [27] |
Yang J Q, Zhang X N, Bourg I C, et al. 4D imaging reveals mechanisms of clay-carbon protection and release[J]. Nature Communications, 2021, 12: 622. DOI:10.1038/s41467-020-20798-6
(  0) 0) |
| [28] |
Edzwald J K, Toensing D C, Leung M C Y. Phosphate adsorption reactions with clay minerals[J]. Environmental Science & Technology, 1976, 10(5): 485-490.
(  0) 0) |
| [29] |
Guo F Y, Li D B, Fein J B, et al. Roles of hydrogen bond and ion bridge in adsorption of two bisphenols onto montmorillonite: An experimental and DFT study[J]. Applied Clay Science, 2022, 217: 106406.
(  0) 0) |
| [30] |
Wang X M, Li W, Harrington R, et al. Effect of ferrihydrite crystallite size on phosphate adsorption reactivity[J]. Environmental Science & Technology, 2013, 47(18): 10322-10331.
(  0) 0) |
| [31] |
Yean S, Cong L, Yavuz C T, et al. Effect of magnetite particle size on adsorption and desorption of arsenite and arsenate[J]. Journal of Materials Research, 2005, 20(12): 3255-3264.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


