2. 中国科学院大学, 北京 100049;
3. 江苏省有机固体废弃物资源化协同创新中心, 南京 210095
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization, Nanjing 210095, China
土壤是人类赖以生存的基础,是一个动态的生命系统。土壤健康支撑着全球生态系统的服务功能和生态平衡,与农业绿色和可持续发展密不可分。土壤健康的核心是“生命”,微生物作为土壤系统持续生命力的源头,为维持植物生产力、保持空气和水环境质量、促进动物和人类健康提供了重要的驱动力[1]。土壤微生物群落稳定性是土壤健康的重要组成部分及评价指标,主要由抵抗力(resistance)和回复力(resilience)度量,其中抵抗力是环境扰动下土壤微生物群落保持不变的能力,回复力是环境扰动结束后土壤微生物群落回复到初始状态的能力[2]。度量土壤微生物群落的抵抗力和回复力需要确定一个相对稳定的状态作为参考状态,它可以是预期最佳条件下的明确状态,也可以是有限波动的状态,通常采用无环境扰动处理的实际状态作为参考状态[3]。土壤微生物群落稳定性研究以土壤受到如干旱、淹水和冻融等环境扰动为前提。微生物群落的组成(微生物多样性、关键物种丰度和网络拓扑参数等)和功能(土壤呼吸、酶活和功能基因等)对扰动做出响应,分别或者共同表现出稳定性。为了量化比较微生物群落的抵抗力和回复力,研究人员提出了多种计算方法,包括衡量环境扰动下微生物群落的绝对变化[4]、相对变化[5]和综合评估[6]等。然而,对于同一土壤的微生物群落,基于不同微生物指标或计算方法得到的稳定性结果可能不同。因此,在研究微生物群落稳定性时,应综合多种微生物响应指标,选择合适的试验设计及计算方法。
黄淮海平原潮土区是我国重要的粮食主产区之一,提供了全国约四分之一的谷类作物。但是由于水热不同步的气候问题,黄淮海平原存在严重的季节性干旱,影响农业生态系统的土壤健康和可持续发展[7]。施肥是一种重要的农业生产措施,大量研究证实施肥会显著影响土壤理化性质,土壤酶活性和微生物生物量等[8]。目前最广泛使用的施肥管理措施包括施用无机肥和有机肥,如黄淮海平原的长期定位施肥试验结果表明施用无机肥或有机肥可以显著增加微生物生物量和土壤酶活[9];施用含氮素的化肥会改变土壤氨氧化细菌的群落结构,显著增加土壤硝化作用的潜能[10]。因此,采用合理的施肥措施对维持和提升土壤地力、增加作物产量具有重要实践意义。
当前的气候趋势表明,土壤受到干旱扰动的次数将越来越多。尤其是在农业土壤中,灌溉、施肥等农业管理措施的不合理也会导致土壤干旱次数的增加[11]。干旱可以通过调节养分有效性和改变物理结构影响微生物群落,导致微生物群落结构改变、微生物生物量和土壤基础呼吸降低[12]。一方面,干旱使一部分微生物直接死亡或进入休眠状态[13]。另一方面,干旱诱导土壤微生物的各种保护机制以避免细胞脱水,如形成生物膜或积累细胞溶质[14]。Gordon等[15]发现干旱-复水循环后不同施肥处理的草地土壤微生物群落结构响应不一致,没有施肥历史的土壤相比施用化肥的土壤具有更高的微生物生物量和真菌/细菌比(F/B)。Sun等[16]研究表明干旱扰动下不同施肥处理物种的响应不同,具体表现为施用化肥处理的稀有物种丰度逐渐增加,而施用有机肥处理的稀有物种丰度逐渐减少。综上所述,前人的研究主要集中于不同施肥措施对土壤微生物群落的影响及不同施肥处理的土壤微生物群落对干旱扰动的响应上。然而,对干旱扰动下不同施肥处理土壤微生物群落稳定性(抵抗力和回复力)缺少定量的分析与比较。
基于此,本研究以河南封丘长期定位试验地不同施肥处理的潮土为研究对象,选取微生物群落的功能(脱氢酶活性)和组成(微生物多样性,关键物种和网络拓扑参数)等响应指标,量化与比较不同施肥处理土壤微生物群落的抵抗力和回复力,综合反映不同施肥处理微生物群落的稳定性,为制定合理的施肥管理措施及维持农业生态系统的土壤健康提供科学依据。
1 材料与方法 1.1 试验区概况及试验设计供试土壤样品采集于潮土农田生态系统长期定位施肥试验,该试验位于河南省封丘县中国科学院封丘农业生态实验站(35° 04' N,113°10' E)。封丘县为半干旱半湿润暖温带季风气候,年均气温14℃,年均降水量615 mm,年降水主要集中于7—9月。长期定位施肥试验始于2011年秋季,种植当地大面积推广作物品种,种植方式是夏玉米-冬小麦轮作,土壤类型为黄河冲积物发育的潮土,土壤质地为砂壤土。
试验共设有5种不同施肥处理,本实验选择其中3种处理,分别是不施肥对照处理(CK)、平衡施用化肥处理(NPK)和有机无机肥配施处理(OM)。试验地施肥量居当地农户中等水平,对于NPK,N、P、K分别以尿素(200 kg·hm–2)、过磷酸钙(80 kg·hm–2)和硫酸钾(150 kg·hm–2)的形式施用。OM与NPK设置等氮投入,其中1/2的氮素由尿素提供,另1/2由菇渣提供。尿素为基肥和追肥,P、K和有机肥均为基肥。基肥在6月玉米和10月小麦播种前均匀地撒施土壤表面,并立即翻耕与土层混合,追肥以手施为主。
2020年6月小麦收获后,采用五点法采集每个小区0~15 cm耕层土壤样品,混合均匀后去除作物残体和根系,过2 mm筛,于4℃保存用于后续干旱扰动实验。供试土壤基本理化性质如表 1。
|
|
表 1 长期不同施肥处理潮土的理化性质 Table 1 Soil chemical properties as affected by a long-term fertilization |
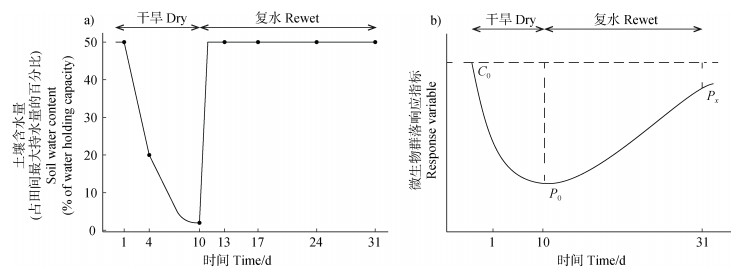
干旱扰动试验前将三种施肥处理的土壤含水量调至田间最大持水量的50%。试验设置6个平行,分别称取200 g不同施肥处理的土壤于500 mL玻璃瓶中。将玻璃瓶放入28℃培养箱自然风干,每日监测质量变化。干旱扰动至土壤质量不变后维持3 d,之后开始复水处理。复水阶段每两天根据质量补充水分,使土壤含水量维持在田间最大持水量的50%。干旱扰动阶段为试验起始至第10天,复水阶段为试验第10天至第31天。采样时间如图 1a所示,分别于试验起始、干旱扰动第4天、10天和复水阶段第3天、7天、14天和21天采集土壤样品。采集的土壤样品一部分于4℃保存,用于测量土壤脱氢酶活性;另一部分于–20℃保存,用于提取土壤DNA。此外,为反映微生物群落在时间梯度上的波动,在相同的培养条件下设置了恒定水分的对照试验,即各处理的土壤含水量保持在田间最大持水量的50%,置于28℃培养箱培养30 d,每10天采集一次土壤样品于4℃保存,用于测量脱氢酶活性。
|
注:对不同施肥处理的土壤进行干旱扰动10 d,复水回复21 d。图a中的点代表采样时间。C0表示试验开始时的微生物群落指标的起始值,P0表示干旱扰动结束时微生物群落指标的响应值,Px表示复水回复后微生物群落指标的响应值。 Note: The soil with fertilization strategies was disturbed by drought for 10 days and recovered by rewetting for 21 days. The dots in figure a)represent the sampling times. C0 means the value of the response variables at the beginning of the experiment, P0 means the value of response variables at the end of drought disturbance, and Px means the value of response variables after water recovery. 图 1 干旱-复水过程中土壤含水量(a)及微生物群落响应指标的变化模式(b)图 Fig. 1 Changes of soil water content(a)and schema of the microbial response variable(b)during the experiment of drought disturbance and water recovery |
土壤pH采用土水质量比1︰2.5浸提pH计(Thermo,USA)测定;土壤有机碳(TOC)采用重铬酸钾氧化法测定;土壤全氮(TN)采用凯氏定氮法测定;土壤全磷(TP)和全钾(TK)采用氢氟酸-次氯酸消煮,分别由钼蓝比色法和火焰光度计法测定;土壤含水量采用烘干法测定[17]。
1.4 基于16S rRNA基因的高通量测序选取不同施肥处理在试验起始(Begin)、干旱扰动结束时(Dry)和复水回复结束时(Rewet)的土壤样品,进行16S rRNA基因的高通量测序。首先提取土壤DNA:称取0.5 g在–20℃保存的土壤样品,用FastDNA® SPIN kit for Soil(MP Biochemicals,Solon,OH,USA)试剂盒提取土壤总DNA(方法参见试剂盒说明书)。用100 µL DES缓冲液洗脱提取DNA,并用NanoDrop ND-1000(Thermo Scientific,USA)核酸蛋白分析仪测定DNA浓度,–30℃保存。高通量测序由Illumina Miseq测序平台完成,使用引物519F(5′-CAGCMGCCGCGGTAATWC-3′)和907R(3′-CCGTCAATTCMTTTRAGTTT-5′)对细菌16S rRNA基因V4 - V5可变区进行扩增。50 μL PCR反应体系包括正向和反向引物各15 μmol·L–1、1.25 μmol·L–1的dNTP、2 μmol·L–1的Taq DNA聚合酶(TaKaRa,Japan)和1 μL的DNA模版(含约50 ng)。阴性对照以无菌水代替DNA模板。PCR扩增程序为:94℃ 5 min,30个循环(94℃ 60 s,55℃ 60 s和72℃ 75 s),最后72℃维持10 min。所有PCR产物均通过1%琼脂糖凝胶进行条带特异性检测。
测序完成后,使用QIIME软件完成序列质量控制、剪切、去除嵌合体、OTU聚类和物种注释等[18]。去除平均质量分数低于25、长度小于200 bp的序列,并根据Barcode序列与样品进行匹配。按照97%的相似性将序列聚类成不同的OTU,其中丰度最高的OTU序列被选作代表序列[19]。物种注释选择SILVA 119数据库(https://www.arb-silva.de/download/archive/qiime/)。为了比较样品间的微生物群落,将所有样品的序列统一抽平到10 000条。
1.5 数据处理 1.5.1 土壤微生物群落指标分析土壤脱氢酶活性(DHA)采用氯化三苯基四氮唑(TTC)比色法测定[17],用于反映微生物群落的整体功能。基于R语言4.1.1版本的vegan包对微生物群落多样性进行分析,选择丰富度指数(Richness)和香农指数(Shannon)反映微生物群落的alpha多样性;基于Bray-Curtis距离计算beta多样性,用于反映微生物群落结构。微生物群落的分散度(dispersion)由vegan包的betadisper函数计算。选取各样本中丰度均高于1%的OTUs作为维持微生物群落稳定性的关键物种。基于随机森林方法,结合OTUs的贡献度(Mean decrease accuracy)和十折交叉验证方法,分别筛选出三种施肥处理中最能解释干旱-复水过程土壤微生物群落变化的前10个关键OTUs。微生物分子生态网络拓扑参数也是描述环境扰动下微生物群落组成变化的重要指标,基于Molecular Ecological Network Analysis(MENA)网站,对OTUs丰度进行log转化,计算物种间的Pearson相关性,用随机矩阵理论(Random matrix theory,RMT)构建微生物分子生态网络(http://ieg4.rccc.ou.edu/MENA/)。选择0.97的相似性阈值,分别构建不同施肥处理在试验起始、干旱扰动结束和复水阶段结束的分子生态网络。为了保证相关性计算的可靠性,每个网络均保留在1/2以上样本存在的OTUs,用MENA平台计算网络拓扑参数及模块化信息。
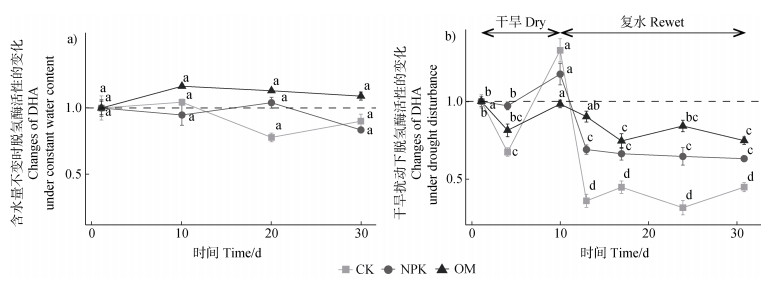
1.5.2 抵抗力与回复力的计算在无干旱扰动的水分对照试验中,三种施肥处理的脱氢酶活性都没有显著变化,说明水分恒定时微生物群落保持相对稳定(图 2a)。因此本文将试验起始时的微生物群落作为参考状态,分别以微生物群落脱氢酶活性,alpha多样性,关键物种丰度,beta多样性和网络拓扑参数作为响应指标,计算三种施肥处理的抵抗力与回复力。其中脱氢酶活性,alpha多样性,关键物种丰度和网络拓扑参数作为单维指标,均基于以下公式计算三种施肥处理的抵抗力[4]和回复力[20]:
| $ {\text{RS}} = 1 - \left( {\frac{{2\left| {{C_0} - {P_0}} \right|}}{{{C_0} + \left| {{C_0} - {P_0}} \right|}}} \right) $ |
| $ {\text{RL}} = \frac{{{P_x}}}{{{C_0}}} $ |
|
注:折线图上方的不同字母表示同一施肥处理的脱氢酶活性在干旱-复水过程中具有显著差异(P < 0.05)。 Note: Different letters at the top of the line represent significant differences during the experiment of drought disturbance and water recovery under the same fertilization strategy(P < 0.05). 图 2 长期不同施肥潮土在恒定水分条件(a)和干旱-复水过程(b)中脱氢酶活性的变化率 Fig. 2 Changes of soil dehydrogenase activity without environmental disturbance(a)and during the experiment of drought disturbance and water recovery(b) |
式中,RS表示抵抗力,RL表示回复力。以脱氢酶活性计算CK的稳定性为例,式中C0指试验起始时的脱氢酶活性,P0指干旱扰动结束时的脱氢酶活性,Px指复水回复结束时的脱氢酶活性,其他指标以此类推(图 1b)。
RS的计算方法考虑了微生物群落指标在干旱扰动下可能降低或增加的情况,基于稳定参考状态的微生物群落指标进行标准化,计算结果在–1到1之间,RS越大表示抵抗力越强。RL衡量了复水后微生物群落回复到起始状态的程度,计算结果大于0,当RL为1时微生物群落回复力最强。
Beta多样性是矩阵型数据(多维指标),本文采用干旱扰动结束时微生物群落与试验起始时微生物群落的Bray-Curtis相似度(Bray-Curtis similarity)衡量微生物群落结构的抵抗力,用复水回复结束时微生物群落与试验起始时微生物群落的Bray-Curtis相似度衡量微生物群落结构的回复力。该指标的数值越高表示抵抗力或回复力越强[21]。
1.5.3 统计分析基于SPSS 24的单因素方差分析(One-way ANOVA)对不同处理间差异显著性进行检验,然后用邓肯检验(Duncan)进行多重比较。统计分析前进行数据的正态和方差齐性检验,必要时对数据进行对数变换。数据可视化均由R语言的ggplot2包实现。为比较不同施肥处理的土壤脱氢酶活性在干旱-复水过程中的变化,用脱氢酶活性与起始脱氢酶活性之比进行标准化,表示脱氢酶活性的变化率。非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)基于Bray-Curtis距离,用以展示不同施肥处理的细菌群落结构在试验过程中的变化,并用多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)检验细菌群落结构差异的显著性。
2 结果 2.1 干旱扰动下不同施肥处理脱氢酶活性的变化试验起始状态CK、NPK、OM的脱氢酶活性分别为TPF 24.5、60.5、124.3 μg·g–1·d–1,处理间差异显著。如图 2所示,干旱扰动改变了三种施肥处理潮土的脱氢酶活性。在干旱第4天,三种施肥处理的脱氢酶活性与起始状态相比均降低,其中CK和OM显著降低。在干旱第10天,CK和NPK的脱氢酶活性与起始状态相比显著增加,体现了干旱对微生物功能强烈的干扰作用;而OM无显著变化,体现了较强的抵抗性。在复水阶段,三种施肥处理的脱氢酶活性均低于其起始状态。复水回复结束时,三种施肥处理的脱氢酶活性仍显著低于其起始状态,说明微生物功能不能完全回复。就回复程度而言,OM最优,CK最差,NPK居中。
三种施肥处理的脱氢酶活性在干旱-复水过程中的变幅表现为OM最小(CV = 0.15),CK最大(CV = 0.57),NPK介于OM和CK之间(CV = 0.28)。以上结果说明OM的脱氢酶活性在整个扰动回复过程中的变化最小。
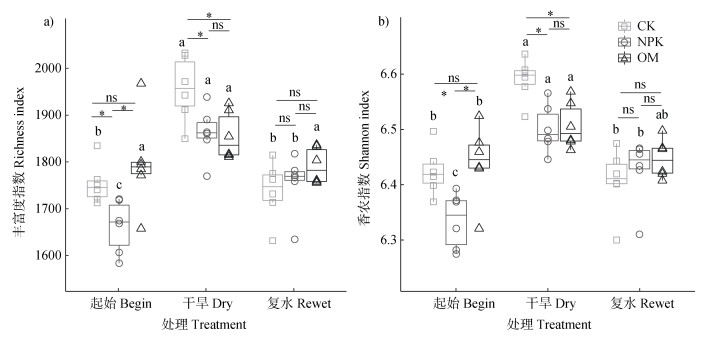
2.2 干旱扰动下不同施肥处理微生物群落物种丰富度和多样性的变化在干旱-复水过程中,三种施肥处理alpha多样性的变化程度不同。如图 3所示,试验起始时,NPK的Richness和Shannon指数均显著低于CK和OM。干旱扰动结束时,CK的Richness和Shannon指数显著高于NPK和OM,CK和NPK的Richness指数与起始状态相比显著增加,三种施肥处理的Shannon指数与起始状态相比均显著增加。干旱导致CK、NPK和OM的Richness指数分别增加11.6%、12.0%和3.3%,Shannon指数分别增加2.6%、2.6%和1.1%,说明OM的alpha多样性在干旱扰动下的变化最小,表现出更强的抵抗性。复水回复结束时,CK和OM的Richness和Shannon指数与起始状态相比无显著差异,说明细菌群落alpha多样性能够回复至起始状态。
|
注:Begin,实验起始(Day1);Dry,干旱扰动结束(Day10);Rewet,复水回复结束(Day31),下同。箱线图上方的不同字母表示同一施肥处理在干旱-复水过程中alpha多样性具有显著差异(P < 0.05);箱线图横线上方星号表示同一时间不同施肥处理间的alpha多样性具有显著差异(P < 0.05),ns表示差异不显著。 Note: Begin, the start of the experiment(Day1);Dry, end of drought disturbance(Day10);Rewet, end of water recovery(Day31). The different letters at the top of the boxplot indicate significant differences during the experiment of drought disturbance and water recovery under the same fertilization strategy(P < 0.05);the asterisk above the boxes indicates a significant difference between fertilization strategies at the same time(P < 0.05), while ns indicates the difference is not significant. 图 3 长期不同施肥潮土在干旱-复水过程中细菌群落丰富度(a)和香农(b)指数的变化 Fig. 3 Changes of Richness(a)and Shannon(b)index during the experiment of drought disturbance and water recovery |
采用随机森林方法分别筛选出三种施肥处理中最能解释干旱-复水过程变异的前10个关键OTUs。干旱扰动结束时,CK、NPK和OM的关键物种丰度平均增加51.1%,39.3%和10.7%,说明OM的关键物种的丰度变化最小,抵抗性更高。复水回复结束时,CK和NPK的关键物种丰度仍高于起始状态35.8%和10.5%,而OM的比起始状态低1.6%,说明OM关键物种的回复最强。
2.3 干旱扰动下不同施肥处理微生物群落结构的变化用非度量多维尺度分析(NMDS)呈现不同施肥处理在干旱-复水过程中细菌群落结构的变化,多元方差分析(PERMONOVA)验证细菌群落结构的差异。结果显示,试验起始时,三种施肥处理细菌群落结构存在显著差异。干旱扰动使三种施肥处理细菌群落结构均发生显著变化,复水回复后三种施肥处理细菌群落结构与起始相比仍有显著差异(图 4a,表 2)。从多元方差分析的F值看,与干旱扰动结束时相比,复水回复时细菌群落结构与起始状态细菌群落结构的差异更大,说明微生物群落在干旱-复水过程中发生了演替,导致微生物群落结构重新排序。此外,在干旱-复水过程中OM细菌群落结构的分散度显著低于CK和NPK,说明OM的细菌群落结构变化最小,体现了较强的群落结构稳定性(图 4b)。

|
注:图b中的不同字母代表不同施肥处理之间具有显著差异(P < 0.05)。 Note: Different letters in figure b indicates significant difference between fertilization strategies(P < 0.05). 图 4 长期不同施肥潮土在干旱-复水过程中细菌群落结构的变化(基于Bray-Curtis距离的NMDS(a)和分散度(b)分析) Fig. 4 Changes of soil beta diversity during the experiment of drought disturbance and water recovery(NMDS(a)and dispersion analysis(b)based on Bray-Curtis distances) |
|
|
表 2 长期不同施肥潮土在干旱-复水过程中细菌群落结构的差异(基于Bray-Curtis距离的PERMONOVA分析) Table 2 Differences in soil community structure during the experiment of drought disturbance and water recovery(PERMANOVA based on Bray-Curtis distance) |
由于微生物物种之间的相互作用,微生物分子生态网络会形成独立或相关的模块。三种施肥处理细菌分子生态网络的模块化系数均超过0.4,表明构建的网络具有典型的模块化特征。干旱-复水过程中不同施肥处理细菌分子生态网络拓扑参数的变化见表 3。试验起始时,CK、NPK和OM的总节点数分别为1 425、1 329和1 415;总连接数分别为10 104、9 570和12 157,均表现为OM > CK > NPK。在干旱-复水过程中,三种施肥处理细菌网络的复杂度(总节点数、总连接数、平均度、平均聚类系数和连通性)均表现为干旱后增加,复水后降低。此外,干旱-复水过程中三种施肥处理细菌网络的负连接数与正连接数之比的变化体现了细菌相互作用的改变,具体表现为干旱扰动结束时CK负连接数比例增加,NPK负连接数比例降低,而OM的负连接数比例基本不变。干旱扰动导致三种施肥处理细菌网络的平均路径长度降低,说明网络向“小世界网络”变化,而复水后这一趋势变弱。干旱也导致三种施肥处理的特征向量中心性降低,复水后增加,体现了网络中节点重要性的变化。在干旱-复水过程中,CK,NPK和OM细菌网络各拓扑参数的变异系数平均值分别为0.11、0.06和0.04(表 3),说明干旱-复水过程中OM的细菌网络变化最小,表现最稳定。
|
|
表 3 长期不同施肥潮土在干旱-复水过程中细菌群落网络拓扑参数的变化 Table 3 Changes of bacterial community network topological parameters during the experiment of drought disturbance and water recovery |
为量化与比较三种施肥处理的微生物群落稳定性,分别基于干旱-复水过程中土壤脱氢酶活性、细菌群落alpha多样性(Richness和Shannon指数)、关键物种丰度、细菌群落结构(beta多样性)和细菌分子生态网络拓扑参数的变化计算不同施肥处理的抵抗力和回复力。表 4可以看出,三种施肥处理各响应指标的抵抗力均显著低于数值1,说明脱氢酶活性、alpha多样性、关键物种、群落结构和分子生态网络均受到干旱的强烈扰动。三种施肥处理脱氢酶活性和群落结构的回复力均显著低于数值1,说明脱氢酶活性和群落结构不能完全回复至起始状态。而CK和OM在alpha多样性的回复力与数值1相比没有显著差异,说明alpha多样性能够回复至起始状态。三种施肥处理网络拓扑参数的回复力均与数值1没有显著差异,说明网络拓扑参数整体上能够回复。
|
|
表 4 干旱-复水过程中长期不同施肥潮土的微生物群落稳定性 Table 4 Soil microbial community stability with fertilization strategies during the experiment of drought disturbance and water recovery |
三种施肥处理各响应指标的抵抗力和回复力均表现为OM最高。在抵抗力上,脱氢酶活性表现为OM > NPK > CK,其中OM的抵抗力显著高于CK;Richness和Shannon指数表现为OM显著高于CK和NPK;关键物种表现为OM > NPK > CK,处理间差异显著;群落结构上表现为OM显著高于CK和NPK;网络拓扑参数上表现为OM > NPK > CK,其中OM显著高于CK。在回复力上,脱氢酶活性表现为OM > NPK > CK,差异显著。NPK在Richness和Shannon指数上的回复力与数值1相比具有显著差异,说明NPK的alpha多样性未完全回复。而CK和OM的alpha多样性能够完全回复,且OM的回复力显著高于CK。NPK和OM的关键物种能够完全回复,说明NPK和OM的回复力强于CK。在群落结构上,CK和OM的回复力显著高于NPK。网络拓扑属性的回复力在不同施肥处理间没有显著差异。
3 讨论 3.1 Birch效应与微生物群落抵抗力通常研究认为,微生物群落在干旱扰动后会表现出负响应[22],然而本研究发现三种施肥处理的脱氢酶活性、alpha多样性、关键物种丰度和网络拓扑参数,在干旱扰动后均呈现正响应。干旱扰动结束时三种不同施肥处理的土壤脱氢酶活性与试验起始相比均呈增加趋势(图 2)。由于测定土壤脱氢酶活性时会加入大量水溶液,这种土壤干旱后加水带来的土壤水势迅速变化、从而导致脱氢酶活性快速增加的现象,是典型的“Birch效应”[23]。Zhao等[12]在研究不同施肥处理的土壤对干湿交替的响应时也发现土壤脱氢酶活性在干旱后迅速增加,存在“Birch效应”。“Birch效应”产生的原因比较复杂,一方面,干旱条件下土壤微生物为了生存需要积累大量溶质以平衡细胞内外的渗透势,复水后土壤微生物会代谢掉干旱时合成的溶质以避免土壤水势上升导致的细胞溶解和死亡[14]。另一方面,土壤干旱扰动后的复水过程会破坏土壤的团粒结构,释放大量有机碳,为微生物提供更多底物[24]。这些过程会促进剩余微生物的活动,引起土壤脱氢酶、土壤呼吸等表现出快速增加的现象。但由于Birch效应带来的脱氢酶活性增加是短暂和不可持续的,微生物活性往往会在干旱-复水之后迅速回落,正如本研究中复水3 d后测得的三种施肥处理的脱氢酶活性与起始状态相比显著降低(图 2)。
与试验起始相比,干旱扰动结束时不同施肥处理的土壤细菌alpha多样性和关键物种丰度也表现为升高趋势(图 3)。这与前人研究结果一致,干旱后再湿润的土壤细菌在DNA水平的alpha多样性显著增加[25]。推测干旱土壤破碎时死亡微生物和团粒结构的裂解使更多的土壤DNA游离出来,DNA提取量增加,提高了细菌丰富度和多样性。此外,干旱扰动结束时三种施肥处理的网络拓扑参数也表现出增加趋势,这是由于网络的拓扑参数受物种丰富度影响显著[26]。
尽管由于Birch效应等原因微生物群落的抵抗力表现为正响应,仍可以用微生物群落的响应幅度来表明抵抗力的大小,变化幅度越大说明抵抗力越弱。因此,本研究选择了能够同等程度比较正响应和负响应的公式来定量抵抗力,这一计算方式也应用于研究土壤中葡萄糖添加引起微生物群落正响应的幅度[27]。
3.2 微生物群落alpha多样性的回复快于微生物群落结构和功能本研究结果表明,复水21 d后,不同施肥处理的土壤细菌群落alpha多样性能够回复到初始状态,而微生物群落功能(脱氢酶活性)和结构(beta多样性)未回复到起始状态(表 4),说明微生物群落alpha多样性的回复可能快于微生物群落结构和功能。Polazzo等[26]研究表明与alpha多样性相比,短暂干扰后微生物群落结构的回复(如果能回复)需要更多的时间。一项有关多种生态系统微生物群落稳定性的荟萃分析也发现,扰动结束后微生物群落alpha多样性普遍都能回复,而微生物群落结构则不能[28]。微生物群落alpha多样性是典型的单一变量型数据,比较而言,beta多样性是多维变量型数据,不仅能解释微生物群落物种数目的变化,还能反映物种类型和相对丰度信息。扰动消失后,随着时间的推移,微生物群落结构与起始状态群落结构的差异呈增加趋势(表 2)。微生物群落结构未回复可能是由于不能抵抗环境扰动的物种无法回复,而能够抵抗环境扰动的物种驱动了扰动结束后群落的演替[29]。此外,本研究结果也表明在干旱-复水过程中三种施肥处理的细菌网络发生了拓扑重建,物种间的相互作用发生显著变化。干旱扰动后微生物群落物种间相互作用的变化也是影响三种施肥处理细菌群落结构回复的原因之一[26]。环境扰动结束后微生物群落功能的回复会受到时间的影响,一般能够部分或完全回复[30]。不同微生物群落功能指标的回复力可能不同,与纤维素酶和漆酶等相比,脱氢酶的回复力较低[31]。因此,本试验中微生物群落的功能没有完全回复可能与复水回复时间较短和选择的功能指标有关。
3.3 施用有机肥有助于提高土壤微生物群落稳定性本研究结果表明,OM的土壤微生物群落在脱氢酶活性、alpha多样性、关键物种、群落结构和网络拓扑属性上都表现出更高的抵抗力和回复力(表 4)。Hueso等[32]在长期干旱扰动对半干旱地区土壤的影响研究中提出,添加有机物在提高土壤微生物生物量的抵抗力与回复力上发挥着重要作用。Liu等[33]比较了高肥力和低肥力土壤的微生物群落稳定性,结果表明高肥力的土壤具有更高的抵抗力与回复力。此外,其他环境扰动(如铜添加、热扰动和土壤消毒)的研究也表明施用有机肥能够提高微生物群落功能的抵抗力与回复力[34]。与CK和NPK相比,OM显著提高了土壤有机碳含量(表 1)。较高的土壤有机碳含量增加了土壤活性养分,使微生物能够分配更多的资源调节渗透压和加固细胞壁[35]。施用有机肥能够促进土壤团粒结构的形成,减缓土壤水分损失,提供更强的物理保护作用,使微生物不会迅速脱水,增加微生物群落中对扰动具有低响应和高抵抗力的物种[36]。此外,施用有机肥使土壤具有更高的微生物多样性(图 3)和功能冗余,即有更多的物种共同行使一种功能。这些原因使OM的微生物群落功能和组成的抵抗力更强。
OM能够促进土壤的团聚化作用,增强干旱扰动下土壤团聚体的稳定性,为复水阶段的土壤回复到起始状态提供更好的条件[35]。此外,OM可增加土壤不稳定性碳含量,复水阶段能够利用不稳定性碳的微生物快速定殖,导致微生物群落的回复力更强[37]。抵抗力强的微生物群落在扰动结束时与起始群落的差异更小,这可能是抵抗力强的微生物群落一般具有更高的回复力的原因[28]。与CK和NPK相比,OM的微生物多样性更高(图 3),具有更大的物种库,同时具有更强的功能冗余,这也是OM在功能和组成的回复力上优于CK和NPK的原因之一[31]。
4 结论三种长期不同施肥处理土壤脱氢酶活性、微生物alpha多样性、关键物种、微生物群落结构和网络拓扑参数对于干旱-复水过程的抵抗力和回复力表现具有显著差异。与不施肥处理和平衡施用化肥处理相比,有机无机肥配施处理中微生物群落特征的变化幅度最小,表现出更强的抵抗力与回复力。本研究为保障农田生态系统的土壤健康和可持续发展,以及实际生产中的合理灌溉与施肥提供了理论依据。然而本研究仅关注了单一干旱扰动下不同施肥处理的微生物群落稳定性特征,其他扰动下不同施肥处理微生物群落稳定性的表现和长期的微生物群落回复情况有待进一步研究。
| [1] |
Tahat M M, Alananbeh K M, Othman Y A, et al. Soil health and sustainable agriculture[J]. Sustainability, 2020, 12(12): 4859. DOI:10.3390/su12124859
(  0) 0) |
| [2] |
Pimm S L. The complexity and stability of ecosystems[J]. Nature, 1984, 307(5949): 321-326. DOI:10.1038/307321a0
(  0) 0) |
| [3] |
Grimm V, Wissel C. Babel, or the ecological stability discussions: An inventory and analysis of terminology and a guide for avoiding confusion[J]. Oecologia, 1997, 109(3): 323-334. DOI:10.1007/s004420050090
(  0) 0) |
| [4] |
Orwin K H, Wardle D A. New indices for quantifying the resistance and resilience of soil biota to exogenous disturbances[J]. Soil Biology & Biochemistry, 2004, 36(11): 1907-1912.
(  0) 0) |
| [5] |
Griffiths B S, Ritz K, Bardgett R D, et al. Ecosystem response of pasture soil communities to fumigation- induced microbial diversity reductions: An examination of the biodiversity-ecosystem function relationship[J]. Oikos, 2000, 90(2): 279-294. DOI:10.1034/j.1600-0706.2000.900208.x
(  0) 0) |
| [6] |
Zhang B, Deng H, Wang H L, et al. Does microbial habitat or community structure drive the functional stability of microbes to stresses following re-vegetation of a severely degraded soil?[J]. Soil Biology & Biochemistry, 2010, 42(5): 850-859.
(  0) 0) |
| [7] |
Zhao J H, Chen L, Duan Y, et al. Effects of straw returning instead of chemical fertilizer on crop yield and soil fertility in fluvo-aquic soil (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(1): 189-200. [赵金花, 陈林, 段衍, 等. 秸秆还田配合化肥减施对潮土作物产量及土壤肥力的影响[J]. 土壤学报, 2023, 60(1): 189-200.]
(  0) 0) |
| [8] |
Bissett A, Richardson A E, Baker G, et al. Bacterial community response to tillage and nutrient additions in a long-term wheat cropping experiment[J]. Soil Biology & Biochemistry, 2013, 58: 281-292.
(  0) 0) |
| [9] |
Chu H Y, Lin X, Fujii T, et al. Soil microbial biomass, dehydrogenase activity, bacterial community structure in response to long-term fertilizer management[J]. Soil Biology & Biochemistry, 2007, 39(11): 2971-2976.
(  0) 0) |
| [10] |
Chu H Y, Fujii T, Morimoto S, et al. Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil[J]. Applied and Environmental Microbiology, 2007, 73(2): 485-491. DOI:10.1128/AEM.01536-06
(  0) 0) |
| [11] |
Székely A J, Langenheder S. Dispersal timing and drought history influence the response of bacterioplankton to drying–rewetting stress[J]. The ISME Journal, 2017, 11(8): 1764-1776. DOI:10.1038/ismej.2017.55
(  0) 0) |
| [12] |
Zhao B Z, Chen J, Zhang J B, et al. Soil microbial biomass and activity response to repeated drying- rewetting cycles along a soil fertility gradient modified by long-term fertilization management practices[J]. Geoderma, 2010, 160(2): 218-224. DOI:10.1016/j.geoderma.2010.09.024
(  0) 0) |
| [13] |
Kaurin A, Mihelič R, Kastelec D, et al. Resilience of bacteria, Archaea, fungi and N-cycling microbial guilds under plough and conservation tillage, to agricultural drought[J]. Soil Biology & Biochemistry, 2018, 120: 233-245.
(  0) 0) |
| [14] |
Schimel J, Balser T C, Wallenstein M. Microbial stress-response physiology and its implications for ecosystem function[J]. Ecology, 2007, 88(6): 1386-1394. DOI:10.1890/06-0219
(  0) 0) |
| [15] |
Gordon H, Haygarth P M, Bardgett R D. Drying and rewetting effects on soil microbial community composition and nutrient leaching[J]. Soil Biology & Biochemistry, 2008, 40(2): 302-311.
(  0) 0) |
| [16] |
Sun Y F, Deng X H, Tao C Y, et al. Temporal dynamics of rare and abundant soil bacterial taxa from different fertilization regimes under various environmental disturbances[J]. mSystems, 2022, 7(5): e0055922. DOI:10.1128/msystems.00559-22
(  0) 0) |
| [17] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [18] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303
(  0) 0) |
| [19] |
Edgar R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461
(  0) 0) |
| [20] |
de Vries F T, Shade A. Controls on soil microbial community stability under climate change[J]. Frontiers in Microbiology, 2013, 4: 265.
(  0) 0) |
| [21] |
Rocca J D, Simonin M, Blaszczak J R, et al. The microbiome stress project: Toward a global meta-analysis of environmental stressors and their effects on microbial communities[J]. Frontiers in Microbiology, 2019, 9: 3272. DOI:10.3389/fmicb.2018.03272
(  0) 0) |
| [22] |
Qi J J, Chen B B, Gao J M, et al. Responses of soil bacterial community structure and function to dry-wet cycles more stable in paddy than in dryland agricultural ecosystems[J]. Global Ecology and Biogeography, 2022, 31(2): 362-377. DOI:10.1111/geb.13433
(  0) 0) |
| [23] |
Birch H F. The effect of soil drying on humus decomposition and nitrogen availability[J]. Plant and Soil, 1958, 10(1): 9-31. DOI:10.1007/BF01343734
(  0) 0) |
| [24] |
Cosentino D, Chenu C, Le Bissonnais Y. Aggregate stability and microbial community dynamics under drying-wetting cycles in a silt loam soil[J]. Soil Biology & Biochemistry, 2006, 38(8): 2053-2062.
(  0) 0) |
| [25] |
Meisner A, Snoek B L, Nesme J, et al. Soil microbial legacies differ following drying-rewetting and freezing- thawing cycles[J]. The ISME Journal, 2021, 15(4): 1207-1221. DOI:10.1038/s41396-020-00844-3
(  0) 0) |
| [26] |
Polazzo F, Marina T I, Crettaz-Minaglia M, et al. Food web rewiring drives long-term compositional differences and late-disturbance interactions at the community level[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(17): e2117364119.
(  0) 0) |
| [27] |
Kuzyakov Y. Priming effects: Interactions between living and dead organic matter[J]. Soil Biology & Biochemistry, 2010, 42(9): 1363-1371.
(  0) 0) |
| [28] |
Hillebrand H, Kunze C. Meta-analysis on pulse disturbances reveals differences in functional and compositional recovery across ecosystems[J]. Ecology Letters, 2020, 23(3): 575-585. DOI:10.1111/ele.13457
(  0) 0) |
| [29] |
Fukami T. Historical contingency in community assembly: Integrating niches, species pools, and priority effects[J]. Annual Review of Ecology, Evolution, and Systematics, 2015, 46: 1-23. DOI:10.1146/annurev-ecolsys-110411-160340
(  0) 0) |
| [30] |
Shade A, Peter H, Allison S D, et al. Fundamentals of microbial community resistance and resilience[J]. Frontiers in Microbiology, 2012, 3: 417.
(  0) 0) |
| [31] |
Chaer G, Fernandes M, Myrold D, et al. Comparative resistance and resilience of soil microbial communities and enzyme activities in adjacent native forest and agricultural soils[J]. Microbial Ecology, 2009, 58(2): 414-424. DOI:10.1007/s00248-009-9508-x
(  0) 0) |
| [32] |
Hueso S, Hernández T, García C. Resistance and resilience of the soil microbial biomass to severe drought in semiarid soils: The importance of organic amendments[J]. Applied Soil Ecology, 2011, 50: 27-36. DOI:10.1016/j.apsoil.2011.07.014
(  0) 0) |
| [33] |
Liu B J, Bei Q C, Wang X J, et al. Microbial metabolic efficiency and community stability in high and low fertility soils following wheat residue addition[J]. Applied Soil Ecology, 2021, 159: 103848. DOI:10.1016/j.apsoil.2020.103848
(  0) 0) |
| [34] |
Yue X L, Zhang J G, Shi A D, et al. Manure substitution of mineral fertilizers increased functional stability through changing structure and physiology of microbial communities[J]. European Journal of Soil Biology, 2016, 77: 34-43. DOI:10.1016/j.ejsobi.2016.10.002
(  0) 0) |
| [35] |
Sun D S, Li K J, Bi Q F, et al. Effects of organic amendment on soil aggregation and microbial community composition during drying-rewetting alternation[J]. Science of the Total Environment, 2017, 574: 735-743. DOI:10.1016/j.scitotenv.2016.09.112
(  0) 0) |
| [36] |
Fan K K, Delgado-Baquerizo M, Guo X S, et al. Microbial resistance promotes plant production in a four-decade nutrient fertilization experiment[J]. Soil Biology & Biochemistry, 2020, 141: 107679.
(  0) 0) |
| [37] |
Hicks L C, Lin S, Rousk J. Microbial resilience to drying- rewetting is partly driven by selection for quick colonizers[J]. Soil Biology & Biochemistry, 2022, 167: 108581.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


