2. 浙江省建德市林业局, 浙江建德 311600
2. Jiande Foresty Bureau of Zhejiang, Jiande 311600, China
植物与菌根真菌形成的互惠共生体对维持陆地生态系统功能具有重要作用[1]。在菌根类型中,丛枝菌根(arbuscular mycorrhiza,AM)和外生菌根(ectomycorrhiza,ECM)具有最高的物种多样性和最广的地理分布,全球约80%的植物能与AM或ECM真菌形成共生关系[2]。菌根真菌帮助宿主植物吸收土壤中的矿质养分,作为回报,宿主植物将3%~20%的光合产物分配给菌根真菌,因此菌根真菌是土壤碳(C)循环的重要环节[1, 3]。马尾松林(Pinus massoniana Lamb.)属于松科,是松属乔木,广泛分布于中国南部与东南部,种植面积超过200万hm2[4],马尾松林通常倾向于与ECM真菌共生,是典型的ECM真菌占优势的森林。但是近年来,马尾松林的松材线虫病日益严重,林分生产力下降,森林生态系统服务功能低下,致使人们不得不砍伐马尾松林,以AM真菌占优势的阔叶林替代马尾松林。在森林替代过程中,与树木共生的菌根真菌类型发生了明显改变,AM真菌和ECM真菌在生理特点和代谢功能上不同[5],因此,菌根真菌类型的改变如何对土壤碳循环产生深远影响仍不清楚。
不同菌根真菌优势森林导致土壤碳循环存在差异的直接因素可能是菌丝生物量和宿主植物的凋落物质量[6]的不同,而优势菌根真菌间接刺激土壤胞外酶活性也会对土壤碳循环产生影响[5]。菌根真菌的菌丝作为土壤中重要的碳源,其生物量的大小影响土壤有机碳的含量,而有研究表明ECM根外真菌的菌丝生物量是AM真菌的10倍以上[7]。ECM真菌的菌丝贡献了总微生物生物量碳的32%[8],并贡献了地下碳库总输入量的50%~60%[9]。虽然AM真菌根外菌丝数量少,但其周转速率(平均5~6 d)相比于ECM菌丝(平均11个月)较快[10],因此两者生物量对土壤有机质积累的贡献尚不清楚。一般而言,ECM真菌优势森林凋落物质量较低,土壤中氮(N)限制严重,土壤碳氮比相对较高,ECM真菌与腐生微生物竞争氮素,因此凋落物分解较慢,损失较少,所以ECM真菌占优势森林中的有机碳多以半分解凋落物形式积累[11]。此外,菌根真菌通过刺激土壤微生物产生酶,从而分解土壤中的有机质,并且菌根真菌可改变微生物C、N、P获取酶的比值。Cheeke等[5]研究发现,随着ECM树种的占比增加,土壤C、N获取酶的比值和C、P获取酶的比值均逐渐减小,表明在ECM真菌占主导的森林中N、P获取酶活性增加。目前,关于菌根真菌与土壤碳循环的研究较多,但是多数研究的森林纬度差异较大,位于不同的气候带[12],关于亚热带同一地区AM真菌占优势和ECM真菌占优势森林将如何影响土壤中有机碳循环及其驱动因素尚不清楚。
本研究以中国亚热带典型次生林为对象,以空间代替时间,通过野外菌根调查确定AM和ECM优势树种,测定土壤有机碳含量、优势菌根真菌生物量、球囊霉素相关土壤蛋白(GRSP)、土壤微生物群落结构以及生物量,进而探讨不同菌根真菌类型对土壤碳循环的影响及其可能的作用机制。本文提出假设,在亚热带地区,ECM真菌占优势的马尾松林逐渐转变为以AM真菌占优势的阔叶林过程中,可能会由于菌根真菌生物量减少和凋落物质量提高从而导致土壤碳储量下降。研究结果可为评估阔叶林替代马尾松林的生态风险以及在“双碳”背景下科学管理亚热带次生林提供理论指导和数据支撑。
1 材料与方法 1.1 试验样地概况试验样地位于浙江省建德市杨村桥镇十里埠村、白云亭以及玉泉寺后山(29°54′ N~29°58′ N,119°43′ E~119°48′ E),位于浙江省西部,该地温暖湿润,四季分明,雨热同期,属于亚热带北缘季风区,年平均气温为17.4℃,年均总降水量为1 600 mm,年均日照总时数为1 760 h,土壤类型为红壤,植被类型主要有常绿阔叶林、落叶阔叶林、针叶林以及针阔混交林。本实验选择季风常绿阔叶林演替过程中的初级和终级阶段,分别为典型的马尾松林和阔叶林。
阔叶林的主要树种有连蕊茶(Camellia cuspidata(Kochs))、白栎(Quercus fabri Hance)、枫香(Liquidambar formosana Hance)、栲树(Castanopsis fargesii Franch)以及芒萁(Dicranopteris dichotoma)等蕨类植物。马尾松林下植被主要是芒萁(D. dichotoma)等蕨类植物。
1.2 试验设计于2021年8月在建德市杨村桥镇十里埠村、白云亭以及玉泉寺后山分别建立一个样地(200 m×200 m),三个样地之间分别间隔5~8 km,森林面积共计10 hm2左右,每个样地包括相互接壤的马尾松林和阔叶林,代表不同菌根占优势的森林。根据当地林业局记录的信息,所选阔叶林的地点原本均生长马尾松,在20~25年前砍伐后以阔叶林替代。在马尾松林和阔叶林分别选择4个样方(10 m×10 m),3个样地共计24个样方,每个样方之间距离为20 m以上,利用五点取样法采集该样方内0~20 cm表层土壤,每个取样点面积约为50 cm×50 cm,采集1 kg左右的土壤,混合均匀,保存于自封袋中置于冰盒内带回实验室进行分析。将土壤过2 mm筛后,分为三份,大约50 g土壤冷冻干燥后保存于–80℃冰箱中,用于微生物分析;另外大约50 g土壤保存于4℃冰箱中,在一周内完成土壤铵态氮、硝态氮以及土壤酶活性测定;其余土壤在阴凉处风干,用于土壤理化性质测定。
1.3 土壤基本理化性质分析土壤理化分析参考鲁如坤的《土壤农业化学分析方法》[13]。土壤pH采用土水比1︰2.5微电极法测定;土壤有机质(SOC)采用重铬酸钾-浓硫酸外加热法测定;土壤全氮采用凯氏定氮法测定;土壤硝态氮和铵态氮分别采用氯化钾浸提—紫外分光光度法和氯化钾浸提—靛酚蓝比色法测定;土壤有效磷采用盐酸氟化铵浸提—钼锑抗比色法测定;土壤速效钾采用乙酸铵浸提—火焰光度计法测定;土壤微生物生物量碳氮采用硫酸钾浸提—氯仿熏蒸提取法,未熏蒸的对照土壤中的碳氮浓度作为土壤可溶性有机碳(DOC)和可溶性总氮(TDN)[14]。
1.4 土壤酶活性和土壤微生物碳利用效率(CUE)的计算测定5种土壤酶活性:与微生物碳获取相关的β-葡萄糖苷酶(BG)、β-纤维二糖苷酶(CEL),与微生物氮获取相关的β-N-乙酰氨基葡萄糖苷酶(NAG)、亮氨酸氨基肽酶(LEU)以及与微生物磷获取相关的酸性磷酸酶(PHOS)。土壤酶活性测定参照Chen等[15]荧光微孔板检测法,称取2 g鲜土于离心管中,加入30 mL pH为5.0的乙酸钠缓冲液,在25℃、180 r·min–1的振荡机上振荡30 min,用磁力搅拌器搅拌1 min,吸取200 μL土壤悬液于96孔板中,立即加入底物,于25℃黑暗条件培养3 h,在365 nm激发波长和450 nm发射波长下进行荧光定量,计算酶活性。5种酶活性的单位均为nmol·g–1·h–1。
土壤微生物碳利用效率(CUE)是基于碳氮的生态化学计量比[16],计算公式如下:
| $ {\rm{CUE}} = {\rm{CUE}}_{{\rm{max}}}[{\rm{S}}_{{\rm{C:N}}}/({\rm{S}}_{{\rm{C:N}}}+{\rm{K}}_{{\rm{N}}})]$ | (1) |
| $ {\rm{S}}_{{\rm{C:N}}}=(1/{\rm{EEA}}_{{\rm{C:N}}})({\rm{B}}_{{\rm{C:N}}}/{\rm{R}}_{{\rm{DOC:TDN}}})$ | (2) |
式中,KN为半饱和常数,KN=0.5;CUEmax为微生物生长效率的上限,设置为0.6;SC:N为一个标量,代表酶活性的分配抵消可用资源的元素组成和微生物生物量组成之间差异的程度;EEAC:N为碳氮获取酶活性比,用(BG+CEL)/(LEU+NAG)表示;BC:N为微生物生物量碳(MBC)与微生物生物量氮(MBN)之比;RDOC:TDN为微生物可溶性有机碳(DOC)与可溶性总氮(TDN)之比。
土壤向量角(VA,vector angle)和向量长度(VL,vector length)计算公式[16]如下:
| $ {\rm{VA}}/ ^{°} = {\rm{Degrees}}({\rm{ATAN2}}(x\text{,}y))$ | (3) |
| $ {\rm{VL}}=\sqrt {{x^2} + {y^2}} $ | (4) |
式中,Degrees为将弧度转换成角度函数,ATAN2表示将根据给定的x轴及y轴坐标,返回正切值。x为碳磷获取酶的比值,y为碳氮获取酶的比值,x用(BG+CEL)/(BG+CEL+PHOS)表示,y用(BG+CEL)/(BG+CEL+NAG+LEU)表示。土壤向量角表示微生物受到相对氮或磷限制,向量角越大,受到磷限制越大,向量角越小,受到氮限制更强;向量长度越大表示微生物受到碳限制越大。
1.5 土壤球囊霉素相关土壤蛋白(glomalin-related soil protein,GRSP)和麦角固醇测定球囊霉素相关土壤蛋白分为易提取球囊霉素相关土壤蛋白(EE-GRSP)和难提取球囊霉素相关土壤蛋白[17],两者之和为总球囊霉素相关土壤蛋白(T-GRSP),本试验测定了EE-GRSP和T-GRSP含量。称取1 g土壤,用柠檬酸钠溶液提取EE-GRSP和T-GRSP,EE-GRSP在高温高压下提取一次,T-GRSP多次提取,直至浸提液无色透明。以牛血清蛋白为标线,采用考马斯亮蓝法显色,在分光光度计(722S,上海菁华)上测定。
根据Awad等[18]使用的方法,首先测定鲜土中的麦角固醇含量,然后称取30 g鲜土于塑料瓶中,将其置于25℃、恒定湿度的生物培养箱中培养5个月,在此期间,外生菌根真菌死亡,5个月后再次测定土壤中的麦角固醇含量,外生菌根真菌生物量即为培养前的麦角固醇含量减去培养后的麦角固醇含量。麦角固醇提取与测定参考曹梦等[19]的QuEChERS-HPLC法。称取鲜土4.0 g,加入4 mL色谱级甲醇,涡旋振荡后离心,吸取上清液于2 mL装有50 mg N-丙基-乙二胺键合硅胶(PSA)和100 mg无水MgSO4的离心管中,涡旋后离心,取上清液过0.22 μm有机系滤膜,采用液相色谱法上机测定,同时制作麦角固醇的标准曲线。使用的色谱柱为Agilent HC-C18(250 mm×4. 6 mm,5 μm),以色谱级甲醇为流动相,流速为1 mL·min–1,进样量为20 μL,柱温25℃,波长为280 nm。
1.6 磷脂脂肪酸(phospholipid fatty acids,PLFAs)和中性脂肪酸(neutral lipid fatty acid,NLFA)分析脂肪酸提取采用23 mL氯仿:甲醇:柠檬酸盐缓冲液(体积比1︰2︰0.8)的单相萃取物从8 g冻干土中提取2 h。利用硅胶柱从中性脂和糖脂中分离出磷脂[20],用氯仿和丙酮洗脱中性脂和糖脂,用甲醇洗脱极性脂。利用1mL 0.2 mol·L–1的甲醇- KOH和1mL甲醇:甲苯(体积比1︰1)将磷脂甲基化为游离脂肪酸甲酯(FAMEs),以19︰0磷脂酰胆碱作为内标物在气相色谱仪上采用MIDI全自动微生物鉴定系统进行分析。进样量为2 μL,初始温度170℃,以2℃·min–1在4 mL·min–1流速下升温至260℃。
磷脂脂肪酸一般被用来测定微生物群落结构和组成[15],土壤PLFAs提取物使用气相色谱仪(Agilent 6850,Agilent,美国)进行鉴定。脂肪酸按照Zak等[21]的方法进行命名和分类。i14:0、i15:0、a15:0、i16:0、a16:0、i17:0、a17:0为革兰氏阳性菌;cy17:0、cy19:0、16:1ω7c、17:1ω8c、18:1ω7c为革兰氏阴性菌;18:1ω9c和18:2ω6c为真菌;10Me16:0、10Me17:0以及10Me18:0为放线菌。研究表明,PLFA 16:1ω5并非AM真菌特有,在细菌中也会存在,从而导致高估AM真菌生物量,而NLFA 16:1ω5相对于PLFA 16:1ω5而言在AM真菌中具有更高的特异性[22],因此本研究采用NLFA 16:1ω5表征AM真菌生物量。
1.7 数据分析采用独立样本T检验分析上述各个指标在ECM真菌占优势森林和AM真菌占优势森林之间的差异性,采用皮尔森(Pearson)相关性分析了土壤T-GRSP与SOC的相关关系、AM真菌生物量与T-GRSP和EE-GRSP的相关关系以及MBC、G+/G–、CUE与ECM/AM的相关关系,运用SPSS 21.0软件进行分析。决策曲线分析(DCA)是一种模型评价方法,根据DCA分析得出结果中的第一轴小于3,因此采用R语言vegan包对不同优势菌根类型森林土壤微生物群落结构进行冗余分析(redundancy analysis,RDA),并使用置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)来解析两种真菌群落组成和结构的差异性。
2 结果 2.1 不同优势菌根类型森林土壤养分含量ECM真菌占优势的森林土壤与AM真菌占优势的森林土壤理化性质存在差异(表 1)。AM真菌占优势森林土壤有机碳(SOC)、速效钾(AK)、全氮(TN)显著高于ECM占优势森林,而铵态氮(NH4+-N)含量显著低于ECM真菌占优势森林(P < 0.05)。
|
|
表 1 不同优势菌根类型森林土壤理化性质 Table 1 Soil physicochemical properties of two forests dominated by different mycorrhizal fungi |
两种不同菌根真菌占优势的森林土壤的GRSP含量和菌根真菌生物量均存在显著差异(图 1)。AM真菌占优势森林的EE-GRSP和T-GRSP相较于ECM真菌占优势森林均显著增加(P < 0.05),分别提高了31.09%和23.94%。
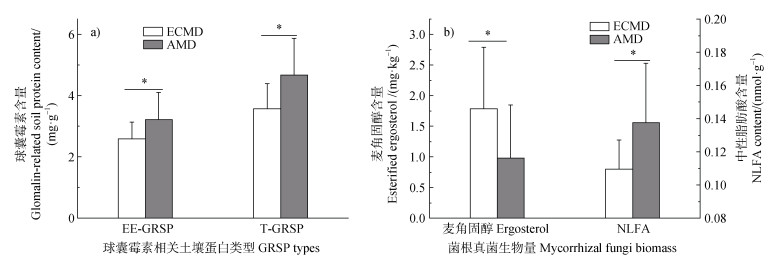
|
注:EE-GRSP,易提取球囊霉素相关土壤蛋白;T-GRSP,总球囊霉素相关土壤蛋白;NLFA,中性脂肪酸,表示AM真菌生物量;*表示同一指标两种森林类型间在0.05水平上具有显著性差异(P < 0.05)。下同。 Note: EE-GRSP, easily extractable glomalin-related soil protein; T-GRSP, total glomalin-related soil protein; NLFA, neutral lipid fatty acids, represents AM fungal biomass; * represent significant differences between the two forest types at the 0.05 level(P < 0.05). The same as below. 图 1 不同菌根真菌类型森林土壤球囊霉素相关土壤蛋白(a)和菌根真菌生物量(b) Fig. 1 The glomalin-related soil protein(a)and mycorrhizal fungi biomass(b)in forest soil of different mycorrhizal fungi types |
麦角固醇含量以及中性脂肪酸(NLFA)16:1ω5c含量,分别用来表征ECM真菌的生物量和AM真菌的生物量。外生菌根真菌生物量在ECM真菌占优势森林显著高于AM真菌占优势森林(P < 0.05),而NLFA则呈现相反的趋势,为ECM真菌占优势森林显著低于AM真菌占优势森林(P < 0.05)(图 1b)。
2.3 土壤胞外酶活性和土壤微生物生物量碳土壤碳氮循环相关酶活性在不同类型菌根真菌占优势的森林中无显著差异(P > 0.05),而酸性磷酸酶活性在AM真菌占优势森林土壤中显著高于ECM真菌占优势森林(P < 0.05)。向量分析发现,两种不同类型菌根优势林的向量角均大于45°,但是ECM真菌占优势森林的向量角显著低于AM真菌占优势森林(P < 0.05),向量长度在两种不同优势菌根森林中无显著差异(图 2c)。
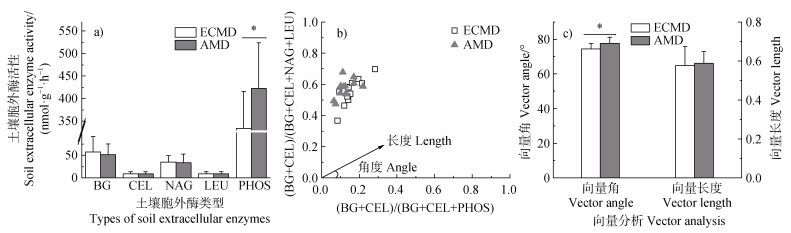
|
注:BG,β-葡萄糖苷酶;CEL,β-纤维二糖苷酶;NAG,β-N-乙酰氨基葡萄糖苷酶;LEU,亮氨酸氨基肽酶;PHOS酸性磷酸酶。下同。 Note: BG, β-glucosidase; NAG, N-Acetyl-glucosaminidas; LEU, L-leucine aminopeptidase; PHOS, acid phosphatase. The same as below. 图 2 不同菌根真菌类型森林土壤酶活性(a)、C / N获取与C / P获取相对比例的胞外酶化学计量学(b)、向量角和向量长度(c) Fig. 2 Enzyme activity(a), the extracellular enzyme stoichiometry of the relative proportions of C to N acquisition versus C to P acquisition(b), vector angle and vector length(c)of forest soil in different mycorrhizal fungi types |
AM真菌占优势森林的土壤微生物生物量碳(MBC)、微生物生物量碳氮的比(MBC:MBN)以及微生物碳利用效率(CUE)显著高于ECM真菌占优势森林(表 2),并且分别提高了64.40%、104%以及53.85%。土壤碳氮比在两种不同类型菌根真菌森林中无显著差异(P > 0.05)。
|
|
表 2 不同类型菌根真菌森林土壤生态化学计量比 Table 2 Ecological stoichiometry of forest soil of different types of mycorrhizal fungi in forest soil |
通过PLFAs测定土壤中微生物群落结构及其生物量(图 3)。土壤中真菌总生物量(fungi)、细菌总生物量(bacteria)以及总微生物生物量(total mass)在两种不同类型优势菌根森林中无显著差异,但是在AM真菌优势林中呈现出更高的趋势(图 3a)。AM真菌占优势森林放线菌(actinomycetes)和革兰氏阳性细菌(G+)显著高于ECM真菌占优势森林(图 3b)。AM真菌占优势森林土壤中革兰氏阳性菌与革兰氏阴性菌的比(G+/G–)显著高于ECM占优势森林(P < 0.05,图 3c)。

|
注:F/B,真菌与细菌比值;G+/G–,革兰氏阳性菌与革兰氏阴性菌比值;PLFAs,磷脂脂肪酸。下同。 Note: F/B, fungal to bacterial biomass ratio; G+/G–, Gram-positive bacteria/gram-negative bacteria; PLFAs, phospholipid fatty acids. The same as below. 图 3 不同类型菌根真菌森林土壤真菌、细菌、微生物总量(a)和各类群生物量(b)及比值(c) Fig. 3 Biomass of total of fungi, bacteria, and microorganisms(a)and various groups(b)and the ratio of soil microbial communities(c)in different types of mycorrhizal fungi forest |
皮尔森相关分析表明,SOC与T-GRSP含量呈显著正相关(图 4a),T-GRSP和EE-GRSP均与AM真菌生物量呈显著正相关(图 4b,图 4c)。但是微生物生物量碳(MBC)(图 4d)、革兰氏阳性菌与阴性菌之比(G+/G–)(图 4e)以及微生物碳利用效率(CUE)(图 4f)均与ECM和AM真菌生物量的比(ECM/AM)呈显著负相关(P < 0.05)。
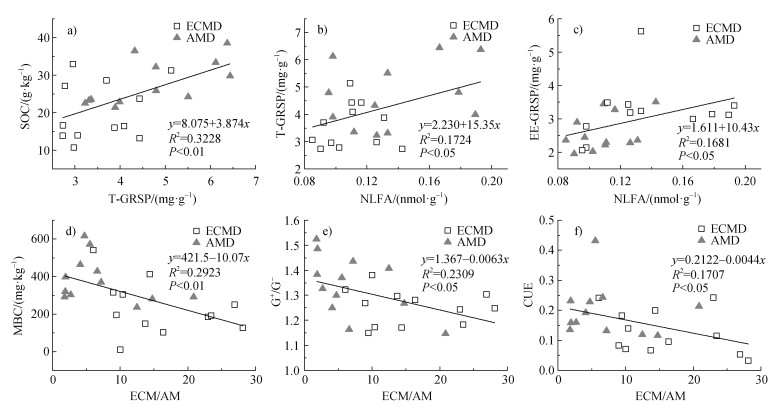
|
注:ECM/AM,ECM真菌生物量与AM真菌生物量的比值。下同。 Note: ECM/AM, the ratio of ECM fungal biomass to AM fungal biomass. The same as below. 图 4 SOC与T-GRSP(a)、GRSP与NLFA(b、c)以及MBC(d)、G+/G–(e)和CUE(f)与ECM/AM的相关关系 Fig. 4 Correlation relationships between SOC and T-GRSP(a), GRSP and NLFA(b, c), MBC(d), G+/G–(e), CUE(f)and ECM/AM |
两种优势菌根真菌森林的土壤微生物群落组成和土壤环境因子的冗余分析结果如图 5所示。轴1(RDA1)解释了样本中81.42%的变异,轴2(RDA2)解释了10.39%的变异,两者共解释了91.81%的微生物群落结构的变异。根据PERMANOVA检验,ECM真菌占优势森林和AM真菌占优势森林的微生物群落组成具有显著性差异(P < 0.05)。由图 5b可知,cy19:0ω9c、cy19:0ω7c、18:2ω6c、18:1ω9c以及10Me17:0对群落组成差异贡献较大。在RDA1轴上,随着ECM真菌占优势转变为AM真菌占优势,环境变量与其呈正相关,并且其中AM真菌生物量(R2=0.48、P=0.002)、土壤有机碳(R2=0.47、P=0.003)、全氮(R2=0.41、P=0.003 5)、硝态氮(R2=0.38、P=0.003)、速效钾(R2=0.29、P=0.03)以及pH(R2=0.34、P=0.002)对微生物群落结构变异具有显著影响。
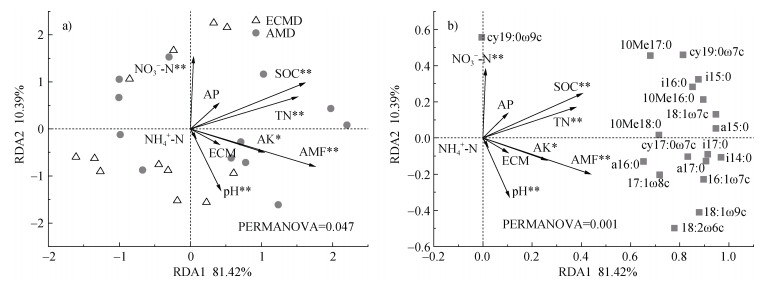
|
注:图中箭头代表环境因子变量;ECM,外生菌根真菌生物量;AMF,丛枝菌根真菌生物量;PERMANOVA,置换多元方差分析。 Note: Arrows represented environmental variables; ECM, ECM fungi biomass; AMF, AM fungi biomass; PERMANOVA, permutational multivariate analysis of variance. 图 5 土壤微生物群落与环境因子(a)以及PLFAs标志物与环境因子(b)的冗余分析(RDA) Fig. 5 Redundancy analysis(RDA)of soil microbial community and environmental factors(a)and PLFAs markers and environmental factors(b) |
本研究AM真菌占优势的森林土壤中的有机碳含量显著高于ECM真菌占优势的森林土壤(表 1),不符合先验假设,并且与Barceló等[23]和Li等[24]以及Lin等[25]的研究结果相反,他们认为ECM真菌占优势的森林表层土壤有机碳含量显著高于AM真菌占优势的森林。
Awad等[18]研究表明,菌根真菌生物量是土壤碳库重要的来源之一。本试验中ECM真菌生物量(以麦角固醇含量为表征)在马尾松林中的含量更高,而AM真菌生物量(以NLFA16:1ω5为表征)在阔叶林中较高,因此,本文中马尾松林是以ECM真菌占优势的森林,阔叶林是以AM真菌占优势的森林。Högberg和Högberg[8]研究表明,在北方森林中,外生菌根真菌菌丝对土壤微生物生物量的贡献可能达到1/3,并且可能与根系一起产生了土壤中1/2的可溶性有机碳。但是本试验中未发现ECM真菌生物量与有机碳的相关性,甚至ECM真菌生物量的趋势与有机碳相反(表 1,图 1b)。但是Lindahl等[26]的研究结果支持本试验结果,他们对于瑞典北方森林土壤有机表层的碳储量进行测定,发现特定的ECM真菌物种—Cortinarius acutus s.1.的存在使碳储量降低了33%。根据现有的理论以及全球分析[27],ECM真菌大多是通过与腐生分解者竞争来抑制有机碳分解,而该物种则积极参与有机碳的分解,减少了局部碳储量。Lindahl等[26]研究结果还表明,Cortinarius属的其他类群也倾向与有机碳含量呈负相关,因此,ECM真菌对有机质积累的作用与其群落组成有很大关系。然而本文尚未测定ECM真菌群落特征,今后的研究将继续深入探究ECM真菌群落对于有机碳的影响。此外,以往ECM真菌多数在温带地区,温度限制了凋落物中顽固组分的分解,导致有机质积累[28],而本研究ECM真菌优势林位于亚热带地区,温度不再限制腐生微生物的活性,增强了土壤有机质的分解[23]。Barceló等[23]研究表明温带森林中随着ECM真菌丰度增加,土壤C︰N上升,但在热带地区土壤C︰N无显著变化。本文研究发现土壤C︰N在两种不同类型的菌根真菌森林中无显著差异(表 2),与Barceló等[23]的结果类似,这可能是因为AM真菌占优势森林与ECM真菌优势森林相比,土壤SOC和TN含量均显著提高,但对土壤C︰N无明显影响。
AM真菌菌丝凋亡后输入土壤中的GRSP含量是导致AM占优势森林土壤有机碳含量高于ECM真菌占优势森林的重要影响因素。T-GRSP和EE- GRSP在AM真菌优势林显著高于ECM真菌优势林。GRSP是AM真菌细胞壁的重要组成成分[17],因此在大多数情况下,GRSP含量与AM真菌定殖有显著相关性[20],本研究结果也证实了这一点(图 4c)。研究表明GRSP贡献了地下土壤有机碳的3%~12%[11],在土壤碳库中有着重要的地位,本研究结果也表明,GRSP与土壤有机碳呈显著正相关(图 4a),因此GRSP的差异可能是导致两种森林有机碳含量差异的一个重要因素。
3.2 不同类型菌根真菌森林对土壤微生物群落结构的影响PLFAs测定显示不同类型菌根真菌占优势森林土壤微生物群落组成和结构具有显著差异(图 5),SOC含量和AM真菌生物量是微生物群落变异的主要影响因素,因此不同类型的菌根真菌可能招募了不同的微生物类群,影响土壤有机质积累和分解过程。本试验结果表明,AM真菌占优势的森林土壤放线菌生物量相对于ECM真菌占优势森林显著增加(图 3b)。放线菌属于r-策略微生物,与负激发效应相关,更专注于利用植物残体,有利于土壤中SOC积累[29]。相对于ECM真菌占优势的森林,AM真菌占优势森林生态系统具有更高的初级生产力[11],产生更多凋落物,因此会招募更多的放线菌,从而导致AM真菌优势森林SOC显著高于ECM真菌优势森林。此外,本研究发现相比于ECM真菌占优势森林,AM真菌占优势的森林G+细菌丰度更高(图 3b),随着ECM/AM升高,G+/G–随之下降,两者呈现显著负相关(图 4e),并且土壤有机碳是驱动两种不同类型菌根真菌森林土壤微生物的重要因素(图 5a)。Fanin等[30]发现革兰氏阴性菌更多地利用易分解的碳源,而革兰氏阳性菌优先利用更难分解的碳作为微生物碳源,因此G+/G–可指示土壤碳源可利用性。其次,Mitchell等[31]研究表明土壤活性碳库耗尽后,革兰氏阳性菌会显著增加,因此,AM真菌优势森林中G+细菌更多,可能是因为其有更多的稳定碳库存在,例如AM真菌占优势森林中有大量的GRSP积累,这是一种稳定的有机碳,研究表明其分解需要6~42年[11]。G+细菌包括更多寡营养微生物,相比于许多呼吸速率较快的富营养微生物,寡营养微生物生长缓慢,因此G+细菌和G–细菌对于碳源利用效率不同[32]。
本研究表明,ECM真菌占优势森林的土壤微生物碳利用效率(CUE)显著低于AM真菌占优势森林(表 2)。ECM真菌菌丝直接分泌特异性胞外酶利用有机氮源,微生物受到严重氮限制,分解大量有机质以获得足够氮。ECM真菌占优势森林中更低的MBC和向量分析结果均显示ECM真菌优势森林中微生物生物量固持的碳更少,以及更强的氮限制(图 2c)。CUE是指分配给生长的有机碳与微生物吸收的有机碳的比值,CUE更高代表微生物生长更有效,通过呼吸作用排放的CO2较少,有机碳积累潜力更高,土壤中积累的有机碳更多[33]。本研究中,随着ECM真菌生物量与AM真菌生物量比值升高,CUE显著下降(图 4f),这可能是因为在养分限制情况下,土壤微生物会被迫分配较多的能量以获取养分,从而增加其呼吸作用,降低微生物CUE[33],因此ECM真菌占优势森林的CUE更低。Hagenbo等[34]也有类似的猜测,他们认为可能是由于ECM真菌占优势森林土壤氮有效性降低,而菌丝为了维持植物的生长,降低了菌丝的碳利用效率,因此ECM真菌优势森林土壤有机碳含量显著低于AM真菌优势森林。此外,研究表明,在养分限制的情况下,宿主植物对于菌根共生体的投入更大,以活化难分解有机质,而ECM真菌则成为或代替腐生真菌成为分解者,增强表土有机碳的周转[22]。本研究表明ECM真菌占优势森林中养分有效性较低,ECM真菌受到氮限制(图 2c),因此猜测其需要分解更多的有机质获得氮素。Thoms等[35]发现土壤碳源多样性与微生物多样性和总量呈正比,由于AM真菌优势林凋落物及根系多样性显著高于ECM真菌优势林,因此推测,AM真菌优势林的微生物多样性显著高于ECM真菌优势林。本研究结果表明,ECM真菌占优势森林和AM真菌占优势森林土壤微生物群落结构具有显著性差异(P < 0.05),并且AM真菌生物量和有机碳含量与其变异显著相关(图 5a)。ECM真菌占优势的森林土壤放线菌和革兰氏阳性细菌PLFAs显著低于AM真菌优势林,其余各类群微生物PLFAs也在ECM真菌优势林呈现出更低的趋势(图 3b)。有研究[36]表明,AM真菌在招募土壤微生物过程中起着重要作用,对微生物群落的影响甚至超过根系。与本研究之前的推测一致,不同类型菌根真菌招募的微生物群落差异可能是驱动有机碳含量差异的重要原因。
4 结论ECM真菌占优势森林土壤有机碳含量以及速效钾、全氮含量均显著低于AM真菌占优势的森林,并且两种类型菌根真菌森林的微生物群落存在显著差异,ECM真菌占优势森林的微生物各类群生物量相对AM真菌优势森林有下降的趋势。本研究证实将ECM真菌优势的马尾松林转变为AM真菌优势的阔叶林,可通过AM真菌菌丝产生的GRSP和招募高CUE的微生物群落来提高土壤中有机碳含量。今后的研究可深入探究森林生物量、光合作用强度等对不同林分有机碳的影响,可更加科学地评估ECM真菌优势的马尾松林转变为AM真菌优势的阔叶林是否为提高生态系统碳汇功能的有效手段。
| [1] |
Guo L D, Tian C J. Progress of the function of mycorrhizal fungi in the cycle of carbon and nitrogen (In Chinese)[J]. Microbiology China, 2013, 40(1): 158-171. [郭良栋, 田春杰. 菌根真菌的碳氮循环功能研究进展[J]. 微生物学通报, 2013, 40(1): 158-171.]
(  0) 0) |
| [2] |
Anthony M A, Crowther T W, van der Linde S, et al. Forest tree growth is linked to mycorrhizal fungal composition and function across Europe[J]. The ISME Journal, 2022, 16(5): 1327-1336. DOI:10.1038/s41396-021-01159-7
(  0) 0) |
| [3] |
Ge J F, Yang W Z, Gao X F, et al. Impacts of mycorrhiza symbionts on ammonia-oxidizing microorganisms as affected by management intensity of Phyllostachys pubescens forests (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(2): 505-513. [葛江飞, 杨为中, 高雄飞, 等. 不同经营强度下毛竹丛枝菌根共生体对氨氧化微生物的影响[J]. 土壤学报, 2021, 58(2): 505-513.]
(  0) 0) |
| [4] |
Yang Y R, Ding J H, Zhang T L, et al. Phenolic acids detection in soil of Pinus massoniana forest and its effect on shrub and grass germination (In Chinese)[J]. Soils, 2013, 45(2): 291-294. [杨奕如, 丁健桦, 张桃林, 等. 马尾松林土壤酚酸类物质检测及其对灌草萌发的影响[J]. 土壤, 2013, 45(2): 291-294.]
(  0) 0) |
| [5] |
Cheeke T E, Phillips R P, Brzostek E R, et al. Dominant mycorrhizal association of trees alters carbon and nutrient cycling by selecting for microbial groups with distinct enzyme function[J]. New Phytologist, 2017, 214(1): 432-442. DOI:10.1111/nph.14343
(  0) 0) |
| [6] |
Mei K C, Chen Y M, Fan Y X, et al. Effects of litters and phosphorus addition on soil carbon priming effect in Pinus massoniana forest (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(4): 1089-1099. [梅孔灿, 陈岳民, 范跃新, 等. 凋落叶和磷添加对马尾松林土壤碳激发效应的影响[J]. 土壤学报, 2022, 59(4): 1089-1099.]
(  0) 0) |
| [7] |
Neumann J, Matzner E. Biomass of extramatrical ectomycorrhizal mycelium and fine roots in a young Norway spruce stand-a study using ingrowth bags with different substrates[J]. Plant and Soil, 2013, 371(1/2): 435-446.
(  0) 0) |
| [8] |
Högberg M N, Högberg P. Extramatrical ectomycorrhizal mycelium contributes one-third of microbial biomass and produces, together with associated roots, half the dissolved organic carbon in a forest soil[J]. New Phytologist, 2002, 154(3): 791-795. DOI:10.1046/j.1469-8137.2002.00417.x
(  0) 0) |
| [9] |
Soudzilovskaia N A, van der Heijden M G, Cornelissen J H, et al. Quantitative assessment of the differential impacts of arbuscular and ectomycorrhiza on soil carbon cycling[J]. New Phytologist, 2015, 208(1): 280-293. DOI:10.1111/nph.13447
(  0) 0) |
| [10] |
Staddon P L, Ramsey C B, Ostle N, et al. Rapid turnover of hyphae of mycorrhizal fungi determined by AMS microanalysis of 14C[J]. Science, 2003, 300(5622): 1138-1140. DOI:10.1126/science.1084269
(  0) 0) |
| [11] |
Jin W H, Shao S, Chen J H, et al. Research progress in the impact of different mycorrhizal types on soil carbon cycling (In Chinese)[J]. Journal of Zhejiang A & F University, 2021, 38(5): 953-962. [金文豪, 邵帅, 陈俊辉, 等. 不同类型菌根对土壤碳循环的影响差异研究进展[J]. 浙江农林大学学报, 2021, 38(5): 953-962.]
(  0) 0) |
| [12] |
Carrara J E, Walter C A, Freedman Z B, et al. Differences in microbial community response to nitrogen fertilization result in unique enzyme shifts between arbuscular and ectomycorrhizal-dominated soils[J]. Global Change Biology, 2021, 27(10): 2049-2060. DOI:10.1111/gcb.15523
(  0) 0) |
| [13] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [14] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707. DOI:10.1016/0038-0717(87)90052-6
(  0) 0) |
| [15] |
Chen J H, Chen D, Xu Q F, et al. Organic carbon quality, composition of main microbial groups, enzyme activities, and temperature sensitivity of soil respiration of an acid paddy soil treated with biochar[J]. Biology and Fertility of Soils, 2019, 55(2): 185-197. DOI:10.1007/s00374-018-1333-2
(  0) 0) |
| [16] |
Zhao Y Z, Liang C F, Shao S, et al. Linkages of litter and soil C: N: P stoichiometry with soil microbial resource limitation and community structure in a subtropical broadleaf forest invaded by Moso bamboo[J]. Plant and Soil, 2021, 465(1/2): 473-490.
(  0) 0) |
| [17] |
Que H, Ge Y Y, Kang F X, et al. Content and distribution of glomalin-related soil protein in soils of Nanjing under different land use types (In Chinese)[J]. Soils, 2015, 47(4): 719-724. [阙弘, 葛阳洋, 康福星, 等. 南京典型利用方式土壤中球囊霉素含量及剖面分布特征[J]. 土壤, 2015, 47(4): 719-724.]
(  0) 0) |
| [18] |
Awad A, Majcherczyk A, Schall P, et al. Ectomycorrhizal and saprotrophic soil fungal biomass are driven by different factors and vary among broadleaf and coniferous temperate forests[J]. Soil Biology and Biochemistry, 2019, 131: 9-18. DOI:10.1016/j.soilbio.2018.12.014
(  0) 0) |
| [19] |
Cao M, Li Y, Sun Z X, et al. A new QuEChERS-HPLC method for determining ergosterol in soil (In Chinese)[J]. Chinese Journal of Analysis Laboratory, 2019, 38(2): 162-166. [曹梦, 李勇, 孙忠祥, 等. QuEChERS-HPLC法测定土壤中麦角甾醇含量[J]. 分析试验室, 2019, 38(2): 162-166.]
(  0) 0) |
| [20] |
Qin H, Niu L M, Wu Q F, et al. Bamboo forest expansion increases soil organic carbon through its effect on soil arbuscular mycorrhizal fungal community and abundance[J]. Plant and Soil, 2017, 420(1/2): 407-421.
(  0) 0) |
| [21] |
Zak D R, Pregitzer K S, Curtis P S, et al. Atmospheric CO2 and the composition and function of soil microbial communities[J]. Ecological Applications, 2000, 10(1): 47-59.
(  0) 0) |
| [22] |
Olsson P A, Bååth E, Jakobsen I, et al. The use of phospholipid and neutral lipid fatty acids to estimate biomass of arbuscular mycorrhizal fungi in soil[J]. Mycological Research, 1995, 99(5): 623-629. DOI:10.1016/S0953-7562(09)80723-5
(  0) 0) |
| [23] |
Barceló M, Bodegom P M, Tedersoo L, et al. Mycorrhizal tree impacts on topsoil biogeochemical properties in tropical forests[J]. Journal of Ecology, 2022, 110(6): 1271-1282. DOI:10.1111/1365-2745.13868
(  0) 0) |
| [24] |
Li J W, Shangguan Z P, Deng L. Variations of belowground C and N cycling between arbuscular mycorrhizal and ectomycorrhizal forests across China[J]. Soil Research, 2020, 58(5): 441-451. DOI:10.1071/SR19377
(  0) 0) |
| [25] |
Lin G, McCormack M L, Ma C, et al. Similar below- ground carbon cycling dynamics but contrasting modes of nitrogen cycling between arbuscular mycorrhizal and ectomycorrhizal forests[J]. New Phytologist, 2017, 213(3): 1440-1451. DOI:10.1111/nph.14206
(  0) 0) |
| [26] |
Lindahl B D, Kyaschenko J, Varenius K, et al. A group of ectomycorrhizal fungi restricts organic matter accumulation in boreal forest[J]. Ecology Letters, 2021, 24(7): 1341-1351. DOI:10.1111/ele.13746
(  0) 0) |
| [27] |
Averill C, Turner B L, Finzi A C. Mycorrhiza-mediated competition between plants and decomposers drives soil carbon storage[J]. Nature, 2014, 505(7484): 543-545. DOI:10.1038/nature12901
(  0) 0) |
| [28] |
Koven C D, Hugelius G, Lawrence D M, et al. Higher climatological temperature sensitivity of soil carbon in cold than warm climates[J]. Nature Climate Change, 2017, 7(11): 817-822. DOI:10.1038/nclimate3421
(  0) 0) |
| [29] |
Fu X, Song Q, Li S, et al. Dynamic changes in bacterial community structure are associated with distinct priming effect patterns[J]. Soil Biology and Biochemistry, 2022, 169: 108671. DOI:10.1016/j.soilbio.2022.108671
(  0) 0) |
| [30] |
Fanin N, Kardol P, Farrell M, et al. The ratio of Gram- positive to Gram-negative bacterial PLFA markers as an indicator of carbon availability in organic soils[J]. Soil Biology and Biochemistry, 2019, 128: 111-114. DOI:10.1016/j.soilbio.2018.10.010
(  0) 0) |
| [31] |
Mitchell P J, Simpson A J, Soong R, et al. Shifts in microbial community and water-extractable organic matter composition with biochar amendment in a temperate forest soil[J]. Soil Biology and Biochemistry, 2015, 81: 244-254. DOI:10.1016/j.soilbio.2014.11.017
(  0) 0) |
| [32] |
Chen L F, He Z B, Wu X R, et al. Linkages between soil respiration and microbial communities following afforestation of alpine grasslands in the northeastern Tibetan Plateau[J]. Applied Soil Ecology, 2021, 161: 103882. DOI:10.1016/j.apsoil.2021.103882
(  0) 0) |
| [33] |
Bi Q F. Different fertilization modes and cultivation years affect soil phosphorus availability and carbon-nitrogen- phosphorus coupling transformations and their microbial mechanism[M]. Hangzhou: Zhejiang University, 2020.[毕庆芳. 施肥模式和耕作年限影响土壤磷有效性和碳氮磷耦合转化的微生物学机制[D]. 杭州: 浙江大学, 2020.]
(  0) 0) |
| [34] |
Hagenbo A, Hadden D, Clemmensen K E, et al. Carbon use efficiency of mycorrhizal fungal mycelium increases during the growing season but decreases with forest age across a Pinus sylvestris chronosequence[J]. Journal of Ecology, 2019, 107(6): 2808-2822. DOI:10.1111/1365-2745.13209
(  0) 0) |
| [35] |
Thoms C, Gattinger A, Jacob M, et al. Direct and indirect effects of tree diversity drive soil microbial diversity in temperate deciduous forest[J]. Soil Biology and Biochemistry, 2010, 42(9): 1558-1565. DOI:10.1016/j.soilbio.2010.05.030
(  0) 0) |
| [36] |
Zhou J C, Zhang L, Feng G, et al. Arbuscular mycorrhizal fungi have a greater role than root hairs of maize for priming the rhizosphere microbial community and enhancing rhizosphere organic P mineralization[J]. Soil Biology and Biochemistry, 2022, 171: 108713. DOI:10.1016/j.soilbio.2022.108713
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


