2. 西北农林科技大学水土保持研究所/黄土高原土壤侵蚀与旱地农业国家重点实验室, 陕西杨凌 712100
2. Institute of Soil and Water Conservation, Northwest A&F University/The State Key Laboratory of Soil Erosion and Dryland Farming on Loess Plateau, Yangling, Shaanxi 712100, China
草甘膦农药(C3H8NO5P)具有高效、广谱、低毒的特点被广泛应用于农业及园艺等行业[1-2],是当今世界上生产量及使用量最大的农药[3-4]。特别是随着抗草甘膦转基因作物在世界范围的发展与推广,草甘膦农药的投入量显著增加[5],其环境风险也日益凸显。研究表明,草甘膦农药在土壤中发生吸附、迁移等过程对环境和生物产生影响,最终通过食物链对人体产生危害[6]。Paz-y-Miño等[7]研究发现,生活在施用草甘膦农药区域及周边的人们的DNA明显受到更高程度的损伤;而且有报道指出,草甘膦农药还可能诱发皮肤癌等健康问题[8]。近年来,草甘膦及其代谢产物氨甲基膦酸(AMPA)在水体、土壤及大气中被频繁检出。Silva等[9]通过筛查法对欧洲农田土壤农药残留进行检测,结果表明:80%以上筛检土壤中含有农药残留,而多种农药并存的样品近60%,其中草甘膦及AMPA检测率及检测含量最高。土壤中大量残留的草甘膦及AMPA不仅对土壤健康造成影响,还可能与其他污染物质相结合,产生更复杂的生态毒理危害。刘冰等[10]研究表明,长期施用10%草甘膦水剂会增加土壤电导率、pH和总碱度,盐碱化趋势增加,从而导致土壤肥力降低,影响作物生长。毛美红等[11]研究发现,长期施用草甘膦导致土壤容重增加、土壤总孔隙度降低,土壤有机质含量显著下降。此外,草甘膦农药还对土壤微生物的种群数量、土壤中细菌、放线菌和真菌生长速率均具有一定的抑制作用,并随草甘膦喷施浓度的增加抑制作用逐渐增强[12]。同时,草甘膦农药影响微生物和植物的共生作用,进而影响土壤有机质含量和植物的抗病性。因此,尽管草甘膦在杂草控制等方面具有显著的效用,但其喷施所带来的环境危害和健康风险问题,越来越被人们关注。
Bento等[13]研究发现草甘膦在30℃时的衰减速度为5℃时的8.4倍,光照对其衰减并无显著影响,但土壤水分对衰减速率具有显著性影响。Al-Rajab和Schiavon [14]研究发现草甘膦在砂壤土、粉砂土和黏壤土的降解半衰期分别为19 d、14.5 d和4 d;辛龙川[15]研究发现在黄土不同粒径团聚体中草甘膦农药降解半衰期为1.17~2.20 d。谢怡等[16]研究发现,草甘膦在自然条件下降解半衰期为38.72 d,而通过灭菌去除原生微生物后,半衰期延长至96.27 d。然而,以上研究结果的差异主要因土壤性质及其观测条件不同所引起的,特别是在草甘膦土壤环境行为研究中往往侧重环境因子,而忽略其本身的化学属性,如电荷、点位吸附且其吸附点位与土壤磷酸盐类似等。Gimsing[17]、Nicholls和Evans [18]认为土壤中磷酸盐与草甘膦存在吸附位点竞争,磷酸盐浓度是决定草甘膦生物有效性的最重要因素。Hébert等[19]研究发现,磷肥施用会显著增加柳树根系对草甘膦的吸收及草甘膦向叶片的转运,从而增加了柳树叶片中草甘膦含量的累积;而da Costa等[20]研究发现,土壤磷含量会影响草甘膦农药的除草效果,且随土壤磷含量的增加,草甘膦的除草性能降低;Zhong等[21]发现,磷酸盐含量的增加还可以减轻草甘膦对水鳖科植物的毒性。由此可见,土壤中磷含量高低对草甘膦的土壤环境行为及其生物有效性产生直接影响,进而可能影响土壤中磷元素的营养功能及作物的生长。
黄土高原地区生态环境脆弱、土壤养分匮乏,特别是黄土母质形成的土壤中磷含量水平较低[22-23],因此,磷肥施用可以快速提高土壤中有效磷的含量,从而满足作物生长、保证粮食产量及农业发展。然而,黄土区草甘膦农药的土壤环境行为是否因土壤磷含量水平变化受到影响,以及其相互作用下有效性问题,仍鲜有报告。基于此,本研究通过室内控制模拟试验,探讨黄土中不同磷酸二氢钾添加条件下,草甘膦农药的衰减行为、土壤磷有效性以及其复合作用条件下其他土壤性质的响应特征,明确磷酸二氢钾施用水平与草甘膦农药土壤环境行为的相互作用关系,以期为后续草甘膦类农药的安全施用及土壤磷有效性研究提供参考。
1 材料与方法 1.1 材料与试剂采集杨凌周边农田耕层土壤(0~20 cm,田间持水量20%),去除土壤中作物残留、根系及砾石,自然条件下风干并过2 mm筛,其基本性质为:土壤容重1.25~1.40 g·cm–3(0~20 cm),田间持水量为20%,pH(H2O)8.02,有机质含量为7.86 g·kg–1,全氮含量为1.43 g·kg–1;全磷含量为0.89 g·kg–1,速效磷含量为27.56 mg·kg–1。本试验中所使用的化学试剂有:磷酸二氢钾(分析纯,Darmstadt)、草甘膦和AMPA(纯度≥98%,Sigma-Aldrich)、100 μg·L–1的草甘膦和AMPA同位素内标物(Augsburg)、氯甲酸-9-芴基甲酯(纯度≥98%,Sigma-Aldrich)、十水合四硼酸钠(纯度≥99.5%,Sigma-Aldrich)、氢氧化钾和盐酸(分析纯,Darmstadt)、甲醇和乙腈(色谱纯,All Chemicals)、甲酸(纯度≥98%,Gevaar)、乙酸铵(色谱纯,Sigma)、液态氨溶液(25%,Merck KGaA)、硼酸缓冲液(5%,Gevaar)、FMOC-Cl(纯度≥98%,Sigma-Aldrich),试验用水为超纯水。
1.2 试验设计根据研究目的及田间肥料施用的实际,本研究中磷酸二氢钾添加水平为:0 mg·kg–1(P0)、50 mg·kg–1(P1)、100 mg·kg–1(P2);土壤水分设计为田间持水量的20%(20FC)、60%(60FC),分别模拟田间土壤表层及自然状态下的土壤水分含量。为恢复土壤微生物活性,先将水分调节后的土壤放入智能气候培养箱培养7 d,保持气候箱温度为25±0.5℃,湿度为80±2%,光照16 h,黑暗8 h,并每天进行两次水分调节,使其土壤含水量保持稳定。预培养结束后,按照磷酸二氢钾添加处理水平,将磷酸二氢钾与土壤充分混合,然后称重放入塑料培养盒中(直径为7 cm,高10 cm),考虑采样时间点(0 d、1 d、3 d、5 d、7 d、14 d、30 d和60 d)及试验重复数量(每个处理设置3个重复),每种磷酸二氢钾添加处理为24个。土壤称取完成后,将配制好的草甘膦溶液均匀地喷施在土壤表面,快速用塑料棒混合(初始浓度为15 mg·kg−1)并整平土壤表面,然后用木槌在土壤表面10 cm处利用其自由落体压实土壤,最后放入培养箱进行观测实验。同时,设置空白试验,即不喷施农药,但加入等量的超纯水,按照同样的步骤进行混合并压实。培养期间,监测培养盒中土壤水分变化,并进行每日两次水分调节,观测培养共计60 d。
样品采集:按照采样设计,在农药喷施当天(0 d)及喷施后的第1、3、5、7、14、30和60天,对土壤样品进行采集,并迅速将样品分成两部分:一部分迅速冷冻保存(–20℃),用来测试草甘膦、AMPA含量以及土壤酶活性;另一部分进行自然风干,用以分析土壤性质。
1.3 草甘膦与AMPA的测定根据Yang等[24]研究方法,具体操作为:取2 g土壤样品于50 mL离心管,用10 mL 0.6 mol·L–1的KOH进行浸提,振荡1 h后在3500 r.min–1的条件下离心15 min。取1 mL上清液于10 mL试管中,加入80 µL 6 mol·L–1的HC1将pH调至9左右,然后加入5 μg·mL–1同位素标记的草甘膦/AMPA混合溶液40 µL,混合均匀后加入0.5 mL 5%浓度的硼酸盐缓冲液以及0.5 mL 6.5 mmol·L–1FMOC-Cl,振荡混合并在室温条件下进行30 min衍生反应。衍生反应结束后加入50 µL蚁酸,再次混匀并吸取0.5 mL的衍生物0.45 μm移置滤管中,待试。标准曲线采用0 μg.mL–1、0.01 μg.mL–1、0.02 μg·mL–1、0.04 μg·mL–1、0.1 μg.mL–1、0.2 μg·mL–1、0.4 μg.mL–1、1 μg.mL–1、2 μg.mL–1和4 μg.mL–1的标准溶液,其衍生方式与样品相同。然后,使用XBridge Shield RP C18色谱柱(3.5 μm孔径,150 mm×2.1 mm内径),通过液相色谱-串联质谱法测定草甘膦和AMPA浓度,具体参考Yang[24]等的研究。
1.4 土壤性质测定常规指标测定:采用碳酸氢钠浸提-钼锑抗分光光度法测定土壤速效磷含量;重铬酸钾容量法测定土壤有机质含量;碱熔—钼锑抗分光光度法测定土壤全磷含量;凯式法消解,凯式定氮仪测定土壤全氮含量。具体步骤见土壤农业化学分析方法[25]。
酶活性指标测定:微孔板荧光法测定三种磷酸二氢钾施用下土壤N-乙酰氨基-β-葡萄糖苷酶(NAG)、亮氨酸酶(LAP)、β-葡萄糖酶(BG)和碱性磷酸酶(ALP)活性。加3 g土壤样品于培养皿,加125 mL调好pH的Tris-HCl缓冲液,用磁悬搅拌器进行搅拌,然后分别吸取土壤悬浮液、酶底物和标准物质于酶标板中,然后于25℃培养箱中培养,NAG、BG培养4 h;LAP培养2 h;ALP培养0.5 h;两种标准物质培养2 h。结束后使用多功能酶标仪在365 nm激发波长和450 nm发射波长下测定荧光值并计算酶活性。
1.5 数据分析基于草甘膦在土壤中的衰减动力学特征,本试验采用一级动力学降解模型对测定数据进行拟合,其公式表达如下:
| $ C_t=C_0 \times e^{-k t}$ | (1) |
式中,Ct为时间t的草甘膦浓度,C0为初始草甘膦浓度(t=0),k为降解速率常数。
按照污染物衰减特征,草甘膦半衰周期(DT50)可利用以下公式计算:
| $\text{DT}50=\text{ln}2 / k$ | (2) |
对测定的数据采用平均值及标准偏差进行统计分析,采用SPSS26.0进行单因素方差分析,比较不同磷酸二氢钾施用水平下土壤草甘膦、AMPA含量以及土壤性质在相同培养时间里的显著性差异(P < 0.05),并运用OriginPro9.1对数据进行拟合并绘图。
2 结果 2.1 不同处理条件下草甘膦的降解 2.1.1 不同处理条件下草甘膦和AMPA残留量变化不同水分及磷酸二氢钾施用条件下,草甘膦与AMPA的含量随喷施后天数的变化差异显著(P < 0.05)(如图 1)。其中,20FC处理下(图 1a-图 1b),不同磷酸二氢钾处理条件下草甘膦含量喷施初期迅速下降,第14天时草甘膦含量分别下降41.87%(P0)、40.27%(P1)、35.73%(P2),其降解速率随磷酸二氢钾水平增加而减小。随喷施后天数增加,草甘膦含量逐渐降低,但不同磷酸二氢钾施用条件下草甘膦含量差异不显著。相对应的,不同磷酸二氢钾施用条件下AMPA含量差异不显著,在草甘膦农药喷施初期迅速增长,在第14天达到峰值,AMPA含量分别为1.56 mg·kg–1(P0)、1.6 mg·kg–1(P1)、1.67 mg·kg–1(P2),此后随着喷施后天数的增加,其含量逐渐下降。观测结束时,20FC处理下不同磷酸二氢钾施用条件下草甘膦降解率分别为55.87%(P0)、55.47%(P1)、55.40%(P2),仍有接近1/2未发生降解。而60FC处理下(图 1c-图 1d),不同磷酸二氢钾施用条件下草甘膦与AMPA的含量随喷施后天数的变化差异显著(P < 0.05)。培养初期,不同磷酸二氢钾施用条件下,草甘膦含量迅速下降,到喷施第5天,草甘膦含量分别下降65.6%(P0)、76.13%(P1)、72.27%(P2),且其降解速率随磷酸二氢钾水平的增加而增加。随喷施后天数增加,草甘膦含量逐渐降低,但不同磷酸二氢钾施用条件下草甘膦含量差异并不显著。相对应的,该水分条件下不同磷酸二氢钾处理对AMPA含量影响的差异不显著,草甘膦农药喷施初期AMPA含量迅速增加,并分别在第5天(P0)和第7天(P1、P2)达到峰值,AMPA含量分别为5.82 mg·kg–1(P0)、5.29 mg·kg–1(P1)、5.24 mg·kg–1(P2),此后随喷施后天数增加,其含量迅速下降。观测结束时,该水分条件下不同磷酸二氢钾施用条件下草甘膦分别降低97%(P0)、98.47%(P1)、98.27%(P2)。
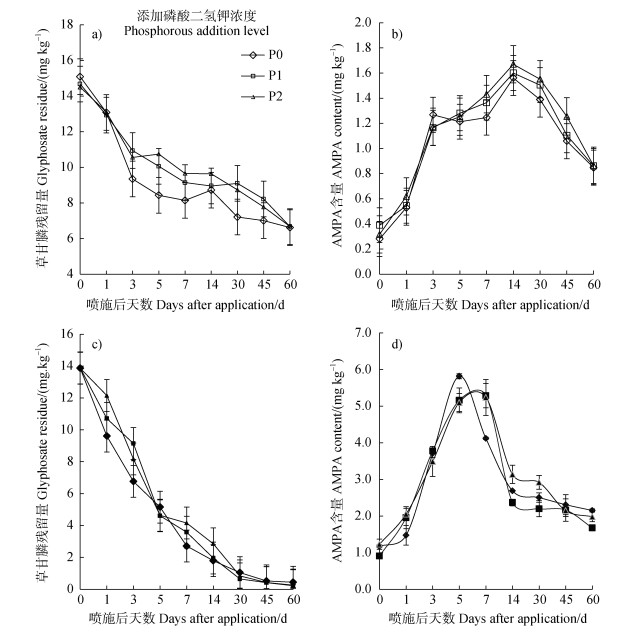
|
注:a-b:20%田间持水量;c-d:60%田间持水量;P0:0 mg·kg–1;P1:50 mg·kg–1;P2:100 mg·kg–1)。下同。 Note: (a-b: 20% field capacity; c-d: 60% field capacity; P0:0 mg·kg–1; P1:50 mg·kg–1; P2:100 mg·kg–1).The same as below. 图 1 不同处理下草甘膦和氨甲基膦酸的残留量变化 Fig. 1 Glyphosate and aminomethylphosphonic acid residues in different treatments |
基于不同磷酸二氢钾施用及水分条件下草甘膦含量及其一级降解动力学模型,并对其降解方程进行拟合(表 1)。结果表明,不同磷酸二氢钾施用及水分条件下草甘膦降解动力学均符合一级动力学模型,半衰期分别为69.3 d(P0-20FC)、70.0 d(P1-20FC)、69.3 d(P2-20FC)、12.8 d(P0-60FC)、10.5 d(P1-60FC)、10.7 d(P2-60FC)。基于拟合方程及半衰期,对不同处理条件下草甘膦降解动力学参数进行比较检验,结果表明:不同磷酸二氢钾施用条件对草甘膦降解半衰期影响差异不显著,但不同水分条件对其影响显著(P < 0.05)。与60FC处理组对比,20FC处理组中草甘膦农药的降解半衰期显著增长,为60FC条件下半衰期的5倍~6倍,且动力学方程拟合效果低于60FC处理。
|
|
表 1 不同处理条件下草甘膦降解动力学拟合方程 Table 1 Degradation kinetics of glyphosate in different treatments |
由图 2a可知,在20FC处理组中,草甘膦农药喷施后土壤速效磷含量随降解时间的变化波动明显。培养前期,不同磷酸二氢钾施用条件下,土壤速效磷含量随喷施后天数的增加而减少,其中P1、P2磷酸二氢钾施用条件下,速效磷含量在第5天最低,其含量分别为45.55 mg·kg–1(P1)、58.26 mg·kg–1(P2),而P0条件下,速效磷含量在第7天达最低值,即26.69 mg·kg–1。此后,土壤速效磷含量逐渐增加,培养结束时,低水平磷酸二氢钾施用条件下(P1),土壤速效磷含量高于喷施当天,但差异不显著,而P0、P2磷酸二氢钾处理条件下速效磷含量显著低于初始土壤速效磷含量。
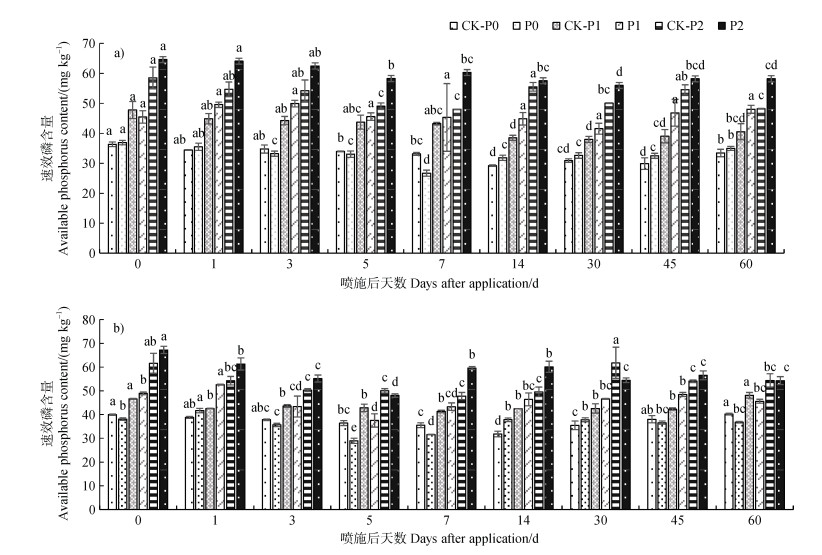
|
注:不同字母表示同一水分条件的同一磷素水平不同时间的差异在P < 5%水平显著。CK-代表未喷施草甘膦农药处理组;不同磷酸二氢钾添加浓度水平P0:0 mg·kg–1;P1:50 mg·kg–1;P2:100 mg·kg–1。 Note: Different letters indicate significant differences among treatments with the same conditions of phosphorus and soil moisture at P < 0.05 level. CK-represents the treated group without glyphosate application; Different phosphate concentration levels P0:0 mg·kg–1; P1:50 mg·kg–1; P2:100 mg·kg–1. 图 2 不同处理中土壤速效磷含量变化(a:20%田间持水量,b:60%田间持水量) Fig. 2 Soil available phosphorus content in different treatments (a: 20% field capacity, b: 60% field capacity) |
由图 2b可知,在60FC处理组中,草甘膦农药喷施后土壤速效磷含量随降解时间的变化波动明显。P2磷酸二氢钾处理条件下,土壤速效磷含量随喷施后天数的增加而显著降低,在第5天最低为28.95 mg·kg–1,与喷施第0天相比下降28.52%,此后不断增加,在第14天达最高值60.13 mg·kg–1,此后又呈现下降趋势,观测结束时,速效磷含量显著低于喷施当天。而P0、P1条件下,草甘膦农药喷施1天内土壤速效磷含量显著增加,此后开始减小,在第5天达最高值,其含量分别为28.95 mg·kg–1(P1)、37.53 mg·kg–1(P2),与喷施当天相比,分别下降24%(P1)、23.34%(P2),此后逐渐升高,观测结束时其含量仍低于喷施当天,但差异不显著。
2.3 不同处理条件下土壤酶活性变化由表 2可知,在20FC处理组中,土壤NAG活性随时间波动明显,且变化趋势相似,但存在一定差异。不同磷酸二氢钾施用条件下,土壤NAG活性差异不显著,但随土壤磷水平的增加NAG活性增强;而草甘膦农药喷施后NAG活性随喷施后天数的增加逐渐升高,到第14天土壤NAG活性达到最高峰,NAG活性分别为93.68 nmol·g–1.h–1(P0)、96.58 nmol·g–1.h–1(P1)、99.80 nmol·g–1.h–1(P2)。草甘膦农药喷施当天,土壤NAG活性被促进,之后随喷施后天数的延长,促进作用先增强后减弱,草甘膦喷施第14天(P0、P1)、30 d(P2)对土壤NAG活性产生抑制,直至观测结束。观测结束时,三种磷酸二氢钾施用条件下土壤NAG活性均显著低于喷施当天。
|
|
表 2 不同处理下土壤N-乙酰氨基-β-葡萄糖苷酶活性变化 Table 2 Soil N-acetamino-β-glucosidase activity in different treatments |
由表 2可知,在60FC处理组中,不同磷酸二氢钾施用条件下土壤NAG活性随时间波动明显,但不同磷水平间其活性差异不显著。培养前期,土壤NAG活性升高,第14天其活性开始下降,第30天活性最低,NAG活性分别为34.85 nmol·g–1.h–1(P0)、44.44 nmol·g–1.h–1(P1)、29.70 nmol·g–1.h–1(P2),此后其活性逐渐升高,但观测结束时NAG活性仍显著低于喷施当天。
由表 3可知,在20FC处理组中,LAP活性波动明显,草甘膦农药喷施后,不同磷酸二氢钾施用条件下,土壤LAP活性呈现微弱增长趋势,喷施后第7天开始下降,至第30天活性最低,LAP活性分别为755 nmol·g–1.h–1(P0)、692 nmol·g–1.h–1(P1)、462 nmol·g–1.h–1(P2),此后土壤LAP活性缓慢恢复,观测结束时无磷处理(P0)及磷倍施(P2)处理中土壤LAP活性显著高于喷施当天(P < 0.05),而P1处理条件下LAP活性低于喷施当天。特别是与无农药喷施组对比,草甘膦喷施后第1天,土壤LAP活性受到抑制,第14天抑制作用最强烈,不同磷酸二氢钾施用条件下抑制率分别达50.01%(P0)、43.07%(P1)、78.60%(P2),此后抑制作用逐渐减弱,第30天后又逐渐增强,观测结束时草甘膦仍对土壤LAP活性表现出强烈抑制作用,抑制率达71.10%(P0)、74.89%(P1)、72.10%(P2)。
|
|
表 3 不同处理下土壤亮氨酸酶活性变化 Table 3 Soil leucine aminopeptidase activity in different treatments |
由表 3可知,高水分条件下(60FC)土壤LAP活性显著高于缺水条件(20FC)(P < 0.05)。不同磷酸二氢钾施用条件下,土壤LAP活性差异不显著。草甘膦农药喷施后第14天,其活性呈现下降趋势,至第30天活性达最低,LAP活性分别为322 nmol·g–1.h–1(P0)、445 nmol·g–1.h–1(P1)、462 nmol·g–1.h–1(P2),此后土壤LAP活性逐渐增强,第45天又开始下降。观测结束时土壤LAP活性显著高于喷施当天(P < 0.05)。特别是与无农药喷施组对比,草甘膦农药喷施后14天内对土壤LAP活性无明显促进或抑制作用,14天后表现出抑制作用,第30天时抑制作用最强烈,抑制率达77.42%(P0)、69.18%(P1)、63.30%(P2),此后抑制作用逐渐减弱,但观测结束时仍表现为抑制作用。
由表 4可知,在20FC和60FC处理组中,不同磷酸二氢钾施用条件下土壤BG活性差异不显著,但随时间波动明显。草甘膦农药喷施后,土壤BG活性呈现增长趋势,至第7天活性最高,此后BG活性开始下降。观测结束时其活性显著低于喷施当天,20FC-P1处理条件下差异不显著。特别地,在20FC和60FC处理组中喷施草甘膦除在第7天对土壤BG活性产生明显促进作用外,大部分培养时间内对其产生抑制作用。
|
|
表 4 不同处理下土壤β-葡萄糖苷酶活性变化 Table 4 Soil β-glucosidase activity in different treatments |
由表 5可知,在20FC处理组中,土壤ALP活性随时间波动明显,且变化趋势相似。不同磷酸二氢钾施用条件下,土壤ALP活性差异不显著。草甘膦农药喷施后,土壤ALP活性呈增长趋势,至第30天活性最高,ALP活性分别为1494 nmol·g–1.h–1(P0)、1344 nmol·g–1.h–1(P1)、21504 nmol·g–1.h–1(P2),此后其活性逐渐降低,观测结束时土壤ALP活性显著低于喷施当天(P < 0.05)。特别地,与无农药喷施组对比,草甘膦农药喷施后对土壤ALP活性产生轻微抑制作用,喷施1天后抑制作用先增强后减弱,至第30天抑制作用消失,此后又呈现微弱抑制作用。喷施草甘膦在大部分培养时间内对土壤ALP活性产生抑制作用,抑制率最高为47.67%(P0)、48.23%(P1)、53.11%(P2)。
|
|
表 5 不同处理下土壤碱性磷酸酶活性 Table 5 Soil alkaline phosphatase activity in different treatments |
由表 5可知,在60FC处理组中,不同磷酸二氢钾施用条件下土壤ALP活性差异不显著,但ALP活性随时间波动明显,总体呈现下降-上升-下降-上升-下降-趋于平稳趋势,至第7天活性最高,ALP活性分别为1929 nmol·g–1.h–1(P0)、1985 nmol·g–1.h–1(P1)、2141 nmol·g–1.h–1(P2),至第45天活性最低,ALP活性分别为245 nmol·g–1.h–1(P0)、335 nmol·g–1.h–1(P1)、316 nmol·g–1.h–1(P2)。观测结束时,其活性显著低于喷施当天(P < 0.05)。特别是与无农药喷施组对比,喷施草甘膦除在第1天以及第14天对土壤ALP产生促进作用外,大部分培养时间内对其产生抑制作用,抑制率最高达57.19%(P0)、56.49%(P1)、62.28%(P2)。
3 讨论 3.1 土壤中磷酸二氢钾水平对草甘膦降解动力学特征的影响草甘膦农药的大量施用及其在土壤中的环境行为,草甘膦及其降解产物AMPA的环境风险一直受到关注。本研究中,不同磷酸二氢钾施用水平对草甘膦农药在土壤中的降解影响不明显,但在草甘膦添加初期,高磷酸二氢钾施用水平的土壤中,草甘膦残留量略高于低磷酸二氢钾施用水平的土壤,该结果可能与草甘膦和土壤中的磷相互竞争吸附位点有关,从而影响其自身的土壤环境行为。Wang等[26]研究发现在土壤中施加与草甘膦结构相似的磷酸盐会降低草甘膦在土壤中的吸附,增加草甘膦在土壤中的迁移,从而不利于草甘膦的降解。Bott等[27]研究发现在未施加磷肥的土壤中,施用草甘膦与大豆植物受损程度无关,然而在经过磷素处理的土壤中,植物受损程度随磷肥水平增加而增加。da Costa等[20]研究发现,大叶鼠尾草生长在磷含量较高的土壤中,草甘膦对其去除的效率较低,土壤中磷肥的增加能够降低草甘膦对大叶鼠尾草的有效性。这是因为磷酸盐与草甘膦结构相似,具有共同的吸附位点,当土壤中磷酸盐含量增加时,土壤对草甘膦的固持作用降低[28]。因此,需要考虑草甘膦在土壤中迁移的风险,特别是在过量施用磷酸二氢钾导致磷含量过高的土壤。
此外通过拟合方程,草甘膦在不同磷酸二氢钾施用及水分条件下其半衰期可以达到69.3 d(P0-20FC)、77.0 d(P1-20FC)、69.3 d(P2-20FC)、12.8 d(P0-60FC)、10.5 d(P1-60FC)、10.7 d(P2-60FC)。草甘膦在不同研究中的半衰期差异较大,目前报道的草甘膦半衰期大约在1~197 d之间[29-30]。Litz等[31]研究发现在8℃的实验条件下草甘膦半衰期为30 d,但高温野外条件下草甘膦衰减更快,半衰期为7.5~10.5 d。不同研究中草甘膦半衰期不同,一方面由于在环境系统的动态变化中,实验室估算的草甘膦半衰期并不能真实反映草甘膦农药在田间的降解情况,另一方面是因为土壤理化性质本身的复杂性,草甘膦在土壤中的持久性及降解一定程度上受土壤理化性质的影响,如温度[13]、土壤粒径[32]和pH[33]等。Bento等[13]研究发现,在20%田间持水量土壤条件下,草甘膦半衰期分别是60%田间持水量和水分饱和土壤的2.9倍和3.6倍。陈望舒等[33]研究发现较高含水率的土壤条件下更有利于草甘膦的降解。均与本研究结果相符,本研究发现,与60%田间持水量处理组相比,20%田间持水量处理组中草甘膦农药的降解半衰期显著增长,为60%田间持水量条件下半衰期的5倍~6倍。这可能是由于在水分较高的土壤条件下更有利于微生物呼吸,当土壤水分含量低时,微生物的代谢活性和呼吸底物的扩散会受到限制[34],而微生物在草甘膦降解过程中又起着十分重要的作用[35],从而间接影响了草甘膦农药的降解衰减特征。
辛龙川[15]研究表明,在不同粒径黑土中草甘膦添加初期降解速率较快,后期随时间的增加降解速率逐渐减缓,草甘膦残留量符合一级动力学衰减模型,其降解产物AMPA含量随草甘膦农药的降解先升高后降低。这是因为在喷施草甘膦农药初期,草甘膦降解生成AMPA,从而导致土壤中AMPA含量的快速增加,同时随着时间变化AMPA在微生物的作用下与草甘膦同步发生降解,因此,随着喷施后天数的延长,其含量逐渐下降。这一结果与本试验结果相似,但不同类型土壤中草甘膦降解速率差异显著,其半衰期与本研究半衰期相差3~62 d。然而,对草甘膦降解动力学特征进行拟合时发现,不同磷酸二氢钾处理条件下草甘膦降解动力学拟合系数R2较辛龙川[15]的研究低,这可能是与土壤类型有关,也可能是部分草甘膦农药转化为其他的降解产物,如肌氨酸[36],从而影响了拟合效果。
3.2 草甘膦农药喷施对土壤磷有效性及酶活性的影响草甘膦分子与磷酸盐结构的相似性,导致草甘膦与土壤中的磷产生吸附竞争,由此影响到磷在土壤中的化学行为及其有效性。本研究发现,草甘膦农药喷施后,不同磷酸二氢钾施用下土壤速效磷含量均显著增加。周垂帆等[37]研究发现,喷施草甘膦农药能够减弱土壤对磷的吸附,低浓度下增强土壤对磷的解吸。周垂帆等[38]通过为期28 d的试验发现,土壤中高于2 mg·kg–1的草甘膦农药显著提高红壤中磷的有效性,喷施草甘膦的红壤速效磷含量在培养期内均高于对照处理。侯文军等[39]研究发现桉树人工林喷施草甘膦农药后,0~2 cm土层速效磷含量显著增加,这与本研究结果相似。土壤喷施草甘膦农药后速效磷含量显著增加,一方面由于草甘膦能降低土壤pH,使土壤铁铝氧化物对磷的专性吸附受到破坏,减少对磷的吸附,促进磷的释放[40];另一方面,有机酸阴离子络合作用能够活化土壤中的Fe-P、A1-P等难溶态磷,草甘膦释放磷的主要机制可能与有机酸活化土壤磷素的机制相同,草甘膦结构中含有一个羧基,从而使草甘膦与难溶性磷中的Al3+、Fe3+进行离子交换,进而占据磷的吸附位点,使土壤速效磷含量增加[17,41]。
大量研究表明草甘膦施入土壤后会对土壤微生物产生影响[42-43],土壤酶在很大程度上来自于土壤中微生物的生命活动,并反映土壤微生物的活性[6]。土壤中BG、NAG、LAP、ALP是微生物分泌的碳、氮、磷获取酶,其活性可作为微生物获取碳、氮、磷资源分配的表达指标[44-45]。本研究发现,在20%田间持水量条件下,即土壤受干旱胁迫条件下土壤酶活性显著低于60%田间持水量条件下的土壤酶活性。谢伟等[46]和杜瑞英等[47]研究发现当土壤处于淹水状态时会显著抑制土壤碱性磷酸酶活性。土壤酶活性一定程度上会受到温度[48]、水分[49]等因素影响,土壤含水率较低会限制根系和微生物对水分的利用,从而降低酶活性,而含水率过高时,土壤通气性差,氧气含量降低,从而影响微生物的耗氧呼吸,进而降低土壤酶活性[50]。此外,水分还通过影响土壤物理化学性质、有机质的有效性及其扩散运输能力而改变土壤微生物活性,从而影响土壤酶的生产和活性[51]。本研究中,喷施草甘膦农药对土壤NAG、BG、LAP活性影响波动较大,但显著抑制土壤ALP活性,20%田间持水量条件下抑制率最高为44.15%(P0)、50.53%(P1)、53.10%(P2),60%田间持水量条件下抑制率最高为57.21%(P0)、56.50%(P1)、62.30%(P2)。呼蕾等[52]研究发现,ALP活性随土壤肥力增加而增加,随草甘膦喷施浓度的增加,土壤ALP活性呈下降趋势,最大降幅为35%。陈隆升等[53]研究发现草甘膦农药喷施60 d后土壤ALP活性受到抑制,喷施150 d后抑制作用有所减轻。侯文军等[54]发现桉树人工林喷施草甘膦后土壤酸性磷酸酶活性显著降低,并且土壤养分循环受阻。磷酸酶是能将有机磷转化为植物可吸收的无机磷的土壤酶[55],草甘膦抑制土壤ALP活性,这可能是草甘膦分子中存在的磷酸基团对土壤ALP活性产生抑制,随着喷施后天数的延长,微生物对草甘膦的适应及草甘膦本身的降解,抑制作用逐渐减弱。长期施用草甘膦,会降低土壤ALP活性而影响土壤磷素的转化,降低土壤肥力[56]。因此,在农业生产中,一方面应尽量控制草甘膦使用量,以减轻其对土壤磷酸酶活性的影响,另一方面应保持合适的土壤湿度提高土壤磷酸酶活性来活化土壤磷,进而提高土壤磷的有效性。
4 结论草甘膦农药喷施的环境风险日益突出。在土壤性质中,磷含量被认为是控制草甘膦有效性的关键因素之一。本研究对不同磷酸二氢钾施用及水分条件下黄土中草甘膦农药降解动力学特征进行研究。本研究得出的结论如下:(1)不同磷酸二氢钾施用及水分条件下,草甘膦农药的降解特征相似,即农药添加初期其降解速率较快,后期随时间的增加降解速率逐渐减缓;其降解产物AMPA随着草甘膦农药的降解先增加后减小,不同磷酸二氢钾水平下AMPA含量差异不显著,不同水分条件下其峰值及变化差异显著。不同磷酸二氢钾施用及水分条件下,草甘膦农药的衰减符合污染物一级动力学降解模型,其半衰期分别为69.3~77.0 d(20FC)、10.5~12.8 d(60FC)。不同磷酸二氢钾施用水平对草甘膦农药降解动力学影响差异不显著,但不同水分梯度下草甘膦农药降解特征变化较大,特别是在60%田间持水量条件下草甘膦衰减速率较大,培养结束时 > 97%以上的草甘膦农药已降解。(2)草甘膦农药喷施后,土壤速效磷含量在培养第7天(20FC)、第5天(60FC)呈现剧烈波动,这可能是因为草甘膦和磷酸盐具有相似结构,二者相互竞争吸附位点导致的,后期随着草甘膦的降解速效磷含量又逐渐恢复,但仍低于草甘膦农药喷施当天。此外,草甘膦农药喷施对土壤酶活性影响较大。其中,土壤ALP活性受到明显抑制,NAG、BG、LAP活性波动较大。不同磷酸二氢钾施用水平对以上四种土壤酶活性影响差异不显著,但不同水分梯度对其影响显著,高水分条件下(60FC)土壤酶活性较大。因此,后续研究还应考虑草甘膦喷施与土壤磷组分及相关酶活性互馈特征,特别是对干旱条件下草甘膦及其降解产物的持久性与土壤健康关系进一步探究,以期为黄土区草甘膦农药的安全喷施提供科学依据。
| [1] |
Baylis A D. Why glyphosate is a global herbicide: Strengths, weaknesses and prospects[J]. Pest Management Science, 2000, 56(4): 299-308. DOI:10.1002/(SICI)1526-4998(200004)56:4<299::AID-PS144>3.0.CO;2-K
(  0) 0) |
| [2] |
Schütte G, Eckerstorfer M, Rastelli V, et al. Herbicide resistance and biodiversity: Agronomic and environmental aspects of genetically modified herbicide-resistant plants[J]. Environmental Sciences Europe, 2017, 29(1): 5. DOI:10.1186/s12302-016-0100-y
(  0) 0) |
| [3] |
van Stempvoort D R, Roy J W, Brown S J, et al. Residues of the herbicide glyphosate in riparian groundwater in urban catchments[J]. Chemosphere, 2014, 95: 455-463. DOI:10.1016/j.chemosphere.2013.09.095
(  0) 0) |
| [4] |
Gu A L, Bai Y L. The market profile, product development and key products of the rice pesticide (In Chinese)[J]. Modern Agrochemicals, 2018, 17(6): 1—5, 22. [顾安乐, 柏亚罗. 水稻用农药市场概况、产品开发及重点品种(Ⅱ)[J]. 现代农药, 2018, 17(6): 1—5, 22.]
(  0) 0) |
| [5] |
Zhao B G, Yan C Y, Luan F X, et al. Development and environmental safety evaluation of glyphosate (In Chinese)[J]. Soybean Science & Technology, 2019(4): 25-33. [赵宝广, 闫彩燕, 栾凤侠, 等. 草甘膦的发展与环境安全性评价[J]. 大豆科技, 2019(4): 25-33.]
(  0) 0) |
| [6] |
Lu J, Yang X C. Department of biological and environmental engineering (In Chinese)[J]. Anhui Agricultural Science Bulletin, 2017, 23(8): 71-75. DOI:10.3969/j.issn.1007-7731.2017.08.032 [鲁晶, 杨学春. 草甘膦对环境的影响研究进展[J]. 安徽农学通报, 2017, 23(8): 71-75.]
(  0) 0) |
| [7] |
Paz-y-Miño C, Sánchez M E, Arévalo M, et al. Evaluation of DNA damage in an Ecuadorian population exposed to glyphosate[J]. Genetics and Molecular Biology, 2007, 30(2): 456-460. DOI:10.1590/S1415-47572007000300026
(  0) 0) |
| [8] |
George J, Prasad S, Mahmood Z, et al. Studies on glyphosate-induced carcinogenicity in mouse skin: A proteomic approach[J]. Journal of Proteomics, 2010, 73(5): 951-964. DOI:10.1016/j.jprot.2009.12.008
(  0) 0) |
| [9] |
Silva V, Mol H G J, Zomer P, et al. Pesticide residues in European agricultural soils - A hidden reality unfolded[J]. Science of the Total Environment, 2019, 653: 1532-1545. DOI:10.1016/j.scitotenv.2018.10.441
(  0) 0) |
| [10] |
Liu B, Liu Q K, Zhou Y. Effects of 10% glyphosate aqueous agent on soil environment (In Chinese)[J]. Hubei Plant Protection, 2011(1): 58-60. [刘冰, 刘全科, 周扬. 施用10%草甘膦水剂对土壤环境的影响[J]. 湖北植保, 2011(1): 58-60.]
(  0) 0) |
| [11] |
Mao M H, Yu T T, Fu L F, et al. The influence of glyphosate on soil physicochemical properties of the shoot-oriented moso bamboo forests (In Chinese)[J]. Journal of Bamboo Research, 2011, 30(3): 29-32. [毛美红, 俞婷婷, 傅柳方, 等. 草甘膦对毛竹笋用林土壤理化性质的影响分析[J]. 竹子研究汇刊, 2011, 30(3): 29-32.]
(  0) 0) |
| [12] |
Yu F Y, Yang D J, Zhu A C, et al. Effects of glyphosate on soil microorganisms and arecanut growth (In Chinese)[J]. Journal of Anhui Agricultural Sciences, 2021, 49(2): 120-122. [余凤玉, 杨德洁, 祝安传, 等. 草甘膦对槟榔园土壤微生物及槟榔生长发育的影响[J]. 安徽农业科学, 2021, 49(2): 120-122.]
(  0) 0) |
| [13] |
Bento C P M, Yang X M, Gort G, et al. Persistence of glyphosate and aminomethylphosphonic acid in loess soil under different combinations of temperature, soil moisture and light/darkness[J]. Science of the Total Environment, 2016, 572: 301-311. DOI:10.1016/j.scitotenv.2016.07.215
(  0) 0) |
| [14] |
Al-Rajab A J, Schiavon M. Degradation of 14C-glyphosate and aminomethylphosphonic acid(AMPA)in three agricultural soils[J]. Journal of Environmental Sciences, 2010, 22(9): 1374-1380. DOI:10.1016/S1001-0742(09)60264-3
(  0) 0) |
| [15] |
Xin L C. Effects of soil aggregates on kinetics of glyphosate degradation in different soil[D]. Yangling, Shaanxi: Northwest A & F University, 2021.[辛龙川. 不同土壤团聚体特征对草甘膦农药降解动力学影响的研究[D]. 陕西杨凌: 西北农林科技大学, 2021.]
(  0) 0) |
| [16] |
XIE Y, CHEN, J, HUANG X, et al. Bioremediation of glyphosate-contaminated soil by degrading bacteria ESG4 (In Chinese)[J]. Environmental Impact Assessment, 2018, 40(05): 92-95. [谢怡, 陈杰, 黄祥, 等. 降解菌ESG4对草甘膦污染土壤的生物修复研究[J]. 环境影响评价, 2018, 40(05): 92-95.]
(  0) 0) |
| [17] |
Gimsing A L. Effect of KCl and CaCl2 as background electrolytes on the competitive adsorption of glyphosate and phosphate on goethite[J]. Clays and Clay Minerals, 2001, 49(3): 270-275. DOI:10.1346/CCMN.2001.0490310
(  0) 0) |
| [18] |
Nicholls P H, Evans A A. Sorption of ionisable organic compounds by field soils. Part 1: Acids[J]. Pesticide Science, 1991, 33(3): 319-330. DOI:10.1002/ps.2780330306
(  0) 0) |
| [19] |
Hébert M P, Fugère V, Gonzalez A. The overlooked impact of rising glyphosate use on phosphorus loading in agricultural watersheds[J]. Frontiers in Ecology and the Environment, 2019, 17(1): 48-56. DOI:10.1002/fee.1985
(  0) 0) |
| [20] |
da Costa Y K S, Ribeiro N M, de Moura G C P, et al. Effect of glyphosate and P on the growth and nutrition of Coffea arabica cultivars and on weed control[J]. Scientific Reports, 2021, 11: 8095. DOI:10.1038/s41598-021-87541-z
(  0) 0) |
| [21] |
Zhong G D, Wu Z H, Liu N, et al. Phosphate alleviation of glyphosate-induced toxicity in Hydrocharis dubia (bl.) backer[J]. Aquatic Toxicology, 2018, 201: 91-98. DOI:10.1016/j.aquatox.2018.05.025
(  0) 0) |
| [22] |
Xu Y, Zhang R Z. Dynamics of soil phosphorus as affected by tillage on the Loess Plateau in central Gansu, China (In Chinese)[J]. Acta Pedologica Sinica, 2017, 54(3): 670-681. [许艳, 张仁陟. 陇中黄土高原不同耕作措施下土壤磷动态研究[J]. 土壤学报, 2017, 54(3): 670-681.]
(  0) 0) |
| [23] |
E S Z, Ding N P, Li L L, et al. Contribution of fertilization to accumulative crop yield and soil fertility in Heilu soil region of the Loess Plateau (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(1): 195-206. [俄胜哲, 丁宁平, 李利利, 等. 黄土高原黑垆土施肥的作物累积产量及土壤肥力贡献[J]. 土壤学报, 2019, 56(1): 195-206.]
(  0) 0) |
| [24] |
Yang X M, Wang F, Bento C P M, et al. Short-term transport of glyphosate with erosion in Chinese loess soil—A flume experiment[J]. Science of the Total Environment, 2015, 512/513: 406-414. DOI:10.1016/j.scitotenv.2015.01.071
(  0) 0) |
| [25] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [26] |
Wang Y J, Zhou D M, Sun R J. Effects of phosphate on the adsorption of glyphosate on three different types of Chinese soils[J]. Journal of Environmental Sciences, 2005, 17(5): 711-715.
(  0) 0) |
| [27] |
Bott S, Tesfamariam T, Kania A, et al. Phytotoxicity of glyphosate soil residues re-mobilised by phosphate fertilisation[J]. Plant and Soil, 2011, 342(1/2): 249-263.
(  0) 0) |
| [28] |
Munira S, Farenhorst A, Flaten D, et al. Phosphate fertilizer impacts on glyphosate sorption by soil[J]. Chemosphere, 2016, 153: 471-477. DOI:10.1016/j.chemosphere.2016.03.028
(  0) 0) |
| [29] |
Wauchope R D, Buttler T M, Hornsby A G, et al. The SCS/ARS/CES pesticide properties database for environmental decision-making[J]. Reviews of Environmental Contamination and Toxicology, 1992, 123: 1-155.
(  0) 0) |
| [30] |
Yang X M, Wang F, Bento C P M, et al. Decay characteristics and erosion-related transport of glyphosate in Chinese loess soil under field conditions[J]. Science of the Total Environment, 2015, 530/531: 87-95. DOI:10.1016/j.scitotenv.2015.05.082
(  0) 0) |
| [31] |
Litz N T, Weigert A, Krause B, et al. Comparative studies on the retardation and reduction of glyphosate during subsurface passage[J]. Water Research, 2011, 45(10): 3047-3054. DOI:10.1016/j.watres.2011.02.015
(  0) 0) |
| [32] |
Xin L C, Wu W X, Xue S, et al. Effects of aggregate size on kinetics of glyphosate degradation in red soil (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2021, 29(5): 910-921. [辛龙川, 吴文雪, 薛萐, 等. 红壤不同粒径团聚体对草甘膦农药降解动力学的影响[J]. 中国生态农业学报, 2021, 29(5): 910-921.]
(  0) 0) |
| [33] |
Chen W S. Effects of glyphosate on soil ecology and its toxicology[D]. Yangzhou: Yangzhou University, 2019.[陈望舒. 草甘膦对土壤生态的影响和毒理研究[D]. 扬州: 扬州大学, 2019.]
(  0) 0) |
| [34] |
Li X G, Han G X, Zhu L Q, et al. Effects of drying-wetting cycle caused by rainfall on soil respiration: Progress and prospect (In Chinese)[J]. Chinese Journal of Ecology, 2019, 38(2): 567-575. [李新鸽, 韩广轩, 朱连奇, 等. 降雨引起的干湿交替对土壤呼吸的影响: 进展与展望[J]. 生态学杂志, 2019, 38(2): 567-575.]
(  0) 0) |
| [35] |
Sun M J, Li H, Jaisi D P. Degradation of glyphosate and bioavailability of phosphorus derived from glyphosate in a soil-water system[J]. Water Research, 2019, 163: 114840. DOI:10.1016/j.watres.2019.07.007
(  0) 0) |
| [36] |
Shinabarger D L, Braymer H D. Glyphosate catabolism by Pseudomonas sp. strain PG2982[J]. Journal of Bacteriology, 1986, 168(2): 702-707. DOI:10.1128/jb.168.2.702-707.1986
(  0) 0) |
| [37] |
Zhou C F, Lin J W, Li Y, et al. Interaction mechanism of phosphorus and glyphosate adsorption and desorption in acidic soil (In Chinese)[J]. Journal of Agro-Environment Science, 2016, 35(12): 2367-2376. DOI:10.11654/jaes.2016-0862 [周垂帆, 林静雯, 李莹, 等. 磷与草甘膦在酸性土壤中吸附解吸交互作用机制[J]. 农业环境科学学报, 2016, 35(12): 2367-2376.]
(  0) 0) |
| [38] |
Zhou C F, Lin J W, Li Y, et al. Effects of glyphosate on inorganic phosphorus transformation in soil (In Chinese)[J]. Journal of Northwest Forestry University, 2016, 31(6): 71-77. [周垂帆, 林静雯, 李莹, 等. 草甘膦对土壤磷形态及有效性的影响[J]. 西北林学院学报, 2016, 31(6): 71-77.]
(  0) 0) |
| [39] |
Hou W J, Zou M, Li B F, et al. Effect of glyphosate on soil physicochemical properties of Eucalyptus plantations (In Chinese)[J]. Scientia Silvae Sinicae, 2020, 56(8): 20-26. [侯文军, 邹明, 李宝福, 等. 施用草甘膦对桉树人工林土壤理化性质的影响[J]. 林业科学, 2020, 56(8): 20-26.]
(  0) 0) |
| [40] |
Wang C H, Wang Z Y, Lin L, et al. Effect of low molecular weight organic acids on phosphorus adsorption by ferric-alum water treatment residuals[J]. Journal of Hazardous Materials, 2012, 203/204: 145-150. DOI:10.1016/j.jhazmat.2011.11.084
(  0) 0) |
| [41] |
Zhang A Q, He L Y, Zhao H E, et al. Effect of organic acids on inorganic phosphorus transformation in soils and its readily available phosphate (In Chinese)[J]. Acta Ecologica Sinica, 2009, 29(8): 4061-4069. [章爱群, 贺立源, 赵会娥, 等. 有机酸对土壤无机态磷转化和速效磷的影响[J]. 生态学报, 2009, 29(8): 4061-4069.]
(  0) 0) |
| [42] |
Liang X, Zhang B S, Liu J R, et al. Research progress of the effects of glyphosate on microorganisms (In Chinese)[J]. Biotechnology Bulletin, 2021, 37(4): 211-223. [梁鑫, 张宝善, 刘继瑞, 等. 草甘膦对微生物影响的研究进展[J]. 生物技术通报, 2021, 37(4): 211-223.]
(  0) 0) |
| [43] |
Tao B, Jiang L X, Shen X F, et al. Effects of glyphosate on soil microorganisms (In Chinese)[J]. Chinese Journal of Oil Crop Sciences, 2011, 33(2): 162—168, 179. [陶波, 蒋凌雪, 沈晓峰, 等. 草甘膦对土壤微生物的影响[J]. 中国油料作物学报, 2011, 33(2): 162—168, 179.]
(  0) 0) |
| [44] |
Deng L, Peng C H, Huang C B, et al. Drivers of soil microbial metabolic limitation changes along a vegetation restoration gradient on the Loess Plateau, China[J]. Geoderma, 2019, 353: 188-200. DOI:10.1016/j.geoderma.2019.06.037
(  0) 0) |
| [45] |
Fanin N, Moorhead D, Bertrand I. Eco-enzymatic stoichiometry and enzymatic vectors reveal differential C, N, P dynamics in decaying litter along a land-use gradient[J]. Biogeochemistry, 2016, 129(1/2): 21-36.
(  0) 0) |
| [46] |
Xie W, Tan X P, Tian H X, et al. Effects of soil moisture on available arsenic and alkaline phosphatase activity in paddy soil (In Chinese)[J]. China Environmental Science, 2016, 36(8): 2418-2424. [谢伟, 谭向平, 田海霞, 等. 土壤水分对稻田土壤有效砷及碱性磷酸酶活性影响[J]. 中国环境科学, 2016, 36(8): 2418-2424.]
(  0) 0) |
| [47] |
Du R Y, Tang M D, Ai S Y, et al. Effects of different soil water on the microbial community diversities in the Cd-contamination vegetable soil (In Chinese)[J]. Journal of Safety and Environment, 2013, 13(2): 1-4. [杜瑞英, 唐明灯, 艾绍英, 等. 含水量对Cd污染菜地土壤中微生物多样性的影响[J]. 安全与环境学报, 2013, 13(2): 1-4.]
(  0) 0) |
| [48] |
Feng G Y, Zhu M E, Chen H M. Study on characters of clay granule aborbing urease (In Chinese)[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry, 2001, 29(5): 84-87. [冯贵颖, 朱铭莪, 陈会明. 土壤粘粒吸附脲酶特征的研究[J]. 西北农林科技大学学报: 自然科学版, 2001, 29(5): 84-87.]
(  0) 0) |
| [49] |
Caldwell B A. Enzyme activities as a component of soil biodiversity: A review[J]. Pedobiologia, 2005, 49(6): 637-644. DOI:10.1016/j.pedobi.2005.06.003
(  0) 0) |
| [50] |
Naylor D, Coleman-Derr D. Drought stress and root-associated bacterial communities[J]. Frontiers in Plant Science, 2018, 8: 2223. DOI:10.3389/fpls.2017.02223
(  0) 0) |
| [51] |
Liu K, Ge Z, Xu Y D, et al. Responses of soil microbial community to drying-wetting alternation relative to tillage mode (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 206-216. [刘奎, 葛壮, 徐英德, 等. 不同耕作方式下黑土微生物群落对干湿交替的响应[J]. 土壤学报, 2020, 57(1): 206-216.]
(  0) 0) |
| [52] |
Hu L, He W X, Wang X D, et al. Effect of glyphosate on soil enzyme (In Chinese)[J]. Journal of Agro-Environment Science, 2009, 28(4): 680-685. [呼蕾, 和文祥, 王旭东, 等. 草甘膦的土壤酶效应研究[J]. 农业环境科学学报, 2009, 28(4): 680-685.]
(  0) 0) |
| [53] |
Chen L S, Chen Y Z, Peng Y H, et al. Effect of glyphosate on number of soil microbial and enzyme activity of Camellia forest (In Chinese)[J]. Hunan Forestry Science & Technology, 2015, 42(4): 32-35. [陈隆升, 陈永忠, 彭映赫, 等. 草甘膦对油茶林土壤微生物数量及酶活性的影响[J]. 湖南林业科技, 2015, 42(4): 32-35.]
(  0) 0) |
| [54] |
Hou W J, Zou M, Li B F, et al. Effect of glyphosate on soil enzyme activitiesin Eucalyptus plantations (In Chinese)[J]. Journal of Northeast Forestry University, 2020, 48(11): 76-79. [侯文军, 邹明, 李宝福, 等. 草甘膦对桉树人工林土壤酶活性的影响[J]. 东北林业大学学报, 2020, 48(11): 76-79.]
(  0) 0) |
| [55] |
Hu L. Effect of glyphosate on soil biochemical activity[D]. Yangling, Shaanxi: Northwest A & F University, 2009.[呼蕾. 草甘膦对土壤生化活性影响的研究[D]. 陕西杨凌: 西北农林科技大学, 2009.]
(  0) 0) |
| [56] |
García-Pérez J A, Alarcón E, Hernández Y, et al. Impact of litter contaminated with glyphosate-based herbicide on the performance of Pontoscolex corethrurus, soil phosphatase activities and soil pH[J]. Applied Soil Ecology, 2016, 104: 31-41.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


