由温室气体浓度增加所导致的气候变暖已成为人类所面临的全球性环境问题。甲烷(CH4)是仅次于二氧化碳(CO2)的第二大温室气体,对加剧全球温室效应起着不可忽视的作用[1]。政府间气候变化专门委员会(IPCC)第六次评估报告指出CH4全球增温潜势在100年的时间尺度上为CO2的28倍,并再次强调了控制全球甲烷排放对减缓升温的重要性[2]。当前全球甲烷净排放量每年可达580 Tg[3],并且仍以每年5 Tg CH4的速率稳步增加[4],对全球气候变化有着显著影响。
农业湿地是大气甲烷的重要排放源[5]。中国作为农业生产大国,水稻种植面积居世界第二,同时中国也是世界上最大的淡水养殖国家[6]。随着对水产品需求的持续增加、土地资源的可利用空间有限以及农民对扩大收入的迫切需求,我国大量稻田转变成了稻田种养结合模式和水产养殖湿地[7]。农业生产方式转变后,稻田种养结合和单一养殖生态系统所特有的农业管理模式会导致其具有不同于常规稻田的甲烷排放特征和排放强度[8]。Liu等[9]研究表明常规稻田转变为养殖湿地后可减少甲烷排放,但该研究仅对甲烷排放通量进行了观测,并未深入探讨甲烷产生和氧化机理。湿地甲烷排放是土壤中甲烷产生和氧化综合效应的结果。因此,对湿地甲烷的产生、氧化及其对不同环境因子的响应进行研究将有助于更深入、全面地了解农业湿地甲烷排放的过程与机制。
温度是影响农业湿地土壤甲烷排放的关键因子[10]。在全球变暖背景下,针对土壤甲烷产生与氧化对温度升高的响应进行了大量的研究,并取得了系列进展[11–13]。Zhang等[11]通过对不同类型泥炭地甲烷产生和氧化潜力对温度的响应研究发现,温度升高会增加甲烷产生和氧化潜力,且甲烷产生潜力在高温时对温度的响应较甲烷氧化潜力更为敏感。Bhattarai等[12]通过室内培养实验得出,甲烷产生过程与所有的生化反应相同,均依赖于温度。温度是影响甲烷产生以及甲烷厌氧氧化两种途径的决定因素。Fan等[13]通过室内培养实验和整合分析表明,甲烷产生潜力和甲烷厌氧氧化潜力均随温度的升高呈指数增加。然而当前关于农业土地利用方式转变下甲烷产生、氧化对温度变化响应的研究相对较少[14],积极开展甲烷产生和氧化对温度的响应研究对于深入理解农业湿地甲烷排放空间变异的机理具有一定的现实意义。
本研究以我国江苏东南部的常规稻田种植体系、由稻田转变来的稻虾种养结合体系和单一虾塘养殖体系为研究对象,通过测定5℃、15℃、25℃和35℃的土壤甲烷产生、氧化潜力,旨在揭示稻田土地利用类型转化后的土壤甲烷产生、氧化潜力变化特征,并探讨土壤甲烷产生、氧化潜力对温度的响应特征。研究结果为进一步评估农业湿地甲烷产生潜力、氧化潜力对气候变暖的响应以及农业土地利用方式转变对甲烷排放的影响提供基础数据和参考资料。
1 材料与方法 1.1 研究区概况研究地点位于江苏省句容市南京农业大学试验基地(31°10′ N,119°46′ E),气候为亚热带季风气候,年平均气温和降水量分别为17.3℃和1 103 mm。水稻种植品种为南梗46号,采用一年一季模式,于每年5月播种,6月移栽,10月中旬收获,收获后进入休耕期。水稻生长季年氮肥投入量为150 kg·hm–2(以N计),其中基肥占60%,分蘖期追肥占40%。选用尿素(46% N)和复合肥(N-P-K:15% ~ 15% ~ 15%)作基肥和追肥。龙虾养殖塘于2012年由水稻田转变而来,养殖虾的品种为克氏原螯虾,于每年6月至10月和11月至5月采用一年两季养殖模式。在养殖期于每日9:00和17:00用商业饲料颗粒、杂鱼和玉米种子喂养龙虾。具体肥料和饲料投入情况见表 1。稻虾种养结合体系田间结构分为水稻共养区(90%)和虾沟共养区(10%)[15]。所有沟渠养殖区于2017年2月在稻田周围开挖1条宽度约2 m、深度约1 m的沟渠,作为克氏原螯虾的栖息地,沟渠占稻田总面积的10%。除水分管理差异外,稻虾种养结合体系中水稻和龙虾管理模式与常规稻田种植和常规虾塘养殖的管理模式相同。
|
|
表 1 肥料、饲料投入情况 Table 1 The input of fertilizers and feeds |
在江苏省句容市南京农业大学试验基地分布有常规稻田种植、稻虾种养结合和常规虾塘养殖体系三种典型农业土地利用系统,于2021年7月中旬分别采集(1)常规稻田(CR):水稻单作区土壤;(2)共作稻区(R-CR):稻虾种养结合体系水稻区土壤;(3)共作虾区(R-CC):稻虾种养结合体系养殖虾沟底泥;(4)常规虾塘(CC):龙虾养殖塘底泥(图 1)。用土钻在每个区域采集0~20 cm土芯,每个土地利用类型区设置三个土壤采样点,每个采样点三个重复,土样带回实验室后立即进行室内培养实验并测定相关理化指标:将土壤浸提、震荡、离心后吸取上清液用TOC分析仪(TOC-L,Shimadzu,Kyoto,日本)测定土壤溶解性有机碳(DOC);将土壤浸提后使用流动分析仪(Auto Analyzer 3,德国)测定铵态氮(

|
注:CR,常规稻田;R-CR,共作稻区;R-CC,共作虾区;CC,常规虾塘。下同。 Note: CR, conventional rice area; R-CR, rice-crayfish rice area; R-CC, rice-crayfish crayfish area; CC, conventional crayfish area. The same as below. 图 1 研究区和采样点位置 Fig. 1 Locations of the study area and sampling sites |
|
|
表 2 不同土地利用类型区土壤基本理化特征 Table 2 Soil physiochemical properties in different land use types |
用经过预处理的土壤进行甲烷产生潜力的测定。甲烷产生潜力采用Singh等[17]改进的方式测定:将2.5 g新鲜土壤加入25 mL血清瓶中,加入无氧无菌水在土壤表面上方提供1 cm水层。在漩涡混合器上混合15 min后瓶子用橡胶塞密封。为了确保厌氧环境,将瓶子抽真空并充满N2保证厌氧环境,将处理好的土壤样品置于黑暗的恒温培养箱中,在设定不同温度条件下连续培养30 d。每个样品3个重复。每60 h采集1次气样,每次抽取培养瓶上部2 mL气样。采集的气体立刻转移至真空瓶中,并加入8 mL N2进行稀释。每次抽完气体后,再向培养瓶中注入等体积高纯氮气,然后继续培养。使用带氢火焰离子化检测器的气相色谱仪(7890A,安捷伦,美国)对气样进行测定,每5天计算1次甲烷产生潜力。为防止培养瓶内甲烷浓度过高而对甲烷产生造成抑制作用,每测定完一次甲烷产生潜力值,用高纯氮气洗气3~5 min。甲烷产生潜力(methane production potential,MPP)通过以下公式计算:
| $ {\text{MPP/}}({\rm{\mathsf{µ}}}{\text{ g}} \cdot {{\text{g}}^{ - 1}} \cdot {{\text{g}}^{ - 1}}) = K \times V/[W \times (1 - {\text{WH}}/100)] $ | (1) |
式中,K为甲烷浓度线性曲线的斜率,μg·L–1·d–1;V为血清瓶体积,L;W为新鲜土壤质量,g;WH为每100克新鲜土壤中H2O的质量,g。
1.4 甲烷氧化潜力测定甲烷氧化潜力的测定参考Kim等[18]方法:将10 g新鲜土壤加入150 mL血清瓶中,加入10 mL去离子水混合,在漩涡混合器上混合15 min后瓶子用橡胶塞密封,用注射器向瓶子中注入1.5 mL CH4(15 280 mg·m–3)。放置12 h后测初始浓度,在设定的温度条件下连续培养30 d,分别在培养过程中每天的相同时间用微型注射器抽取2 mL气体,并加入8 mL N2进行稀释。每次抽取气体后,再向培养瓶中注入等体积高纯合成空气,以保持培养瓶内外压力平衡。使用气相色谱仪测定甲烷,甲烷氧化潜力(methane oxidation potential,MOP)通过公式计算得到:
| $ \mathrm{MOP} /\left({\rm{\mathsf{µ}}} \mathrm{g} \cdot \mathrm{g}^{-1} \cdot \mathrm{d}^{-1}\right)=K \times V /[1-\mathrm{WH} / 100] $ | (2) |
式中,K为甲烷浓度线性曲线的斜率,μg·L–1·d–1;V为血清瓶体积,L;W为新鲜土壤质量,g;WH为每100克新鲜土壤中H2O的质量,g。
1.5 数据处理与分析运用Excel 2020软件对初始数据进行计算及分析。运用SPSS 22.0软件对数据进行统计分析,采用双变量多因素方差分析检验土地利用类型和温度对土壤甲烷产生、氧化潜力的影响;统计检验的显著水平为α=0.05。运用Origin 2022软件作图。
2 结果 2.1 甲烷产生潜力对温度的响应 2.1.1 土地利用类型转变下的甲烷产生潜力在整个培养期间,四种培养温度下的甲烷产生潜力均表现为由大到小依次为共作虾区、常规虾塘、共作稻区、常规稻田。在四个不同培养温度下,常规稻田、共作稻区、共作虾区和常规虾塘土壤甲烷产生潜力平均值分别为0.17、0.25、1.14和0.33 μg∙g–1∙d–1。相同温度下共作虾区的甲烷产生潜力显著高于其他土地利用类型区,常规虾塘和共作稻区次之,常规稻田的甲烷产生潜力最低(图 2)。
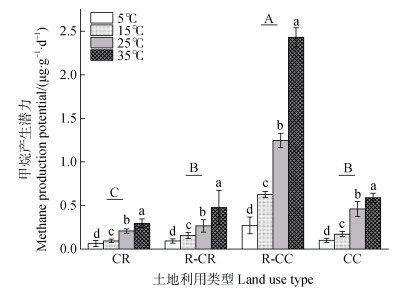
|
注:不同大写字母表示不同土地利用类型间在0.05水平上差异显著(P < 0.05);不同小写字母表示相同土地利用类型不同温度处理在0.05水平上差异显著(P < 0.05)。下同。 Note: Different capital letters indicated significant differences between different land use types at the level of 0.05(P < 0.05). Different lowercase letters indicate significant difference in different temperature treatments in the same land use type at the level of 0.05(P < 0.05).The same as below. 图 2 不同土地利用类型下不同温度的甲烷产生潜力 Fig. 2 Methane production potential under different temperature levels and land use types |
甲烷产生潜力在培养后期整体上呈现逐渐降低的趋势(图 3),整个培养期内常规稻田、共作稻区、共作虾区、常规虾塘土壤甲烷产生潜力均随培养温度的升高而显著增强(图 2)。甲烷产生潜力在5℃、15℃、25℃和35℃时的平均值分别为0.13、0.26、0.55和0.95 μg∙g–1∙d–1。常规稻田、共作稻区、共作虾区、常规虾塘四种土地利用类型区在培养温度为5℃条件下,甲烷产生潜力一直处于较低水平,平均值分别为0.05、0.08、0.27和0.10 μg∙g–1∙d–1。与5℃相比,15℃显著增加了四种土地利用类型区的甲烷产生潜力,但仍相对处于较低水平,平均值分别为0.06、0.16、0.63和0.17 μg∙g–1∙d–1。温度为25℃时,甲烷产生潜力进一步提高,平均值分别为0.21、0.26、1.25和0.46 μg∙g–1∙d–1。培养温度为35℃时,甲烷产生潜力达到最高水平,平均值分别为0.30、0.48、2.43和0.59 μg∙g–1∙d–1。
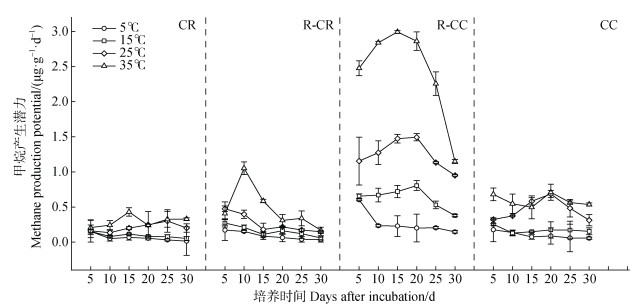
|
图 3 土壤甲烷产生潜力随培养时间的动态变化 Fig. 3 Change of methane production potential in incubation time |
培养期间,除25℃时共作稻区甲烷氧化潜力大于常规虾塘外,5℃、15℃和35℃温度下的甲烷氧化潜力均呈现出由高到低依次为常规稻田、常规虾塘、共作稻区、共作虾区。常规稻田、共作稻区、共作虾区和常规虾塘的土壤甲烷氧化潜力平均值分别为1.38、1.00、0.71和1.01 μg∙g–1∙d–1。在相同的培养温度下,常规稻田甲烷氧化潜力最高,常规虾塘和共作稻区次之,共作虾区甲烷氧化潜力最低(图 4)。
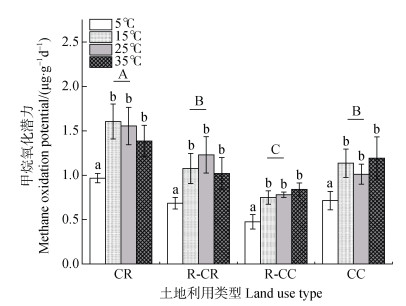
|
图 4 不同土地利用类型下不同温度的甲烷氧化潜力 Fig. 4 Methane oxidation potential under different temperature levels and land use types |
甲烷氧化潜力在5℃、15℃、25℃和35℃时的平均值为0.71、1.14、1.14和1.11 μg∙g–1∙d–1。5℃下的甲烷氧化潜力与15℃、25℃、35℃时的甲烷氧化潜力存在显著差异,而这三种培养温度之间无显著性差异。培养温度为5℃时,甲烷氧化潜力在培养期内一直处于较低水平(图 5),平均值分别为0.97、0.69、0.48和0.71 μg∙g–1∙d–1。与5℃相比,15℃显著增加了四种土地利用类型区的甲烷氧化潜力,甲烷氧化潜力平均值分别为1.61、1.08、0.75和1.14 μg∙g–1∙d–1。温度为25℃时甲烷氧化潜力平均值分别为1.56、1.23、0.78和1.01 μg∙g–1∙d–1,与15℃相比,稻虾种养结合体系中的共作稻区和共作虾区的甲烷氧化潜力小幅度增强而常规稻田和虾塘养殖的甲烷氧化潜力略微下降,两个温度下的甲烷氧化潜力无显著差异。培养温度为35℃时的甲烷氧化潜力与15℃和25℃时的甲烷氧化潜力相当,四种土地利用类型区的甲烷氧化潜力分别为1.39、1.02、0.84和1.19 μg∙g–1∙d–1。
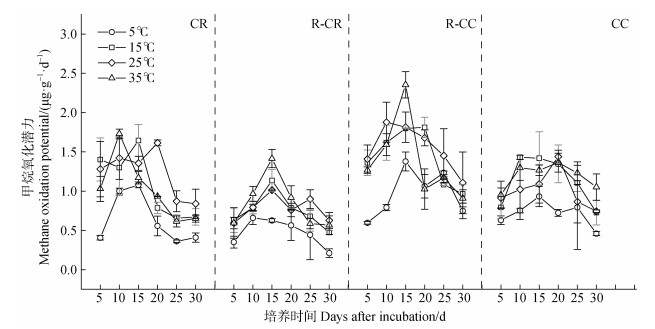
|
图 5 土壤甲烷氧化潜力随培养时间的动态变化 Fig. 5 Change of methane oxidation potential in incubation time |
不同土地利用类型下的甲烷产生潜力和氧化潜力存在显著差异(图 2和图 4),常规稻田甲烷产生潜力最低,而甲烷氧化潜力最高,当常规稻田转变为稻虾种养结合和虾塘养殖后,提高了甲烷产生潜力、降低了甲烷氧化潜力,其中共作虾区的甲烷产生潜力最高,而甲烷氧化潜力最低。
导致不同土地利用类型甲烷产生、氧化潜力差异的因素众多[19],其中水分管理是调控甲烷产生、氧化过程的决定性因素,可通过影响土壤氧化还原电位(Eh)、含氧量、微生物活性影响甲烷产生和氧化潜力[20]。采样期间水稻处于生长季,常规稻田水位深度为15 cm,共作稻区和共作虾区常年淹水,采样期水位保持在38.33和58.25 cm,常规虾塘水位稳定在60 cm左右,Eh因水位的不同而发生显著变化(表 2)。研究表明Eh是影响甲烷产生、氧化过程的重要环境因子[21]:环境中的产甲烷菌群落丰度和产甲烷量随着Eh的降低而增加,而Eh较高时为甲烷氧化菌提供适宜环境。本研究中常规稻田的低水位环境导致其具有较高的氧化还原电位(表 2),刺激甲烷氧化菌代谢,使其具有最高的甲烷氧化潜力(图 4);常规稻田种植转变为稻虾种养结合农业后,持续淹水管理降低了共作稻区和共作虾区的Eh,且共作虾区处于深度淹水,供氧不足,导致Eh最低,刺激产甲烷菌代谢,使其甲烷产生潜力最大(图 2);而常规稻田转变为虾塘养殖后虽然淹水深度增加,但由于龙虾作为底栖动物,其对底泥土壤的高强度扰动显著改善了土壤的供氧状况,增加了土壤含氧量[22],因而具有相对较高Eh,导致其甲烷产生潜力低于共作虾区(图 2)。
与甲烷产生潜力相比,甲烷氧化潜力在不同土地利用类型中差异较小(图 4),主要因水分管理不同而异[23],而甲烷产生潜力除水分管理外还受饲料和氮肥投入的影响,土地利用类型转变后由于投入养分结构的变化导致土壤碳氮含量发生较大变化,进而影响土壤DOC含量(表 2)。研究表明湿地土壤的甲烷产生潜力与土壤DOC含量之间存在显著的正相关关系[24],DOC是导致甲烷产生差异性的决定因子[25]:由于稻虾种养结合体系中水稻和龙虾管理模式与常规稻田和常规虾塘的管理模式相同,同时投入饲料和氮肥使稻虾种养体系中的DOC含量显著高于常规稻田和常规虾塘,共作虾区在投入大量龙虾饲料的同时,过剩氮肥及秸秆残体等有机肥不断积累,为产甲烷菌提供了大量的碳源,导致其具有最高的甲烷产生潜力(图 2)。
此外,土壤甲烷产生和氧化潜力随培养时间变化在后期逐渐降低(图 3和图 5),与王维奇等[26]研究结果类似,土壤微生物受底物浓度的限制其代谢活性降低,导致甲烷产生潜力和甲烷氧化潜力在培养后期逐渐降低。Wassman等[27]对不同地区稻田土壤甲烷产生潜力进行研究,发现随着底物的不断消耗,甲烷产生潜力随培养时间的进行达到峰值后呈现逐渐下降的趋势。由此可见底物含量是影响甲烷产生、氧化过程的先决条件,当底物含量较低时,温度效应会被过低的底物含量影响。
3.2 温度对甲烷产生、氧化潜力的影响无论何种土地利用类型,土壤甲烷产生潜力均随温度的升高而增强(图 2),温度对土壤甲烷产生潜力有极显著的促进作用(P < 0.001),本研究中甲烷产生潜力随温度升高呈现指数增长(图 6)。与杨平等[28]研究结果相似,本研究的结果(图 6)进一步证实了土壤中甲烷的产生是一个高度依赖温度的过程。由微生物代谢活动引起的甲烷排放占甲烷排放源的69%[29],而土壤微生物活性显著依赖于温度[12]。研究发现产甲烷菌的最适生长温度通常在35℃~42℃间[30],本研究的培养温度在5℃至35℃之间,随着温度的升高,产甲烷菌多样性和数量均增加,甲烷产生潜力也随之大大提高[31]。温度除了影响土壤产甲烷菌的活性之外,还可通过改变甲烷产生途径来影响甲烷产生潜力。自然环境下的甲烷产生途径可分为利用H2还原CO2的氢营养型和通过乙酸裂解的乙酸营养型两种途径[32]。研究证明在低温和高温条件下甲烷产生途径及相关的产甲烷菌类型会发生明显变化[33]:低于25℃时土壤的甲烷产生途径主要为乙酸营养型分解甲烷,随着温度升高,甲烷产生途径逐渐转变为氢营养型和乙酸营养型的混合产甲烷[34]。当培养温度从5℃逐渐升高至35℃时,甲烷产生过程中可利用底物增多,使土壤甲烷产生潜力提高。但该研究结果是否与温度改变导致产甲烷群落数量和活性变化、甲烷产生途径改变等有关需在今后开展相关工作加以证实。
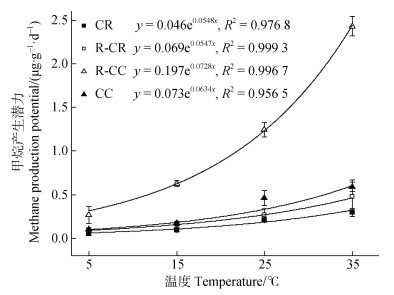
|
图 6 不同土地利用类型土壤甲烷产生潜力与温度的关系 Fig. 6 Relationships between methane production potential and temperature under different land use types |
与甲烷产生潜力对温度的响应不同,甲烷氧化潜力仅在5~15℃比较敏感,这与其他学者的研究结果类似,如,Knoblauch等[35]研究发现冻原土中土壤氧化速率的最适温度在22℃到28℃之间,甲烷氧化菌丰度随温度升高发生改变,但土壤甲烷氧化速率几乎不受影响;Fan等[13]通过研究发现甲烷氧化在5~20℃时的温度敏感性要高于20~35℃时的温度敏感性。当培养温度为5℃时,低温下甲烷氧化菌的活性较低,温度是限制甲烷氧化的因素,当温度提高时,土壤甲烷氧化菌的活性增加,甲烷和氧气扩散速率的增速低于甲烷氧化菌活性的增加,从而成为甲烷氧化的限制因素[36]。本研究结果发现甲烷氧化潜力对温度的响应要小于甲烷产生潜力(图 2和图 4),与丁维新和蔡祖聪[36]得出结论一致,即温度对甲烷氧化的影响作用弱于甲烷产生,甲烷氧化菌较产甲烷菌更不易受到温度的影响,但仍未明晰甲烷氧化菌对温度变化低反馈的具体机制,有待今后深入研究。
本研究中土壤甲烷产生潜力、氧化潜力不仅受到农业土地利用类型或温度单个因素的显著影响(P < 0.01),且两个因素之间的交互效应对土壤甲烷产生潜力存在显著影响(P < 0.01),但对甲烷氧化潜力并无显著差异(P=0.81;表 3),类似结果出现在其他研究中,Liu等[14]研究发现产甲烷菌、甲烷氧化菌等微生物对当地环境具有很强的适应性,不同类型土壤在不同温度响应下表现出不同的细菌群落结构和功能[14],因此在评价温度效应时必须考虑不同生物气候带地区间的差异。甲烷产生、氧化潜力是多种因素综合作用的结果,除土地利用类型和温度影响外,还受到肥料施用、土壤理化性质、土壤深度、种植植物、微生物等多种因素的影响[37]。故在今后研究中需侧重开展土地利用类型和温度与其他环境变量间的综合作用对农业湿地甲烷产生、氧化潜力的研究,为揭示甲烷排放机理提供基础数据和参考价值。
|
|
表 3 土地利用类型和温度及交互作用对甲烷产生潜力、甲烷氧化潜力的影响 Table 3 Effects of temperature and land use type on methane production and oxidation potentials |
常规稻田转变为稻虾种养结合农业和常规虾塘养殖后呈现不同的甲烷产生潜力和氧化潜力特征:甲烷产生潜力由大到小依次为共作虾区、常规虾塘、共作稻区、常规稻田;甲烷氧化潜力由大到小依次为常规稻田、常规虾塘、共作稻区、共作虾区。主要由于水分管理和饲料、氮肥投入差异引起底物和环境因子差异所导致。甲烷产生潜力随培养温度的升高呈现指数增加,而甲烷氧化潜力仅在低温时较为敏感,甲烷产生潜力对温度的依赖性强于甲烷氧化潜力。此外,甲烷产生、氧化潜力是多种因素综合作用的结果,在今后研究过程中应加强多因子及其交互影响对甲烷产生、氧化的研究,为揭示农业湿地的甲烷排放机理提供数据参考。
| [1] |
Swart N C, Gille S T, Fyfe J C, et al. Recent Southern Ocean warming and freshening driven by greenhouse gas emissions and ozone depletion[J]. Nature Geoscience, 2018, 11(11): 836-841. DOI:10.1038/s41561-018-0226-1
(  0) 0) |
| [2] |
IPCC. Climate change 2021: The physical science basis[R]. Cambridge, United Kingdom and New York, NY, USA, 2391.
(  0) 0) |
| [3] |
He J, Naik V, Horowitz L W, et al. Investigation of the global methane budget over 1980-2017 using GFDL-AM4.1[J]. Atmospheric Chemistry and Physics, 2020, 20(2): 805-827. DOI:10.5194/acp-20-805-2020
(  0) 0) |
| [4] |
Saunois M, Bousquet P, Poulter B, et al. The global methane budget 2000-2012[J]. Earth System Science Data Discussions, 2016, 8(2): 697-751. DOI:10.5194/essd-8-697-2016
(  0) 0) |
| [5] |
Tian H Q, Lu C Q, Ciais P, et al. The terrestrial biosphere as a net source of greenhouse gases to the atmosphere[J]. Nature, 2016, 531(7593): 225-228. DOI:10.1038/nature16946
(  0) 0) |
| [6] |
FAO. The state of world fisheries and aquaculture 2020[R]. Sustainablity in action. Rome, 2020.
(  0) 0) |
| [7] |
Bashir M A, Liu J, Geng Y C, et al. Co-culture of rice and aquatic animals: An integrated system to achieve production and environmental sustainability[J]. Journal of Cleaner Production, 2020, 249: 119310. DOI:10.1016/j.jclepro.2019.119310
(  0) 0) |
| [8] |
Yuan J J, Xiang J, Liu D Y, et al. Rapid growth in greenhouse gas emissions from the adoption of industrial-scale aquaculture[J]. Nature Climate Change, 2019, 9: 318-322. DOI:10.1038/s41558-019-0425-9
(  0) 0) |
| [9] |
Liu S W, Hu Z Q, Wu S, et al. Methane and nitrous oxide emissions reduced following conversion of rice paddies to inland crab-fish aquaculture in southeast China[J]. Environmental Science & Technology, 2016, 50(2): 633-642.
(  0) 0) |
| [10] |
van Hulzen J, Segers R, van Bodegom P, et al. Temperature effects on soil methane production: An explanation for observed variability[J]. Soil Biology and Biochemistry, 1999, 31(14): 1919-1929. DOI:10.1016/S0038-0717(99)00109-1
(  0) 0) |
| [11] |
Zhang H, Tuittila E S, Korrensalo A, et al. Methane production and oxidation potentials along a Fen-bog gradient from southern boreal to subarctic peatlands in Finland[J]. Global Change Biology, 2021, 27(18): 4449-4464. DOI:10.1111/gcb.15740
(  0) 0) |
| [12] |
Bhattarai S, Cassarini C, Lens P N L. Physiology and distribution of archaeal methanotrophs that couple anaerobic oxidation of methane with sulfate reduction[J]. Microbiology and Molecular Biology Reviews, 2019, 83(3): e00074-e00018.
(  0) 0) |
| [13] |
Fan L C, Dippold M A, Thiel V, et al. Temperature sensitivity of anaerobic methane oxidation versus methanogenesis in paddy soil: Implications for the CH4 balance under global warming[J]. Global Change Biology, 2022, 28(2): 654-664. DOI:10.1111/gcb.15935
(  0) 0) |
| [14] |
Liu P F, Klose M, Conrad R. Temperature effects on structure and function of the methanogenic microbial communities in two paddy soils and one desert soil[J]. Soil Biology and Biochemistry, 2018, 124: 236-244. DOI:10.1016/j.soilbio.2018.06.024
(  0) 0) |
| [15] |
Liu T Q, Li C F, Tan W F, et al. Rice-crayfish co-culture reduces ammonia volatilization and increases rice nitrogen uptake in central China[J]. Agriculture, Ecosystems and Environment, 2022, 330: 107869. DOI:10.1016/j.agee.2022.107869
(  0) 0) |
| [16] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [17] |
Singh A, Singh R S, Upadhyay S N, et al. Community structure of methanogenic archaea and methane production associated with compost-treated tropical rice-field soil[J]. FEMS Microbiology Ecology, 2012, 82(1): 118-134. DOI:10.1111/j.1574-6941.2012.01411.x
(  0) 0) |
| [18] |
Kim G W, Ho A, Kim P J, et al. Stimulation of methane oxidation potential and effects on vegetation growth by bottom ash addition in a landfill final evapotranspiration cover[J]. Waste Management, 2016, 55: 306-312. DOI:10.1016/j.wasman.2016.03.058
(  0) 0) |
| [19] |
Xu H, Cai Z C, Yagi K. Methane production potentials of rice paddy soils and its affecting factors (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(1): 98-104. [徐华, 蔡祖聪, 八木一行. 水稻土CH4产生潜力及其影响因素[J]. 土壤学报, 2008, 45(1): 98-104.]
(  0) 0) |
| [20] |
Wang Q S. Regulation and mechanism of greenhouse gas emissions of circular agriculture ecosystem of planting and breeding in paddy (In Chinese)[J]. Chinese Journal of Eco-Agriculture, 2018, 26(5): 633-642. [王强盛. 稻田种养结合循环农业温室气体排放的调控与机制[J]. 中国生态农业学报, 2018, 26(5): 633-642.]
(  0) 0) |
| [21] |
Tang Q, Xue X F, Wang H, et al. New knowledge of methanogens and methanotrophs in lake ecosystems (In Chinese)[J]. Journal of Lake Sciences, 2018, 30(3): 597-610. [唐千, 薛校风, 王惠, 等. 湖泊生态系统产甲烷与甲烷氧化微生物研究进展[J]. 湖泊科学, 2018, 30(3): 597-610.]
(  0) 0) |
| [22] |
Yuan Y, Bingner R L, Theurer F D, et al. Water quality simulation of rice/crawfish field ponds within annualized AGNPS[J]. Applied Engineering in Agriculture, 2007, 23(5): 585-595. DOI:10.13031/2013.23669
(  0) 0) |
| [23] |
Fang X T, Zhao J T, Wu S, et al. A two-year measurement of methane and nitrous oxide emissions from freshwater aquaculture ponds: Affected by aquaculture species, stocking and water management[J]. Science of the Total Environment, 2022, 813: 151863. DOI:10.1016/j.scitotenv.2021.151863
(  0) 0) |
| [24] |
Liu D Y, Ding W X, Yuan J J, et al. Substrate and/or substrate-driven changes in the abundance of methanogenic archaea cause seasonal variation of methane production potential in species-specific freshwater wetlands[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4711-4721.
(  0) 0) |
| [25] |
Zeleke J, Sheng Q, Wang J G, et al. Effects of Spartina alterniflora invasion on the communities of methanogens and sulfate-reducing bacteria in estuarine marsh sediments[J]. Frontiers in Microbiology, 2013, 4: 243.
(  0) 0) |
| [26] |
Wang W Q, Zeng C S, Tong C. Methane production and oxidation capacities of soil from the reed marsh of the Minjiang River Estuary (In Chinese)[J]. Wetland Science, 2008, 6(1): 60-68. [王维奇, 曾从盛, 仝川. 闽江口芦苇湿地土壤甲烷产生与氧化能力研究[J]. 湿地科学, 2008, 6(1): 60-68.]
(  0) 0) |
| [27] |
Wassmann R, Neue H, Bueno C, et al. Methane production capacities of different rice soils derived from inherent and exogenous substrates[J]. Plant and Soil, 1998, 203(2): 227-237. DOI:10.1023/A:1004357411814
(  0) 0) |
| [28] |
Yang P, He Q H, Tong C. Responses of methane production to temperature in tidal marshes soil of the Min River Estuary (In Chinese)[J]. Acta Scientiae Circumstantiae, 2015, 35(9): 2957-2963. [杨平, 何清华, 仝川. 闽江口潮汐沼泽湿地土壤甲烷产生对温度变化的响应[J]. 环境科学学报, 2015, 35(9): 2957-2963.]
(  0) 0) |
| [29] |
Conrad R. The global methane cycle: Recent advances in understanding the microbial processes involved[J]. Environmental Microbiology Reports, 2009, 1(5): 285-292.
(  0) 0) |
| [30] |
Jiang N, Chen Z J, Cao Y, et al. Methanogenic archaea and their mediated methanogenic pathways in cold wetland (In Chinese)[J]. Microbiology China, 2013, 40(1): 137-145. [蒋娜, 陈紫娟, 曹轶, 等. 低温湿地甲烷古菌及其介导的甲烷产生途径[J]. 微生物学通报, 2013, 40(1): 137-145.]
(  0) 0) |
| [31] |
Høj L, Olsen R A, Torsvik V L. Effects of temperature on the diversity and community structure of known methanogenic groups and other archaea in high Arctic peat[J]. The ISME Journal, 2008, 2(1): 37-48.
(  0) 0) |
| [32] |
Zhang J C, Xu Y Q, Lu Y H. Microbial mechanisms of methane production and oxidation in terrestrial ecosystems (In Chinese)[J]. Acta Ecologica Sinica, 2015, 35(20): 6592-6603. [张坚超, 徐镱钦, 陆雅海. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 2015, 35(20): 6592-6603.]
(  0) 0) |
| [33] |
Grosskopf R, Janssen P H, Liesack W. Diversity and structure of the methanogenic community in anoxic rice paddy soil microcosms as examined by cultivation and direct 16S rRNA gene sequence retrieval[J]. Applied and Environmental Microbiology, 1998, 64(3): 960-969.
(  0) 0) |
| [34] |
Rui J P, Qiu Q F, Lu Y H. Syntrophic acetate oxidation under thermophilic methanogenic condition in Chinese paddy field soil[J]. FEMS Microbiology Ecology, 2011, 77(2): 264-273.
(  0) 0) |
| [35] |
Knoblauch C, Zimmermann U, Blumenberg M, et al. Methane turnover and temperature response of methane-oxidizing bacteria in permafrost-affected soils of northeast Siberia[J]. Soil Biology and Biochemistry, 2008, 40(12): 3004-3013.
(  0) 0) |
| [36] |
Ding W X, Cai Z C. Effect of temperature on methane production and oxidation in soils (In Chinese)[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 604-608. [丁维新, 蔡祖聪. 温度对甲烷产生和氧化的影响[J]. 应用生态学报, 2003, 14(4): 604-608.]
(  0) 0) |
| [37] |
Xu X, Chen C, Xiong Z Q. Effects of biochar and nitrogen fertilizer amendment on abundance and potential activity of methanotrophs and methanogens in paddy field (In Chinese)[J]. Acta Pedologica Sinica, 2016, 53(6): 1517-1527. [许欣, 陈晨, 熊正琴. 生物炭与氮肥对稻田甲烷产生与氧化菌数量和潜在活性的影响[J]. 土壤学报, 2016, 53(6): 1517-1527.]
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


