硫元素是生物体必需的营养元素之一,是生命物质的主要构成组分,且在生命新陈代谢过程中扮演着重要的角色[1-2]。硫元素的化学性质活泼,价态从–2价到+6价不等,而不同价态硫化合物之间的相互转化主要由代谢功能多样的微生物所驱动,最终构成了土壤硫循环[3-4]。微生物驱动的硫循环可分为六个途径:有机硫转化途径、其他(转运)途径、同化硫酸盐还原途径、硫氧化途径、异化硫酸盐还原途径以及硫歧化途径[5-7]。目前,对全球硫循环的研究已有很多,但这些研究主要关注于无机硫的循环代谢,尤其是异化硫酸盐还原过程[8-10]。技术条件在很大程度上限制了对硫循环整体代谢途径及其机制的认识[11]。由于受技术条件限制,对硫的生物转换特征及机制了解尚不充分。相较于传统方法,宏基因组测序技术可直接从环境样品中提取DNA进行深度测序,能够更加全面、真实、精确地反映微生物群落的遗传信息[12-14]。因此,目前宏基因组测序技术是实现微生物群落全覆盖的有效方法,被广泛应用于微生物群落多样性和组成的分析。
红壤性水稻土是我国南方水稻生产重要的土壤类型,其总面积约占全国耕地面积的30%,其粮食贡献率接近全国粮食总产量的50%[15-16],是重要的农业土壤资源。在稻田生态系统中,硫元素含量与碳和氮元素相比并不丰富,但其所发挥的作用却不能忽视。例如,水稻植株中90%以上的有机硫会参与氨基酸和蛋白质的合成[17],但高浓度硫化氢会极大危害水稻种子的萌发及根系的生长,从而降低水稻产量[18]。由于水稻独特的种植模式,稻田土壤长期处于干湿交替状态,其氧化还原过程交替频繁,不同形态的硫元素转化的生物化学反应活跃,为不同硫元素转化的生物化学循环途径提供了良好的环境[19]。因此,研究红壤性水稻土中微生物驱动的硫元素代谢循环途径特征对了解红壤性水稻土硫循环具有重要的意义。本文的研究拟回答如下科学问题:红壤性水稻土的硫循环途径特征是什么?不同母质发育的红壤性水稻土是否具有相同的硫循环途径特征?负责硫循环各途径的微生物群落结构组成特点如何?特定的母质中是否存在独特的优势硫转化功能菌群?
为了回答上述科学问题,本研究分别以花岗岩和第四纪红色黏土母质发育的红壤性水稻土为研究对象,通过宏基因组生物信息学技术,探究两种不同母质发育的红壤性水稻土中硫循环相关功能微生物群落组成,分析两种不同母质发育的红壤水稻土硫循环途径特征及其相关功能微生物群落结构特点,旨在揭示红壤性水稻土中硫循环代谢途径特征,增强在微观尺度上对水稻土中硫循环机制的理解。
1 材料与方法 1.1 研究区概况供试土壤样品是两种不同母质发育的红壤性水稻土,分别为第四纪红色黏土母质发育的祁阳水稻土(DSJ)和花岗岩母质发育的海南水稻土(HG)。
第四纪红色黏土母质发育的祁阳水稻土(DSJ)采自中国农业科学院湖南祁阳农田生态系统国家野外科学观测研究站(26°45′42″N、111°52′32″E),该地区属于亚热带气候,海拔150 ~ 170 m,年平均气温17.8 ℃,年平均降水1 290 mm。该地区主要种植双季稻,每季水稻总施肥量为N 160 kg·hm–2、P2O5 90 kg·hm–2、K2O 90 kg·hm–2。土壤母质为第四纪红色黏土,土壤质地为壤质黏土。
花岗岩母质发育的海南水稻土(HG)采自海南省儋州市西培农场附近(19°48′83″N、109°47′61″E),该地区属于热带海洋季风气候,高温多雨,年平均气温为22.5 ~ 25.6 ℃,年平均降水140 ~ 1 800 mm。该地区主要种植双季稻,每季水稻总施肥量为N 160 kg·hm–2、P2O5 95 kg·hm–2、K2O 95 kg·hm–2。土壤母质为花岗岩,土壤质地为砂质壤土。
1.2 土壤样品采集与测定方法土壤样品采集于2020年12月,在两种母质发育的红壤性水稻土中,分别随机选取3个面积为25 m2的小区,各小区间隔不低于10 m,按照梅花形布点的方式用直径2.5 cm的土钻钻取0 ~ 15 cm土壤,置于有干冰的盒子中带回实验室,去除土样中的枯枝落叶等杂物后,一部分土样风干用于土壤基本理化性质的测定,另一部分土样保存于–80 ℃冰箱用于后续DNA提取及宏基因组测序。
土壤基本理化性质参考《土壤农化分析》进行测定[20]。土壤全硫含量使用元素分析仪(Vario Microcube,Elementar,Hanau,德国)测定;土壤水溶性硫和吸附性硫分别以H2O和KH2PO4(P,500 mg·L–1)溶液为浸提剂,浸提液过滤后于电感耦合等离子体原子发射光谱(ICP·AES)测定,本研究中有效硫含量为水溶性硫与吸附性硫之和;有机硫由全硫和有效硫的差值获得[21]。土壤基本理化性质见表 1。
|
|
表 1 供试土壤基本理化性质 Table 1 Physical and chemical properties of tested soil |
采用FastDNA Spin kit for soil(MP Biomedicals,Cleveland,OH,USA)试剂盒,按照操作手册提取土壤样品的DNA。对所提取的总DNA进行质量检测:1%琼脂糖凝胶电泳测定DNA质量;超微量分光光度计NanoDrop 2000(Thermo Fisher Scientific,USA)测定DNA纯度和浓度。取2 μg DNA样品备送派森诺生物科技有限公司进行宏基因组测序,采用Illumina Hiseq高通量测序平台测序。
1.4 宏基因组序列分析与数据统计分析宏基因组测序数据分析从原始FASTQ文件开始,首先使用软件Seqprep和Sickle对下机原始数据进行去接头、质量剪切以及去污染等优化处理,然后使用软件SOAPdenovo、MetaGene分别对通过质量筛查的有效序列进行拼接组装和基因预测,最后使用比对软件BLASTP(BLAST Version 2.2.28+,http://blast.ncbi.nlm.nih.gov/Blast.cgi)将基因集与SCycDB数据库(一个快速注释宏基因组研究中硫循环微生物群落的数据库)[5]进行比对(BLAST比对参数设置期望值e-value为10–5),并通过SCycDB数据库对应的分类学信息数据库获得物种注释,然后使用物种对应的基因丰度总和计算该物种的丰度。采用SPSS 26.0进行统计分析,单因素方差分析(One-way ANOVA)检验两种母质发育的红壤性水稻土中硫循环各途径的功能基因丰度均值差异的显著性(差异水平P < 0.05),用独立样本t检验两种母质发育的红壤性水稻土的基本理化性质,用Spearman(斯皮尔曼)相关性分析土壤硫含量与硫循环各途径的相关性;用Origin 22.0做硫循环途径的发生频率图;用R语言中ggplot2包绘制门水平以及种水平上的微生物群落结构图。
2 结果 2.1 宏基因组测序基本数据如表 2所示,经过Hiseq高通量测序后,花岗岩母质发育的红壤性水稻土(HG)和第四纪红色黏土母质发育的红壤性水稻土(DSJ)分别产生了大约12 Gb、11 Gb的数据量,原始序列经过滤,去除低质量序列、模糊序列和嵌合体序列后,分别得到了平均60 105 693、87 331 963条清除后序列条数。宏基因组测序结果几乎涵盖了环境样品中所有的微生物,所有样品的覆盖度都在97%以上,说明该结果能够比较全面真实地反映土壤微生物群落组成。
|
|
表 2 土壤基因组DNA测序数据统计 Table 2 Statistics of soil genomic DNA sequencing data |
细菌、古菌和真菌完成的硫转化途径功能基因丰度如图 1所示。为了使宏基因组测序深度标准化,本研究将每个硫循环途径的基因丰度作为其在样品内的检出频率(图 1)。细菌序列在基因文库中处于主导地位,占所有序列的99.52%,其次为古菌占0.442%和真菌占0.0317%。细菌和古菌在两种母质发育的红壤性水稻土中硫循环途径发生频率表现出相似的趋势,即有机硫转化途径微生物功能基因丰度的检出频率最高,每百万个带注释的细菌序列平均检测到16 000个功能基因,硫歧化途径微生物功能基因丰度的检出频率最低,每百万个带注释的细菌序列平均检测到116个功能基因。细菌和古菌的硫循环各途径的微生物功能基因丰度检出频率均表现出花岗岩母质发育的红壤 > 第四纪红色黏土母质发育的红壤的趋势,但古菌中微生物内部的转运途径微生物功能基因丰度发生频率比同化途径、氧化途径的发生频率更低。花岗岩母质发育的红壤性水稻土中真菌参与的硫循环途径微生物功能基因仅在有机硫转化途径中检测到;第四纪红色黏土母质发育的水稻土中真菌参与的硫循环途径功能基因仅异化硫酸盐途径未检测出。
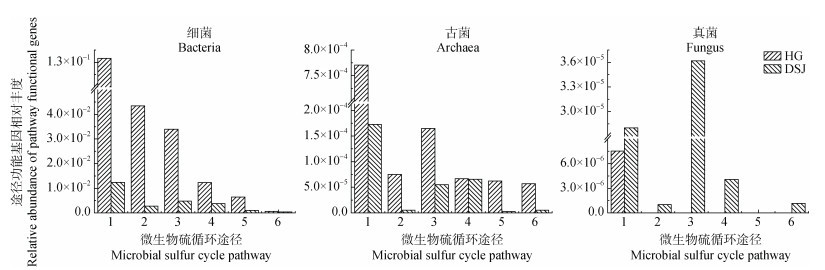
|
注:1表示有机硫转化途径;2表示其他(转运)途径;3表示同化硫酸盐还原途径;4表示硫氧化途径;5表示异化硫酸盐还原途径;6表示硫歧化途径。下同。 Note: 1 represents the organic sulfur conversion pathway; 2 means other(transit)routes; 3 represents the assimilative sulfate reduction pathway; 4 represents the sulfur oxidation pathway; 5 represents the dissimilated sulfate reduction pathway; 6 represents the sulfur disproportionation pathway. The same below. 图 1 细菌、古菌和真菌参与的硫循环途径微生物功能基因的相对丰度 Fig. 1 Relative abundance of microbial functional genes for each sulfur cycling pathway in bacteria, archaea and fungi |
对不同母质发育的红壤水稻土所涉及的6条硫循环代谢途径的微生物功能基因丰度进行单因素方差分析,结果表明,两种母质发育的红壤水稻土中硫循环六条途径微生物功能基因均能被检测到,且花岗岩发育的水稻土中硫循环途径的微生物功能基因丰度均显著高于第四纪红色黏土发育的水稻土(P < 0.05,图 2)。其中有机硫转化途径微生物功能基因的丰度在两种母质发育的水稻土中均最高,且远远高于其他硫循环途径微生物功能基因的丰度;而硫歧化途径微生物功能基因的丰度最低。值得注意的是,相对研究较多的异化硫酸盐还原途径的微生物功能基因丰度却很低。
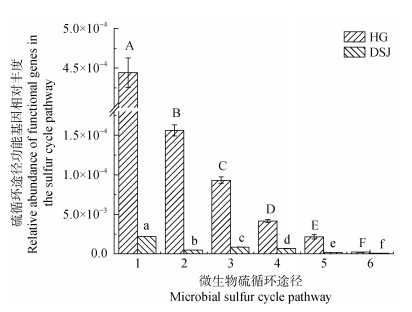
|
注:大写字母表示花岗岩母质发育的红壤性水稻土中存在显著性差异(P < 0.05),小写字母表示第四纪红色黏土发育的红壤性水稻土中存在显著性差异(P < 0.05);纵坐标值是从每百万个基因序列中检测到的目标功能基因的相对丰度。 Note: Capital letters indicate significant differences in red paddy soils with granitic parent material(P < 0.05), Lowercase letters indicate significant differences in red paddy soils with red clay development during the Quaternary period(P < 0.05). The ordinate value is the relative abundance of a target functional gene detected per million gene sequences. 图 2 六种硫循环途径涉及的微生物功能基因丰度 Fig. 2 Abundance of microbial functional gene involved in six sulfur cycling pathways |
在门水平分类上,两种母质发育的红壤性水稻土中硫循环微生物群落组成相似(图 3)。相对丰度≥1%的门类有15个,主要是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)、放线菌门(Actinobacteria)等,约占两个样本硫循环各途径总序列的97%。相对丰度≤1%的门类仅占两个样品硫循环各途径总序列的3%(图 3)。变形菌门(Proteobacteria)在两个母质发育的红壤性水稻土中均属于优势菌门,相对丰度占比55%以上。其次酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)以及放线菌门(Actinobacteria),占比分别为10.61%、7.18%、5%以及4.89%。这五大优势菌门共占总微生物群落的80%以上。但在第四纪红色黏土母质发育的红壤性水稻土硫循环各途径中均存在丰度较高的未鉴定门类微生物,尤其是在异化硫酸盐还原途径中丰度最高,占比33.29%;并且硫歧化途径中疣微菌门(Verrucomicrobia)和厚壁菌门(Firmicutes)的占比明显高于其他途径以及花岗岩发育的水稻土,占比分别为21.42%和11.11%。
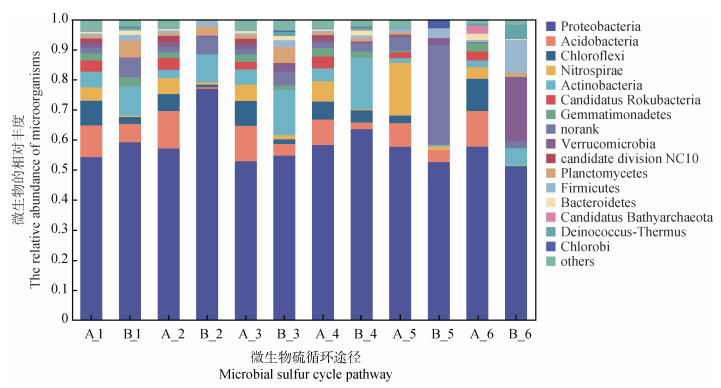
|
注:A表示花岗岩母质发育的红壤,B表示第四纪红色黏土母质发育的红壤。1表示有机硫转化途径,2表示其他(转运)途径,3表示同化硫酸盐还原途径,4表示硫氧化途径,5表示异化硫酸盐还原途径,6表示硫歧化途径。下同。 Note: A represents the red soil developed from granite parent materials, and B represents the red soil developed from quaternary red clay parent materials.1 represents the organic sulfur conversion pathway, 2 represents other(transport)pathways, 3 represents the assimilative sulfate reduction pathway, 4 represents the sulfur oxidation pathway, 5 represents the dissimilar sulfate reduction pathway, and 6 represents the sulfur disproportionation pathway. The same below. 图 3 参与硫循环涉及的微生物群落结构(门水平) Fig. 3 Microbial community structure involved in sulfur cycling pathway at the phylum level |
对两种母质发育的红壤性水稻土中参与硫循环的微生物物种丰度进行热图展示,如图 4所示。两种母质发育的红壤性水稻土中介导硫循环途径的优势微生物种群差异较大。如Deltaproteobacteria、Acidobacteria、Betaproteobacteria在花岗岩母质发育的红壤性水稻土硫循环所有途径中均属于优势功能微生物,其丰度占花岗岩母质水稻土所有硫循环微生物丰度的40%以上,且参与花岗岩母质发育的红壤性水稻土硫循环途径中微生物相对丰度较第四纪红红壤性水稻土的更高。第四纪红色黏土母质发育的水稻土中介导硫循环各途径的微生物丰度均低于花岗岩母质发育的水稻土,但参与其硫循环的优势微生物却更加丰富,如在有机硫转化途径中Gemmatirosa kalamazoonesis丰度最高;在其他(转运)途径Azoarcus sp.丰度最高;在同化硫酸盐还原途径Anaeromyxobacter sp.丰度最高;在硫氧化途径、异化硫酸盐还原途径以及硫歧化途径中丰度最高的微生物分别为Betaproteobacteria、Candidatus Filomicrobium marinum和Opitutus terrae。两种母质发育的红壤性水稻土中参与异化硫酸盐还原途径和硫歧化途径的微生物菌种类别均相对较少,尤其是在第四纪红色黏土母质发育的水稻土中。Betaproteobacteria、Anaeromyxobacter dehalogenans和Pseudolabrys taiwanensis是两种红壤性水稻土中硫循环各途径所共有的细菌。在两种母质发育的红壤性水稻土中介导硫循环各条途径丰度位居前20的微生物中并未检测出真菌和古菌。
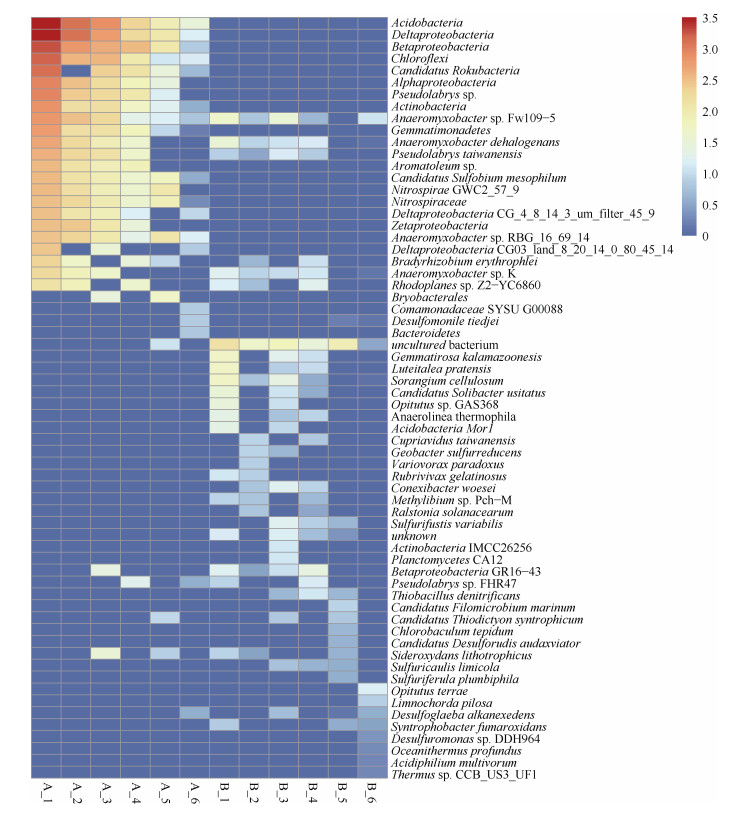
|
注:仅展示不同母质发育水稻土中每条硫循环途径功能微生物中丰度最高的前20个物种。 Note: Only the top 20 species of microorganisms with the highest abundance of each sulfur cycling pathway in paddy soils with different parent materials were displayed. 图 4 硫循环途径的微生物群落结构(种水平) Fig. 4 Microbial community structure of sulfur cycling pathway at the species level |
对土壤硫含量与两种母质发育的红壤性水稻土中硫循环各途径功能基因进行相关性分析,结果表明,红壤性水稻土中硫含量会对硫循环途径功能基因相对丰度产生影响(图 5)。如土壤全硫含量与同化硫酸盐还原途径呈显著正相关(P < 0.05);土壤有机硫含量与同化硫酸盐还原途径呈显著正相关(P < 0.05);土壤有效硫与除同化硫酸盐还原途径以外的所有硫循环都呈现显著负相关(P < 0.05),其中与其他(转运)途径呈现极显著负相关(P < 0.01)。
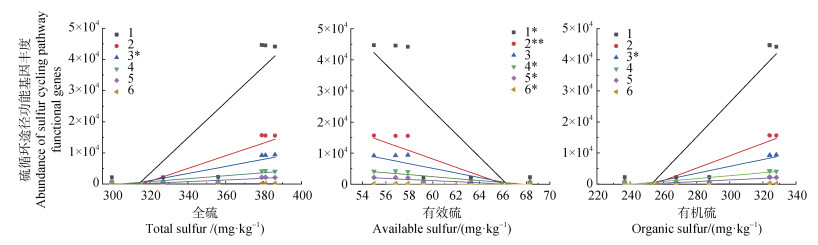
|
注:*表示硫含量与硫循环不同途径间的存在显著差异(P < 0.05),**表示硫含量与硫循环不同途径间的存在极显著差异(P < 0.01)。 Note: * indicates significant difference between sulfur content and different pathways of the sulfur cycle(P < 0.05), ** indicates very significant difference between sulfur content and different sulfur cycle pathways(P < 0.01). 图 5 土壤硫含量与硫循环各途径功能基因相对丰度的相关性分析 Fig. 5 Correlation analysis between soil sulfur content and relative abundance of functional genes in sulfur cycle pathways |
通过宏基因组深度测序后发现在两种母质发育的红壤性水稻土中,有机硫转化途径的功能基因相对丰度是检出频率最高的硫循环途径,显著高于其他硫循环途径功能基因的相对丰度(P < 0.05),而硫歧化途径功能基因相对丰度的检出频率最低(图 2)。由微生物驱动的全球硫循环中能够介导有机硫转化过程的功能基因广泛分布于环境中。对淡水、温泉及海洋沉积物的宏基因组分析中发现,有机硫转化过程的微生物系统发育多样性以及功能基因丰度最高,而介导硫歧化途径的微生物功能基因丰度最低[5]。Carrión等[22]对湖泊、河流、海洋沉积物以及多种土壤环境中的硫代谢功能微生物进行宏基因组学分析表明,有机硫转化过程中能够将甲硫醇(CH3SH;MeSH)转化为二甲基硫(dimethyl sulfide;DMS)的甲硫醇甲基转移酶(Methanethiol S-methyltransferase;MddA)广泛存在于海洋和陆地环境中,其在土壤环境中最为丰富,土壤环境中约有超过76%的细菌均存在该酶基因,包括放线菌、根瘤菌和沉积物假单胞菌等。也有研究发现,硫歧化途径的硫氧化还原酶(Sulphur oxygenase/reductase;SOR)仅在约35种不同的细菌和古细菌中被发现,包括嗜中温和嗜极端微生物(如嗜热微生物、嗜碱微生物以及嗜酸微生物等)[23],进一步表明了土壤环境中硫歧化途径的发生频率相对较低。与营养循环相关的宏基因组序列数量越多表明营养循环速率越快[24-25],因此本研究中花岗岩母质发育的红壤性水稻土中硫循环速率要远高于第四纪红色黏土母质发育的红壤性水稻土。
已有研究表明,土壤养分含量(如有机质、全氮、全硫以及有效硫等)能够显著影响土壤微生物群落丰度与多样性。Taketani等[26]发现沉积物中的有机碳是微生物进行硫酸盐还原反应的电子供体,沉积物中硫酸盐还原菌可代谢的碳源与硫酸盐还原率呈正相关。Mishra等[27]发现,在印度红树林雨季有较高含量的土壤养分,致使雨季较旱季有着更丰富的硫氧化微生物。在本研究中,土壤有效硫(AS)的含量与土壤硫循环途径整体呈显著负相关(P < 0.05,图 5),而第四纪红色黏土发育的红壤性水稻土中有效硫含量显著高于花岗岩母质发育的红壤性水稻土(P < 0.05,表 1),推测养分含量较高可能是造成花岗岩母质发育的红壤性水稻土中硫循环的微生物功能基因相对丰度显著高于第四纪红色黏土母质发育的红壤性水稻土中的功能基因相对丰度的重要原因之一(图 2)。
3.2 母质对硫循环功能微生物的影响已有研究发现,微生物群落并非是均匀分布的,而是呈现一种少量优势物种和大量的稀有物种的规律,且少量优势物种丰度较高[28]。本研究发现,在门水平分类上,两种母质发育的红壤性水稻土中参与硫循环的微生物群落组成相似(图 3),相对丰度大于等于1%的门类占总微生物群落相对丰度的80%以上,其优势菌门均属于变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)和放线菌门(Actinobacteria)等,这与陈俊松等[29]对湖泊硫循环微生物的研究中的结论相似。有研究对淡水、温泉、海洋沉积物和土壤4种生境中参与硫循环的微生物群落进行分类学分析也发现,变形菌门(Proteobacteria)在4种生境中均为硫循环微生物群落的优势门类[5]。对同一循环途径而言,在某一生境中占优势的微生物类群往往在所有生境中均占优势[25]。由此可知,不同母质对红壤性水稻土中硫循环门水平分类上影响不显著。
在不同母质发育的水稻土中,参与硫循环的具体功能菌种会有所不同,即特定的母质中存在着独特的优势硫转化功能菌种。Giovannoni和Stingl[30]发现在海洋生态系统中所有硫代谢途径功能基因均可以在变形杆菌中找到,其他谱系的微生物则是在其生理功能上更单一,这也就导致了在不同硫循环途径中会存在不同的优势微生物菌种。本研究中,与第四纪红色黏土母质发育的红壤性水稻土相比,花岗岩母质发育的水稻土中硫循环功能微生物相对丰度更高。好氧硫氧化微生物(Acidobacteria)、厌氧光养硫氧化微生物(Betaproteobacteria)及厌氧硫酸盐还原菌(Deltaproteobacteria)等是所参与的所有硫循环途径主要的优势硫转化功能菌群(图 4),其中Deltaproteobacteria被证明同时具有硫酸盐还原和硫歧化的功能[31-32],但在第四纪红色黏土母质发育的红壤性水稻土中并未检测出Deltaproteobacteria等微生物,其硫循环途径的优势微生物各不相同。以其他(转运)途径和同化硫酸盐还原途径为例,丰度最高的微生物菌种分别是固氮弧菌(Azoarcus sp.)和厌氧粘细菌(Anaeromyxobacter sp.),前者是以有机碳作为电子供体,能将亚硝酸盐或硝酸盐转化为氮气的同时将硫化物氧化为硫单质的微生物[33],后者被证明是一类典型的利用乙酸盐的作为电子供体的呼吸型铁还原菌,在厌氧条件下通过微生物异化Fe(Ⅲ)还原作用,能够有效地竞争电子供体抑制水稻土中依赖乙酸盐的产甲烷过程抑制水稻土中依赖乙酸盐的产甲烷过程[34-35],这表明在第四纪红色黏土母质发育的红壤性水稻土中硫元素与其他元素(如碳、氮、铁等元素)的耦合更加频繁。因此,水稻土中硫元素与其他元素循环的耦合机制值得进一步深入研究。
本研究发现两种母质发育的红壤性水稻土中参与异化硫酸盐还原途径和硫歧化途径的微生物丰度相较于其他途径微生物均很低,但两种母质发育的水稻土中参与异化硫酸盐还原途径的微生物种类均不尽相同,这可能意味着在土壤环境中能够进行异化硫酸盐还原反应的微生物多样性更加丰富。这与Anantharaman等[36]在不同海洋和土壤环境中介导异化硫酸盐还原途径的微生物进行的宏基因组测序结果相似。
4 结论两种母质发育的红壤性水稻土中存在相同的硫循环途径特征,即有机质转化途径是微生物功能基因检出频率最高的途径,硫歧化途径是微生物功能基因检出频率最低的途径。受土壤养分含量的影响,花岗岩母质发育的红壤性水稻土中硫循环功能基因丰度显著高于第四纪红色黏土母质发育的红壤性水稻土。两种母质发育的红壤性水稻土中主导硫循环的微生物在门水平上没有显著差异,但在种水平分类上差异显著,表明不同母质中存在着独特的优势硫转化功能菌群。
| [1] |
Saito K. Sulfur assimilatory metabolism. The long and smelling road[J]. Plant Physiology, 2004, 136(1): 2443-2450. DOI:10.1104/pp.104.046755
(  0) 0) |
| [2] |
Grein F, Ramos A R, Venceslau S S, et al. Unifying concepts in anaerobic respiration: Insights from dissimilatory sulfur metabolism[J]. Biochimica et Biophysica Acta-Bioenergetics, 2013, 1827(2): 145-160. DOI:10.1016/j.bbabio.2012.09.001
(  0) 0) |
| [3] |
Zhang H, Li Y J, Wang W Y, et al. Research progress of the microbial sulfur-cycling network (In Chinese)[J]. Acta Microbiologica Sinica, 2021, 61(6): 1567-1581. [张宏, 李颖杰, 王文颖, 等. 微生物硫循环网络的研究进展[J]. 微生物学报, 2021, 61(6): 1567-1581.]
(  0) 0) |
| [4] |
Castro H F, Williams N H, Ogram A. Phylogeny of sulfate-reducing bacteria[J]. FEMS Microbiology Ecology, 2000, 31(1): 1-9.
(  0) 0) |
| [5] |
Yu X L, Zhou J Y, Song W, et al. SCycDB: A curated functional gene database for metagenomic profiling of sulphur cycling pathways[J]. Molecular Ecology Resources, 2021, 21(3): 924-940. DOI:10.1111/1755-0998.13306
(  0) 0) |
| [6] |
Hu X, Liu J H, Liu H W, et al. Sulfur metabolism by marine heterotrophic bacteria involved in sulfur cycling in the ocean (In Chinese)[J]. Science China Earth Sciences, 2018, 48(12): 1540-1550. [胡欣, 刘纪化, 刘怀伟, 等. 异养细菌硫代谢及其在海洋硫循环中的作用[J]. 中国科学: 地球科学, 2018, 48(12): 1540-1550.]
(  0) 0) |
| [7] |
Wu B, Liu F, Fang W, et al. Microbial sulfur metabolism and environmental implications[J]. Science of the Total Environment, 2021, 778(12/13): 146085.
(  0) 0) |
| [8] |
Baker B J, Lazar C S, Teske A P, et al. Genomic resolution of linkages in carbon, nitrogen, and sulfur cycling among widespread estuary sediment bacteria[J]. Microbiome, 2015, 3: 14. DOI:10.1186/s40168-015-0077-6
(  0) 0) |
| [9] |
Hausmann B, Pelikan C, Herbold C W, et al. Peatland Acidobacteria with a dissimilatory sulfur metabolism[J]. The ISME Journal, 2018, 12(7): 1729-1742. DOI:10.1038/s41396-018-0077-1
(  0) 0) |
| [10] |
Vavourakis C D, Mehrshad M, Balkema C, et al. Metagenomes and metatranscriptomes shed new light on the microbial-mediated sulfur cycle in a Siberian soda lake[J]. BMC Biology, 2019, 17(1): 69. DOI:10.1186/s12915-019-0688-7
(  0) 0) |
| [11] |
Wasmund K, Mußmann M, Loy A. The life sulfuric: microbial ecology of sulfur cycling in marine sediments[J]. Environmental Microbiology Reports, 2017, 9(4): 323-344. DOI:10.1111/1758-2229.12538
(  0) 0) |
| [12] |
Konstantinidis K T, Rosselló-Móra R, Amann R. Uncultivated microbes in need of their own taxonomy[J]. The ISME Journal, 2017, 11(11): 2399-2406. DOI:10.1038/ismej.2017.113
(  0) 0) |
| [13] |
Wang Z H, Jiang X J. Metagenomics-centric assembly of nitrifying communities in three pH-distinct soils with the same origin of parent material (In Chinese)[J]. Acta Microbiologica Sinica, 2021, 61(7): 1933-1944. [王智慧, 蒋先军. 宏基因组技术研究泥岩母质发育的三种不同pH紫色土硝化微生物群落演变规律[J]. 微生物学报, 2021, 61(7): 1933-1944.]
(  0) 0) |
| [14] |
He J Z, Yuan C L, Shen J P, et al. Methods for and progress in research on soil metagenomics (In Chinese)[J]. Acta Pedologica Sinica, 2012, 49(1): 155-164. [贺纪正, 袁超磊, 沈菊培, 等. 土壤宏基因组学研究方法与进展[J]. 土壤学报, 2012, 49(1): 155-164.]
(  0) 0) |
| [15] |
Sun B, Liang Y, Xu R K, et al. Long-term research on red soil degradation and remediation promotes development of ecological recycling agriculture in hilly region of Southeast China (In Chinese)[J]. Bulletin of Chinese Academy of Sciences, 2018, 33(7): 746-757. [孙波, 梁音, 徐仁扣, 等. 红壤退化与修复长期研究促进东南丘陵区生态循环农业发展[J]. 中国科学院院刊, 2018, 33(7): 746-757.]
(  0) 0) |
| [16] |
Zhao Q G. Degradation of red soil in our country (In Chinese)[J]. Soils, 1995, 27(6): 281-285. [赵其国. 我国红壤的退化问题[J]. 土壤, 1995, 27(6): 281-285.]
(  0) 0) |
| [17] |
Freney J R, Jacq V A, Baldensperger J F. The significance of the biological sulfur cycle in rice production[M]// Dommergues Y R, Diem H G. Microbiology of Tropical Soils and Plant Productivity. Developments in Plant and Soil Sciences, vol 5. Netherlands: Springer, 1982: 271—317.
(  0) 0) |
| [18] |
Jacq V A, Prade K, Ottow J C G. Iron Sulphide accumulation in the rhizosphere of wetland rice(Oryza sativa L.)as the result of microbial activities[J]. Developments in Geochemistry, 1991, 6: 453-468.
(  0) 0) |
| [19] |
Liu X Z, He J Z, Zhang L M. The sulfate-reducing bacteria and surfer cycle in paddy soil (In Chinese)[J]. Acta Ecologica Sinica, 2009, 29(8): 4455-4463. [刘新展, 贺纪正, 张丽梅. 水稻土中硫酸盐还原微生物研究进展[J]. 生态学报, 2009, 29(8): 4455-4463.]
(  0) 0) |
| [20] |
Bao S D. Soil and agricultural chemistry analysis (In Chinese). 3rd ed[M]. Beijing: China Agriculture Press, 2000. [鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000.]
(  0) 0) |
| [21] |
Liu X X, Wang J, Zeng H. Spatial variation in surface soil sulfur in the temperate grasslands of china and environmental constraints (In Chinese)[J]. Acta Ecologica Sinica, 2016, 36(24): 7919-7928. [刘潇潇, 王钧, 曾辉. 中国温带草地土壤硫的分布特征及其与环境因子的关系[J]. 生态学报, 2016, 36(24): 7919-7928.]
(  0) 0) |
| [22] |
Carrión O, Pratscher J, Curson A R J, et al. Methanethiol-dependent dimethylsulfide production in soil environments[J]. The ISME Journal, 2017, 11: 2379-2390. DOI:10.1038/ismej.2017.105
(  0) 0) |
| [23] |
Rühl P, Kletzin A. The sulfur oxygenase reductase activity assay: Catalyzing a reaction with elemental sulfur as substrate at high temperatures[J]. Bio-protocol, 2017, 7(14): e2403.
(  0) 0) |
| [24] |
Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21390-21395.
(  0) 0) |
| [25] |
Nelson M B, Martiny A C, Martiny J B H. Global biogeography of microbial nitrogen-cycling traits in soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(29): 8033-8040.
(  0) 0) |
| [26] |
Taketani R G, Yoshiura C A, Dias A C F, et al. Diversity and identification of methanogenic archaea and sulphate-reducing bacteria in sediments from a pristine tropical mangrove[J]. Antonie van Leeuwenhoek, 2010, 97(4): 401-411. DOI:10.1007/s10482-010-9422-8
(  0) 0) |
| [27] |
Mishra R, Rashmi, Swain R, et al. Diversity and seasonal fluctuation of predominant microbial communities in Bhitarkanika, a tropical mangrove ecosystem in India[J]. Revista de Biología Tropical, 2012, 60(2): 909-924.
(  0) 0) |
| [28] |
McGill B J, Etienne R S, Gray J S, et al. Species abundance distributions: moving beyond single prediction theories to integration within an ecological framework[J]. Ecology Letters, 2007, 10(10): 995-1015. DOI:10.1111/j.1461-0248.2007.01094.x
(  0) 0) |
| [29] |
Chen J S, Yang J, Jiang H C. Research progress on microbes involved in lacustrine sulfur cycling (In Chinese)[J]. Acta Microbiologica Sinica, 2020, 60(6): 1177-1191. [陈俊松, 杨渐, 蒋宏忱. 湖泊硫循环微生物研究进展[J]. 微生物学报, 2020, 60(6): 1177-1191.]
(  0) 0) |
| [30] |
Giovannoni S J, Stingl U. Molecular diversity and ecology of microbial plankton[J]. Nature, 2005, 437(7057): 343-348.
(  0) 0) |
| [31] |
Bell E, Lamminmäki T, J Alneberg J, et al. Active sulfur cycling in the terrestrial deep subsurface[J]. The ISME Journal, 2020, 14(5): 1260-1272.
(  0) 0) |
| [32] |
M ller H, Marozava S, Probst A J, et al. Groundwater cable bacteria conserve energy by sulfur disproportionation[J]. The ISME Journal, 2020, 14(2): 623-634.
(  0) 0) |
| [33] |
Ma X D, Gao L F, Tan W B, et al. Screening of a heterotrophic desulphurization and denitrification strain and its biological desulfurization and denitrification characteristics (In Chinese)[J]. Microbiology China, 2015, 42(5): 853-857. [马晓丹, 高灵芳, 谭文博, 等. 一株异养脱硫反硝化菌株的筛选及其生物脱硫脱氮特性研究[J]. 微生物学通报, 2015, 42(5): 853-857.]
(  0) 0) |
| [34] |
Coates J D, Cole K A, Michaelidou U, et al. Biological control of hog waste odor through stimulated microbial Fe(Ⅲ) reduction[J]. Applied and Environmental Microbiology, 2005, 71(8): 4728-4735.
(  0) 0) |
| [35] |
Wang X J, Bei Q C, Liu G, et al. Microbial abundance and community composition in different types of paddy soils in China and their affecting factors (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3): 767-776. [王晓洁, 卑其成, 刘钢, 等. 不同类型水稻土微生物群落结构特征及其影响因素[J]. 土壤学报, 2021, 58(3): 767-776.]
(  0) 0) |
| [36] |
Anantharaman K, Hausmann B, Jungbluth S P, et al. Expanded diversity of microbial groups that shape the dissimilatory sulfur cycle[J]. The ISME Journal, 2018, 12(7): 1715-1728.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


