2. 上海市农业科学院生物技术研究所, 农业农村部农业转基因生物安全评价(环境)重点实验室, 上海市农业遗传育种重点实验室, 上海 201106;
3. 山东省农业技术推广中心, 济南 250003;
4. 复旦大学生命科学学院, 上海 200433
2. Biotechnology Research Institute of Shanghai Academy of Agricultural Sciences, Key Laboratory of Biosafety Assessment (Environment) of Agricultural Genetically Modified Organisms of Ministry of Agriculture and Rural Affairs, Shanghai Key Laboratory of Agricultural Genetics and Breeding, Shanghai 201106, China;
3. Shandong Agricultural Technology Extension Center, Jinan 250003, China;
4. School of Life Sciences of Fudan University, Shanghai 200433, China
Bt毒素(Bt toxin)是苏云金芽孢杆菌(Bacillus thuringiensis,Bt)在芽孢形成过程中产生的具有高度特异性杀虫活性的晶体蛋白(Insecticidal Crystal Protein,ICP)[1],由晶体蛋白基因(Crystal protein,Cry)和溶细胞毒素基因(Cytolytic toxin,Cyt)两种Bt基因编码[2-3]。Bt基因主要应用于转Bt基因植物和Bt菌生物农药。目前抗虫(转Bt基因)/耐除草剂复合性状转基因作物在全球的种植面积最大,中国批准商业化种植的转Bt基因作物是转基因抗虫棉[4]。将Bt基因通过人工遗传修饰改造后转入植物中表达的Bt毒素可通过根系分泌物、花粉和植物残体等方式释放到土壤环境中[5-6]。此外,Bt菌生物农药已成为世界上应用最为广泛的微生物杀虫剂,占生物农药生产量和使用量的90%左右,已广泛应用于农业、林业和环境卫生害虫的防治中[7]。但是目前Bt菌生物农药存在杀虫谱较窄、稳定性较差和残效期较短的弊端,从而限制了其更广泛的应用。通过基因工程技术构建高效、广谱的重组Bt基因和制备Bt重组工程菌成为Bt菌生物农药研究重点[8]。Wang等[9]将鞘翅目高毒力的Cry3Aa7基因通过电击转化到对鳞翅目害虫高毒力野生菌株G03中获得重组工程菌G033A,其是国内获批农药登记的第一例转基因Bt工程菌[10]。转Bt基因植物和Bt重组工程菌表达释放的Bt毒素与土壤原有Bt菌表达的Bt原毒素在结构和功能等方面存在较大差异,因而被视为具有生物毒性的环境外源物质,其潜在环境生态风险受到广泛关注[3,11-12]。Bt毒素在环境中残留和积累超过了昆虫消耗及环境因子对其的钝化,可能对环境中微生物的数量、群落结构和功能产生潜在影响[13]。为了加强对转基因产品的监控和管理,转基因植物和植物用转基因微生物在批准商业化生产前必须进行环境安全性评价[14],而Bt毒素对微生物群落和功能多样性的影响成为生物安全研究领域中的前沿热点[15]。
土壤微生物是土壤中最活跃的部分,不仅对维持土壤生态系统中的物质循环和能量代谢发挥着重要作用[16],而且由于土壤微生物对环境干扰的敏感性,微生物群落和功能多样性可以作为生态系统健康监测的标准生态指标[17-18]。土壤微生物群落是由丰度较高的优势菌属以及低丰度菌属构成,不同菌种通过直接或间接的相互作用形成复杂的共发生网络,但微生物多样性不足以解析微生物各个物种间的相互作用[18]。近年来,关联网络分析被广泛应用来研究微生物的共发生模式,使物种间的直接互作或生态位共享特征得到较好的重现,对于理解微生物生态系统的稳定性至关重要[19-21]。真菌是土壤微生物的重要组成部分,参与植物残体的分解[22],推动土壤养分的循环[23],对环境变化有指示作用[24],因此,解析土壤真菌群落结构与潜在功能对施加外源Bt蛋白的响应规律可更好地理解Bt毒素的环境行为和微生物生态效应。由于可培养的微生物种类只占总量的1%~10%[25-26],基于传统的微生物平板培养的分析方法无法分析微生物群落中的稀有物种。近年来,基于核糖体RNA高通量测序技术被应用到微生物生态学研究中,为全面评估Bt毒素对土壤微生物群落结构的影响提供了可靠的技术手段。由于功能上高度保守,序列上的不同位置具有不同的变异速率,核糖体RNA(rRNA)是目前在微生物分子生态学上最为有用以及应用最广泛的分子标记[27]。18S rRNA基因为编码真核生物核糖体小亚基rRNA的DNA序列,通过18S rRNA基因序列比对,可以分析不同分类水平真核生物的系统发育关系。基于核糖体RNA高通量测序技术覆盖了环境样品中的全部微生物,因此可以更加全面真实地反映微生物群落组成,为研究微生物群落结构与功能、微生物对环境变化的响应与反馈等开辟了一条新的途径。
本研究揭示了Bt毒素在土壤中的持留动态;同时采用真菌18S rRNA基因高通量测序技术,分析不同培养时间的土壤真菌群落和功能多样性对施加Bt毒素的响应规律;构建土壤真菌群落的物种关联网络图,解析真菌群落物种之间互做关系及群落稳定性,探讨真菌群落演替与Bt毒素之间的相关关系,系统阐明施加外源Bt毒素对土壤微生态的影响,为Bt毒素的环境安全评价提供理论基础和参考策略。
1 材料与方法 1.1 外源Bt毒素施加及土壤微宇宙培养土壤样品采集于上海市农业科学院(31°13'18"N,121°19'10" E)蔬菜大棚,大棚土壤中没有种植过转Bt基因作物。于2021年5月16日使用五点随机取样法采集0~20 cm土壤样品,装入无菌密封袋,放入冰桶带回实验室。土样充分混匀后,过2 mm钢筛,称取100 g土壤转移至培养瓶中。本研究施加的外源Bt毒素为Cry1Ab(99.0%纯度,EnviroLogix Inc.,Portland,Maine,USA),Cry1Ab毒素是目前世界上应用最为广泛的杀虫毒素之一[28]。基于转Bt基因作物组织(如叶、根和茎)中的水溶性Bt毒素含量在几十到几百ng·g–1[29-30],因此本研究将土壤中Cry1Ab毒素的初始浓度设置为0、5.0、10.0、50.0、100.0和500.0 ng·g–1干土。将含有不同浓度Bt毒素土壤的培养瓶在28℃室内避光放置进行土壤培养,土壤含水量保持在60%。在土壤培养的1、5、10、50、100 d采集各浓度处理中的3个重复样本,同时采集未施加Bt毒素的土样作为对照,共计采集93个土壤样本。部分土壤样品保存于-20℃,进行微生物总DNA提取和真菌18S rRNA基因高通量测序,其余部分保存于4℃,用于土壤中水溶性Bt毒素含量测定。
1.2 水溶性Bt毒素含量测定称取通1 g土壤于50 mL离心管中,加入3 mL十二烷基苯磺酸钠(SDS)提取缓冲液(pH = 7.4)。室温200 r·min–1下摇床中震荡12 h,8 000 r·min–1室温离心20 min。吸取上清液转移至30 kD超滤管(Millipore Filter Corporation)中,4 000 r·min–1离心20 min后,吸取上清液于1.5 mL离心管中,采用Cry1Ab/Ac酶联免疫定量检测试剂盒(Quanti-Plate™ Kit for Cry1Ab/Cry1Ac,EnviroLogix Inc.,Portland,Maine,USA)测定土壤中水溶性Bt毒素含量,重复测量3次,取3次重复数值的平均值。
1.3 土壤微生物总DNA抽提土壤微生物总DNA提取采用Fast DNA Spin kit for soil试剂盒(MP Biomedicals,Santa Ana,CA)。根据试剂盒操作说明提取0.5 g土壤样品微生物总DNA,并使用Nanodrop ND-1000超微量分光光度计(NanoDrop Technologies,Wilmington,DE)和1%的凝胶电泳检测DNA浓度和质量,将DNA于–20 ℃保藏备用,进行后续测序分析。
1.4 真菌18S rRNA基因测序及生物信息学分析委托上海美吉生物医药科技有限公司基于Illumina Miseq PE300/NovaSeq PE250平台,采用引物SSU0817F(5’-TTAGCATGGAATAATRRAATA GGA-3’)和1196R(5’-TCTGGACCTGGTGAGTTT CC-3’)对93个土壤样本真菌18S rRNA基因V5-V7可变区进行高通量测序,具体测序步骤参见Li等[15]和张永杰等[31]。真菌原始序列已经提交至NCBI SRA(https://www.ncbi.nlm.nih.gov/sra/),登录号为SRP392775。施加不同浓度Bt毒素的土壤经过不同时间培养后,真菌群落组成的差异通过基于Bray-Curtis距离的主坐标分析(PCoA)进行分析。相似性分析(Analysis of similarities,ANOSIM),是一种非参数检验,用来检验组间(两组或多组)差异是否显著大于组内差异,从而判断分组是否有意义。首先利用距离算法(默认Bray-Curtis)计算两两样品间的距离,然后将所有距离从小到大进行排序,按以下公式计算R值,之后将样品进行置换,重新计算R*值,R*大于R的概率即为P值。本研究选择相对丰度前200的真菌属进行LEfSe(Linear discriminant analysis effect size)分析。LEfSe分析是将线性判别分析与非参数的Kruskal-Wallis以及Wilcoxon秩和检验相结合,从而筛选关键的生物标记物Biomarker(关键群落成员)[32]。在差异物种进化分支图(Cladogram)中,由内至外辐射的圆圈代表了由门至属(或种)的分类级别。差异物种的LDA值分布图颜色代表对应分组,柱状图的长度代表差异物种的贡献度大小(即为LDA Score),本研究的图中展示了LDA Score大于设定值(默认设置为3)的条件下不同组间丰度有显著差异的物种,即每组内丰度显著高于其他各组的Biomarker。PICRUSt2(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)是一款基于标记基因序列来预测功能丰度的软件[33]。本研究基于真菌18S rRNA基因测序信息,采用PICRUSt2预测真菌编码酶来提供真菌群落功能组成的信息。关联网络图是用来探究微生物之间的相互关系,本研究选择相对丰度前200的真菌属水平物种构建真菌群落关联网络。基于随机矩阵理论(Random matrix theory,RMT)方法,通过计算Spearman相关系数和Jaccard距离,确定微生物共现网络的阈值。通过Permutation和Bootstrap,迭代1 000次获得Spearman相关系数和Jaccard距离的P值。然后使用Brown's方法合并上述P值。采用错误发现率(False discovery rate,FDR)对P值进行校正,将具有显著性(P < 0.05,r > 0.6)的关系构建关联网路图。使用R语言igraph包和Gephi对网络进行可视化[34]。节点间的连线的粗细代表物种之间的相关性大小,线条越粗,相关性越大;红色线条表示正相关,灰色线条表示负相关。
1.5 数据统计分析采用SPSS 26.0软件(SPSS Inc,Chicago,IL,USA)对Bt毒素含量、真菌物种及真菌群落多样性指数(香农指数(Shannon index,H')、辛普森指数(Simpson index,D)、丰富度指数(Richness index,R)和均匀度指数(Evenness index,E))进行单因素方差分析(One-way ANOVA),具体计算公式参见文献[22,35]。使用Fisher氏最小显著差检验(Fisher's least significant difference,简称LSD检验)进行多重比较,显著性差异水平设置为P < 0.05。
2 结果 2.1 Bt毒素在土壤中持留不同土壤培养时间的水溶性Bt毒素含量如图 1所示。未施加Bt毒素的对照土壤中,其原有的Bt菌产生的水溶性Bt毒素含量范围为0.282~0.312 ng·g–1干土,在不同培养时间没有表现出显著差异(图 1a)。Bt毒素的初始浓度为5和10 ng·g–1的土壤,经过1d培养后,其水溶性Bt毒素含量显著降低(图 1b,图 1c),在第5天下降到对照土壤中水溶性Bt毒素含量水平。Bt毒素初始浓度为50、100和500 ng·g–1的土壤,随着培养时间延长,其水溶性Bt毒素含量显著降低,在第100天下降到对照土壤水平(图 1d-图 1f)。
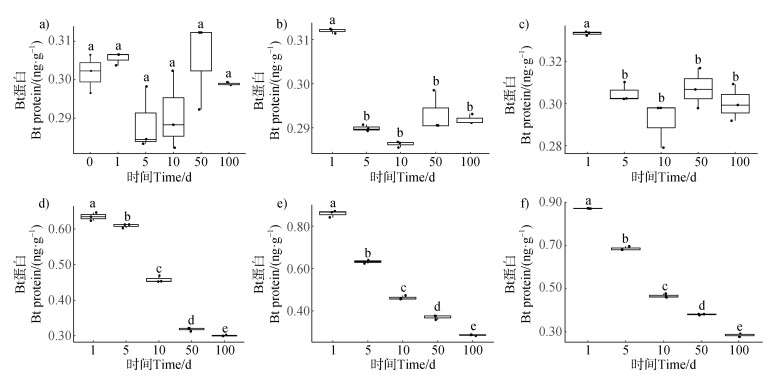
|
注:Bt毒素初始浓度为0 ng·g–1(a)、5 ng·g–1(b)、10 ng·g–1(c)、50 ng·g–1(d)、100 ng·g–1(e)、500 ng·g–1(f)土壤。 Note: Soil with Bt toxins initial concentration of 0 ng·g–1(a), 5 ng·g–1(b), 10 ng·g–1(c), 50 ng·g–1(d), 100 ng·g–1(e), 500 ng·g–1(f). 图 1 不同培养时间的土壤中水溶性Bt毒素含量 Fig. 1 The concentration of water-dissolved Bt toxins in the soil at different incubation times |
通过对93个土壤样本真菌的18S rRNA基因进行测序,总计获得4 359 089条有效序列,经过优化过滤低质量序列得到4 273 657条优质序列。供试土壤样品序列经拆分、去冗余后在97%的相似度下进行OTU聚类,总计获得541个OTUs。微生物多样性测序分析中可以用稀释曲线来验证测序数据量是否足以反映样品中的物种多样性。基于93个土壤样本在OTUs水平的观测物种数目(Observed OTUs,Sobs)和香农指数的稀释曲线均趋于平缓,表明测序深度已经基本覆盖到土壤样本真菌的所有物种(图 2)。
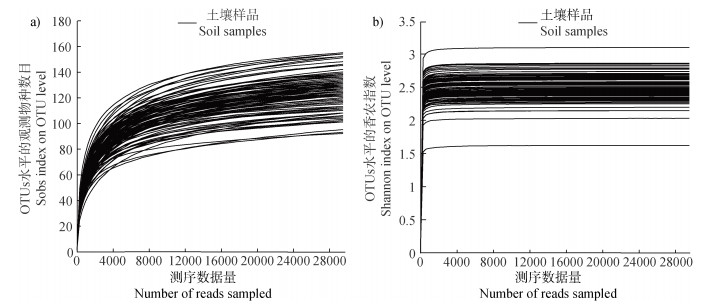
|
注:(a)基于OTUs水平的Sobs稀释曲线;(b)基于OTUs水平的Shannon稀释曲线。 Note: (a)Sobs rarefaction curves based on OTUs levels; (b)Shannon rarefaction curves based on OTUs levels. 图 2 土壤样本真菌测序数据的稀释曲线 Fig. 2 Rarefaction curves of fungal sequencing data from soil samples |
施加外源Bt毒素的土壤和未施加Bt毒素的对照土壤经过不同时间培养后,其真菌群落构成均发生显著改变(图 3a)。PCoA结果显示,在土壤培养1d时,与未施加Bt毒素的对照土壤相比,仅Bt毒素初始浓度为500 ng·g–1土壤真菌群落组成发生了明显改变(图 3b),表明真菌群落结构改变的程度与施加Bt毒素浓度有密切关系;随着土壤培养时间延长,施加低浓度Bt毒素的土壤真菌群落组成也逐渐发生了明显变化(图 3c-图 3f),在培养100 d后,Bt毒素初始浓度为5 ng·g–1土壤真菌群落结构也发生显著改变(图 3f)。此外,未施加Bt毒素的对照土壤和施加Bt毒素土壤在不同培养时期,其真菌群落组成均出现了明显变化,且群落改变的程度会随时间延长而逐渐加剧(图 3g-图 3l),说明土壤培养时间增强了土壤真菌群落的多样性演替。相似性分析(ANOSIM)结果表明,不同Bt毒素施加浓度或不同土壤培养时间的土壤真菌群落组成存在极显著差异(P = 0.001)。

|
注:所有样本的PCoA分析(a);不同初始Bt毒素浓度的土壤培养1 d(b)、5 d(c)、10 d(d)、50 d(e)、100 d(f)的真菌PCoA分析;初始Bt毒素为0 ng·g–1(g)、5 ng·g–1(h)、10 ng·g–1(i)、50 ng·g–1(j)、100 ng·g–1(k)、500 ng·g–1(l)土壤不同培养时间的真菌PCoA分析。 Note: PCoA analysis of all samples(a). Fungal PCoA analysis of soil incubated at different initial Bt toxin concentrations on 1d(b), 5 d(c), 10 d(d), 50 d(e), 100 d(f). Initial Bt toxin of 0 ng·g–1(g), 5 ng·g–1(h), 10 ng·g–1(i), 50 ng·g–1(j), 100 ng·g–1(k), 500 ng·g–1(l) fungal PCoA analysis of soils with different incubation times. 图 3 土壤真菌群落组成的主坐标分析 Fig. 3 PCoA analysis of soil fungal community composition |
鉴于Bt毒素施加浓度和土壤培养时间均可以影响土壤真菌群落组成,本研究选取Bt毒素初始浓度最高(500 ng·g–1)和土壤培养时间(100 d)最长的土壤处理样本BT500_100(3个重复)与其培养时间的对照土壤样本BT500_1(3个重复)、其未施加Bt毒素的对照土壤样本BT0_100(3个重复)以及其空白对照的土样样本BT0_1(3个重复)为研究对象,继续进行真菌群落多样性分析(图 4)。土壤真菌群落多样性指数分析结果表明,未施加Bt毒素的对照土壤培养100 d后,香农指数显著降低;Bt毒素初始浓度500 ng·g–1的土壤经过培养100天后,其香农指数显著提高(图 4a);辛普森指数和均匀度指数均表现为类似结果(图 4b,图 4d)。值得注意的是,丰富度指数在各个样本之间没有显著性差异(图 4c)。
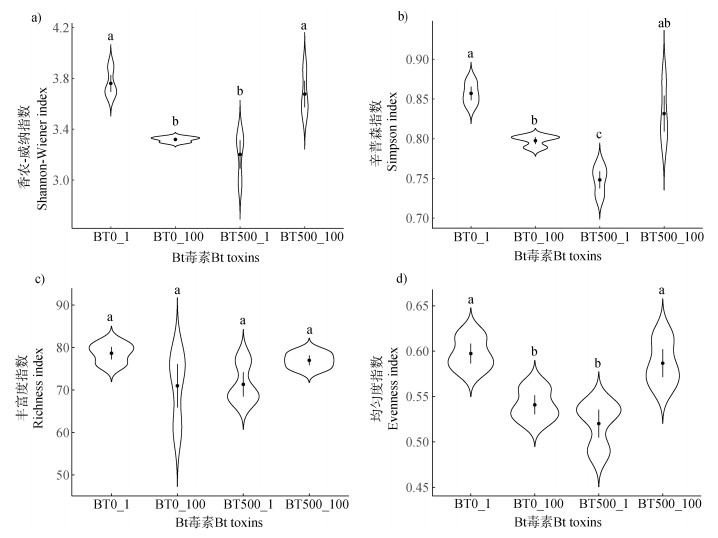
|
图 4 土壤真菌群落多样性指数的差异性分析 Fig. 4 Analysis of diversity index of soil fungal communities |
LEfSe分析的物种进化分支图展示了真菌多级物种层级组成(图 5a)。LDA图表明土壤样本BT500_100与BT0_100有15个显著差异的真菌属(图 5b,LDA score > 3,P < 0.05)。Cladosporium、Paratritirachium和Conidiobolus等5个真菌属在土壤样本BT0_100显著富集,Phymatotrichopsis、Homalogastra、Geosmithia和Apiotrichum等10个真菌属在BT500_100显著富集(图 5b),说明在施加Bt毒素的土壤样本BT500_100中富集的真菌属明显高于对照土壤样本BT0_100。图 5c展示从门到属分类水平上的真菌丰度前20的差异物种。T检验分析表明,Cladosporium、Robbauera和Geosmithia等物种相对丰度在BT500_100与BT0_100之间有显著差异(图 5c)。
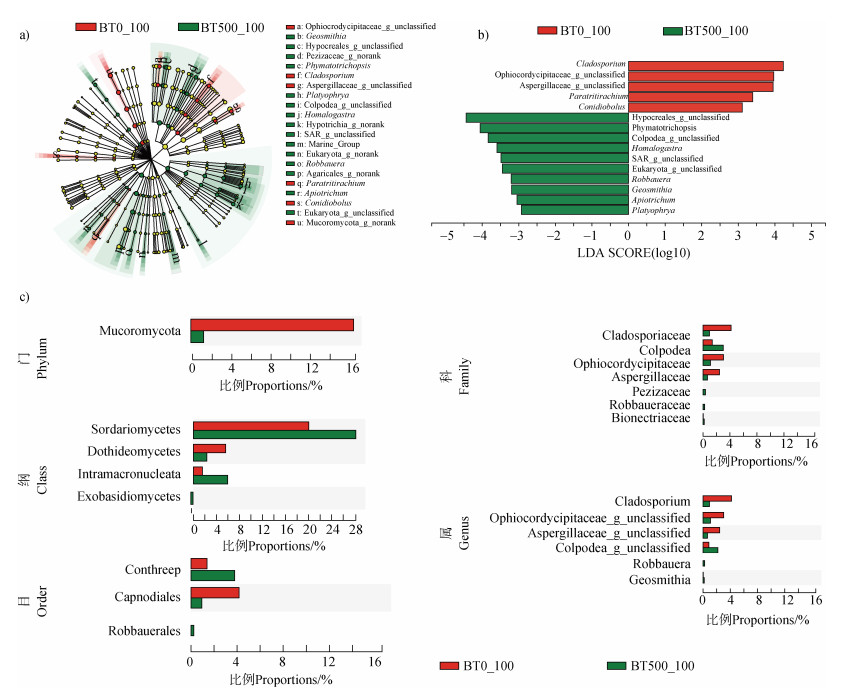
|
注:(a)真菌群落的物种进化分支图,由内至外辐射的圆圈代表了由门至属(或种)的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比。无显著差异的物种统一着色为黄色,差异物种跟随组进行着色,红色节点表示在红色组别中起到重要作用的微生物类群,绿色节点表示在绿色组别中起到重要作用的微生物类群。(b)LDA值分布柱状图,图中展示了LDA Score大于设定值3的显著差异的真菌属。(c)各个分类水平上显著差异的真菌物种。 Note: (a), Cladogram of fungal community taxa, circles radiating from the inside to the outside represents taxonomic levels from phylum to genus(or species). Each small circle at different taxonomic levels represents a taxon at that level, and the size of the small circle diameter is proportional to the relative abundance size. Significantly different species are unified and colored in yellow, and differential species are colored following the group, with red nodes indicating microbial taxa that play an important role in the red groups and green nodes indicating microbial taxa that play an important role in the green groups.(b), LDA score distribution histogram, the figure shows the fungal genera with a significant difference in LDA Score over the set value of 3.(c), Fungal taxa differ significantly at different taxonomic levels. 图 5 土壤样本BT500_100与BT0_100真菌群落的LEfSe分析 Fig. 5 LEfSe analysis of fungal communities in soil samples between BT500_100 and BT0_100 |
土壤样本BT500_100与BT0_100的PICRUSt2功能预测分析结果表明,总共有870个真菌功能基因编码酶参与了Bt毒素施加后的土壤物质和能量的转化过程。采用T检验分析相对丰度前50个真菌酶的差异性,结果表明39个真菌酶发生显著变化。相对于BT0_100,BT500_100有38个真菌酶相对丰度显著增加,仅1个真菌酶NAD(+)ADP核糖转移酶(EC:2.4.2.30)相对丰度显著降低(图 6)。其中参与蛋白质降解(三肽基肽酶IEC:3.4.14.9)、碳素代谢(几丁质酶EC:3.2.1.14、乙醛脱氢酶EC:1.2.1.3、L-阿拉伯糖异构酶EC:5.3.1.4、α-葡萄糖苷酶EC:3.2.1.20、β-葡萄糖苷酶EC:3.2.1.21等)和磷素代谢(酸性磷酸酶EC:3.1.3.2)的功能基因编码酶相对丰度显著升高。
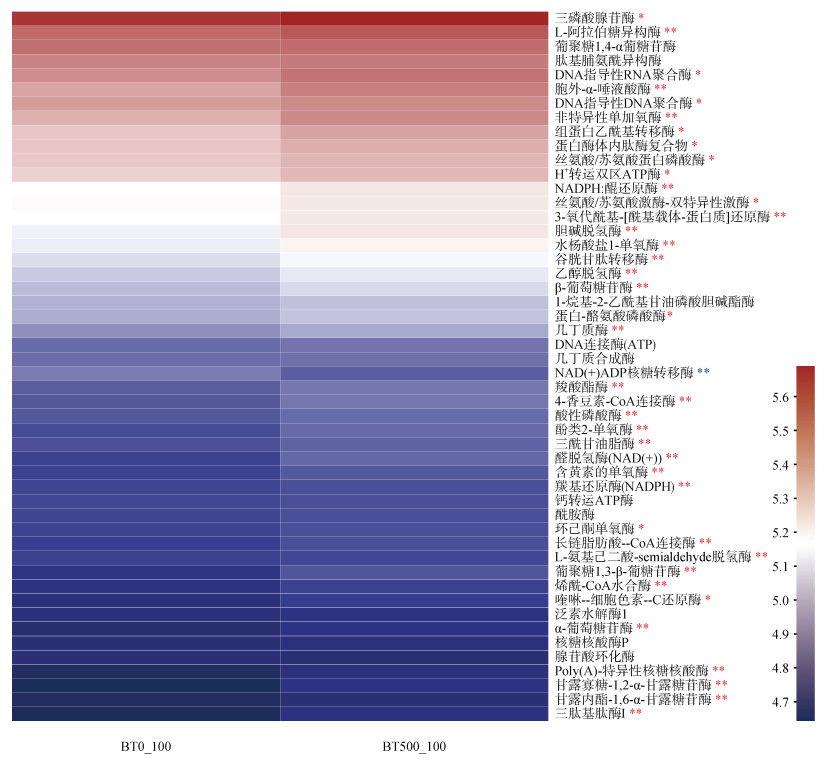
|
注:蓝色星号表示相对于BT0_100,BT500_100的真菌功能基因编码酶的相对丰度显著降低;红色星号表示相对于BT0_100,BT500_100的真菌功能基因编码酶的相对丰度显著升高;一个星号对应5%的显著性水平,即P < 0.05;两个星号对应1%的显著性水平,即P < 0.01。 Note: The blue asterisks indicate a significant decrease in the relative abundance of fungal functional genes encoding enzymes for BT500_100 relative to BT0_100. The red asterisks indicate a significant increase in the relative abundance of fungal functional genes encoding enzymes for BT500_100 relative to BT0_100. One asterisk corresponds to a 5% significance level, P < 0.05. Two asterisks correspond to a 1% significance level, P < 0.01. 图 6 真菌功能基因编码酶的相对丰度热图 Fig. 6 Heatmap of the relative abundance of fungal functional genes encoding enzymes |
采用关联网络分析用于寻找土壤真菌群落在施加Bt毒素及土壤培养过程中呈现的共现或互斥的固有模式,探究微生物群落中是否存在特定的模块单元(Module)以完成特定的生态功能,并据此寻找整个群落的组成变化的关键物种。对照土壤样本BT0_100的真菌群落的正负相关比例分别是89.37%和10.63%,土壤处理样本BT500_100的真菌群落的正负相关比例分别是75.98%和24.02%(图 7a,图 7b);BT0_100网络节点形成13个主要模块,BT500_100网络节点形成15个主要模块(图 7c,图 7d)。关联网络图中节点度(Node degree)越高,表明其与其他节点关联的边数(Edge)越高,被视为微生态群落中的关键物种。BT500_100真菌群落的9个关键物种(Goniomonas、Cercomonas、Mycamoeba、Aplanochytrium、Colpoda、Leptomyxa、Morus、Nuclearia和Parafuscospora)的节点度均大于7,为该微生态群落中的关键物种。
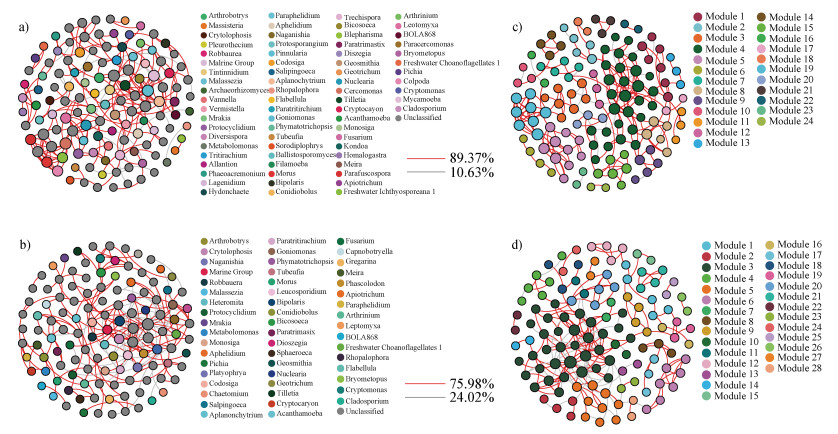
|
注:(a)基于正负相关性的土壤样本BT0_100真菌网络分析;(b)基于正负相关性的土壤样本BT500_100真菌网络分析;(c)基于模块化的土壤样本BT0_100真菌网络分析;(d)基于模块化的土壤样本BT500_100真菌网络分析。 Note: (a), Fungal network analysis of BT0_100 in soil samples based on positive and negative correlation; (b), Fungal network analysis of BT500_100 in soil samples based on positive and negative correlation; (c), Fungal network analysis of BT0_100 in soil samples based on modularity; (d), Fungal network analysis of BT500_100 in soil samples based on modularity. 图 7 土壤真菌群落的关联网络分析 Fig. 7 Correlation network analysis of soil fungal communities |
鉴于施加外源Bt毒素可以显著改变土壤真菌群落结构(图 3),选取不同培养时间的Bt毒素施加浓度最高土壤处理样本(500 ng·g–1)为研究对象,分析其土壤真菌物种与水溶性Bt毒素相关关系(图 8),结果表明真菌物种Bipolaris、Paratritirachium和Leucosporidium具有较高平均度,其相对丰度与水溶性Bt毒素含量为显著正相关关系(P < 0.05);Cyrtolophosis、Phascolodon、Goniomonas、Marine_Group、Phymatotrichopsis具有较高平均度,其相对丰度与水溶性Bt毒素含量为显著负相关关系(P < 0.05)。

|
注:网络图中的圆形节点代表真菌属水平的物种;圆形节点的度越大,节点越大;网络图中的方形节点代表Bt毒素。 Note: The circular nodes in the network diagram represent taxa at the fungal genus level. The larger degree of the circular node, the larger the node. The square nodes in the network diagram represent Bt toxins. 图 8 土壤真菌物种与水溶性Bt毒素的关联网络图 Fig. 8 Correlation network diagram of soil fungal taxa and water-dissolved Bt toxins |
Bt作物和Bt重组工程菌释放的Bt毒素在土壤中持留及降解动态,是评价其环境风险大小的核心问题[36]。Saxena等[37]、Stotzky[38-39]研究发现转Bt基因植物和土壤Bt菌释放Bt毒素进入土壤中,会迅速被土壤颗粒和腐殖酸吸附形成结合态Bt毒素,难以被微生物降解从而保持较长时间的生物活性。土壤对Bt毒素的吸附作用受到Bt毒素类型、土壤性质和环境条件的影响[40]。Valldor等[28]报道目前常用的磷酸盐吐温缓冲液(PBST)只能提取土壤中水溶性Bt毒素,被土壤颗粒吸附的结合态Bt毒素所占比例较高且较难被提取,无法用酶联免疫法(ELISA)进行测定。汪海燕[11]以克螟稻为试材,建立了CrylAb毒素纯化制备方法、土壤中CrylAb蛋白的提取方法以及HPT蛋白酶联免疫分析方法,并在此基础上研究了实验室条件下源于克螟稻秸秆的Cry1bA毒素在土壤中的吸附和降解规律。Li等[41]研究发现初始浓度为50和100 ng·g–1的Cry1Ac在土壤培养1 d后,水溶性Bt毒素浓度迅速降低;在10d后,其浓度接近其所用分析方法的最低检出浓度。本研究采用美国环境保护署指定的标准ELISA定量试剂盒,分析了Cry1Ab毒素在土壤中降解情况,结果也发现Cry1Ab毒素进入土壤中,其水溶性Cry1Ab毒素浓度迅速降低,但是Cry1Ac初始浓度为50、100和500 ng·g–1的土壤经过50d培养后,其水溶性Cry1Ab毒素浓度仍然显著高于对照土壤(图 1),本研究结果与Li等[41]研究结果差异的原因可能是所采用的测定方法、Bt毒素类型或土壤理化性质不同。Bt毒素在土壤中会进行一系列复杂的物理、化学和生物过程,包括土壤吸附、解吸附、生物降解和转化等。付庆灵[40]研究发现,Bt毒素进入土壤中2 h后便基本达到吸附-解吸附动态平衡状态,因此推测本研究中土壤培养1 d后,水溶性Bt毒素含量迅速降低主要是由土壤颗粒吸附引起;而随着培养时间的延长,土壤微生物对水溶性Bt毒素的降解作用是其含量降低的主要原因。
3.2 Bt毒素对土壤真菌群落影响的评估Bt毒素在土壤生态系统中长期积累,一方面可能使靶标害虫对该毒素的选择压增加,从而增加抗性,缩短转Bt基因植物的应用时间;另一方面可能对其他非靶标生物例如土壤微生物的群落组成和多样性等造成不利影响,从而破坏土壤生态系统健康与稳定性。农业农村部发布的《转基因植物安全评价指南(2022年修订)》中明确要求,需要进行转基因植物与外源基因表达蛋白对微生物群落结构和多样性影响的评估,但是目前相关研究主要集中于转基因植物[15,35],Bt毒素研究相对较少,其微生态效应亟待系统阐释。Li等[41]采用末端限制性片段长度多态性(T-RFLP)指纹图谱技术分析了施加不同浓度Cry1Ac毒素对土壤真菌群落多样性的影响,结果表明在土壤培养的100 d中,土壤真菌群落结构没有发生显著改变。在本研究中,施加Bt毒素和培养时间均可以显著影响土壤真菌群落组成,且随着施加Bt毒素浓度增加和土壤培养时间延长,土壤真菌群落差异性逐渐变大(图 3)。本结果研究与Li等[41]研究结果不一致,原因可能与分析微生物群落所采用方法不同有关。本研究采用真菌18S rRNA基因进行测序,总计获得541个OTUs。而Li等[41]采用T-RFLP指纹图谱技术得到的真菌OTUs数目为65~85个。与T-RFLP等低通量测序方法相比,基于二代高通量技术的微生物多样性测序能同时对样品中的优势物种、稀有物种以及一些未知的物种进行检测,可以获得更加全面和准确的物种分类和群落组成。基于本研究结果,同时考虑到转Bt基因植物在不同生长期通过根系分泌物、花粉和植物残体等方式向环境中释放Bt毒素数量不同[5,12],建议对转Bt基因植物和Bt毒素的微生态效应的评估应该要考虑其长期影响及Bt毒素施加量。
在本研究中,相对于未施加Bt毒素的对照土壤,Bt毒素初始浓度500 ng·g–1的土壤经过培养100 d后,其真菌群落的丰富度指数没有显著改变,但其香农指数显著提高(图 4),说明施加外源Bt毒素虽然没有改变真菌物种在分类水平上的数目,但是提高了真菌物种的丰度,从而提高了真菌群落多样性。值得注意的是,随着培养时间延长,施加Bt毒素土壤的水溶性Bt毒素含量显著降低,在100 d下降至对照土壤水平(图 1)。Valldor等[28]向土壤中施加14C标记的Cry1Ab毒素,在土壤微生物生物量碳中检测到了14C,表明微生物参与了Bt毒素碳素转化过程。因此推测本研究向土壤中施加外源Bt毒素后,土壤中水溶性Bt蛋白可以作为土壤真菌的底物和营养,从而提高了真菌丰度和多样性。微生物生态系统稳定性是指微生物群落抵抗外界环境变化、干扰和保持系统平衡的能力[20]。施加外源Bt毒素是否对微生物群落结构稳定性产生影响,目前少见相关报道。微生物关联网络中特定模块数和物种之间的负相关比例是评估群落稳定性的两个常用指标[17]。本研究采用相对丰度前200的真菌属水平物种构建的关联网络中,土壤样本BT500_100真菌群落的负相关比例和模块数均明显高于对照土壤样本BT0_100,表明施加外源Bt毒素提高了土壤真菌群落的稳定性。
3.3 参与Bt毒素降解和转化的潜在真菌物种和功能Bt毒素作为有机碳和有机氮的化合物,其在土壤微生物的作用下,进行着碳素和氮素的代谢过程。探索微生物物种和潜在功能与Bt毒素碳、氮素循环之间的关系,成为评价Bt毒素生态效应的新切入点。本研究通过LEfSe分析发现,相对于BT0_100,Phymatotrichopsis、Homalogastra、Geosmithia和Apiotrichum等10个真菌属在BT500_100显著富集(图 5)。真菌物种Cyrtolophosis、Phascolodon、Goniomonas、Marine_Group、Phymatotrichopsis相对丰度与水溶性Bt毒素含量为显著负相关关系(图 8)。上述结果说明,施加Bt毒素可以显著提高上述这些物种的丰度,并且土壤中水溶性Bt毒素含量随着培养时间延长而降低,因而推测这些物种可以高效同化来自Bt毒素的碳素和氮素。值得注意的是,LEfSe分析和关联网络分析均发现Phymatotrichopsis与水溶性Bt毒素有密切关系。Uppalapati等[42]报道Phymatotrichopsis可以利用单糖、双糖或多糖作为碳源,并且其可以产生淀粉酶和具有碳素分解的代谢途径。Geosmithia作为腐生真菌广泛生活在各种植物基质、土壤或食物中,可以能利用包括有机酸和氨基酸在内广泛碳源来促进菌体生长[43],因而推测这些真菌可能通过多糖水解、糖酵解和有机酸代谢等碳素利用途径参与到Bt毒素的碳素转化过程中。PICRUSt2功能预测结果表明,施加Bt毒素可以显著提高参与蛋白质降解、碳素代谢和磷素代谢的功能基因编码酶相对丰度(图 6),表明真菌群落的物种多样性和潜在多功能性对外源Bt毒素的响应是一致的。此外,Bt毒素是含氮有机化合物-蛋白质,蛋白质会水解为氨基酸,进而通过氨化作用和硝化作用转化生成铵态氮和硝态氮[44]。在上述的土壤氮素循环过程中,氮素代谢功能微生物发挥了关键作用,但是在本研究中没有发现驱动氮素循环的功能基因编码酶显著变化,主要归因于细菌在氮素循环微生物中占主导地位,所占比例95%,真菌仅占3%[45]。
4 结论本研究解析了土壤真菌群落和潜在功能对施加外源Bt毒素的动态响应规律,施加Bt毒素和培养时间均可以显著影响土壤真菌微生态,但是未检测到施加Cry1Ab毒素对土壤真菌群落多样性和稳定性产生负面影响。基于本研究结果,建议对转Bt基因植物、Bt重组菌生物农药和Bt毒素的微生态效应的评估应该要关注Bt毒素施加量及其长期影响。
| [1] |
Hannay C L. Crystalline inclusions in aerobic sporeforming bacteria[J]. Nature, 1953, 172(4387): 1004.
(  0) 0) |
| [2] |
Shan Y M. Discovery and activity analysis of novel insecticidal genes from Bacillus thuringiensis[D]. Harbin: Northeast Agricultural University, 2019.[单月明. 苏云金芽胞杆菌新型杀虫基因的发掘与活性分析[D]. 哈尔滨: 东北农业大学, 2019.]
(  0) 0) |
| [3] |
Wu J Y, Wei L, He J L, et al. Characterization of a novel Bacillus thuringiensis toxin active against Aedes aegypti larvae[J]. Acta Tropica, 2021, 223: 106088. DOI:10.1016/j.actatropica.2021.106088
(  0) 0) |
| [4] |
James C. Brief 55: Global Status of Commercialized Biotech/GM Crops: 2019[R]. ISAAA: Ithaca, NY. 2019.
(  0) 0) |
| [5] |
Losey J E, Rayor L S, Carter M E. Transgenic pollen harms monarch larvae[J]. Nature, 1999, 399(6733): 214.
(  0) 0) |
| [6] |
Liu J, Liang Y S, Hu T, et al. Environmental fate of Bt proteins in soil: Transport, adsorption/desorption and degradation[J]. Ecotoxicology and Environmental Safety, 2021, 226: 112805. DOI:10.1016/j.ecoenv.2021.112805
(  0) 0) |
| [7] |
Wei Q, Zhu X H, He J C, et al. Toxicity comparison and lethal phenotypes of five microbial insecticides against three major rice pests in laboratory research (In Chinese)[J]. Plant Protection, 2022, 48(4): 165-174. [魏琪, 朱旭晖, 何佳春, 等. 5种微生物杀虫剂对3种水稻主要害虫的室内毒力比较及致死表型观察[J]. 植物保护, 2022, 48(4): 165-174.]
(  0) 0) |
| [8] |
Ding X Z, Luo Z H, Xia L Q, et al. Cloning and expression of the cry1Ac-tchiB fusion gene from Bacillus Thuringinesis and Tobacco and its insecticidal synergistic effect (In Chinese)[J]. Acta Microbiologica Sinica, 2007, 47(6): 1002-1008. DOI:10.3321/j.issn:0001-6209.2007.06.012 [丁学知, 罗朝晖, 夏立秋, 等. 苏云金芽胞杆菌cry1Ac与烟草几丁质酶tchiB双价基因克隆表达及其杀虫增效作用研究[J]. 微生物学报, 2007, 47(6): 1002-1008.]
(  0) 0) |
| [9] |
Wang G J, Zhang J, Song F P, et al. Engineered Bacillus thuringiensis GO33A with broad insecticidal activity against lepidopteran and coleopteran pests[J]. Applied Microbiology and Biotechnology, 2006, 72(5): 924-930. DOI:10.1007/s00253-006-0390-x
(  0) 0) |
| [10] |
Liu H M, Xu G J. Microbial pesticide Bacillus thuringiensis G033A (In Chinese)[J]. Pesticide Science and Administration, 2018, 39(4): 59-60. DOI:10.3969/j.issn.1002-5480.2018.04.018 [刘华梅, 许国建. 微生物农药苏云金杆菌G033A[J]. 农药科学与管理, 2018, 39(4): 59-60.]
(  0) 0) |
| [11] |
Wang H Y. Study on environmental behavior and bioeffects of Bt transgenic rice and expressed products of its exogenous gene[D]. Hangzhou: Zhejiang University, 2007.[汪海燕. Bt水稻及其外源基因表达蛋白的环境行为与生物学效应[D]. 杭州: 浙江大学, 2007.]
(  0) 0) |
| [12] |
Li Y J, Wang C, Ge L, et al. Environmental behaviors of Bacillus thuringiensis(Bt) insecticidal proteins and their effects on microbial ecology[J]. Plants: Basel, Switzerland, 2022, 11(9): 1212.
(  0) 0) |
| [13] |
Belousova M E, Malovichko Y V, Shikov A E, et al. Dissecting the environmental consequences of Bacillus thuringiensis application for natural ecosystems[J]. Toxins(Basel), 2021, 13(5): 355.
(  0) 0) |
| [14] |
Agricultural Genetically Modified Organisms Safety Management Office of the Ministry of Agriculture and Rural Affairs. Notice of the Agricultural Genetically Modified Organisms Safety Management Office of the Ministry of Agriculture and Rural Affairs on publicly soliciting opinions on the "Guidelines for the Safety Evaluation of Genetically Modified Plants(Revised in 2022)"[Z]. 2022.[农业农村部农业转基因生物安全管理办公室. 农业农村部农业转基因生物安全管理办公室关于公开征求《转基因植物安全评价指南(2022年修订)》意见的通知[Z]. 2022.]
(  0) 0) |
| [15] |
Li P, Xue Y, Shi J L, et al. The response of dominant and rare taxa for fungal diversity within different root environments to the cultivation of Bt and conventional cotton varieties[J]. Microbiome, 2018, 6(1): 184. DOI:10.1186/s40168-018-0570-9
(  0) 0) |
| [16] |
Li P, Wu G G, Li Y J, et al. Long-term rice-crayfish-turtle co-culture maintains high crop yields by improving soil health and increasing soil microbial community stability[J]. Geoderma, 2022, 413: 115745. DOI:10.1016/j.geoderma.2022.115745
(  0) 0) |
| [17] |
de Vries F T, Griffiths R I, Bailey M, et al. Soil bacterial networks are less stable under drought than fungal networks[J]. Nature Communications, 2018, 9: 3033. DOI:10.1038/s41467-018-05516-7
(  0) 0) |
| [18] |
Qiu L P, Zhang Q, Zhu H S, et al. Erosion reduces soil microbial diversity, network complexity and multifunctionality[J]. The ISME Journal, 2021, 15(8): 2474-2489. DOI:10.1038/s41396-021-00913-1
(  0) 0) |
| [19] |
Fuhrman J A. Microbial community structure and its functional implications[J]. Nature, 2009, 459(7244): 193-199. DOI:10.1038/nature08058
(  0) 0) |
| [20] |
He J Z, Li J, Zheng Y M. Thoughts on the microbial diversity-stability relationship in soil ecosystems (In Chinese)[J]. Biodiversity Science, 2013, 21(4): 412-421. [贺纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性-稳定性关系的思考[J]. 生物多样性, 2013, 21(4): 412-421.]
(  0) 0) |
| [21] |
Banerjee S, Walder F, Büchi L, et al. Agricultural intensification reduces microbial network complexity and the abundance of keystone taxa in roots[J]. The ISME Journal, 2019, 13(7): 1722-1736. DOI:10.1038/s41396-019-0383-2
(  0) 0) |
| [22] |
Li P, Li Y C, Shi J L, et al. Rice straw return of different decomposition days altered soil fungal community structure (In Chinese)[J]. Acta Ecologica Sinica, 2017, 37(13): 4309-4317. [李鹏, 李永春, 史加亮, 等. 水稻秸秆还田时间对土壤真菌群落结构的影响[J]. 生态学报, 2017, 37(13): 4309-4317.]
(  0) 0) |
| [23] |
Sheng Y Y, Cong J, Lu H, et al. Soil fungal diversity of the timberline ecotone in Shennongjia National Park (In Chinese)[J]. Acta Ecologica Sinica, 2018, 38(15): 5322-5330. [盛玉钰, 丛静, 卢慧, 等. 神农架国家公园林线过渡带土壤真菌多样性[J]. 生态学报, 2018, 38(15): 5322-5330.]
(  0) 0) |
| [24] |
Liang J G, Jiao Y, Liu P C, et al. Arbuscular mycorrhizal fungi as a potential indicator to assess effects of genetically modified crops on soil microorganisms (In Chinese)[J]. Acta Agriculturae Zhejiangensis, 2018, 30(7): 1267-1272. DOI:10.3969/j.issn.1004-1524.2018.07.22 [梁晋刚, 焦悦, 刘鹏程, 等. 丛枝菌根真菌作为指示性物种评估转基因作物对土壤微生物影响的研究概述[J]. 浙江农业学报, 2018, 30(7): 1267-1272.]
(  0) 0) |
| [25] |
Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-169. DOI:10.1128/mr.59.1.143-169.1995
(  0) 0) |
| [26] |
Ghazanfar S, Azim A, Ghazanfar M, et al. Metagenomics and its application in soil microbial community studies: Biotechnological[J]. Journal of Animal and Plant Sciences, 2010, 6(2): 611-622.
(  0) 0) |
| [27] |
Li X R. Using ribosomal RNA pyrosequencing to explore the microbial community structure[D]. Shanghai: Fudan University, 2011.[李晓然. 基于核糖体RNA高通量测序分析微生物群落结构[D]. 上海: 复旦大学, 2011.]
(  0) 0) |
| [28] |
Valldor P, Miethling-Graff R, Martens R, et al. Fate of the insecticidal Cry1Ab protein of GM crops in two agricultural soils as revealed by 14C-tracer studies[J]. Applied Microbiology and Biotechnology, 2015, 99(17): 7333-7341. DOI:10.1007/s00253-015-6655-5
(  0) 0) |
| [29] |
Rui Y K, Yi G X, Zhao J, et al. Changes of Bt toxin in the rhizosphere of transgenic Bt cotton and its influence on soil functional bacteria[J]. World Journal of Microbiology and Biotechnology, 2005, 21(6): 1279-1284.
(  0) 0) |
| [30] |
Xiao M Q, Dong S S, Li Z L, et al. Effects of water management practices on residue decomposition and degradation of Cry1Ac protein from crop-wild Bt rice hybrids and parental lines during winter fallow season[J]. Ecotoxicology and Environmental Safety, 2015, 122: 275-289. DOI:10.1016/j.ecoenv.2015.08.008
(  0) 0) |
| [31] |
Zhang Y J, Cui N B, Zhang L Z, et al. Fungal diversity during raw vinegar brewing process as revealed by high-throughput sequencing (In Chinese)[J]. Acta Microbiologica Sinica, 2020, 60(7): 1358-1369. [张永杰, 崔宁波, 张丽珍, 等. 基于DNA高通量测序分析生料酿醋过程中的真菌多样性[J]. 微生物学报, 2020, 60(7): 1358-1369.]
(  0) 0) |
| [32] |
Fang D X, Zhao G, Xu X Y, et al. Microbial community structures and functions of wastewater treatment systems in plateau and cold regions[J]. Bioresource Technology, 2018, 249: 684-693. DOI:10.1016/j.biortech.2017.10.063
(  0) 0) |
| [33] |
Douglas G M, Maffei V J, Zaneveld J R, et al. PICRUSt2 for prediction of metagenome functions[J]. Nature Biotechnology, 2020, 38(6): 685-688. DOI:10.1038/s41587-020-0548-6
(  0) 0) |
| [34] |
Zhang J H, Wang J Y, Meng Z X, et al. Soil microbial richness predicts ecosystem multifunctionality through co-occurrence network complexity in alpine meadow (In Chinese)[J]. Acta Ecologica Sinica, 2022, 42(7): 2542-2558. [张君红, 王健宇, 孟泽昕, 等. 土壤微生物多样性通过共现网络复杂性表征高寒草甸生态系统多功能性[J]. 生态学报, 2022, 42(7): 2542-2558.]
(  0) 0) |
| [35] |
Li P, Ye S F, Liu H, et al. Cultivation of drought-tolerant and insect-resistant rice affects soil bacterial, but not fungal, abundances and community structures[J]. Frontiers in Microbiology, 2018, 9: 1390. DOI:10.3389/fmicb.2018.01390
(  0) 0) |
| [36] |
Bai Y Y, Jiang M X, Cheng J A. Temporal expression patterns of Cry1Ab insecticidal protein in Bt rice plants and its degradation in paddy soils (In Chinese)[J]. Acta Ecologica Sinica, 2005, 25(7): 1583-1590. DOI:10.3321/j.issn:1000-0933.2005.07.008 [白耀宇, 蒋明星, 程家安. Bt水稻Cry1Ab杀虫蛋白表达的时间动态及其在水稻土中的降解[J]. 生态学报, 2005, 25(7): 1583-1590.]
(  0) 0) |
| [37] |
Saxena D, Flores S, Stotzky G. Insecticidal toxin in root exudates from Bt corn[J]. Nature, 1999, 402(6761): 480.
(  0) 0) |
| [38] |
[38] Stotzky G. Persistence and biological activity in soil of insecticidal proteins from Bacillus thuringiensis and of bacterial DNA bound on clays and humic acids[J]. Journal of Environmental Quality, 2000, 29(3): 691-705.
(  0) 0) |
| [39] |
Stotzky G. Persistence and biological activity in soil of the insecticidal proteins from Bacillus thuringiensis, especially from transgenic plants[J]. Plant and Soil, 2005, 266(1): 77-89.
(  0) 0) |
| [40] |
Fu Q L. The adsorption and rematining of Bacillus thuringinesis toxin in minerals and soil colloids[D]. Wuhan: Huazhong Agricultural University, 2009.[付庆灵. Bt毒素在矿物和土壤胶体上的吸附和残留研究[D]. 武汉: 华中农业大学, 2009.]
(  0) 0) |
| [41] |
Li Z L, Bu N S, Chen X P, et al. Soil incubation studies with Cry1Ac protein indicate no adverse effect of Bt crops on soil microbial communities[J]. Ecotoxicology and Environmental Safety, 2018, 152: 33-41. DOI:10.1016/j.ecoenv.2017.12.054
(  0) 0) |
| [42] |
Uppalapati S R, Young C A, Marek S M, et al. Phymatotrichum(cotton) root rot caused by Phymatotrichopsis omnivora: Retrospects and prospects[J]. Molecular Plant Pathology, 2010, 11(3): 325-334. DOI:10.1111/j.1364-3703.2010.00616.x
(  0) 0) |
| [43] |
Pepori A L, Bettini P P, Comparini C, et al. Geosmithia-Ophiostoma: A new fungus-fungus association[J]. Microbial Ecology, 2018, 75: 632-646. DOI:10.1007/s00248-017-1062-3
(  0) 0) |
| [44] |
Dohrmann A B, Küting M, Jünemann S, et al. Importance of rare taxa for bacterial diversity in the rhizosphere of Bt- and conventional maize varieties[J]. The ISME Journal, 2013, 7(1): 37-49. DOI:10.1038/ismej.2012.77
(  0) 0) |
| [45] |
Nelson M B, Martiny A C, Martiny J B H. Global biogeography of microbial nitrogen-cycling traits in soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(29): 8033-8040.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


