2. 皖江流域退化生态系统的恢复与重建省部共建协同创新中心, 安徽芜湖 241002;
3. 安徽省水土污染治理与修复工程实验室, 安徽芜湖 241002
2. Collaborative Innovation Center of Recovery and Reconstruction of Degraded Ecosystem in Wanjiang Basin Co-founded by Anhui Province and Ministry of Education, Wuhu, Anhui 241002, China;
3. Anhui Provincial Engineering Laboratory of Water and Soil Pollution Control and Remediation, Anhui Normal University, Wuhu, Anhui 241002, China
二苯砷酸(diphenylarsinic acid,DPAA)是含砷化学武器二苯氰砷(diphenylcyanoarsine,DA)和二苯氯砷(diphenylchloroarsine,DC)在环境中的主要降解产物[1]。在世界大战期间,DA和DC被大量制造和使用,战后仅通过土地填埋等措施进行处理,因而周边土壤非常容易受到砷的污染。目前,已经在中国、欧洲和日本等多个国家化学武器埋藏区的土壤(< 10 mg·kg–1)和地下水(< 15 mg·L–1)等不同环境介质中检出了DPAA[1-3]。研究表明,DPAA在环境中存留时间长、毒性强[4],能够通过“土壤-水稻-人体”[5]的途径传递,最终危害人体健康。2002年,日本发生了一起DPAA污染井水导致的集体中毒事件[6],此后这种新兴环境污染物引起了政府机构和学术界的高度关注。研究DPAA在土壤中的释放和转化过程对于深入认识DPAA的环境地球化学行为至关重要。
土壤中无机砷的释放和转化与铁还原以及硫酸盐还原过程密切相关[7]。最近针对DPAA的研究发现,淹水土壤中的DPAA主要发生脱苯环生成苯砷酸(phenylarsonic acid,PAA)[8],而在硫酸盐还原条件下,DPAA主要发生硫化并生成二苯基硫代砷酸(diphenylthioarsinic acid,DPTAA)[9]。前期的研究还发现,在铁含量低而有机质含量高的黑土中,铁还原促进了DPAA释放和进一步的硫化[10];而在铁含量高而有机质含量低的红壤中,铁还原产生的Fe(Ⅱ)与硫酸盐还原产生的硫化物反应,通过消耗硫化物从而不利于DPAA的硫化[11]。由此可见,铁还原和硫酸盐还原对DPAA释放与硫化的影响在不同类型土壤中明显不同。此外,添加硫酸盐的生物刺激修复被认为是去除土壤中DPAA污染的一种有效方法[12]。但目前相关的研究主要关注添加碳源和硫酸盐等人为调控措施对DPAA释放与硫化的影响,针对不同土壤类型、不同土地利用方式导致的氧化铁含量、形态及微生物群落结构等土壤物理化学、生物学性质的差异对DPAA释放与硫化的影响尚有待深入研究。
我国热带、亚热带红壤是一种典型的高氧化铁土壤,对DPAA具有较强的吸附能力[13];但在淹水还原条件下,铁还原促进红壤中DPAA释放的效应很可能较为显著。而这类土壤是我国化学武器埋藏区的主要土壤类型之一,并在南方经济发达地区和粮食主产区广泛分布,更有可能引发DPAA污染问题。鉴于此,本研究选取两种不同土地利用方式(花生地、林地)的红壤作为研究对象,考察添加不同浓度乳酸钠及硫酸钠培养时DPAA的释放与硫化情况,并分析铁还原和硫酸盐还原的影响,以期为准确评估DPAA的环境健康风险和发展DPAA污染红壤的生物刺激修复技术提供理论依据。
1 材料与方法 1.1 仪器与试剂TSQ Quantum Access MAX型高效液相色谱-质谱联用仪(HPLC-MS/MS,TSQ Quantum Access MAX,Thermo公司,美国),恒温培养箱(BSG-300型,上海博迅),原子荧光光谱仪(AFS9700型,北京海光),紫外分光光度计(UV752型,上海佑科),真空冷冻干燥机(YWLG-10A型,南京研沃生物科技),离心机(L530型,湖南湘仪)。DPAA(纯度97%)购自日本Wako公司,甲醇和甲酸为色谱纯,其余试剂为分析纯。实验用水为18.2 MΩ超纯水。
1.2 供试土壤供试土壤采自江西鹰潭中国科学院红壤生态实验站的花生地(28°15'N,116°55'E)和林地(28°12'N,116°56'E),为不含DPAA的表层土壤(0~15 cm)。土壤经室内风干、除根和研磨过2 mm筛后备用。土壤基本性质见表 1。
|
|
表 1 供试土壤的理化性质 Table 1 The physicochemical properties of the tested soils |
以100 mL西林瓶作为培养容器,加入20.0 g土壤,平整铺于底部,添加总体积为29.7 mL的含不同浓度硫酸钠和乳酸钠的液体,采用硅胶塞和铝盖密封瓶口;插入针管作为排气口,针管的另一端埋入装有超纯水的玻璃试管中,定期补充水分以保证半密闭环境[10]。试验共设置4个处理:不添加硫酸钠和乳酸钠(S-C-);仅添加硫酸钠(426 μg·g–1干土,以S计,下同)(S+C-);同时添加硫酸钠(426 μg·g–1干土)和乳酸钠(1 300 μg·g–1干土,以C计,下同)(S+C+);同时添加硫酸钠(426 μg·g–1干土)和乳酸钠(2 170 μg·g–1干土)(S+C++),每个处理设6个重复。所有西林瓶置于25℃、避光条件下预培养2周,再加入0.3 mL 2 000 mg·L–1DPAA溶液,使得DPAA的最终添加量为30 mg·kg–1干土(低于《销毁日本遗弃在华化学武器土壤污染控制标准》(GB 19062-2003)[14]中规定的总砷浓度限值—30 mg·kg–1干土),3 000 r·min–1振荡10 min使土水混合液充分混匀,置于恒温培养箱中继续培养。
1.4 取样及测定方法培养至0、1、2、6和13周时分别进行破坏性取样。每个处理取4个重复,将土水混合液加入1 mol·L–1 HCI溶液中(v/v=1:9),振荡24 h后测定HCl提取态Fe2+和HCl提取态总铁[15]。剩余土水混合液离心后,取上清液测定DPAA、Fe2+、
按照下列公式计算DPAA去除率:
| $ \text{DPAA}去除率/\%=(M_{0}–M_{t})/M_{0}×100 $ | (1) |
式中,M0为0时刻土壤固、液相中DPAA含量之和,mg;Mt为t时刻土壤固、液相中DPAA含量之和,mg。
DPAA及其转化产物的测定采用HPLC-MS/MS法[16]。溶解态Fe2+和HCl提取态铁采用邻菲罗啉分光光度法测定,
培养至0、6和13周时采集土壤样品,采用十六烷基三甲基溴化铵(hexadecyltrimethyl ammonium bromide,CTAB)法提取DNA,再用1%琼脂糖凝胶电泳检测DNA的纯度和浓度。采用引物341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTA CNNGGGTATCTAAT-3’)对细菌16S rRNA基因的V3+V4可变区进行PCR扩增。扩增程序:98℃预变性1 min;(98℃,10 s;50℃,30 s;72℃,30 s)×30个循环;72℃修复延伸5 min。根据PCR产物的浓度进行等浓度混样,充分混匀后使用1×TAE浓度2%的琼脂糖凝胶电泳纯化PCR产物,选择割胶回收目标条带。使用建库试剂盒(TruSeq®DNA PCR-Free Sample Preparation Kit)进行文库构建,构建好的文库经过Qubit定量和文库检测,合格后使用NovaSeq 6000 PE250进行上机测序。测序服务委托深圳微科盟科技集团有限公司完成。
1.6 数据分析采用Excel 2010分析原始数据,所有结果用平均值±标准偏差表示。采用Origin 2021作图。
2 结果 2.1 DPAA的固液分配两种土地利用方式红壤的固、液相中DPAA百分含量的变化如图 1所示。0周时,花生地的S-C-和S+C-处理中液相DPAA百分含量分别为57.2%和66.1%(图 1a,图 1b),而S+C+和S+C++处理中液相DPAA百分含量(70%~80%)有所增加(图 1c,图 1d)。随着培养时间的延长,S-C-和S+C-处理中液相DPAA百分含量始终低于固相,而S+C+和S+C++处理中液相DPAA百分含量始终高于固相(仅1个例外)。由此可见,对花生地而言,与S-C-和S+C-处理相比,S+C+和S+C++处理中DPAA释放明显增强。
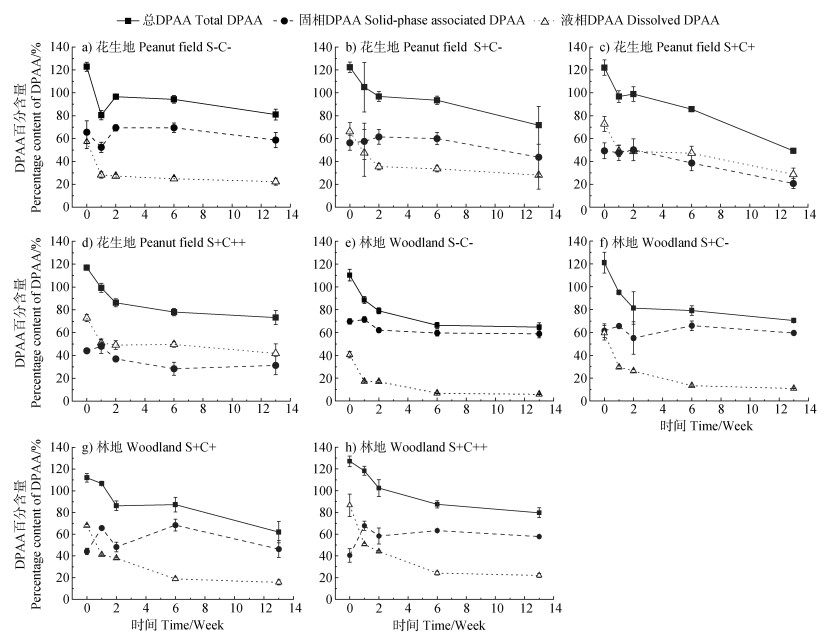
|
注:S-C-,不添加硫酸钠和乳酸钠;S+C-,仅添加硫酸钠;S+C+,同时添加硫酸钠(426 μg·g–1)和乳酸钠(1 300 μg·g–1,以C计);S+C++,同时添加硫酸钠(426 μg·g–1)和乳酸钠(2 170 μg·g–1)。总DPAA百分含量为取样时刻DPAA含量与初始DPAA投加量(0.6 mg)的比值,液相DPAA百分含量为取样时刻溶解态DPAA含量与初始DPAA投加量的比值,固相DPAA百分含量为取样时刻固相结合态DPAA含量与初始DPAA投加量的比值,下同。 Note: S-C-, without the addition of sodium sulfate or sodium lactate; S+C-, only with the addition of sodium sulfate; S+C+, with the addition of sodium sulfate(426 μg·g–1) and sodium lactate(1 300 μg·g–1 dry soil, in terms of C); S+C++, with the addition of sodium sulfate(426 μg·g–1) and sodium lactate(2 170 μg·g–1 dry soil). The percentage content of total DPAA was calculated as the ratio of the mass of total DPAA obtained at each sampling point to the mass of total DPAA added(0.6 mg). The percentage contents of dissolved and solid-phase-associated DPAA were calculated as the ratio of the mass of dissolved and solid-phase-associated DPAA obtained at each sampling point to the mass of total DPAA added, respectively, the same below. 图 1 花生地(a~d)和林地(e~h)中二苯砷酸(DPAA)百分含量随时间的变化 Fig. 1 Changes in the percentage content of diphenylarsinic acid(DPAA) in peanut field(a-d) and woodland(e-h) with time |
与花生地相比,林地的4个处理在0周时液相DPAA百分含量差异明显,分别为40.6%、59.6%、67.8%和86.7%(图 1e~图 1h)。其中,与S-C-和S+C-处理相比,S+C+和S+C++处理中DPAA的释放明显增加,且S+C++处理中DPAA的释放最为明显。上述结果说明,与花生地相比,乳酸钠对林地中DPAA释放的促进作用更强。此外,与S-C-处理相比,S+C-处理中DPAA的释放明显增加,这很可能与
两种土地利用方式红壤的总DPAA百分含量随时间的变化见图 1。总体而言,花生地和林地的4个处理中总DPAA百分含量均表现为随时间的延长不断降低。与其他处理相比,花生地的S+C+处理中DPAA的转化速率和最终转化率均明显增加,13周后DPAA的转化率可达59.6%(图 1c);而林地的4个处理中DPAA的最终转化率均小于45%(图 1e~图 1h)。根据保留时间和碎片离子的信息[10]可知,在花生地S+C+处理的固、液相中均检测到DPAA(保留时间tR=6.6 min,定性离子对为263/245、263/141)的硫化产物——DPTAA(tR=7.3 min,定性离子对为279/261、279/183)(图 2a,图 2b);而在其他处理中均未检测到DPTAA和PAA(数据未显示),推测可能存在其他的DPAA转化路径,如通过逐步脱苯环最终降解为无机砷,或者发生甲基化等[8]。
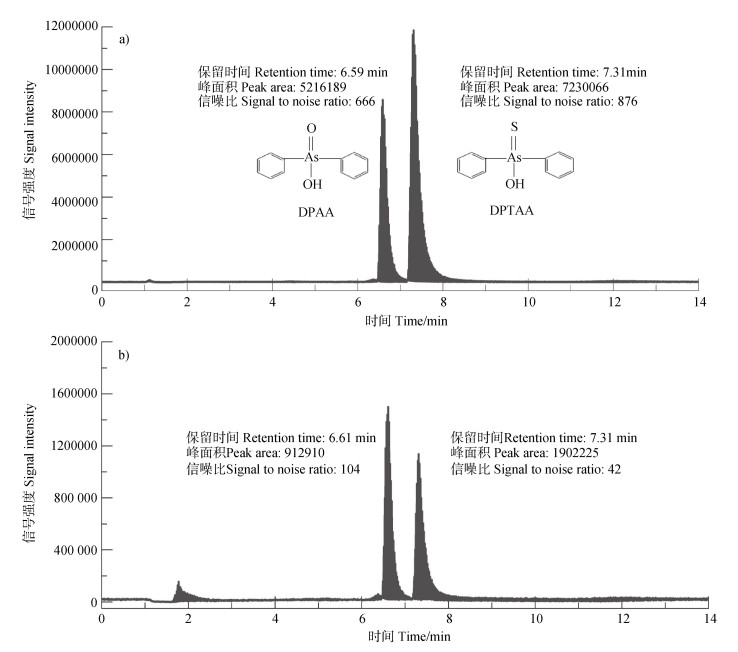
|
图 2 花生地的S+C+处理在培养13周后上清液(a)和土壤浸提液(b)的HPLC⁃MS/MS总离子流图 Fig. 2 Total ion chromatograms in HPLC⁃MS/MS analysis of supernatant(a) and soil extract(b) in S+C+ treatment of peanut field after 13 weeks of incubation |
对于花生地的4个处理,在0~2周总DPAA的减少主要是由于液相DPAA的降低;2周后总DPAA和固、液相的DPAA均表现为随时间的延长有不同程度的降低,其中S+C+处理中固、液相DPAA降低的趋势最为明显(图 1a~图 1d)。对于林地的S+C+处理,在0~6周总DPAA的减少主要是由于液相DPAA的降低,而在6~13周总DPAA的减少是由于固相DPAA的降低;对于其他处理,在0~6周总DPAA和液相DPAA随时间的变化趋势基本一致,而6周后总DPAA和固、液相的DPAA百分含量变化不明显(图 1e~图 1h)。上述结果表明,花生地和林地液相中的DPAA先发生转化/降解,当其含量逐渐减少时,固相DPAA也可继续发生转化/降解。
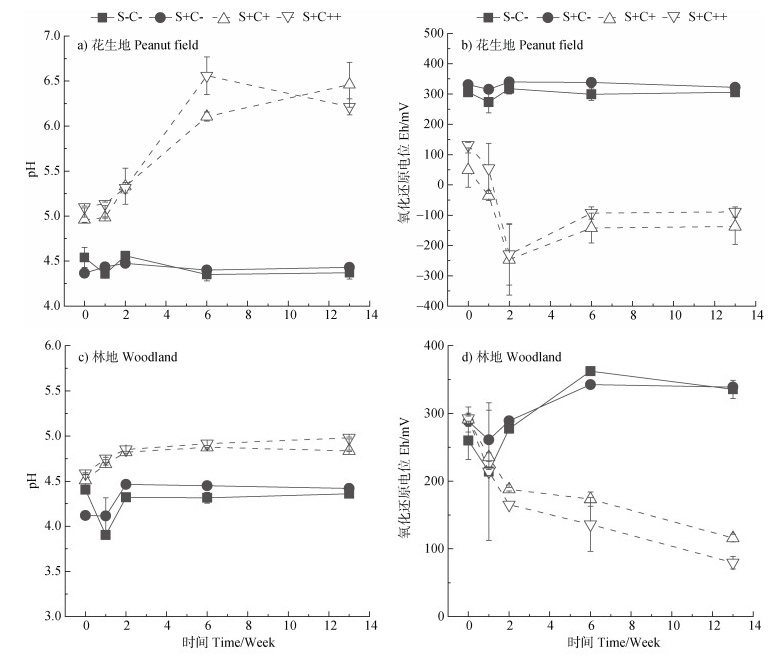
2.3 铁还原特征两种土地利用方式红壤的土水混合液中HCl提取态Fe2+与HCl提取态总铁的比值以及溶液相中Fe2+含量随时间的变化如图 3所示。由图可知,对于花生地的4个处理,2周后HCl提取态Fe2+与HCl提取态总铁的比值随时间的延长不断增加,说明铁还原在持续进行[15];13周后铁还原程度表现为:S+C++ > S+C+ > S-C- > S+C-,铁还原程度最高可达58.3%(图 3a)。其中,S+C+和S+C++处理中铁还原程度的增加很可能与添加的乳酸钠作为电子供体有关[20];S-C-处理的铁还原程度高于S+C-处理,推测可能是因为后者添加的硫酸盐发生还原(图 4a),通过竞争乳酸钠从而不利于铁还原的进行。此外,由于S+C+和S+C++处理中铁还原程度较高,溶液相中有大量Fe2+的检出(< 80 mg·L–1,图 3b)。与花生地不同,林地的4个处理中铁还原程度均较低(< 25%)(图 3c),且在整个培养过程中溶解态Fe2+浓度均低于10 mg·L–1(图 3d)。
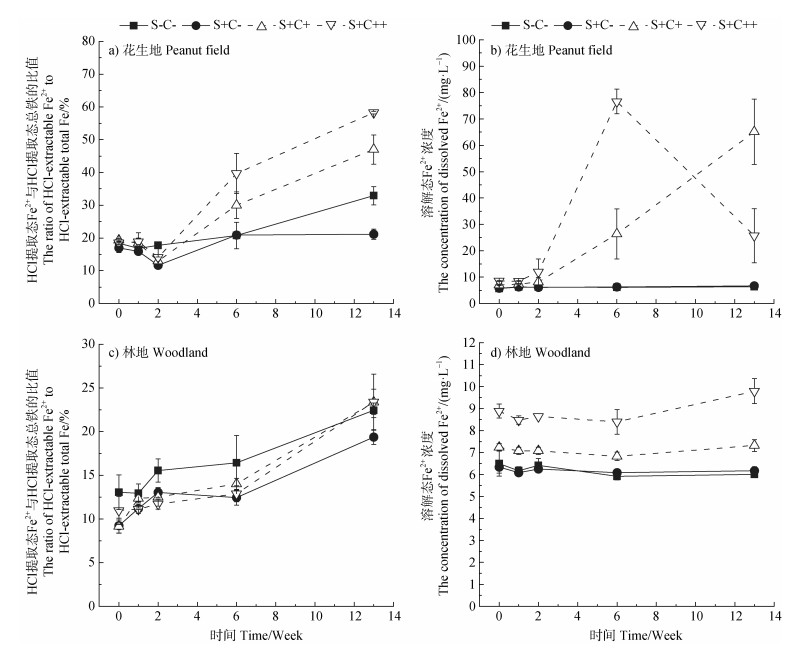
|
图 3 花生地(a,b)和林地(c,d)土水混合液中HCl提取态Fe2+与HCl提取态总铁的比值以及溶解态Fe2+浓度随时间的变化 Fig. 3 Changes in the ratios of HCl-extractable Fe2+ to HCl-extractable total Fe in the soil-water mixture and the concentrations of dissolved Fe2+ in peanut field(a, b) and woodland(c, d) with time |
|
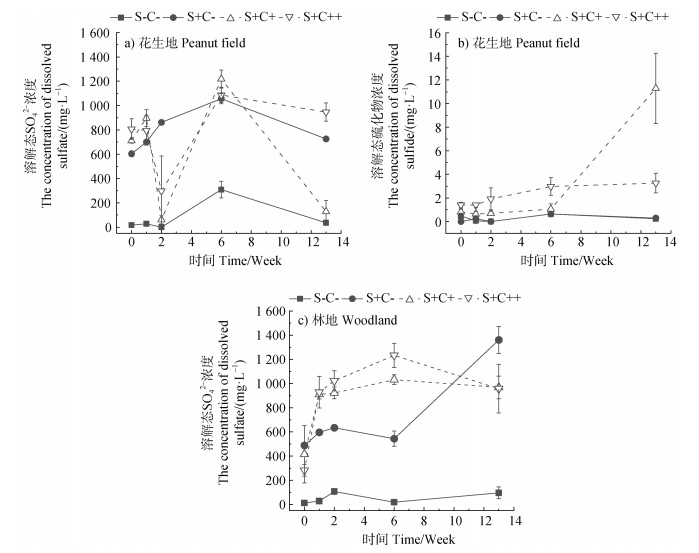
注:林地的4个处理中均未检测到溶解态硫化物。 Note: Dissolved sulfide was not detected in four treatments of woodland.
图 4 花生地(a,b)和林地(c)的溶解态 |
两种土地利用方式红壤中溶解态
|
图 5 花生地(a,b)和林地(c,d)的pH和Eh随时间的变化 Fig. 5 Changes in the pH and Eh in peanut field(a, b) and woodland(c, d) with time |
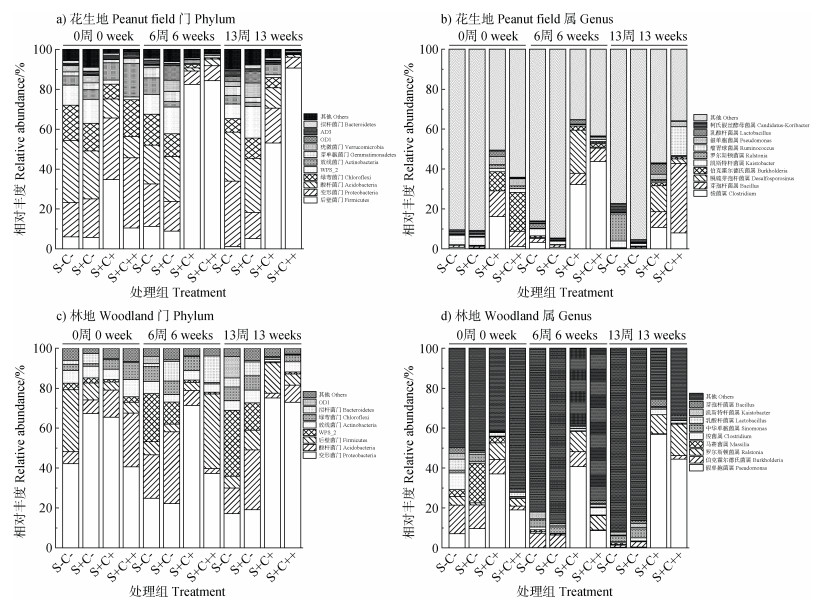
两种土地利用方式红壤中的优势细菌在门和属水平上的相对丰度变化见图 6。由图可知,花生地的4个处理在门水平上的优势菌群包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、酸杆菌门Acidobacteria)、绿弯菌门(Chloroflexi)、WPS_2、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)、OD1、AD3和拟杆菌门(Bacteroidetes)(图 6a)。其中,S+C+和S+C++处理中厚壁菌门的相对丰度分别由0周的34.7%和10.5%增至13周的53.1%和90.6%,说明随着时间的延长厚壁菌门逐渐占据优势地位。此外,花生地的4个处理在属水平上的优势菌群包括梭菌属(Clostridium)、芽孢杆菌属(Bacillus)、脱硫芽孢杆菌属(Desulfosporosinus)、伯克霍尔德氏菌属(Burkholderia)、凯斯特杆菌属(Kaistobacter)、罗尔斯顿菌属(Ralstonia)、瘤胃球菌属(Ruminococcus)、假单胞菌属(Pseudomonas)、乳酸杆菌属(Lactobacillus)和柯氏假丝酵母菌属(Candidatus-Koribacter)(图 6b)。其中,厚壁菌门中的梭菌属和芽孢杆菌属与铁还原过程密切相关[22]。在花生地土壤整个培养过程中,梭菌属和芽孢杆菌属的丰度在S+C+和S+C++处理中分别为1.2%~43.8%和5.7%~34.8%,而在S-C-和S+C-处理中分别为0.1%~3.2%和0.2%~2.0%(图 6b),这与S+C+和S+C++处理中铁还原程度增加的结果(图 3a)一致。此外,脱硫芽孢杆菌属与硫酸盐还原过程密切相关[23]。对于花生地而言,在S+C+和S+C++处理中,0周时均未检测到脱硫芽孢杆菌属,在6周时其丰度分别为21.6%和0.5%,在13周时的丰度分别为13.1%和2.2%;而对于S-C-和S+C-处理,在整个培养过程中均未检测到脱硫芽孢杆菌属(图 6b),这与花生地的S+C+处理中硫酸盐还原最为明显的结果(图 4a)较为吻合。
|
注:0周、6周和13周为土培试验进行的时间。相对丰度大于1%的定为优势菌门或优势菌属,相对丰度低于1%的定为其他。 Note: 0, 6 and 13 weeks is the time for the soil incubation experiment. Those with relative abundances greater than 1% are designated as dominant phylum or dominant genus, and those with relative abundances below 1% are designated as others. 图 6 花生地(a,b)和林地(c,d)的优势细菌在门和属水平上的相对丰度随时间的变化 Fig. 6 Changes in the relative abundances of dominant bacteria in peanut field(a, b) and woodland(c, d) at the phylum and genus levels over time |
林地的4个处理在门水平上的优势菌群包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、WPS_2、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteriodetes)和OD1(图 6c)。其中,变形菌门(17.1%~75.1%)的丰度始终高于厚壁菌门(3.8%~37.3%)。此外,林地的4个处理在属水平上的优势菌群共有9个,分别为假单胞菌属(Pseudomonas)、伯克霍尔德氏菌属(Burkholderia)、罗尔斯顿菌属(Ralstonia)、马赛菌属(Massilia)、梭菌属(Clostridium)、中华单胞菌属(Sinomonas)、乳酸杆菌属(Lactobacillus)、凯斯特杆菌属(Kaistobacter)和芽孢杆菌属(Bacillus)(图 6d)。其中,芽孢杆菌属(< 3.7%)和梭菌属(< 8.4%)的相对丰度较低,且未检测到脱硫芽孢杆菌属,这与林地的4个处理中铁还原程度较低(图 3c)以及硫酸盐未发生还原(图 4c)的结果一致。
3 讨论 3.1 铁还原对红壤中DPAA释放的影响培养0周时,乳酸钠仅在一定程度上促进了花生地中DPAA的释放,而对林地中DPAA释放的促进作用明显增强(图 1a~图 1h)。根据以往的研究可知,土壤中的氧化铁,尤其是非晶质氧化铁提供了DPAA吸附的主要位点[13],而乳酸钠很可能通过覆盖氧化铁表面的吸附位点或竞争吸附等作用降低土壤对DPAA的吸附[10]。据此推测,由于花生地的非晶质氧化铁含量高于林地(表 1),因而对DPAA的吸附能力更强,这很可能降低了乳酸钠对DPAA释放的促进作用。随着培养时间的延长,与S-C-和S+C-处理相比,S+C+和S+C++处理中DPAA的释放明显增强(图 1a~图 1d),这很可能与后者铁还原程度增加而导致花生地中更多氧化铁的吸附位点被破坏有关[10]。与花生地不同,林地的4个处理未见明显的DPAA释放现象(图 1e~图 1h)。这进一步说明,当铁还原程度降低时,铁还原促进DPAA释放的效应较为有限。此外,结合2种花生地红壤中铁还原影响DPAA释放的结果(表 2)可知,随着铁还原速率和程度的增加,铁还原促进红壤中DPAA释放的效应明显增强。综上可知,虽然富铁红壤对DPAA的吸附能力较强,但经淹水和添加乳酸钠处理后,由于其中的氧化铁(尤其是非晶质氧化铁)非常容易在微生物作用下发生还原[24],由此导致的DPAA污染问题值得关注。
|
|
表 2 不同类型土壤中铁还原对DPAA释放与硫化的影响 Table 2 Effects of Fe reduction on the mobilization and thionation of DPAA in different types of soil |
本研究(图 4a~图 4b)中,花生地的S+C+处理中硫酸盐还原最为显著,且DPAA主要发生硫化;与S+C+处理相比,S+C++处理中铁还原程度增加而硫酸盐还原程度降低,溶解态硫化物浓度始终低于4 mg·L–1,同时未检测到DPTAA;此外,花生地的S-C-和S+C-处理(图 4b)以及林地的4个处理(数据未显示)中硫化物浓度均较低,且未检测到DPTAA(数据未显示)。前人的研究也发现,添加硫酸盐促进了土壤中DPAA的快速硫化,而添加硫酸盐还原的抑制剂——钼酸钠后,未检测到DPTAA[12]。最近,何玉环[25]对红壤性水稻土进行灭菌处理后再添加乳酸钠和硫酸盐,培养20 d后在土壤固、液相中均未检测到DPTAA,且培养体系中未见硫酸盐发生还原产生硫化物。进一步的机理研究还发现,溶液体系中DPAA的硫化[26]很可能是硫酸盐还原菌介导下的化学过程,即DPAA与硫酸盐还原产生的硫化物反应继而生成DPTAA。针对无机砷的研究也表明,高浓度的硫化物能够明显促进无机砷的硫化[27]。综上可知,硫酸盐的还原程度以及溶液相中硫化物的浓度很可能是控制淹水红壤中DPAA硫化的重要因素。
本研究中,花生地的S+C+处理在6周后发生了硫酸盐还原,13周时在其固、液相中均检测到DPTAA;而在花生地的S+C++处理中,虽然铁还原促进DPAA释放的效应更强,但由于硫酸盐还原程度的降低,13周时仍未检测到DPTAA(数据未显示)。由此可见,对花生地而言,铁还原通过促进DPAA释放进而促进其发生硫化的效应不明显。可能的解释是:由于铁还原通过产生的Fe(Ⅱ)消耗大量硫化物或者通过竞争电子供体从而有效抑制硫酸盐还原,导致与铁还原促进DPAA的释放和进一步的硫化相比,硫酸盐的还原程度及溶液相中硫化物的浓度很可能是控制花生地红壤中DPAA硫化的一个更重要的因素。这也解释了与花生地的S+C++处理相比,S+C+处理中铁还原程度的降低和硫酸盐还原程度的增加有利于DPAA硫化的原因。结合不同类型红壤的结果,随着铁还原速率和程度的增加,铁还原促进DPAA释放和进一步硫化的效应随之增强(表 2);对比红壤(花生地)和黑土的结果(表 2)可知,随着土壤中总铁含量的增加和硫酸盐还原程度的降低,铁还原通过消耗硫化物从而抑制DPAA硫化的效应有所增强。
土壤中铁还原和硫酸盐还原反应的发生,除了与氧化铁的形态(晶质、非晶质)和添加的电子供体(如乳酸钠)有关,还与土壤本身的微生物学特点密切相关[28]。本研究中选择的2种土地利用方式红壤,在添加不同浓度乳酸钠和硫酸盐后土壤细菌群落结构及其变化明显不同:与林地相比,花生地的4个处理中梭菌属和芽孢杆菌属的丰度明显增加,且S+C+和S+C++处理中脱硫芽孢杆菌属的丰度明显提高(图 6b,图 6d),这很可能分别促进了铁还原[29]和硫酸盐还原[30],最终对DPAA释放和硫化产生更显著的影响[10,12]。综上所述,未来仍需关注土壤自身理化性质及微生物学特点导致的铁还原和硫酸盐还原过程的差异及其对DPAA释放与硫化的影响。值得注意的是,本研究中的供试红壤均为旱地土壤,所得到的研究结果势必与一直处于淹水或者干湿交替条件下的水稻土(如红壤性水稻土)不同;但考虑到土地利用方式的变更(如旱地改水田)是南方红壤区改良土壤和提高土地生产力的常用措施[31],本文的研究结果将为红壤中DPAA环境行为的研究、环境风险的预测以及污染修复策略的制定提供理论依据。
4 结论在添加不同浓度乳酸钠及硫酸钠培养的条件下,花生地和林地红壤中DPAA的释放与硫化情况明显不同。同时添加乳酸钠和硫酸盐显著促进了花生地中铁还原和硫酸盐还原的发生,从而增强了铁还原促进DPAA释放的效应,而铁还原程度的增加和硫酸盐还原程度的降低不利于DPAA的硫化;与花生地不同,无论是否添加乳酸钠和硫酸盐,林地中未见DPAA释放与硫化现象,这与林地中铁还原程度较低且硫酸盐未发生还原有关。总体而言,与铁还原促进DPAA的释放和进一步的硫化相比,硫酸盐的还原程度以及溶液相中硫化物的浓度很可能是控制淹水红壤中DPAA硫化的一个更重要的因素。此外,淹水条件下花生地中梭菌属、芽孢杆菌属和脱硫芽孢杆菌属丰度的增加很可能分别促进了铁还原和硫酸盐还原,从而对DPAA释放与硫化产生更显著的影响。未来仍需关注土壤自身理化性质及微生物学特点导致的铁还原和硫酸盐还原过程的差异及其对土壤中DPAA释放与硫化的影响。
| [1] |
Kinoshita K, Shida Y S, Sakuma C, et al. Determination of diphenylarsinic acid and phenylarsonic acid, the degradation products of organoarsenic chemical warfare agents, in well water by HPLC-ICP-MS[J]. Applied Organometallic Chemistry, 2005, 19(2): 287-293. DOI:10.1002/aoc.789
(  0) 0) |
| [2] |
Zhang Y, Zhu Y B, Zhao S P, et al. Arsenic in soils contaminated by arsenic‐containing chemical weapons in a site of Jilin, China: Fraction and bioaccessibility[J]. Environmental Science and Pollution Research, 2022, 29(19): 28957-28972. DOI:10.1007/s11356-021-18482-3
(  0) 0) |
| [3] |
Daus B, Hempel M, Wennrich R, et al. Concentrations and speciation of arsenic in groundwater polluted by warfare agents[J]. Environmental Pollution, 2010, 158(11): 3439-3444. DOI:10.1016/j.envpol.2010.06.029
(  0) 0) |
| [4] |
Niemikoski H, Lehtonen K K, Ahvo A, et al. Metabolism and cytotoxicity of diphenylarsinic acid, a degradation product of sea-dumped chemical warfare agents, in a rainbow trout liver cell line RTL-W1[J]. Aquatic Toxicology, 2021, 241: 105993. DOI:10.1016/j.aquatox.2021.105993
(  0) 0) |
| [5] |
Arao T, Maejima Y, Baba K. Uptake of aromatic arsenicals from soil contaminated with diphenylarsinic acid by rice[J]. Environmental Science & Technology, 2009, 43(4): 1097-1101.
(  0) 0) |
| [6] |
Ishii K, Tamaoka A, Otsuka F, et al. Diphenylarsinic acid poisoning from chemical weapons in Kamisu, Japan[J]. Annals of Neurology, 2004, 56(5): 741-745. DOI:10.1002/ana.20290
(  0) 0) |
| [7] |
Chen X M, Zeng X C, Kawa Y K, et al. Microbial reactions and environmental factors affecting the dissolution and release of arsenic in the severely contaminated soils under anaerobic or aerobic conditions[J]. Ecotoxicology and Environmental Safety, 2020, 189: 109946. DOI:10.1016/j.ecoenv.2019.109946
(  0) 0) |
| [8] |
Maejima Y, Arao T, Baba K. Transformation of diphenylarsinic acid in agricultural soils[J]. Journal of Environmental Quality, 2011, 40(1): 76-82. DOI:10.2134/jeq2009.0496
(  0) 0) |
| [9] |
Hisatomi S, Guan L, Nakajima M, et al. Formation of diphenylthioarsinic acid from diphenylarsinic acid under anaerobic sulfate-reducing soil conditions[J]. Journal of Hazardous Materials, 2013, 262: 25-30. DOI:10.1016/j.jhazmat.2013.08.020
(  0) 0) |
| [10] |
Zhu M, Tu C, Hu X F, et al. Solid-solution partitioning and thionation of diphenylarsinic acid in a flooded soil under the impact of sulfate and iron reduction[J]. Science of the Total Environment, 2016, 569/570: 1579-1586. DOI:10.1016/j.scitotenv.2016.07.001
(  0) 0) |
| [11] |
Zhu M, Luo Y M, Cheng N N, et al. Contrasting effects of iron reduction on thionation of diphenylarsinic acid in a biostimulated Acrisol[J]. Environmental Science and Pollution Research, 2020, 27(14): 16646-16655. DOI:10.1007/s11356-020-08107-6
(  0) 0) |
| [12] |
Guan L, Hisatomi S, Fujii K, et al. Enhanced transformation of diphenylarsinic acid in soil under sulfate-reducing conditions[J]. Journal of Hazardous Materials, 2012, 241/242: 355-362. DOI:10.1016/j.jhazmat.2012.09.054
(  0) 0) |
| [13] |
Zhu M, Luo Y M, Yang R Y, et al. Diphenylarsinic acid sorption mechanisms in soils using batch experiments and EXAFS spectroscopy[J]. Frontiers of Environmental Science & Engineering, 2020, 14: 58.
(  0) 0) |
| [14] |
Chinese Research Academy of Environmental Sciences. Control standard of soil pollutants for the destruction of chemical weapons abandoned by Japan in China(GB19062-2003)[S]. Beijing: China Environmental Science Press, 2007.[中国环境科学研究院. 销毁日本遗弃在华化学武器土壤污染控制标准(GB19062-2003)[S]. 北京: 中国环境科学出版社, 2007.]
(  0) 0) |
| [15] |
Kappler A, Benz M, Schink B, et al. Electron shuttling via humic acids in microbial iron(Ⅲ) reduction in a freshwater sediment[J]. FEMS Microbiology Ecology, 2004, 47(1): 85-92. DOI:10.1016/S0168-6496(03)00245-9
(  0) 0) |
| [16] |
Zhu M, Tu C, Zhang H B, et al. Simultaneous determination of diphenylarsinic and phenylarsinic acids in amended soils by optimized solvent extraction coupled to HPLC-MS/MS[J]. Geoderma, 2016, 270: 109-116. DOI:10.1016/j.geoderma.2015.08.033
(  0) 0) |
| [17] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [18] |
Cord-Ruwisch R. A quick method for the determination of dissolved and precipitated sulfides in cultures of sulfate-reducing bacteria[J]. Journal of Microbiological Methods, 1985, 4(1): 33-36. DOI:10.1016/0167-7012(85)90005-3
(  0) 0) |
| [19] |
Wei J S, Shen B, Ye G, et al. Selenium and arsenic removal from water using amine sorbent, competitive adsorption and regeneration[J]. Environmental Pollution, 2021, 274: 115866. DOI:10.1016/j.envpol.2020.115866
(  0) 0) |
| [20] |
Xia D, Yi X Y, Lu Y, et al. Dissimilatory iron and sulfate reduction by native microbial communities using lactate and citrate as carbon sources and electron donors[J]. Ecotoxicology and Environmental Safty, 2019, 174: 524-531. DOI:10.1016/j.ecoenv.2019.03.005
(  0) 0) |
| [21] |
Qiu R L, Wu Q, Yao W Y. Study in affecting factors of soil sulfate adsorption-desorption process in South China (In Chinese)[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2001, 40(4): 88-92. DOI:10.3321/j.issn:0529-6579.2001.04.025 [仇荣亮, 吴箐, 尧文元. 南方土壤硫酸根吸附解吸影响因子研究[J]. 中山大学学报(自然科学版), 2001, 40(4): 88-92.]
(  0) 0) |
| [22] |
Luo D, Meng X T, Zheng N G, Li Y Y, Yao H Y, Chapman S J. The anaerobic oxidation of methane in paddy soil by ferric iron and nitrate, and the microbial communities involved[J]. Science of the Total Environment, 2021, 788: 147773. DOI:10.1016/j.scitotenv.2021.147773
(  0) 0) |
| [23] |
Sato Y, Hamai T, Hori T, et al. Desulfosporosinus spp. were the most predominant sulfate-reducing bacteria in pilot- and laboratory-scale passive bioreactors for acid mine drainage treatment[J]. Applied Microbiology Biotechnology, 2019, 103: 7783-7793. DOI:10.1007/s00253-019-10063-2
(  0) 0) |
| [24] |
Luo T, Huang Z L, Li X Y, Zhang Y Y. Anaerobic microbe mediated arsenic reduction and redistribution in coastal wetland soil[J]. Science of the Total Environment, 2020, 727: 138630. DOI:10.1016/j.scitotenv.2020.138630
(  0) 0) |
| [25] |
He Y H. Study on the release and transformation process of diphenylarsinic acid in flooded soil[D]. Wuhu, Anhui: Anhui Normal University, 2022.[何玉环. 淹水土壤中二苯砷酸的释放与转化过程研究[D]. 安徽芜湖: 安徽师范大学, 2022.]
(  0) 0) |
| [26] |
Guan L, Shiiya A, Hisatomi S, et al. Sulfate-reducing bacteria mediate thionation of diphenylarsinic acid under anaerobic conditions[J]. Biodegradation, 2015, 26(1): 29-38. DOI:10.1007/s10532-014-9713-2
(  0) 0) |
| [27] |
Sun S T, Xie X J, Li J X, et al. Distribution and formation of thioarsenate in high arsenic groundwater from the Datong Basin, northern China[J]. Journal of Hydrology, 2020, 590: 125268. DOI:10.1016/j.jhydrol.2020.125268
(  0) 0) |
| [28] |
Kappler A, Bryce C, Muammar M, et al. An evolving view on biogeochemical cycling of iron[J]. Nature Reviews Microbiology, 2021, 19: 360-374. DOI:10.1038/s41579-020-00502-7
(  0) 0) |
| [29] |
Wang Y H, Zhang G L, Wang H L, et al. Effects of different dissolved organic matter on microbial communities and arsenic mobilization in aquifers[J]. Journal of Hazardous Materials, 2021, 411: 125146. DOI:10.1016/j.jhazmat.2021.125146
(  0) 0) |
| [30] |
Yoshikawa M, Zhang M. Constraints in anaerobic microbial dechlorination, fermentation, and sulfate-reduction induced by high concentrations of tetrachloroethylene[J]. Water, Air & Soil Pollution, 2020, 231: 390.
(  0) 0) |
| [31] |
Li Z P, Cheng L L, Lin X X. Characteristics for changes of humus composition in Acrisol and its relationship with fertility evolution (In Chinese)[J]. Soils, 2002, 34(1): 9-15. [李忠佩, 程励励, 林心雄. 红壤腐殖质组成变化特点及其与肥力演变的关系[J]. 土壤, 2002, 34(1): 9-15.]
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


