2. 中国科学院大学, 北京 100049;
3. 中国科学院大学南京学院, 南京 211135
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
土壤团聚体是土壤结构的基本单元,其粒级大小及分布比例是反映土壤结构优劣的关键指标,可表征不同管理措施下土壤质量的变化特征[1]。合理的团聚体组成有利于提高土壤孔隙度、增加持水能力和降低土壤可蚀性,从而使水分、养分更好地利用和转化[2],此外,团聚体稳定性的提高还可降低团聚体内部有机碳的矿化,提高团聚体中的有机碳积累[3],水分和养分的利用转化及有机碳的积累有利于提高土壤肥力,促进作物生长及其可持续性。
土壤团聚体的形成和稳定主要是通过土壤中矿物、有机质和生物间复杂的相互作用实现的,其中微生物是形成土壤团聚体最活跃的生物因素之一[4],其在促进土壤颗粒团聚和维持团聚体稳定性方面起着重要作用。与细菌相比,真菌在团聚体形成中发挥着更重要的作用[5],因为其分泌物的黏合作用以及真菌菌丝和植物细根的缠绕作用,可更有效地使土壤颗粒紧密结合,形成团聚体[1,6]。Six等[6]指出真菌菌丝与细根结合促进了大于2 000 µm团聚体的形成,还有研究[7]表明,球囊霉素相关土壤蛋白(GRSP)和微生物生物量碳(MBC)是起黏结作用的重要生物胶结物质,它们与团聚体的数量存在很强的相关性。GRSP是一种由丛枝菌根真菌(AMF)释放的具有疏水性的糖蛋白,是可以将土壤颗粒聚合在一起的黏合剂。GRSP可通过以下步骤促进土壤团聚和稳定:(1)GRSP在微团聚体内部和之间进行粘附;(2)在GRSP影响下产生的活性有机化合物(细胞外多糖)稳定微团聚体;(3)真菌菌丝和植物根系结合微团聚体形成大团聚体后,通过GRSP连接大团聚体内部的间隙来稳定大团聚体;(4)在大团聚体上形成GRSP保护层[8]。一般而言,土壤中易提取球囊霉素相关土壤蛋白(EE-GRSP)及其与总球囊霉素相关土壤蛋白的比值(EE-GRSP/T-GRSP)与土壤团聚体稳定的相关性更高,在一定程度上可反映新生成球囊霉素相关土壤蛋白的多少以及衡量丛枝菌根真菌的活跃程度[7]。MBC是土壤微生物的产物,是土壤有机碳中的活性组分,它也是一种胶结剂,可通过吸附作用与土壤颗粒结合,在保持团聚体稳定性中发挥作用[6,9]。但真菌群落组成和胶结物质的相互作用尚不明确。
氮是作物生长所必需的营养元素,施用氮肥是提高土壤肥力和作物产量的有效途径[10]。大量研究发现真菌群落组成及胶结物质含量受氮肥施用水平影响,例如Tang等[11]研究表明,不同的氮肥添加量对真菌群落多样性存在显著影响;Tong等[3]指出氮肥施入过量可能导致土壤酸化、次生盐渍化、养分失衡和作物病害,从而对土壤真菌多样性产生负面影响;Lu等[12]指出施氮过量会抑制真菌生长,减少胶结物质产生。但不同氮肥施用条件下真菌群落组成和胶结物质含量的变化与土壤团聚体组成之间的关系尚不清楚。
黄淮海平原是我国重要的农业经济区和粮食主产区,而长期以来,集约化种植中不合理的施肥增加了土壤结构退化的风险,例如为追求作物产量的提升而长期过量投入氮肥使得土壤结构变差、氮肥利用效率降低,反而限制了作物产量的提高。但长期不同施氮水平如何影响团聚体组成及真菌群落与胶结物质的作用机制尚不清楚。本研究以设置在河南封丘的氮肥水平长期田间试验为研究平台,研究了5个氮肥水平下土壤水稳性团聚体组成的差异及其与特定生物胶结剂和真菌群落之间相关性,主要目的包括:(1)明确氮肥施用梯度对土壤团聚体组成、胶结物质含量和真菌群落组成的影响,(2)挖掘土壤团聚体组成与胶结物质和真菌群落组成之间的内在关系。
1 材料与方法 1.1 研究区概况本试验以位于河南省新乡市封丘县的中国科学院封丘农业生态实验站(35°01′N,114°24′E)为平台开展,该区域属半干旱半湿润的暖温带季风气候,年平均温度13.9℃,多年平均降雨量约615 mm,蒸发量约1 875 mm,全年日照时数2 300~2 500 h。该区域土壤类型主要为黄河冲积物发育形成的典型潮土,耕层土壤质地为碱性砂质壤土。
1.2 试验设计本试验为长期定位试验(始于2005年),设置5个施氮水平,即每个作物季分别施氮0、150、190、230和270 kg·hm–2,每个施氮水平设3个重复,小区随机排列,每个小区面积为48 m2(8 m×6 m)。长期试验之前,土壤(0~30 cm)理化性质为:pH 8.28,有机碳5.92 g·kg–1,全氮0.57 g·kg–1,全磷0.76 g·kg–1,全钾21.2 g·kg–1,碱解氮45.7 mg·kg–1,有效磷5.75 mg·kg–1,速效钾120.0 mg·kg–1。
作物种植方式为夏玉米和冬小麦轮作,作物地上部分在收获后移除。玉米品种为郑单958,小麦品种为郑麦9023。所施氮肥为尿素(N 46.3%),分基肥和追肥两次施用,玉米季60%为基施,其余40%于大喇叭口期作为追肥施用;小麦季40%为基施,其余60%于返青期作为追肥施用。磷肥为重过磷酸钙(含P2O5 46.1%)80 kg·hm–2,钾肥为硫酸钾(含K2O 49.6%)200 kg·hm–2,磷肥和钾肥均随氮肥基施。小麦季追肥后进行灌溉,玉米季追肥后若无降雨或降雨量低于20 mm时进行灌溉。
1.3 样品采集与测定土壤样品于2020年10月玉米收获后采集。每个小区使用S型采样法采集0~20 cm土样,混合后分成三份,一部分风干后用于土壤基本性质和胶结物质的测定,一部分存储于–20℃下用于测定土壤硝态氮、铵态氮、可溶性有机碳、可溶性有机氮和微生物生物量碳,一部分存储于–80℃下用于土壤DNA提取。每个小区使用小铁铲采集0~20 cm土层原状土壤样品,将其沿自然裂缝掰开后过8 mm筛,去除作物根系和碎屑后风干,用于测定土壤团聚体。
土壤有机碳(SOC)、全氮(TN)、全磷(TP)、全钾(TK)、碱解氮(AHN)、硝态氮(
土壤团聚体分级采用Elliott[14]的湿筛法。使用套筛孔径分别为2 000、250和53 µm的团聚体自动筛分仪进行分级,将60 g土壤样品置于最上层的2 000 µm筛上,在沉降筒内的蒸馏水中浸泡5 min,以3 cm振幅、2 min内50次的频率进行上下振动,随后取出套筛,将不同孔径筛子上的土壤分别冲洗至预先称重的铝盒中,得到大于2 000 µm、2 000~250 µm和250~53 µm粒级团聚体,将沉降筒中的土壤样品溶液在1 250×g下离心30 min,得到小于53 µm粉黏粒。将以上各粒级团聚体于60℃下烘干后称重。平均重量直径(MWD)计算公式如下:
| $ \text{MWD} =\sum\nolimits_{i = 1}^n {{{\bar X}_i} \times {W_i}} $ |
式中,Wi表示第i个粒级团聚体质量所占百分比,
球囊霉素相关土壤蛋白(GRSP)的测定采用Wright和Upadhyaya [15]的方法并稍作修改。易提取球囊霉素相关土壤蛋白(EE-GRSP)的提取方法为:取1 g过2 mm筛的风干土置于离心管中,加入8 mL的20 mmol·L–1(pH 7.0)的柠檬酸钠浸提液,高压灭菌60 min(121℃)后,于10 000×g离心力下离心6 min,收集上清液。总球囊霉素相关土壤蛋白(T-GRSP)的提取方法为:取1 g过2 mm筛的风干土于离心管中,加入8 mL的50 mmol·L–1(pH 8.0)的柠檬酸钠浸提液,高压灭菌60 min(121℃)后,于10 000×g离心力下离心6 min,收集上清液,反复提取5次。以牛血清蛋白为标准,使用考马斯亮蓝法测定上述上清液中的蛋白浓度,求得EE-GRSP和T-GRSP含量。难提取球囊霉素相关土壤蛋白(DE-GRSP)含量为T-GRSP与EE-GRSP含量之差。土壤微生物生物量碳(MBC)采用氯仿熏蒸法进行提取和测定[13]。
1.4 土壤DNA提取与高通量测序土壤DNA使用Fast DNA Spin Kit for Soil(MP Biomedicals,Santa Ana,CA,美国)试剂盒,根据说明书操作从0.50 g鲜土中提取。使用NanoDrop™ 1000分光光度计(Thermo Fisher Scientific,Waltham,MA,美国)测量DNA纯度和浓度。使用引物ITS5F(5′-GGAAGTAAAAGTCGTAACAA GG-3′)/ITS1R(5′-GCTGCGTTCTTCATCGATGC-3′)进行真菌PCR扩增,PCR扩增条件为98℃ 5 min,25个循环(98℃ 30 s,53℃ 30 s,72℃ 45 s),之后72℃ 5 min。反应产物使用VAHTSTM DNA Clean Beads(Vazyme,南京,中国)试剂盒进行纯化。将不同样品的PCR扩增产物等摩尔混合后,采用Illumina MiSeq测序仪进行序列分析(委托上海派森诺生物科技股份有限公司测定)。使用QIIME(1.91)去除低质量序列并用核蛋白体数据库(Ribosomal Database Project)去除嵌合体,将高质量序列使用Uparse软件以97%相似度划分后采用Blast方法以联合数据库(Unite Database)进行真菌注释。
1.5 数据统计分析使用R 4.2.1软件的vegan包进行主坐标分析(principal co-ordinates analysis,PCoA)和冗余分析(redundancy analysis,RDA);使用置换多元方差分析(permutational multivariate analysis of variance,PERMANOVA)判断不同处理间土壤真菌群落结构的差异;使用蒙特卡洛置换检验(Monte Carlo permutation test,999 permutatio-ns)对影响土壤真菌群落结构的土壤理化性质进行显著性检验。
使用SPSS 26.0软件进行单因素方差分析和相关分析,使用新复检验法(Duncan's new multiple range test)进行平均值显著性多重比较(P < 0.05)。使用Microsoft Excel 2019、Origin 2021和R 4.2.1软件进行数据处理和绘图。
2 结果 2.1 长期不同施氮水平下的土壤基本理化性质与F0处理相比,F1、F2、F3和F4处理的SOC和TN含量显著升高(P<0.05),平均分别增加20.26%和32.90%,而AP和AK含量显著降低,平均分别降低55.33%和40.60%,但是上述四个参数在F1、F2、F3和F4处理之间无显著变化(表 1)。随着氮肥施用量的增加,土壤pH有降低趋势,但仅有F4处理显著低于F0处理;而
|
|
表 1 不同处理土壤理化性质 Table 1 Soil physicochemical properties under different treatments |
团聚体分布在F1与F2处理间类似、F3和F4处理间类似(图 1a)。与F0处理相比,F1和F2处理显著增加大于2 000 µm和2 000~250 µm团聚体质量比例,而显著降低小于53 µm粉黏粒质量比例;F3和F4处理显著增加2 000~250 µm团聚体质量比例,而显著降低小于53 µm粉黏粒质量比例。
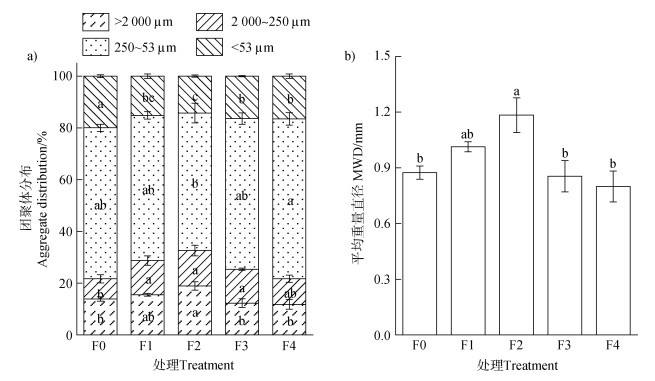
|
注:柱状图上的误差线为标准误,不同小写字母表示相同粒级不同处理间的差异显著(P < 0.05)。 Note: The error lines on the bars in panels a and b are standard errors. Different letters indicate a significant difference between treatments(P < 0.05). 图 1 长期不同施氮水平下土壤各粒级团聚体质量比例(a)和平均重量直径(b) Fig. 1 The mass proportion(a) and mean weight diameter of soil aggregates(b) under long-term different N application rates |
与团聚体在不同处理间的分布趋势类似,平均重量直径(MWD)在F1和F2处理间类似、F3和F4处理间类似(图 1b)。与F0处理相比,F1和F2处理的MWD平均增加25.60%,而F3和F4处理的MWD与F0处理之间无显著变化。
由表 2可知,EE-GRSP和MBC含量在F1、F2、F3和F4处理间无显著差异,但与F0处理相比,F1、F2、F3和F4处理的EE-GRSP含量平均增加25.44%,MBC含量平均增加36.80%。尽管F2处理的DE-GRSP和T-GRSP含量与F0和F1处理类似,但显著低于F3和F4处理。EE-GRSP/T-GRSP则表现为在F2处理中最高。
|
|
表 2 长期不同施氮水平下的土壤胶结物质 Table 2 Effects of long-term different N application rates on soil binding agents |
真菌ITS高通量测序序列经过物种注释后归属于17个门,44个纲,100个目,180个科和268个属。由图 2可知,各处理的真菌优势菌门均为子囊菌门(Ascomycota),其相对丰度为75.40%,其余相对丰度大于1%的门主要为担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)和毛霉门(Mucoromycota),相对丰度分别为4.57%、3.16%和2.27%。随着施氮量的增加,子囊菌门的相对丰度表现为升高趋势,与F0处理相比,F1、F2、F3和F4处理的子囊菌门相对丰度显著增加,分别增加15.24%、16.47%、24.41%和24.41%。与F0处理相比,F1、F2、F3和F4处理的土壤被孢霉门相对丰度显著降低,分别降低61.90%、65.85%、66.50%和59.40%。F3和F4处理的担子菌门相对丰度相较F0处理显著降低,分别降低69.76%和79.33%。毛霉门的相对丰度在各处理间差异未达到显著水平。
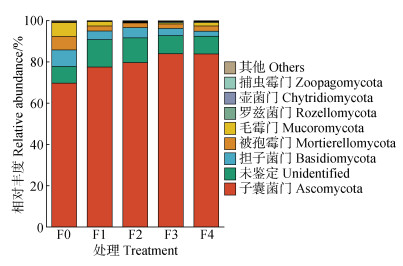
|
图 2 长期不同施氮水平对门水平土壤真菌群落组成影响 Fig. 2 Effects of long-term different N application rates on the relative abundance of the major fungal phyla |
对各处理真菌群落组成进行PCoA分析,第一轴和第二轴分别解释了31.34%和15.33%的总方差(图 3a)。5个处理可分为F0、F1和F2以及F3和F4三组,置换多元方差分析表明三组之间两两差异显著。对土壤理化性质和不同处理的OTU丰度进行RDA分析(图 3b),并基于蒙特卡洛置换检验表明,TN、AK、AP、SOC、
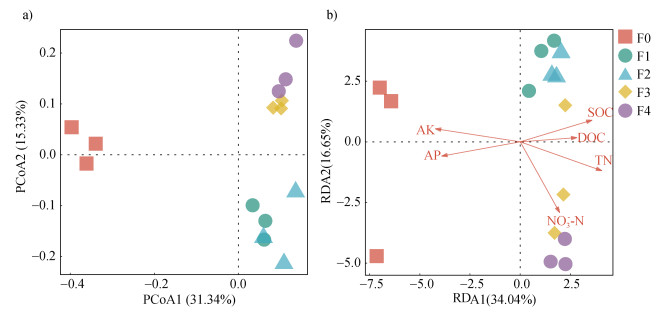
|
图 3 不同施氮水平的土壤真菌群落主坐标分析(PCoA,a)及土壤真菌群落组成与土壤理化性质的冗余分析(RDA,b) Fig. 3 Principal co-ordinate analysis(PCoA) of soil fungal communities under different N application rates(a) and redundancy analysis(RDA) of soil fungal community composition and physicochemical properties(b) |
在属水平上对相对丰度最高的30个优势属进行分析,Fusicolla、被孢霉属(Mortierella)、黑孢壳属(Melanospora)、亚隔孢壳属(Didymella)、柄孢壳属(Podospora)、根霉属(Rhizopus)、葡萄穗霉属(Stachybotrys)和白腐菌属(Phlebia)等8个属在F0处理中富集(图 4);久浩酵母属(Guehomyces)、拟棘壳孢属(Pyrenochaetopsis)、支顶孢属(Acremonium)和柱霉属(Scytalidium)等4个属在F1和F2处理中富集;金黄孢子菌属(Chrysosporium)、Phaeoacremonium、炭团菌属(Hypoxylon)和裂壳属(Schizothecium)等4个属在F3和F4处理中富集。此外,端梗霉属(Acrophialophora)和青霉属(Penicillium)2个属相对丰度在F1处理中最高,外瓶霉属(Exophiala)相对丰度在F2处理中最高。
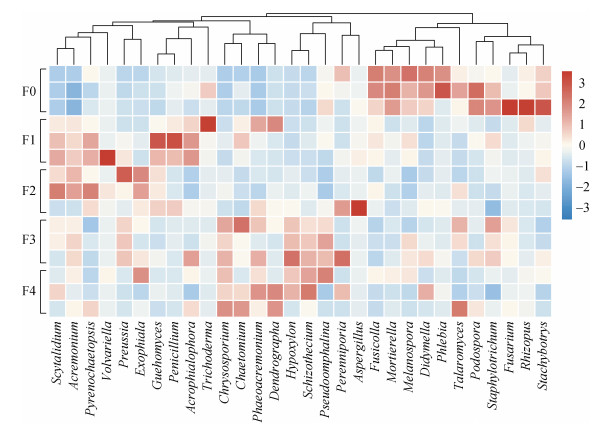
|
注:图中颜色越趋近红色表示对应处理的该物种丰度越高,越趋近蓝色表示对应处理的该物种丰度越低。同一聚类树表明丰度分布相似。 Note: In the figure, the closer the color is to red, the higher the relative abundance of the genus in the corresponding treatment, and the closer the color is to blue, the lower the relative abundance of the genus in the corresponding treatment. The same cluster tree indicates similar abundance distribution. 图 4 长期不同施氮水平下土壤真菌属水平丰度差异 Fig. 4 Differences in the relative abundance of soil fungi at the genus level under long-term different N application |
将土壤团聚体质量比例、平均重量直径及胶结物质与在F0、F1和F2、F3和F4中富集的物种进行皮尔森相关性分析(图 5)。结合图 4结果表明,(1)F1和F2处理增加的大于2 000 µm团聚体质量比例主要与该两处理富集的拟棘壳孢属(Pyrenochaetopsis)相对丰度显著正相关;增加的2 000~250 µm团聚体质量比例与EE-GRSP/T-GRSP和EE-GRSP显著正相关,而与亚隔孢壳属(Didymella)和被孢霉属(Mortierella)相对丰度呈显著负相关;同时F1和F2处理降低的小于53 µm质量比例与被孢霉属(Mortierella)、白腐菌属(Phlebia)、黑孢壳属(Melanospora)、Fusicolla、柄孢壳属(Podospora)和亚隔孢壳属(Didymella)相对丰度呈显著正相关,而与支顶孢属(Acremonium)、柱霉属(Scytalidium)、外瓶霉属(Exophiala)、EE-GRSP/T-GRSP、EE-GRSP和MBC呈显著负相关。(2)F3和F4处理增加的2 000~250 µm团聚体质量比例与EE-GRSP含量显著正相关,而与亚隔孢壳属(Didymella)和被孢霉属(Mortierella)相对丰度呈显著负相关,同时F3和F4处理降低的小于53 µm质量比例与被孢霉属(Mortierella)、白腐菌属(Phlebia)、黑孢壳属(Melanospora)、Fusicolla、柄孢壳属(Podospora)和亚隔孢壳属(Didymella)相对丰度呈显著正相关,而与EE-GRSP含量显著负相关。
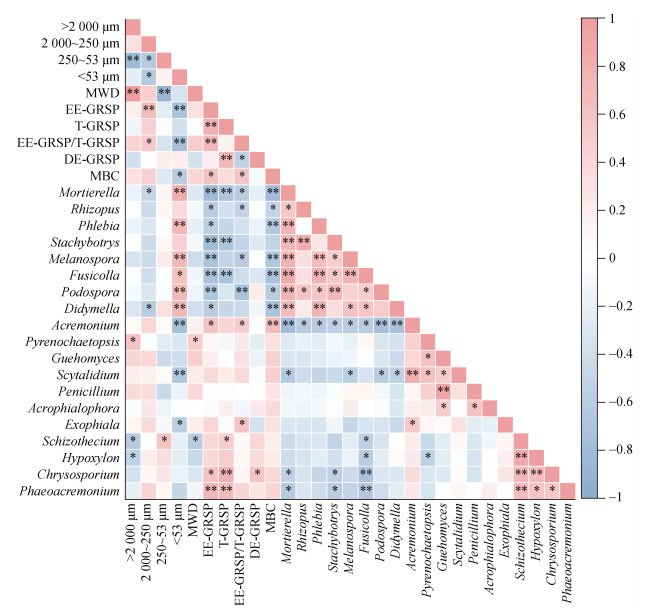
|
注:图中的红色和蓝色分别表示正相关和负相关关系,*和**分别表示显著相关(P < 0.05)和极显著相关(P < 0.01)。> 2 000 µm:> 2000 µm团聚体质量比例;2 000~250 µm:2 000~250 µm团聚体质量比例;250~53 µm:250~53 µm团聚体质量比例;< 53 µm:< 53 µm团聚体质量比例。 Note: In the figure, red indicates a positive relationship and blue indicates a negative relationship. "*" indicates significant correlation(P < 0.05), and "**" indicates extremely significant correlation(P < 0.01). > 2 000 µm: the proportion of > 2 000 µm aggregates; 2 000-250 µm: the proportion of 2 000-250 µm aggregates; 250-53 µm: the proportion of 250-53 µm aggregates; < 53 µm: the proportion of < 53 µm aggregates. 图 5 土壤团聚体质量比例、平均重量直径、胶结物质及差异真菌优势属之间的相关性 Fig. 5 Correlation among soil aggregate distribution, mean weight diameter, binding agents and dominant genus |
土壤有机碳在维持土壤生产力方面发挥着重要作用,本研究中,作物地上部在收获后被移除,土壤有机碳积累仅来自于地下部生物量,施氮促进了作物生长,使根系和根系分泌物增加并提升了SOC含量,施氮的4个处理的SOC含量相较不施氮处理显著提高(表 1)。但与地上部分生物量相比,根部生物量受施氮量的影响相对较小,SOC含量在施用氮肥的4个处理间差异不显著(表 1)。DOC是土壤活性有机碳,它与作物和土壤微生物的活性密切相关,且较土壤总有机碳对土壤管理措施的响应更快[16],本研究中,150 kg·hm–2和190 kg·hm–2氮肥施用水平下的土壤环境更利于DOC积累(表 1)。长期氮肥的施用相较不施氮增加了土壤氮素的储备,但F1、F2、F3和F4处理间的TN含量无显著变化(表 1),这可能是由于当施氮量超过一定范围,随着施氮量的增加,氮素流失比例也随之增大,使实际供氮水平未显著提高,降低了氮素利用率。本研究中,随着氮肥施用量的增加,
土壤大于2 000 µm和2 000~250 µm团聚体质量比例以及MWD是表示土壤团聚体稳定性的常用指标,可反映土壤结构对施肥等管理措施的响应,稳定的团聚体利于土壤中水分和养分的利用与转化,从而改善土壤生产力[19–20]。本研究表明,150 kg·hm–2和190 kg·hm–2施氮水平更有助于稳定土壤结构(图 1),这与以往的一些研究结果一致,例如Bai等[21]发现,与不施氮相比,氮肥的输入促进了土壤中大团聚体的形成并增大了MWD,施氮对土壤大团聚体的促进作用主要发生在小于200 kg·hm–2氮输入时,而长期大于200 kg·hm–2引起的土壤酸化和阳离子养分的消耗则对根系和微生物有抑制作用,影响土壤团聚;Yan等[22]研究发现在小麦-大豆和小麦-玉米种植制度下,中氮施肥(120 kg·hm–2)较高氮施肥(240 kg·hm–2)和不施氮(0)更利于促进土壤大团聚体的形成及提高团聚体相关碳含量。
土壤团聚体的分布和稳定性与土壤胶结物质密切相关,GRSP和MBC等胶结物质被诸多研究证实具有促进土壤团聚体形成和稳定的作用[7,23-24]。T-GRSP反映土壤中累积GRSP的水平,而EE-GRSP则是土壤中新鲜的GRSP,EE-GRSP/T-GRSP在一定程度上可衡量丛枝菌根真菌的活跃程度。本研究中,施氮处理相较不施氮处理显著提高了EE-GRSP和MBC含量(表 2),这可能是由于施氮可促进作物生长,作物将更多的光合产物分配至根系及相关真菌中,使分泌的胶结物质增加。但另一方面,氮施入过量则会抑制丛枝菌根真菌的活跃程度[21],本研究中,施氮量超过190 kg·hm–2后EE-GRSP/T-GRSP下降(表 2),丛枝菌根真菌活跃性下降。
3.3 不同施氮量对土壤真菌群落组成的影响及其关键环境因子土壤真菌群落结构体现了真菌群落组成,决定了真菌功能,其在土壤团聚体分布、有机质(动植物残体等)降解和腐殖质的形成等生物化学过程中发挥着重要作用[3,25]。子囊菌门为本地区潮土中的优势菌,这与以往研究[26]结果相同。子囊菌是参与土壤中动植物残体分解的重要腐生菌,其可产生大量无性孢子并快速生长,从而在土壤中大量存在[27]。本研究中,施氮处理的子囊菌门相对丰度均显著高于不施氮处理(图 2),这可能由于子囊菌门适于高肥力的土壤环境[27],其相对丰度会随着氮肥等的施入而显著升高。
土壤养分变化是导致真菌群落结构发生改变的重要因素。本研究结果表明,TN、AK、AP、SOC、
本研究中,拟棘壳孢属(Pyrenochaetopsis)可能通过菌丝与土壤颗粒和植物细根的缠绕作用促进了大团聚体的形成(图 5)。Chen等[30]研究表明较高的有机碳含量可能会刺激拟棘壳孢属(Pyrenochaetopsis)的生长,拟棘壳孢属(Pyrenochaetopsis)还被认为是土壤-根系微生物群落的重要指示属,与作物的株高和茎粗呈显著正相关 [31]。本研究中,F1和F2处理中富集的支顶孢属(Acremonium)和外瓶霉属(Exophiala)相对丰度的增加通过提高EE-GRSP/T-GRSP和EE-GRSP含量间接促进了2 000~250 µm团聚体质量比例增加;支顶孢属(Acremonium)、柱霉属(Scytalidium)和外瓶霉属(Exophiala)相对丰度的增加以及EE-GRSP/T-GRSP、EE-GRSP和MBC含量的增加降低了小于53 µm质量比例(图 4,图 5)。土壤中的植物根系等残留物经过微生物的转化后形成的高腐殖化初级颗粒是形成土壤团聚体的重要因素[32],支顶孢属(Acremonium)和柱霉属(Scytalidium)为纤维素降解真菌,可对根系和植物残渣进行高效降解,并提高SOC和MBC含量,MBC可通过与土壤矿物颗粒之间的吸附和结合作用,促进形成大团聚体[33]。Bondarenko等[34]还发现支顶孢属(Acremonium)具有丰富的黏液,并且菌丝成束聚集,Macia-Vicente等[35]研究表明外瓶霉属(Exophiala)的菌丝通常与植物根系缠绕在一起,上述因素均有利于土壤的团聚;此外,它们还可能通过真菌之间的共生关系刺激丛枝菌根真菌的生长。金黄孢子菌属(Chrysosporium)是木质素降解菌,可能通过土壤有机碳的增加促进丛枝菌根真菌的生长并生成EE-GRSP。亚隔孢壳属(Didymella)、Fusicolla、柄孢壳属(Podospora)和亚隔孢壳属(Didymella)均为植物病原菌,在植物秸秆和根系残留量较少、无充足外源有机物料补充的缺氮环境中,植物病原菌通常会通过寄生或共生的方式通过宿主获取养分和能量,从而占据优势[27]。而F1、F2、F3和F4处理通过氮肥的施用增加了养分,降低了植物病原菌的竞争力,为有利于土壤团聚的真菌提供了适宜生存环境。
4 结论长期不同施氮量使土壤理化性质发生变化,也改变了土壤真菌群落组成,其中TN、AK、AP、SOC、
| [1] |
Six J, Elliott E, Paustian K. Soil macroaggregate turnover and microaggregate formation: A mechanism for C sequestration under no-tillage agriculture[J]. Soil Biology and Biochemistry, 2000, 32(14): 2099-2103. DOI:10.1016/S0038-0717(00)00179-6
(  0) 0) |
| [2] |
Rabbi S M, Minasny B, McBratney A B, et al. Microbial processing of organic matter drives stability and pore geometry of soil aggregates[J]. Geoderma, 2020, 360(C): 114033.
(  0) 0) |
| [3] |
Tong L H, Zhu L, Lv Y H, et al. Response of organic carbon fractions and microbial community composition of soil aggregates to long-term fertilizations in an intensive greenhouse system[J]. Journal of Soils and Sediments, 2020, 20(2): 641-652. DOI:10.1007/s11368-019-02436-x
(  0) 0) |
| [4] |
[4] Hemkemeyer M, Christensen B T, Martens R, et al. Soil particle size fractions harbour distinct microbial communities and differ in potential for microbial mineralisation of organic pollutants[J]. Soil Biology and Biochemistry, 2015, 90: 255-265. DOI:10.1016/j.soilbio.2015.08.018
(  0) 0) |
| [5] |
Wang Y D, Wang Z L, Zhang Q Z, et al. Long-term effects of nitrogen fertilization on aggregation and localization of carbon, nitrogen and microbial activities in soil[J]. Science of the Total Environment, 2018, 624: 1131-1139. DOI:10.1016/j.scitotenv.2017.12.113
(  0) 0) |
| [6] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between(micro) aggregates, soil biota, and soil organic matter dynamics[J]. Soil and Tillage Research, 2004, 79(1): 7-31. DOI:10.1016/j.still.2004.03.008
(  0) 0) |
| [7] |
Guo Z C, Zhang Z B, Zhou H, et al. Long-term animal manure application promoted biological binding agents but not soil aggregation in a Vertisol[J]. Soil and Tillage Research, 2018, 180: 232-237. DOI:10.1016/j.still.2018.03.007
(  0) 0) |
| [8] |
Agnihotri R, Sharma M P, Prakash A, et al. Glycoproteins of arbuscular mycorrhiza for soil carbon sequestration: Review of mechanisms and controls[J]. Science of the Total Environment, 2022, 806: 150571. DOI:10.1016/j.scitotenv.2021.150571
(  0) 0) |
| [9] |
Sun Q, Meng J, Lan Y, et al. Long-term effects of biochar amendment on soil aggregate stability and biological binding agents in brown earth[J]. Catena, 2021, 205: 105460. DOI:10.1016/j.catena.2021.105460
(  0) 0) |
| [10] |
Wang M, Wang L, Li Q, et al. Nitrogen fertilizer driven bacterial community structure in a semi-arid region of Northeast China[J]. Sustainability, 2021, 13(21): 11967. DOI:10.3390/su132111967
(  0) 0) |
| [11] |
Tang S, Zhou J J, Pan W K, et al. Impact of N application rate on tea(Camellia sinensis) growth and soil bacterial and fungi communities[J]. Plant and Soil, 2022, 475(1/2): 343-359.
(  0) 0) |
| [12] |
Lu X F, Hou E Q, Guo J Y, et al. Nitrogen addition stimulates soil aggregation and enhances carbon storage in terrestrial ecosystems of China: A meta-analysis[J]. Global Change Biology, 2021, 27(12): 2780-2792. DOI:10.1111/gcb.15604
(  0) 0) |
| [13] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [14] |
Elliott E T. Aggregate structure and carbon, nitrogen, and phosphorus in native and cultivated soils[J]. Soil Science Society of America Journal, 1986, 50(3): 627-633. DOI:10.2136/sssaj1986.03615995005000030017x
(  0) 0) |
| [15] |
Wright S F, Upadhyaya A. Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J]. Soil Science, 1996, 161(9): 575-586. DOI:10.1097/00010694-199609000-00003
(  0) 0) |
| [16] |
Zhou T T, LI D D, QIU L L, et al. Coupling effects of straw and woody peat on rapidly increasing soil organic matter and crop yield under different application ratios (In Chinese)[J]. Acta Pedologica Sinica, 2023. DOI:10.11766/trxb202112030656 [周谈坛, 李丹丹, 邱丽丽, 等. 不同配施比例下秸秆和木本泥炭对快速提升土壤有机质和作物产量的耦合影响[J]. 土壤学报, 2023.]
(  0) 0) |
| [17] |
Cassman K G, Dobermann A, Walters D T. Agroecosystems, nitrogen-use efficiency, and nitrogen management[J]. Ambio, 2002, 31(2): 132-140. DOI:10.1579/0044-7447-31.2.132
(  0) 0) |
| [18] |
Zhu X M, Wang F T, Xing J C, et al. Effects of overturning Sesbania cannabina on soil carbon, nitrogen and microbiological biomass in coastal area (In Chinese)[J]. Soils, 2021, 53(3): 549-556. [朱小梅, 王甫同, 邢锦城, 等. 田菁翻压还田对滩涂土壤碳氮及微生物生物量的影响[J]. 土壤, 2021, 53(3): 549-556.]
(  0) 0) |
| [19] |
Zhang Q Q, Song Y F, Wu Z, et al. Effects of six-year biochar amendment on soil aggregation, crop growth, and nitrogen and phosphorus use efficiencies in a rice-wheat rotation[J]. Journal of Cleaner Production, 2020, 242: 118435. DOI:10.1016/j.jclepro.2019.118435
(  0) 0) |
| [20] |
Liu Y L, Wang P, Wang J K. Formation and stability mechanism of soil aggregates: Progress and prospect (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(3): 627-643. [刘亚龙, 王萍, 汪景宽. 土壤团聚体的形成和稳定机制: 研究进展与展望[J]. 土壤学报, 2023, 60(3): 627-643.]
(  0) 0) |
| [21] |
Bai T S, Wang P, Ye C L, et al. Form of nitrogen input dominates N effects on root growth and soil aggregation: A meta-analysis[J]. Soil Biology and Biochemistry, 2021, 157: 108251. DOI:10.1016/j.soilbio.2021.108251
(  0) 0) |
| [22] |
Yan Z J, Zhou J, Nie J W, et al. Do cropping system and fertilization rate change water-stable aggregates associated carbon and nitrogen storage?[J]. Environmental Science and Pollution Research, 2021, 28(46): 65862-65871. DOI:10.1007/s11356-021-15562-2
(  0) 0) |
| [23] |
Guo Z C, Zhang J B, Fan J, et al. Does animal manure application improve soil aggregation? Insights from nine long-term fertilization experiments[J]. Science of the Total Environment, 2019, 660: 1029-1037. DOI:10.1016/j.scitotenv.2019.01.051
(  0) 0) |
| [24] |
Bertagnoli B G, Oliveira J F, Barbosa G M, et al. Poultry litter and liquid swine slurry applications stimulate glomalin, extraradicular mycelium production, and aggregation in soils[J]. Soil and Tillage Research, 2020, 202: 104657. DOI:10.1016/j.still.2020.104657
(  0) 0) |
| [25] |
Jiang X Y, Zhang Q Q, Shen H J, et al. Effects of biochar on soil aggregate stability and microbial community in paddy field (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(6): 1564-1573. [蒋雪洋, 张前前, 沈浩杰, 等. 生物质炭对稻田土壤团聚体稳定性和微生物群落的影响[J]. 土壤学报, 2021, 58(6): 1564-1573.]
(  0) 0) |
| [26] |
Li H M, Tian S Y, Li D D, et al. Effect of application of organic materials on content of labile organic carbon and composition of microbial community in fluvio-aquatic soil (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3): 777-787. [李慧敏, 田胜营, 李丹丹, 等. 有机物料施用对潮土活性有机碳及微生物群落组成的影响[J]. 土壤学报, 2021, 58(3): 777-787.]
(  0) 0) |
| [27] |
Ma L, Zhao W H, Guo Z B, et al. Effects of long-term application of phosphorus fertilizer on fungal community diversity, composition, and intraspecific interactions and variation with application rate in a lime concretion black soil (In Chinese)[J]. Acta Ecologica Sinica, 2019, 39(11): 4158-4167. [马垒, 赵文慧, 郭志彬, 等. 长期不同磷肥施用量对砂姜黑土真菌多样性、群落组成和种间关系的影响[J]. 生态学报, 2019, 39(11): 4158-4167.]
(  0) 0) |
| [28] |
Li Y L, Tremblay J, Bainard L D, et al. Long-term effects of nitrogen and phosphorus fertilization on soil microbial community structure and function under continuous wheat production[J]. Environmental Microbiology, 2020, 22(3): 1066-1088. DOI:10.1111/1462-2920.14824
(  0) 0) |
| [29] |
Xiong C, Singh B K, He J Z, et al. Plant developmental stage drives the differentiation in ecological role of the maize microbiome[J]. Microbiome, 2021, 9(1): 171. DOI:10.1186/s40168-021-01118-6
(  0) 0) |
| [30] |
Chen Z M, Wang Q, Ma J W, et al. Fungal community composition change and heavy metal accumulation in response to the long-term application of anaerobically digested slurry in a paddy soil[J]. Ecotoxicology and Environmental Safety, 2020, 196: 110453. DOI:10.1016/j.ecoenv.2020.110453
(  0) 0) |
| [31] |
Li F Q, Jin Z L, Wang Z C, et al. Host plant selection imprints structure and assembly of fungal community along the soil-root continuum[J]. mSystems, 2022, 7(4): e0036122. DOI:10.1128/msystems.00361-22
(  0) 0) |
| [32] |
Jiang M B, Wang X H, Liusui Y H, et al. Variation of soil aggregation and intra-aggregate carbon by long-term fertilization with aggregate formation in a grey desert soil[J]. Catena, 2017, 149: 437-445. DOI:10.1016/j.catena.2016.10.021
(  0) 0) |
| [33] |
Song K, Sun Y F, Qin Q, et al. The effects of earthworms on fungal diversity and community structure in farmland soil with returned straw[J]. Frontiers in Microbiology, 2020, 11: 594265. DOI:10.3389/fmicb.2020.594265
(  0) 0) |
| [34] |
Bondarenko S A, Georgieva M L, Bilanenko E N. Alkalitolerant micromycetes in acidic and neutral soils of the temperate zone[J]. Microbiology, 2016, 85(6): 737-744. DOI:10.1134/S0026261716060035
(  0) 0) |
| [35] |
Macia-Vicente J, Glynou K, Piepenbring M. A new species of Exophiala associated with roots[J]. Mycological Progress, 2016, 15(2): 18. DOI:10.1007/s11557-016-1161-4
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


