拟除虫菊酯类农药是人工合成的、类似天然除虫菊素化学结构的农药[1]。目前拟除虫菊酯已成为全球第三大杀虫剂品种[2]。然而,拟除虫菊酯的广泛使用可能引起害虫抗药性增加、农药残留、农产品安全风险以及微生物多样性变化等一系列问题,同时拟除虫菊酯及其代谢物也常在各种环境介质中检出[3]。最近几年,拟除虫菊酯的生殖毒性、神经毒性、遗传毒性、免疫毒性和内分泌干扰作用已被相关研究证实[4-5]。然而,有关拟除虫菊酯对土壤环境及土壤生物的风险评估研究较少。
甲氰菊酯(FEN)作为一种常用的拟除虫菊酯杀虫剂,广泛用于防治水果、蔬菜、棉花和大田作物上的多种害虫。3-苯氧基苯甲酸(3-PBA)是拟除虫菊酯类农药在土壤中降解的主要产物[6],并且3-PBA较母体化合物流动性更强,容易在土壤中造成广泛污染[7],因此,3-PBA可能对土壤环境构成潜在威胁。蚯蚓是土壤生态系统中重要的生物类群,在有机质转化、土壤养分矿化和污染物分解等过程中发挥着重要作用[8]。更为重要的是蚯蚓对环境污染胁迫较敏感,蚯蚓生物标志物能够有效地指示土壤污染水平[9]。据报道,蚯蚓体内很多酶可作为生物标志物[9]。例如,蚯蚓体内催化污染物代谢的代谢酶系:细胞色素P450(CYP450)、羧酸酯酶(CarE)、谷胱甘肽-S-转移酶(GST)等[10],以及抗氧化酶如超氧化物歧化酶(SOD)和过氧化氢酶(CAT)[11]。同时反映氧化损伤程度的丙二醛(MDA)含量也是蚯蚓体内反映土壤环境污染的重要生物标志物[12]。因此测定菊酯类农药暴露后,蚯蚓体内相关酶活性变化可明确农药对土壤环境及土壤生物的环境风险。
本研究拟明确甲氰菊酯在几种不同理化性质土壤中的降解趋势及主要代谢物3-PBA的生成情况,同时探明甲氰菊酯在蚯蚓体内的富集行为,最后明确甲氰菊酯对蚯蚓的生态毒性效应。研究结果对甲氰菊酯在土壤环境中的降解行为研究具有重要的指导意义,同时也为更好地评估拟除虫菊酯类农药的环境风险提供依据。
1 材料与方法 1.1 供试材料与仪器甲氰菊酯(FEN)购自南京红太阳股份有限公司,代谢物3-PBA购自北京百灵威科技有限公司。无水硫酸钠、氯化钠、乙酸乙酯、乙腈均为分析纯,购自重庆悦翔化工有限公司。赤子爱胜蚓(Eisenia fetida),购于青岛瓦力生物科技有限公司。
高效液相色谱仪(Agilent 1260系列,安捷伦科技,美国),恒温培养振荡器(ZWY-240,智诚分析仪器制造有限公司,上海),高速组织捣碎机(齐欣科学仪器有限公司,上海),台式低速离心机(3-5N,恒诺仪器设备有限公司,湖南),旋转蒸发器(RE-52AA,亚荣生化仪器公司,上海)。
1.2 FEN在土壤中的降解及3-PBA生成试验不同理化性质的土壤样品分别采自广西南宁(编号:1)、四川广元(编号:2)、北京海淀(编号:3)、甘肃天水(编号:4)四地(深度为0~10 cm),同时采集的土壤中未检测到FEN残留,土壤理化性质见表 1。土壤风干后过2 mm筛。并选择酸性最强的1号土壤和碱性最强的4号土壤做灭菌处理,分别编号为5号土壤和6号土壤。FEN的污染水平均设置为5 mg·kg–1。染毒土壤于(20±1)℃的培养室中避光培养,分别于0、3、5、7、14、21、28、35和42 d后收集5 g土壤样本(干物质量),每个处理设置3个重复。
|
|
表 1 供试土壤理化性质 Table 1 Physical-chemical properties of tested soils |
实验用土为人工土,由70%(质量分数,下同)石英砂、20%高岭土和10%泥炭藓组成,用碳酸钙调整pH为6.0±0.5。在人工土中添加FEN使其暴露浓度为20 mg·kg–1,加入去离子水调节土壤水分含量为最大持水量的40%(质量分数),然后将蚯蚓放入含药土壤,放置于(20±1)℃、80%~85%湿度和600 lux恒定光照的培养箱中,每周补充蒸发水并提供5 g牛粪。分别于暴露0、3、5、7、10、14、21和28 d取样检测FEN在蚯蚓体内的富集情况,每个处理设置三个重复。生态毒性样品准备与上述过程相似,将FEN在人工土壤中的亚致死暴露浓度设定为0.5 mg·kg–1和5 mg·kg–1。在第3、7、11、14和21天随机收集蚯蚓以测定蛋白质含量和酶活性。
1.4 蚯蚓样品中FEN的提取方法将染毒处理后的蚯蚓清肠3 h,称取5 g放入50 mL离心管,匀浆处理。每管加入20 mL乙酸乙酯、5 g无水硫酸钠和1 g氯化钠,在250 r·min–1下振动30 min,随后超声15 min,接着3 500 r·min–1离心5 min。取上清液,通过10 g无水硫酸钠脱水后转移至旋转蒸发瓶。再向含沉淀的离心管中加入20 mL乙酸乙酯,重复上述步骤一次。合并提取液,土壤样品在35℃旋转蒸发至近干;对于蚯蚓样品,旋转蒸发至1 mL时加入2 mL乙腈和2 mL正己烷,进行液液萃取,弃去正己烷层以去除脂肪,重复3次,将下层乙腈再次旋转蒸发至近干。最后用1 mL乙腈定容,过0.22 μm滤膜后,待HPLC仪器检测。按下述公式计算生物-土壤富集因子(BSAF)。
| $ \text{BSAF} = \frac{{{C_{\text{e}}}}}{{{C_{\text{s}}}}} $ | (1) |
式中,BSAF为生物体从周围土壤中吸收污染物的能力;Ce为蚯蚓体内FEN的浓度,mg·kg–1;Cs为土壤中FEN的浓度,mg·kg–1。
1.5 高效液相色谱(HPLC)分析色谱柱选用C18色谱柱,流动相为V(甲醇):V(水)=90:10,柱流速为0.8 mL·min–1,进样量为10 μL,检测波长为230 nm,柱温为20℃。土壤样品中FEN和3-PBA的平均回收率范围为91.6%~98.57%,在0.05、0.5和5 mg·kg–1的加标水平下,相对标准偏差(RSD)低于5.83%。对于蚯蚓样品,在0.1、0.5和5 mg·kg–1的加标水平下,平均回收率范围为79.45%~88.89%,RSD低于5.12%。土壤和蚯蚓中FEN对映体的检出限(LOD)和最低检测浓度分别为0.02 mg·L–1和0.05 mg·kg–1。检测方法满足土壤和蚯蚓中FEN及3-PBA的检测要求。
1.6 FEN对蚯蚓酶活性的影响试验将不同暴露时间点收集的已清肠蚯蚓在50 mmol·L–1磷酸缓冲盐溶液(pH=7.8,w/v=1/10)中匀浆,然后在4℃下以5 000 r·min–1离心15 min。随后将上清液转移至新管中进行蛋白质含量测定。蛋白质含量采用Bradford法[13]。根据Shang和Soderlund[14]的方法测定细胞色素P450(CYP450)活性。使用van Asperen[15]的方法测定羧酸酯酶(CarE)活性。谷胱甘肽-S-转移酶(GST)活性参考Habig等[16]的方法进行测定。根据Liu等[17]所述的硝基蓝氯化四氮唑(NBT)法测定超氧化物歧化酶(SOD)活性。同样,根据Liu等[17]报道的方法测定过氧化氢酶(CAT)活性。采用硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量[18]。
1.7 数据分析采用Microsoft Excel 2010和SPSS 20.0软件对数据进行分析,并以平均值±标准偏差(Mean±SD)表示。采用单因素方差分析(ANOVA)和最小显著性差异(LSD)法进行差异显著性分析(P < 0.05)。
2 结果与讨论 2.1 FEN在土壤中的降解FEN在非灭菌土壤中的半衰期为24.40~29.49 d,在1号、2号土壤(酸性)中的半衰期大于3号、4号土壤(碱性),而在5号土壤中为103.1 d,在6号土中降解小于5%(表 2)。从图 1可以看出,FEN在非灭菌土壤中的浓度逐渐降低,代谢物3-PBA的含量先升高后降低,而FEN在灭菌土壤中降解较慢。表明FEN在不同土壤中的降解行为与土壤pH和土壤微生物密切相关。微生物的存在会促进FEN降解[19],同时代谢物3-PBA先升高后降低,表明3-PBA自身在土壤中也存在降解[20]。
|
|
表 2 甲氰菊酯(FEN)在土壤中降解的一阶速率常数(k)、半衰期(t1/2)和决定系数(R2) Table 2 The first-order rate constant(k), half-life(t1/2), and decision coefficient(R2) of fenpropathrin(FEN) degradation in soil |
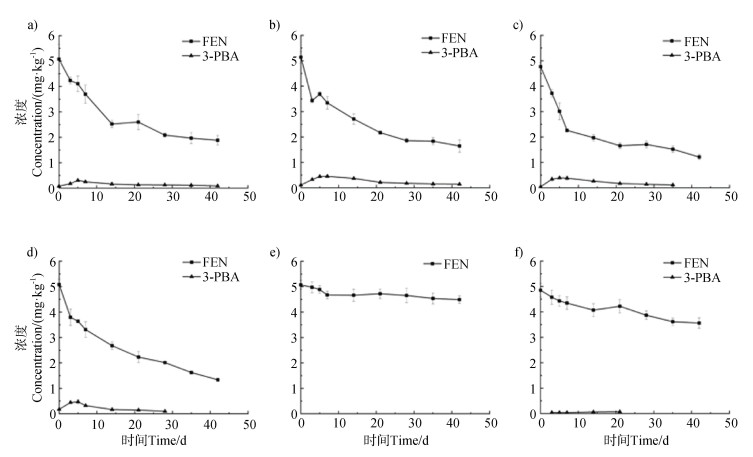
|
注:图a为1号(广西南宁)土壤,图b为2号(四川广元)土壤,图c为3号(北京海淀)土壤,图d为4号(甘肃天水)土壤,图e为5号(广西南宁灭菌)土壤,图f为6号(甘肃天水灭菌)土壤。 Note: Figure a shows soil No. 1(Nanning, Guangxi), figure b shows soil No. 2(Guangyuan, Sichuan), figure c shows soil No. 3(Haidian, Beijing), figure d shows soil No. 4(Tianshui, Gansu), figure e shows soil No. 5(Nanning, Guangxi sterilization) and figure f shows soil No. 6(Tianshui, Gansu sterilization). 图 1 甲氰菊酯(FEN)的降解曲线及其代谢物3-苯氧基苯甲酸(3-PBA)在土壤中的形成 Fig. 1 Degradation curves of fenpropathrin(FEN) and formation of its metabolite 3-Phenoxybenzoic acid(3-PBA) in soils |
如图 2 a、图 2 b所示,在培养初期,FEN在蚯蚓体内迅速增加,在第7天左右达到最大值,最大富集因子为0.3,其中富集速率的降低可能是由于已累积的FEN对蚯蚓的毒性效应所致[21]。7 d之后,FEN在蚯蚓体内的浓度逐渐降低,这可能是由于蚯蚓对污染物代谢转化能力的增强所致[22]。因此,蚯蚓对FEN的富集呈现峰形富集曲线,这与报道的氰戊菊酯在蚯蚓中的富集曲线[23]类似。暴露期间蚯蚓蛋白质含量变化见图 2 c。在第14天和第21天,FEN暴露组蛋白含量显著低于对照组(P < 0.05),且随暴露浓度增加这种差异加大。进一步说明FEN对蚯蚓具有生长抑制作用,且存在剂量效应。
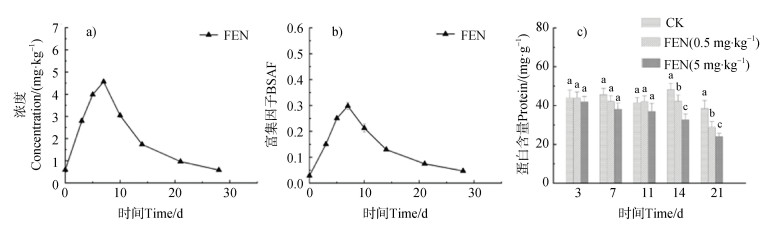
|
注:CK为空白对照组,土壤中未添加FEN。 Note: CK was a blank control group, in which the soil was not supplemented with FEN. 图 2 FEN在蚯蚓组织中的富集曲线(a)和生物-土壤富集因子(BSAF)曲线(b)以及FEN暴露对蚯蚓蛋白质含量的影响(c) Fig. 2 Enrichment curves of FEN in earthworm tissues(a) and biota soil accumulation factor(BASF) curves(b) and the effect of FEN exposure on the protein content of earthworms(c) |
酶活性研究表明,蚯蚓暴露于FEN后,体内CYP450活性从第7天开始显著增加(P < 0.05)(图 3 a)。对于CarE活性,在第14天首次观察到显著增加(P < 0.05),这种显著差异一直持续到暴露结束(图 3 b)。GST活性也在第14天显著增加(P < 0.05)(图 3 c)。这些解毒酶活性的增加可能是由于蚯蚓通过激活解毒机制来代谢污染物所致[24]。对于SOD活性,5 mg·kg–1 FEN暴露组从第7天开始显著增加(P < 0.05)(图 3 d)。CAT活性在暴露初期(11 d)未改变,第14天显著增加(P < 0.05)(图 3 e)。在第21天5 mg·kg–1 FEN暴露组SOD、CAT活性显著高于0.5 mg·kg–1 FEN暴露组(P < 0.05)。说明随着暴露时间和暴露剂量的增加,FEN诱导了活性氧(ROS)的过量生成,导致了蚯蚓体内的氧化应激反应。其中,SOD先通过将多余的
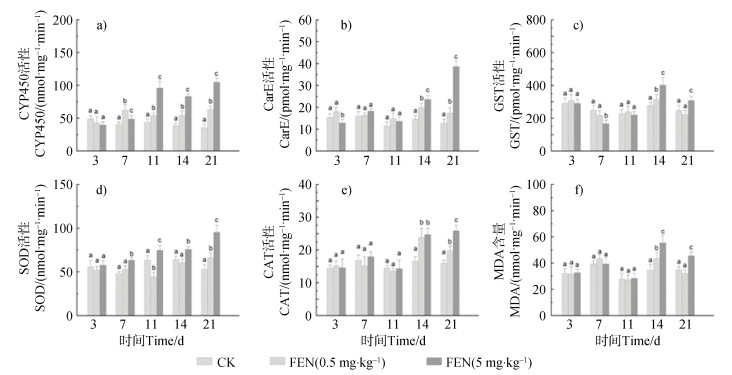
|
注:数据为一式三份的平均值±标准偏差(SD)。不同的小写字母表示相同时间的处理之间差异显著(P < 0.05)。 Note: Data are expressed as mean ± standard deviation(SD) in triplicate. Different letters indicate significant differences between treatments(P < 0.05). 图 3 FEN对细胞色素P450(CYP450,a)、羧酸酯酶(CarE,b)、谷胱甘肽-S-转移酶(GST,c)、抗氧化酶如超氧化物歧化酶(SOD,d)、过氧化氢酶(CAT,e)和丙二醛(MDA,f)含量的影响 Fig. 3 Effects of FEN on the cytochrome P450(CYP450, a), carboxylesterase(CarE, b), glutathione-S-transferase(GST, c), superoxide dismutase(SOD, d), catalase(CAT, e) activities and malondialdehyde(MDA, f) contents |
综合生物标志物响应指数(IBR)能将不同生物标志物进行综合分析,反映环境污染物对生物体的影响,IBR越大表明生物所受影响越大[27]。在FEN暴露第14天和第21天,蚯蚓的IBR分析结果如图 4,其中星状图中同一线型围成的三角形面积即为IBR值。结果表明,高剂量(5 mg·kg–1)暴露下,由CYP450、CarE、GST和SOD、CAT、MDA分别计算得到的IBR显著高于低剂量(0.5 mg·kg–1)处理组,表明FEN对蚯蚓毒性效应存在剂量效应,即高浓度的FEN对蚯蚓生态毒性更大。
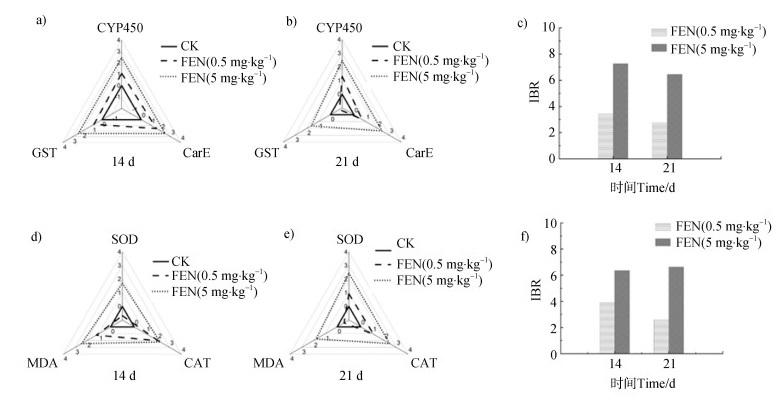
|
注:每个星图中的黑色实线是基线(归一化值为0),而激活或抑制效应已在基线的外部或内部被引用。 Note: The solid black line in each star chart is the baseline(normalized value = 0), while the activation or inhibition effects have been referenced outside or inside the baseline. 图 4 FEN暴露的雷达图(14 d和21 d,0.5 mg·kg–1和5 mg·kg–1)和基于相应生物标志物的综合生物标志物反应指数(IBR)(c基于CYP450、CarE、GST;f基于SOD、CAT、MDA) Fig. 4 Radar plots of FEN exposure(14 and 21 days, 0.5 mg·kg–1 and 5 mg·kg–1), and integrated biomarker response index(IBR) based on corresponding biomarkers(c based on CYP450, CarE, GST; f based on SOD, CAT, MDA) |
本研究明确了甲氰菊酯在土壤中的降解行为以及对蚯蚓的生态毒性效应。在FEN的降解过程中,土壤pH和土壤微生物是重要的影响因素,FEN在碱性土壤和非灭菌土壤中更容易降解。在FEN降解过程中,检测到代谢物3-PBA的生成,同时代谢物3-PBA含量先升高后降低,因此在评估农药对土壤生物的影响时,其代谢物也需要重点关注。通过评估FEN在蚯蚓体内的富集行为和对蚯蚓生物标志物的影响,证实了FEN暴露后抑制蚯蚓生长,并诱导氧化应激效应。本文结果有助于更好地评估甲氰菊酯的环境风险,为全面评价拟除虫菊酯类农药提供数据支持。
| [1] |
Casida J E, Quistad G B. Golden age of insecticide research: Past, present, or future?[J]. Annual Review of Entomology, 1998, 43: 1-16. DOI:10.1146/annurev.ento.43.1.1
(  0) 0) |
| [2] |
Zhu Q Y, Yang Y, Zhong Y Y, et al. Synthesis, insecticidal activity, resistance, photodegradation and toxicity of pyrethroids(a review)[J]. Chemosphere, 2020, 254: 126779. DOI:10.1016/j.chemosphere.2020.126779
(  0) 0) |
| [3] |
Li H Z, Wei Y L, Lydy M J, et al. Inter-compartmental transport of organophosphate and pyrethroid pesticides in South China: Implications for a regional risk assessment[J]. Environmental Pollution, 2014, 190: 19-26. DOI:10.1016/j.envpol.2014.03.013
(  0) 0) |
| [4] |
Ma X C, Zhang W, Song J Y, et al. Lifelong exposure to pyrethroid insecticide cypermethrin at environmentally relevant doses causes primary ovarian insufficiency in female mice[J]. Environmental Pollution, 2022, 298: 118839. DOI:10.1016/j.envpol.2022.118839
(  0) 0) |
| [5] |
Jurewicz J, Radwan P, Wielgomas B, et al. Exposure to pyrethroid pesticides and ovarian reserve[J]. Environment International, 2020, 144: 106028. DOI:10.1016/j.envint.2020.106028
(  0) 0) |
| [6] |
Miyamoto J, Beynon K I, Roberts T R, et al. ChemInform abstract: The chemistry, metabolism and residue analysis of synthetic pyrethroids(107 literaturzitate)[J]. Chemischer Informationsdienst, 1981, 53(10): 1967-2022.
(  0) 0) |
| [7] |
Zhao T Y, Hu K D, Li J L, et al. Current insights into the microbial degradation for pyrethroids: Strain safety, biochemical pathway, and genetic engineering[J]. Chemosphere, 2021, 279: 130542. DOI:10.1016/j.chemosphere.2021.130542
(  0) 0) |
| [8] |
Datta S, Singh J, Singh S, et al. Earthworms, pesticides and sustainable agriculture: A review[J]. Environmental Science and Pollution Research International, 2016, 23(9): 8227-8243. DOI:10.1007/s11356-016-6375-0
(  0) 0) |
| [9] |
Guo J W, Zhou S P, Liu S Q, et al. Advances in application of earthworm biomarkers in monitoring soil ecosystem (In Chinese)[J]. Asian Journal of Ecotoxicology, 2020, 15(5): 69-81. [郭佳葳, 周世萍, 刘守庆, 等. 蚯蚓生物标志物在土壤生态系统监测中的应用研究进展[J]. 生态毒理学报, 2020, 15(5): 69-81.]
(  0) 0) |
| [10] |
Jiang L L, Ling S Y, Fu M R, et al. Bioaccumulation, elimination and metabolism in earthworms and microbial indices responses after exposure to decabromodiphenyl ethane in a soil-earthworm-microbe system[J]. Environmental Pollution, 2021, 289: 117965. DOI:10.1016/j.envpol.2021.117965
(  0) 0) |
| [11] |
Cheng Y L, Zhu L S, Song W H, et al. Combined effects of mulch film-derived microplastics and atrazine on oxidative stress and gene expression in earthworm(Eisenia fetida)[J]. Science of the Total Environment, 2020, 746: 141280. DOI:10.1016/j.scitotenv.2020.141280
(  0) 0) |
| [12] |
[12] Liu T, Chen D, Li Y Q, et al. Enantioselective bioaccumulation and toxicity of the neonicotinoid insecticide dinotefuran in earthworms(Eisenia fetida)[J]. Journal of Agricultural and Food Chemistry, 2018, 66(17): 4531-4540. DOI:10.1021/acs.jafc.8b00285
(  0) 0) |
| [13] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254. DOI:10.1016/0003-2697(76)90527-3
(  0) 0) |
| [14] |
Shang C C, Soderlund D M. Monooxygenase activity of tobacco budworm(Heliothis virescens F.) larvae: Tissue distribution and optimal assay conditions for the gut activity[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1984, 79(3): 407-411. DOI:10.1016/0305-0491(84)90396-1
(  0) 0) |
| [15] |
van Asperen K. A study of housefly esterases by means of a sensitive colorimetric method[J]. Journal of Insect Physiology, 1962, 8(4): 401-416. DOI:10.1016/0022-1910(62)90074-4
(  0) 0) |
| [16] |
Habig W H, Pabst M J, Jakoby W B. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation[J]. Journal of Biological Chemistry, 1974, 249(22): 7130-7139. DOI:10.1016/S0021-9258(19)42083-8
(  0) 0) |
| [17] |
Liu Y L, Fang K, Zhang X L, et al. Enantioselective toxicity and oxidative stress effects of acetochlor on earthworms(Eisenia fetida) by mediating the signaling pathway[J]. Science of the Total Environment, 2021, 766: 142630. DOI:10.1016/j.scitotenv.2020.142630
(  0) 0) |
| [18] |
Zhang S S, Ding J N, Razanajatovo R M, et al. Interactive effects of polystyrene microplastics and roxithromycin on bioaccumulation and biochemical status in the freshwater fish red tilapia(Oreochromis niloticus)[J]. Science of the Total Environment, 2019, 648: 1431-1439. DOI:10.1016/j.scitotenv.2018.08.266
(  0) 0) |
| [19] |
Tan X P, He J H, Guo Z M, et al. Progress of soil enzyme response to heavy metal pollution and its indication (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(1): 50-62. [谭向平, 何金红, 郭志明, 等. 土壤酶对重金属污染的响应及指示研究进展[J]. 土壤学报, 2023, 60(1): 50-62.]
(  0) 0) |
| [20] |
Xu Y X, Li X H, Teng Q H, et al. Microbial remediation of cypermethrin-contaminated soil and effect on soil microbial communities (In Chinese)[J]. Acta Pedologica Sinica, 2008, 45(4): 693-698. [许育新, 李晓慧, 滕齐辉, 等. 氯氰菊酯污染土壤的微生物修复及对土著微生物的影响[J]. 土壤学报, 2008, 45(4): 693-698.]
(  0) 0) |
| [21] |
Yang G B, Zhou S P, Xiong Z P, et al. Bioaccumulation of chlorpyrifos in earthworm and its growth under different soil pollution conditions (In Chinese)[J]. Chinese Journal of Soil Science, 2021, 52(4): 920-926. [杨广斌, 周世萍, 熊张平, 等. 不同污染条件下毒死蜱在蚯蚓体内的蓄积特征及其生长影响[J]. 土壤通报, 2021, 52(4): 920-926.]
(  0) 0) |
| [22] |
Zhao S Y, Zhu L Y. Uptake and metabolism of 10: 2 fluorotelomer alcohol in soil-earthworm(Eisenia fetida) and soil-wheat(Triticum aestivum L.) systems[J]. Environmental Pollution, 2017, 220: 124-131. DOI:10.1016/j.envpol.2016.09.030
(  0) 0) |
| [23] |
Ye X Q, Xiong K, Liu J. Comparative toxicity and bioaccumulation of fenvalerate and esfenvalerate to earthworm Eisenia fetida[J]. Journal of Hazardous Materials, 2016, 310: 82-88. DOI:10.1016/j.jhazmat.2016.02.010
(  0) 0) |
| [24] |
Fang K, Han L X, Liu Y L, et al. Enantioselective bioaccumulation and detoxification mechanisms of earthworms(Eisenia fetida) exposed to mandipropamid[J]. Science of the Total Environment, 2021, 796: 149051. DOI:10.1016/j.scitotenv.2021.149051
(  0) 0) |
| [25] |
Liu T, Wang X G, Xu J L, et al. Biochemical and genetic toxicity of dinotefuran on earthworms(Eisenia fetida)[J]. Chemosphere, 2017, 176: 156-164. DOI:10.1016/j.chemosphere.2017.02.113
(  0) 0) |
| [26] |
Li X, Zhu L, Du Z, et al. Mesotrione-induced oxidative stress and DNA damage in earthworms(Eisenia fetida)[J]. Ecological Indicators, 2018, 95: 436-443. DOI:10.1016/j.ecolind.2018.08.001
(  0) 0) |
| [27] |
Xu Q X, Pan Y Y, Yang T T, et al. Oxidative stress effect of razor clams(Sinonovacula constricta) on intertidal crude oil pollution and its IBR evaluation (In Chinese)[J]. Chinese Environmental Science, 2023, 43(1): 328-340. [徐青霞, 潘玉英, 杨婷婷, 等. 缢蛏(Sinonovacula constricta)对潮间带原油污染的氧化应激效应及其IBR评价[J]. 中国环境科学, 2023, 43(1): 328-340.]
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


