2. 福建省林业科学研究院, 福州 350012;
3. 福建省洋口国有林场, 福建顺昌 353211;
4. 南京师范大学地理科学学院, 南京 210023
2. Fujian Academy of Forestry Sciences, Fuzhou 350012, China;
3. Yangkou National Forest Farm of Fujian, Shunchang, Fujian 353211, China;
4. School of Geographic Sciences, Nanjing Normal University, Nanjing 210023, China
氮(N)是植物生长的关键营养元素之一。在未施肥的森林生态系统中,土壤供氮能力在为植物生长提供足够的氮素方面起到至关重要的作用。土壤氮素供应能力的大小是由一系列微生物调控的氮素转化过程所控制[1-2],如矿化、硝化和微生物同化等。矿化作用是将土壤有机氮转化为无机氮的过程,也是森林生态系统产生可被植物直接吸收利用的无机氮的主要过程[3],因此矿化作用的强弱决定了森林土壤中可供植物和微生物利用的氮素有效性高低。矿化产生的铵态氮又会被硝化微生物氧化为硝态氮,即硝化作用。硝化过程中伴随着气态氮(如温室气体N2O)损失,其终产物硝态氮因带负电不易被土壤胶体吸附,因而易淋失至地表水或通过淋溶进入地下水导致水体硝酸盐污染,也可能在局部厌氧环境中通过反硝化脱氮产生N2O、NO等气态氮进而污染大气,所以硝化作用是土壤中重要的氮损失关联途径。因此,研究森林生态系统土壤氮素矿化和硝化作用对植物生长以及生态环境保护具有重要意义。
森林生态系统土壤的矿化和硝化作用会受到土壤有机质的数量和质量、土壤微生物组成和多样性以及pH等多种因素的影响[3-4]。通常,土壤的碳、氮含量可有效预测矿化作用强度,如大量研究表明矿化速率与土壤全氮含量呈显著正相关关系[5],这反映了底物有效性在调控土壤无机氮产生过程中的重要性;矿化速率也与土壤有机碳含量显著相关[6],这主要是土壤中碳氮含量间存在协方差关系的结果。然而,硝化速率与土壤碳氮含量的相关关系主要在矿化速率较高的土壤中较为明显,这是因为硝化作用强度在很大程度上取决于矿化速率的高低[7-8],矿化速率高则可为硝化微生物提供更多底物(铵态氮)进而刺激硝化作用的进行。此外,土壤pH也是调节土壤氮素转化过程的重要因素,一般而言,硝化作用强度通常与土壤pH呈显著正相关关系[9],而在pH < 5的酸性土壤中则不发生硝化过程[10]。矿化速率也与土壤pH呈正相关关系[11],但其对土壤pH的变化不如对硝化作用敏感。由此可见,森林生态系统的氮素转化特征受到多种因素的影响,其内在影响机制尚有待进一步研究。
杉木(Cunninghamia lanceolata(Lamb))作为我国南方重要的经济树种,其具有速生、优质和适应性强等特性。第九次全国森林资源清查显示,杉木栽培面积达990万hm2,蓄积量达7.55亿m3,分占全国人工乔木林总面积、总蓄积量的1/4和1/3,均排名第一[12]。最近几十年内,为了满足日益增长的木材需求,人们致力于培育速生、优质的杉木人工林品种,但在此阶段内常伴随着因人工林面积扩大以及集约化经营而导致的土壤养分含量损失、地力衰退和林地生产力降低等土壤退化和生态环境问题。与此同时,这些问题又会反过来影响杉木人工林土壤的养分供应状况,特别是对不同土壤的氮素供应与转化水平造成影响。近年来,有研究从林龄、林型、间伐等因素对杉木人工林土壤养分循环,尤其是土壤氮素循环的影响方面进行了研究[13-14],但鲜有从种内水平关注不同无性系对杉木人工林土壤氮素转化特征的影响。因为不同无性系杉木人工林品种在栽培生物学上具有显著差异,不同无性系的扦插生根以及对土壤养分的利用能力各不相同,这就面临着不同无性系在推广栽培过程中的选择性难题。本研究以福建省洋口国有林场6个无性系和1个第2代良种的14年生杉木人工林土壤为对象,通过室内培养试验探究不同无性系杉木对土壤中无机氮动态、矿化作用和硝化作用的影响,以期为杉木无性系选育和合理栽培提供理论依据。
1 材料与方法 1.1 采样区概况与供试土壤采集供试土壤为燕山晚期白云母化中细粒花岗岩发育的山地暗红壤,质地为砂质粉壤土,位于福建省南平市顺昌县洋口林场国家杉木良种基地(26°30′N~28°20′N,117°00′E~119°25′E)(图 1)。该地区系武夷山系的低山丘陵地貌,属于典型的中亚热带湿润季风气候,雨量充沛,光照丰富,该地降雨多集中在3—8月,平均降雨量为1 756 mm,年平均气温在18~20℃之间,绝对最高温度39℃,绝对最低温度–4℃,无霜期280 d,相对湿度82%,年均蒸发量为1 413 mm。本研究选择的是2007年2月营造的杉木无性系测定林。造林前,林地经过炼山、清杂、挖明穴、回表土等管理措施,造林密度为每公顷2 500株,即株行距为2.0 m×2.0 m。无性系杉木人工林栽培包括3个空间重复,共21个小区,每个小区面积为667 m2,小区间栽植2列或行隔离树种,在杉木生长期间未进行任何施肥和管理。参试的无性系杉木人工林共计7个处理,分为5个杉木无性系、1个无性系混系和1个杉木第2代良种(对照),具体为:洋003无性系,简称Y003;洋008无性系,简称Y008;洋020无性系,简称Y020;洋061无性系,简称Y061;洋062无性系,简称Y062;福建省洋口林场第2代种子园良种,简称Ysec;福建省洋口国有林场无性系混系扦插苗,简称Ymix。
|
图 1 福建省洋口国有林场地理位置 Fig. 1 Geographical location of Yangkou National Forest Farm of Fujian |
供试土壤采自2021年7月,主要采集每个小区表层土壤样品(0~20 cm),均采用五点采样法采集5个子样品并均匀混合为一个样品,每小区采集土壤2.5 kg左右。采集的新鲜土壤即刻去除可见的植物残体和石块等,在室内环境下混匀、磨细并过2 mm筛,于4℃冰箱中储存备用。不同无性系杉木人工林土壤的主要理化性质详见表 1。
|
|
表 1 供试土壤的主要理化性质 Table 1 Physico-chemical properties of tested soil |
本研究采用实验室连续培养方法测定不同培养时间土壤无机氮含量变化,进而计算土壤氮素净转化速率。具体步骤如下:7种土壤均称取相当于20 g烘干土的鲜土置于250 mL三角瓶中,每种土壤样品3个空间重复,共计6次取样,每次取样设置3次重复,共计7×3×6×3=378瓶。称重法滴加蒸馏水将三角瓶中土壤水分含量调节至60%最大持水量(WHC),用封口膜将三角瓶口封紧,在封口膜上扎4个孔利于透气,置于25±1℃恒温培养箱中培养28 d。培养期间,每隔3 d采用称重法用滴管补充土壤蒸发损失的水分,保持土壤含水量在60% WHC。分别在培养的0.5 h、3 d、7 d、14 d、21 d和28 d随机取出每种土壤的3个样品作为重复进行破坏性取样。按液土比为5:1加入100 mL的2 mol·L–1 KCl溶液,恒温振荡1 h后过滤,将滤液收集在100 mL塑料瓶中,测定滤液中铵态氮(
土壤
土壤氮素净氮矿化速率(M,mg·kg–1·d–1)和净硝化速率(N,mg·kg–1·d–1)分别按照下列公式计算:
| $ M =[( {\text{NH}}_4^ + + {\text{NO}}_3^ - )_\text{t} –( {\text{NH}}_4^ + + {\text{NO}}_3^ - )_\text{t0}]/(t–t_{0}) $ | (1) |
| $ N =[( {\text{NO}}_3^ - )_\text{t}–( {\text{NO}}_3^ - )_\text{t0}]/(t–t_{0}) $ | (2) |
式中,(
采用SPSS22.0软件和SIMCA 13.0软件对数据进行方差分析和相关性分析,用LSD(最小显著性差异)方法分析处理间差异显著性(P < 0.05)、PLSR(偏最小二乘回归)方法进行回归分析,采用OriginPro 2018软件和Arc Gis 10.7软件做图。
2 结果 2.1 不同无性系杉木人工林土壤的主要理化性质不同无性系杉木人工林土壤的pH在4.63~4.80之间,且不同无性系间无显著差异,表明不同无性系并未显著影响土壤pH(表 1)。所有无性系杉木人工林土壤的铵态氮含量(5.75~7.85 mg·kg–1)显著高于硝态氮含量(P < 0.05),铵态氮与硝态氮的比值均大于1(变化范围为2.82~6.03),表明不同无性系杉木人工林土壤的无机氮均以铵态氮为主,这与测得的土壤为酸性的结果相一致。与Y003相比,Ymix显著提高了杉木人工林土壤的有机碳含量(P < 0.05),但与Y008、Y020、Y061、Y062和Ysec间无显著差异,表明Ymix对杉木人工林土壤中有机碳积累的促进作用最强,Y008、Y020、Y061、Y062和Ysec次之。不同无性系杉木人工林土壤全氮含量按Ymix、Y020、Ysec、Y061、Y008、Y062、Y003的顺序依次降低,其中Ymix处理杉木人工林土壤的全氮含量最高,为1.46 g·kg–1,显著高于Y062、Y008和Y003(P < 0.05),与Y020、Y061和Ysec间无显著差异。不同无性系杉木人工林土壤的C/N间差异不显著。
2.2 不同无性系杉木人工林土壤中无机氮含量变化培养过程中不同无性系杉木人工林土壤铵态氮含量的动态变化如图 2a所示。由图 2a可知,不同无性系杉木人工林土壤

|
图 2 不同无性系杉木人工林土壤铵态氮(a)和硝态氮(b)含量变化 Fig. 2 Dynamics of ammonium(a) and nitrate(b) in soil with different clones |
与土壤中
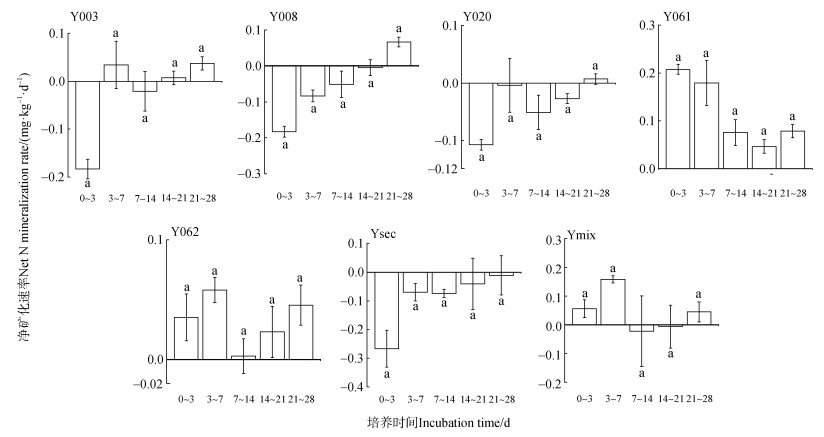
如图 3所示,不同无性系杉木人工林土壤的净矿化速率均较低,培养期间平均净矿化速率在–0.093~0.118 mg·kg–1·d–1范围内,表明杉木人工林土壤的有机氮矿化能力较弱,供氮水平较低。但不同无性系杉木人工林对土壤净矿化速率的影响存在明显差异。在培养期间,Y061和Y062两种无性系杉木人工林土壤净矿化速率在培养期间均为正值,且显著高于其他无性系杉木人工林土壤(P < 0.05),表明这两种无性系相较于其他无性系杉木人工林更有利于促进土壤有机氮矿化。Ymix土壤的净矿化速率除7~14 d为负值(–0.02 mg·kg–1·d–1)外,其他阶段均为正值,这就表明培养期间该无性系土壤有机氮矿化与无机氮同化之间在相互转化;与之相反的是,Ysec土壤净矿化速率为负值,其变化范围在–2.6 mg·kg–1·d–1至0 mg·kg–1·d–1,表明该无性系更利于促进杉木人工林土壤无机氮同化。Y008和Y020两种无性系杉木人工林土壤净矿化速率在培养的前21 d均为负值,但当培养到第28天时为正值(分别为0.07和0.007 mg·kg–1·d–1),表明这两种无性系杉木人工林土壤在前期促进了土壤无机氮的同化,后期则有促进有机氮矿化的趋势。Y003处理仅在0~3 d时间段内表现出明显的无机氮同化(净矿化速率为–0.18 mg·kg–1·d–1),而其他时间段的净矿化速率均约等于零(–0.02~0.03 mg·kg–1·d–1),表明该土壤有机氮的矿化即土壤的供氮能力处于较低水平。
|
注:图中不同小写字母表示差异显著(P < 0.05)。下同。 Note: Different lowercase letters in the figure indicate significant differences(P < 0.05). The same as below. 图 3 不同无性系杉木人工林土壤净矿化速率变化 Fig. 3 The net N mineralization rates of soil with different clones |
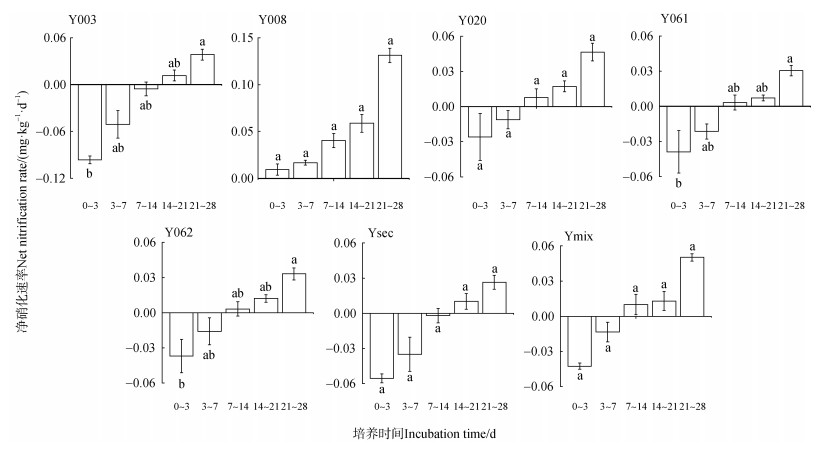
与净矿化速率相似,不同无性系杉木人工林土壤的净硝化速率也均处于较低水平,在–0.021~0.051 mg·kg–1·d–1范围内,表明杉木人工林土壤具有较低的硝化能力,这可能与杉木人工林较低的土壤pH有关。此外,不同无性系间杉木人工林土壤的净硝化速率有明显差异(图 4)。在培养期间,所有无性系杉木人工林土壤的净硝化速率均随培养时间延长而提高,表明土壤铵态氮在被持续氧化为硝态氮。对于Y008而言,其净硝化速率在各个时间段均为正值,且显著高于其他无性系(P < 0.05),且在14~28 d内的净硝化速率达到0.14 mg·kg–1·d–1,这表明Y008最易引起无性系杉木人工林土壤中硝态氮累积,进而硝酸盐淋溶及气态氮损失风险的潜力也最大。相反,Y061、Y062和Ysec等3种无性系杉木人工林土壤的净硝化速率均在0.03 mg·kg–1·d–1以下,显著低于其他无性系(P < 0.05),表明这三种无性系杉木人工林土壤硝化能力较弱,也相应地降低了土壤中硝态氮的累积风险。与Y061、Y062和Ysec相似,Y003、Y020和Ymix等3种无性系杉木人工林土壤在培养前期主要以无机氮的同化为主,但在21~28 d时净硝化速率有提高趋势,均在0.04 mg·kg–1·d–1以上,也就意味着培养后期硝态氮累积风险也随之提高。
|
图 4 不同无性系杉木人工林土壤净硝化速率变化 Fig. 4 The net nitrification rates of soil with different clones |
在外源氮输入较低、降雨量较高条件下的森林生态系统中,要保持有限的氮素必须降低氮的各种输出,如淋溶或气态氮损失等[16],其可能的内在机制有:(1)降低无机氮产生速率和
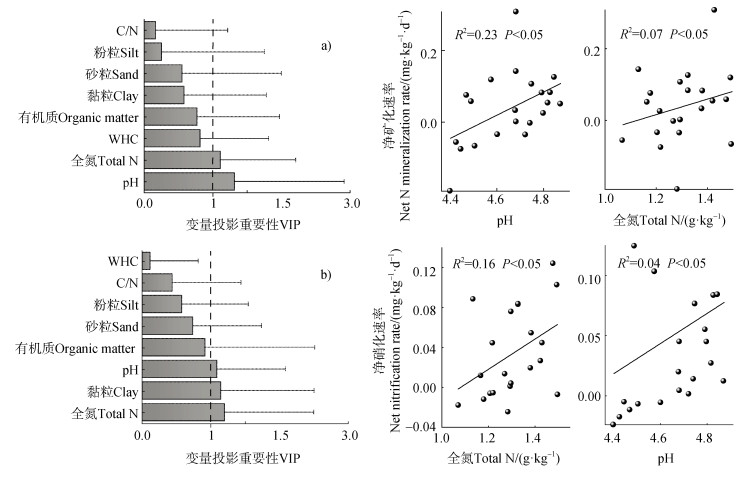
尽管本研究发现不同无性系杉木人工林土壤的净矿化速率均较低,但其净矿化速率间仍存在显著差异,研究结果表明,不同无性系杉木人工林土壤具有不同的净矿化速率(图 3)。一般地,土壤氮素矿化速率与土壤有机碳和全氮含量呈正相关关系[3]。在本研究中,所有无性系杉木人工林土壤有机质(37~48 g·kg–1)和全氮(1.1~1.5 g·kg–1)含量均较低(表 1),这也就预示不同无性系杉木人工林土壤净氮矿化量和净硝化量较低。通过回归分析发现,净矿化速率与全氮之间的相关性显著高于有机质(图 5),这可能是杉木人工林土壤氮素循环缓慢,土壤微生物系统对有机氮的转换能力较弱的结果。对土壤净矿化速率产生影响的最显著因子是土壤全氮含量(图 5a),Y003、Y008、Y020和Ysec等多种无性系杉木人工林土壤在培养期间的平均净氮矿化速率为负值,表明土壤有机氮的矿化低于微生物对有机氮的固定,表现为氮的固持,这与李平等[22]发现不施用氮肥的林地土壤净矿化速率结果一致。该结果表明上述几种无性系对于土壤有效氮的利用率较低,而土壤氮素的损失风险值得注意。针叶林的特性导致凋落物分解速率较低,难以为土壤提供足够的有机质,土壤微生物活性较低,这可能也是导致杉木人工林土壤供氮能力较弱的一个重要原因[20]。此外,研究发现土壤pH对净氮矿化速率也有重要影响(R2=0.23,P < 0.05,图 5)。李辉信等[23]认为土壤pH与红壤净矿化速率具有显著的正相关关系,本研究中的7种无性系均栽培于酸性较高的土壤条件下,由表 1可知,Y062土壤pH显著高于其他无性系,且其在培养期间的平均净矿化速率显著高于其他无性系。酸性较高的土壤条件(pH < 5.0)下,矿化作用会受到抑制[23]。本研究中7种无性系杉木人工林土壤pH均在5.0以下(表 1),土壤氮净矿化速率可能受到了一定的抑制作用。土壤质地也通过影响土壤孔隙度和颗粒组成进而改变土壤空气和水分的循环过程、土壤微生物结构与组成等,进一步影响土壤氮素转化过程[24–25]。通常情况下,粉壤土矿化作用高于砂土和黏土[26],这也与本研究结果一致,Y008、Y020和Ysec等3种无性系杉木人工林土壤粉粒占比最低且净矿化速率略低于其余4种无性系(表 1,图 3),表明这3种土壤供氮能力较弱,为无性系杉木人工林提供有效氮的数量较低,实际栽培中应适当进行氮肥的施用。
|
图 5 净矿化速率(a)和净硝化速率(b)与基本理化性质之间回归分析与拟合关系 Fig. 5 Regression analysis and the fitting relationship between net mineralization rate(a) and net nitrification rate(b) and basic physicochemical properties |
本研究中不同无性系杉木人工林土壤净硝化速率在培养期间呈现明显上升趋势,但是在培养结束时净硝化速率仅在0.02~0.15 mg·kg–1·d–1范围内,陈瑞等[20]通过23 d的培养试验表明:不同林龄杉木人工林土壤净硝化速率均在0~1.5 mg·kg–1·d–1范围内,且随林龄的增长而升高,这与本文中的试验结果(图 4)相近。朱祥妹等[27]利用短期培养实验也发现,福建北部杉木人工林土壤净硝化速率在–0.1~0.1 mg kg–1 d–1之间,与本文中的研究结果(图 4)相近。Zhang等[28]的培养实验发现江西原始针叶林生态系统土壤总硝化速率在1.03 mg kg–1 d–1,显著高于本研究结果。这就表明林型与林龄之间的差异会导致土壤净硝化速率间的显著差异,本研究中的7种无性系杉木为15年生人工林,随着林龄的增长,其土壤净硝化速率可能会显著升高,随着林龄的增长硝化细菌活性的增强和群落结构的改变可能是导致土壤硝化作用增强的主要原因。
通常情况下,硝化作用强弱可以通过土壤中
本研究发现不同无性系杉木人工林显著影响土壤氮素转化过程。所有无性系杉木人工林土壤净转化速率均较低,通过对比发现,Y061和Y062两种无性系杉木人工林土壤净矿化速率显著高于其他无性系,说明该两种土壤有效氮素供应能力高于其他无性系,具有大面积推广栽培的种间优势。另一方面,研究发现Y008土壤净硝化速率显著高于其他无性系,表明该土壤在培养期间硝态氮的累积与淋溶损失风险高于其他无性系,在良种推广方面需要注意的是土壤氮素的有效保留问题。不同无性系杉木人工林对土壤基本理化性质具有显著影响,主要体现在土壤全氮含量、土壤pH以及土壤黏粒组分等方面,其他理化性质在无性系间并无显著差异。在之后的研究中会进一步考虑原位森林生态系统中的各种影响因素,为不同无性系良种的选育推广提供更有效的依据。
| [1] |
Fang J, Weng Y N, Li B E, et al. Graphene oxide decreases the abundance of nitrogen cycling microbes and slows nitrogen transformation in soils[J]. Chemosphere, 2022, 309: 136642. DOI:10.1016/j.chemosphere.2022.136642
(  0) 0) |
| [2] |
Li D J, Liu J, Chen H, et al. Soil gross nitrogen transformations in responses to land use conversion in a subtropical Karst region[J]. Journal of Environmental Management, 2018, 212: 1-7.
(  0) 0) |
| [3] |
Xu J S, Su X, Jia Z P, et al. Effects of warming on soil nitrogen transformation rates, microbial biomass carbon and nitrogen and enzyme activity in crust-covered soil system (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(3): 788-797. [徐军山, 苏雪, 贾志鹏, 等. 增温对结皮土壤系统氮转化速率及微生物生物量碳氮与酶活性的影响[J]. 土壤学报, 2021, 58(3): 788-797.]
(  0) 0) |
| [4] |
Elrys A S, Wang J, Metwally M A S, et al. Global gross nitrification rates are dominantly driven by soil carbon‐to‐nitrogen stoichiometry and total nitrogen[J]. Global Change Biology, 2021, 27(24): 6512-6524. DOI:10.1111/gcb.15883
(  0) 0) |
| [5] |
Hardo B, Jürgen A, Mats V, et al. Annual net nitrogen mineralization and litter flux in well-drained downy birch, Norway spruce and Scots pine forest ecosystems[J]. Silva Fennica, 2018, 52(4): 10013.
(  0) 0) |
| [6] |
Elrys A S, Ali A, Zhang H M, et al. Patterns and drivers of global gross nitrogen mineralization in soils[J]. Global Change Biology, 2021, 27(22): 5950-5962. DOI:10.1111/gcb.15851
(  0) 0) |
| [7] |
Zhao W, Zhang J B, Müller C. Mechanisms behind the stimulation of nitrification by N input in subtropical acid forest soil[J]. Journal of Soils and Sediments, 2017, 17: 2338-2345. DOI:10.1007/s11368-016-1461-y
(  0) 0) |
| [8] |
Dan X Q, Meng L, He M Q, et al. Regulation of nitrogen acquisition in vegetables by different impacts on autotrophic and heterotrophic nitrification[J]. Plant and Soil, 2022, 474(1/2): 581-594.
(  0) 0) |
| [9] |
Zhang J B, Cai Z C, Zhu T B, et al. Mechanisms for the retention of inorganic N in acidic forest soils of southern China[J]. Scientific Reports, 2013, 3: 2342. DOI:10.1038/srep02342
(  0) 0) |
| [10] |
Müller C, Laughlin R J, Spott O, et al. Quantification of N2O emission pathways via a 15N tracing model[J]. Soil Biology and Biochemistry, 2014, 72: 44-54. DOI:10.1016/j.soilbio.2014.01.013
(  0) 0) |
| [11] |
Cheng Y, Zhang J B, Wang J, et al. Soil pH is a good predictor of dominating N2O production pathways under aerobic conditions[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(3): 370-373. DOI:10.1002/jpln.201400577
(  0) 0) |
| [12] |
State Forestry Administration. China forest resources report: Ninth national forest resources inventory (In Chinese). Beijing: China Forestry Publishing House, 2019. [国家林业局. 中国森林资源报告: 第九次全国森林资源清查[M]. 北京: 中国林业出版社, 2019.]
(  0) 0) |
| [13] |
Selvalakshmi S, Vasu D, He Z J, et al. Soil nutrients dynamics in broadleaved forest and Chinese fir plantations in subtropical forests[J]. Journal of Tropical Forest Science, 2018, 30(2): 242-251. DOI:10.26525/jtfs2018.30.2.242251
(  0) 0) |
| [14] |
Zhou J, Li Q R, Liu M, et al. Neighboring tree species alter uptake of  0) 0) |
| [15] |
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing: China Agricultural Science and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [16] |
Chmelíková L, Schmid H, Anke S, et al. Nitrogen-use efficiency of organic and conventional arable and dairy farming systems in Germany[J]. Nutrient Cycling in Agroecosystems, 2021, 119: 337-354. DOI:10.1007/s10705-021-10126-9
(  0) 0) |
| [17] |
Cheng Y, Elrys A S, Merwad A R M, et al. Global patterns and drivers of soil dissimilatory nitrate reduction to ammonium[J]. Environmental Science and Technology, 2022, 56(6): 3791-3800. DOI:10.1021/acs.est.1c07997
(  0) 0) |
| [18] |
Ma H L, Wei C L, Li L, et al. Effects of glucose addition on soil nitrogen transformation and net mineralization and nitrification in Chinese fir plantation (In Chinese)[J]. Forest Research, 2014, 27(3): 356-362. [马红亮, 魏春兰, 李磊, 等. 添加葡萄糖对杉木人工林土壤氮素转化及净矿化和硝化的影响[J]. 林业科学研究, 2014, 27(3): 356-362.]
(  0) 0) |
| [19] |
Xiao H Y, Liu B, Yu Z P, et al. Seasonal dynamics of soil mineral nitrogen pools and nitrogen mineralization rate in different forests in subtropical China (In Chinese)[J]. Chinese Journal of Applied Ecology, 2017, 28(3): 730-738. [肖好燕, 刘宝, 余再鹏, 等. 亚热带不同林分土壤矿质氮库及氮矿化速率的季节动态[J]. 应用生态学报, 2017, 28(3): 730-738.]
(  0) 0) |
| [20] |
Chen R, Xiang W H, Xu X, et al. Speed of soil nitrogen mineralization and effect of fertilizer combined with warming on It in different ages Chinese fir plantation (In Chinese)[J]. Hunan Agricultural Sciences, 2010(5): 125-129. DOI:10.3969/j.issn.1006-060X.2010.05.042 [陈瑞, 项文化, 徐晓, 等. 不同年龄杉木林土壤氮矿化及其对施肥增温的响应[J]. 湖南农业科学, 2010(5): 125-129.]
(  0) 0) |
| [21] |
Zhang J B, Zhu T B, Cai Z C, et al. Nitrogen cycling in forest soils across climate gradients in Eastern China[J]. Plant and Soil, 2011, 342: 419-432. DOI:10.1007/s11104-010-0706-6
(  0) 0) |
| [22] |
Li P, Lang M, Wei W. Effects of nitrogen application amounts on net nitrogen transformation rates in forest and agricultural black soils (In Chinese)[J]. Chinese Journal of Soil Science, 2020, 51(3): 694-701. [李平, 郎漫, 魏玮. 不同施氮量对林地和农田黑土净氮转化速率的影响[J]. 土壤通报, 2020, 51(3): 694-701.]
(  0) 0) |
| [23] |
Li H X, Hu F, Liu M Q, et al. Characteristics of nitrogen mineralization and nitrification in red soils (In Chinese)[J]. Soils, 2000, 32(4): 194—197, 214. DOI:10.3321/j.issn:0253-9829.2000.04.006 [李辉信, 胡锋, 刘满强, 等. 红壤氮素的矿化和硝化作用特征[J]. 土壤, 2000, 32(4): 194—197, 214.]
(  0) 0) |
| [24] |
Harrison-Kirk T, Beare M H, Meenken E D, et al. Soil organic matter and texture affect responses to dry/wet cycles: Changes in soil organic matter fractions and relationships with C and N mineralisation[J]. Soil Biology and Biochemistry, 2014, 74: 50-60. DOI:10.1016/j.soilbio.2014.02.021
(  0) 0) |
| [25] |
Ding S J, Yang W L, Xin X L, et al. Effects of plough layer thickness on the transformation and fate of fertilizer nitrogen in fluvo-aquic soils with different textures (In Chinese)[J]. Acta Pedologica Sinica, 2023. DOI:10.11766/trxb202204060097 [丁世杰, 杨文亮, 信秀丽, 等. 耕层厚度对潮土中化肥氮素转化的影响[J]. 土壤学报, 2023.]
(  0) 0) |
| [26] |
Dang P F, Li C F, Huang T T, et al. Effects of different continuous fertilizer managements on soil total nitrogen stocks in China: A meta-analysis[J]. Pedosphere, 2022, 32(1): 39-48. DOI:10.1016/S1002-0160(21)60059-0
(  0) 0) |
| [27] |
Zhu X M, Li R C, Lu J F, et al. Short-term effect of SO2 fumigation on soil net nitrogen transformation rates for Castanopsis carlesii and Cunninghamia lanceolata forests of northern Fujian, mid-subtropics of China (In Chinese)[J]. Journal of Anhui Agricultural Sciences, 2013, 41(6): 2439-2441. DOI:10.3969/j.issn.0517-6611.2013.06.035 [朱祥妹, 李任超, 陆建芳, 等. SO2对中亚热带两种森林土壤氮净转化速率的短期影响[J]. 安徽农业科学, 2013, 41(6): 2439-2441.]
(  0) 0) |
| [28] |
Zhang Y C, Zhang J B, Meng T Z, et al. Heterotrophic nitrification is the predominant  0) 0) |
| [29] |
Zhang J B, Cheng Y, Cai Z C. The mechanisms of soil regulating nitrogen dynamics (In Chinese)[J]. Advances in Earth Science, 2019, 34(1): 11-19. [张金波, 程谊, 蔡祖聪. 土壤调配氮素迁移转化的机理[J]. 地球科学进展, 2019, 34(1): 11-19.]
(  0) 0) |
| [30] |
Kou L, Guo D, Yang H, et al. Growth, morphological traits and mycorrhizal colonization of fine roots respond differently to nitrogen addition in a slash pine plantation in subtropical China[J]. Plant and Soil, 2015, 391(1): 207-218.
(  0) 0) |
| [31] |
Qiu X, Hou J, Guo N, et al. Seasonal variations and influencing factors of gross nitrification rate in desert steppe soil[J]. Sustainability, 2022, 14(8): 4787. DOI:10.3390/su14084787
(  0) 0) |
| [32] |
Li P, Lang M. Effect of cultivation on gross and net N transformation rates in black soil relative to duration (In Chinese)[J]. Acta Pedologica Sinica, 2020, 57(1): 165-173. [李平, 郎漫. 开垦年限对黑土氮初级转化速率和净转化速率的影响[J]. 土壤学报, 2020, 57(1): 165-173.]
(  0) 0) |
| [33] |
Zhao C, He X X, Dan X Q, et al. Soil dissolved organic matters mediate bacterial taxa to enhance nitrification rates under wheat cultivation[J]. Science of the Total Environment, 2022, 828: 154418. DOI:10.1016/j.scitotenv.2022.154418
(  0) 0) |
| [34] |
Chen Z X, Tu X S, Meng H, et al. Microbial process-oriented understanding of stimulation of soil N2O emission following the input of organic materials[J]. Environmental Pollution, 2021, 284: 117176. DOI:10.1016/j.envpol.2021.117176
(  0) 0) |
| [35] |
He J Z, Hu H W, Zhang L M. Current insights into the autotrophic thaumarchaeal ammonia oxidation in acidic soils[J]. Soil Biology and Biochemistry, 2012, 55: 146-154. DOI:10.1016/j.soilbio.2012.06.006
(  0) 0) |
| [36] |
Zhang Y, Dai S Y, Huang X Q, et al. pH-induced changes in fungal abundance and composition affects soil heterotrophic nitrification after 30 days of artificial pH manipulation[J]. Geoderma, 2020, 366: 114255. DOI:10.1016/j.geoderma.2020.114255
(  0) 0) |
| [37] |
Steele K W, Saunders W M H. Soil nitrification activity and phosphorus uptake by ryegrass after nitrogen fertiliser application[J]. New Zealand Journal of Agricultural Research, 2011, 23(1): 83-84.
(  0) 0) |
| [38] |
Zhang Q L, Liu Y, Ai G M, et al. The characteristics of a novel heterotrophic nitrification–aerobic denitrification bacterium, Bacillus methylotrophicus strain L7[J]. Bioresource Technology, 2012, 108: 35-44. DOI:10.1016/j.biortech.2011.12.139
(  0) 0) |
| [39] |
Zhang J B, Müller C, Zhu T B, et al. Heterotrophic nitrification is the predominant  0) 0) |
 2024, Vol. 61
2024, Vol. 61


