2. 广东省科学院生态环境与土壤研究所, 广州 510650;
3. 中国科学院大学, 北京 100049;
4. 华南土壤污染控制与修复国家地方联合工程研究中心, 广州 510650
2. Institute of Eco-environmental and Soil Sciences, Guangdong Academy of Sciences, Guangzhou 510650, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. National-Regional Joint Engineering Research Center for Soil Pollution Control and Remediation in South China, Guangzhou 510650, China
砷作为有毒类金属元素在自然和人为活动影响下释放到土壤环境中,土壤累积的砷可通过植物吸收进入食物链[1]。与其他农作物相比,水稻在淹水条件下更容易积累砷[2]。在淹水条件的稻田土壤中无机砷发生还原释放,使得三价砷(As(Ⅲ))成为土壤溶液中的主要砷形态[3]。应对还原条件下高浓度砷,微生物细胞能进行胞内As(Ⅲ)外排,或者As(Ⅲ)甲基化。在砷甲基化微生物胞内,As(Ⅲ)与谷胱甘肽形成复合物后,以S-腺苷甲硫氨酸为甲基供体在砷甲基转移酶(arsenic methyltransferase,ArsM)催化下进行逐步甲基化,生成一甲基亚砷酸(MMAs(Ⅲ))、二甲基亚砷酸(DMAs(Ⅲ))中间产物,进而生成挥发性三甲基砷(TMAs(Ⅲ)),这些产物可在有氧条件下被快速氧化为五价甲基砷,即一甲基砷(MMAs)、二甲基砷(DMAs)和三甲基砷氧化物(TMAsO)[4]。砷甲基转移酶基因arsM是砷抗性基因家族的成员,异源表达arsM赋予砷敏感大肠杆菌对As(Ⅲ)的耐受性,表明arsM是微生物进化出的重要砷抗性机制[5]。砷甲基化将高毒三价砷转化为低毒的五价甲基砷和产生挥发性砷排出胞外,实现微生物对砷的解毒[6]。稻田中微生物砷甲基化过程改变As(Ⅲ)的毒性和有效性,所以调控微生物砷甲基化对指导砷污染稻田土壤修复具有重要意义。
砷甲基化微生物在稻田土壤中呈现高度物种多样性,且已经有多株好氧砷甲基化菌被分离鉴定。嗜纤维菌科的好氧砷甲基化细菌Cytophagaceae. SM-1分离自浅水层稻田土壤,此种菌能在24 h内将As(Ⅲ)几乎全部转化为DMAs、TMAsO和挥发性TMAs(Ⅲ),接种Cytophagaceae. SM-1能明显促进水稻土中甲基砷和挥发性砷的产生[7]。水稻根际筛出的好氧链霉菌属Streptomyces sp. strain GSRB54被验证具有砷甲基化能力,主要甲基砷产物为DMAs和TMAsO[8]。此外,假单胞菌产碱杆菌属Pseudomonas alcaligenes NBRC14159和芽孢杆菌Bacillus sp. CX-1能将As(Ⅲ)转化为甲基砷,产物主要为DMAs[9-10]。已有研究构建arsM功能Pseudomonas putida KT2440,砷甲基化主要产物为DMAs,能产生挥发性砷[11]。携带arsM的基因工程菌Sphingomonas desiccabilis和Bacillus idriensis被用于促进砷污染土壤砷的挥发[12]。将重组的arsM功能菌Rhizobium leguminosarum与红花苜蓿共生,赋予根瘤菌-植物共生体系砷甲基化能力,具有修复砷污染土壤的潜力[13]。
芽孢杆菌属(Bacillus)是土壤中常见的优势微生物类群之一,已有研究报道了具有砷抗性的芽孢杆菌属成员能发挥植物促生的功能,对砷污染土壤中水稻植株生长有积极影响[14]。砷污染农用地土壤中分离的砷抗性Bacillus aryabhattai AS6展现出产吲哚-3-乙酸(IAA)、铁载体、1-氨基环丙烷-1-羧酸(ACC)脱氨酶和溶磷的活性,接种AS6后能减少砷污染下的水稻植株毒性,对水稻苗生长有促进作用[15]。接种砷抗性芽孢杆菌AsSP9能减少水稻砷毒性,增加水稻发芽率、相对根长、淀粉酶和蛋白酶活性和生物量[16]。水稻根际土中分离的具砷抗性和砷氧化功能的芽孢杆菌Bacillus flexus ASO-6能氧化As(Ⅲ)为As(Ⅴ),降低砷的毒性,同时具有产IAA和溶磷等能力,接种至水稻后显著增加砷污染下水稻种子萌发和植株叶绿素[17]。此外,Bacillus amyloliquefaciens NBRISN13通过溶解硅增加硅的有效性,减少水稻砷的累积,改善水稻的生长情况[18]。砷抗性芽孢杆菌除了直接作用于水稻促进植株生长外,还能改变水稻根际微生物菌群来影响水稻生长。例如Bacillus amyloliquefaciens NBRISN13(SN13)接种后相对富集了有益的根际微生物,协同帮助水稻在高盐条件下的健康生长[19]。Bacillus megaterium接种至水稻根际能提高植物有益菌的丰度,对水稻系统抗性和生长有积极影响[20]。然而,应用砷甲基化功能芽孢杆菌对水稻砷胁迫的影响尚不清楚。
砷甲基化功能菌Streptomyces sp. strain GSRB54能增加水培体系下水稻根际甲基砷浓度[8]。还有研究接种携带arsM基因的Pseudomonas oleovorans B4.10增加土壤酶活和根际矿质元素转化,缓解水稻植株砷胁迫[21]。但水稻根际菌的砷甲基化能力和其影响砷胁迫下水稻生长的作用机制的研究还较为缺乏。本研究从砷污染稻田根际土中筛选出一株砷甲基化功能芽孢杆菌Bacillus sp. LH14,探究了该菌株的砷甲基化效率和砷抗性以及促生相关特性,然后在砷污染土壤中水稻根际接种LH14,探究其影响下的根际砷形态转化和根际微生物相互作用,以期为砷甲基化功能菌应用于砷污染土壤修复和缓解植物砷胁迫提供理论指导。
1 材料与方法 1.1 供试材料LB培养基配制(g·L–1):蛋白胨10,酵母提取物5,氯化钠10;R2A培养基配制(g·L–1):胰蛋白胨0.25,酸水解酪蛋白0.5,酵母提取物0.5,可溶性淀粉0.5,磷酸氢二钾0.3,硫酸镁0.1,丙酮酸钠0.3,蛋白胨0.25,葡萄糖0.5;ST培养基配制(g·L–1):蛋白胨5,酵母提取物0.5,葡萄糖5。
12 mmol·L–1 NaAsO2溶液用0.22 μm滤膜过滤除菌备用;Salkowski比色液按照每份1.5 mL 0.5 mol·L–1 FeCl3、30 mL 98%H2SO4、50 mL H2O的比例配置;土壤DNA提取使用DNeasy PowerSoil Kit试剂盒(QIAGEN)。
供试土壤采自广东省汕头莲花山砷污染稻田,总砷含量为126 mg·kg–1,土壤风干后筛分至 < 2 mm备用。供试植物为水稻,水稻品种为黄华占。
1.2 砷甲基化菌的分离和鉴定称取2 g水稻根际土壤加入100 mL 1/10ST培养基中,在30℃摇床200 r·min–1培养3 d。将培养物进行梯度稀释(103~107)后,涂布于含12 μmol·L–1 As(Ⅲ)R2A固体培养基上,在30 ℃培养箱中培养2 d。从平板上挑选不同形态的单菌落接种到含12 μmol·L–1 As(Ⅲ)的R2A液体培养基中,在30℃下摇床200 r·min–1培养3 d,然后样品经0.22 μm滤头过滤,用NexION 300X高效液相色谱-电感耦合等离子体-质谱仪(HPLC-ICP-MS,PerkinElmer,USA)对甲基砷进行定性定量测试,测试目标物包括MMAs(Ⅲ)、MMAs(Ⅴ)、DMAs(Ⅴ)和TMAsO(Ⅴ)。一株能将As(Ⅲ)转化为TMAsO(Ⅴ)和DMAs(Ⅴ)的菌株(LH14)被分离,并经三次纯化后获得纯菌株,并于30%甘油中-80℃保藏备用。
对菌株LH14的16S rRNA基因用27F/1492R引物扩增,对16S rRNA基因全长TA克隆后,由上海生工生物进行测序。将获得的基因序列(1387 bp)用Blast进行核苷酸同源性分析,确定菌株LH14与酸速生芽孢杆菌Bacillus acidiceleris同源性达99.93%。菌株LH14全基因组序列由派森诺进行测定,序列数据上传至NCBI(登录号NZ_CP096034.1)。利用NCBI Prokaryotic Genome Annotation Pipeline进行基因功能注释,鉴定出砷甲基转移功能基因arsM(locus tag:MY490_10085),蛋白长度为264个氨基酸。将LH14与其他Bacillus属ArsM同源蛋白序列在MEGA7.0中构建Neighbor-Joining系统发育树,用bootstrap自举分析重复检验1 000次检验系统发育树置信度。
1.3 菌株的As(Ⅲ)甲基化能力和砷抗性测定将对数生长期菌接种进含12 μmol·L–1 As(Ⅲ)的LB培养基,使反应起始OD600为0.01,30℃下摇床200 r·min–1培养34 h,设置6个取样,样品经0.22 μm滤头过滤后,用HPLC-ICP-MS测定砷形态。培养结束后将顶空气体用硝酸银(10%)浸泡过的硅胶粒进行收集,HNO3(1%)于90℃ 2 h洗脱后,用上述方法测定砷形态。为测定该菌株的砷抗性,在0、10、20、50、100、200、500 μmol·L–1 As(Ⅲ)的LB培养基中接种菌株(OD600 = 0.01),于摇床培养40 h,每4 h测定OD值,每个处理3个重复。
1.4 IAA测定和水稻种子萌发实验接种菌株于有无L-色氨酸(100 mg·L–1)的含0、5、12 μmol·L–1 As(Ⅲ)LB液体培养基中,培养13 h后取菌液用0.22 μm滤头过滤,溶液用Salkowski进行显色,于530 nm波长处测定吸光值。
水稻种子在30%过氧化氢表面消毒并用去离子水洗净后,将种子浸泡于菌液(10 mmol·L–1 MgCl2重悬后使OD600为1)中30 min(LH14),并用MgCl2溶液浸泡种子作为不接种对照处理(CK)。将种子(25粒)放置于培养皿中滤纸上,加入12 mL 0、15、100 μmol·L–1 As(Ⅲ)溶液,25℃避光培养5 d,测量水稻根长芽长及鲜重干重。
1.5 水稻盆栽实验用5 L实验盆装入3.5 kg砷污染稻田土,加入去离子水使得表面水层高2 cm,将育苗15 d后的水稻苗移栽到盆中,每盆6株。设置水稻根部有无接种共3个处理,分别为加入10 mL去离子水(CK)、10 mL OD600 1.0菌液(LH14)、和重复4次并每次间隔一周接种10 mL OD600 1.0菌液(LH14R),每个处理4个重复。在水稻生长的0、8、14、20和26 d用土壤孔隙水取样器连接真空玻璃管对根际土壤溶液进行取样(约5 mL),经0.22 μm滤头过滤后测定砷形态。在第8天和第26天,将水稻苗从盆栽中取出,用超纯水冲洗水稻根部,采集根表 0~2 mm的土壤样品,液氮速冻30 min后-80℃保存,待提取DNA。26 d后测量所有处理中的水稻株高。
1.6 荧光定量PCR和16S rRNA基因高通量测序用QIAamp PowerFecal Pro DNA Kit试剂盒对18个土壤样品进行DNA提取,然后用Nanodrop测定浓度和纯度,并用1%琼脂糖凝胶电泳进行质鉴。16S rRNA和arsM基因绝对定量的PCR反应体系为10 μL,包括TB Green Premix Ex Taq II 5 μL、上下游引物各0.4 μL(10 μmol·L–1)、DNA模板1 μL、ddH2O 3.6 μL。所用引物515F/806R和arsMF1/arsMR2和qPCR扩增条件见表 1。用pUC19质粒载体构建相应基因的质粒标准曲线(102~108copies·μL–1)。使用CFX 384 Real-Time PCR Detection System(Bio-Rad Laboratories,USA)进行扩增,每个样品三个重复,扩增过程中包括阴性对照,反应效率为90%~100%,决定系数(R2) > 0.99。用带接头和barcode的引物515F/806R对16S rRNA V4区进行扩增,建库后使用Illumina MiSeq PE300测序仪进行双端测序。
|
|
表 1 实时荧光定量PCR引物序列及反应条件 Table 1 Details of primer pairs and thermal cycling parameters for qPCR |
高通量测序产生每个样本最少131 343条序列量,原始序列经过质控和拼接,去冗余后进行聚类和去噪,生成amplicon sequence variant(ASV)特征表。18个样本共获得13 352个ASV,使用SILVA v132数据库对ASV进行物种注释。为比较各处理间物种丰度的差异,对科水平下物种相对丰度进行Z-score归一化,即Z-score =(x-μ)/σ,其中x、μ和σ分别为单个物种相对丰度值、均值和标准差。通过微生物分子生态网络方法(pMEN)分析各个处理中ASV水平的共出现网络图,并在属水平上分析与Bacillus属相关联的物种共出现网络,然后用Gephi软件进行可视化。利用SPSS 26软件进行方差分析,检验处理间差异的显著性。
2 结果 2.1 Bacillus sp. LH14砷转化效率和砷抗性菌株LH14在含12 μmol·L–1 As(Ⅲ)培养基中培养34 h内,甲基砷浓度随时间逐渐增加,主要形态为TMAsO和DMAs,未检出MMAs(图 1a)。34 h后,TMAsO和DMAs浓度分别达2.6 μmol·L–1和0.6 μmol·L–1,甲基砷转化率26.1%。培养基顶空也被发现有甲基砷TMAs(Ⅲ)气体产生,浓度为3.5 μmol·L–1,占总砷的28.8%。培养结束时As(Ⅲ)浓度下降至3.7 μmol·L–1,有As(Ⅴ)生成(2.0 μmol·L–1)。该结果表明Bacillus sp.LH14具有砷甲基化能力,将As(Ⅲ)主要转化为溶解态TMAsO和TMAs(Ⅲ)气体。菌株LH14砷抗性实验结果表明,砷存在对LH14生长产生抑制作用,在5~100 μmol·L–1 As(Ⅲ)浓度范围内菌进入对数生长期的时间延长,40 h后有砷处理下OD600值相比空白对照有所下降(图 1b)。

|
图 1 菌株LH14在含12 μmol·L–1 As(Ⅲ)培养基中培养34 h内不同形态砷浓度(a)及不同As(Ⅲ)浓度下LH14生长曲线(b) Fig. 1 As speciation in LB medium inoculated with Bacillus sp. LH14 under 12 μmol·L–1 As(Ⅲ)(a), growth curves(OD600) of Bacillus sp. LH14 under different As(Ⅲ) concentrations(b) |
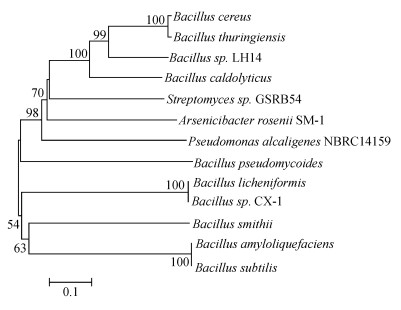
菌株LH14全基因鉴定出一个arsM同源基因,该arsM基因位于As(Ⅲ)结合型转录阻遏蛋白arsR下游,在距arsR长约为6 kb的间隔中包含7个基因,其中包括胞内解毒型砷还原基因arsC、s砷代谢转录调节蛋白arsD和砷泵ATP酶基因arsA。arsM基因对应蛋白质序列含264个氨基酸,与其他芽孢杆菌属物种ArsM蛋白序列一致性分别为Bacillus cereus(70.8%)、Bacillus thuringiensis(70.8%)、Bacillus caldolyticus(62.6%)、Bacillus sp.CX-1(31.6%)和Bacillus pseudomycoides(33.3%)。ArsM蛋白序列系统发育树表明,菌株LH14的arsM基因与Bacillus cereus和Bacillus thuringiensis的进化关系较为接近(图 2)。
|
图 2 基于ArsM蛋白序列构建的Neighbor-Joining系统发育树 Fig. 2 Phylogenetic tree of deduced amino acid sequences of ArsM retrieved from Bacillus sp. LH14 and reference protein sequences of ArsM retrieved from GenBank |
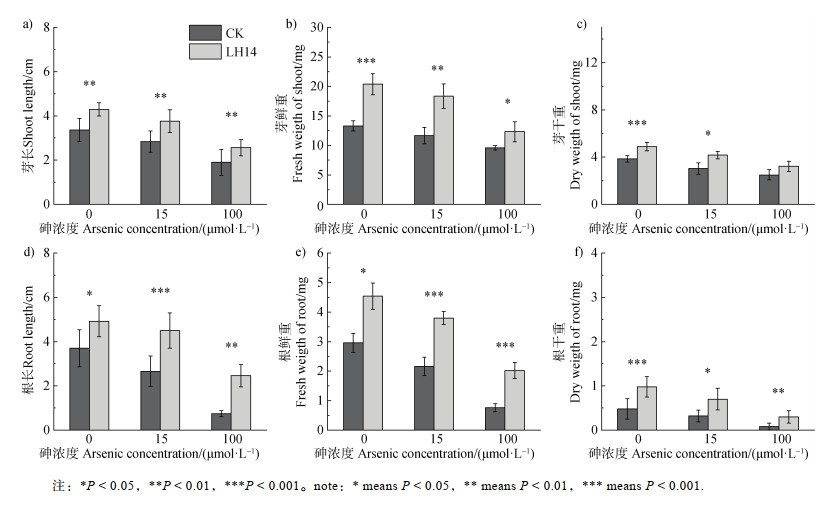
促生特性试验表明菌株LH14在所有处理下均有产IAA的能力,如表 2所示,在色氨酸(IAA合成前体物)存在条件下IAA产量高于无色氨酸处理。As(Ⅲ)存在显著抑制了IAA产生,在5 μmol·L–1和12 μmol·L–1 As(Ⅲ)条件下分别降低了约54%和89%。在不同砷浓度下,接种LH14后的种子萌发率为60%~88%,高于无接种的处理(38%~76%)。接种对有无砷条件下均能显著增加水稻芽长和根长,对芽和根的鲜重和干重也有促进作用。100 μmol·L–1 As(Ⅲ)浓度下相比无接种处理,接种后芽长和根长分别增加34.7%和232%(图 3a和3d),芽鲜重增加28.7%而干重变化不明显(图 3b和图 3c),根鲜重和干重分别增加165%和275%(图 3e和图 3f),这些结果表明菌株LH14有助于缓解水稻砷胁迫,促进植株生长。
|
|
表 2 在0、5和12 μmol·L–1 As(Ⅲ)浓度下菌株LH14的IAA产量 Table 2 IAA production of LH14 at 0, 5 and 12 μmol·L–1 As(Ⅲ) concentrations |
|
注:*P < 0.05,**P < 0.01,***P < 0.001。 note: * means P < 0.05, ** means P < 0.01, *** means P < 0.001. 图 3 在0、15和100 μmol·L–1 As(Ⅲ)浓度下有无接种LH14影响下的水稻幼苗生长 Fig. 3 The growth of rice seedling inoculated with or without LH14 responding to 0, 15 and 100 μmol·L–1 As(Ⅲ), respectively |
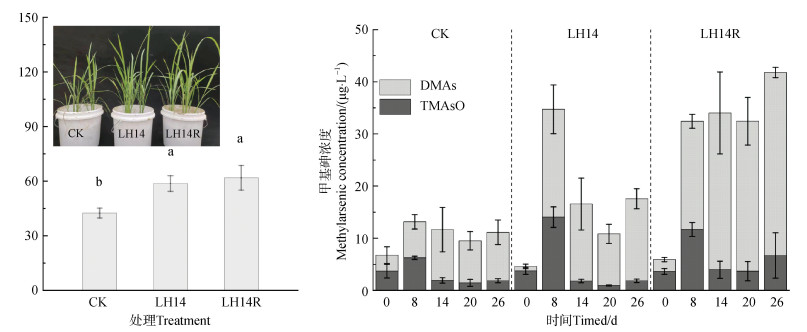
在土壤-水稻体系中水稻根际单次接种(LH14)和多次接种(LH14R)处理均显著增加了水稻株高,分别提高38.3%和45.6%(图 4a),显示出LH14对砷污染土壤中水稻生长的促进作用。在26 d培养期内水稻根际土壤溶液中As(Ⅲ)浓度约为350 μg·L–1。CK处理中根际甲基砷浓度为9.5~11.6 μg·L–1,LH14和LH14R处理8 d后甲基砷浓度分别增至34.7和32.4 μg·L–1,提高2.6倍和2.5倍,形态主要为二甲基砷(图 4b)。第8天后,LH14处理中根际甲基砷浓度有所下降,而LH14R处理甲基砷始终保持较高浓度,在培养最后LH14和LH14R处理的甲基砷较CK分别高1.6倍和3.8倍。以上结果表明LH14有助于砷污染条件下的水稻生长,同时转化水稻根际土壤溶液中As(Ⅲ)为甲基砷,且多次接种能够在水稻根际保持较稳定的甲基砷产生量。
|
注:不同小写字母表示不同处理组水稻株高差异显著(P < 0.05)。 Note: The different lowercase letter means significant difference in rice plant height with different treatments(P < 0.05). 图 4 有无接种LH14影响下的砷污染土壤中水稻株高(a)及根际土壤溶液甲基砷浓度(b) Fig. 4 Rice plant height(a) and methylarsenic concentration in rhizosphere soil solution(b) in arsenic-contaminated soil treated with or without the strain LH14 |
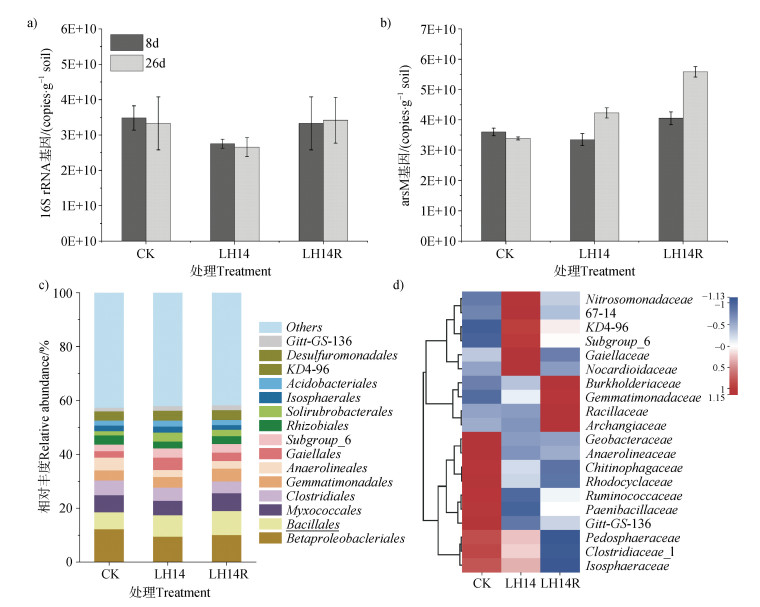
LH14和LH14R处理相比CK对26 d后水稻根际细菌16S rRNA基因丰度无显著影响(图 5a)。LH14处理虽然在第8天对水稻根际arsM基因丰度无显著影响,但第26天时arsM基因显著高于CK(图 5b)。LH14R处理在第8天和第26天均显著提高根际arsM基因丰度。水稻根际微生物菌群组成结果表明,Betaproteobacteriales、Bacillales、Myxococcales、Clostridiales和Gemmatimonadales为所有处理中的主要根际细菌物种,它们的相对丰度占到总细菌菌群的31.6%~34.7%(图 5c)。相比CK中Bacillales相对丰度(6.3%),LH14和LH14R处理中其丰度增加至8.0%和8.9%。科水平下相对丰度Top 20的物种组成聚类分析结果表明,LH14与CK处理中芽孢杆菌科Bacillaceae相对丰度皆为3.6%,在LH14R处理中增至4.1%(图 5d)。相较于CK处理,LH14处理增加了Nitrosomonadaceae和Nocardioidaceae的相对丰度,而LH14R处理对Burkholderiaceae和Gemmatimonadaceae有富集作用。
|
注:不同小写字母表示不同处理组差异显著(P < 0.05)。 Note: The different lowercase letter means significant differences with different treatments(P < 0.05). 图 5 有无接种LH14影响下第8天和第26天水稻根际土壤16S rRNA基因拷贝数(a)、arsM基因拷贝数(b),和第26天目水平微生物群落组成(c)和科水平细菌组成聚类图(d) Fig. 5 16S rRNA gene copies number(a) and arsM gene copies number(b) in rice rhizosphere soil on days 8 and 26, composition of bacterial communities at the order level(c), and heat map of the top 20 abundant genera at the family level(d) on the day 26 in soil treated with or without the strain LH14 |
水稻根际细菌ASV互作网络图拓扑性质结果显示(图 6a),对照、单次和多次接种处理的总节点数分别为495、498和426,总边数分别为784、814和552,其中负边的占比分别为27.9%、23.6%和30.6%,平均网络连接度分别为3.2、3.3和2.6,表明多次接种LH14使得微生物网络连接度和连接数降低,网络复杂度降低,并增加了相互排斥的比例。网络模块化所有处理的网络模块化系数均大于0.4,说明网络具有模块化结构,能被划分为多个独立的集群。多次接种处理的网络模块化系数为0.86,大于对照处理的0.76,接种LH14后网络模块化程度增强表明微生物菌群响应于接种带来的扰动,从而改变网络结构和功能。

|
注:pp,正相关,np,负相关。 Note: pp means positive correlations, np means negative correlations. 图 6 有无接种LH14影响下根际土壤细菌ASV共现网络图(a)和芽孢杆菌属相关物种的共现网络图(b) Fig. 6 Co-occurrence networks of bacterial ASVs in rhizosphere soil(a) and co-occurrence networks of taxa related to genus Bacillus(b) in soil treated with or without the strain LH14 |
为探究Bacillus属细菌与其他物种的相互关系,构建了以Bacillus为中心的网络(图 6b),结果表明对照、单次和多次接种处理的总边数分别为59、21和16,所有网络正边数占比为76.2%~83.9%。在多次接种后与Bacillus存在正相关关系的物种包括Burkholderiaceae、Uncultured Gemmatimonadaceae和Planococcaceae,而与Thauera、Bryobacter和Uncultured Microscillaceae为负相关关系。
3 讨论水稻根际是营养元素吸收转运和重金属砷形态转化的活跃区域,根际分泌的有机物和氧气为好氧砷甲基化微生物提供了生存环境[8]。淹水条件下土壤中还原释放的As(Ⅲ)在根际除了被微生物或化学氧化外,还可以进行微生物甲基化[22]。已有研究表明好氧砷甲基化菌具有较高的砷甲基化效率[23],从稻田土壤中分离的Cytophagaceae. SM-1和Streptomyces sp. strain GSRB54培养最后的甲基化效率均超过总砷的50%[7–8]。本研究中分离自水稻根际土壤的Bacillus sp. LH14在34 h内将54.9%的12 μmol·L–1 As(Ⅲ)转化为溶解态和气态甲基砷,验证了水稻根际存在砷甲基化能力较强的微生物。Bacillus属中存在多个携带arsM基因的物种(图 2),其中Bacillus sp. CX-1被验证能在24 h后将10 μmol·L–1 As(Ⅲ)全部转化为DMAs[10]。菌株CX-1的arsM基因为组成型表达,转录不受arsR基因控制,异源表达该arsM能赋予细胞砷抗性,表明arsM催化的砷甲基化反应是微生物耐受环境中砷的重要机制。本研究中菌株LH14的ArsM蛋白序列与Bacillus sp. CX-1进化距离较远,并且LH14的arsM在arsR阻遏蛋白基因下游,转录受arsR控制,表现出携带arsM的Bacillus物种间arsM转录调节方式可能存在差异。此外,在水稻根际接种LH14后主要产物为DMAs,与LB培养基中砷甲基化产物主要为TMAsO不同,表明不同的底物和生长条件可能导致砷甲基化效率和主要甲基砷产物形态发生变化。菌株LH14的ArsM蛋白与Bacillus cereus和Bacillus thuringiensis的进化距离接近,与Bacillus cereus ATCC14579相似度为99.9%的Bacillus sp. CZ-2能将DMAs(Ⅲ)转化为挥发性二甲基砷气体[24],表明Bacillus属物种具有多种代谢含砷化合物的途径,采取不同策略适应环境中不同形态的含砷化合物。稻田土壤淹水条件下As(Ⅲ)可达5~40 μmol·L–1,菌株LH14能耐受100 μmol·L–1 As(Ⅲ)浓度进行生长,并在土壤体系中在显著增加arsM功能基因丰度,促进As(Ⅲ)转化为甲基砷,体现出LH14具有应用于土壤砷污染修复的潜力。
芽孢杆菌属物种具有多种益于植物生长的特性,影响环境胁迫下植物的抗逆性[25]。由于三价无机砷As(Ⅲ)与蛋白质辅酶的巯基结合具有生物毒性,As(Ⅲ)对水稻生长产生抑制作用,主要体现为种子萌发减少和生物量降低[26]。接种具砷抗性的LH14提高了高砷浓度条件下的种子萌发率、根和芽长及鲜重和干重,显示出LH14能够缓解砷对水稻生长的胁迫。已有研究表明砷抗性根际菌促进砷污染条件下水稻生长,可能是因为菌株能够产生植物促生因子(包括IAA和ACC脱氨酶)[17]。根际促生菌能利用植物根系分泌的色氨酸合成IAA,直接促进植物细胞伸长和细胞分裂[27-28]。Bacillus sp. LH14有助于砷胁迫下水稻生长可能与LH14在砷胁迫下产IAA的能力有关,类似于之前研究发现接种产IAA的根际菌使得植株能更好的在As污染土壤中生长[15,29]。
在砷污染土壤-水稻体系中接种LH14显著增加了水稻植株株高,可能与其改变水稻根际微生物菌群有关[30]。单次接种LH14后,根际土壤中Bacillaceae相对丰度与CK处理无显著差异,但LH14处理富集了其他细菌物种(例如Nitrosomonadaceae),并在属水平下芽孢杆菌相关的共现网络图中发现,LH14处理改变了Bacillus属相关物种关系,表明LH14单次接种能影响其相关物种间相互作用。LH14多次接种处理中,Bacillaceae丰度增加的同时,也富集了Burkholderiaceae和Gemmatimonadaceae,并且Bacillus与Burkholderiaceae和Uncultured Gemmatimonadaceae存在正相关关系。Burkholderiaceae的物种能产生多种水解酶和生物活性物质,有利于植物生长和健康,其中B. phytofirmans不仅能帮助植物抵御致病菌,还能增加植物的抗逆性(包括低温、高盐和干旱)[31]。归属于Gemmatimonadaceae的Gemmatimonas属物种被发现与根际土壤营养变化关系紧密,能够溶解磷从而为植株提供更多磷源,并且在健康根际土中比病害土壤根际有更高的丰度,是植物根际促生菌群的核心物种[32]。由此可见,多次接种LH14处理对植物有益菌Burkholderiaceae和Gemmatimonadaceae有富集作用,从而对砷污染土壤中水稻生长产生积极影响。类似的,解淀粉芽孢杆菌FH-1被报道接种至水稻大田中能显著增加植物有益物种的丰度,同时提高水稻的生物量和产量,表明FH-1通过改变根际微生物菌群进而促进水稻生长[33]。另一方面,已有研究表明甲基砷(尤其是DMAs)相比五价砷As(Ⅴ)的植物毒性较高,导致拟南芥植株茎和根的生物量降低[34]。但在本研究中多次接种砷甲基化功能菌LH14于砷污染土壤后增加了水稻植株的生物量,表明LH14介导的甲基砷产生不是影响水稻生长的主要因素。
4 结论本研究验证了水稻根际芽孢杆菌Bacillus sp. LH14具有较高的甲基砷和挥发能力,并能耐受100 μmol·L–1 As(Ⅲ)进行生长。多次接种LH14至砷污染土壤中水稻根际提高了土壤甲基砷浓度,表明LH14可影响根际土壤环境中的砷转化。LH14具有在砷胁迫下产IAA的能力,增加了高砷浓度下种子萌发率、根和芽长及生物量。LH14接种显著增加水稻株高,并提高了根际植物有益菌的相对丰度,例如Burkholderiaceae和Gemmatimonadaceae,表明LH14可通过产生植物激素和富集根际有益菌,直接和间接地促进砷污染土壤中水稻生长,缓解水稻砷胁迫。
| [1] |
Zhu Y G, Yoshinaga M, Zhao F J, et al. Earth abides arsenic biotransformations[J]. Annual Review of Earth and Planetary Sciences, 2014, 42: 443-467. DOI:10.1146/annurev-earth-060313-054942
(  0) 0) |
| [2] |
Zhao F J, McGrath S P, Meharg A A. Arsenic as a food chain contaminant: Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61: 535-559. DOI:10.1146/annurev-arplant-042809-112152
(  0) 0) |
| [3] |
Qiao J T, Li X M, Hu M, et al. Transcriptional activity of arsenic-reducing bacteria and genes regulated by lactate and biochar during arsenic transformation in flooded paddy soil[J]. Environmental Science & Technology, 2018, 52(1): 61-70. DOI:10.3969/j.issn.1673-288X.2018.01.014
(  0) 0) |
| [4] |
Wang P P, Chen S C, Zhu Y G, et al. Advances in the research of arsenic methylation and volatilization by microorganisms (In Chinese)[J]. Journal of Agro-Environment Science, 2018, 37(7): 1377-1385. [王培培, 陈松灿, 朱永官, 等. 微生物砷甲基化及挥发研究进展[J]. 农业环境科学学报, 2018, 37(7): 1377-1385.]
(  0) 0) |
| [5] |
Xue X M, Zhu Y G. Arsenic biotransformation in soils and its relationship with antibiotic resistance (In Chinese)[J]. Acta Pedologica Sinica, 2019, 56(4): 763-772. [薛喜枚, 朱永官. 土壤中砷的生物转化及砷与抗生素抗性的关联[J]. 土壤学报, 2019, 56(4): 763-772.]
(  0) 0) |
| [6] |
Qin J, Rosen B P, Zhang Y, et al. Arsenic detoxification and evolution of trimethylarsine gas by a microbial arsenite S-adenosylmethionine methyltransferase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(7): 2075-2080.
(  0) 0) |
| [7] |
Huang K, Chen C, Zhang J, et al. Efficient arsenic methylation and volatilization mediated by a novel bacterium from an arsenic-contaminated paddy soil[J]. Environmental Science & Technology, 2016, 50(12): 6389-6396.
(  0) 0) |
| [8] |
Kuramata M, Sakakibara F, Kataoka R, et al. Arsenic biotransformation by Streptomyces sp. isolated from rice rhizosphere[J]. Environmental Microbiology, 2015, 17(6): 1897-1909. DOI:10.1111/1462-2920.12572
(  0) 0) |
| [9] |
Zhang J, Cao T T, Tang Z, et al. Arsenic methylation and volatilization by arsenite S-adenosylmethionine methyltransferase in Pseudomonas alcaligenes NBRC14159[J]. Applied and Environmental Microbiology, 2015, 81(8): 2852-2860. DOI:10.1128/AEM.03804-14
(  0) 0) |
| [10] |
Huang K, Xu Y, Packianathan C, et al. Arsenic methylation by a novel ArsM As(Ⅲ)S-adenosylmethionine methyltransferase that requires only two conserved cysteine residues[J]. Molecular Microbiology, 2018, 107(2): 265-276. DOI:10.1111/mmi.13882
(  0) 0) |
| [11] |
Chen J, Sun G X, Wang X X, et al. Volatilization of arsenic from polluted soil by Pseudomonas putida engineered for expression of the arsM Arsenic(Ⅲ)S-adenosine methyltransferase gene[J]. Environmental Science & Technology, 2014, 48(17): 10337-10344.
(  0) 0) |
| [12] |
Liu S, Zhang F, Chen J, et al. Arsenic removal from contaminated soil via biovolatilization by genetically engineered bacteria under laboratory conditions[J]. Journal of Environmental Sciences, 2011, 23(9): 1544-1550. DOI:10.1016/S1001-0742(10)60570-0
(  0) 0) |
| [13] |
Zhang J, Xu Y, Cao T T, et al. Arsenic methylation by a genetically engineered Rhizobium-legume symbiont[J]. Plant and Soil, 2017, 416(1): 259-269.
(  0) 0) |
| [14] |
Kumar S, Choudhary A K, Suyal D C, et al. Leveraging arsenic resistant plant growth-promoting rhizobacteria for arsenic abatement in crops[J]. Journal of Hazardous Materials, 2022, 425: 127965. DOI:10.1016/j.jhazmat.2021.127965
(  0) 0) |
| [15] |
Ghosh P K, Maiti T K, Pramanik K, et al. The role of arsenic resistant Bacillus aryabhattai MCC3374 in promotion of rice seedlings growth and alleviation of arsenic phytotoxicity[J]. Chemosphere, 2018, 211: 407-419. DOI:10.1016/j.chemosphere.2018.07.148
(  0) 0) |
| [16] |
Pandey S, Ghosh P K, Ghosh S, et al. Role of heavy metal resistant Ochrobactrum sp. and Bacillus spp. strains in bioremediation of a rice cultivar and their PGPR like activities[J]. Journal of Microbiology, 2013, 51(1): 11-17. DOI:10.1007/s12275-013-2330-7
(  0) 0) |
| [17] |
Das S, Jean J S, Chou M L, et al. Arsenite-oxidizing bacteria exhibiting plant growth promoting traits isolated from the rhizosphere of Oryza sativa L. : Implications for mitigation of arsenic contamination in paddies[J]. Journal of Hazardous Materials, 2016, 302: 10-18. DOI:10.1016/j.jhazmat.2015.09.044
(  0) 0) |
| [18] |
Bist V, Anand V, Srivastava S, et al. Alleviative mechanisms of silicon solubilizing Bacillus amyloliquefaciens mediated diminution of arsenic toxicity in rice[J]. Journal of Hazardous Materials, 2022, 428: 128170. DOI:10.1016/j.jhazmat.2021.128170
(  0) 0) |
| [19] |
Nautiyal C S, Srivastava S, Chauhan P S, et al. Plant growth-promoting bacteria Bacillus amyloliquefaciens NBRISN13 modulates gene expression profile of leaf and rhizosphere community in rice during salt stress[J]. Plant Physiology and Biochemistry, 2013, 66: 1-9. DOI:10.1016/j.plaphy.2013.01.020
(  0) 0) |
| [20] |
Cheng T, Yao X Z, Wu C Y, et al. Endophytic Bacillus megaterium triggers salicylic acid-dependent resistance and improves the rhizosphere bacterial community to mitigate rice spikelet rot disease[J]. Applied Soil Ecology, 2020, 156: 103710. DOI:10.1016/j.apsoil.2020.103710
(  0) 0) |
| [21] |
Anand V, Kaur J, Srivastava S, et al. Potential of methyltransferase containing Pseudomonas oleovorans for abatement of arsenic toxicity in rice[J]. Science of the Total Environment, 2023, 856: 158944. DOI:10.1016/j.scitotenv.2022.158944
(  0) 0) |
| [22] |
Zhong S X, He H F, Chen Z L, et al. Advancement in study on biochemical behavior of arsenic in flooded paddy soil (In Chinese)[J]. Acta Pedologica Sinica, 2018, 55(1): 1-17. [钟松雄, 何宏飞, 陈志良, 等. 水淹条件下水稻土中砷的生物化学行为研究进展[J]. 土壤学报, 2018, 55(1): 1-17.]
(  0) 0) |
| [23] |
Viacava K, Meibom K L, Ortega D, et al. Variability in arsenic methylation efficiency across aerobic and anaerobic microorganisms[J]. Environmental Science & Technology, 2020, 54(22): 14343-14351.
(  0) 0) |
| [24] |
Chen C, Huang K, Xie W Y, et al. Microbial processes mediating the evolution of methylarsine gases from dimethylarsenate in paddy soils[J]. Environmental Science & Technology, 2017, 51(22): 13190-13198.
(  0) 0) |
| [25] |
Saxena A K, Kumar M, Chakdar H, et al. Bacillus species in soil as a natural resource for plant health and nutrition[J]. Journal of Applied Microbiology, 2020, 128(6): 1583-1594. DOI:10.1111/jam.14506
(  0) 0) |
| [26] |
Abedin M J, Meharg A A. Relative toxicity of arsenite and arsenate on germination and early seedling growth of rice(Oryza sativa L.)[J]. Plant and Soil, 2002, 243(1): 57-66. DOI:10.1023/A:1019918100451
(  0) 0) |
| [27] |
Ma Y, Prasad M N V, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 2011, 29(2): 248-258. DOI:10.1016/j.biotechadv.2010.12.001
(  0) 0) |
| [28] |
Glick B R, Penrose D M, Li J P. A model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria[J]. Journal of Theoretical Biology, 1998, 190(1): 63-68. DOI:10.1006/jtbi.1997.0532
(  0) 0) |
| [29] |
Srivastava S, Verma P C, Chaudhry V, et al. Influence of inoculation of arsenic-resistant Staphylococcus arlettae on growth and arsenic uptake in Brassica juncea(L.)Czern. Var. R-46[J]. Journal of Hazardous Materials, 2013, 262: 1039-1047. DOI:10.1016/j.jhazmat.2012.08.019
(  0) 0) |
| [30] |
Wang S Q, Wei S J, Yang T T, et al. Effect of streptomyces JD211 promoting growth of rice seedlings and diversity of soil bacteria (In Chinese)[J]. Acta Pedologica Sinica, 2015, 52(3): 673-681. [王世强, 魏赛金, 杨陶陶, 等. 链霉菌JD211对水稻幼苗促生作用及土壤细菌多样性的影响[J]. 土壤学报, 2015, 52(3): 673-681.]
(  0) 0) |
| [31] |
Eberl L, Vandamme P. Members of the genus Burkholderia: good and bad guys[J]. F1000Research, 2016, 5: F1000FacultyRev-1007.
(  0) 0) |
| [32] |
Liu C, Zhuang J Y, Wang J, et al. Soil bacterial communities of three types of plants from ecological restoration areas and plant-growth promotional benefits of Microbacterium invictum(strain X-18)[J]. Frontiers in Microbiology, 2022, 13: 926037. DOI:10.3389/fmicb.2022.926037
(  0) 0) |
| [33] |
Li Q Q, Xu S, Zhao W, et al. Rhizosphere microbiome mediated growth-promoting mechanisms of Bacillus amyloliquefaciens FH-1 on rice (In Chinese)[J]. Acta Microbiologica Sinica, 2019, 59(12): 2410-2426. [李晴晴, 徐松, 赵维, 等. 根际微生物组介导的解淀粉芽孢杆菌FH-1对水稻的促生机制[J]. 微生物学报, 2019, 59(12): 2410-2426.]
(  0) 0) |
| [34] |
Tang Z, Kang Y Y, Wang P T, et al. Phytotoxicity and detoxification mechanism differ among inorganic and methylated arsenic species in Arabidopsis thaliana[J]. Plant and Soil, 2016, 401(1): 243-257.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


