铁是植物生长发育所必须的微量营养元素[1]。我国广泛分布的石灰性土壤中,高pH和高浓度的重碳酸氢盐严重降低了土壤中铁的有效性[2],导致植物缺铁而引起叶片失绿黄化,严重影响植物生长发育、作物产量和品质[1,3]。已有证据表明双子叶植物和非禾本科单子叶植物通常依靠以铁还原为基础的机理Ⅰ(Strategy Ⅰ)吸收铁[4]。但是,在碱性缺铁土壤中植物释放的质子大多被高pH条件所缓冲,根系铁螯合还原酶活性也被严重抑制[2],机理Ⅰ植物中以铁还原为基础的吸收途径很容易受到阻碍。通过外源添加有益微生物来提高土壤铁的有效性是缓解石灰性土壤植物缺铁胁迫的有效途径之一。
丛枝菌根(Arbuscular Mycorrhizal,AM)真菌是一类常见的植物根系共生菌,能与陆地上80%以上的植物建立共生关系,具有抵抗水分、盐碱及养分胁迫的能力[5]。AM真菌可有效改善植物磷营养已成为共识,然而最新研究表明AM真菌由于缺乏磷酸酶合成基因本身难以溶解有机磷[6],但在根际解磷菌的作用下则可发挥解磷作用[7],因此,AM真菌的解磷机制与根际细菌的联合作用紧密相关[8],该观点在丛枝菌根真菌(AMF)菌剂的应用方面得到验证,菌剂中AM真菌的促生作用可能与菌剂混合物中的其他微生物有关。在缺铁条件下接种AM真菌对向日葵[9]、榅桲[10]等植物均具有一定促生作用,一方面可能通过分泌酚类化合物等来提高铁的有效性;另一方面可能与定殖在AM真菌菌丝和孢子表面的根际细菌的共同作用[11]有关。关于根际细菌改善植物铁营养的研究也较为广泛,Youry等[12]通过接种根际细菌能够刺激植物根系分泌次生代谢物如酚类化合物增强根际Fe3+螯合或还原。而关于溶铁细菌与AM真菌联合接种改善植物铁吸收的研究较少,Radheshyam等[13]将分离得到的不同根际促生细菌与AM真菌联合接种,发现其中枯草芽孢杆菌和AM真菌组合可显著促进小麦籽粒中铁含量增加。此外,土壤pH和石灰性土壤条件显著影响AM真菌与植物的共生关系[14]。
植物吸收铁途径主要表现为根系质膜质子泵外排H+,使根际土壤酸化,促进难溶性铁的溶解,Fe3+在根系表面被铁还原酶(由FRO基因编码)还原为Fe2+,通过转运蛋白(由IRT基因编码)转运至根细胞内供植物吸收利用[15]。FIT1是植物缺铁反应的主控调控因子,调控了绝大部分铁相关基因的表达[16]。此外,也有研究表明根特异性转录因子AtMYB72在根际细菌介导的微生物与植物根系分泌物互作的调控中起着核心作用[17],同时也是植物适应缺铁策略的一个重要组成部分。通过根际细菌进一步促进石灰性土壤上AM真菌改善植物铁营养的效应是提高铁有效性的重要途径。本研究在盆栽试验筛选根际高效溶铁细菌的基础上,分别与纯培养得到的AMF孢子共接种,探讨AM真菌与溶铁细菌协同促进石灰性土壤难溶性铁的活化和促进植物铁吸收的机制,为制备高效菌根-溶铁细菌复合菌剂提供理论依据,促进石灰性土壤上农业可持续发展。
1 材料与方法 1.1 供试土壤与材料供试土壤为甘肃省兰州景泰县(36°43′N,103°33′E)的石灰性土壤,土壤理化性状见表 1。将新鲜土壤自然风干过20目筛,辐照灭菌后与石英砂(灭菌)以3︰1(v/v)混合,每盆装250 g混合土样。
|
|
表 1 供试土壤基础理化性质 Table 1 Basic physicochemical properties of soil tested |
供试细菌为实验室前期从番茄根际分离到的5株根际细菌,分别为Advenella kashmirensis(B1)、Arthrobacter cupressi(B2)、Klebsiella variicola(B3)、Variovorax guangxiensis(B4)和Enterobacter ludwigii(B5)。
供试AMF菌剂为根内球囊霉(Rhizoshagu irregularis MUCL 43194,Ri)。菌剂来源及孢子纯化方法:柠檬酸钠缓冲液溶解胡萝卜离体根纯培养的Ri孢子凝胶,真空抽滤,无菌水将孢子冲洗下来后血球计数器计数并稀释得到纯净的Ri孢子悬液。
供试植物材料:红矮生樱桃小番茄(Lycopersicon esculentum)。
1.2 根际溶铁细菌的筛选番茄育苗:番茄种子提前用去离子水浸泡12 h,75%酒精浸泡1 min,无菌水冲洗3~5次,2%(v/v)次氯酸钠溶液浸泡15 min,无菌水冲洗5次。消毒好的番茄种子均匀地平铺在灭菌的滤纸上催芽3~5 d,挑选萌发的种子点播于灭菌的穴盘基质中,至番茄长出三片真叶时移栽至上述混合土壤中。
设置5株单细菌接种处理分别为B1、B2、B3、B4和B5,以不接种对照(CK),每个处理设6个重复。番茄移栽一周后接种细菌悬液(终浓度为107 CFU·g–1土壤),培养25 d后收获。
1.3 高效溶铁细菌单株及菌群与AMF共培养盆栽试验番茄育苗和移栽同上。
设置单接种AMF处理(Ri)、三株单细菌分别与AMF共接种处理(B1+Ri、B2+Ri、B3+Ri)、混合细菌与AMF共接种处理(B1+B2+B3+Ri),以不接种为对照(CK)。每个处理设6个重复,移栽时接种Ri孢子液(每盆500个孢子)至番茄根系,待AMF定殖20 d后,接种细菌悬液(终浓度为107 CFU·g–1土壤),番茄生长25 d后收获。
1.4 菌根侵染率及菌丝密度测定菌根侵染率检测采用台盼蓝染色法[18];菌丝密度采用网格交叉法测定[18]。
| $ \text { 侵染率 } \mathrm{F} / \%=(\text { 侵染根段数/总根段数 } ) \times 100 $ | (1) |
| $ \begin{array}{c} 侵染强度 {\rm{M}}/\%= ( 95 \% {\rm{n5}}+70\% {\rm{n4}}+30\% {\rm{n3}}+5\%\\ \mathrm{n} 2+\mathrm{n} 1 ) /总根数 \times 100 \end{array} $ | (2) |
式中,n5为侵染达根段90%以上的根数;n4为侵染达根段50%~90%的根数;n3为侵染达根段10%~50 %的根数;n2为侵染达根段10%以内的根数;n1为侵染达根段5%以内的根数。
菌丝密度计算公式:菌丝密度/(m·g–1)=菌丝长度/风干土质量
1.5 土壤pH和有效铁含量测定土壤有效铁采用二乙三胺五乙酸(DTPA)浸提法,电感耦合等离子体发射光谱仪(ICP-OES)测定[19];土壤pH使用pH计(METTLER TOLEDO,梅特勒-托利多仪器(上海)有限公司)测定,水(煮沸去除CO2)土比为2.5︰1。
1.6 番茄生理及铁含量指标测定统计番茄根、茎、叶片干物质量(105℃杀青30 min,75℃烘干至恒重);根系形态使用根系扫描仪(WinRHIZO,美国)测定总根长、根表面积、根平均直径、根体积及总根尖数;叶绿素含量测定采用无水乙醇浸提比色法[20];根系铁螯合还原酶活性测定采用2,2’-联吡啶比色法[21];根系和新叶活性铁含量采用1 mol·L–1 HCl浸提,ICP-OES测定[20];根茎叶全铁含量采用HNO3-HClO4(4:1 v/v)消煮,ICP-OES测定(注:全铁含量与植株干物质量的乘积为全铁积累量)[20]。
1.7 根系铁吸收相关基因相对定量参照Zhou等[22]的方法采用实时荧光定量PCR测定。
提取番茄根系总RNA并反转录得到cDNA。进行实时荧光定量PCR:将反转录得到的cDNA样品作为模板,选取Actin作为内参基因,番茄与铁吸收相关的同源基因为目的基因,其引物序列如下表 2,使用qPCR试剂盒(ChamQ Universal SYBR qPCR Master Mix,Q711,诺唯赞)进行定量;q RT-PCR扩增程序:预变性95℃ 30 s,循环反应95℃ 10 s,60℃ 30 s,循环40次,熔解曲线95℃ 15 s,60℃ 60 s,95℃ 15 s。
|
|
表 2 q RT-PCR引物序列 Table 2 Primer sequence of q RT-PCR |
使用WPS Office Excel 2019处理原始数据,所有结果用平均数±标准差表示。使用SPSS Statistics 26进行差异显著性分析和多重比较,显著性水平为P < 0.05。使用Graphpad Prism 9进行绘图。
2 结果 2.1 高效溶铁菌株的筛选与CK相比,接种B1、B2、B3可显著改善番茄缺铁失绿现象(图 1a),并均显著提高番茄根茎叶的生物量,而B4和B5与CK无显著差异(图 1a,图 1c)。接种B1、B2、B3和B5显著提高叶片活性铁含量,分别增加74.21%、133.66%、175.8%和69.6%(图 1b)。B1、B2和B3还显著增加根系和地上部全铁积累量,分别增加6.48倍和2.61倍、4.11倍(根系)和2.03倍、4.37倍和2.25倍(地上部),而B4仅增加了地上部总铁积累量,B5仅增加了叶片活性铁含量(图 1d,图 1b)。综上,B1、B2和B3促进番茄生长和铁吸收的效果最好。
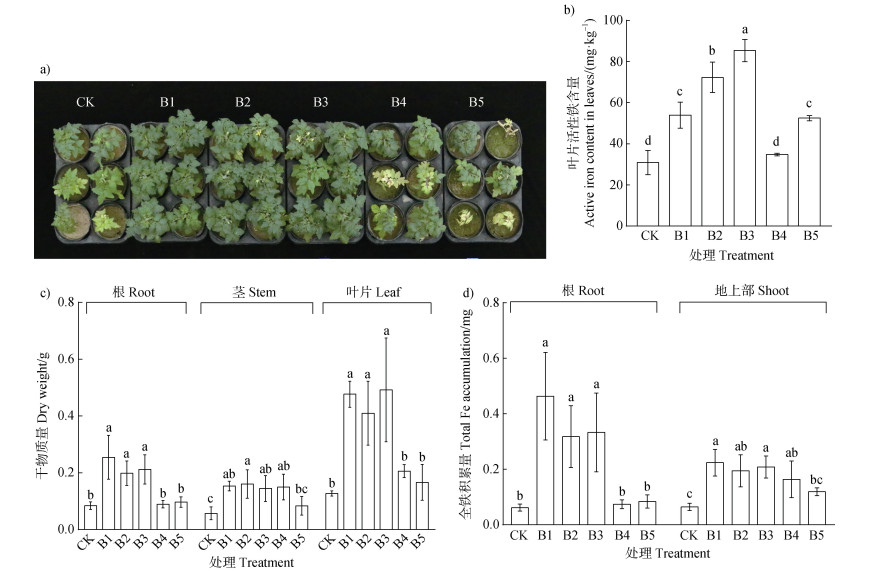
|
注:不同小写字母表示相同部位不同处理间在0.05水平下差异显著。CK,不接菌处理;B1、B2、B3、B4、B5分别表示接种B1、B2、B3、B4、B5根际细菌处理。下同。 Note: Different lowercase letters indicate significant differences between treatments in the same part(P < 0.05). CK, no inoculation; B1, B2, B3, B4 and B5 respectively represent the inoculation of B1, B2, B3, B4 and B5 with rhizosphere bacteria. The same as below. 图 1 单接种5株根际细菌对石灰性土壤上番茄生长(a和c)、叶片活性铁含量(b)和根系及地上部全铁积累量(d)的影响 Fig. 1 Effects of single inoculation of 5 rhizosphere bacteria on tomato growth(a, c), active iron content in leaves(b)and total iron accumulation in root and shoot(d)in calcareous soil |
由图 2可知,与Ri处理相比,细菌与AM真菌共接种处理下番茄地上部生物量分别显著提高60.0%、44.5%、63.6%、92.3%,其中B1+B2+B3+Ri处理下番茄根系生物量较Ri处理显著增加63.64%。如图 3a所示,与Ri相比,细菌及混合细菌分别与AM真菌共接种处理下番茄叶绿素含量均显著提高。所有细菌与Ri共接种(B1+Ri、B2+Ri、B3+Ri、B1+B2+B3+Ri)处理均显著提高了番茄根和叶片中全铁积累量,分别提高45.22%和92.86%、49.25%和75.71%、57.16%和95.09%、107.46%和159.46%。在茎中,B2+Ri、B3+Ri和B1+B2+B3+Ri处理下全铁积累量分别提高50%、75.86%和91.38%。与单接Ri相比,B3与Ri共接种处理下根系活性铁含量最高,达119.59 mg·kg–1,显著高于其他处理。在叶片中,B1和B3分别与Ri共接种处理下活性铁含量显著提高41.23%和44.30%(图 3b)。
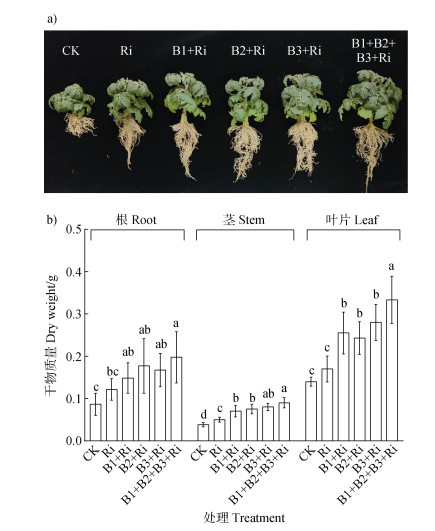
|
注:Ri,单独接种AM真菌处理。下同。 Note: Ri, inoculated with AM fungus alone. The same as below. 图 2 三株溶铁细菌与丛枝菌根真菌共接种对番茄生长的影响(a. 不同接菌处理下番茄生长表型;b. 不同接菌处理下番茄根、茎和叶片的干物质量) Fig. 2 Effect of co-inoculation of three strains of iron-solubilizing bacteria with arbuscular mycorrhizal fungi on tomato growth(a. Tomato growth phenotype under different inoculation treatments; b. Dry biomass of tomato root, stem and leaves under different inoculation treatments) |
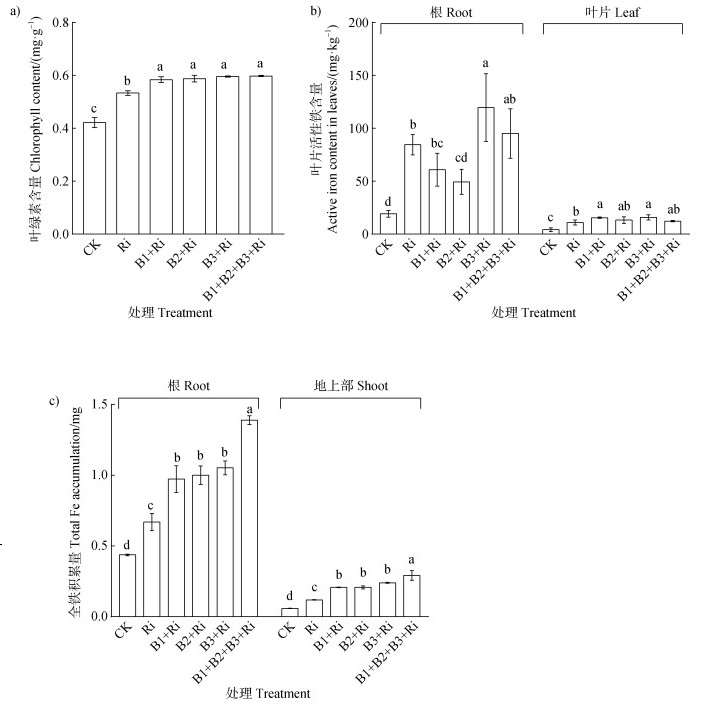
|
图 3 溶铁细菌与丛枝菌根真菌共接种对番茄叶绿素含量(a)、根和叶片活性铁含量(b)、根系和地上部全铁积累量(c)的影响 Fig. 3 Effects of co-inoculation of iron-solubilizing bacteria and arbuscular mycorrhizal fungi on chlorophyll content(a), active iron content in roots and leaves(b), total iron accumulation in root and shoot(c)of tomato |
在菌根处理下番茄根系中均发现了典型的菌根结构,而未接种AM真菌的处理中未发现菌根结构(图 4)。与单接种Ri相比,单株细菌及菌群与AM真菌的组合均可显著增加菌根侵染率、侵染强度(表 3),其中B1+Ri、B2+Ri、B3+Ri及B1+B2+B3+Ri的菌根侵染率分别显著提高13.35%、18.34%、21.64%和30.99%,侵染强度分别显著提高20.03%、28.27%、30.87%和35.70%。除了B1+B2+B3+Ri处理,其余处理的菌丝密度与Ri均无显著差异。综上,B1+B2+B3+Ri处理下的菌根侵染率、侵染强度和菌丝密度最高(表 3)。
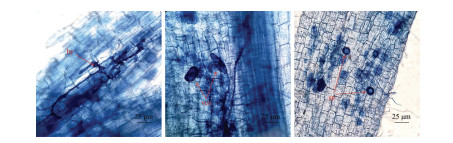
|
注:hy,菌丝结构;ves,泡囊;sp,孢子。 Note: hy: hyphal structure; ves: vesicle; sp: spore. 图 4 显微镜下观察番茄根系中丛枝菌根真菌的共生结构(40×) Fig. 4 Symbiotic structure of arbuscular mycorrhizal fungi in tomato roots observed under a microscope(40×) |
|
|
表 3 细菌和AM真菌双接种对番茄根系菌根侵染率、侵染强度和菌丝密度的影响 Table 3 Effects of inoculated bacteria and AM fungi on mycorrhizal infection rate, infection intensity and hyphal density of tomato roots |
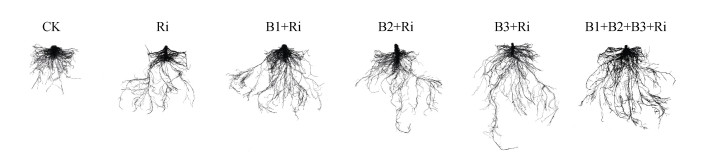
由图 5所示,与CK相比,各接菌处理均明显改善番茄的根系形态,显著提高根系长度、根表面积、根体积和根尖数,接种AM真菌进一步促进了番茄根系生长(图 5,表 4)。与Ri处理相比,B2+Ri处理下番茄根表面积显著提高30.60%,B3+Ri和B1+B2+B3+Ri处理下番茄根系形态指标分别显著提高30.04%和20.10%(根长)、37.49%和38.90%(根表面积)、28.87%和44.33%(根体积),其中B1+B2+B3+Ri处理番茄根尖数显著增加44.62%(表 4)。
|
图 5 各接菌处理下番茄根系扫描图 Fig. 5 Scanning images of tomato roots under control and inoculation treatments |
|
|
表 4 溶铁细菌与AM真菌共接种对番茄根系形态的影响 Table 4 Effect of co-inoculation of iron-solubilizing bacteria and AM fungi on root morphology of tomato |
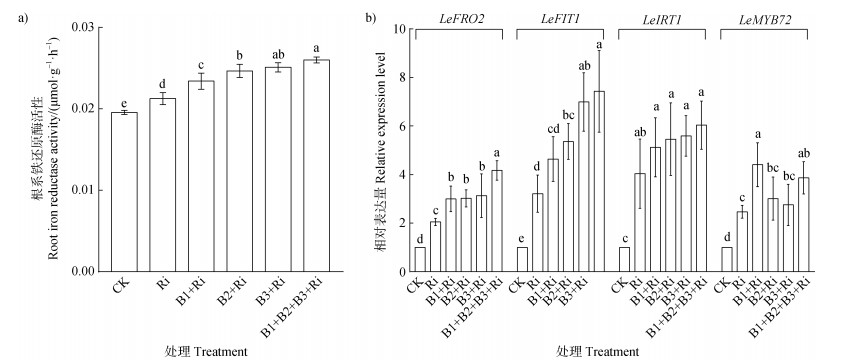
由图 6可知,与对照相比,各接菌处理均显著提高了番茄根系铁还原酶活性、LeFRO2、LeIRT1、LeFIT1和LeMYB72的基因表达量。与单接Ri相比,同时接种细菌与Ri显著提高番茄根系铁还原酶活性、LeFRO2、LeFIT1和LeMYB72的基因表达水平。其中,混合细菌与AM真菌双接种处理下番茄根系铁还原酶活性、LeFIT1、LeFRO2、LeIRT1和LeMYB72基因表达量最高,分别较单接AM真菌上调22.07%、508.1%、317.3%、503.5%和286.7%。与CK相比,各细菌与AM真菌组合处理下显著上调番茄根系中LeIRT1的表达,较单接Ri处理下其表达量有升高的趋势但无显著差异(图 6b)。
|
图 6 溶铁细菌和AM真菌共接种对番茄根系铁还原酶活性(a)及铁吸收相关基因相对表达量(b)的影响 Fig. 6 Effects of co-inoculation of iron-solubilizing bacteria and AM fungi on ferric reductase activity(a)and relative expression levels of LeIFT1, LeFRO2, LeIRT1 and LeMYB72 genes(b)in tomato roots. |
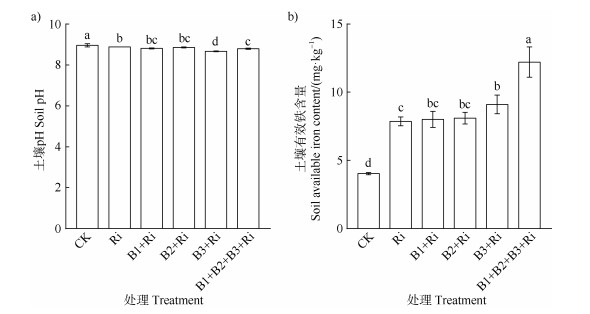
由图 7a可知,与CK相比,各接菌处理均可显著降低番茄根际土壤pH,与单接Ri处理相比,溶铁细菌与AM真菌组合处理下土壤pH均有下降的趋势,其中B3+Ri处理下番茄根际土壤的pH最低(8.67),相比Ri显著降低了0.21;与土壤pH一致,与CK相比,各接菌处理均能显著提高番茄根际土壤的有效铁含量;与Ri相比,B1+Ri和B2+Ri处理下土壤有效铁含量略有提高,其中B3+Ri和B1+B2+B3+Ri处理下土壤有效铁含量分别显著提高15.78%和55.23%(图 7b)。
|
图 7 溶铁细菌和AM真菌共接种处理下土壤pH(a)和有效铁含量(b) Fig. 7 Soil pH(a)and available iron content(b)under co-inoculation of iron-solubilizing bacteria and AM fungi |
根际微生物对于植物生长发育及养分吸收至关重要,逆境中植物通常招募土壤中特定的功能微生物以缓解胁迫[23]。微生物在植物铁吸收中也发挥着重要作用,如分泌质子、产有机酸等次生代谢物、产铁载体及一系列氧化还原等过程[24]。本研究筛选获得3株高效溶铁细菌可有效改善石灰性土壤上番茄铁营养,尤其是B3提高叶片中活性铁含量(图 1d)。虽然铁在地壳中含量很高,但受pH及其他因素影响,其在碱性和石灰性土壤中有效性很低。根际微生物可通过分泌H+降低根际pH,直接增加铁矿物的溶解度,或分泌有机酸等次生代谢物质螯合难溶性铁,促进土壤铁矿物的生物转化[25]。本试验中,单独接种AM真菌可在一定程度上降低土壤pH、提高土壤有效铁含量,而将上述3株溶铁细菌单独或混合与AM真菌共接种的效果更显著,尤其是包含B3的处理(图 7b),表明溶铁细菌与AM真菌存在协同作用且不同溶铁细菌与AM真菌间存在不同的互作机制。
3.2 根际溶铁细菌与AM真菌联合接种增强菌根功能在土壤养分缺乏条件下AM真菌通过产生并形成大量菌丝将土壤中的养分转移至植物体内[6]。植物-AM真菌-根际细菌系统被认为是一个连续体,细菌不仅定殖于植物根部,还在相关的菌根菌丝网络中定殖[26]。AM真菌对根际细菌功能的调控是土壤矿质养分转化的关键途径之一。Zhang等[6]发现AM真菌能增加溶磷细菌在根际的定殖数量,原因是菌丝不断扩展形成的巨大菌丝网络为根际细菌提供了更多的生态位,使其能够紧密地附着于菌丝上,增强了根际细菌的定殖率[27],促进了AM真菌与根系的物质和信号传递,进一步有利于将植物产生的碳水化合物分泌至菌丝际促进根际细菌生长并增强其功能[28]。最新研究结果表明,与AM真菌(菌丝)相关的细菌已被确定为植物-AM真菌共生的第三个组成部分,在菌根功能中发挥着关键作用[29]。本研究发现单株溶铁细菌或菌群均可显著增加菌根侵染率、侵染强度和菌丝密度(图 4,表 3),表明AM真菌的功能受到溶铁细菌的调控。
3.3 根际溶铁细菌与AM真菌协同改善植物根系形态并促进铁吸收根系是植物吸收养分和水分的主要器官,良好的根系构型有利于促进植物对矿质元素的吸收[30]。本研究中,与单接Ri相比,B3+Ri和B1+B2+B3+Ri显著增加了根长、根表面积、根体积和根尖数,而B1+Ri和B2+Ri无显著差异(图 5,表 4),进一步说明3株溶铁细菌可能具有不同的促生功能。B3属于Klebsiella属,已被证明可产生大量的生长素类物质[31],推测B3可能通过产生生长素类物质促进番茄根系生长,分泌更多的有机酸等物质而降低土壤pH、增加铁的有效性,从而有利于植株对铁的吸收。
3.4 根际溶铁细菌与AM真菌联合作用增加根系铁还原酶活性及上调铁吸收相关基因的表达本研究中不同单菌或菌群与AM真菌组合均可增加根系铁还原酶活性并与LeFRO2表达模式一致(图 6a,图 6b),表明溶铁细菌与AM真菌可促进根际铁的还原,改善植物铁营养。与CK相比各接菌处理均能上调LeIRT1的表达量,而与单独接种AM真菌相比差异不显著(图 6d),表明溶铁细菌可能不直接调控LeIRT1基因的表达而通过提高AM真菌定殖程度间接调控,推测AM真菌可能是调控LeIRT1基因表达的关键因素。Zamioudis等[32]认为,AtMYB72除了对诱导植株系统抗性的发生至关重要外,也是植物适应缺铁策略的一个重要因素,其表达受转录因子AtFIT1的调控。在供铁不足条件下,拟南芥AtMYB72在根系中被强烈诱导表达,通过激活苯丙素途径促进荧光酚类化合物的产生并分泌至根际,促进植物在铁有效性低的条件下对铁的吸收[33]。本试验中不同单菌或菌群与AM真菌组合均可显著上调番茄根系中LeFIT1表达(图 6c),激活植物对缺铁的应答反应。与Ri相比,仅有B1+Ri和B1+B2+B3+Ri处理中LeMYB72相对表达量显著上调,其他处理间无显著差异(图 6b),说明B1菌可能通过LeFIT1调控下游LeMYB72的表达诱导系统抗性的发生,促进酚类化合物的合成和分泌,从而有利于根际铁活化和植物铁吸收。
4 结论本研究筛选获得3株高效根际溶铁细菌,可促进石灰性土壤上番茄生长并提高番茄铁吸收。与单独接种AM真菌相比,3株溶铁细菌与AM真菌联合接种可有效提高菌根侵染能力并改善植株根系生长,进而扩大根系对土壤养分的吸收范围,直接促进铁吸收;共接种能够有效降低根际土壤pH、提高土壤有效铁含量,促进石灰性土壤中难溶性铁的活化;此外,共接种处理能够显著提高番茄根系铁还原酶活性,上调根系铁吸收相关基因的表达,有效促进植株对铁的吸收和积累,综合各项指标表明,菌群与AM真菌的混合(B1+B2+B3+Ri)接种效果最好。因此,三株溶铁细菌协同AM真菌能够促进石灰性土壤上难溶性铁的活化并有效改善植物铁吸收。
| [1] |
Vose P B. Iron nutrition in plants: A world overview[J]. Journal of Plant Nutrition, 1982, 5(4/7): 233-249.
(  0) 0) |
| [2] |
Shi W M. Biological availability of iron in calcareous soil and its influencing factors (In Chinese)[J]. Soils, 1990, 22(2): 75—77, 82. DOI:10.3321/j.issn:0253-9829.1990.02.002 [施卫明. 石灰性土壤中铁的生物有效性及其影响因素[J]. 土壤, 1990, 22(2): 75—77, 82.]
(  0) 0) |
| [3] |
Zuo Y M, Zhang F S. Effect of peanut mixed cropping with gramineous species on micronutrient concetrations and iron chlorosis of peanut plants grown in a calcareous soil[J]. Plant and Soil, 2008, 306(1/2): 23-36.
(  0) 0) |
| [4] |
Zhang L L, Liu X X, Zhu Y X, et al. Research progresses on iron uptake, translocation and their signaling pathways in strategy Ⅰ plants (In Chinese)[J]. Journal of Plant Nutrition and Fertilizers, 2021, 27(7): 1258-1272. [张林琳, 刘星星, 祝亚昕, 等. 机理Ⅰ植物铁营养的吸收转运及信号调控机制研究进展[J]. 植物营养与肥料学报, 2021, 27(7): 1258-1272.]
(  0) 0) |
| [5] |
Pu Z T, Zhang L, Zhang C, et al. Research progress of arbuscular mycorrhizal fungi and plant symbiosis affecting plant water regime (In Chinese)[J]. Soils, 2022, 54(5): 882-889. [蒲子天, 张林, 张弛, 等. 丛枝菌根真菌与植物共生影响植物水分状态的研究进展[J]. 土壤, 2022, 54(5): 882-889.]
(  0) 0) |
| [6] |
Zhang L, Xu M G, Liu Y, et al. Carbon and phosphorus exchange may enable cooperation between an arbuscular mycorrhizal fungus and a phosphate-solubilizing bacterium[J]. New Phytologist, 2016, 210(3): 1022-1032. DOI:10.1111/nph.13838
(  0) 0) |
| [7] |
Wang L T, Zhang L, George T S, et al. A core microbiome in the hyphosphere of arbuscular mycorrhizal fungi has functional significance in organic phosphorus mineralization[J]. New Phytologist, 2022, 238(2): 859-873.
(  0) 0) |
| [8] |
Saia S, Aissa E, Luziatelli F, et al. Growth-promoting bacteria and arbuscular mycorrhizal fungi differentially benefit tomato and corn depending upon the supplied form of phosphorus[J]. Mycorrhiza, 2020, 30(1): 133-147. DOI:10.1007/s00572-019-00927-w
(  0) 0) |
| [9] |
Kabir A H, Debnath T, Das U, et al. Arbuscular mycorrhizal fungi alleviate Fe-deficiency symptoms in sunflower by increasing iron uptake and its availability along with antioxidant defense[J]. Plant Physiology and Biochemistry, 2020, 150: 254-262. DOI:10.1016/j.plaphy.2020.03.010
(  0) 0) |
| [10] |
Rahimi S, Baninasab B, Talebi M, et al. Arbuscular mycorrhizal fungi inoculation improves iron deficiency in quince via alterations in host root phenolic compounds and expression of genes[J]. Scientia Horticulturae, 2021, 285: 110165. DOI:10.1016/j.scienta.2021.110165
(  0) 0) |
| [11] |
Emmett B D, Lévesque-Tremblay V, Harrison M J. Conserved and reproducible bacterial communities associate with extraradical hyphae of arbuscular mycorrhizal fungi[J]. The ISME Journal, 2021, 15(8): 2276-2288. DOI:10.1038/s41396-021-00920-2
(  0) 0) |
| [12] |
Youry P, Alexander P, Roberto T, et al. Plant-microorganism-soil interactions influence the Fe availability in the rhizosphere of cucumber plants[J]. Plant Physiology and Biochemistry, 2015, 87: 45-52. DOI:10.1016/j.plaphy.2014.12.014
(  0) 0) |
| [13] |
Radheshyam Y, Pankaj R, Parikshita R, et al. Bacteria from native soil in combination with arbuscular mycorrhizal fungi augment wheat yield and biofortification[J]. Plant Physiology and Biochemistry, 2020, 150(C): 222-233.
(  0) 0) |
| [14] |
Islam M N, Germida J J, Walley F L, et al. Survival of a commercial AM fungal inoculant and its impact on indigenous AM fungal communities in field soils[J]. Applied Soil Ecology, 2021, 166: 103979. DOI:10.1016/j.apsoil.2021.103979
(  0) 0) |
| [15] |
Robinson N J, Procter C M, Connolly E L, et al. A ferric-chelate reductase for iron uptake from soils[J]. Nature, 1999, 397(6721): 694-697. DOI:10.1038/17800
(  0) 0) |
| [16] |
Colangelo E P, Guerinot M L. The essential basic helix-loop-helix protein FIT1 is required for the iron deficiency response[J]. Plant Cell, 2004, 16(12): 3400-3412. DOI:10.1105/tpc.104.024315
(  0) 0) |
| [17] |
Stringlis I A, Yu K, Feussner K, et al. MYB72-dependent coumarin exudation shapes root microbiome assembly to promote plant health[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(22): 5213-5222.
(  0) 0) |
| [18] |
Sheng P P, Liu R J, Li M. Methodological comparison of observation and colonization measurement of arbuscular mycorrhizal fungi (In Chinese)[J]. Mycosystema, 2011, 30(4): 519-525. [盛萍萍, 刘润进, 李敏. 丛枝菌根观察与侵染率测定方法的比较[J]. 菌物学报, 2011, 30(4): 519-525.]
(  0) 0) |
| [19] |
Lu R K. Analytical methods for soil and agrochemistry (In Chinese). Beijing: China Agricultural Sciences and Technology Press, 2000. [鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.]
(  0) 0) |
| [20] |
Li H S. Principles and techniques of plant physiological and biochemical experiment (In Chinese). Beijing: Higher Education Press, 2000. [李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.]
(  0) 0) |
| [21] |
Xu L Z, Zhang F S, Li C J. 2, 2'-bipyridyl-colorimetric method for measurement of Fe(Ⅲ)reductase activity in roots of dicotyls (In Chinese)[J]. Plant Nutrition and Fertilizer Science, 1998, 4(1): 63-66. DOI:10.3321/j.issn:1008-505X.1998.01.010 [许良政, 张福锁, 李春俭. 双子叶植物根系Fe3+还原酶活性的2, 2'-联吡啶比色测定法[J]. 植物营养与肥料学报, 1998, 4(1): 63-66.]
(  0) 0) |
| [22] |
Zhou C, Zhu L, Ma Z Y, et al. Improved iron acquisition of Astragalus sinicus under low iron-availability conditions by soil-borne bacteria Burkholderia cepacia[J]. Journal of Plant Interactions, 2018, 13(1): 9-20. DOI:10.1080/17429145.2017.1407000
(  0) 0) |
| [23] |
Trivedi P, Leach J E, Tringe S G, et al. Plant-microbiome interactions: From community assembly to plant health[J]. Nature Reviews Microbiology, 2020, 18(11): 607-621. DOI:10.1038/s41579-020-0412-1
(  0) 0) |
| [24] |
Jin C W, Ye Y Q, Zheng S J. An underground tale: Contribution of microbial activity to plant iron acquisition via ecological processes[J]. Annals of Botany, 2014, 113(1): 7-18. DOI:10.1093/aob/mct249
(  0) 0) |
| [25] |
Hu S W, Liu T X, Li F B, et al. The abiotic and biotic transformation processes of soil iron-bearing minerals and its interfacial reaction mechanisms of heavy metals: A review (In Chinese)[J]. Acta Pedologica Sinica, 2022, 59(1): 54-65. DOI:10.11766/trxb202010300268 [胡世文, 刘同旭, 李芳柏, 等. 土壤铁矿物的生物-非生物转化过程及其界面重金属反应机制的研究进展[J]. 土壤学报, 2022, 59(1): 54-65.]
(  0) 0) |
| [26] |
Jiang F Y, Zhang L, Zhou J C, et al. Arbuscular mycorrhizal fungi enhance mineralisation of organic phosphorus by carrying bacteria along their extraradical hyphae[J]. New Phytologist, 2021, 230(1): 304-315. DOI:10.1111/nph.17081
(  0) 0) |
| [27] |
Zhang L, Shi N, Fan J Q, et al. Arbuscular mycorrhizal fungi stimulate organic phosphate mobilization associated with changing bacterial community structure under field conditions[J]. Environmental Microbiology, 2018, 20(7): 2639-2651. DOI:10.1111/1462-2920.14289
(  0) 0) |
| [28] |
Kaiser C, Kilburn M R, Clode P L, et al. Exploring the transfer of recent plant photosynthates to soil microbes: Mycorrhizal pathway vs direct root exudation[J]. New Phytologist, 2015, 205(4): 1537-1551. DOI:10.1111/nph.13138
(  0) 0) |
| [29] |
Zhou J C, Chai X F, Zhang L, et al. Different arbuscular mycorrhizal fungi cocolonizing on a single plant root system recruit distinct microbiomes.[J]. mSystems, 2020, 5(6): 23-25.
(  0) 0) |
| [30] |
Yu K, Wang X L, Zhang X B, et al. Research progress on interactions between root and beneficial microbes (In Chinese)[J]. Plant Physiology Journal, 2020, 56(11): 2275-2287. [禹坷, 王孝林, 张学斌, 等. 植物根系与益生菌相互作用的研究进展[J]. 植物生理学报, 2020, 56(11): 2275-2287.]
(  0) 0) |
| [31] |
Ah-Young K, Raheem S, Sang-Mo K, et al. IAA-producing Klebsiella variicola AY13 reprograms soybean growth during flooding stress[J]. Journal of Crop Science and Biotechnology, 2017, 20(4): 235-242. DOI:10.1007/s12892-017-0041-0
(  0) 0) |
| [32] |
Zamioudis C, Korteland J, van Pelt J A, et al. Rhizobacterial volatiles and photosynthesis-related signals coordinate MYB72 expression in Arabidopsis roots during onset of induced systemic resistance and iron-deficiency responses[J]. The Plant Journal, 2015, 84(2): 309-322. DOI:10.1111/tpj.12995
(  0) 0) |
| [33] |
Zamioudis C, Hanson J, Pieterse C M J, et al. ß-Glucosidase BGLU42 is a MYB72-dependent key regulator of rhizobacteria-induced systemic resistance and modulates iron deficiency responses in Arabidopsis roots[J]. New Phytologist, 2014, 204(2): 368-379. DOI:10.1111/nph.12980
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


