球囊霉素是一种在土壤中普遍存在,由丛枝菌根(Arbuscular mycorrhizal,AM)真菌产生,具有良好热稳性的特殊糖蛋白。因其在促进土壤团聚体形成和稳定、增加土壤有机碳库以及提高植物抗逆能力等方面的重要作用而备受关注[1–3]。质谱分析表明,球囊霉素相关土壤蛋白(Glomalin related soil protein,GRSP)是一种氮-连接糖蛋白,由3%~5%的氮、36%~59%的碳、4%~6%的氢、33%~49%的氧、0.8%~8.8%的铁和0.03%~0.1%的磷组成[4–7],但分子结构尚未进行晶体学研究,因此对球囊素结构的了解尚不充分[8]。目前关于球囊霉素的提取方法应用最广泛的是Wright和Nichols[9]在2002年提出的柠檬酸钠高温提取法,即利用121℃高温下用20 mmol·L–1的柠檬酸钠溶液提取丛枝菌根真菌(AMF)菌丝所产生的稳定糖蛋白。一般将提取的这类蛋白物质统称为GRSP,简称为球囊霉素。按照分离方法的差别,又将球囊霉素分为易提取球囊霉素(EE-GRSP)和总球囊霉素(T-GRSP)[1]。深入认识GRSP在改善土壤结构和理化性质、减缓温室气体排放和环境污染等方面的作用,可为农业土壤培肥、提升土壤固碳减排功能、土壤资源的可持续利用提供理论依据。
GRSP可通过促进土壤团聚体的形成来影响土壤的理化性质[10]。作为持久性黏合剂[5],GRSP可将细小的土壤颗粒黏结成微团聚体,聚合成大团聚体,进而形成稳定的土壤结构单元[7]。已有大量研究[8,10-11]发现土壤中的GRSP含量与团聚体平均重量直径等衡量其稳定性的指标呈正相关。因此,GRSP可显著地提高土壤团聚体的稳定性,改善土壤的理化特性[3]。与植物根系及菌丝对土壤团聚体稳定性的影响相比,GRSP可更为直接地影响土壤团聚体的稳定[12]。GRSP促进土壤团聚和稳定的机制可概括为:(1)球囊霉素胶结微团聚体并填充其内部,(2)GRSP可刺激微生物产生胞外多糖进一步稳定微团聚体。
除提高土壤团聚体稳定性外,GRSP还能够促进土壤对碳的贮存,降低陆地生态系统土壤中二氧化碳的净排放,进而减缓全球气候变暖[13]。GRSP中碳的含量占土壤全碳的4%~5%,这主要是由于球囊霉素难溶于水,不被蛋白酶水解,难于分解,而且还受团聚体的物理保护[14]。此外,GRSP在土壤环境中通过降低重金属的生物有效性或通过其所形成的团聚体的物理隔离,从而降低重金属的毒害[15]。
由此可见,近年来,对GRSP在土壤中的稳定性以及在影响因素和生态功能等方面均有了较为深入的研究,但是对GRSP在土壤团聚体中的分配特征,以及环境因子对不同粒径团聚体中GRSP的影响程度尚缺乏系统研究。土壤团聚体作为土壤结构的组成单位,是土壤物质和能量储存与转化的结构基础。土壤中有机类物质的存在,尤其是GRSP,有助于土壤团聚体的形成[3,16-17]。已有大量研究[3,18]表明,GRSP在土壤团聚体结构的形成和稳定过程中起着重要作用,例如东北黑土中的EE-GRSP对稳定土壤团聚体起关键作用[17]。因此,综合研究GRSP在团聚体中的分布特征及影响因素对于土壤结构的改善和土壤质量的提升具有重要理论价值,研究结果对于制定相应的土壤管理措施、改良土壤生态环境和发挥土壤生态功能等具有非常重要的意义。
1 材料与方法 1.1 数据收集与整理本研究借助中国知网(CNKI)、Web of Science和Google Scholar等中英文数据库,检索已发表关于球囊霉素在团聚体中分配的研究论文,检索时间截止2022年8月31日。检索关键词为球囊霉素/Glomalin、土壤团聚体/soil aggregate等,最终搜集到88篇论文。由于文中必须包含团聚体质量百分比和团聚体各粒级球囊霉素含量的数据,不适宜的文献被进一步剔除。而且,无论团聚体分级采用干筛还是湿筛,所有数据进行统一整理分析。最后,19篇文献的332组有效数据满足分析要求,组成本研究的数据集。除此之外,本研究还包含采样点气候条件(年平均温度、年均降水量)和土壤基本理化性质(土壤pH、土壤有机碳SOC)以及详细的地理位置(经纬度)。各类研究数据从文章的文本或表格中直接提取,或利用Getdata软件从数据图表中间接获得。对于原始文献中缺失的环境变量数据,则从其全球气候数据库(https://www.worldlim.org/)中获取。此外,由于各文献对团聚体的筛分各不相同,因而将各文献中团聚体的粒径整合为四个级别,即大团聚体(> 2 000 μm)、小团聚体(2 000~250 μm)、微团聚体(250~53 μm)和粉黏粒级微团聚体(< 53 μm)。
1.2 数据分析采用Microsoft Excel 2016对数据进行整理与初步分析,采用SPSS Statistics 21软件对数据进行相关性分析与差异性分析(P < 0.05)。采用一般线性回归模型分析团聚体中球囊霉素和土壤理化性质与气候因子之间的相关性。使用Origin2020进行制图。
2 结果 2.1 不同团聚体中球囊霉素的含量由图 1可知,易提取球囊霉素在大团聚体(> 2 000 μm)、小团聚体(2 000~250 μm)、微团聚体(250~53 μm)和粉黏粒级微团聚体(< 53 μm)中的含量分别为0.49、0.48、0.23和0.28 mg·kg–1,而总球囊霉素在大团聚体、小团聚体和微团聚体中的含量分别为2.37、1.91、1.68和0.96 mg·kg–1。无论是易提取球囊霉素还是总球囊霉素在大团聚体和小团聚体中的含量均显著大于在微团聚体和粉黏粒径团聚体的中的含量。
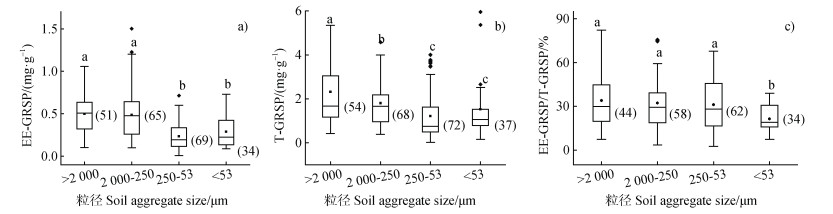
|
注:T-GRSP,总球囊霉素;EE-GRSP,易提取球囊霉素。不同小写字母表示不同粒径间差异显著(P < 0.05)。图中括号内的数字表示该处理的数据量。下同。 Note: T-GRSP, total glomalin related soil protein; EE-GRSP, easy extraction of glomalin related soil protein. Different lowercase letters represent significant differences among treatments(P < 0.05). The numbers in parentheses are the amount of data. The same as below. 图 1 不同粒径团聚体中易提取球囊霉素(EE-GRSP,a)、总球囊霉素(T-GRSP,b)的含量和易提取球囊霉素占总球囊霉素的比例(c) Fig. 1 The content of EE-GRSP(a), T-GRSP(b)and the proportion of EE-GRSP in T-GRSP(c)in different size aggregates |
不同粒径团聚体中易提取球囊霉素占总球囊霉素的比例分别为33.99%、32.31%、31.21%和21.48%。除粉黏粒级微团聚体(< 53 μm)显著小于其余各粒径团聚体外,其余各粒径团聚体中易提取球囊霉素的占比相差不明显。
2.2 温度和降水与团聚体中球囊霉素的相关性目前有关团聚体中球囊霉素研究的年平均温度范围主要集中在2~30℃,而年平均降水范围集中在300~1 800 mm。通过比较不同粒径土壤团聚体中球囊霉素与年平均温度和降水的相互关系(图 2),发现仅有大团聚体中易提取球囊霉素或总球囊霉素的含量与年平均温度呈显著正相关,其他粒级团聚体中易提取球囊霉素或总球囊霉素的含量与年平均温度均无显著相关性。易提取球囊霉素的含量在大团聚体、小团聚体中均与年平均降水呈显著正相关性。除粉黏粒级微团聚体外,其他粒级团聚体中总球囊霉素的含量均与年平均降水呈显著正相关。
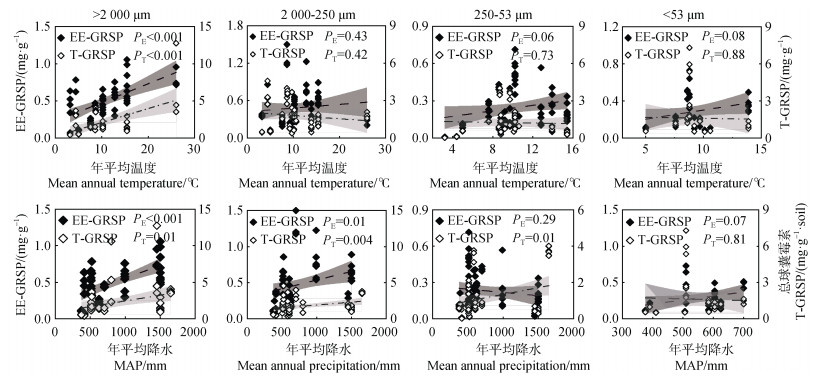
|
注:PE为易提取球囊霉素与环境因子的相关系数,PT为总球囊霉素与环境因子的相关系数。P < 0.05表示存在显著相关性。下同。 Note: PE is the correlation coefficient between EE-GRSP and environmental factors. PT is the correlation coefficient between T-GRSP and environmental factors. P < 0.05 represents a significant correlation. The same as below. 图 2 不同粒径团聚体中球囊霉素与年平均温度(上)和年平均降水量(下)之间的相互关系 Fig. 2 Relationships between GRSP and mean annual temperature(above), mean annual precipitation(below)with different size aggregates |
目前有关团聚体中球囊霉素研究的有机碳含量范围主要集中在0~24 mg·g–1,而酸碱度的范围集中在4~9。通过比较不同粒径土壤团聚体中球囊霉素与有机碳含量和酸碱度的相互关系(图 3),发现易提取球囊霉素/总球囊霉素的含量在微团聚体、粉黏粒级微团聚体中与有机碳含量呈显著正相关性,其他粒级团聚体中易提取球囊霉素/总球囊霉素的含量与有机碳含量均无显著相关性。易提取球囊霉素的含量在大团聚体、小团聚体中与pH呈显著负相关性。总球囊霉素在小团聚体中与pH呈负相关,在粉黏粒级微团聚体中与pH呈正相关,其他粒级团聚体中总球囊霉素的含量均与pH无显著相关性。
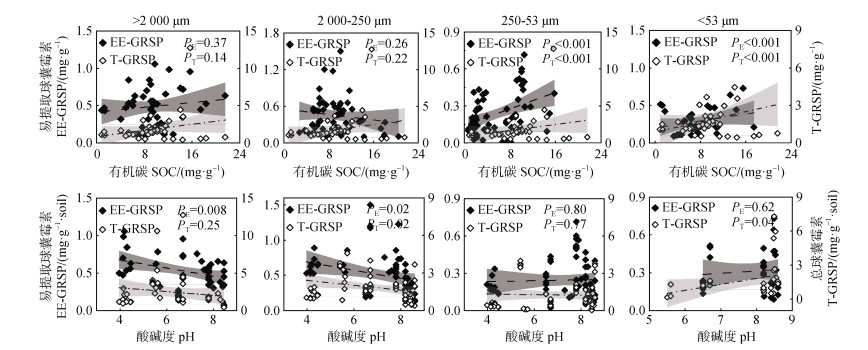
|
图 3 不同粒径团聚体中球囊霉素与土壤有机碳(上)和pH(下)之间的相互关系 Fig. 3 Relationships between GRSP and SOC(above), soil pH(below)with different size aggregates |
不同利用方式通过改变土壤条件对土壤环境产生复杂影响,从而影响土壤的生物多样性和活性,最终影响土壤中GRSP的含量。由图 4可知,林地中易提取球囊霉素在大团聚体、小团聚体、微团聚体和粉黏粒级微团聚体中的含量分别为0.61、0.53、0.33和0.18 mg·kg–1,总球囊霉素含量分别为2.09、1.72、1.36和1.43 mg·kg–1。耕地中易提取球囊霉素在大团聚体、小团聚体、微团聚体和粉黏粒级微团聚体中的含量分别0.47、0.36、0.16和0.35 mg·kg–1,总球囊霉素含量分别为2.57、1.54、0.69和2.09 mg·kg–1。草地中易提取球囊霉素在四个粒级团聚体中的含量分别为0.41、0.57、0.24和0.22 mg·kg–1,总球囊霉素含量分别为1.53、1.66、0.84和0.79 mg·kg–1。
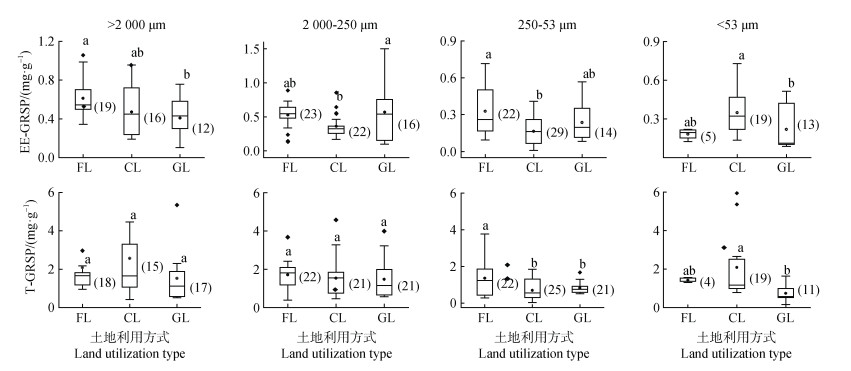
|
注:FL,林地;CL耕地,GL,草地。 Note: FL, forest land; CL, crop land; GL, grassland. 图 4 不同土地利用方式下各粒径团聚体中易提取球囊霉素(上)和总球囊霉素(下)的含量 Fig. 4 Comparison of the content of EE-GRSP(above)and T-GRSP(below)with different size aggregates |
由图 5可知,土壤有机碳中易提取球囊霉素碳的含量在大团聚体、小团聚体、微团聚体和粉黏粒级微团聚体中分别为0.03、0.02、0.02和0.02 mg·g–1,总球囊霉素碳的含量分别为0.10、0.07、0.08和0.10 mg·g–1。无论是易提取球囊霉素碳占有机碳的比例,还是总球囊霉素碳占有机碳的比例在各粒级团聚体中均无显著性差异。
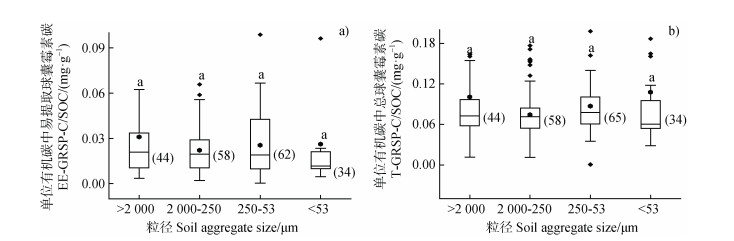
|
图 5 不同粒径团聚体土壤中单位有机碳中易提取球囊霉素(a)和总球囊霉素(b)的含量 Fig. 5 Content of carbon derived from EE-GRSP(a)and T-GRSP(b)in SOC with different size aggregates |
虽然不同粒级团聚体中易提取球囊霉素和总球囊霉素的含量差别不明显,但大团聚体(> 2 000 μm)、小团聚体(2 000~250 μm)中含量要显著高于微团聚体(< 250 μm,图 1a和图 1b)。这主要是因为大团聚体、小团聚体相对于微团聚体具有更好的通气状况与水热条件,对GRSP主要生产者AM真菌的生长更为有利[3]。Singh等[19]同样发现大团聚体中的GRSP含量更高,对环境变化也更敏感,认为它对土壤结构的贡献更大。
总球囊霉素是AM真菌生产的新老蛋白的总和,而易提取球囊霉素被认为是AM真菌新产生的蛋白,稳定性相对较差,因而在土壤中保留时间更短[5,20-21]。因此,易提取球囊霉素和总球囊霉素之间的比值可反映土壤中球囊霉素稳定性和产生速率的差异,而针对不同团聚体中的比例关系可反映各粒级之间球囊霉素的潜在积累能力差异[21]。由图 1c可知粉黏粒级微团聚体易提取球囊霉素与总球囊霉素的比例显著小于其他三个粒级的团聚体,说明粉黏粒级微团聚体中球囊霉素的生产速率低于其他较大粒径的团聚体。该现象的主要原因是AM真菌在粉黏粒级微团聚体中生长发育受限,导致该粒径团聚体中的AM真菌数量较低。
AM真菌菌根中的碳通过根外菌丝沉积至土壤,菌根对土壤有机碳的贡献可达到54~900 kg·hm–2[22]。因此,AM真菌菌丝和AM真菌释放的GRSP是土壤有机碳库的重要组成部分[23],而GRSP来源的碳是SOC的主要来源[24]。由图 5可知,球囊霉素确实是土壤有机碳库的重要组成部分,其中T-GRSP中的碳含量为0.07~0.10 mg·g–1 SOC,相当于土壤总有机碳的7.42%~10.77%,而EE-GRSP的碳含量为0.02~0.03 mg·g–1 SOC,相当于土壤总有机碳2.21%~3.10%。GRSP除了通过其胶结能力促进团聚体的形成外,其稳定的化学性质也有利于土壤有机碳的固持。
有机碳被认为是土壤中球囊霉素最有效的预测因子之一,土壤中球囊霉素的含量与有机碳呈正相关关系[1],并已在牧场、草原和森林土壤等得到证实[25]。球囊霉素被认为是土壤活性有机碳库的重要来源[14]。土壤中GRSP约占有机碳含量的27%,而在泥炭中可达53%[9]。然而,本研究中发现大于250 μm团聚体的球囊霉素与有机碳的含量并无显著相关性,但粒径更小的微团聚体和粉黏粒级微团聚体中球囊霉素的含量却与有机碳含量呈显著正相关(图 3)。这主要是因为大团聚体更容易受外界环境的影响而发生破坏,导致其周转速率快于微团聚体,进而使部分球囊霉素失去物理保护。而包裹在微团聚体中的球囊霉素和其他有机物质由于受到更强的物理化学保护而免受微生物及其分泌的水解酶的影响[3]。
3.2 环境因子对不同粒径团聚体中球囊霉素的影响温度和降水以及二者的共同作用是影响陆地生物群落呈带状地理分布的根本原因,水热状况对AM真菌和宿主植物的生长也会产生关键影响,进而影响球囊霉素的分泌。温度和降水等气候因素对土壤中GRSP的贡献可达20%~29%[26]。本研究表明,温度(3.2~26℃)主要影响大团聚体中球囊霉素的含量,降水(375~1 650 mm)主要影响大团聚体和小团聚体中球囊霉素的含量,且它们均呈显著正相关(图 2)。大团聚体和小团聚体中球囊霉素的含量随降水量的增加而增加,这与Adame等[27]的研究结果一致,发现在沿海地区土壤GRSP随着雨季年降雨量的增加而增加。Xiang等[28]也认为AM真菌与降水量存在高度相关性,但是有研究表明球囊霉素含量会随着森林土壤含水量的增加而减少。丛枝菌根真菌作为一种好气性真菌其生长和发育需要一定的氧气和水分,大于250 μm团聚体具有良好的通气性和水热状况。温度可影响AM真菌的生长发育,在低温(< 14℃)下AM真菌会产生较多的囊泡,而在高温(> 26℃)下则产生较多的根外菌丝,有利于球囊霉素的分泌[29]。然而也有研究发现,低温会抑制AM真菌菌丝分解,进而确保GRSP继续生产[26]。较高的温度刺激微生物活性,加速有机物矿化,而GRSP变得易受微生物攻击,从而降低其含量[9,27]。大多数AM真菌均有其生长发育的最适温度范围,如Hawkes等[29]发现在25℃接种AM真菌能够显著促进植物生长,但是在15℃接种AM真菌则无任何效应。然而,由于AM真菌的广泛分布以及物种的多样性导致它在整个土壤系统中的最适温度范围很难确定,本研究发现在3~30℃的区间内大团聚体中GRSP含量随温度的升高而增加,由此可知,30℃不是整个AM真菌群落最适温度范围的上限。
土壤pH同时影响GRSP的组成和含量,因为土壤酸碱性对AM真菌的生长发育有很强的影响[30]。由图 3可知,中性或微酸性土壤有利于大团聚体和小团聚体中球囊霉素的产生与累积。Wang等[30]研究发现酸性土壤中GRSP含量较高,随着土壤pH的升高而减少。微团聚体中的球囊霉素对pH的响应不显著,可能是由于与大团聚体相比,微团聚体有更强的物理化学保护机制以及球囊霉素与土壤矿物更强的结合机制[3]。
3.3 不同土地利用方式下团聚体中球囊霉素的分布特征比较不同土地利用方式下不同粒径团聚体中易提取球囊霉素和总球囊霉素的含量,发现林地土壤各粒径团聚体中GRSP含量均高于或等于耕地和草地(图 4),林地似乎更有利于土壤中GRSP的积累。这与Treseder和Turner[31]的结果相一致,他们对22个生态系统进行对比分析后,发现森林土壤中球囊霉素要远远高于农田和草地土壤。这可能由于林地具有更高的有机碳储量,Liu等[32]对全球的有机碳储量进行研究,结果显示由高到低依次为林地的有机碳储量、耕地的有机碳储量、草地的有机碳储量。不同的土地利用方式下由于土壤性质和生物群落的不同而导致AM真菌的生长以及球囊霉素的分泌存在差异,并进一步影响团聚体的形成[33]。农田生态系统人为的管理活动影响着土壤有机碳的输入与周转,强烈影响AM真菌的发生与分布[34-37]。此外,寄主类型也是影响AM真菌发生和分布的重要因子。大量试验已表明寄主植物不同,AM真菌的侵染、产孢量、种属构成均不同,进而影响GRSP的产生[25]。
正如前面所述,土壤中球囊霉素的含量通常与土壤有机碳的含量密切相关。全球森林表层土壤中的有机碳储量为农田和草地土壤的两倍[32],森林土壤具有较高的有机碳含量使AM真菌有更多的碳源及养分供给其生长及GRSP的分泌。而且,微生物可能更喜欢其他有机化合物而非球囊霉素,因此当有机碳含量较高时,球囊霉素的分解受到抑制[31]。田间的耕作活动对AM真菌菌丝的生长[38]以及球囊霉素的产生[39]均会产生负面影响。耕作破坏根系和真菌网络,进而降低土壤团聚体的稳定性,导致团聚体包裹的球囊霉素被释放,容易被微生物所利用。由传统耕作改为免耕以及退耕还林通常均会导致AM真菌丰度的增加[31]。Piotrowski等[40]通过五种AM真菌的接种培养试验,发现禾本植物与草本植物根际周围的菌丝长度并无太大差别,甚至还发现部分种类草本植物根系的生物量可能与AM真菌的菌丝长度呈负相关。
4 结论大于250 μm团聚体中球囊霉素含量要高于小于250 μm团聚体,接近70%的球囊霉素分布在大于250 μm团聚体中。易提取球囊霉素占总球囊霉素的比例在小于53 μm团聚体中更低,占20%左右,显著低于其他粒径的30%。球囊霉素中的碳占土壤总有机碳的比例在各团聚体中无显著差异,其中易提取球囊霉素占2%,总球囊霉素占8%。大于250 μm团聚体中球囊霉素对环境因子(温度、降水和pH)的变化有明显的响应规律,即在该粒径团聚体中球囊霉素随温度和降水的增加而增加,但随pH的升高而下降。在小于250 μm团聚体中并未发现类似的响应规律,但发现球囊霉素随土壤有机碳增加而增加。林地土壤较耕地和草地更有利于球囊霉素的积累,表现为各粒径中的球囊霉素均较高,而耕地与草地土壤各粒径团聚体中总球囊霉素含量并无显著差别。
| [1] |
Holátko J, Brtnický M, Kučerík J, et al. Glomalin–Truths, myths, and the future of this elusive soil glycoprotein[J]. Soil Biology and Biochemistry, 2021, 153: 108116. DOI:10.1016/j.soilbio.2020.108116
(  0) 0) |
| [2] |
Gispert M, Phang C, Carrasco-Barea L. The role of soil as a carbon sink in coastal salt-marsh and agropastoral systems at La Pletera, NE Spain[J]. Catena, 2020, 185: 104331. DOI:10.1016/j.catena.2019.104331
(  0) 0) |
| [3] |
Liu Y L, Wang P, Wang J K. Formation and stability mechanism of soil aggregates: Progress and prospect (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(3): 627-643. DOI:10.11766/trxb202112180686 [刘亚龙, 王萍, 汪景宽. 土壤团聚体的形成和稳定机制: 研究进展与展望[J]. 土壤学报, 2023, 60(3): 627-643.]
(  0) 0) |
| [4] |
He J D, Chi G G, Zou Y N, et al. Contribution of glomalin-related soil proteins to soil organic carbon in trifoliate orange[J]. Applied Soil Ecology, 2020, 154: 103592. DOI:10.1016/j.apsoil.2020.103592
(  0) 0) |
| [5] |
Agnihotri R, Sharma M P, Prakash A, et al. Glycoproteins of arbuscular mycorrhiza for soil carbon sequestration: Review of mechanisms and controls[J]. Science of the Total Environment, 2022, 806: 150571. DOI:10.1016/j.scitotenv.2021.150571
(  0) 0) |
| [6] |
Parihar M, Rakshit A, Meena V S, et al. The potential of arbuscular mycorrhizal fungi in C cycling: A review[J]. Archives of Microbiology, 2020, 202: 1581-1596. DOI:10.1007/s00203-020-01915-x
(  0) 0) |
| [7] |
Gan J W, Han X Z, Zou W X. Glomalin and its roles in soil ecosystem: A review (In Chinese)[J]. Soils and Crops, 2022, 11(1): 41-53. [甘佳伟, 韩晓增, 邹文秀. 球囊霉素及其在土壤生态系统中的作用[J]. 土壤与作物, 2022, 11(1): 41-53.]
(  0) 0) |
| [8] |
Liu H, Wang X, Liang C, et al. Glomalin-related soil protein affects soil aggregation and recovery of soil nutrient following natural revegetation on the Loess Plateau[J]. Geoderma, 2020, 357: 113921. DOI:10.1016/j.geoderma.2019.113921
(  0) 0) |
| [9] |
Wright S F, Nichols K A. Glomalin: Hiding place for a third of the world's stored soil carbon[J]. Agricultural Research, 2002, 50(9): 4-7.
(  0) 0) |
| [10] |
Nautiyal P, Rajput R, Pandey D, et al. Role of glomalin in soil carbon storage and its variation across land uses in temperate Himalayan regime[J]. Biocatalysis and Agricultural Biotechnology, 2019, 21: 101311. DOI:10.1016/j.bcab.2019.101311
(  0) 0) |
| [11] |
Xia Z T, Zhao J X, Li Y M, et al. Effect of annual rotation and fallow pattern on the soil glomalin and aggregate stability (In Chinese)[J]. Journal of Agro-Environment Science, 2022, 41(1): 99-106. [夏梓泰, 赵吉霞, 李永梅, 等. 周年轮作休耕模式对土壤球囊霉素和团聚体稳定性的影响[J]. 农业环境科学学报, 2022, 41(1): 99-106.]
(  0) 0) |
| [12] |
Wright S, Green V, Cavigelli M. Glomalin in aggregate size classes from three different farming systems[J]. Soil and Tillage Research, 2007, 94(2): 546-549. DOI:10.1016/j.still.2006.08.003
(  0) 0) |
| [13] |
Rillig M C, Wright S F, Allen M F, et al. Rise in carbon dioxide changes soil structure[J]. Nature, 1999, 400(6745): 628-628. DOI:10.1038/23168
(  0) 0) |
| [14] |
Staunton S, Saby N P A, Arrouays D, et al. Can soil properties and land use explain glomalin-related soil protein(GRSP)accumulation? A nationwide survey in France[J]. Catena, 2020, 193: 104620. DOI:10.1016/j.catena.2020.104620
(  0) 0) |
| [15] |
Gujre N, Agnihotri R, Rangan L, et al. Deciphering the dynamics of glomalin and heavy metals in soils contaminated with hazardous municipal solid wastes[J]. Journal of Hazardous Materials, 2021, 416: 125869. DOI:10.1016/j.jhazmat.2021.125869
(  0) 0) |
| [16] |
Spohn M, Giani L. Water-stable aggregates, glomalin-related soil protein, and carbohydrates in a chronosequence of sandy hydromorphic soils[J]. Soil Biology and Biochemistry, 2010, 42(9): 1505-1511. DOI:10.1016/j.soilbio.2010.05.015
(  0) 0) |
| [17] |
Zhang S X, Li Q, Zhang X P, et al. Effects of conservation tillage on soil aggregation and aggregate binding agents in black soil of Northeast China[J]. Soil and Tillage Research, 2012, 124: 196-202. DOI:10.1016/j.still.2012.06.007
(  0) 0) |
| [18] |
Cai L, Yang Y J, Chong Y J, et al. Effects of different restoration approaches of subtropical degraded forests on bonding materials and stability of soil aggregate (In Chinese)[J]. Acta Ecologica Sinica, 2023, 43(9): 3689-3698. [蔡琳, 杨予静, 种玉洁, 等. 亚热带退化森林不同恢复方式对土壤团聚体胶结物质及稳定性的影响[J]. 生态学报, 2023, 43(9): 3689-3698.]
(  0) 0) |
| [19] |
Singh A K, Rai A, Singh N. Effect of long term land use systems on fractions of glomalin and soil organic carbon in the Indo-Gangetic Plain[J]. Geoderma, 2016, 277: 41-50. DOI:10.1016/j.geoderma.2016.05.004
(  0) 0) |
| [20] |
Rillig M C. Arbuscular mycorrhizae and terrestrial ecosystem processes[J]. Ecology Letters, 2004, 7(8): 740-754. DOI:10.1111/j.1461-0248.2004.00620.x
(  0) 0) |
| [21] |
Koide R T, Peoples M S. Behavior of Bradford-reactive substances is consistent with predictions for glomalin[J]. Applied Soil Ecology, 2013, 63: 8-14. DOI:10.1016/j.apsoil.2012.09.015
(  0) 0) |
| [22] |
Zhu Y G, Miller R M. Carbon cycling by arbuscular mycorrhizal fungi in soil–plant systems[J]. Trends in Plant Science, 2003, 8(9): 407-409. DOI:10.1016/S1360-1385(03)00184-5
(  0) 0) |
| [23] |
Wilson G W T, Rice C W, Rillig M C, et al. Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi: Results from long-term field experiments[J]. Ecology Letters, 2009, 12(5): 452-461. DOI:10.1111/j.1461-0248.2009.01303.x
(  0) 0) |
| [24] |
Tu J Y, Jin W H, Sheng W X, et al. The change in dominant mycorrhizal fungi type induced by stand transformation affects soil organic carbon Accumulation (In Chinese)[J]. Acta Pedologica Sinica, 2024. DOI:10.11766/trxb202206210271 [屠嘉莹, 金文豪, 盛卫, 等. 林分改变驱动的优势菌根真菌类型变化影响土壤有机碳积累[J]. 土壤学报, 2024.]
(  0) 0) |
| [25] |
Xiao L, Zhang Y, Li P, et al. Effects of freeze-thaw cycles on aggregate-associated organic carbon and glomalin-related soil protein in natural-succession grassland and Chinese pine forest on the Loess Plateau[J]. Geoderma, 2019, 334: 1-8. DOI:10.1016/j.geoderma.2018.07.043
(  0) 0) |
| [26] |
Miller R, Jastrow J, Reinhardt D. External hyphal production of vesicular-arbuscular mycorrhizal fungi in pasture and tallgrass prairie communities[J]. Oecologia, 1995, 103(1): 17-23. DOI:10.1007/BF00328420
(  0) 0) |
| [27] |
Adame M F, Wright S F, Grinham A, et al. Terrestrial–marine connectivity: patterns of terrestrial soil carbon deposition in coastal sediments determined by analysis of glomalin related soil protein[J]. Limnology and Oceanography, 2012, 57(5): 1492-1502. DOI:10.4319/lo.2012.57.5.1492
(  0) 0) |
| [28] |
Xiang D, Veresoglou S D, Rillig M C, et al. Relative importance of individual climatic drivers shaping arbuscular mycorrhizal fungal communities[J]. Microbial Ecology, 2016, 72(2): 418-427. DOI:10.1007/s00248-016-0773-1
(  0) 0) |
| [29] |
Hawkes C V, Hartley I P, Ineson P, et al. Soil temperature affects carbon allocation within arbuscular mycorrhizal networks and carbon transport from plant to fungus: temperature, carbon, and mycorrhizal fungi[J]. Global Change Biology, 2008, 14(5): 1181-1190. DOI:10.1111/j.1365-2486.2007.01535.x
(  0) 0) |
| [30] |
Wang Q, Wu Y, Wang W J, et al. Spatial variations in concentration, compositions of glomalin related soil protein in poplar plantations in northeastern China, and possible relations with soil physicochemical properties[J]. The Scientific World Journal, 2014, 2014: 160403.
(  0) 0) |
| [31] |
Treseder K K, Turner K M. Glomalin in ecosystems[J]. Soil Science Society of America Journal, 2007, 71(4): 1257-1266. DOI:10.2136/sssaj2006.0377
(  0) 0) |
| [32] |
Liu Y L, Ge T D, van Groenigen K J, et al. Rice paddy soils are a quantitatively important carbon store according to a global synthesis[J]. Communications Earth & Environment, 2021, 2(1): 1-9.
(  0) 0) |
| [33] |
Borie F, Rubio R, Morales A. Arbuscular mycorrhizal fungi and soil aggregation[J]. Journal of Soil Science and Plant Nutrition, 2008, 8(2): 9-18.
(  0) 0) |
| [34] |
Liu Y, Ge T D, Wang P, et al. Residence time of carbon in paddy soils[J]. Journal of Cleaner Production, 2023, 400: 136707.
(  0) 0) |
| [35] |
Liu Y L, Wang P, Cai G, et al. Divergent accumulation of microbial and plant necromass along paddy soil development in a millennium scale[J]. Soil and Tillage Research, 2023, 232: 105769.
(  0) 0) |
| [36] |
Liu Y L, Ge T D, Zhu Z K, et al. Carbon input and allocation by rice into paddy soils: A review[J]. Soil Biology and Biochemistry, 2019, 133: 97-107.
(  0) 0) |
| [37] |
Liu Y L, Ge T D, Ye J, et al. Initial utilization of rhizodeposits with rice growth in paddy soils: Rhizosphere and N fertilization effects[J]. Geoderma, 2019, 338: 30-39.
(  0) 0) |
| [38] |
Castillo C, Rubio R, Rouanet J, et al. Early effects of tillage and crop rotation on arbuscular mycorrhizal fungal propagules in an Ultisol[J]. Biology and Fertility of Soils, 2006, 43(1): 83-92.
(  0) 0) |
| [39] |
Yang M Y, Yang N, Liu H J, et al. Effect of different land use type on distribution of glomalin-related soil protein on hilly slope with purple soils in Hengyang of Hunan Province, China (In Chinese)[J]. Acta Agrestia Sinica, 2020, 28(5): 1260-1265. [杨满元, 杨宁, 刘慧娟, 等. 衡阳紫色土丘陵坡地不同土地利用方式对球囊霉素相关土壤蛋白分布的影响[J]. 草地学报, 2020, 28(5): 1260-1265.]
(  0) 0) |
| [40] |
Piotrowski J, Denich T, Klironomos J, et al. The effects of arbuscular mycorrhizas on soil aggregation depend on the interaction between plant and fungal species[J]. New Phytologist, 2004, 164(2): 365-373.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


