2. 南京农业大学资源与环境科学学院, 江苏省海洋生物学重点实验室, 南京 210095;
3. 南京农业大学理学院, 南京 210095;
4. 绵阳师范学院, 四川县域经济发展研究中心, 四川绵阳 621000;
5. 苏州农业职业技术学院园艺科技学院, 江苏苏州 215008
2. College of Resources and Environmental Sciences, Jiangsu Provincial Key Laboratory of Marine Biology, Nanjing Agricultural University, Nanjing 210095, China;
3. College of Science, Nanjing Agricultural University, Nanjing 210095, China;
4. Sichuan County Economic Development Research Center, Mianyang Normal University, Mianyang, Sichuan 621000, China;
5. College of Horticulture and Technology, Suzhou Polytechnic Institute of Agriculture, Suzhou, Jiangsu 215008, China
番茄(Solanum lycopersicum L.)是一种广泛分布的一年生蔬菜作物,尽管适应范围很广,但其生产集中在一些温暖而干燥的地区,而这些地区的土壤盐分通常比较高[1],而番茄对盐中度敏感[2],因此,提高番茄耐盐性的研究就显得迫切而重要。近年来国内外番茄设施农业的迅猛发展带来的土壤次生盐渍化问题,使得该研究的重要性和必要性更为突出。
纳米材料的研究日益深入,在农林、畜牧、医学和环境科学等领域均有广泛应用[3-5],目前仅有几篇纳米材料的应用提高盐胁迫下番茄生长、发育和产量品质的文献见诸报道,如Pérez-Labrada等[6]研究发现盐胁迫下纳米铜的叶面喷施提高了番茄幼苗的抗氧化,从而促进植株耐盐性。纳米硒的应用提高了番茄的抗氧化,从而有助于植株生长和番茄果的品质形成[7]。还有纳米硅[8-9]和纳米ZnO[10-11]诱导番茄耐盐性的研究。Aazami等[12]发现盐胁迫下纳米级Fe3O4和ZnO(Fe3O4NPs和ZnONPs)可诱导盐胁迫下番茄细胞氧化损伤的修复,Fe3O4NPs诱导愈伤组织的比例更高,而ZnONPs诱导愈伤组织的再生率高于Fe3O4NPs。Abd-Alla等[13]研究表明Fe3O4NPs显著促进了盐胁迫下鹰嘴豆幼苗及其根瘤菌的生长。盐胁迫下纳米材料在番茄种子萌发阶段的研究主要见诸于Almutairi[14-15]的研究。其研究[14]表明,盐胁迫下纳米银(AgNPs)处理提高了番茄的发芽率、根长、幼苗鲜物质量和干物质量,基因表达模式表明AgNPs可能参与了胁迫的调控反应。Almutairi[15]同时发现用纳米硅也可明显提高番茄种子的发芽和幼苗的生长。Al-Quraan等[16]研究发现,黑灰碳纳米纤维(CNFs)处理下,番茄种子γ-氨基丁酸上升,可能参与了氧化损伤的减轻,从而促进了盐胁迫下番茄种子萌发。
目前除了上述Aazami等[12]和Abd-Alla等[13]两篇文献外,很难检索到Fe3O4NPs调控植物耐盐性的文献,除Almutairi[14-15]和Al-Quraan等[16]三篇文献外,很难检索到纳米材料调控盐胁迫番茄种子萌发的研究文献,而Fe、Fe2O3、Fe3O4等各种纳米含铁颗粒调控番茄种子萌发的文献均很难查阅到。关于Fe3O4NPs调控植物生长的文献亦不多[17-18]。制备Fe3O4NPs常用的方法有高温热分解法、水热法、溶剂热法、溶胶凝胶法、共沉淀法等。其中,高温热分解法使用的有机金属前驱体价格高昂,水热法和溶解热法需要在高温高压的反应条件下进行,溶胶凝胶法中材料的粒径难以控制,相比较而言,共沉淀法具有设备简单、易控制、成本低、产量大等优点[19]。因此本研究采用共沉淀法合成Fe3O4NPs,并探讨其不同浓度(1~400 mg·L–1)对盐胁迫下番茄种子萌发、幼苗生长、植株保护酶系统活性、丙二醛(MDA)、脯氨酸(Pro)和活性氧积累的影响,为纳米材料在盐土农业上的应用提供科学依据和技术支撑。
1 材料与方法 1.1 试验材料与设备纳米材料制备所需试剂FeCl₃·6H₂O、FeCl2·4H₂O、氨水、无水乙醇等试剂均为分析纯,试验前保证药品无变质、吸潮、过期等现象。试验过程中主要用到的仪器包括超声波清洗器(KQ-250B,昆山)、恒温箱(SPX-250B,天津)、电热鼓风干燥箱(DHG-9053A,上海)、电子天平(TP-214,北京)、X射线衍射仪(Rigaku D/max-RA,日本)、扫描电子显微镜(Scanning Electron Microscope,SEM,Hitachi SU8010,日本)和透射电子显微镜(Transmission Electron Microscope,TEM,FEI F20,美国)。试验过程中所使用的玻璃器皿均用超纯水(电阻率为18 MΩ·m)和无水乙醇超声洗净,烘干后使用。
1.2 Fe3O4纳米材料(Fe3O4NPs)的合成与分散液的配置及材料的表征方法粒径约为10 nm的Fe3O4采用共沉淀法[19-20]制备(稍有修改):在玻璃烧杯中,加入六水合氯化铁、四水合氯化亚铁和去离子水,混合搅拌,同时逐滴滴加氨水,滴加过程中搅拌溶液,确保沉淀均匀,调溶液pH至10±0.1。然后将烧杯转移至80℃的水浴锅水浴保持30 min,水浴过程中不停地剧烈搅拌。最后将反应产物用去离子水和无水乙醇反复离心洗涤,再进一步烘干后即得到Fe3O4NPs。用分析天平称取一定量上述纳米Fe3O4固体,加入去离子水,超声分散30 min,配置成1、10、50、100、200、300、400 mg·L–1的悬浮液,以供浸种使用。参照文献[19-20],用X射线衍射仪对样品的物质相、结晶度和纯度进行表征。用扫描电子显微镜对样品的微观形貌和结构进行观察。用透射电子显微镜,对样品的微观结构和形貌进行表征,并做高分辨率的透射电镜(High Resolution Transmission Electron Microscope,HRTEM)分析。
1.3 发芽盒试验设计与处理取番茄(Solanum lycopersicum)品种“合作903”种子经70%乙醇清洗1 min,然后用20% NaClO润洗10 min,最后用蒸馏水冲洗干净,用吸水纸吸干后分别用0、1、10、50、100、200、300、400 mg·L–1 Fe3O4NPs分散液浸种24 h,取出种子清洗干净,用吸水纸吸干后选取健壮、饱满、大小一致的番茄种子分别转入直径12 cm、高度5 cm的硬塑料发芽盒中分别进行低盐处理(100 mmol·L–1 NaCl)和高盐处理(150 mmol·L–1 NaCl)。低盐处理的一系列Fe3O4NPs浸种浓度处理分别表示为LS、LSN1、LSN10、LSN50、LSN100、LSN200、LSN300、LSN400,高盐处理的一系列Fe3O4NPs浸种浓度处理分别表示为HS、HSN1、HSN10、HSN50、HSN100、HSN200、HSN300、HSN400。以不用NaCl和Fe3O4NPs浸种的处理为对照(CK)。每个处理设3个重复,每个发芽盒中放置50粒种子,置于25℃恒温培养箱中进行暗培养7 d,培养期间始终保持滤纸湿润,即倾斜时盒底无溶液集聚。以胚根露出长度为种子的1/2为萌发标准[2],每天统计各处理的发芽率,第7天收样测定和计算。
1.4 砂培试验设计与处理种子前处理同1.3。浸种后取出种子清洗干净,吸水纸吸干,分别播种至装有砂子的盆中,每盆播种40粒,播种深度1 cm,播种后即用含100 mmol·L–1 NaCl的1/10霍格兰(Hoagland)溶液缓缓浇灌,浇透。这样构成LS、LSN1、LSN10、LSN50、LSN100、LSN200、LSN300、LSN400等不同处理,以不用NaCl和Fe3O4NPs浸种的处理为对照(CK)。每个处理设置3个重复。置于温室中自然光照处理18 d,统计成苗率并取样,进行相关测定。整个处理过程中,每隔1 d,更换一次处理溶液。
1.5 种子发芽和生长指标的测定发芽盒试验中,每天统计各处理的发芽情况,按照文献[21-22]计算发芽势(Germination Potential,GP)和发芽率(Germination Rate,GR)。用最小刻度为1 mm的钢尺量取在发芽盒中萌发7 d的萌发种子胚根和下胚轴长度。
| $ {\text{GP}}/\%={\text{(3 d发芽种子数/供检测的种子数)}}×100 $ |
| $ {\text{GR}}/\%={\text{(7 d发芽种子数/供检测的种子数)}}×100 $ |
砂培18 d,统计各处理的番茄种子成苗数,按下列公式计算成苗率(Seedling Rate,SR)。用最小刻度为1 mm的钢尺量取幼苗根长和下胚轴。用万分之一电子天平(Sartorius,美国)量取番茄幼苗整株鲜物质量(Fresh Biomass,FB),在105℃杀青15 min后于75℃烘干至恒重,称得植株干物质量(Dry Biomass,DB)。按下列公式计算幼苗含水量(Water Content,WC)。
| $ {\text{SR}}/\%=(幼苗数/供检测的种子数)×100 $ |
| $ {\text{WC}}/\%=[{\text{(FB-DB)/FB}}] ×100 $ |
称取全株鲜样用0.05 mol·L–1磷酸缓冲液(pH=7.8)冰浴研磨,离心(4 000 r·min–1,4 oC)15 min,取其上清液进行保护酶系统活性[23]测定,即超氧化物歧化酶(Superoxide Dismutase,SOD)活性采用氮蓝四唑(Nitro-blue Tetrazolium,NBT)还原法测定,SOD活性单以抑制NBT光化还原的50%为一个酶活性单位(U)表示。过氧化物酶(Peroxidase,POD)活性采用愈创木酚比色法测定,以每分钟A470变化0.01为1个过氧化物酶活性单位(U)。过氧化氢酶(Catalase,CAT)活性采用紫外吸收法测定,以每分钟OD240减少0.1的酶量为1个酶活性单位(U)。采用硫代巴比妥酸法[23]测定丙二醛(Malondialdehyde,MDA)含量,磺基水杨酸法[23]测定脯氨酸(Proline,Pro)含量,用羟胺氧化法测定超氧阴离子自由基(O2·-)含量[23],用二甲酚橙法测定过氧化氢(H2O2)含量[23]。
1.7 数据处理每个试验设置3个重复,数据表示为“平均值±SD”。使用SPSS 18.0统计软件在P˂0.05水平上进行单因素显著性方差分析(ANOVA)。使用Origin 8.0及Excel 2016绘制图形。
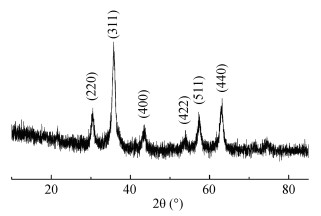
2 结果 2.1 Fe3O4NPs的合成与表征采用共沉淀法制作出Fe3O4NPs。图 1所示为Fe3O4NPs的X-射线衍射(X-Ray Diffraction,XRD)谱图,可看出有明显的尖锐峰出现,表明制备得到的纳米材料具有良好的结晶性,标注的6个衍射峰(30.2°、35.5°、43.2°、53.6°、57.1°和62.7°)分别对应于反尖晶石结构Fe3O4(JCPDS 88-0315)的(220)、(311)、(400)、(422)、(511)和(440)晶面。所合成的Fe3O4NPs的晶型结构与XRD标准谱图十分吻合,无杂质峰出现,说明Fe3O4NPs成功合成。
|
图 1 纳米Fe3O4(Fe3O4NPs)的X-射线衍射(X-Ray Diffractio,XRD)图谱 Fig. 1 The X-ray diffraction (XRD) patterns of the nanoparticle Fe3O4NPs |
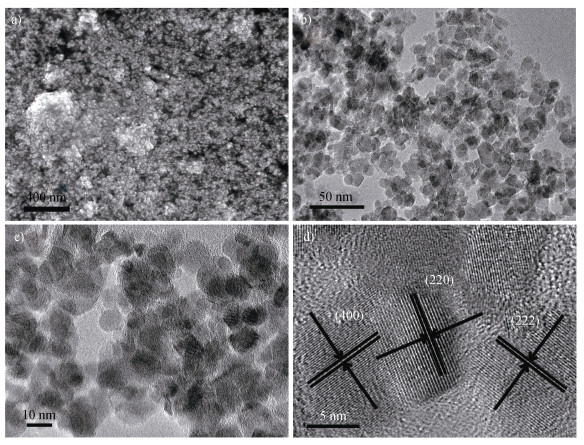
图 2a为Fe3O4NPs的扫描电镜照片,可看到Fe3O4NPs为比较小的颗粒形状,分布较为均匀。为进一步观察其形貌和结构,对样品进行了透射电镜的表征。在透射电镜下,Fe3O4NPs的大小和形状更为清晰,呈类球形颗粒状,直径大约10 nm,分布较为均匀(图 2b,图 2c),其结果和扫描电镜的结果相一致。图 2d是对应的透射电镜的高分辨照片,可看到清晰的Fe3O4NPs的晶格条纹,分别对应于(400)、(220)和(222)晶面,进一步证实了Fe3O4NPs的成功合成。
|
图 2 Fe3O4NPs的扫描电镜(SEM)图片(a)和透射电镜(TEM)图片(b、c、d) Fig. 2 The scanning electron microscope (SEM) image (a) and transmission electron microscope (TEM)(b, c, d) of Fe3O4NPs |
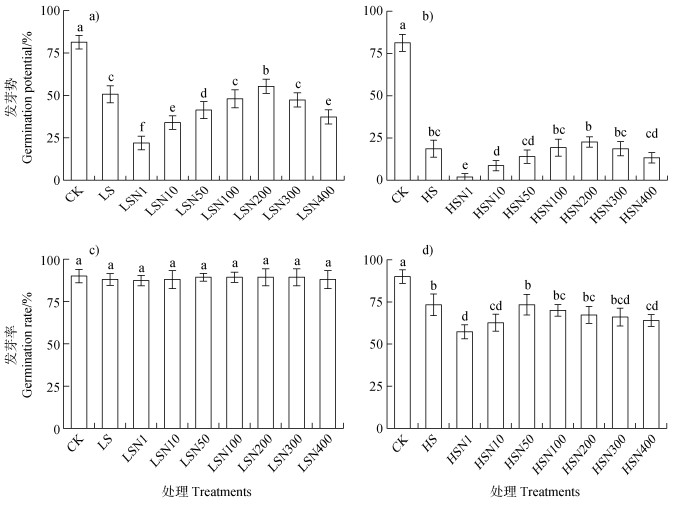
在发芽盒中进行的盐胁迫萌发试验表明,盐胁迫(100、150 mmol·L–1 NaCl)明显降低番茄种子的发芽势(GP),尤其是在高盐(150 mmol·L–1 NaCl)下(图 3a,图 3b),不同浓度Fe3O4NPs浸种处理下,则展示了不同情况的调控效应。盐胁迫下,1 mg·L–1 Fe3O4NPs浸种的番茄种子GP进一步显著下降,随着纳米材料浸种浓度上升,其GP逐渐上升,200 mg·L–1 Fe3O4NPs浸种的番茄种子GP均达到最大值,其中低盐胁迫下,200 mg·L–1 Fe3O4NPs浸种处理(LSN200)的GP显著大于仅盐处理(LS)的(P < 0.05),随着Fe3O4NPs浸种浓度上升至300和400 mg·L–1,其GP呈现下降(图 3a,图 3b)。与对照相比,低盐胁迫并不影响最终的发芽率(GR),Fe3O4NPs浸种,其GR也未显著变化(图 3c)。而高盐胁迫下,其GR显著下降,1 mg·L–1 Fe3O4NPs浸种的番茄种子GR进一步显著下降,随着Fe3O4NPs浸种浓度上升,其GR开始上升,50 mg·L–1 Fe3O4NPs(HSN50)处理下,其GR和单独盐处理(HS)的差异不显著,随着Fe3O4NPs浸种浓度继续上升,其GR逐渐下降(图 3d)。该结果说明在盐胁迫下番茄种子的发芽中,200 mg·L–1 Fe3O4NPs浸种处理有促进的效果,在低盐胁迫下短时间发芽势(GP)上体现尤为明显,而长时间处理下,种子均能吸够水分,其不同处理发芽率(GR)无明显差异;而高盐胁迫下由于盐分对种子渗透胁迫的影响很大,使得该差异未达到显著水平。
|
注:LS、LSN1、LSN10、LSN50、LSN100、LSN200、LSN300、LSN400处理分别表示1、10、50、100、200、300、400 mg·L–1 Fe3O4NPs浸种后统一用低盐(100 mmol·L–1 NaCl)处理。HS、HSN1、HSN10、HSN50、HSN100、HSN200、HSN300、HSN400处理分别表示1、10、50、100、200、300、400 mg·L–1 Fe3O4NPs浸种后统一用高盐(150 mmol·L–1 NaCl)处理。CK为清水浸种后,不加NaCl的蒸馏水处理。图柱上不同的小写字母表示处理间差异显著(P < 0.05)。下同。 Note: The treatments of LS, LSN1, LSN10, LSN50, LSN100, LSN200, LSN300, and LSN400 represent 1, 10, 50, 100, 200, 300, and 400 mg·L–1 Fe3O4NPs soaking seeds, respectively, and uniformly treated with low salt(100 mmol·L–1 NaCl)after soaking. Treatment with HS, HSN1, HSN10, HSN50, HSN100, HSN200, HSN300, and HSN400, respectively, indicated that 1, 10, 50, 100, 200, 300, and 400 mg·L–1 Fe3O4NPs soaking seeds, and uniformly treated with high salt(150 mmol·L–1 NaCl). CK represent seeds soaked in and treated with distilled water. The different lowercase letters on the column in Figure 1 indicate significant differences between treatments(P < 0.05). The same below. 图 3 低盐(100 mmol·L–1 NaCl,a、c)和高盐(150 mmol·L–1 NaCl,b、d)胁迫下不同浓度Fe3O4NPs浸种对番茄种子发芽势(a、b)和发芽率(c、d)的影响 Fig. 3 Effects of soaking seeds with different concentrations of Fe3O4NPs on germination potential (a, b) and germination rate(c, d) of tomato seeds under low salt stress (100 mmol·L–1 NaCl, a, c) and high salt stress (150 mmol·L–1 NaCl, b, d) |
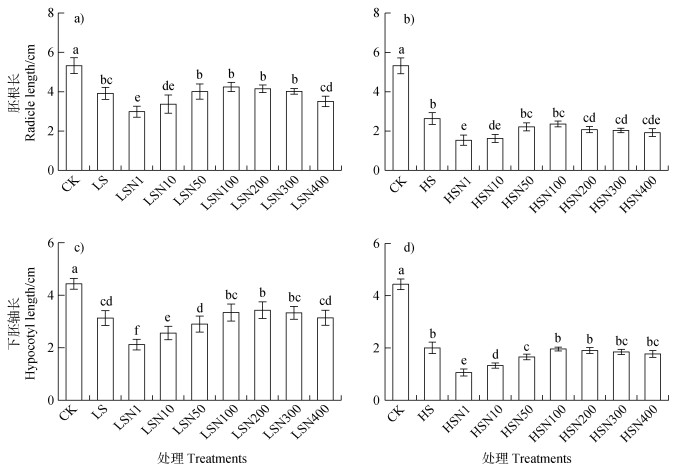
图 4所示,盐胁迫明显降低发芽盒里番茄种子胚根和下胚轴的长度,尤其是对下胚轴长的抑制更为明显。盐胁迫下,不同浓度Fe3O4NPs浸种也展示了不同情况的调控效应。低盐和高盐胁迫下,1 mg·L–1 Fe3O4NPs浸种的番茄种子胚根长和下胚轴长均进一步显著下降,尤其下胚轴长的降低更为明显,随着Fe3O4NPs浸种浓度上升,其胚根长和下胚轴长度逐渐显著上升,100 ~200 mg·L–1 Fe3O4NPs浸种的植株胚根和下胚轴长度达到峰值;低盐处理下,200 mg·L–1 Fe3O4NPs处理(LSN200)的下胚轴长较仅低盐处理(LS)的显著上升(P < 0.05),而其他情况下的胚根和下胚轴长与仅盐处理的差异均不显著(图 4)。在发芽盒中进行的盐胁迫萌发试验表明1 mg·L–1 Fe3O4NPs浸种对番茄种子胚根和下胚轴伸长的抑制明显,而200 mg·L–1 Fe3O4NPs浸种对下胚轴伸长有一定的促进效应。
|
图 4 低盐(100 mmol·L–1 NaCl,a、c)和高盐(150 mmol·L–1 NaCl,b、d)胁迫下不同浓度Fe3O4NPs浸种对番茄种子胚根长(a、b)和下胚轴长(c、d)的影响 Fig. 4 Effects of soaking seeds with different concentrations of Fe3O4NPs on radicle length (a, b) and hypocoltyl length(c, d)of tomato seeds under low salt stress (100 mmo l·L–1 NaCl, a, c) and high salt stress (150 mmo l·L–1 NaCl, b, d) |
盐胁迫18 d明显降低番茄成苗率、幼苗鲜物质量和含水量,增加幼苗超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,不同浓度Fe3O4NPs浸种,也展示了对上述指标不同的调控效应(图 5)。100 mmol·L–1 NaCl胁迫下,1 mg·L–1 Fe3O4NPs(LSN1)处理下,番茄种子的成苗率、幼苗鲜物质量和含水量均进一步显著下降(图 5a,图 5b,图 5c),表现了明显的生长抑制效应,而SOD和POD活性进一步显著上升,CAT活性下降(图 5d,图 5e,图 5f),随着Fe3O4NPs浸种浓度上升,其成苗率、幼苗鲜物质量、含水量和CAT活性均逐渐显著上升(图 5a,图 5b,图 5c,图 5f),而SOD和POD活性均逐渐下降(图 5d,图 5e),100 mg·L–1 Fe3O4NPs(SN100)处理下其成苗率达到峰值(图 5a),200 mg·L–1 Fe3O4NPs(SN200)处理下幼苗鲜物质量、含水量和CAT活性均达到峰值,均显著高于单独的盐处理的(图 5b,图 5c,图 5f),砂培条件下盐胁迫萌发试验显示200 mg·L–1 Fe3O4NPs处理对萌发后成苗和幼苗素质具有显著的促进效应。随着Fe3O4NPs浸种浓度继续上升,成苗率、幼苗鲜物质量、含水量、CAT活性均逐渐下降。随着Fe3O4NPs浸种浓度的上升,SOD和POD活性呈现先下降、后上升,100 mg·L–1 Fe3O4NPs(SN100)处理下其酶活均为最低,但是均显著高于对照,同时显著低于仅盐处理(图 5d,图 5e)。
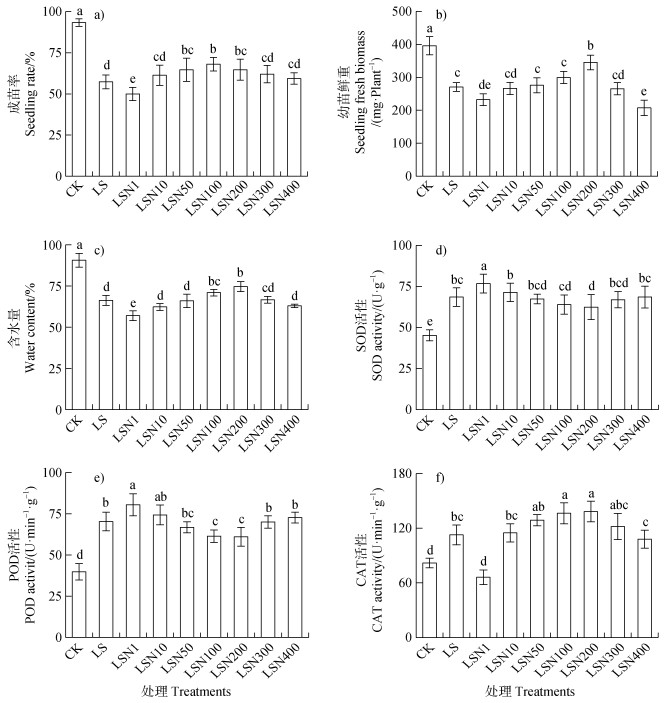
|
图 5 100 mmol·L–1 NaCl胁迫下不同浓度Fe3O4NPs浸种对番茄种子成苗率(a)、幼苗鲜物质量(b)、含水量(c)、超氧化物歧化酶(SOD)活性(d)、过氧化物酶(POD)活性(e)和过氧化氢酶(CAT)活性(f)的影响 Fig. 5 Effects of soaking seeds with different concentrations of Fe3O4NPs on seedling rate (a), seedling fresh biomass (b), water content (c), superoxide dismutase (SOD) activity (d), peroxidase (POD) activity (e) and catalase (CAT) activity (f) of tomato seeds under salt stress of 100 mmol·L–1 NaCl |
砂培条件下盐胁迫萌发试验显示,盐胁迫明显增加番茄幼苗的MDA、Pro、O2·-和H2O2含量,辅以不同浓度纳米级Fe3O4浸种,也展示了不同情况的调控效应(图 6)。盐胁迫下,1 mg·L–1 Fe3O4NPs(LSN1)处理下,膜脂过氧化产物MDA、细胞渗透调节保护物质及自由基清除剂Pro、活性氧(O2·-和H2O2)含量均进一步上升,其中O2·-和H2O2含量的上升均达到显著水平,显示了典型的次生氧化胁迫特征;随着Fe3O4NPs浸种浓度上升,MDA、Pro、O2·-和H2O2含量逐渐下降,200 mg·L–1 Fe3O4NPs(LSN200)处理下幼苗MDA、Pro、O2·-和H2O2含量均达到最低值(图 6),表明氧化胁迫得以明显缓解。
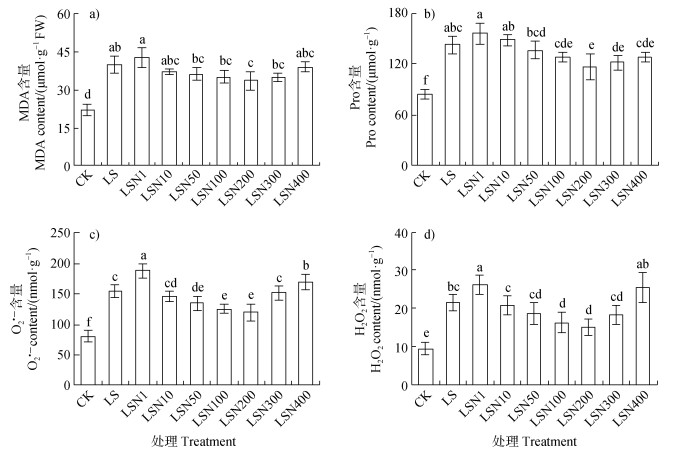
|
图 6 100 mmol·L–1 NaCl胁迫下不同浓度Fe3O4NPs浸种对番茄幼苗丙二醛(MDA)(a)、脯氨酸(Pro)(b)、超氧阴离子自由基(O2·-)(c)和过氧化氢(H2O2)(d)含量的影响 Fig. 6 Effects of soaking seeds with different concentrations of Fe3O4NPs on contents of malondialdehyde (MDA)(a), proline (Pro)(b), superoxide anion radical (O2·-)(c) andhydrogen peroxide (H2O2)(d) of tomato seedlings under salt stress of 100 mmol·L–1 NaCl |
分析不同浓度Fe3O4NPs浸种处理下,砂培番茄幼苗各指标之间的关系,结果(表 1)表明,幼苗鲜物质量与成苗率和含水量呈正相关,且均达到极显著水平(P < 0.01);幼苗鲜物质量、成苗率与SOD活性、POD活性、MDA含量、O2·-含量和H2O2含量呈负相关,且均达到极显著水平(P < 0.01);幼苗鲜物质量与Pro含量呈显著负相关(P < 0.05);幼苗鲜物质量与CAT活性无明显的相关性(P > 0.05)。表 1还显示,与其他指标相比,幼苗鲜物质量与O2·-和H2O2含量的负相关更为显著;成苗率与SOD和POD活性以及MDA含量更为显著。成苗率与SOD活性、POD活性以及MDA、Pro、O2·-和H2O2含量均为显著负相关(表 1)。
|
|
表 1 番茄幼苗鲜生物量(SFB)、成苗率(SR)、含水量(WC)、保护酶系统活性、MDA、Pro、O2·-和H2O2含量之间的相关性 Table 1 Correlation between seedling fresh biomass (SFB), seedling rate (SR), water content (WC), protective enzyme system activity, contents ofMDA, Pro, O2·-, and H2O2 content in tomato seedlings |
土壤盐分是植物生长和产量等形成的主要障碍之一。在全球作物生产中,除了耐盐作物品种研发外,通过外源化学物质和肥料的应用,如钙、硅、钾、碘、硒、褪黑素和生物有机肥等应用,有效提高植物生长和产量,受到了广泛研究和关注[24-25]。纳米生物技术的介入,可进一步发挥一些材料在抗逆和促生上的应用,成为可持续农业的一个有前途的工具[5],一些具有独特理化性质的纳米粒子不仅作为纳米载体,也可内在地促进植物生长和提高抗逆能力,纳米粒子的这种生物学作用取决于其理化性质、施用方法和施用浓度等[26]。
3.2 纳米材料调控盐胁迫下作物种子的萌发盐胁迫对植物种子发芽和植物生长产生不利影响,众所周知这主要是由缺水引起的[27],缺水导致植物渗透胁迫和生化差异的异常变化[15,28],而工程纳米材料与植物种子的界面结合可提高脆弱的植物萌发期抗逆能力[29]。盐胁迫下纳米材料被用于提高作物的萌发相关文献有30余篇,研究较多的是ZnONPs、AgNPs、纳米SiO2(SiO2NPs)、纳米TiO2(TiO2NPs)和纳米Se(SeNPs)等在盐胁迫下调控作物种子萌发,其次也有一些文献关于纳米CeO2(CeO2NPs)、纳米碳(CNPs)、纳米硅(SiNPs)、纳米锌(ZnNPs)调控盐胁迫下作物种子萌发[3]。Gaafar等[30]开展了ZnONPs浸种2 h调控盐胁迫下大豆种子萌发的研究,在250 mmol·L–1 NaCl胁迫下,大豆种子发芽率显著下降,25、50 mg·L–1 ZnONPs浸种的种子发芽率上升,尤其50 mg·L–1 ZnONPs浸种的促进效应尤为明显,而100、200 mg·L–1 ZnONPs浸种的种子发芽率则进一步显著下降,表明ZnONPs的施用效果在盐胁迫下大豆种子萌发过程中具有鲜明的浓度效应。Almutairi[14]用AgNPs浸种2 h,发现0.05~2.5 mg·L–1 AgNPs浸种不同程度地提高盐胁迫番茄种子的发芽率,150 mmol·L–1 NaCl胁迫下,0.5和2.5 mg·L–1浸种的发芽效果最好,200 mmol·L–1 NaCl胁迫下,2.0 mg·L–1浸种的发芽效果最好。本研究首次尝试用Fe3O4NPs调控盐胁迫下番茄种子萌发,发现Fe3O4NPs调控番茄种子萌发也同样具有典型的浓度效应(图 3),从低至高浓度Fe3O4NPs处理下,类似Almutairi[14-15]的研究,其番茄发芽势和发芽率呈现不同的调控效应,其中1 mg·L–1 Fe3O4NPs进一步降低种子发芽的效应最为明显;而盐胁迫下所有Fe3O4NPs浸种处理中,200 mg·L–1处理的番茄种子表现出一定程度的促进发芽的效应。Gaafar等[30]研究发现,盐胁迫下,25~200 mg·L–1 ZnONPs浸种的番茄种子发芽7 d后的根长和地上部长均不同程度增加,其中50和100 mg·L–1 ZnONPs浸种处理下地上部长度显著增加。Almutairi[14]发现150 mmol·L–1 NaCl胁迫下0.05~2.0 mg·L–1 AgNPs浸种处理均能增加番茄种子根长,其中1.5 mg·L–1浓度下促进最为显著,而2.5 mg·L–1 AgNPs处理下番茄种子根长显著下降;200 mmol·L–1 NaCl胁迫下,0.05~2.5 mg·L–1 AgNPs浸种处理,均能增加番茄种子根长,且随着浸种浓度的增加,根长呈抛物线状变化,在1.5 mg·L–1浓度下增加最为显著。而本研究中,盐胁迫下随着Fe3O4NPs浸种浓度上升,番茄发芽种子的胚根长和下胚轴长也呈现抛物线状,发现200 mg·L–1 Fe3O4NPs浸种处理显著促进100 mmol·L–1 NaCl胁迫下的番茄下胚轴长度(图 4),该促进效应的机理需要进一步探讨。研究[30]表明,用ZnO颗粒浸泡的植物种子中锌的浓度越高,发芽率和生长性状越高,锌纳米颗粒可能通过提高水分利用效率和叶片相对含水量来增加膨压和植物大小。作为纳米颗粒,Fe和Zn同样作为植物生长的必须微量元素,很可能在促进水分吸收上具有类似的机制。
3.3 纳米材料对盐胁迫下成苗及其对作物早期幼苗氧化还原平衡的调控Almutairi[15]发现盐胁迫下,0.05 mg·L–1 AgNPs浸种的番茄幼苗鲜物质量进一步显著下降,随着浸种浓度的上升,鲜物质量逐渐上升,呈现抛物线状,在1.5 mg·L–1浓度下鲜物质量最大,显著高于仅盐处理的。该特征和现象与本研究中番茄幼苗鲜物质量不同处理下的变化(图 5b))很相似。本研究表明,100 mmol·L–1 NaCl胁迫下,1 mg·L–1 Fe3O4NPs浸种的番茄幼苗鲜物质量进一步下降,随着Fe3O4NPs浸种浓度的上升,番茄幼苗鲜物质量逐渐上升,再逐渐下降,其中200 mg·L–1 Fe3O4NPs浸种的幼苗鲜物质量达到最高(图 5),表明200 mg·L–1 Fe3O4NPs浸种具有显著的成苗和壮苗作用。Gaafar等[30]研究也发现,250 mmol·L–1 NaCl胁迫下ZnONPs浸种的大豆幼苗鲜物质量也呈现类似的抛物线浓度效应,50 mg·L–1 ZnONPs浸种的幼苗鲜物质量较仅盐处理的增加近1倍,而25、100和200 mg·L–1 ZnONPs浸种处理的幼苗鲜物质量均显著下降,同时发现大豆幼苗POD和CAT活性、MDA含量和Pro含量随ZnONPs浸种浓度上升,先逐渐下降再回升,而SOD活性随浸种浓度上升而下降,50 mg·L–1 ZnONPs浸种的幼苗SOD、POD和CAT等酶活性数值均最低,MDA含量和Pro含量也最低。该保护酶系统应激ZnONPs浸种处理的变化和本研究结果(图 5)不同。本研究表明,盐胁迫下,1 mg·L–1 Fe3O4NPs浸种的幼苗的氧化胁迫加剧,其MDA、Pro、O2·-和H2O2含量也均进一步上升,SOD和POD酶活也显著上升(图 5),随着Fe3O4NPs浸种浓度达到100~200 mg·L–1,其耐盐性得到显著改善,幼苗鲜物质量、成苗率和MDA、Pro、O2·-和H2O2含量以及SOD、POD活性均呈现极显著负相关(表 1),表明植株抗氧化的改善导致耐盐性的增强。Al-Quraan等研究发现盐胁迫下黑灰碳纳米纤维处理的番茄种子的MDA水平显著下降,种子含水量上升,从而其发芽率显著增加,表明番茄种子萌发的改善和其抗氧化能力的提升密切相关。该研究[16]还发现用纳米碳引发番茄种子,发现50 mmol·L–1 NaCl胁迫下50、250 mg·L–1纳米碳进一步显著增加植株的叶绿素含量,其叶片H2O2、MDA含量显著上升,而其SOD和CAT活性无显著变化,植株主要通过叶片抗坏血酸过氧化物酶(APX)活性和番茄果实中生物活性化合物的提升保护植株免受盐胁迫的负面影响。该研究表现的纳米碳调控盐胁迫番茄种子萌发的抗氧化特征与本研究结果(图 5)也不尽相同。本研究表明,盐胁迫下,Fe3O4NPs浸种的番茄早期幼苗活性氧的积累与SOD、POD活性呈现极显著正相关,与膜脂过氧化产物MDA、重要的细胞渗透调节保护物质及自由基清除剂Pro也呈现极显著正相关,而与CAT活性无明显的相关性(表 1)。这表明纳米材料种类、处理方式以及盐胁迫强度的差异和植株取样分析阶段的不同,使得植株启动抗氧化的机制显示出多样性的变化[26]。而由于铁是植物生长和发育所需的关键元素,铁在促进植株氮素利用、促进叶绿素的合成、参与抗氧化代谢等方面发挥着重要作用[18],这些很可能是本研究中Fe3O4NPs调控番茄幼苗生长和抗氧化的主要原因,但是其浓度效应的差异现象仍需进一步探讨。
4 结论本研究用共沉淀法合成粒径为10 nm的Fe3O4NPs,其X-射线衍射图谱分析表明该纳米材料具有良好的结晶性,无杂质峰出现,并通过电镜观察和分析,进一步证实了Fe3O4NPs的成功合成。其分散液浸种对盐胁迫下番茄种子萌发、成苗、抗氧化代谢等展示了依赖于浸种浓度的调控特征,即1 mg·L–1 Fe3O4NPs浸种处理表现出进一步抑制萌发的典型特征,而200 mg·L–1 Fe3O4NPs浸种处理展示其促进萌发、成苗和壮苗的典型作用。通过相关性分析,上述过程均与其抗氧化是否得到改善直接相关。针对愈来愈严重的土壤盐渍、干旱等农业生态环境问题,启动开展Fe3O4NPs研究并应用至盐土农业、设施农业生产中可显著减少农药和化肥的迁移与流失,有效提高农药和化肥的利用效率,促进植物生长,提高农业生产,并减少环境污染,这方面研究的重要性、迫切性和可行性不言而喻。Fe3O4NPs对番茄种子萌发的上述效应的调控机制研究尚需全面和深入地探讨,进一步探讨在非盐胁迫(即正常条件)下Fe3O4NPs外源处理对种子萌发的影响也是必要的,使用组学手段更深入地分析盐胁迫下番茄种子萌发过程中生理功能的调控及抗氧化、离子稳态调控等作用机制也有迫切的需要。
| [1] |
Cilek A, Berberoglu S. Biotope conservation in a Mediterranean agricultural land by incorporating crop modelling[J]. Ecological Modelling, 2019, 392: 52-66. DOI:10.1016/j.ecolmodel.2018.11.008
(  0) 0) |
| [2] |
Fan C Z, Wu X Y, Guan X, et al. Concentration effects and its physiological mechanism of soaking seeds with brassinolide on tomato seed germination under salt stress (In Chinese)[J]. Acta Ecologica Sinica, 2021, 41(5): 1857-1867. [范翠枝, 吴馨怡, 关欣, 等. 油菜素内酯浸种对盐胁迫番茄种子萌发的影响及其生理机制[J]. 生态学报, 2021, 41(5): 1857-1867.]
(  0) 0) |
| [3] |
Hassanisaadi M, Barani M, Rahdar A, et al. Role of agrochemical-based nanomaterials in plants: Biotic and abiotic stress with germination improvement of seeds[J]. Plant Growth Regulation, 2022, 97(2): 375-418. DOI:10.1007/s10725-021-00782-w
(  0) 0) |
| [4] |
Hu P J, Du Y P, Xia B, et al. Bibliometric analysis of research on soil colloids affecting the behavior of heavy metals based on Web of Science (In Chinese)[J]. Acta Pedologica Sinica, 2023. DOI:10.11766/trxb202207270413 [胡鹏杰, 杜彦锫, 夏冰, 等. Science对土壤胶体影响重金属行为研究的计量分析[J]. 土壤学报, 2023.]
(  0) 0) |
| [5] |
Ding Y Z, Wang X L, Zeng Y, et al. Mechanism of p-hydroxybiphenyl degradation by persulfate activated with iron-carbon composite nanomaterials in soil (In Chinese)[J]. Soils, 2022, 54(5): 1041-1050. [丁英志, 王肖磊, 曾宇, 等. 铁碳复合纳米材料活化过硫酸盐降解土壤中对羟基联苯的机制研究[J]. 土壤, 2022, 54(5): 1041-1050.]
(  0) 0) |
| [6] |
Pérez-Labrada F, López-Vargas E R, Ortega-Ortiz H, et al. Responses of tomato plants under saline stress to foliar application of copper nanoparticles[J]. Plants, 2019, 8(6): Article 151. DOI:10.3390/plants8060151
(  0) 0) |
| [7] |
Morales-Espinoza M C, Cadenas-Pliego G, Pérez-Alvarez M, et al. Se nanoparticles induce changes in the growth, antioxidant responses, and fruit quality of tomato developed under NaCl stress[J]. Molecules, 2019, 24(17): 3030. DOI:10.3390/molecules24173030
(  0) 0) |
| [8] |
Sayed E G, Mahmoud A W M, El-Mogy M M, et al. The effective role of nano-silicon application in improving the productivity and quality of grafted tomato grown under salinity stress[J]. Horticulturae, 2022, 8(4): 293. DOI:10.3390/horticulturae8040293
(  0) 0) |
| [9] |
Pinedo-Guerrero Z H, Cadenas-Pliego G, Ortega-Ortiz H, et al. Form of silica improves yield, fruit quality and antioxidant defense system of tomato plants under salt stress[J]. Agriculture, 2020, 10(9): 367. DOI:10.3390/agriculture10090367
(  0) 0) |
| [10] |
Faizan M, Bhat J A, Chen C, et al. Zinc oxide nanoparticles(ZnO-NPs)induce salt tolerance by improving the antioxidant system and photosynthetic machinery in tomato[J]. Plant Physiology and Biochemistry, 2021, 161(4): 122-130.
(  0) 0) |
| [11] |
Hosseinpour A, Haliloglu K, Cinisli K T, et al. Application of zinc oxide nanoparticles and plant growth promoting bacteria reduces genetic impairment under salt stress in tomato(Solanum lycopersicum L. 'Linda')[J]. Agriculture, 2020, 10(11): 521. DOI:10.3390/agriculture10110521
(  0) 0) |
| [12] |
Aazami M A, Rasouli F, Ebrahimzadeh A. Oxidative damage, antioxidant mechanism and gene expression in tomato responding to salinity stress under in vitro conditions and application of iron and zinc oxide nanoparticles on callus induction and plant regeneration[J]. BMC Plant Biology, 2021, 21(1): 597. DOI:10.1186/s12870-021-03379-7
(  0) 0) |
| [13] |
Abd-Alla M H, Nafady N A, Bashandy S R, e t al. Mitigation of effect of salt stress on the nodulation, nitrogen fixation and growth of chickpea(Cicer arietinum L.)by triple microbial inoculation[J]. Rhizosphere, 2019, 10: 100148. DOI:10.1016/j.rhisph.2019.100148
(  0) 0) |
| [14] |
Almutairi Z M. Influence of silver nano-particles on the salt resistance of tomato(Solanum lycopersicum)during germination[J]. Agriculture and Biology, 2016, 18(2): 449-457. DOI:10.17957/IJAB/15.0114
(  0) 0) |
| [15] |
Almutairi Z M. Effect of nano-silicon application on the expression of salt tolerance genes in germinating tomato(Solanum lycopersicum L.)seedlings under salt stress[J]. Plant Omics, 2016, 9(1): 106-114.
(  0) 0) |
| [16] |
Al-Quraan N A, Al-Akhras M, Ayoub A A. Effect of ash carbon nanofibers on GABA shunt pathway in germinating seeds of tomato(Lycopersicon esculentum Mill. c. v. Rohaba.)under salt stress[J]. Turkish Journal of Botany, 2021, 45(2): 124-139. DOI:10.3906/bot-2008-34
(  0) 0) |
| [17] |
Neha J, Abhishek P, Devanshi C U, et al. Synthesis of biocompatible Fe3O4 and MnO2 nanoparticles for enhanced tuberization in potato(Solanum tuberosum L.)[J]. Biocatalysis and Agricultural Biotechnology, 2022, 39: 102258. DOI:10.1016/j.bcab.2021.102258
(  0) 0) |
| [18] |
Elanchezhian R, Kumar D, Ramesh K, et al. Morpho-physiological and biochemical response of maize(Zea mays L.)plants fertilized with nano-iron(Fe3O4)micronutrient[J]. Journal of Plant Nutrition, 2017, 40(14): 1969-1977. DOI:10.1080/01904167.2016.1270320
(  0) 0) |
| [19] |
Cui W Y, Xue D, Tan N D, et al. Pt supported on octahedral Fe3O4 microcrystals as a catalyst for removal of formaldehyde under ambient conditions[J]. Chinese Journal of Catalysis, 2018, 39(9): 1534-1542. DOI:10.1016/S1872-2067(18)63082-7
(  0) 0) |
| [20] |
Syamsu, Saehana S, Darmadi I W, et al. Introduction of nanoparticle magnetic development as transfer medium at mung bean seeds(virginia radiata L.)using soaking method[J]. Journal of Physics: Conference Series, 2020, 1434: 012026. DOI:10.1088/1742-6596/1434/1/012026
(  0) 0) |
| [21] |
Haghighi M, Afifipour Z, Mozafarian M. The effect of N-Si on tomato seed germination under salinity levels[J]. Journal of Biological and Environmental Sciences, 2012, 6: 87-90.
(  0) 0) |
| [22] |
Chen J, Guan X, Fan C Z, et al. Effects of salt stress on form of polyamine and antioxidation in germinating tomato seed (In Chinese)[J]. Acta Pedologica Sinica, 2021, 58(6): 1598-1609. DOI:10.11766/trxb202002180051 [陈军, 关欣, 范翠枝, 等. 盐胁迫对番茄种子萌发中多胺形态变化和抗氧化的影响[J]. 土壤学报, 2021, 58(6): 1598-1609.]
(  0) 0) |
| [23] |
Wang X K. Principles and techniques of plant physiological biochemical experiment (In Chinese). 2nd ed[M]. Beijing: Higher Education Press, 2006. [王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京: 高等教育出版社, 2006.]
(  0) 0) |
| [24] |
Ahammed G J, Li Y, Li X, et al. Epigallocatechin-3-gallate alleviates salinity-retarded seed germination and oxidative stress in tomato[J]. Journal of Plant Growth Regulation, 2018, 37(4): 1349-1356.
(  0) 0) |
| [25] |
Su Y, Tian C Y, Mai W X, et al. Progress and prospect of biological salt removal from farmland under drip irrigation in arid area of northwest China (In Chinese)[J]. Acta Pedologica Sinica, 2023, 60(4): 925-938. DOI:10.11766/trxb202202150008 [苏媛, 田长彦, 买文选, 等. 滴灌条件下西北干旱区农田生物排盐研究进展与展望[J]. 土壤学报, 2023, 60(4): 925-938.]
(  0) 0) |
| [26] |
Zhao L J, Lu L, Wang A D, et al. Nano-biotechnology in agriculture: Use of nanomaterials to promote plant growth and stress tolerance[J]. Journal of Agricultural and Food Chemistry, 2020, 68(7): 1935-1947.
(  0) 0) |
| [27] |
Pu Z T, Zhang L, Zhang C, et al. Research progress of arbuscular mycorrhizal fungi and plant symbiosis affecting plant water regime (In Chinese)[J]. Soils, 2022, 54(5): 882-889. [蒲子天, 张林, 张弛, 等. 丛枝菌根真菌与植物共生影响植物水分状态的研究进展[J]. 土壤, 2022, 54(5): 882-889.]
(  0) 0) |
| [28] |
Ge LJ, Yang XY, Liu Y, et al. Improvement of seed germination under salt stress via overexpressing caffeic acid O-methyltransferase 1(SlCOMT1)in Solanum lycopersicum L[J]. International Journal of Molecular Sciences, 2023, 24(1): 734.
(  0) 0) |
| [29] |
An J, Hu P G, Li F J, et al. Improvement by seed priming with cerium oxide nanoparticles[J]. Environmental Science-Nano, 2020, 7(8): 2214-2228.
(  0) 0) |
| [30] |
Gaafar R, Diab R, Halawa M, et al. Role of zinc oxide nanoparticles in ameliorating salt tolerance in soybean[J]. Egyptian Journal of Botany, 2020, 60(3): 733-747.
(  0) 0) |
| [31] |
González-García Y, López-Vargas E R, Pérez-Álvarez M, et al. Seed priming with carbon nanomaterials improves the bioactive compounds of tomato plants under saline stress[J]. Plants, 2022, 11(15): 1984.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61


