2. 中国地质大学(武汉)环境学院, 武汉 430078;
3. 江苏省污染场地土壤与地下水修复工程实验室, 南京 210008
2. School of Environment, China University of Geosciences (Wuhan), Wuhan 430078, China;
3. Laboratory of Soil and Groundwater Remediation Engineering for Contaminated Sites in Jiangsu Province, Nanjing 210008, China
近年来,随着经济快速发展,我国面临的土壤环境问题日益严峻。由于大气沉降、污水灌溉、有害废水直排或泄漏等问题,土壤已成为多种污染物的“汇”。其中,持久性有机污染物(Persistent Organic Pollutants,POPs)由于其高毒性、持久性、生物累积性和长距离迁移性引起人们极大的关注。多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)是一类土壤中普遍存在的典型POPs,由两个或两个以上苯环的碳氢化合物及其衍生物组成。PAHs具有强疏水性和亲脂性,可与土壤中有机质发生强烈的分配和吸附作用[1-2],长期滞留在土壤中。目前,已有16种代表性PAHs(∑16PAHs)被我国和美国环保署列为优先控制污染物。化石、生物燃料燃烧和汽车尾气排放是导致我国土壤中普遍存在PAHs污染的主要原因[3],Liu等[4]发现我国长治市农田土壤的∑16PAHs污染高达917 μg·kg–1;焦化、冶炼、石油化工、电子拆解等工业场地土壤中的PAHs污染问题则更加突出[5],Luo等[6]报道沈阳市发电厂和防水材料厂附近的土壤中∑16PAHs浓度高达21 821 μg·kg–1,而Man等[7]也发现香港电子垃圾场地土壤中∑16PAHs浓度最高达8 042 μg·kg–1。根据Maliszewska-Kordybach的土壤PAHs的污染程度分级:土壤∑16PAHs<200 μg kg–1为未污染土壤;∑16PAHs在200~600 μg kg–1为轻度污染土壤;∑16PAHs在600~1 000μg kg–1为中度污染土壤;∑16PAHs>1000 μg kg–1为重度污染;∑16PAHs>10 000 μg/kg为非常严重污染[8],我国土壤PAHs污染较为严重。此外,污染的区域分布、主导污染物种类等污染特征尚不清楚,因此需要对我国土壤中PAHs污染组成和空间分布特征进行分析。
PAHs对人体具有致癌、致畸、致突变作用,已有文献报道PAHs暴露会诱发人群肺癌、皮肤癌和膀胱癌[9]。我国生态环境部发布的《土壤环境质量建设用地土壤污染风险管控标准(GB36600-2018)》和美国国家环保局发布的《美国国家环保局区域筛选值》规定了部分PAHs的土壤管控标准,但是目前所推荐的标准均是基于土壤污染物总量暴露评估进行制定,没有考虑到污染物赋存形态、人体对污染物的有限吸收以及人体胃肠道中复杂消化过程可能对污染物的降解作用,这些因素均会导致高估PAHs暴露风险。为准确评估PAHs对人体的健康风险,研究者提出了生物有效性(Bioavailability)以开展污染物风险评估研究。郭晓欣等[10]将生物可给性(Bioaccessibility)引入PAHs风险评估后发现苯并[a]芘和二苯并[a,h]蒽的人体健康致癌风险降低了一个数量级,修复目标值也分别提升了2.6倍和1.5倍,在一定程度上克服了土壤PAHs修复目标值过于保守的问题。
生物有效性的测定通过将动物暴露于污染物质,并在暴露周期结束后监测血液或肝脏组织中的目标污染物浓度。尽管动物毒性实验结果能更真实地反映污染物实际暴露水平,但动物实验试验周期长,研究成本较高,并要求专业人员进行操作,难以在实际评估项目中大规模应用,故人们提出了针对土壤污染物的物理化学提取法以及基于体外模拟人体胃肠道消化过程的生物可给性以预测生物有效性。国际上Ruby等[11]于1993年提出的生理原理提取法(PBET)被认为是测定生物可给性的体外胃肠模拟实验设计的起点,起初被广泛用于土壤中金属离子生物可给性测定,后经改进可测定土壤、室内灰尘和食物中的多环芳烃和多氯联苯等半挥发性有机物的生物可给性[12-15]。此外,除了生理原理提取法(PBET),人体肠道微生物生态模拟法(SHIME)和德国研究院法(DIN)等也是测定污染物生物可给性的常用方法。我国《建设用地土壤污染修复目标值制定指南(试行)》也推荐利用体外模拟实验方法测定半挥发性有机污染物的生物可给性。本文首先基于123篇文献分析了我国土壤中∑16PAHs的污染分布特征(表 1),并进一步解析PAHs对人体的主导暴露途径;其次对国内外测定PAHs生物可给性的方法及改进手段进行综述,并深入分析消化液组分、不同土壤类型等因素对PAHs生物可给性测定的影响,以期为优化体外模拟测定方法,精准评估PAHs的健康风险提供关键科技支撑。
|
|
表 1 我国表层土壤PAHs污染调查的文献地理信息分布 Table 1 Geographical distribution of surved literature for PAHs pollution in China's surface soils |
本文基于2000―2020年国内报道的关于我国不同地区土壤PAHs的文献,对∑16PAHs的污染特征进行分析。如表 1所示,文献调查的PAHs污染地点分布于33个省、自治区和直辖市,共涉及229个采样地点,可以较好地代表我国大部分地区土壤PAHs的污染情况。表 2总结了∑16PAHs污染物的理化性质和毒理学参数,包括9种非致癌和7种致癌PAHs(carcinogenic PAHs,∑7cPAHs)(苯并[a]蒽(BaA)、苯并[a]芘(BaP)、䓛(Chr)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、二苯并[a,h]蒽(DahA)和茚并[1,2,3-cd]芘(IcdP))。如表 2所示,∑16PAHs蒸气压均小于1 mmHg,表明多为半挥发或难挥发有机物;而Kow值较大,表明其亲脂性较强,易分配累积到人体脂肪组织中产生长期伤害[16];同时由于PAHs的Koc值较大,能与土壤有机质紧密结合,因此较高环PAHs不易从土壤颗粒中释放。7种cPAHs均具有经口(致癌斜率因子,SFo)和呼吸(单位致癌风险,IUR)致癌毒性效应,且BaP和DahA的SFo和IUR值最大,致癌毒性最强。
|
|
表 2 16种优先控制PAHs理化和毒理学性质及相关土壤PAHs筛选值 Table 2 Physiochemical and toxicological properties of 16 priority-controlled PAHs and relevant soil screening values |
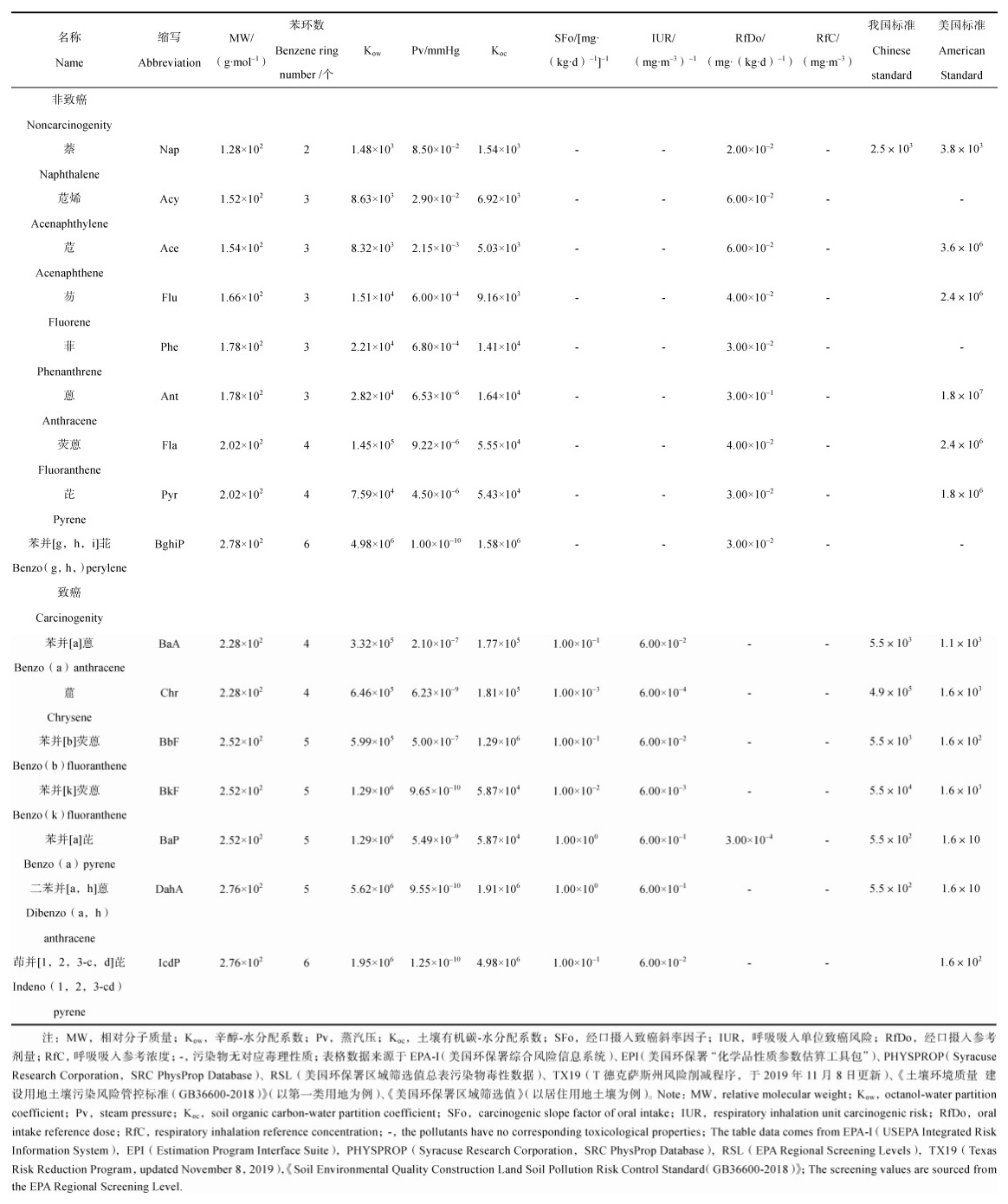
根据文献[17]报道,济南市表层土壤中∑16PAHs的平均浓度高达23 250 μg·kg–1[17],本文根据所有文献统计得出的平均值为1 314.7 μg·kg–1,污染较为严重[8]。为判断单一PAHs污染程度,以7种cPAHs为例,将文献中各采样地点cPAHs平均浓度绘制为浓度分布直方图及分布曲线,并标出表 2中美国规定的部分PAHs筛选值,如图 1所示。由图可知,BaP和Icdp的浓度均值及95%置信上限值均大于美国国家环保局制定的筛选值(因我国生态环境部制定PAHs筛选值均大于cPAHs浓度最大值,故未在图中画出),说明大部分采样地点BaP和Icdp可能产生污染风险,需进行风险评估;其他cPAHs仅有BbF和DahA有少量点位平均浓度大于筛选值,说明污染风险较小,推测原因是本文统计的采样地点除工业场地外还包含公园、湿地、郊区农田等距污染源较远的地点。
|
图 1 不同场地中7种cPAHs的浓度分布直方图及分布曲线 Fig. 1 Histograms and distribution curves of concentration distribution for 7 carcinogenic PAHs in different sites |
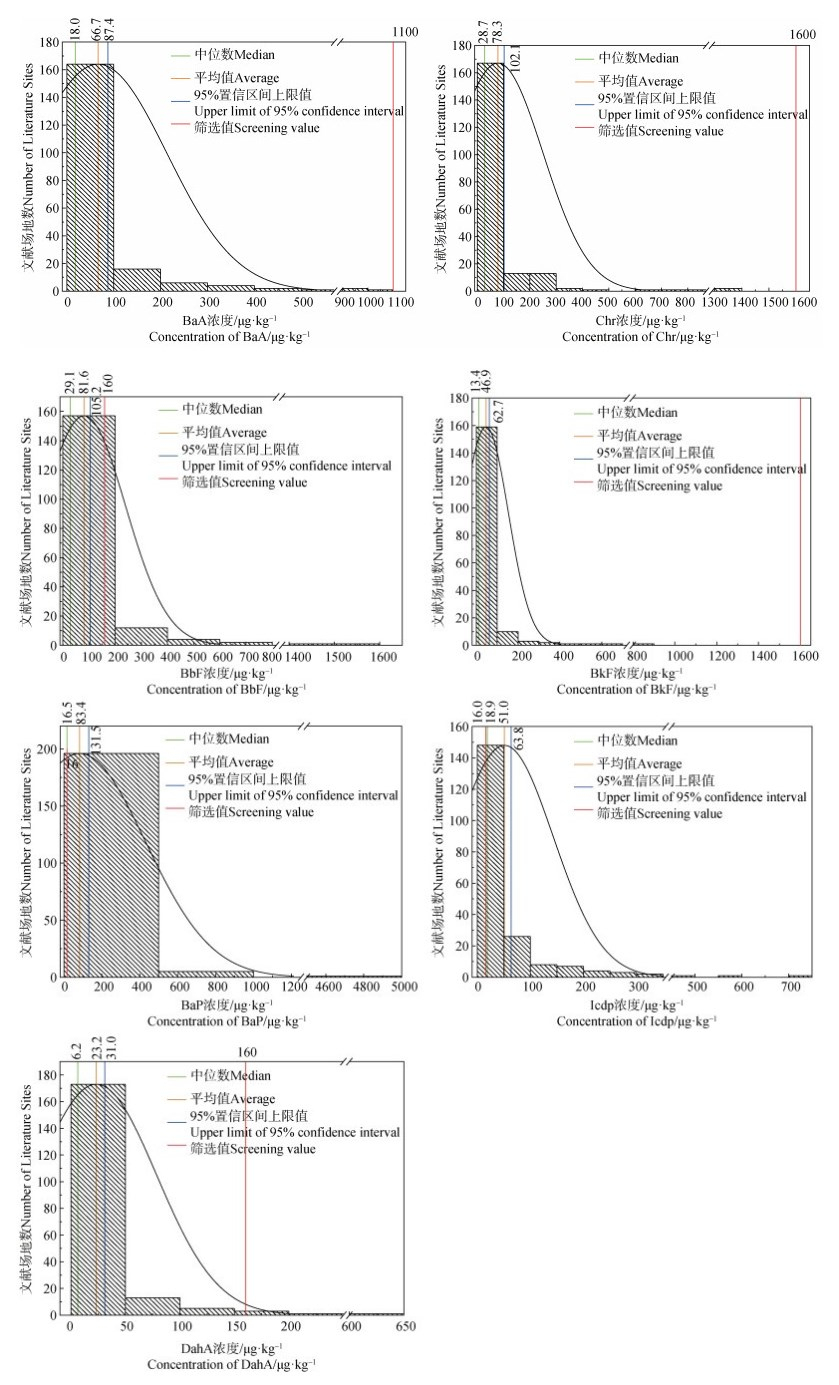
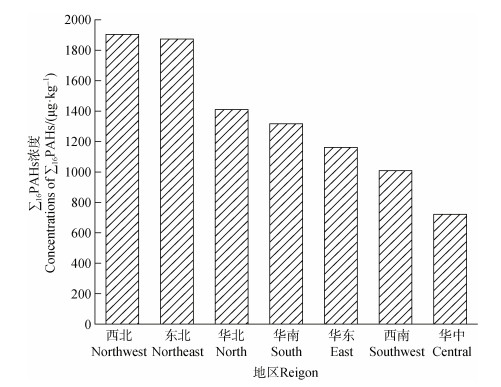
各地区∑16PAHs浓度及∑7cPAHs浓度占∑16PAHs浓度的百分比分别如图 2和图 3所示,各地区土壤中∑16PAHs浓度高低趋势为西北(1 904.8 μg·kg–1)>东北(1 874.6 μg·kg–1)>华北(1 410.7 μg·kg–1)>华南(1 316.8 μg·kg–1)>华东(1 161.3 μg·kg–1)>西南(1 008.8 μg·kg–1)>华中(721.3 μg·kg–1),∑7cPAHs占∑16PAHs的百分比顺序为:华中(43.71%)、华东(42.08%)、华北(41.99%)、华南(39.00%)、东北(34.4%)、西南(33.14%)及西北(20.97%)。可以观察到,北方地区PAHs污染更为严重,∑7cPAHs占比较南方更大,可能原因是北方某些省份重工业比例较大,以煤炭燃烧为主的能源经济结构排放的PAHs量更大,且煤炭燃烧主要产生高环PAHs,使其占∑16PAHs较高,这与尚庆彬等[18]的研究一致。至于高环PAHs占比较低的西北地区,推测原因是收集文献中含大量地处偏远地区新疆和青海的样本,其污染主要来自其他地区大气传输的低环PAHs,从而导致西北地区低环PAHs占比较大。此外,各地区7种cPAHs百分比平均值顺序为BbF(8.14%)>Chr(6.86%)>IcdP(5.13%)>BaP(5.04%)>BaA(4.97%)>BkF(3.80%)>DahA(2.53%),说明BbF和Chr在各地区占比均较高,尤其华东(BbF,8.84%;Chr,8.52%)和华中地区(BbF,10.24%;Chr,9.19%)最为明显。此外,∑cPAHs的平均检出率均较高[19-33],超过50%,从大到小依次为Chr(81.69%)>BaA(81.63%)>BbF(76.09%)>IcdP(75.03%)>BaP(74.43%)>BkF(69.44%)>DahA(67.21%),与浓度占比比较后发现,Chr和BbF在土壤中的浓度及检出率均较高。
|
图 2 不同地区土壤中∑16PAHs浓度 Fig. 2 ∑16PAHs Concentrations of soils in different regions |
|
图 3 不同地区土壤中cPAHs含量占∑16PAHs百分比 Fig. 3 Percentages of carcinogenic PAHs in ∑16PAHs from soils in different regions |
PAHs对人体的暴露途径主要包括:经口摄入、皮肤接触土壤;吸入室内、室外土壤颗粒物;吸入表层、下层土壤室外蒸气以及下层土壤的室内蒸气。本文利用本课题组自主研发的污染场地健康与环境风险评估软件(HERA++),根据国家导则默认参数,推导了土壤PAHs在不同暴露途径下的贡献率(PPC,Exposure Pathway Contribution)(表 3)。
|
|
表 3 16种优控PAHs在不同暴露途径下对致癌风险/危害商的贡献率 Table 3 Contribution rates to carcinogenic risks/ hazard quotients of 16 priority-controlled PAHs under different exposure pathways |
由表 3可知,挥发性较强的萘以吸入下层土壤室内蒸气为主要暴露途径,致癌风险和危害商的贡献率分别为64.96%和46.79%。其他PAHs通过经口摄入土壤暴露途径对总致癌风险或危害商的贡献率范围为62.71%~72.98%,皮肤接触途径贡献率次之,为27.02%~29.38%,其他暴露途径则占比较少(贡献率不超过6.76%),说明经口摄入土壤颗粒为PAHs的主导暴露途径,与已有文献报道结果一致[7,34-37]。基于不同暴露途径,PAHs对人体的生物可给性主要包括在胃肠液和肺液中的可给性,而经口摄入土壤颗粒主要进入胃肠液中,故本文主要关注土壤PAHs在胃肠液中释放的模拟方法。
2 生物有效性(可给性)研究进展 2.1 生物有效性(可给性)定义由于生物有效性涉及研究领域众多,对生物有效性的定义和边界在不同领域难以统一。为消除生物有效性在理论上的歧义,美国研究顾问委员会(US National Research Council,USNRC)首先提出了“生物有效性过程”的概念[38],以规范环境领域“生物有效性”的学术内涵。污染物从环境迁移至生物体内主要包括以下5个过程(图 4):污染物与固相物质结合或从固相物质中释放(A);污染物解吸后向生物体迁移(B);结合态污染物向生物体迁移(C);生物膜对污染物的吸收(D);通过生物膜的污染物与生物体内反应位点结合(E)。生物有效性主要指D过程,而生物可给性则包括A-D过程,具有更广的内涵和适用范围。
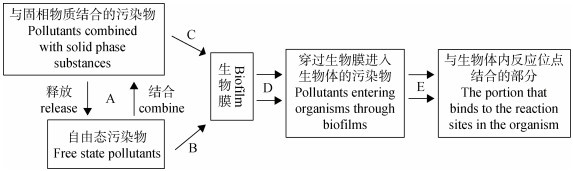
|
图 4 土壤污染物的生物利用过程示意图 Fig. 4 Schematic diagram of biological utilization processes of soil pollutants |
生物有效性被定义为污染物进入人体后能穿过胃肠道上皮细胞进入人体内循环的剂量占总摄入量的比例,也称为绝对生物有效性[39]。不同形态的污染物在同种基质中或相同污染物在不同基质中的生物有效性称为相对生物有效性。生物可给性被定义为土壤污染物溶解于胃肠液后,能被人体吸收利用的部分,因此生物可给性是最大程度的生物有效性。
2.2 生物可给性测定方法目前,土壤污染物的生物可给性评价方法常分为两大类:(1)物理化学提取法,包括温和溶剂提取法、固相提取法、被动采样技术和超临界流体萃取技术等;(2)生物学方法,即体外生理实验(In Vitro or Physiological Based Extraction Test)模拟法——体外模拟人体胃肠道消化过程,用于代替测定生物有效性的动物实验法(In Vivo or Animal Test)。本节就对两类生物可给性评价方法分别进行简介。
2.2.1 物理化学方法传统化学提取法包括使用强力有机溶剂(二氯甲烷、正己烷等)对土壤进行索氏提取、加速溶剂萃取及超声萃取等[40-42]。但是,基于污染物总量的耗竭性提取往往会高估土壤污染物的风险,故近年来人们多尝试使用非耗竭性提取的物理化学法进行代替,如使用醇类溶剂与水混合溶液或环糊精等表面活性剂提取PAHs的温和溶剂萃取法;以分配理论为基础的固相提取技术、基于分子扩散原理的被动采样技术和利用流体在超临界状态下的传质特性提取有机污染物的超临界流体萃取技术也常被用来测定多环芳烃、多氯联苯等有机污染物的生物可给性。
1)温和溶剂提取法
温和溶剂萃取法(Mild Solvent Extration,MSE)是指土壤样品中加入极性溶剂或溶剂与水的混合物(如丁醇、甲醇、甲醇-水),搅拌混合物,然后分析萃取物中的污染物与耗竭性提取的污染物质量之比即为生物可给性[43],该技术已被说明与蚯蚓动物实验测定的生物有效性间有良好相关性[44]。但是,由于有机溶剂与污染物有较强相似相容性,在一定程度上仍会高估污染物的风险,故人们提出如“环糊精”的表面活性剂来评估有机污染物的生物可给性。环糊精(Cyclodextrin,CD)是一种环式低聚糖,具有一个环外亲水、环内疏水且有一定结构的立体手性空腔,这种环状结构可以有机污染物如PAHs等形成包合配合物[45]。Reid等[46]用环糊精衍生物羟丙基-β-环糊精(Hydroxypropyl-β-cyclodextrin,HPCD)的水溶液、丁醇震荡提取以及二氯甲烷索氏提取法对不同老化时间污染土壤中的Phe进行提取。结果表明,丁醇和二氯甲烷都高估了菲的生物可给性,只有HPCD能够更好的评价菲对微生物的生物可给性。
2)固相提取法
固相提取法(Solid Phase Extration,SPE)是指使用吸附剂提取土壤中可解吸进入水相的一部分污染物来评价不同生物体的生物可给性。常用的吸附剂包括疏水性较强的非离子型吸附剂Tenax-TA和XAD-2等吸附树脂,Cui等[43]发现使用Tenax6小时或24小时的提取技术可作为简化方法来预测PAHs的快速解吸组分并有效预测评价生物可给性,Cornelissen等[47]采用Tenax单点提取6种沉积物中的10种PAHs,结果发现提取6 h的PAHs的数量是快速解吸部分的0.5倍,用Tenax-TA提取6 h的量比总量提取的量更能准确地表示污染物的环境风险。树脂提取法最大的优点在于它漂浮于水面很容易从土壤溶液中分离出来,吸附的PAHs易被有机溶剂萃取,且能够重复利用,最大缺点是消耗的时间和成本较大[48]。
3)被动采样技术
被动采样提取(Passive Sampler Methods,PSMs)又被定义为仿生萃取[49],该技术通过分子扩散原理模拟有机物穿过生物膜从水相到生物有机相的分配平衡过程,也包含了污染物从土壤向土壤溶液转移的过程[48]。常用的被动采样器常使用聚合物材料,如聚二甲基硅烷、聚乙烯、聚甲醛等,目前已被证明与蚯蚓摄取PAHs测得的生物有效性和水生蠕虫体内PAHs的生物积累之间密切相关[50-51]。但是,PSM目前仅应用于评价有限类型的有机污染物的生物可给性,且需采用更严格的质量控制手段来减小误差,故被动采样技术还需进一步开发和完善。
4)超临界流体萃取法
超临界流体萃取(Supercritical Fluid Extration,SFE)是利用流体在超临界状态时的密度大、黏度小等优良传质性质而开发的针对有机污染物的提取技术,该技术可用于研究土壤污染物的吸附解吸过程,并预测其生物可给性。目前常用的流体萃取剂是CO2,CO2在一定温度压力下对PAHs的溶解度与水相近,且极性和生物脂质相似,故使用纯CO2作为超临界流体的萃取气体可以快速测定污染土壤中PAHs的快速解吸组分并预测其生物可给性[52-53]。不同研究发现SFE提取的PCBs可以代表其快速解吸组分以及蚯蚓可吸收的生物可给性部分[54-55],Librando等[56]还发现SFE可从土壤中提取90%以上的PAHs。但是,由于土壤基质的巨大异质性如有机质含量和土壤空隙结构等因素使目标化合物的提取条件受到很大影响,操作方法难以统一是SFE法难以大规模应用的重要因素,故还需进一步研究不同土壤类型对SFE提取的影响。
2.2.2 生物学方法生物学方法测定生物可给性采用与人体生理条件一致或相近的人工合成消化液(唾液、胃液、小肠液等)来模拟土壤中污染物在人体消化系统(口腔、胃、小肠、大肠等)的溶出量[57-58]。虽然生物可给性是最大程度的生物有效性,污染物在胃肠液中的可给量高于有效量,但生物可给性测定方法具有分析时间短、结果重现性好、实验设计简便等优点,成为一种有效预测生物有效性的方法。因此,将保守的可给量代替有效量进行风险评估更具实际应用价值。经过28年发展,体外胃肠模拟方法经历了一系列演变,主要包括:生理原理提取法、人体肠道微生物生态模拟法和德国研究院法等。16种优先控制PAHs可给性测定方法总结在表 4中。
|
|
表 4 生物可给性测定方法(体外生理模拟法) Table 4 Bioaccessibility determination method(In Vitro or Physiological Based Extraction Test) |
1)生理原理提取法(Physiologically-Based Extraction Test,PBET)。PBET法最初由Ruby等[59-60]提出用来模拟铅和砷的生物可给性,该方法包括胃、肠的连续模拟阶段。在人体饥饿状态下,模拟胃液的pH一般为1.5,包含胃蛋白酶和各种有机酸,模拟小肠液的pH则偏中性,包含胆汁、胰酶和黏蛋白等中性物质。胃、肠模拟液与污染物反应时间一般分别为1 h和4 h,其实验条件较化学溶剂直接提取土壤污染物更接近人体生理条件。PBET基本流程如下:首先向模拟胃肠反应器底部通入氩气搅动,依次加入模拟胃液和污染土壤,达到平衡状态后吸取反应液,分析胃消化阶段结束后溶液中污染物浓度;再调节反应液进入小肠模拟阶段,反应结束后,分析模拟小肠液中的污染物浓度,溶液和土壤中污染物质量之比即为生物可给性(%)。PBET法已被大规模用来测定PAHs生物可给性[61-63]。Tang等[64]首次使用PBET法测定北京地区表层土壤PAHs生物可给性,结果显示胃肠阶段生物可给性范围分别为3.90%~54.9%和9.20~60.5%;汤莉莉等[1]使用PBET法测定北京市土壤16种优控PAHs生物可给性,发现土壤在胃和小肠阶段生物可给性最高分别达18.03%和47.67%;Khan等[65]也发现土壤中8种PAHs的胃肠生物可给性分别为20.0%~46.0%和27.0%~53.0%。说明土壤在胃肠液中能释放出一部分赋存其中的污染物,PBET法能够有效测定PAHs的生物可给性。
2)结肠扩展PBET法(Colon Extended Physiologically Based Extraction Test,CE-PBET)。由于PAHs等疏水性有机污染物(Hydrophobic Organic Contaminants,HOCs)在胃肠模拟液中较难溶解,PBET法对其生物可给性的测定结果偏低,不够准确,而食物在通过人体结肠的时间占通过消化道总时间近80%,Cavret和Feidt[66]还发现PAHs可以穿过结肠上皮细胞系Caco-2细胞膜,且结肠内部含有胆盐和丰富的碳水化合物会促进有机污染物从基质中解吸,故后续研究提出了结肠扩展PBET法用于优化PBET法。Tilston等[67]在PBET法中添加了一个结肠腔室来评估PAHs生物可给性,结果发现使用CE-PBET法测量7种PAHs萘(NaP)、苊(Ace)、芴(Flu)、菲(Phe)、蒽(Ant)、荧蒽(Fla)、芘(Pyr)生物可给性(13.7%~75.1%)大于使用PBET法的测量结果(7.9%~62.8%),这可归因于结肠腔室中黏蛋白和胆盐对PAHs的增溶作用以及消化时间的延长。CE-PBET法也被用来测定土壤和灰尘中PAHs和多溴二苯醚(Poly Brominated Diphenyl Ethers,PBDEs)的生物可给性[68-69],结果发现结肠室内16种优控PAHs仍有不同程度释放,不同PBDEs在添加结肠室消化后生物可给性也有所提升,其中BDE-100的生物可给性从36%增大至53%。
3)人体肠道微生物生态模拟法(Simulator of the Human Intestinal Microbial Ecosystem,SHIME)。SHIME测定法是由Molly等[70]开发的一种自动多级反应器。这个由计算机控制的动态反应器由五个隔间组成,包括胃、小肠和升、横、降结肠阶段,与CE-PBET法不同的是,SHIME的结肠模拟部分除了相应有机和无机成分,还加入了结肠微生物群,这有助于深入了解结肠微生物群如乳酸杆菌、葡萄球菌对有机污染物的代谢作用。van de Wiele等[71]将SHIME法用于测定公园污染土壤生物可给性,发现土壤经过胃、小肠和结肠模拟液消化分别释放出0.44%、0.12%和0.3%的PAHs;Yu等[72]对上海市场上18种食品如蜗牛和鸡肉等进行SHIME测定,发现∑16PAHs的总生物可给性平均范围为29%~61%。Siciliano等[73]使用SHIME法测定了加拿大土壤颗粒中PAHs生物可给性,发现胃肠阶段生物可给性均小于8%,结肠阶段生物可给性为1.2%~21.0%;Cave等[74]测定了六种不同浓度的cPAHs在土壤中的生物可给性,其三个阶段的总生物可给性范围为12.8%~58.7%,说明SHIME法新增的结肠阶段也能释放一定污染物。值得注意的是微生物对有机物的代谢作用,如van de Wiele等[75]发现BaP在结肠微生物作用下会代谢为7-羟基BaP,因此只评估污染物浓度可能会低估其生物可给性,故SHIME虽然模拟环境更接近人体真实情况,但由于其复杂的操作和结肠微生物群可能对目标污染物的降解作用,导致可给性测定结果误差,因此SHIME法在大规模测定有机物可给性方面应用较为有限。
4)Rodriguez体外胃肠法(In Vitro Gastrointestinal,IVG)。Rodriguez等[76]建立了IVG方法用于测定土壤中砷的生物可给性,该方法与PBET法不同之处在于胃消化液中加入了NaCl而非有机酸,导致胃液pH较高,且加入了生面团模拟消化道中食物,该方法对砷的生物可给性预测结果与动物实验结果相近[77-78]。但IVG法在测定持久性有机污染物方面的应用有限,仅有James等[79]研究了8种BaP污染土壤(0.17~650 μg·kg–1)的生物可给性,测定结果为0.1%~13%,且此结果与动物实验得到的生物有效性相关性较差,可能原因是模拟消化时间短,未达到污染物在土壤与模拟液介质间的吸附解吸平衡[80]。
5)荷兰公共卫生与环境研究院法(Dutch National Institute for Public Health and the Environment,RIVM)。RIVM相比PBET法增加了唾液模拟液用于模拟口腔阶段,且胃和小肠液pH更低[81](胃模拟阶段pH=1,小肠阶段pH=5.5),RIVM法包括禁食和喂食状态的模拟[82-84]。Pu等[85]在土壤中加入200 000和400 000 μg·kg–1的Phe,使用RIVM法进行禁食模拟消化,测得的体外可给性结果与大鼠血液模型的体内结果呈一般相关性(R2=0.53)。然而,由于其实验中土壤样本数量少,添加Phe的模拟污染土壤与实际污染土壤的误差较大,且对大鼠进行灌胃或静脉注射后测定血液中PAHs浓度会忽略肝脏对PAHs的代谢作用导致高估生物有效性,故Pu等的研究结果代表性较差。Grøn等[86]将土豆泥和鸡肉加入消化液模拟喂食状态,测量了四种BaP(220~5 400 μg·kg–1)和DahA(80~990 μg·kg–1)污染土壤的生物可给性,其测定结果随土壤类型而变化,如污染时间较长的柏油污染土壤BaP和DahA的生物可给性较低(5.7%和12%)。RIVM法虽然更完整地模拟了人体消化过程,但由于提取过程是连续性的,只能在最终阶段获取PAHs生物可给性,且模拟过程复杂,因此利用RIVM法的研究较少。
6)有机物喂养人体模拟评估实验(Fed Organic Estimation human Simulation Test,FOREhST)。由于PAHs的亲脂性,食品中含有的脂质可能会增加土壤PAHs的溶解度,促进PAHs释放[80,87],Cave等[74]开发了由喂食状态RIVM法改进而成的FOREhST法,在口腔阶段添加的婴儿奶粉成分分别代表了荷兰和英国两个国家的平均营养摄入,Cave对废弃煤气厂污染土壤中6种cPAHs(BaA、BbF、BkF、BaP、DBA、IcdP)的生物可给性测定,结果表明FOREhST法具有较好重复性,且比较SHIME测定结果呈现相关性(R2=0.55)。Cave等[88]使用FOREhST法测定柏油厂草地土壤中PAHs生物可给性,结果表明16种PAHs生物可给性平均值为25%。Lorenzi等[89]测定煤气场地16种PAHs生物可给性,平均值为61.3%,相较于上述其他模拟方法更大,说明在消化液中加入食物组分可提高PAHs生物可给性,也符合进食状态下人体的消化情况,但FOREhST法与动物实验模拟的体外实验结果建立相关性的报道还较少,还需进一步验证其可靠性。
7)德国研究院法(The German-Deutsches Institut fur Normung,DIN)。DIN法首先由Hack和Selenka[90]开发,用于测定土壤中PAHs和多氯联苯(PCBs)的生物可给性,且已经被德国标准研究院采纳为土壤中无机和有机污染物生物可给性测定的标准方法。但是,与其他方法相比,研究人员采用DIN法测定HOCs生物可给性的研究报道较少。DIN方法和PBET法类似,模拟污染物的体外胃、肠消化阶段,但其肠道消化时间更长(6 h)。此外,DIN法在胃阶段加入了人体日常摄入的无机盐类(CaCl2、MgCl2、KCl等)及奶粉以丰富模拟过程,其主要目的是研究食物对PAHs和HOCs生物可给性的影响。Zhang等[91]使用DIN法测定污染土壤中PAHs生物可给性,发现测定结果略高于采用PBET和FOREhST法测定的生物可给性。但Yu等[15]使用DIN法测定的电子污染土壤中PBDEs生物可给性与雌性C57BL/6鼠测定的体内生物有效性相关性较差,还需进一步验证。总体而言,关于DIN测定法的研究和应用较少,对HOCs生物可给性的测定还较为有限。
总而言之,通过比较物理化学方法和生物学方法测定生物可给性,发现物理化学法虽然操作简单、分析快速,但测得的生物可给性通常与蚯蚓、蠕虫等非哺乳动物的毒性实验进行生物有效性验证,而体外模拟实验则常与和人类亲缘关系较近的哺乳动物如幼猪、猴类毒性试验测得的生物有效性进行相关性比较,故对PAHs对人体的生物有效性预测更为直观,故本文将对体外模拟法进行进一步介绍。在体外模拟法中,不同方法的消化参数以及污染物的赋存介质——土壤的性质类型对生物可给性的测定结果有较大的影响。由于土壤有机碳含量和老化时间的不同,会导致土壤释放PAHs的程度不同。因此,本部分将对PAHs生物可给性测定方法进行综述,并结合污染土壤的性质类型进行深入分析。16种优控PAHs生物可给性测定的土壤类型列于表 5中。
|
|
表 5 用于生物可给性测定的土壤或污染介质类型 Table 5 Soil or polluting medium types for bioaccessibility test |
小肠吸收过程可使污染物在小肠中保持浓度梯度,促使污染物从土壤中解吸。然而,传统体外胃肠模拟法没有考虑到这一过程,因此会低估测定的生物可给性[92-95]。针对传统方法不足,改进体外模拟法的方式主要是在胃肠液中加入吸附剂来模拟小肠动态吸收过程,加入吸附剂不仅可以提高生物可给性,也可增强体外模拟结果与动物实验测定结果之间的相关性。
1)硅胶吸附剂。硅胶柱有很强的吸附能力,Gouliarmou等[96]在CE-PBET方法基础上利用硅胶柱来提高胃肠液吸附PAHs的能力,在胃、小肠和结肠液三种模拟液中添加的硅胶柱提取使PAHs释放能力增加了1-3个数量级。Juhasz等[61]在PBET法中加入了约为土壤有机质含量100倍的硅胶,结果表明PAHs生物可给性均有提升,其中四环和五环的PAHs生物可给性提高了16.8倍~27.3倍,停车场附近土壤中Flu和Pyr生物可给性高达78.9%和81.7%。范任君[97]在DIN方法基础上耦合有机硅胶,结果发现∑7cPAHs生物可给性的范围从3.18%~46.9%提升至16.0%~90.5%,且有机硅胶有较好的重复使用性;James等[98]分别使用高频和低频振荡的FOREhST法(添加硅胶棒)对污染场地土壤中14种PAHs的平均生物可给性进行测定,发现与幼猪血浆PAHs暴露即生物有效性之间的相关性较强,分别为R2=0.81(p<0.005)和R2=0.64(p<0.01)。
2)Tenax吸附剂。Tenax是一种多孔高效吸附材料,对疏水性有机污染物(Hydrophobic Organic Contaminants,HOCs)有很强亲和性。李超[99]将Tenax吸附剂添加于胃肠液中,发现明显提高了7种PAHs(Pyr,Flu,Chr,BbF,BkF,BaP,BghiP)和滴滴涕(Dichlorodiphenyltrichloroethane,DDTs)的生物可给性,且对DDTs进一步进行动物实验后表明测得的生物有效性和可给性之间有良好线性相关性。Zhang等[91]在五种不同方法(UBM、FOREhST、IVD、PBET、DIN)中加入Tenax测定PAHs生物可给性,发现Tenax作为HOCs的吸附“汇”,使三环、四环、五/六环PAHs的生物可给性分别增加了5倍、6倍和11.2倍,且通过建立Tenax、消化时间、液固比等影响因子对生物可给性的多元线性回归方程发现Tenax因子的标准化系数较其他影响因子更大,说明加入Tenax能极大影响生物可给性。Chen等[100]发现Tenax改进FOREhST测定的硝化PAHs(Nitrated PAHs,NPAHs)在老化土壤中的平均生物可给性(20.6%)更接近小鼠模型测定的生物有效性平均值(19.5%),高于传统FOREhST测定的平均值(8.4%);Li等[101]发现加入Tenax的PBET测得PCBs的生物可给性与小鼠模型测得的生物有效性R2=0.7,相关性较强,说明在体外胃肠模拟中加入吸附剂可以更可靠地预测POPs的生物有效性。
3)环状18碳固相萃取膜(C18膜)。James等[79]利用C18膜作为吸附剂来提高PAHs生物可给性,结果发现加入C18后体外生物可给性与利用幼猪试验模型得到的生物有效性之间的相关性R2从0.03(无相关性)提升至0.45(呈一般相关)。
总体而言,相比于传统体外胃肠模拟方法,添加吸附剂可以更准确地测定生物可给性,并有效地用于预测PAHs的生物有效性。
2.4 生物可给性影响因素综上所述,影响PAHs溶解和释放的各个因素均可能改变生物可给性,本文下述从体外消化条件(消化液组分、时间等)、PAHs理化性质及其在土壤中的老化作用和土壤性质(土壤有机碳含量)三个方面讨论影响PAHs生物可给性的因素。
1)消化液组分。Tang等[64]和Lu等[102]研究发现小肠模拟条件下PAHs生物可给性均大于胃模拟条件的生物可给性,可能原因是小肠阶段含有的胆盐会促进胶束形成,使溶液表面张力降低,PAHs更易溶解。Tilston等[67]也发现当小肠和结肠阶段存在胆盐时,上清液中检测到大量PAHs;Oomen等[103]认为胆盐胶束对基质中HOCs迁移起着核心作用。此外,消化液中食物的脂质成分会与胆汁形成混合胶束,也可能增加PAHs的溶解[90,104]。消化液中的酶类物质如胃蛋白酶、胰酶等,对PAHs的生物可给性影响较小。Minhas等[105]发现将胃蛋白酶从消化液中去除时,消化液中Chr浓度没有显著变化。Tang等[64]研究表明胃蛋白酶和胰酶只能略微降低消化液的表面张力,说明酶对PAHs生物可给性的影响有限,且Weston和Mayer[106]未发现酶活性与PAHs可给性间的线性相关性。此外,小肠模拟液的pH较胃液高,能够促进土壤有机质的溶解[107],也有利于提高PAHs生物可给性。
2)消化液对土壤的消化时间。Zhang等[91]研究发现消化时间对生物可给性影响较大,通常消化时间越长,土壤可以释放更多PAHs至消化液中并最终达到吸附解吸平衡。Juhasz等[87]对杂酚油污染土壤中PAHs进行生物可给性测定,发现7种PAHs可给性较低,约为2.0%~3.3%,其原因是胃、肠模拟液消化时间较短(仅为2 h),未达吸附解吸平衡。相反地,Siciliano等[73]将体外消化时间延长至18 h,结果表明PAHs小肠阶段可给性增大到1.2%~21.0%。但是,消化时间也需合理控制,Tilston等[67]对人工混合PAHs土壤进行消化,发现结肠阶段培养8 h后溶液中PAHs浓度几乎不变,消化延长至16 h后培养基变黑出现明显含硫气味,表明出现了硫还原菌的活性微生物污染。故消化时间应控制在PAHs与模拟液达到吸附解吸平衡的状态,防止过度消化且干扰生物可给性分析。
3)PAHs性质及其在土壤中的老化作用。Zhang等[108]发现土壤有机质对PAHs的吸附效果随其疏水性增强而增强,Khan等[65]通过实验发现PAHs环数增加后,其胃肠阶段生物可给性会随之降低,这与高环PAHs水溶性低、Koc高更易被土壤有机质吸附有关。Vasiluk等[109]也发现含高环BaP的低有机质含量土壤(11%)在消化液中释放量约为高有机质土壤(29%)的两倍,且小肠中胆汁提取物对Koc值较高PAHs的生物可给性提升具有更显著作用,Gouliarmou等[96]发现硅胶棒吸附汇的加入使高环PAHs的释放量较低环PAHs更大。但Min等[102]发现三环到六环PAHs在胃肠阶段的生物可给性依次增加,推测原因是小分子量PAHs更易进入土壤孔隙内部被封锁,导致生物可给性较低。
随着时间推移,赋存污染物的土壤基质会在自然条件下发生老化,这可能会改变土壤的物理结构,如土壤渗透性降低,而PAHs易持续扩散到土壤内部有机质的纤孔被土壤封锁其中,或从吸附性较弱的NOM相转移至吸附性较强的黑炭相上,从而降低其生物可给性[79,91,106]。事实上,已有研究表明老化土壤的污染物很难释放到消化液中,生物可给性通常更低[110]。例如,Minhas等[105]对未老化和分别老化6和12个月的Chr混合土壤进行生物可给性测定,发现老化土壤消化液和EVA膜中Chr浓度明显更低。Vasiluk等[109]对老化7天和4个月的悉尼港沉积物中BaP进行生理原理提取,发现老化沉积物的BaP提取量大量减少,进一步证明土壤老化会显著减小PAHs生物可给性。
4)土壤有机质组成。由于PAHs的强疏水性和低水溶性,土壤有机质对PAHs起到主要吸附作用,有机质对PAHs的吸附曲线通常可以用总有机碳(Total Organic Carbon,TOC)含量表示[61,111],土壤TOC含量越高,吸附的PAHs越多。PAHs吸附可分为吸附于结构疏松、无固定形状、化学活性较强的软碳类物质和结构致密、具有微孔结构、化学活性较弱的硬碳类物质两种情况,Li等[112]使用扫描电镜显示了河流沉积物的软碳和硬碳结构。软碳类物质包括胡敏酸(Humic Acid,HA)、富里酸(Fulvic Acid,FA)等,硬碳类物质则包括胡敏素(Humin,HM)和黑炭(Black Carbon,BC)等。研究表明,软碳通常显示线性和非竞争性吸收或分配,硬碳则通常以非线性竞争表面吸附和孔隙填充为主[61,93-95,110]。一般情况下,PAHs在土壤中的吸附形态可分为快速解吸、缓慢解吸和不可逆解吸部分,被软碳吸附的PAHs为快速解吸部分,而硬碳则主要吸附的是缓慢或不可逆解吸部分[79,91,106]。Meyer等[63]研究发现4种地质吸附剂的PAHs生物可给性大小排序为石英砂(26.9%)>黏土(6.4%)>泥炭(4.8%)>木炭(0.1%),其中木炭BC含量最高;范任君[97]发现7种cPAHs的生物可给性与BC含量呈显著负相关,也可说明硬碳类物质对PAHs的吸附能力较强;Zhang等[108]将土壤分为HA、FA和HM三部分进行PAHs(NaP、Phe、Pyr和BaA)吸附解吸实验,发现HM的非线性吸附量及吸附亲和力最强,是结合PAHs的主要组分,推测原因是HM灰分含量更高,与矿物质结合较紧密,而有机矿物复合物可提供更多吸附位点及更高非均相吸附能量,吸附更多PAHs,包桂奇等[112]和钟名誉等[113]也得出了类似结论;Ukalska-Jaruga等[115]也研究发现使用温和溶剂提取的PAHs(Fla、Pyr、BaA和Chr)生物可给性量则与FA和HA含量呈正比,而PAHs总浓度和提取残留浓度则与HM含量呈显著正相关,说明PAHs在土壤中的持久性取决于稳定的硬碳类物质,而不稳定的软碳类物质则可促进PAHs的解吸释放。
由于土壤SOM组分在结构和组成上存在显著差异,故对PAHs的吸附特性存在偏差。根据碳骨架排列方式,SOM可分为芳香族C组分和脂肪族C组分,研究表明芳香族成分可以通过π -π相互作用和范德华力结合PAHs,脂肪族成分则通过疏水相互作用与PAHs结合。目前,关于SOM对HOC的吸附是芳香族C或脂肪族C起到主要结合作用还尚未有定论,Zhuo等[116]指出芳香族C在结合PAHs方面起到重要作用,Li等[114]也发现河流下游沉积物OM对PAHs的吸附更加强烈与其高芳香族成分有关,但是,Zhang等[108]研究发现SOM对PAHs的吸附亲和力与脂肪族C组分呈正相关,而与芳香族C组分呈负相关,HM对PAHs吸附亲和力最强也与其脂肪族组分最多有关。综上所述,土壤SOM组成对16种优控PAHs的生物可给性影响尚不明确,需要进一步研究。
2.5 生物可给性测定范围本文统计了文献中直接给出和计算得出的PAHs生物可给性数据,将16种优控PAHs的生物可给性数据绘制成箱线图(见图 5)。方框内代表上下四分位数之间的数据量,占总数据的50%(即1IQR),据2.4节所述,可以观察到由于土壤性质、生物可给性测定方法不同,PAHs的测定结果波动较大,且由于土壤老化、消化时间短等因素使PAHs可给性过低,会出现1.5IQR范围外的“异常值”。通过计算得出16种优控PAHs的生物可给性平均值如下:NaP(72.4%)、Acy(77.3%)、Ace(62.8%)、Flu(46.0%)、Phe(44.4%)、Ant(35.8%)、Fla(34.6%)、Pyr(34.3%)、BaA(32.5%)、Chr(29.2%)、BbF(29.9%)、BkF(28.5%)、BaP(21.9%)、DahA(14.8%)、Bghip(13.2%)、IcdP(16.6%),分析可知PAHs可给性大小基本符合与Koc值成反比的规律,由图可知低环PAHs的可给性中位值(27.2%~73.3%)也多高于高环PAHs(6.5%~46%),即Koc值较大的高环PAHs与土壤有机质结合的更紧密不易释放。从风险评估角度分析,非致癌PAHs中NaP、Acy和Ace生物可给性均值超过50%,达到较高水平,7种致癌PAHs中,BaA、Chr、BbF和BkF生物可给性最高可分别达80%、70%、75%和75%,其可给性均值也较大。此外,根据上文(1.1部分)所述,BbF和Chr浓度占∑16PAHs百分比和检出率也较高,因此,在风险管控中,除毒性最强的BaP外,NaP、Acy、Ace、BbF和Chr5种PAHs对暴露风险的贡献占比可能普遍较大。
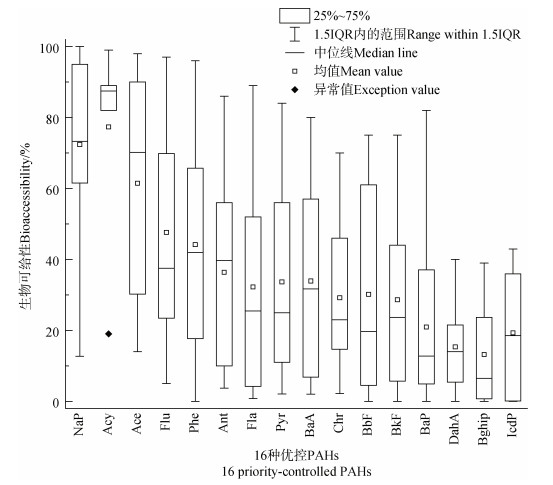
|
图 5 16种优控PAHs生物可给性范围 Fig. 5 Bioaccessibility ranges of 16 priority-controlled PAHs |
本文首先分析了我国表层土壤中∑16PAHs的分布特征与成分组成,结果表明∑16PAHs广布于各个省市,北方地区PAHs污染更加严重,其中华中地区∑7cPAHs占比最大。其次,通过风险评估结果表明PAHs主导暴露途径为经口摄入土壤,因此会对人体健康造成较大风险。由于以PAHs总浓度为基准的风险评估方法过于保守,人们更多地采用物理化学法或体外模拟胃肠法消化土壤以测定PAHs生物可给性,进行精细化风险评估节约成本,但物理化学法无法较直观地反应PAHs对人体的生物有效性,而目前体外模拟测定方法的核心问题是测得的生物可给性与体内动物实验测得的生物有效性建立相关性的报道还较少,各种测定方法也因不同影响因素使得结果误差较大,故未有一种普适性的方法可以较准确预测PAHs的生物有效性。对此,可给性测定的方法在未来还需在以下几个方面进行改进:
1)体外模拟法的关键因素之一是尽可能还原人体消化内环境,需进一步改进模拟条件如消化时间、消化液组分等,提高模拟的可信度;
2)还原体内消化环境的同时进行动物口服毒性试验进行比较,尽管加入吸附材料可以显著提升PAHs生物可给性,但仍需进一步研究加强与生物有效性的相关性并最终达到替代动物实验进行生物有效性评估的目的;
3)体外模拟法亦受到PAHs物理化学性质,土壤pH、老化时间和有机质含量等因素影响,需研究污染物及赋存基质性质对生物可给性的影响,了解不同PAHs在不同类型土壤基质中可给性的变化,为PAHs精细化风险评估提供理论支撑。
| [1] |
Tang L L. Comtamination of polycyclic aromatic hydrocarbons in urban soils in Beijing[D]. Nanjing: Nanjing University of Information Science and Technology, 2004.[汤莉莉. 北京城市土壤中多环芳烃的污染研究[D]. 南京: 南京信息工程大学, 2004.]
(  0) 0) |
| [2] |
Desalme D, Binet P, Chiapusio G. Challenges in tracing the fate and effects of atmospheric polycyclic aromatic hydrocarbon deposition in vascular plants[J]. Environmental Science & Technology, 2013, 47(9): 3967-3981.
(  0) 0) |
| [3] |
Peng C, Chen W, Liao X, et al. Polycyclic aromatic hydrocarbons in urban soils of Beijing: Status, sources, distribution and potential risk[J]. Environmental Pollution, 2011, 159(3): 802-808. DOI:10.1016/j.envpol.2010.11.003
(  0) 0) |
| [4] |
Liu G, Guo W, Niu J, et al. Polycyclic aromatic hydrocarbons in agricultural soils around the industrial city of Changzhi, China: Characteristics, spatial distribution, hotspots, sources, and potential risks[J]. Journal of Soils and Sediments, 2017, 17(1): 229-239. DOI:10.1007/s11368-016-1490-6
(  0) 0) |
| [5] |
Zhu G H, Sun L, Liao X Y, et al. Characteristics and risk assessment of heavy metal and PAHs composite pollution in Chenzhou industrial site (In Chinese)[J]. Geographical Research, 2012, 31(5): 831-839. [朱岗辉, 孙璐, 廖晓勇, 等. 郴州工业场地重金属和PAHs复合污染特征及风险评价[J]. 地理研究, 2012, 31(5): 831-839.]
(  0) 0) |
| [6] |
Luo Q, Gu L, Shan Y, et al. Distribution, source apportionment, and health risk assessment of polycyclic aromatic hydrocarbons in urban soils from Shenyang, China[J]. Environmental Geochemistry and Health, 2020, 42(7): 1817-1832. DOI:10.1007/s10653-019-00451-y
(  0) 0) |
| [7] |
Man Y B, Kang Y, Wang H S, et al. Cancer risk assessments of Hong Kong soils contaminated by polycyclic aromatic hydrocarbons[J]. Journal of Hazardous Materials, 2013, 261: 770-776. DOI:10.1016/j.jhazmat.2012.11.067
(  0) 0) |
| [8] |
Maliszewska-Kordybach B. Polycyclic aromatic hydrocarbons in agricultural soils in Poland: preliminary proposals for criteria to evaluate the level of soil contamination[J]. Applied Geochemistry, 1996, 11(1/2): 121-127.
(  0) 0) |
| [9] |
Menzie C A, Potocki B B, Santodonato J. Exposure to carcinogenic PAHs in the environment[J]. Environmental Science & Technology, 1992, 26(7): 1278-1284.
(  0) 0) |
| [10] |
Guo X X, Fan J J, Zhou Y Y, et al. Refined risk assessment of typical polycyclic aromatic hydrocarbons in a coking site (In Chinese)[J]. Asian Journal of Ecotoxicology, 2021, 16(1): 155-164. [郭晓欣, 范婧婧, 周友亚, 等. 焦化场地典型多环芳烃类污染物精细化风险评估[J]. 生态毒理学报, 2021, 16(1): 155-164.]
(  0) 0) |
| [11] |
Ruby M V, Davis A, Link T E, et al. Development of an in vitro screening test to evaluate the in vivo bioaccessibility of ingested mine-waste lead[J]. Environmental Science & Technology, 1993, 27(13): 2870-2877.
(  0) 0) |
| [12] |
Pan W, Kang Y, Zeng L, et al. Comparison of in vitro digestion model with in vivo relative bioavailability of BDE-209 in indoor dust and combination of in vitro digestion/Caco-2 cell model to estimate the daily intake of BDE-209 via indoor dust[J]. Environmental Pollution, 2016, 218: 497-504.
(  0) 0) |
| [13] |
Juhasz A L, Herde P, Smith E. Oral relative bioavailability of dichlorodiphenyltrichloroethane(DDT)in contaminated soil and its prediction using in vitro strategies for exposure refinement[J]. Environmental Research, 2016, 150: 482-488.
(  0) 0) |
| [14] |
Smith E, Weber J, Rofe A, et al. Assessment of DDT relative bioavailability and bioaccessibility in historically contaminated soils using an in vivo mouse model and fed and unfed batch in vitro assays[J]. Environmental Science & Technology, 2012, 46(5): 2928-2934.
(  0) 0) |
| [15] |
Yu Y, Lou S, Wang X, et al. Relationships between the bioavailability of polybrominated diphenyl ethers in soils measured with female C57BL/6 mice and the bioaccessibility determined using five in vitro methods[J]. Environment International, 2019, 123: 337-344.
(  0) 0) |
| [16] |
Abdel-Shafy H I, Mansour M S M. A review on polycyclic aromatic hydrocarbons: Source, environmental impact, effect on human health and remediation[J]. Egyptian Journal of Petroleum, 2016, 25(1): 107-123.
(  0) 0) |
| [17] |
Dai J, Li S, Zhang Y, et al. Distributions, sources and risk assessment of polycyclic aromatic hydrocarbons(PAHs)in topsoil at Ji'nan city, China[J]. Environmental Monitoring and Assessment, 2008, 147(1): 317-326.
(  0) 0) |
| [18] |
Shang Q B, Duan Y H, Xu L S, et al. Spatial distribution and genesis of polycyclic aromatic hydrocarbons(PAHs)in the surface soil in China (In Chinese)[J]. Journal of Ecology and Rural Environment, 2019, 35(7): 8. [尚庆彬, 段永红, 徐立帅, 等. 我国表层土壤多环芳烃含量的空间分布及成因[J]. 生态与农村环境学报, 2019, 35(7): 8.]
(  0) 0) |
| [19] |
Lv J G, Bi C J, Chen Z L, et al. Distribution and ecological risk assessment of polycyclic aromatic hydrocarbons in agricultural soil of the Chongming island in Shanghai (In Chinese)[J]. Chinese Journal of Environmental Science, 2012, 33(12): 4270-4275. [吕金刚, 毕春娟, 陈振楼, 等. 上海市崇明岛农田土壤中多环芳烃分布和生态风险评价[J]. 环境科学, 2012, 33(12): 4270-4275.]
(  0) 0) |
| [20] |
Zhao L, Hou H, Shangguan Y, et al. Occurrence, sources, and potential human health risks of polycyclic aromatic hydrocarbons in agricultural soils of the coal production area surrounding Xinzhou, China[J]. Ecotoxicology and Environmental Safety, 2014, 108: 120-128.
(  0) 0) |
| [21] |
Feng H Y, Fu X Q, Zhao Q, et al. Health risk assessment of polycyclic aromatic hydrocarbons in soils of Ningbo area, China (In Chinese)[J]. Journal of Agro-Environment Science, 2011, 30(10): 1998-2004. [冯焕银, 傅晓钦, 赵倩, 等. 宁波土壤中多环芳烃的健康风险评价[J]. 农业环境科学学报, 2011, 30(10): 1998-2004.]
(  0) 0) |
| [22] |
Xing X, Qi S, Zhang J, et al. Spatial distribution and source diagnosis of polycyclic aromatic hydrocarbons in soils from Chengdu Economic Region, Sichuan Province, western China[J]. Journal of Geochemical Exploration, 2011, 110(2): 146-154.
(  0) 0) |
| [23] |
Ma J, Zhou Y. Soil pollution by polycyclic aromatic hydrocarbons: A comparison of two Chinese cities[J]. Journal of Environmental Sciences, 2011, 23(9): 1518-1523.
(  0) 0) |
| [24] |
Li Y T, Li F B, Chen J J, et al. The concentrations, distribution and sources of PAHs in agricultural soils and vegetables from Shunde, Guangdong, China[J]. Environmental Monitoring and Assessment, 2008, 139(1): 61-76.
(  0) 0) |
| [25] |
Yang G Y, Zhang T B, Gao S T, et al. Source and distribution characteristics of polycyclic aromatic hydrocarbons in agricultural soils in the Pearl River Delta (In Chinese)[J]. Chinese Journal of Environmental Science, 2007, 28(10): 2350-2354. [杨国义, 张天彬, 高淑涛, 等. 珠江三角洲典型区域农业土壤中多环芳烃的含量分布特征及其污染来源[J]. 环境科学, 2007, 28(10): 2350-2354.]
(  0) 0) |
| [26] |
Wang L, Xu X, Lu X. Composition, source and potential risk of polycyclic aromatic hydrocarbons(PAHs)in vegetable soil from the suburbs of Xianyang City, Northwest China: A case study[J]. Environmental Earth Sciences, 2016, 75(1): 1-13.
(  0) 0) |
| [27] |
Chen C, Zhang M S, Yang J W, et al. Pollution status and sources of polycyclic aromatic hydrocarbons in soil of Qiannan state (In Chinese)[J]. Ecology and Environmental Sciences, 2009, 18(3): 929-933. [陈椽, 张明时, 杨加文, 等. 黔南州土壤中多环芳烃的污染现状及来源分析[J]. 生态环境学报, 2009, 18(3): 929-933.]
(  0) 0) |
| [28] |
Lu J L, Zhao Y Y, Hao L B, et al. Distribution and risk evaluation of polycyclic aromatic hydrocarbons of agricultural soil in the middle Jilin Province (In Chinese)[J]. Journal of Jilin University: Earth Science Edition, 2010, 40(3): 683-688. [陆继龙, 赵玉岩, 郝立波, 等. 吉林省中部农业土壤中PAHs的分布及风险评价[J]. 吉林大学学报: 地球科学版, 2010, 40(3): 683-688.]
(  0) 0) |
| [29] |
Zhang G G, Luo Y P, Huang D Q, et al. Study on the distribution characteristics of polycyclic aromatic hydrocarbons in agricultural soils in Zhuzhou City (In Chinese)[J]. Environmental Monitoring in China, 2009, 25(1): 51-54. [张光贵, 罗岳平, 黄东勤, 等. 株洲市区农业土壤中多环芳烃的分布特征研究[J]. 中国环境监测, 2009, 25(1): 51-54.]
(  0) 0) |
| [30] |
Ping L F, Luo Y M, Zhang H B, et al. Distribution of polycyclic aromatic hydrocarbons in thirty typical soil profiles in the Yangtze River Delta region, east China[J]. Environmental Pollution, 2007, 147(2): 358-365.
(  0) 0) |
| [31] |
Jiao H, Rui X, Wu S, et al. Polycyclic aromatic hydrocarbons in the Dagang Oilfield(China): Distribution, sources, and risk assessment[J]. International Journal of Environmental Research and Public Health, 2015, 12(6): 5775-5791.
(  0) 0) |
| [32] |
Ma J, Zhou Y, Wan H. Study on polycyclic aromatic hydrocarbons(PAHs)contents and sources in the surface soil of Huizhou City, South China, based on multivariate statistics analysis[J]. Chinese Journal of Geochemistry, 2009, 28(4): 335-339.
(  0) 0) |
| [33] |
Ouyang Z, Gao L, Yang C. Distribution, sources and influence factors of polycyclic aromatic hydrocarbon at different depths of the soil and sediments of two typical coal mining subsidence areas in Huainan, China[J]. Ecotoxicology and Environmental Safety, 2018, 163: 255-265.
(  0) 0) |
| [34] |
Li D X, Tan Z H, Zhang K, et al. Distribution, sources and risk assessment of polycyclic aromatic hydrocarbon in surface soils of different funtional areas in Xi'an (In Chinese)[J]. Journal of Xi'an Engineering University, 2020, 34(1): 47-54. [李冬雪, 谭志海, 张珂, 等. 西安市不同功能区表层土中多环芳烃的分布、来源及风险评估[J]. 西安工程大学学报, 2020, 34(1): 47-54.]
(  0) 0) |
| [35] |
Man Y B, Kang Y, Wang H S, et al. Cancer risk assessments of Hong Kong soils contaminated by polycyclic aromatic hydrocarbons[J]. Journal of Hazardous Materials, 2013, 261: 770-776.
(  0) 0) |
| [36] |
Zhang J, Yang J, Wang R, et al. Effects of pollution sources and soil properties on distribution of polycyclic aromatic hydrocarbons and risk assessment[J]. Science of the Total Environment, 2013, 463: 1-10.
(  0) 0) |
| [37] |
Kumar B, Verma V K, Kumar S, et al. Polycyclic aromatic hydrocarbons in residential soils from an Indian city near power plants area and assessment of health risk for human population[J]. Polycyclic Aromatic Compounds, 2014, 34(3): 191-213.
(  0) 0) |
| [38] |
Ehlers L J, Luthy R G. Peer reviewed: Contaminant bioavailability in soil and sediment[J]. Environmental Science & Technology, 2003, 37(15): 295A-302A.
(  0) 0) |
| [39] |
Ruby M V, Lowney Y W, Bunge A L, et al. Oral bioavailability, bioaccessibility, and dermal absorption of PAHs from soil—State of the science[J]. Environmental Science & Technology, 2016, 50(5): 2151-2164.
(  0) 0) |
| [40] |
Santos M D R, Cerqueira M R F, de Oliveira M A L, et al. Box–Behnken design applied to ultrasound-assisted extraction for the determination of polycyclic aromatic hydrocarbons in river sediments by gas chromatography/mass spectrometry[J]. Analytical Methods, 2014, 6(6): 1650-1656.
(  0) 0) |
| [41] |
Brilis G M, Marsden P J. Comparative evaluation of Soxhlet and sonication extraction in the determination of polycyclic aromatic hydrocarbons in soil[J]. Chemosphere, 1990, 21(1/2): 91-98.
(  0) 0) |
| [42] |
Shao X, Xu Y, Zhang W, et al. Polycyclic aromatic hydrocarbons(PAHs)pollution in agricultural soil in Tianjin, China[J]. Soil and Sediment Contamination: An International Journal, 2015, 24(3): 343-351.
(  0) 0) |
| [43] |
Cui X, Mayer P, Gan J. Methods to assess bioavailability of hydrophobic organic contaminants: Principles, operations, and limitations[J]. Environmental Pollution, 2013, 172: 223-234.
(  0) 0) |
| [44] |
Kelsey J W, Alexander M. Declining bioavailability and inappropriate estimation of risk of persistent compounds[J]. Environmental Toxicology and Chemistry: An International Journal, 1997, 16(3): 582-585.
(  0) 0) |
| [45] |
Mousset E, Oturan N, Van Hullebusch E D, et al. Influence of solubilizing agents(cyclodextrin or surfactant)on phenanthrene degradation by electro-Fenton process–study of soil washing recycling possibilities and environmental impact[J]. Water Research, 2014, 48: 306-316.
(  0) 0) |
| [46] |
Reid B J, Stokes J D, Jones K C, et al. Influence of hydroxypropyl‐β‐cyclodextrin on the extraction and biodegradation of phenanthrene in soil[J]. Environmental Toxicology and Chemistry: An International Journal, 2004, 23(3): 550-556.
(  0) 0) |
| [47] |
Cornelissen G, Rigterink H, Ferdinandy M M A, et al. Rapidly desorbing fractions of PAHs in contaminated sediments as a predictor of the extent of bioremediation[J]. Environmental Science & Technology, 1998, 32(7): 966-970.
(  0) 0) |
| [48] |
Zhang Y N. Study on the prediction of PAHs bioaccessibility in soils by chemical methods[D]. Nanjing: Institute of Soil Science, Chinese Academy of Sciences, 2016.[张亚楠. 土壤中多环芳烃生物可给性的化学方法表征研究[D]. 南京: 中国科学院南京土壤研究所, 2016.]
(  0) 0) |
| [49] |
Parkerton T F, Maruya K A, Lydy M J, et al. Guidance on passive sampling methods to improve management of contaminated sediments[J]. Integrated Environmental Assessment and Management, 2014, 10(2): 210-223.
(  0) 0) |
| [50] |
Gomez-Eyles J L, Jonker M T O, Hodson M E, et al. Passive samplers provide a better prediction of PAH bioaccumulation in earthworms and plant roots than exhaustive, mild solvent, and cyclodextrin extractions[J]. Environmental Science & Technology, 2012, 46(2): 962-969.
(  0) 0) |
| [51] |
Muijs B, Jonker M T O. Does equilibrium passive sampling reflect actual in situ bioaccumulation of PAHs and petroleum hydrocarbon mixtures in aquatic worms?[J]. Environmental Science & Technology, 2012, 46(2): 937-944.
(  0) 0) |
| [52] |
Hawthorne S B, Poppendieck D G, Grabanski C B, et al. PAH release during water desorption, supercritical carbon dioxide extraction, and field bioremediation[J]. Environmental Science & Technology, 2001, 35(22): 4577-4583.
(  0) 0) |
| [53] |
Smith R M. Extractions with superheated water[J]. Journal of Chromatography A, 2002, 975(1): 31-46.
(  0) 0) |
| [54] |
Hallgren P, Westbom R, Nilsson T, et al. Measuring bioavailability of polychlorinated biphenyls in soil to earthworms using selective supercritical fluid extraction[J]. Chemosphere, 2006, 63(9): 1532-1538.
(  0) 0) |
| [55] |
Cipullo S, Prpich G, Campo P, et al. Assessing bioavailability of complex chemical mixtures in contaminated soils: Progress made and research needs[J]. Science of the Total Environment, 2018, 615: 708-723.
(  0) 0) |
| [56] |
Librando V, Hutzinger O, Tringali G, et al. Supercritical fluid extraction of polycyclic aromatic hydrocarbons from marine sediments and soil samples[J]. Chemosphere, 2004, 54(8): 1189-1197.
(  0) 0) |
| [57] |
Hyn Holman, Goth-Goldstein R, Aston D, et al. Evaluation of gastrointestinal solubilization of petroleum hydrocarbon residues in soil using an in vitro physiologically based model[J]. Environmental Science & Technology, 2002, 36(6): 1281-1286.
(  0) 0) |
| [58] |
Juhasz A L, Smith E, Weber J, et al. Effect of soil aging on in vivo arsenic bioavailability in two dissimilar soils[J]. Chemosphere, 2008, 71(11): 2180-2186.
(  0) 0) |
| [59] |
Ruby M V, Davis A, Link T E, et al. Development of an in vitro screening test to evaluate the in vivo bioaccessibility of ingested mine-waste lead[J]. Environmental Science & Technology, 1993, 27(13): 2870-2877.
(  0) 0) |
| [60] |
Ruby M V, Davis A, Schoof R, et al. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J]. Environmental Science & Technology, 1996, 30(2): 422-430.
(  0) 0) |
| [61] |
Juhasz A L, Tang W, Smith E. Using in vitro bioaccessibility to refine estimates of human exposure to PAHs via incidental soil ingestion[J]. Environmental Research, 2016, 145: 145-153.
(  0) 0) |
| [62] |
Lu M, Yuan D, Lin Q, et al. Assessment of the bioaccessibility of polycyclic aromatic hydrocarbons in topsoils from different urban functional areas using an in vitro gastrointestinal test[J]. Environmental Monitoring and Assessment, 2010, 166(1): 29-39.
(  0) 0) |
| [63] |
Meyer W, Kons S, Achten C. Impact of reference geosorbents on oral bioaccessibility of PAH in a human in vitro digestive tract model[J]. Environmental Science and Pollution Research, 2015, 22(7): 5164-5170.
(  0) 0) |
| [64] |
Tang X Y, Tang L, Zhu Y G, et al. Assessment of the bioaccessibility of polycyclic aromatic hydrocarbons in soils from Beijing using an in vitro test[J]. Environmental Pollution, 2006, 140(2): 279-285.
(  0) 0) |
| [65] |
Khan S, Cao Q, Lin A J, et al. Concentrations and bioaccessibility of polycyclic aromatic hydrocarbons in wastewater-irrigated soil using in vitro gastrointestinal test[J]. Environmental Science and Pollution Research-International, 2008, 15(4): 344-353.
(  0) 0) |
| [66] |
Cavret S, Feidt C. Intestinal metabolism of PAH: In vitro demonstration and study of its impact on PAH transfer through the intestinal epithelium[J]. Environmental Research, 2005, 98(1): 22-32.
(  0) 0) |
| [67] |
Tilston E L, Gibson G R, Collins C D. Colon extended physiologically based extraction test(CE-PBET)increases bioaccessibility of soil-bound PAH[J]. Environmental Science & Technology, 2011, 45(12): 5301-5308.
(  0) 0) |
| [68] |
Abdallah M A E, Tilston E, Harrad S, et al. In vitro assessment of the bioaccessibility of brominated flame retardants in indoor dust using a colon extended model of the human gastrointestinal tract[J]. Journal of Environmental Monitoring, 2012, 14(12): 3276-3283.
(  0) 0) |
| [69] |
Collins C D, Mosquera-Vazquez M, Gomez-Eyles J L, et al. Is there sufficient 'sink'in current bioaccessibility determinations of organic pollutants in soils?[J]. Environmental Pollution, 2013, 181: 128-132.
(  0) 0) |
| [70] |
Molly K, Vande Woestyne M, Verstraete W. Development of a 5-step multi-chamber reactor as a simulation of the human intestinal microbial ecosystem[J]. Applied Microbiology and Biotechnology, 1993, 39(2): 254-258.
(  0) 0) |
| [71] |
Van de Wiele T R, Verstraete W, Siciliano S D. Polycyclic aromatic hydrocarbon release from a soil matrix in the in vitro gastrointestinal tract[J]. Journal of Environmental Quality, 2004, 33(4): 1343-1353.
(  0) 0) |
| [72] |
Yu Y X, Chen L, Yang D, et al. Polycyclic aromatic hydrocarbons in animal-based foods from Shanghai: Bioaccessibility and dietary exposure[J]. Food Additives & Contaminants: Part A, 2012, 29(9): 1465-1474.
(  0) 0) |
| [73] |
Siciliano S D, Laird B D, Lemieux C L. Polycyclic aromatic hydrocarbons are enriched but bioaccessibility reduced in brownfield soils adhered to human hands[J]. Chemosphere, 2010, 80(9): 1101-1108.
(  0) 0) |
| [74] |
Cave M R, Wragg J, Harrison I, et al. Comparison of batch mode and dynamic physiologically based bioaccessibility tests for PAHs in soil samples[J]. Environmental Science & Technology, 2010, 44(7): 2654-2660.
(  0) 0) |
| [75] |
Van de Wiele T, Vanhaecke L, Boeckaert C, et al. Human colon microbiota transform polycyclic aromatic hydrocarbons to estrogenic metabolites[J]. Environmental Health Perspectives, 2005, 113(1): 6-10.
(  0) 0) |
| [76] |
Rodriguez R R, Basta N T, Casteel S W, et al. An in vitro gastrointestinal method to estimate bioavailable arsenic in contaminated soils and solid media[J]. Environmental Science & Technology, 1999, 33(4): 642-649.
(  0) 0) |
| [77] |
Beak D G, Basta N T, Scheckel K G, et al. Bioaccessibility of arsenic bound to corundum using a simulated gastrointestinal system[J]. Environmental Chemistry, 2006, 3(3): 208-214.
(  0) 0) |
| [78] |
Basta N T, Foster J N, Dayton E A, et al. The effect of dosing vehicle on arsenic bioaccessibility in smelter-contaminated soils[J]. Journal of Environmental Science and Health Part A, 2007, 42(9): 1275-1281.
(  0) 0) |
| [79] |
James K, Peters R E, Laird B D, et al. Human exposure assessment: A case study of 8 PAH contaminated soils using in vitro digestors and the juvenile swine model[J]. Environmental Science & Technology, 2011, 45(10): 4586-4593.
(  0) 0) |
| [80] |
Cui X Y, Xiang P, He R W, et al. Advances in in vitro methods to evaluate oral bioaccessibility of PAHs and PBDEs in environmental matrices[J]. Chemosphere, 2016, 150: 378-389.
(  0) 0) |
| [81] |
Ajam S, Bruil M A, Cjg D, et al. Bioaccessibility of contaminants from ingested soil in humans. Method development and research on the bioaccessibility of lead and benzo[a]pyrene[R]. Dutch National Institute for Public Health and the Environment Report, 2001.
(  0) 0) |
| [82] |
Ljung K, Oomen A, Duits M, et al. Bioaccessibility of metals in urban playground soils[J]. Journal of Environmental Science and Health Part A, 2007, 42(9): 1241-1250.
(  0) 0) |
| [83] |
Oomen A G, Sips A J A M, Groten J P, et al. Mobilization of PCBs and lindane from soil during in vitro digestion and their distribution among bile salt micelles and proteins of human digestive fluid and the soil[J]. Environmental Science & Technology, 2000, 34(2): 297-303.
(  0) 0) |
| [84] |
Smith R P, Robertson A M, Watchel C J. Measurement of polycyclic aromatic hydrocarbon(PAH)bioaccessibility and their use in the assessment of human health risk[J]. Geoscience in South-West England, 2008, 12(1): 27-31.
(  0) 0) |
| [85] |
Pu X, Lee L S, Galinsky R E, et al. Evaluation of a rat model versus a physiologically based extraction test for assessing phenanthrene bioavailability from soils[J]. Toxicological Sciences, 2004, 79(1): 10-17.
(  0) 0) |
| [86] |
Grøn C, Oomen A, Weyand E, et al. Bioaccessibility of PAH from Danish soils[J]. Journal of Environmental Science and Health Part A, 2007, 42(9): 1233-1239.
(  0) 0) |
| [87] |
Juhasz A L, Weber J, Stevenson G, et al. In vivo measurement, in vitro estimation and fugacity prediction of PAH bioavailability in post-remediated creosote-contaminated soil[J]. Science of the Total Environment, 2014, 473: 147-154.
(  0) 0) |
| [88] |
Cave M R, Vane C H, Kim A, et al. Measurement and modelling of the ingestion bioaccessibility of polyaromatic hydrocarbons in soils[J]. Environmental Technology & Innovation, 2015, 3: 35-45.
(  0) 0) |
| [89] |
Lorenzi D, Entwistle J, Cave M, et al. The application of an in vitro gastrointestinal extraction to assess the oral bioaccessibility of polycyclic aromatic hydrocarbons in soils from a former industrial site[J]. Analytica Chimica Acta, 2012, 735: 54-61.
(  0) 0) |
| [90] |
Hack A, Selenka F. Mobilization of PAH and PCB from contaminated soil using a digestive tract model[J]. Toxicology Letters, 1996, 88(1/3): 199-210.
(  0) 0) |
| [91] |
Zhang S, Li C, Li Y, et al. Bioaccessibility of PAHs in contaminated soils: Comparison of five in vitro methods with Tenax as a sorption sink[J]. Science of the Total Environment, 2017, 601: 968-974.
(  0) 0) |
| [92] |
Wang Z, Zhao J, Song L, et al. Adsorption and desorption of phenanthrene on carbon nanotubes in simulated gastrointestinal fluids[J]. Environmental Science & Technology, 2011, 45(14): 6018-6024.
(  0) 0) |
| [93] |
Pu X, Lee L S, Galinsky R E, et al. Bioavailability of 2, 3′, 4, 4′, 5-pentachlorobiphenyl(PCB118)and 2, 2′, 5, 5′-tetrachlorobiphenyl(PCB52)from soils using a rat model and a physiologically based extraction test[J]. Toxicology, 2006, 217(1): 14-21.
(  0) 0) |
| [94] |
Li C, Teng Y, Ma L Q. Tenax as sorption sink for in vitro bioaccessibility measurement of polycyclic aromatic hydrocarbons in soils[J]. Environmental Pollution, 2015, 196: 47-52.
(  0) 0) |
| [95] |
Fang M, Stapleton H M. Evaluating the bioaccessibility of flame retardants in house dust using an in vitro Tenax bead-assisted sorptive physiologically based method[J]. Environmental Science & Technology, 2014, 48(22): 13323-13330.
(  0) 0) |
| [96] |
Gouliarmou V, Collins C D, Christiansen E, et al. Sorptive physiologically based extraction of contaminated solid matrices: Incorporating silicone rod as absorption sink for hydrophobic organic contaminants[J]. Environmental Science & Technology, 2013, 47(2): 941-948.
(  0) 0) |
| [97] |
Fan R J. Study on the bioaccessibility of polycyclic aromatic hydrocarbons in field using simulated gastrointestinal fluid coupling with adsorption materials[D]. Nanjing: School of Environment, Nanjing University, 2021.[范任君. 模拟胃肠液耦合吸附材料法测定场地多环芳烃生物可获得性研究[D]. 南京: 南京大学环境学院, 2021.]
(  0) 0) |
| [98] |
James K, Peters R E, Cave M R, et al. In vitro prediction of polycyclic aromatic hydrocarbon bioavailability of 14 different incidentally ingested soils in juvenile swine[J]. Science of the Total Environment, 2018, 618: 682-689.
(  0) 0) |
| [99] |
Li C. Measurement of bioaccessibility of organic pollutants in soils using Tenax-modified invitro gastrointestinal method[D]. Nanjing: School of Environment, Nanjing University, 2015.[李超. Tenax改进体外胃肠模拟法对土壤中有机污染物生物有效性的研究[D]. 南京: 南京大学环境学院, 2015.]
(  0) 0) |
| [100] |
Chen X, Li C, Cao X, et al. Bioaccessibility and bioavailability of NPAHs in soils using in vitro-in vivo assays: Comparison of laboratory and outdoor environmental aging effect[J]. Science of the Total Environment, 2023, 161619.
(  0) 0) |
| [101] |
Li C, Zhang R, Li Y, et al. Relative bioavailability and bioaccessibility of PCBs in soils based on a mouse model and Tenax-improved physiologically-based extraction test[J]. Chemosphere, 2017, 186: 709-715.
(  0) 0) |
| [102] |
Lu M, Yuan D, Lin Q, et al. Assessment of the bioaccessibility of polycyclic aromatic hydrocarbons in topsoils from different urban functional areas using an in vitro gastrointestinal test[J]. Environmental Monitoring and Assessment, 2010, 166(1): 29-39.
(  0) 0) |
| [103] |
Oomen A G, Mayer P, Tolls J. Nonequilibrium solid-phase microextraction for determination of the freely dissolved concentration of hydrophobic organic compounds: Matrix effects and limitations[J]. Analytical Chemistry, 2000, 72(13): 2802-2808.
(  0) 0) |
| [104] |
Ruby M V, Fehling K A, Paustenbach D J, et al. Oral bioaccessibility of dioxins/furans at low concentrations(50−350 ppt toxicity equivalent)in soil[J]. Environmental Science & Technology, 2002, 36(22): 4905-4911.
(  0) 0) |
| [105] |
Minhas J K, Vasiluk L, Pinto L J, et al. Mobilization of chrysene from soil in a model digestive system[J]. Environmental Toxicology and Chemistry: An International Journal, 2006, 25(7): 1729-1737.
(  0) 0) |
| [106] |
Weston D P, Mayer L M. In vitro digestive fluid extraction as a measure of the bioavailability of sediment‐associated polycyclic aromatic hydrocarbons: Sources of variation and implications for partitioning models[J]. Environmental Toxicology and Chemistry: An International Journal, 1998, 17(5): 820-829.
(  0) 0) |
| [107] |
Yin Y, Allen H E, Li Y, et al. Adsorption of mercury(II)by soil: Effects of pH, chloride, and organic matter[J]. Journal of Environmental Quality, 1996, 25(4): 837-844.
(  0) 0) |
| [108] |
Zhang Z, Liu S, Wang X, et al. Differences in structure and composition of soil humic substances and their binding for polycyclic aromatic hydrocarbons in different climatic zones[J]. Environmental Pollution, 2023, 322: 121121.
(  0) 0) |
| [109] |
Vasiluk L, Pinto L J, Walji Z A, et al. Benzo[a]pyrene bioavailability from pristine soil and contaminated sediment assessed using two in vitro models[J]. Environmental Toxicology and Chemistry: An International Journal, 2007, 26(3): 387-393.
(  0) 0) |
| [110] |
Zhang Y, Pignatello J J, Tao S. Bioaccessibility of PAHs and PAH derivatives in a fuel soot assessed by an in vitro digestive model with absorptive sink: Effects of aging the soot in a soil-water mixture[J]. Science of the Total Environment, 2018, 615: 169-176.
(  0) 0) |
| [111] |
Guo X, Luo L, Ma Y, et al. Sorption of polycyclic aromatic hydrocarbons on particulate organic matters[J]. Journal of Hazardous Materials, 2010, 173(1/3): 130-136.
(  0) 0) |
| [112] |
Bao G Q, Ni J Z, Wei R, et al. Sorption characteristics of phenanthrene by different soil organic matter fractions (In Chinese)[J]. China Environmental Science, 2013, 33(5): 861-867. [包桂奇, 倪进治, 魏然, 等. 土壤不同有机质组分对菲的吸附特征研究[J]. 中国环境科学, 2013, 33(5): 861-867.]
(  0) 0) |
| [113] |
Zhong M Y, Chen Z, Jia X Y, et al. The analysis in distribution and bioavailability of polycyclic aromatic hydrocarbons in organic matter components of coking contaminated soil (In Chinese)[J]. Journal of Environmental Sciences, 2021, 41(8): 3349-3358. [钟名誉, 陈卓, 贾晓洋, 等. 焦化污染土壤有机质不同组分中多环芳烃分布及其生物有效性分析[J]. 环境科学学报, 2021, 41(8): 3349-3358.]
(  0) 0) |
| [114] |
Li Z, Zhang W, Shan B. Effects of organic matter on polycyclic aromatic hydrocarbons in riverine sediments affected by human activities[J]. Science of the Total Environment, 2022, 815: 152570.
(  0) 0) |
| [115] |
Ukalska-Jaruga A, Smreczak B. The impact of organic matter on polycyclic aromatic hydrocarbon(PAH)availability and persistence in soils[J]. Molecules, 2020, 25(11): 2470.
(  0) 0) |
| [116] |
Zhuo C, Hu S, Yang Y, et al. Effects of the structures and micropores of sedimentary organic matter on the oxidative degradation of benzo(a)pyrene by Na2S2O8[J]. Water Research, 2020, 174: 115635.
(  0) 0) |
 2024, Vol. 61
2024, Vol. 61